魔芋葡甘露聚糖(koniac glucomannan,KGM)是由分子比为1∶1.6的D-葡萄糖和D-甘露糖残基以β-1,4-糖苷键聚合而形成的大分子多糖,其平均分子质量大约为1 000 KDa[1-2]。由于其具有良好的成膜,生物相容性,生物降解性和凝胶性能[3-5],因此,常用作食品原料和食品添加剂[6-8]。但是,由于葡甘露聚糖分子量大、水溶性差、水溶胶不稳定,特别是在高温和冷冻条件下稳定性极差,使其应用受到限制[9],所以研究中通常需要对KGM进行改性,如羧甲基化等[10]。改性后制成的的羧甲基魔芋葡甘露聚糖(carboxymethyl konjac glucomannan,CMKGM)具有良好的拉伸、凝胶等性能[11-12]。
海藻酸钠(sodium alginate,简称SA)是由β-D-甘露糖醛酸和α-L-古洛糖醛酸按(1→4)键连接而成的多糖[13]。SA因为其水溶液具有好的凝胶性、稳定性和高黏性,所以在食品,化妆品和制药工业中常用作添加剂和辅助剂[14-16]。此外,SA由于其低毒性和优异的生物相容性而被广泛应用于制备生物医学材料[17-20]。
微囊是缓/控释制剂中常见的剂型,其包裹药物成囊的优点有:克服药物自身的缺陷,达到控制药物的释放,提高药物的生物相容性和稳定性等,近年来受到广泛关注[21-23]。WANG等[24]用KGM、海藻酸钠和壳聚糖作为囊材,以牛血清白蛋白和胰岛素为模型药物,制备控释微球。研究表明微球中包含魔芋葡甘露聚糖,SA和KGM之间存在弱的氢键和静电作用,载药量随KGM质量的增加而增加。WU等[25]研究出新型纤维素硫酸钠-壳聚糖-聚磷酸钠微囊,以5-氨基水杨酸为模型药物。体外溶胀和释放分析表明,药物优先释放在模拟结肠液中,表明微囊是一种结肠靶向释药载体。本文以牛血清蛋白(BSA)为模型药物,研究CMKGM/SA微囊的体外释放,以及各因素对微囊缓释性的影响,研究微囊在人工模拟消化液中的释放性质,对微囊的结肠定位释药特性进行评价,并对微囊体外释放进行模型拟合,为蛋白质类药物的结肠靶向给药的进一步研究做基础。
1 材料与方法
1.1 材料与试剂
魔芋葡甘露聚糖,北海多环保健品有限公司;海藻酸钠,成都市科龙化工试剂厂;牛血清蛋白、氯乙酸钠、HCl、NaOH、KH2PO4等均为分析纯。
1.2 仪器与设备
UV-2802S 紫外可见分光光度计,尤尼柯仪器有限公司;HJ-3数显恒温磁力搅拌器,上海鸿都电子科技有限公司;868酸度计,美国Orion公司;AL204电子天平,梅特勒-托利多仪器(上海)有限公司。
1.3 实验方法
1.3.1 CMKGM的制备
取5.0 g KGM置于500 mL三口烧瓶的乙醇溶液中,加入NaOH溶液,搅拌。经过碱化的KGM加入氯乙酸钠(氯乙酸与氢氧化钠反应得到的钠盐)的乙醇溶液,使氯乙酸与KGM质量比分别为0.25∶1、1∶1、2∶1,搅拌,用1.0 mol/L的盐酸溶液,调节pH至7.0,减压抽滤,用体积分数为60%和80%的乙醇及和无水乙醇溶液洗涤滤饼数次,40.0℃下真空干燥,得到白色粉末产物,将其编号为CMKGM1,CMKGM2,CMKGM3。
1.3.2 CMKGM/SA微囊的制备
取CMKGM∶SA(质量比)为3∶1,将所得CMKGM溶于去离子水中,搅拌,加入SA继续搅拌,称取牛血清蛋白(BSA),加入搅拌均匀,用1 mL注射器以30 r/min的速度滴入CaCl2溶液中,固化,去离子水冲洗,真空干燥,得到1#微囊(CMKGM1)、2#微囊(CMKGM2)和3#微囊(CMKGM3)。
1.3.3 取代度的测定
酸化滴定法是羧甲基取改性产物取代度测定的常用方法[26]。称取CMKGM 1.0 g,溶于40.0 mL的2.0 mol/L盐酸溶液,磁力搅拌,过滤,用无水乙醇洗涤样品,直至滤液用硝酸银检测无氯离子为止。量取0.1 mol/L的NaOH标准溶液40.0 mL,溶解CMKGM,微热,即用0.1 mol/L的HCl溶液滴定NaOH,用酚酞作指示剂,记录消耗的HCl溶液体积。
A=(CNaOH×VNaOH-CHCl×VHCl)/m
(1)
DS=A×0.162/(1-0.058A)
(2)
式中:A,1.0 g样品所消耗的NaOH的量,mmol;m,称样量,g;DS,取代度;0.162,KGM的失水葡萄糖(或甘露糖)单元的毫摩尔质量,g/mmol;0.058,失水葡萄糖(或甘露糖)单元的一个羟基被羧甲基取代后单元毫摩尔质量的净增量,g/mmol。
1.3.4 CMKGM的表面形貌观察
将干燥后的CMKGM样品固定在双面导电胶上,在真空下对样品进行离子溅射喷金处理,用F16502电子扫描显微镜(SEM)选择合适的倍数观察CMKGM形貌。
1.3.5 微囊体外释放性能的测定
1.3.5.1 人工模拟消化液的配制
(1)人工模拟胃液(SGF)的配制
取9.0 mL的浓Hcl,用去离子水稀释,定容至1 000.0 mL,去除杂质,用0.1 mol/L的NaOH标准溶液调节pH至1.0。
(2)人工模拟小肠液(SIF)的配制
取13.6 g的KH2PO4溶于去离子水中,定容至1 000.0 mL,去除杂质,用0.1 mol/L的NaOH标准溶液调节pH至6.8。
(3)人工模拟结肠液(SCF)的配制
取6.8 g的KH2PO4溶于去离子水中,定容至1 000.0 mL,去除杂质,用0.1 mol/L的NaOH标准溶液调节pH至7.4。
1.3.5.2 BSA标准曲线的绘制
用去离子水配制一系列不同浓度的BSA溶液,首先进行全波长扫描,确定最大吸收峰在279 nm波长处。在279 nm波长处,以去离子水作为参比溶液,测定BSA溶液的吸光度(A)。然后以浓度为纵坐标,以吸光度(A)为横坐标,作BSA浓度和吸光度的关系曲线,线性拟合得到标准曲线方程为:
C=1 680.8A+1.836 5 R2=0.999 7 (SGF)
(3)
C=1 621.2A+2.858 2 R2=0.999 6 (SIF)
(4)
C=1 564.5A+2.637 2 R2=0.999 8 (SCF)
(5)
1.3.5.3 微囊内药物含量的测定
取CMKGM/SA微囊,准确称量、研细,置于500 mL容量瓶中,加入人工模拟消化液,摇匀,于37.0 ℃水浴中加入完全溶解,冷却至室温,定容,摇匀,在279 nm处用紫外分光光度计测定吸光度。
1.3.5.4 BSA体外释放度的测定
《中华人民共和国药典》2010年版第二部,体外释放度试验方法的第一法用来测定BSA的累积释放率,将CMKGM/SA微囊置于500 mL释放液中,温度为(37.5±0.5)℃,转速为100 r/min。每小时取样1次,在30 s内完成取样,并且补充相同体积、相同温度的人工模拟液。样液经0.5 μm微孔滤膜过滤,以模拟液作为参比溶液,在最大吸收波长279 nm处测定吸光度。累积释药率(accumulation release percentage,ARP)用式(6)计算:
![]()
(6)
式中:ARP,t时间内药物的累积释放率;Mt,药物在t时间内释放液中的累积浓度;M∞,药物完全释放时释放液中的浓度。
1.3.6 微囊体外释放模型
微囊的体外释放可用表1中的模型进行拟合,R为相关系数,越趋向于1表明曲线的拟合效果越好[27]。
表1 微囊体外释放数学拟合模型
Table 1 Model fitting equation of in vitro release of microcapsule

1.4 数据处理
采用Origin 8.5进行实验数据处理。
2 结果与讨论
2.1 CMKGM的取代度
由1.3.1的方法制备得到CMKGM,取代度结果如表2所示。
表2 CMKGM的取代度
Table 2 Degree of substitution of CMKGM

由表2可知,随着氯乙酸与KGM比例的升高,CMKGM的取代度也随之升高,最高达到75%。
2.2 CMKGM形貌观察
图1-a为KGM的形貌,其颗粒大小杂乱不一,结构不紧密。由图1-b、1-c、1-d可以看出:随着取代度增大,CMKGM结构比KGM结构更加紧密,颗粒体积有所增大。因为随着取代度的增加,CMKGM分子内部基团之间的作用力增大,结合更牢固,表现出颗粒体积增大,质地紧密,这有利于延长其作为囊材的缓释时间。

图1 KGM和CMKGM的电镜扫描图
Fig.1 SEM of KGM and CMKGM
2.3 微囊体外释放性能的研究
2.3.1 微囊的体外释放曲线
根据蛋白类药物易被体内的酶水解,在循环系统中停留时间短等特点,选择12 h作为研究时间,研究其体外释放。选择去离子水为微囊药物的释放液,测定药物累积释放度,绘制1#微囊、2#微囊和3#微囊的药物的体外释放曲线,结果如图2所示。
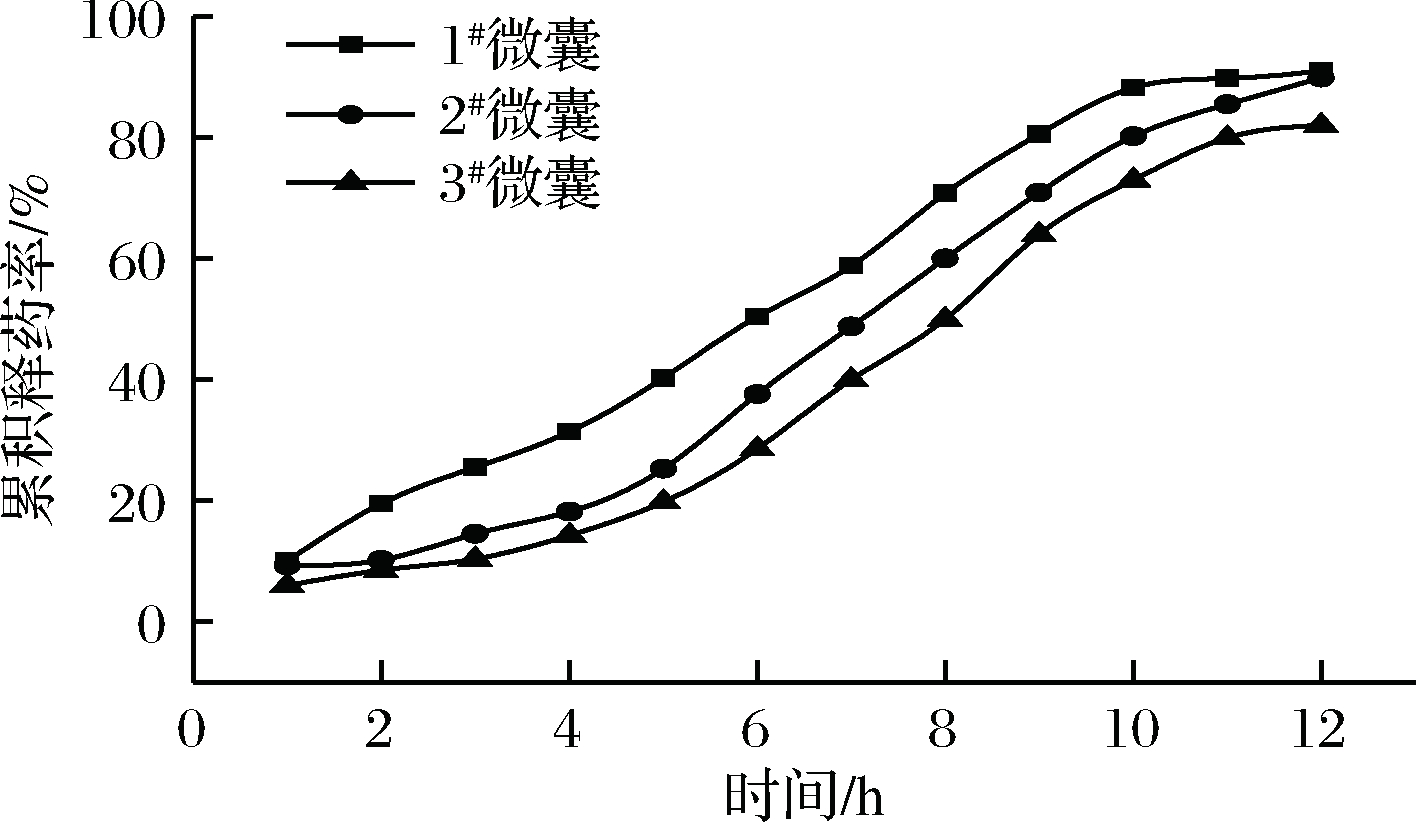
图2 微囊体外释放曲线
Fig.2 Release curve of microcapsule in vitro
由图2可知,1#微囊、2#微囊和3#微囊的药物在0~5 h时缓慢释放,累积释放度分别为40.3%、25.3%和19.8%,药物在6~9 h持续释放,10~12 h时释放基本趋于平缓,在12 h后的累积释放度分别为91%、89.9%和82%。2#微囊和3#微囊具有缓释效果,因为随着取代度增大,分子内羧甲基数量增多,CMKGM和SA协同作用加强,可以很好地包裹药物。
2.3.2 CMKGM与SA质量比对微囊释放性能的影响
通过研究1#微囊、2#微囊和3#微囊的体外释放可知,2#微囊和3#微囊具有缓释效果,并且3#微囊在12 h后的累积释放率达到90%。因此,选择3#微囊,研究CMKGM和SA的质量比对微囊释放性能的影响。
由图3可知,CMKGM∶SA(质量比)为1∶1、2∶1、3∶1和4∶1时,微囊的药物释放具有缓释性,药物在0~5 h时缓慢释放,累积释放度分别为14%、20%、23.6%和26.3%,药物在6~9 h持续释放,10~12 h时释放基本趋于平缓,在12 h后的累积释放度分别为72%、80%、86%和90%。随着CMKGM∶SA的增加,制备的微囊缓释效果越来越低,当CMKGM∶SA(质量比)为5∶1时,微囊的释放几乎呈线性。是因为随着CMKGM∶SA(质量比)的增加,CMKGM与SA之间的协同作用达到饱和,结构不紧密,不能很好地包裹药物,水分很容易渗入,药物释放达不到缓释的效果。

图3 CMKGM与SA质量比微囊体外释放曲线
Fig.3 Release curve of microcapsule in vitro of mass ratio of CMKGM and SA
2.3.3 BSA质量对微囊释放性能的影响
选择3#微囊,研究BSA质量对微囊释放性能的影响。
由图4可知,BSA质量为20.0 mg和30.0 mg时,微囊的药物释放具有缓释性,药物在0~5 h时缓慢释放,累积释放度分别为18%和27%,药物在6~9 h持续释放,10~12 h时释放基本趋于平缓,在12 h后的累积释放度分别为80%和92%。BSA为40.0 mg时,微囊的药物释放不具有缓释效果。因为随着BSA质量的增加,囊材包裹不完全,导致药物出现突释,达不到缓释的效果。
2.3.4人工模拟消化液中微囊的体外释放曲线
由图5可知,在SGF中,药物释放很缓慢,12 h后的累积释放度为18.5%。在SIF中,0~4 h时药物释放较为缓慢,累积释放度达到13%,12 h后累积释放度达到50%。在SCF中,0~4 h时药物释放较为缓慢,累积释放度达到18%,随着时间的增加,药物释放几乎呈线性,12 h后累积释放度为86%,达到蛋白类药物的缓释效果。

图4 BSA质量对微囊体外释放曲线的影响
Fig.4 Release curve of microcapsule in vitro with different BSA’s quality
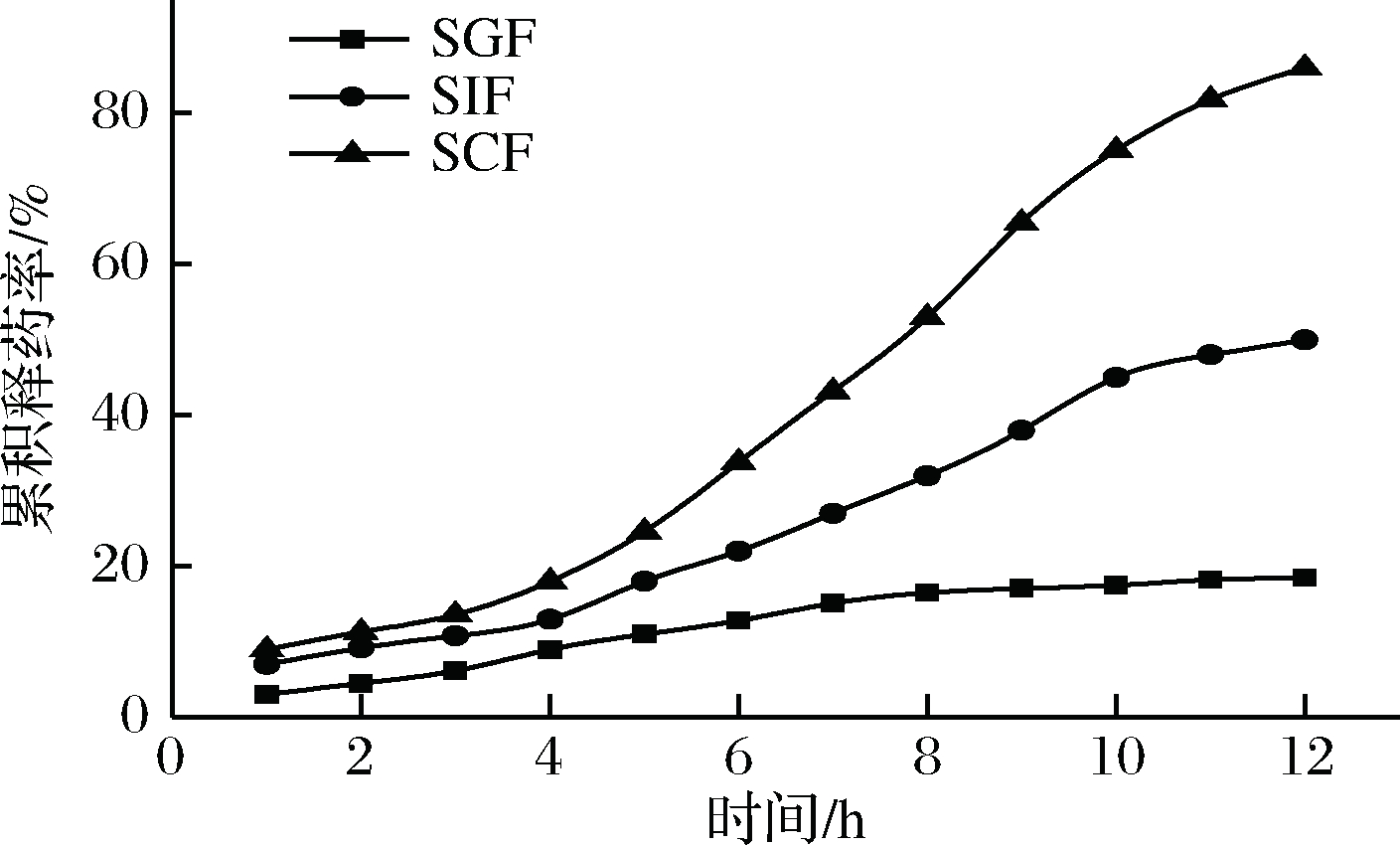
图5 人工模拟消化液中微囊的体外释放曲线
Fig.5 Release curve of microcapsule in vitro with Artificial simulation digestive juices
2.4 微囊体外释药特性的拟合模型
研究在人工模拟消化液中微囊的体外释放曲线可知,制备的微囊在SCF中具有很好的缓释效果。选取CMKGM3,CMKGM∶SA为3∶1,BSA质量为30.0 mg,制备微囊,对其体外释放进行模型拟合。在SCF中微囊的累积释放数据见表3。
表3 微囊体外累积释放率
Table 3 ARP of in vitro ralease of microcapsule
由表4中相关系数R值可以看出,Higuchi方程更拟合药物体外释放行为,药物释放释药以Fick扩散为主。由微囊的释放曲线可知,当累积释放度达到50%时,时间为7.5 h左右,符合Higuchi方程拟合的结果。图6为BSA微囊体外释放的Higuchi模型拟合结果。
由图6可知,用Higuchi模型对2#微囊体外释放数据进行拟合,BSA释放曲线与Higuchi模型的拟合理论曲线比较接近。
3 结论
微囊体外释放研究表明,1#微囊、2#微囊和3#微囊的药物在0~5 h时缓慢释放,6~9 h时持续释放,在10~12 h时释放基本趋于平缓,12 h后的累积释放分别为91%、89.9%和82%。由于2#微囊和3#微囊所用改性后的CMKGM取代度较大,而SEM显示,CMKGM结构比KGM结构更加紧密,颗粒体积增大,故具有良好的缓释效果。CMKGM和SA的质量比对3#微囊体外释放的影响结果表明,CMKGM∶SA(质量比)为1∶1、2∶1、3∶1和4∶1时,微囊的药物释放具有缓释效果,药物在0~5 h时缓慢释放,6~9 h时持续释放,药物在10~12 h时释放基本趋于平缓。BSA质量对微囊体外释放的影响结果表明,当BSA为20.0和30.0 mg时,微囊的药物释放具有缓释效果,药物在0~5 h时缓慢释放,在6~9 h时,药物持续释放,在10~12 h时释放基本趋于平缓。微囊在人工模拟消化液的体外释放结果表明:在SGF中,药物释放很缓慢,12 h后的累积释放度为18.5%。在SIF中,0~5 h时药物释放较为缓慢,累积释放度达到13%,6~9 h时持续释放,12 h后累积释放度达到50%。在SCF中,0~5 h时药物释放较为缓慢,累积释放度达到18%,6~12 h时持续释放,药物释放几乎呈线性,12 h后累积释放度为86%。微囊体外释放模型拟合发现,Higuchi方程更拟合药物体外释放行为,药物释放药以Fick扩散为主。
表4 微囊体外释放模型的模拟结果及相关参数
Table 4 Fitting results and relative parameters of in vitro ralease of microcapsule
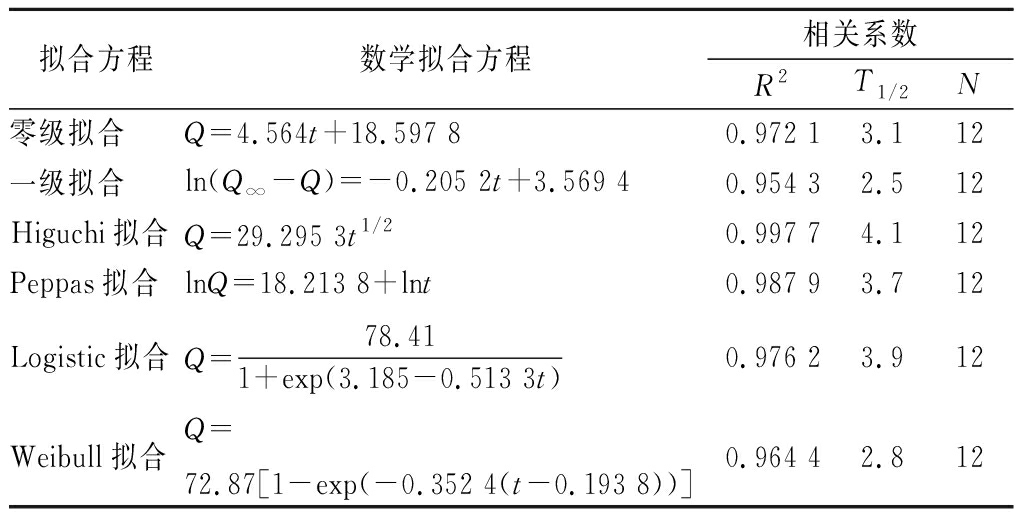
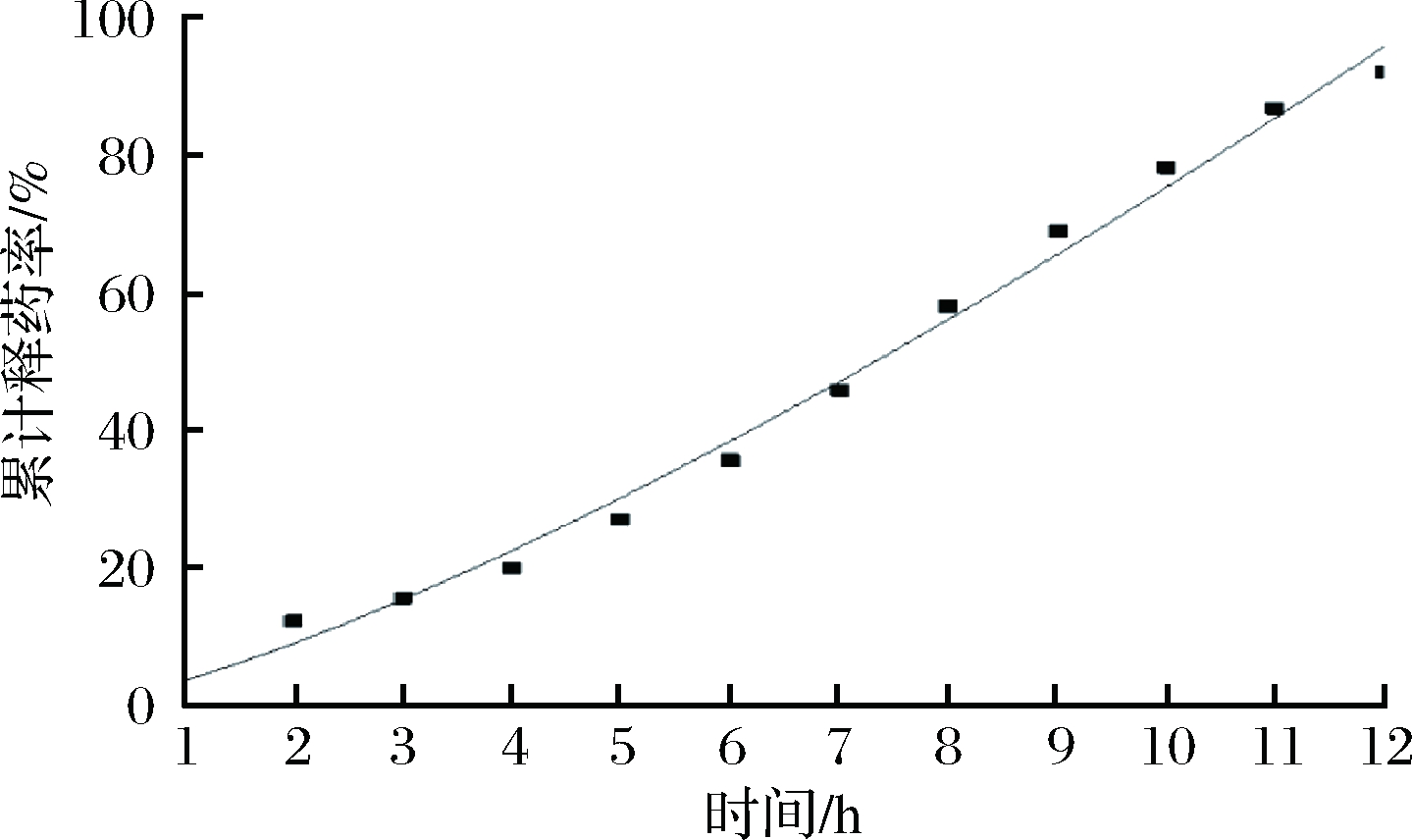
图6 BSA微囊体外释放的模型拟合
Fig.6 Model fit of BSA release from microcapsule
参考文献
[1] HUANG L, TAKAHASHI R, KOBAYASHI S, et al. Gelation behavior of native and acetylated konjac glucomannan[J]. Biomacromolecules, 2002, 3(6):1 296-1 303.
[2] NISHINARI K, TAKAHASHI R. Interaction in polysaccharide solutions and gels[J]. Current Opinion in Colloid & Interface Science, 2003, 8(4/5):396-400.
[3] JIAN Wen-jie, WU Jian-yong. Effects of pH and temperature on colloidal properties and molecular characteristics of Konjac glucomannan[J]. Carbohydrate Polymers, 2015, 134:285-292.
[4] BEHERA S S, RAY R C. Konjac glucomannan, a promising polysaccharide of amorphophallus konjac K. Koch in health care[J]. International Journal of Biological Macromolecules, 2016, 92:942-956.
[5] ZHANG Cui, CHEN Ji-da, YANG Feng-qing. Konjac glucomannan, a promising polysaccharide for OCDDS[J]. Carbohydrate Polymers, 2014, 104(1):175-181.
[6] JI Lei, XUE Yong, ZHANG Tao, et al. The effects of microwave processing on the structure and various quality parameters of Alaska pollock surimi protein-polysaccharide gels[J]. Food Hydrocolloids, 2017, 63:77-84.
[7] HUANG Qing, GE Hong-he, JIN Wei-ping, et al. Significant improvement for the functional properties of konjac glucomannan based on phase separation[J]. International Journal of Food Science & Technology, 2016, 51(11): 2 396-2 405.
[8] JIAN Wei-jin, WU Hua-yi, WU Lan-lan, et al. Effect of molecular characteristics of Konjac glucomannan on gelling and rheological properties of Tilapia myofibrillar protein[J]. Carbohydrate Polymers, 2016, 150:21-31.
[9] 杨晓鸿. 魔芋胶的交联化学改性研究[J]. 应用化工, 2004, 33(1):9-11.
[10] WU Li-ping, LIN Xiao-yan, WU Jia-jie, et al. Adsorption behavior of carboxymethyl konjac glucomannan microspheres for fluoride from aqueous solution[J]. Rsc Advances, 2016, 6(92):89 417-89 429.
[11] 王萌.葡甘聚糖改性制备纸张增强剂的研究[D]. 北京:北京林业大学, 2016.
[12] 覃余敏. 改性魔芋粉CMK的制备及其理化性能的研究[J]. 江苏丝绸, 2002(6):16-19.
[13] ZUBER M, ZIA F, ZIA K M, et al. Collagen based polyurethanes-A review of recent advances and perspective[J]. International Journal of Biological Macromolecules, 2015, 79:377-387.
[14] CI S X, HUYNH T H, LOUIE L W, et al. Molecular mass distribution of sodium alginate by high-performance size-exclusion chromatography[J]. Journal of Chromatography A, 1999, 864(2):199-210.
[15] 王婷婷. 海藻酸钠微球包封L-抗坏血酸的制备及其在化妆品中的应用[D]. 无锡:江南大学, 2014.
[16] KONG H J, SMITH M K, MOONEY D J. Designing alginate hydrogels to maintain viability of immobilized cells[J]. Biomaterials, 2003, 24(22):4 023-4 029.
[17] VENKATESAN J, BHATNAGAR I, MANIVASAGAN P, et al. Alginate composites for bone tissue engineering: A review[J]. International Journal of Biological Macromolecules, 2015, 72:269-281.
[18] TREENATE P, MONVISADE P. In vitro, drug release profiles of pH-sensitive hydroxyethylacryl chitosan/sodium alginate hydrogels using paracetamol as a soluble model drug[J]. International Journal of Biological Macromolecules, 2017, 99:71-78.
[19] 陈红,徐静,康晓梅,等. 海藻酸钠及其复合材料在生物医药中的研究进展[J]. 世界科技研究与发展, 2010, 32(4):536-539.
[20] 樊华,张其清. 海藻酸钠在药剂应用中的研究进展[J]. 中国药房, 2006, 17(6):465-467.
[21] 宋健,陈磊,李效军. 微胶囊化技术及应用[M]. 北京:化学工业出版社,2001(1): 25-29.
[22] 李占锋. 多功能载药微胶囊的超声化学制备及其性能研究[D]. 长春:吉林大学, 2016.
[23] 汪洋,张成伟. 微囊化技术在药剂学中的应用[J]. 中国实用医药, 2008, 3(12): 183-185.
[24] WANG Kang, HE Zhi-ming. Alginate-konjac glucomannan-chitosan beads as controlled release matrix[J]. International Journal of Pharmaceutics, 2002, 244(2): 117-126.
[25] WU Qing-xi, YAO Shan-jing. Novel NaCS-CS-PPS microcapsules as a potential enzyme-triggered release carrier for highly-loading 5-ASA[J]. Original Research Article Colloids and Surfaces B: Biointerfaces, 2013(109): 147-153.
[26] 黄静,潘丽军. 一种快速准确测定羧甲基淀粉取代度的方法[J]. 食品工业科技, 2003(3): 82-58.
[27] 朱颖,程宁,王雨青,等. 硫酸沙丁胺醇脉冲微丸释放特性的模型拟合和比较[J]. 中国医药工业杂志, 2006, 37(1):20-22.