植物乳杆菌是一类革兰氏阳性的乳杆菌,在自然界中广泛存在,尤其是分布在各类发酵食品中,如蔬菜、肉、乳制品及葡萄酒等。同时植物乳杆菌也存在于人体胃肠道中,是人体胃肠道内的益生菌群,对人体健康具有很大的促进作用[1]。目前大量研究表明,植物乳杆菌具有调节免疫功能、调节慢性代谢性疾病、拮抗致病菌感染、调节肠道功能、调节精神和神经功能等多种健康功效,同时植物乳杆菌益生功能的临床研究也在逐渐展开。基于植物乳杆菌良好的生理特性及益生功能,植物乳杆菌在食品、动物饲料、工业生产、医疗保健等领域被广泛应用,国内外学者对其研究也越来越深入。因此本文将主要综述国内外植物乳杆菌基因组学、营养代谢规律、耐胁迫机制、益生功能及临床应用等方面的研究进展,旨在为植物乳杆菌的研究和应用提供参考。
1 植物乳杆菌基因组学研究进展
近年来,随着高通量测序技术的快速发展以及2003年第1株植物乳杆菌的全基因组测序的完成,掀起了全世界范围内植物乳杆菌全基因组测序的热潮。至 2018年10月,完成全基因组测序并提交至美国国立生物技术信息中心(National Center for Biotechnology Information,NCBI)的植物乳杆菌菌株有67株,基因组草图304株。已完成全基因组测序的部分植物乳杆菌概况见表1。对于植物乳杆菌全基因组序列的测定,以及结合功能基因组学研究,有助于我们全面、系统地了解植物乳杆菌基因组的结构和组成,进而从分子水平上为分析植物乳杆菌的生物学功能及应用提供依据。纵观植物乳杆菌全基因组的基本信息,发现植物乳杆菌具有以下特点:(1)全基因组的长度在2.9~3.7 Mb之间,是乳酸菌中基因组最大的种类;(2)G+C百分含量通常为 45%左右,而双歧杆菌GC%含量高达60%左右,唾液乳杆菌GC%含量则低至33%左右。而植物乳杆菌与其他种类乳杆菌的重要差异在于已报道的植物乳杆菌基因组中,均有不编码细胞壁的蛋白酶存在[2]。
2 植物乳杆菌营养代谢规律研究进展
植物乳杆菌属于化能异养型微生物,缺少对多种化合物的合成能力,需从外界获取生长代谢所需的营养物质。如糖类、氨基酸、生长因子和矿物质等。
植物乳杆菌在生长过程中,除了受底物的影响外,还受其他因素影响,如有机酸、氧气及渗透压等。有机酸是植物乳杆菌的主要代谢产物,会造成pH下降,抑制菌株生长。未解离分子形式的有机酸与细胞膜的磷脂具有高度互溶性,能够被动扩散至细胞内部,直到胞内外有机酸分子浓度一致[3-4]。进入胞内的有机酸会解离成H+和酸根离子,从而对胞内的一些活性物质产生抑制,也会造成菌株生长受到抑制。除此之外,已知植物乳杆菌为兼性厌氧生长,通常情况下,氧自身不会损害细胞,但是氧分子暴露后则以![]() 的形式存在,这些基团的富集可引起氧化应激效应并损害植物乳杆菌细胞内的蛋白质、脂肪酸、DNA,导致细胞凋亡[5]。在微生物生长过程中,渗透压是降低其生长速率、影响其新陈代谢活力的主要因素。研究表明,在同一初始摩尔渗透压浓度的NaCl、乳糖、蔗糖条件下,植物乳杆菌的生长繁殖速率随摩尔渗透压浓度的增高而加快;且在高摩尔渗透压浓度乳糖和蔗糖条件下,细胞能够保持胞内外浓度平衡[6]。
的形式存在,这些基团的富集可引起氧化应激效应并损害植物乳杆菌细胞内的蛋白质、脂肪酸、DNA,导致细胞凋亡[5]。在微生物生长过程中,渗透压是降低其生长速率、影响其新陈代谢活力的主要因素。研究表明,在同一初始摩尔渗透压浓度的NaCl、乳糖、蔗糖条件下,植物乳杆菌的生长繁殖速率随摩尔渗透压浓度的增高而加快;且在高摩尔渗透压浓度乳糖和蔗糖条件下,细胞能够保持胞内外浓度平衡[6]。
表1 已完成全基因组测序的部分植物乳杆菌
Table 1 Summary of whole genome sequencing of the Lactobacillus plantarum

续表1

注:表1是 NCBI 数据库中已完成测序的植物乳杆菌基因组的基本信息。
3 植物乳杆菌耐胁迫机制研究进展
植物乳杆菌耐胁迫主要包括耐受酸、胆盐、渗透压、温度、氧化和饥饿的胁迫。具体耐胁迫机制表述如下:
3.1 植物乳杆菌耐受酸胁迫研究进展
植物乳杆菌在生长过程中发酵碳水化合物产乳酸,进而导致菌株生长环境的变化,构成所谓的“酸胁迫”环境,为了应对各种酸胁迫,植物乳杆菌会产生一定的应激反应。当酸性环境引起菌体内部失衡时,菌体为了保持细胞在酸胁迫时的稳定性,会调动各种调节机制来应对酸胁迫。其酸应激反应机制主要包括:1) 氨的产生。生成NH3 提高环境pH,是乳酸菌抵御酸胁迫比较普遍的一种调控机制。其中,精氨酸脱亚胺酶(ADI)系统是生成NH3 最常见的来源,它在乳酸菌的酸耐受过程中起着重要的作用。其次还有胍丁胺脱亚胺酶(AgDI)系统,脲酶系统(urease system)及酸胁迫下的其他氨基酸代谢。其中植物乳杆菌主要是通过ADI系统抵御酸胁迫。2)脱羧反应。主要包括谷氨酸脱羧酶系统(glutamic acid decarboxylase,GAD),苹果酸-乳酸发酵途径(malolactic acid fermentation,MLF)及酸胁迫下的其他脱羧反应。有研究表明植物乳杆菌通过MLF抵御酸胁迫[7];3)受损大分子的保护或修复。主要包括:受损蛋白质的保护或修复和受损DNA 的保护或修复。当处于酸性环境时,乳酸菌的分子伴侣、热激蛋白等会显著性地上调表达,从而保护目标蛋白质的活性[8]。COHEN 等研究表明,植物乳杆菌WCFS1 的糖酵解酶类在生长到稳定期时下调表达,而LELOIR 途径的代谢酶,如半乳糖激酶、UDP-葡萄糖-4-差向异构酶和丙酮酸氧化酶上调表达[9]。受损DNA 的保护或修复主要指当乳酸菌遇到酸胁迫时,胞内pH 的降低会导致DNA 的脱嘧啶和脱嘌呤。当乳酸菌有碱基缺陷或DNA 损伤时,可以利用碱基切除和核苷酸切除的方式来进行修复。有研究表明,核酸外切酶参与90%的碱基修复,被酸胁迫诱导作为保护机制[10];4)其他保护机制,如细胞密度、生物膜的形成、双组分调控机制及代谢途径改变的机制(当乳酸菌面对自身酸化带来的胁迫时,通常会在生长过程中改变某些代谢途径,通过增加ATP 的产生减小酸胁迫对菌体造成的损伤)。
3.2 植物乳杆菌耐受胆盐胁迫研究进展
植物乳杆菌发挥益生作用的前提是顺利通过胃的酸性环境以及十二指肠高胆盐环境,以活菌的状态到达小肠和大肠,进而发挥微生态调整的功能。因此在益生菌筛选工作中,对胆盐的耐受是益生菌必备的生理特征。植物乳杆菌耐受胆盐的机理主要包括:1)胞外多糖的产生。胞外多糖作为一种多糖性质的外层结构,有助于菌体更好地减少胃酸和胆盐的损害。2)表层蛋白对胆盐耐受性的影响。表层蛋白(surface layer protein,SLP)是一种在革兰氏阳性菌和革兰氏阴性菌,以及古细菌中都有发现的细胞封装结构。由它形成了细胞最外层的蛋白层,甚至形成一个胶囊结构将细胞完全包裹起来。3)乳酸菌对胆盐的转化。乳酸菌中的胆盐水解酶可以将对菌体毒性较高的初级胆盐转化为毒性较低的次级胆盐,从而提高菌株在肠胃道的生存率。4)胆盐耐受的应激反应。已有学者研究发现通过胆盐胁迫,植物乳杆菌中抗氧化酶类基因、离子泵蛋白基因、膜蛋白基因、转录调控基因、胆盐水解酶基因、多药转运蛋白基因、糖转运蛋白基因等表达量都发生了变化[11]。5)膜结构的维持。胆盐作为一种表面活性剂,可以乳化食品中的脂肪成分,而乳酸菌中95%的脂质集中于细胞膜上的磷脂,因此细胞膜是胆盐破坏细胞结构的位点[12]。胡斌的研究发现植物乳杆菌菌体脂肪酸构成通过影响菌体细胞完整性而改变其胆盐耐受能力[13-14]。
3.3 植物乳杆菌耐受渗透压胁迫研究进展
一些研究者认为,细菌中主要运用两类调节机制来调节细胞内外的渗透压:氯化钾型及相容性溶质型。大多数中度嗜盐菌的耐盐机制是相容性溶质型[15]。乳酸菌对抗渗透压胁迫的机制主要包括:(1)恢复胞内离子平衡。包括:1)Na+转运体,一些膜蛋白能直接或间接调节细胞膜对盐离子的通透性,从而参与渗透压的调节。其中,细胞膜上的Na+/H+反向转运蛋白是微生物外排Na+的主要途径[16]。有研究表明,在植物乳杆菌中发现了编码Na+/H+反向转运蛋白的基因,高渗条件下Na+/H+反向转运蛋白将胞内Na+排出,降低Na+在代谢活跃部位的积累,从而减轻Na+对细胞的毒害作用[17];2)K+转运体,当细胞受到盐胁迫时,除了外排Na+外,细胞通常还会增加K+的吸收,恢复Na+/K+,从而恢复细胞内水和离子平衡。而有研究发现,植物乳杆菌胞外盐浓度的变化对胞内K+的浓度没有显著的影响[18];3)H+转运体。(2)吸收或合成相容性溶质。对于大多数微生物来说,都可以积累多种相容性溶质,但起主要作用的往往是其中的一种或几种。不同的乳酸菌积累相容性溶质的种类也存在差别(表2)。(3)改变细胞壁/膜的组成。(4)调节应激蛋白表达。(5)调节胞内代谢平衡。
表2 部分乳酸菌利用相容性溶质情况
Table 2 Compatible solutes that can be utilized by partial lactic acid bacteria

注:+,可利用;-,不可利用;nd,没有检测到。
3.4 植物乳杆菌耐受温度胁迫研究进展
植物乳杆菌最适生长条件一般在中温,但在工业生产中,植物乳杆菌往往则会面临不同温度的胁迫,如低温刺激下,植物乳杆菌扩散和细胞膜的转运速度降低。核糖体转录和翻译过程受到抑制,导致蛋白质的合成量减少,细胞骨架遭到破坏,造成细胞膜的流动性发生改变,细胞膜的通透性增加,从而造成细胞的代谢损伤[21]。植物乳杆菌为了应对低温变化,则会:1)提高膜脂质中不饱和脂肪酸的比例[22-23];2)产生一系列冷休克蛋白,修复损坏的DNA 结构[24]。在高温条件下,蛋白质也会发生变性和降解,并最终改变细胞膜的流动性[25]。植物乳杆菌为了应对高温变化,则会:1)诱导产生一系列伴侣蛋白和蛋白酶,这些蛋白被称为热休克蛋白[21];2)增加膜脂质中饱和脂肪酸的比例[6, 23]。
3.5 植物乳杆菌耐受氧化胁迫研究进展
在制约植物乳杆菌生存生长的诸多胁迫因素中,氧化胁迫有着较为特殊的地位。植物乳杆菌抗氧胁迫的机制主要包括:1)碳水化合物代谢和能量的产生。植物乳杆菌主要是通过糖酵解途径生成能量。在氧化胁迫条件下, 植物乳杆菌通过提高糖酵解途径的整体代谢水平以产生更多能量满足细胞抵抗胁迫的需要[26]。2)碳水化合物转运及利用。在氧化胁迫下、植物乳杆菌细胞增加了对不同单糖、寡糖和低聚糖的利用度,其碳源利用谱的扩增,有助于细胞产生更多能量和还原力,以应对环境的氧化压力。3)胞内氧化还原平衡和ROS解毒。在植物乳杆菌中,Trx系统是氧化胁迫条件下细胞存活的关键因素[27]。有研究者指出,植物乳杆菌在转录翻译过程中可迅速地提高Trx系统的表达量,对于菌体在氧化胁迫发生后短时间内稳定细胞内氧化还原电势具有重要意义。4)普遍胁迫响应机制。主要是指细胞面对不同环境压力的共同响应机制,包括对分子伴侣、蛋白酶以及一些特殊功能蛋白的诱导。有研究发现植物乳杆菌氧化胁迫转录组中检测到分子伴侣蛋白基因groES 和groEL上调,分子伴侣GroES-GroEL普遍存在于细菌中,是蛋白质正确折叠所需的分子伴侣[28]。
3.6 植物乳杆菌耐受饥饿胁迫研究进展
植物乳杆菌无论是在自然环境中还是在生产、应用中都不可避免地面临着不同环境因素的胁迫。在这些胁迫中,营养物质的缺失是最常见的影响因素。植物乳杆菌通常会通过进入饥饿状态或活的非可培养(viable but nonculturable,VBNC)状态达到较低的代谢水平,以适应不良环境的压力[29-30]。植物乳杆菌在饥饿胁迫状态下产生应激反应的机制主要包括:1)应激蛋白的大量表达;2)细菌进入休眠状态[31]。在碳源缺乏或者能量缺乏时,植物乳杆菌通过控制基因转录、DNA 复制和细胞分裂,节约能量,进入休眠状态。
4 植物乳杆菌益生功能研究进展
近年来,随着肠道菌群与人体健康研究的深入开展,人类逐渐意识到调节肠道微生态稳态对人体健康至关重要。大量研究证实,益生菌具有调节肠道菌群结构,改善肠道微生态稳态,从而促进健康的良好功效。因此,益生菌作为一种具有改善人体健康功能的饮食,被大众广为接受和关注,同时也吸引了越来越多科研工作者进行研究。其中,植物乳杆菌基于其良好的生理特性和益生功能,已经成为了益生菌功能研究领域的一个热点方向。因此,作者将概述目前国内外植物乳杆菌益生功能的研究进展,并介绍作者所在课题组的相关研究成果,以供研究者参考。
4.1 调节免疫功能
研究表明,植物乳杆菌能通过细菌本身或细胞壁成分提高黏膜表面和血清中IgA、IgG和IgM水平,增强体液免疫;促进T淋巴细胞和B淋巴细胞的增殖,加强细胞免疫;增强单核吞噬细胞(单核细胞和巨噬细胞)的活力,刺激活性氧、溶酶体酶和单核因子的分泌,加强非特异性免疫反应[32]。下面列举一些代表性研究成果以供参考。
PERDIGON 等对小鼠饲喂植物乳杆菌L. plantarum CRL936 后,可诱导小鼠肠上皮的IgM和派尔集合淋巴结中的免疫细胞,并增强肠道和支气管中IgA和CD4+T细胞的免疫功能[33]。DEL等利用患莱姆病小鼠模型研究植物乳杆菌对其机体自身免疫力的调节作用,研究表明口服植物乳杆菌活菌剂可以有效地防止小鼠被细菌感染[34]。MARAGKOUDAKIS研究表明,在给山羊的饲料中添加不同剂量的植物乳杆菌 PCA 236会不同程度地提高其体内IgA、IgG和IgM水平,对山羊免疫系统起到一定的调节作用[35]。DONG等发现,植物乳杆菌 NCIMB 8826 能够增强淋巴细胞、T细胞、T细胞亚群以及NK细胞的活性,同时使IL-1β、IL-6、IL-10、TNF-α等细胞因子的活性也有不同程度地提升[36]。
4.2 调节慢性代谢性疾病功能
4.2.1 调节代谢紊乱
大量研究表明,植物乳杆菌可有效调节血糖、血脂、血压平衡,具有改善代谢紊乱的作用[37-38]。HUANG等研究发现,补充植物乳杆菌L. plantarum K68发酵的果蔬产品,能够降低大鼠血清中葡萄糖和胰岛素的含量,有效调控胰岛素抵抗指数,从而缓解代谢综合征引发的胰岛素抵抗[39]。LI等通过建立高血脂大鼠模型,发现植物乳杆菌L. plantarum NCU116能够显著增加血清中高密度脂蛋白胆固醇(HDL-C)水平,降低血清中总胆固醇(TC)、总甘油三酯(TG)和低密度脂蛋白胆固醇(LDL-C)的含量,改善血脂异常[37]。LI等发现,植物乳杆菌L. plantarum X1可通过提高2型糖尿病小鼠体内短链脂肪酸的水平,缓解糖尿病相关症状[40]。LIU等发现植物乳杆菌TWK10能够显著抑制血管紧张素转化酶(ACE)活性[41],NEJATI等发现植物乳杆菌PU11通过高产γ-氨基丁酸来抑制血管紧张素转化酶(ACE)活性[42],表明这些植物乳杆菌具有缓解高血压的潜在功效。
作者所在课题组近期研究发现,植物乳杆菌CCFM591和ZS2058能够显著缓解小鼠血糖水平异常升高,维持小鼠机体血糖-胰岛素之间的稳态;补充ZS2058显著降低了血清中TC和LDL-C的水平,而CCFM591对血脂紊乱无显著的改善作用;另外补充CCFM591能显著提高小鼠粪便中短链脂肪酸的含量[43]。
4.2.2 调节酒精性和非酒精性脂肪肝
近年研究表明,植物乳杆菌对酒精性肝损伤具有改善作用。ZHAO等研究发现,植物乳杆菌C88对慢性酒精所致的小鼠肝损伤具有改善作用[44]。SHUKLA等研究发现,植物乳杆菌可以通过EGF受体依赖的机制,预防和减轻酒精引起的结肠上皮紧密连接的破坏、内毒素血症和肝损伤[45]。KIM等研究发现,植物乳杆菌LC27和长双歧杆菌LC67可以通过抑制LPS介导的NF-κB激活,从而抑制小鼠酒精性脂肪变性[46]。作者所在课题组也筛选得到1株植物乳杆菌LP1001,研究证明其能够显著缓解小鼠酒精性肝损伤[47]。另外也有研究显示,植物乳杆菌能够调节胆汁酸代谢、调节肠道短链脂肪酸水平、降低血清中胆固醇水平,具有缓解非酒精性脂肪肝的潜在功效[37, 48-49]。
4.3 拮抗胃肠道致病菌感染
胃肠道致病菌感染是引起胃肠道疾病的一个重要因素。服用抗生素是治疗胃肠道致病菌感染的最有效方法,然而抗生素治疗也存在许多问题,如抗生素会引起胃肠道微生态环境紊乱,出现腹胀、腹泻及便秘等一系列消化道病症,甚至发生更为严重的不良反应,如抗生素相关性肠炎,耐药性菌株的出现,导致治疗反复性。因此,近年来许多研究人员探索其他拮抗胃肠道致病菌感染的新方法,如益生菌、抗氧化剂、植物化学物质等非抗生素制剂来改进或完善现有的治疗方案,其中益生菌在拮抗胃肠道致病菌感染方面具有显著性优势。下面以植物乳杆菌为例,列举一些代表性研究成果以供参考。
4.3.1 拮抗沙门氏菌
研究表明,植物乳杆菌能够抑制沙门氏菌生长[50-51]、影响其毒力因子表达[52]、降低沙门氏菌对肠上皮细胞的黏附和侵袭[50, 53]、减少实验动物肠组织及内容物和脏器中菌载量[50-51]、调节免疫功能[53-54]、降低沙门氏菌感染引起的动物死亡率[55]等。作者所在课题组近期研究发现,以死亡率为判断指标,植物乳杆菌对预防沙门氏菌感染具有菌株特异性,植物乳杆菌ZS2058能有效预防沙门氏菌感染[56]。
4.3.2 拮抗空肠弯曲杆菌
研究表明,植物乳杆菌可以有效拮抗空肠弯曲杆菌感染。如在体外抑制空肠弯曲杆菌生长[57],下调小鼠感染空肠弯曲杆菌后的炎性因子水平[58],降低肉鸡饲养环境中的空肠弯曲杆菌污染程度[59]。作者所在课题组近期筛选出植物乳杆菌N8、N9,该菌株可以有效抑制空肠弯曲杆菌粘附、侵袭HT-29细胞系[60],并且可以降低小鼠感染空肠弯曲杆菌后的病原定植量[61]。
4.3.3 拮抗幽门螺杆菌
研究表明,植物乳杆菌通过代谢抗菌物质(乳酸、过氧化氢、细菌素等)、分泌幽门螺杆菌竞争性粘附受体、刺激黏蛋白的表达和稳定胃黏膜等作用来抑制幽门螺杆菌定植[62-63]。作者所在课题组研究发现,植物乳杆菌L. plantarum 18在体外和小鼠实验中均能够抑制幽门螺杆菌的生长和感染[64-65]。
4.4 调节肠道功能
研究表明,植物乳杆菌具有调节肠道功能、干预肠道疾病、维持肠道健康的作用。目前,植物乳杆菌已经在改善便秘、腹泻、炎症性肠炎、结直肠癌等肠道疾病方面表现出良好的干预效果。植物乳杆菌调节肠道功能的作用机制主要包括:(1)调节肠道菌群,维持肠道微生态系统平衡;(2)调节肠道黏膜局部和系统免疫功能;(3)增强肠道上皮屏障功能等。下面列举一些代表性研究成果以供参考。
4.4.1 调节便秘
李川发现,植物乳杆菌NCU116 能够显著缓解洛哌丁胺诱导的小鼠便秘[66]。彭芝榕等发现植物乳杆菌F1208能够显著缓解洛哌丁胺诱导的大鼠便秘[67]。易若琨等发现植物乳杆菌YS-1对活性炭诱导的小鼠便秘具有预防作用[68]。
4.4.2 调节腹泻
姚国强等发现植物乳杆菌 HM-10能够显著缓解犊牛的腹泻,降低腹泻率、腹泻时间和死亡率[69]。NAGASHIMA等发现分离自日本北海道泡菜中的植物乳杆菌也能缓解小牛的腹泻发病率[70]。
4.4.3 调节炎症性肠病
NEMOTO等发现植物乳杆菌 Sanriku-SU7能够改善DSS诱导的小鼠结肠炎[71]。作者所在课题组研究发现,植物乳杆菌ZS2058通过产生共轭亚油酸改善DSS诱导的小鼠结肠炎[72]。
4.4.4 抑制结直肠癌
研究表明,植物乳杆菌具有抑制结肠癌细胞增殖的作用[73]。近期作者所在课题组也筛选出1株具有拮抗结直肠癌作用的植物乳杆菌 F17,在体外和动物实验中均验证了其有效性[74]。
4.5 调节精神和神经功能
研究表明,肠道菌群通过作用于“肠-脑轴”来调节神经系统,进而影响精神和神经功能,如情绪、认知、运动功能等。目前已有报道证明,植物乳杆菌可通过调节肠道微生态和“肠-脑轴”来改善精神和神经功能。以下列举一些代表性研究成果以供参考。
4.5.1 调节焦虑、抑郁等情绪功能障碍
LIU等证明植物乳杆菌PS128通过增加无菌小鼠纹状体中单胺类神经递质,改善了无菌小鼠的焦虑行为和认知行为,提示其具有潜在的神经和精神调节作用[75]。另外,LIU等证明,植物乳杆菌PS128通过增加小鼠脑中的神经递质水平和减少脑中的炎症水平,从而改善生命早期应激小鼠和成年小鼠的焦虑和抑郁行为,再次揭示植物乳杆菌PS128具有潜在的精神调节作用[76]。DHALIWAL等证明植物乳杆菌MTCC 9510能够显著改善慢性不可预知温和应激和睡眠剥夺应激诱导的小鼠神经和精神异常,包括改善焦虑、抑郁、认知和刻板行为等。进一步研究显示植物乳杆菌MTCC 9510通过调节应激小鼠的肠道菌群、肠道炎症水平、肠道屏障和血脑屏障完整性等作用来恢复肠-脑轴正常状态,从而改善应激小鼠的神经和精神状态[77]。DAVIS等证明植物乳杆菌能够显著改善应激引起的斑马鱼焦虑行为和肠道菌群失衡[78]。
4.5.2 调节阿尔茨海默症等认知功能障碍
LIU等证明植物乳杆菌TWK10发酵豆奶是良好的神经保护剂,能显著提高血管性痴呆大鼠的认知功能[79]。MALLIKARJUNA等研究表明植物乳杆菌MTCC1325能够显著改善D-半乳糖诱导的AD大鼠脑中总ATP酶水平,具有延缓神经退变的潜在功效[80]。NIMGAMPALLE等进一步研究证实植物乳杆菌MTCC1325能够显著改善D-半乳糖诱导的AD大鼠的认知功能[81]。
4.6 减除有害因子
在人类日常生活和生产过程中,存在着许多会影响人类健康的有害因子,包括物理性污染物(如有害金属)、化学性污染物(如塑化剂、全氟化合物)、生物性污染物(如展青霉素)等。因此亟待开发高效的清除方法来减除这些有害因子的危害。研究表明,植物乳杆菌具有良好的清除有害因子的功效,为开发新型清除有害因子的策略研究提供了新思路。以下列举一些代表性研究成果以供参考。
4.6.1 清除有害金属
有害金属污染已成为严重的食品安全卫生问题,最为典型的有害重金属是铅、镉、铝等。针对清除有害金属方面的研究,作者所在课题组筛选得到1株对铅离子具有较强吸附能力的植物乳杆菌 CCFM8661[82];筛选得到1株对镉具有极强吸附能力的植物乳杆菌 CCFM8610[83-86],其吸附镉能力显著高于商业益生菌株如鼠李糖乳杆菌 LGG 及干酪乳杆菌代田株;筛选得到一株对铝离子具有较强吸附能力的植物乳杆菌 CCFM639[87-90],并且均在动物实验中证实了其清除有害金属的高效性及分子机制。
4.6.2 清除塑化剂
研究证明,人类日常生活中广泛使用的塑化剂,邻苯二甲酸二(2-乙基己基)酯(DEHP)可经过多种途径进入人体并蓄积在脏器组织中,对人体产生多种毒性作用。目前研究主要通过VE、茶多酚、儿茶素等具有抗氧化活性的物质来缓解DEHP进入机体后产生的毒性[91-93],但这些方法的改善效果仍不理想。作者所在课题组首次采用植物乳杆菌进行体内干预DEHP毒性的研究,通过动物实验证明植物乳杆菌CCFM1019可通过吸附和抗氧化的协同作用,缓解DEHP引起的机体损伤,为缓解塑化剂毒性研究提供了新思路。
4.6.3 清除全氟化合物
目前研究主要是通过摄入抗氧化物质来降低全氟化合物的毒性损伤,但往往需要摄入大量抗氧化物质才能发挥作用,其副作用尚需评估[94]。近期作者所在课题组已经筛选出分别对典型全氟化合物——全氟辛酸(PFOA)和全氟辛烷磺酸(PFOS),具有较强吸附能力的植物乳杆菌CCFM738和CCFM737;并且通过动物实验证实植物乳杆菌CCFM738和CCFM737分别缓解了PFOA和PFOS引起的肝损伤[95]。
4.6.4 清除展青霉素
展青霉素是某些真菌产生的具多靶器官毒性的不饱和杂环内酯型毒素,已成为影响食品和饲料安全的重要风险因素。ZOGHI证实了植物乳杆菌的表面层蛋白质是其与展青霉素的结合位点,植物乳杆菌最高可从果汁中去除 91.23%的展青霉素[96]。作者所在课题组也发掘出能够清除展青霉素的植物乳杆菌株,在6 h内可降解展青霉素高达90%,将其降解为展青霉素前体物质E-ascladiol,其毒性明显降低;同时该菌株在动物体内也可以显著缓解展青霉素毒性。
5 植物乳杆菌临床应用研究进展
目前,植物乳杆菌已经在动物模型中展现出良好的益生功能,但其对人体益生功效的临床研究仍然处在初步阶段。已有临床研究表明,通过摄入植物乳杆菌或其发酵食品,能够对人体产生一些特定的益生功效。以下列举一些代表性研究成果以供参考。
5.1 调节免疫功能
MANE等通过临床研究发现服用L. plantarum CECT7315和L. plantarum CECT7316均能够增强老年人的机体免疫力[97]。HARIMA-MIZUSAWA等通过临床研究证实,服用L. plantarum YIT 0132发酵的柑橘汁能够显著缓解柳杉花粉引起的过敏症状[98]。
5.2 调节慢性代谢性疾病
在临床研究中,HARIRI 等证实L. plantarum A7可调节血糖水平,增加胰岛素敏感性,缓解机体代谢紊乱[99]。另外,临床研究表明服用L. plantarum A7 能够显著改善2型糖尿病肾病患者的肾脏功能[100]。MALIK等通过临床研究证明,服用L. plantarum 299v能够显著改善男性冠状动脉疾病患者的血管内皮功能,并减轻炎症[101]。KIRPICH等通过临床研究证实,服用植物乳杆菌8PA3和两歧双歧杆菌,能够显著改善酒精性肝损伤,效果好于标准治疗方法[102]。
5.3 调节肠道功能
HIGASHIKAWA等通过双盲随机人群试验,证明植物乳杆菌L. plantarum SN13T 发酵酸奶能够显著缓解便秘[103]。另外,服用L. plantarum 299v 4周能够显著缓解肠易激综合症患者的腹痛和腹胀现象[104-105]。
5.4 调节精神和神经功能
通过双盲随机安慰剂对照人群试验,RUDZKI等证明植物乳杆菌L. plantarum 299v能够显著改善抑郁患者的认知功能,进一步研究表明是由于植物乳杆菌L. plantarum 299v显著降低了抑郁患者体内的犬尿氨酸浓度[106]。通过双盲随机安慰剂对照人群试验,LEW等证明植物乳杆菌P8能够显著改善人群的焦虑、抑郁、记忆、认知等行为[107]。
5.5 其他益生功能
OL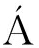 H等通过临床研究证明,植物乳杆菌L. plantarum 299能够显著改善胰腺脓毒症[108]。LEE等通过临床研究证明,L. plantarum HY7714能够显著缓解皮肤衰老[109]。IWASAKI等通过临床研究证实,灭活的植物乳杆菌L. plantarum L-137能够显著改善牙周病治疗效果[110]。BOSCH等通过临床研究证明,服用L. plantarum CECT 7315/7316能够显著改善老年人的健康水平[111]。
H等通过临床研究证明,植物乳杆菌L. plantarum 299能够显著改善胰腺脓毒症[108]。LEE等通过临床研究证明,L. plantarum HY7714能够显著缓解皮肤衰老[109]。IWASAKI等通过临床研究证实,灭活的植物乳杆菌L. plantarum L-137能够显著改善牙周病治疗效果[110]。BOSCH等通过临床研究证明,服用L. plantarum CECT 7315/7316能够显著改善老年人的健康水平[111]。
6 结束语
近年来随着科学技术的迅猛发展,国内外学者对植物乳杆菌的生理特性及益生功能研究也越来越深入。目前植物乳杆菌已经被广泛地应用于食品、动物饲料、工业生产、医疗保健等领域,具有巨大的市场需求和发展潜力。
目前植物乳杆菌已经在动物模型中展现出良好的益生功能,但对于部分功能的研究仍处于基础理论研究阶段,在临床实验和生产应用上还未成规模,未来还需要更多精确、大规模、深入的临床研究加以验证。
随着多组学技术的日益成熟,多组学技术在植物乳杆菌研究领域的应用日益受到青睐和重视。未来需综合应用基因组学、转录组学、蛋白质组学和代谢组学研究模式,揭示植物乳杆菌的遗传信息;解析其生理和代谢机制,研究植物乳杆菌应对生理和环境变化的适应机理;挖掘其重要的功能基因,探明其发挥有益功能的分子机制。综合应用多组学技术将会为植物乳杆菌更深入的理论和应用研究提供充分保障。
参考文献
[1] 曹承旭, 郭晶晶, 乌日娜, 等. 植物乳杆菌的生理功能和组学研究进展[J]. 乳业科学与技术, 2018, 41(1): 33-39.
[2] 陈臣. 植物乳杆菌ST-Ⅲ全基因组序列分析及其对低聚果糖代谢通路的解析[D]. 无锡: 江南大学, 2014.
[3] CARPENTER C E, BROADBENT J R. External concentration of organic acid anions and pH: key independent variables for studying how organic acids inhibit growth of bacteria in mildly acidic foods[J]. Journal of Food Science, 2009, 74(1): R12-15.
[4] 崔树茂. 乳酸菌的生长抑制和冻干存活的影响因素及规律[D]. 无锡: 江南大学, 2016.
[5] LEITE M C T, TROXELL B, BRUNO-BARCENA J M, et al. Biology of reactive oxygen species, oxidative stress, and antioxidants in lactic acid bacteria // Venema K, do Carmo A P. Probiotics and Prebiotics: current research and future trends[M]. Poole: Caister Academic Press, 2015: 205-218.
[6] 赵山山. 植物乳杆菌ST-Ⅲ盐应激反应及其协同保护作用的研究[D]. 无锡: 江南大学, 2016.
[7] MILLER B J, FRANZ C M, CHO G S, et al. Expression of the malolactic enzyme gene (mle) from Lactobacillus plantarum under wine making conditions[J]. Current Microbiology, 2011, 62(6): 1 682-1 688.
[8] ANGELIS M D, GOBBETTI M. Environmental stress responses in Lactobacillus: a review[J]. Proteomics, 2004, 4(1): 106-122.
[9] COHEN D P, RENES J, BOUWMAN F G, et al. Proteomic analysis of log to stationary growth phase Lactobacillus plantarum cells and a 2-DE database[J]. Proteomics, 2006, 6(24): 6 485-6 493.
[10] VAN de G M, SERROR P, CHERVAUX C, et al. Stress responses in lactic acid bacteria[J]. Antonie Van Leeuwenhoek, 2002, 82(1-4): 187-216.
[11] BRON P A, MARCO M, HOFFER S M, et al. Genetic characterization of the bile salt response in Lactobacillus plantarum and analysis of responsive promoters in vitro and in situ in the gastrointestinal tract[J]. Journal of Bacteriology, 2004, 186(23):7 829-7 835.
[12] RUIZ L, MARGOLLES A, S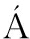 NCHEZ B. Bile resistance mechanisms in Lactobacillus and Bifidobacterium[J]. Frontiers in Microbiology, 2013, 4:396.
NCHEZ B. Bile resistance mechanisms in Lactobacillus and Bifidobacterium[J]. Frontiers in Microbiology, 2013, 4:396.
[13] 胡斌. 植物乳杆菌胆盐耐受评价及内在影响因素分析[D]. 无锡: 江南大学, 2015.
[14] TARANTO M P, FERNANDEZ MURGA M L, LORCA G, et al. Bile salts and cholesterol induce changes in the lipid cell membrane of Lactobacillus reuteri[J]. Journal of Applied Microbiology, 2003, 95(1):86-91.
[15] 崔小华. 嗜盐紫色硫细菌耐盐机制与光合色素研究[D]. 太原: 山西大学, 2013.
[16] PADAN E, BIBI E, ITO M, et al. Alkaline pH homeostasis in bacteria: new insights[J]. Biochimica et Biophysica Acta-Biomembranes, 2005, 1 717(2): 67-88.
[17] WANG Y, CHEN C, AI L, et al. Complete genome sequence of the probiotic Lactobacillus plantarum ST-III[J]. Journal of Bacteriology, 2011, 193(1): 313-314.
[18] GLAASKER E, KONINGS W N, POOLMAN B. Osmotic regulation of intracellular solute pools in Lactobacillus plantarum[J]. Journal of Bacteriology, 1996,178(3): 575-582.
[19] OBIS D, GUILLOT A, MISTOU M Y. Tolerance to high osmolality of Lactococcus lactis subsp. lactis and cremoris is related to the activity of a betaine transport system. FEMS Microbiology Letters, 2001, 202(1): 39-44.
[20] 陈卫. 乳酸菌科学与技术[M]. 北京: 科学出版社, 2018.
[21] DE ANGELIS M, GOBBETTI M. Environmental stress responses in Lactobacillus: a review[J]. Proteomics, 2004, 4(1): 106-122.
[22] SCHOUG A, FISCHER J, HEIPIEPER H J, et al. Impact of fermentation pH and temperature on freeze-drying survival and membrane lipid composition of Lactobacillus coryniformis Si3[J]. Journal of Industrial Microbiology & Biotechnology, 2008, 35(3):175-181.
[23] 李宝坤. 乳酸杆菌冷冻干燥生理损伤机制及保护策略的研究[D].无锡:江南大学, 2011.
[24] CORCORAN B M, ROSS R P, FITZGERALD G F, et al. Enhanced survival of GroESL-overproducing Lactobacillus paracasei NFBC338 under stressful conditions induced by drying[J]. Applied and Environmental Microbiology, 2006, 72(7): 5 104-5 107.
[25] GUERZONI M E, LANCIOTTI R, COCCONCELLI P S. Alteration in cellular fatty acid composition as a response to salt, acid, oxidative and thermal stresses in Lactobacillus helveticus[J]. Microbiology, 2001, 147(8): 2 255-2 264.
[26] 杨杨. 植物乳杆菌CAUH2氧化胁迫反应机制及转录因子CopR在氧化胁迫应答中的作用[D]. 北京: 中国农业大学, 2018.
[27] SERATA M, IINO T, YASUDA E, et al. Roles of thioredoxin and thioredoxin reductase in the resistance to oxidative stress in Lactobacillus casei[J]. Microbiology, 2012, 158(Pt 4):953-962.
[28] MAYHEW M, DA SILVA A C R, MARTIN J, et al. Protein folding in the central cavity of the GroEL-GroES chaperonin complex[J]. Nature, 1996, 379(6 564): 420-426.
[29] OLIVER J D. Recent findings on the viable but nonculturable state in pathogenic bacteria[J]. FEMS Microbiology Reviews, 2010, 4:415-425.
[30] HECKER M, REDER A, FUCHS S, et al. Physiological proteomics and stress/starvation responses in Bacillus subtilis and Staphylococcus aureus[J]. Research in Microbiology, 2009, 160: 245-258.
[31] ERCAN O, WELS M, SMID E J, et al. Genome-wide transcriptional responses to carbon starvation in nongrowing Lactococcus lactis[J]. Applied and Environmental Microbiology, 2015, 81: 2 554-2 561.
[32] 李吉楠, 孙鹏, 覃春富, 等. 乳酸菌对动物局部和系统免疫调节功能影响的研究进展[J]. 畜牧兽医学报, 2013, 44(11): 1 700-1 705.
[33] PERDIGON G, VINTINI E, ALVAREZ S, et al. Study of the possible mechanisms involved in the mucosal immune system activation by lactic acid bacteria[J]. Journal of Dairy Science, 1999, 82(6):1 108.
[34] DEL R B, DATTWYLER R J, AROSO M, et al. Oral immunization with recombinant Lactobacillus plantarum induces a protective immune response in mice with Lyme disease[J]. Clinical & Vaccine Immunology Cvi, 2008, 15(9):1 429-1 435.
[35] MARAGKOUDAKIS P A, MOUNTZOURIS K C, ROSU C, et al. Feed supplementation of Lactobacillus plantarum PCA 236 modulates gut microbiota and milk fatty acid composition in dairy goats-a preliminary study[J]. International Journal of Food Microbiology, 2010, 141(1): 109-116.
[36] DONG H, ROWLAND I, YAQOOB P. Comparative effects of six probiotic strains on immune function in vitro[J]. The British Journal of nutrition, 2012, 108(3): 459-470.
[37] LI C, NIE S P, ZHU K X, et al. Lactobacillus plantarum NCU116 improves liver function, oxidative stress and lipid metabolism in rats with high fat diet induced non-alcoholic fatty liver disease[J]. Food & Function, 2014, 5(12):3 216-3 223.
[38] LI X, WANG N, YIN B, et al. Effects of Lactobacillus plantarum CCFM0236 on hyperglycaemia and insulin resistance in high-fat and streptozotocin-induced type 2 diabetic mice[J]. Journal of Applied Microbiology. 2016, 121(6):1 727-1 736.
[39] HUANG H Y, KORIVI M, TSAI C H, et al. Supplementation of Lactobacillus plantarum K68 and fruit-vegetable ferment along with high fat-fructose diet attenuates metabolic syndrome in rats with insulin resistance[J]. Evidence-Based Complementray and Alternative Medicine, 2013(1):943 020.
[40] LI X, WANG N, YIN B, et al. Lactobacillus plantarum X1 with α-glucosidase inhibitory activity ameliorates type 2 diabetes in mice[J]. Rsc Advances, 2016, 6(68): 63 536-63 547.
[41] LIU Y, ZENG S, LEU Y, et al. Antihypertensive effect of a combination of uracil and glycerol derived from Lactobacillus plantarum strain TWK10-fermented soy milk[J]. Journal of Agricultural and Food Chemistry, 2015, 63(33): 7 333-7 342.
[42] NEJATI F, RIZZELLO C G, DI CAGNO R, et al. Manufacture of a functional fermented milk enriched of Angiotensin-Ⅰ converting enzyme (ACE)-inhibitory peptides and γ-amino butyric acid (GABA)[J]. LWT-Food Science and Technology, 2013, 51(1): 183-189.
[43] 朱广素, 王刚, 王园园, 等. 植物乳杆菌通过调节肠道短链脂肪酸缓解代谢综合征[J]. 食品科学, 2018.
[44] ZHAO L, JIANG Y, NI Y, et al. Protective effects of Lactobacillus plantarum C88 on chronic ethanol-induced liver injury in mice[J]. Journal of Functional Foods, 2017, 35: 97-104.
[45] SHUKLA P K, MEENA A S, MANDA B, et al. Lactobacillus plantarum prevents and mitigates alcohol-induced disruption of colonic epithelial tight junctions, endotoxemia, and liver damage by an EGF receptor-dependent mechanism[J]. FASEB Journal, 2018:fj.201800351R.
[46] KIM W G, KIM H I, KWON E K, et al. Lactobacillus plantarum LC27 and Bifidobacterium longum LC67 mitigate alcoholic steatosis in mice by inhibiting LPS-mediated NF-κB activation through restoration of the disturbed gut microbiota [J]. Food & Function, 2018, 8: 4 255-4 265.
[47] 迟菲菲, 田丰伟, 王刚, 等. 植物乳杆菌LP1001缓解小鼠酒精性肝损伤的研究[J]. 中国乳品工业, 2012, 40(9): 4-7.
[48] IACONO A, RASO G M, CANANI R B, et al. Probiotics as an emerging therapeutic strategy to treat NAFLD: focus on molecular and biochemical mechanisms[J]. Journal of Nutritional Biochemistry, 2011, 22(8):699-711.
[49] 曹少锋, 梅璐, 黄煌, 等. 降脂益生菌调节胆固醇代谢改善小鼠非酒精性脂肪肝[J]. 中国微生态学杂志, 2018, 30(8): 869-874.
[50] FAYOL-MESSAOUDI D, COCONNIER-POLTER M H, MOAL V L, et al. The Lactobacillus plantarum strain ACA-DC287 isolated from a Greek cheese demonstrates antagonistic activity in vitro and in vivo against Salmonella enterica serovar Typhimurium[J]. Journal of Applied Microbiology, 2007, 103(3): 657-665.
[51] CHIU H H, TSAI C C, HSIH H Y, et al. Screening from pickled vegetables the potential probiotic strains of lactic acid bacteria able to inhibit the Salmonella invasion in mice[J]. Journal of Applied Microbiology, 2008, 104(2): 605-612.
[52] YANG X, BRISBIN J, YU H, et al. Selected lactic acid-producing bacterial isolates with the capacity to reduce Salmonella translocation and virulence gene expression in chickens[J]. PLoS One, 2014, 9(4): e93 022.
[53] CHEN C Y, TSEN H Y, LIN C L, et al. Enhancement of the immune response against Salmonella infection of mice by heat-killed multispecies combinations of lactic acid bacteria[J]. Journal of Medical Microbiology, 2013, 62 (Pt 11): 1 657-1 664.
[54] ZOUMPOPOULOU G, FOLIGNE B, CHRISTODOULOU K, et al. Lactobacillus fermentum ACA-DC 179 displays probiotic potential in vitro and protects against trinitrobenzene sulfonic acid (TNBS)-induced colitis and Salmonella infection in murine models[J]. International Journal of Food Microbiology, 2008, 121(1): 18-26.
[55] ISHIKAWA H, KUTSUKAKE E, FUKUI T, et al. Oral administration of heat-killed Lactobacillus plantarum strain b240 protected mice against Salmonella enterica Serovar Typhimurium[J]. Bioscience, Biotechnology, and Biochemistry, 2010, 74(7): 1 338-1 342.
[56] LIU J, HU D, CHEN Y, et al. Strain-specific properties of Lactobacillus plantarum for prevention of Salmonella infection[J]. Food & Function, 2018, 9(7): 3 673-3 682.
[57] CAMPANA R, VAN S H, BAFFONE W. Strain-specific probiotic properties of lactic acid bacteria and their interference with human intestinal pathogens invasion[J]. Gut Pathogens, 2017, 9(1):12.
[58] EKMEKCIU I, FIEBIGER U, STINGL K, et al. Amelioration of intestinal and systemic sequelae of murine Campylobacter jejuni infection by probiotic VSL#3 treatment[J]. Gut Pathogens, 2017, 9(1):17.
[59] SMIALEK M, BURCHARDT S, KONCICKI A. The influence of probiotic supplementation in broiler chickens on population and carcass contamination with Campylobacter, spp. -field study[J]. Research in Veterinary Science, 2018, 118:312-316.
[60] WANG G, ZHAO Y, TIAN F, et al. Screening of adhesive lactobacilli with antagonistic activity against Campylobacter jejuni[J]. Food Control, 2014, 44(44):49-57.
[61] 王刚, 贺禹丰, 陈晓华, 等. 乳酸菌生物学特性与其拮抗空肠弯曲杆菌在小鼠肠道定植能力的分析[J]. 食品与发酵工业, 2017, 43(8): 73-80.
[62] 陈晓华, 田丰伟, 刘小鸣, 等. 防治幽门螺杆菌感染的益生菌研究进展[J]. 食品工业科技, 2011, 32(6): 483-487.
[63] 陈晓华, 肖苇苇, 田丰伟, 等. 具有拮抗幽门螺杆菌作用的植物乳杆菌特性研究[J]. 食品工业科技, 2012, 33(2):195-198.
[64] CHEN X, TIAN F, LIU X, et al. In vitro screening of lactobacilli with antagonistic activity against Helicobacter pylori from traditionally fermented foods[J]. Journal of Dairy Science, 2010, 93(12): 5 627-5 634.
[65] CHEN X, LIU X M, TIAN F, et al. Antagonistic activities of Lactobacilli against Helicobacter pylori growth and infection in human gastric epithelial cells[J]. Journal of Food Science, 2012, 77(1):9-14.
[66] 李川. 植物乳杆菌NCU116的益生功能及其作用机制[D]. 南昌: 南昌大学, 2015.
[67] 彭芝榕, 刘晓梅, 倪学勤, 等. 植物乳杆菌F1208对便秘大鼠胃肠道功能的影响[J]. 食品科学, 2013, 34(13): 243-246.
[68] 易若琨, 骞宇, 王强, 等. 植物乳杆菌YS-1对活性炭诱导小鼠便秘的预防作用[J]. 食品科学, 2017, 38(17): 238-243.
[69] 姚国强, 赵树平, 高鹏飞, 等. 乳酸菌微生态制剂防治犊牛腹泻应用研究[J].中国奶牛, 2014, 17: 55-58.
[70] NAGASHIMA K, YASOKAWA D, ABE K, et al. Effect of a Lactobacillus species on incidence of diarrhea in calves and change of the microflora associated with growth [J]. Bioscience and Microflora, 2010, 29(2): 97-110.
[71] NEMOTO M, KUDA T, EDA M, et al. Protective effects of Mekabu aqueous solution fermented by Lactobacillus plantarum Sanriku-SU7 on human enterocyte-like HT-29-luc cells and DSS-induced murine IBD model[J]. Probiotics and Antimicrobial Proteins, 2017, 9(1):48-55.
[72] 王俊通. 产共轭亚油酸乳酸菌对DSS诱导小鼠结肠炎的改善作用[D]. 无锡:江南大学, 2016.
[73] PAOLILLO R, ROMANO C C, SORRENTINO S, et al. Immunomodulatory effects of Lactobacillus plantarum on human colon cancer cells[J]. International Immunopharmacology, 2009, 9(11): 1 265.
[74] 王尔胤. 具有缓解结直肠癌功能的乳酸菌的筛选与机制研究[D]. 无锡: 江南大学, 2017.
[75] LIU W H, CHUANG H L, HUANG Y T, et al. Alteration of behavior and monoamine levels attributable to Lactobacillus plantarum PS128 in germ-free mice[J]. Behavioural Brain Research, 2016, 298(Pt B):202-209.
[76] LIU Y W, LIU W H, WU C C, et al. Psychotropic effects of Lactobacillus plantarum PS128 in early life-stressed and na?ve adult mice[J]. Brain Research, 2016, 1 631:1-12.
[77] DHALIWAL J, SINGH D P, SINGH S, et al. Lactobacillus plantarum MTCC 9510 supplementation protects from chronic unpredictable and sleep deprivation-induced behaviour, biochemical and selected gut microbial aberrations in mice[J]. Journal of Applied Microbiology, 2018, 125(1): 257-269.
[78] DAVIS D J, DOERR H M, GRZELAK A K, et al. Lactobacillus plantarum attenuates anxiety-related behavior and protects against stress-induced dysbiosis in adult zebrafish[J]. Scientific Reports, 2016, 6: 33 726.
[79] LIU T H, CHIOU J, TSAI T Y. Effects of Lactobacillus plantarum TWK10-fermented soymilk on deoxycorticosterone acetate-salt-induced hypertension and associated dementia in Rats[J]. Nutrients.,2016, 8(5). pii: E260.
[80] MALLIKARJUNA N, PRAVEEN K, YELLAMMA K. Role of Lactobacillus plantarum MTCC1325 in membrane-bound transport ATPases system in Alzheimer's disease-induced rat brain[J]. Bioimpacts, 2016, 6(4): 203-209.
[81] NIMGAMPALLE M, KUNA Y. Anti-alzheimer properties of probiotic, Lactobacillus plantarum MTCC 1325 in Alzheimer's disease induced Albino rats[J]. Journal of Clinical and Diagnostic Research, 2017, 11(8): KC01-KC05.
[82] TIAN F, ZHAI Q, ZHAO J, et al. Lactobacillus plantarum CCFM8661 alleviates lead toxicity in mice[J]. Biological Trace Element Research, 2012, 150(1-3):264-271.
[83] ZHAI Q, TIAN F, ZHAO J, et al. Oral administration of probiotics inhibits absorption of the heavy metal cadmium by protecting the intestinal barrier[J]. Applied and Environmental Microbiology, 2016, 82(14):4 429-4 440.
[84] ZHAI Q, TIAN F, WANG G, et al. The cadmium binding characteristics of a lactic acid bacterium in aqueous solutions and its application for removal of cadmium from fruit and vegetable juices[J]. RSC Advances, 2016, 6(8):5 990-5 998.
[85] ZHAI Q, XIAO Y, ZHAO J, et al. Identification of key proteins and pathways in cadmium tolerance of Lactobacillus plantarum strains by proteomic analysis[J]. Scientific Reports, 2017, 7(1):1 182.
[86] ZHAI Q, LI T, YU L, et al. Effects of subchronic oral toxic metal exposure on the intestinal microbiota of mice[J]. Science Bulletin, 2017,62(12):831-840.
[87] YU L, ZHAI Q, LIU X, et al. Lactobacillus plantarum CCFM639 alleviates aluminium toxicity[J]. Applied microbiology and Biotechnology, 2016,100(4): 1 891-1 900.
[88] YU L, ZHAI Q, TIAN F, et al. Potential of Lactobacillus plantarum CCFM639 in protecting against aluminum toxicity mediated by intestinal barrier function and oxidative stress[J]. Nutrients, 2016, 8(12):pii: E783.
[89] YU L, ZHAI Q, YIN R, et al. Lactobacillus plantarum CCFM639 Alleviate Trace Element Imbalance-Related Oxidative Stress in Liver and Kidney of Chronic Aluminum Exposure Mice[J]. Biological Trace Element Research, 2017, 176(2): 342-349.
[90] YU L, ZHAI Q, TIAN F, et al. Lactobacillus plantarum CCFM639 can prevent aluminium-induced neural injuries and abnormal behaviour in mice[J]. Journal of Functional Foods, 2017, 30:142-150.
[91] HEUDORF U, MERSCHSUNDERMANN V, ANGERER J. Phthalates: toxicology and exposure [J]. International Journal of Hygiene & Environmental Health, 2007, 210(5): 623.
[92] SRINIVASAN C. Diethyl hexyl phthalate-induced changes in insulin signaling molecules and the protective role of antioxidant vitamins in gastrocnemius muscle of adult male rat[J]. Toxicology & Applied Pharmacology, 2011, 257(2): 155-164.
[93] GE J, HAN B, HU H, et al. Epigallocatechin-3-O-gallate protects against hepatic damage and testicular toxicity in male mice exposed to Di-(2-ethylhexyl) phthalate[J]. Journal of Medicinal Food, 2015, 18(7): 753-761.
[94] ZOU W, LIU W, YANG B, et al. Quercetin protects against perfluorooctanoic acid-induced liver injury by attenuating oxidative stress and inflammatory response in mice[J]. International Immunopharmacology, 2015, 28(1):129-135.
[95] XING J, WANG F, XU Q, et al. Screening of potential probiotic lactic acid bacteria based on gastrointestinal properties and perfluorooctanoate toxicity[J]. Applied Microbiology & Biotechnology, 2016, 100(15):1-12.
[96] ZOGHI A, KHOSRAVI-DARANI K, SOHRABVANDI S, et al. Effect of probiotics on patulin removal from synbiotic apple juice[J]. Journal of the Science of Food and Agriculture, 2017, 97(8):2 601-2 609.
[97] MANE J, PEDROSA E, LOREN V, et al. A mixture of Lactobucillus plantarum CECT 7315 and CECT 7316 enhances systemic immunity in elderly subjects. A dose-response. double-blind. placebo-controlled randomized pilot trial[J]. Nutricion Hospitalaria, 2011, 26(1): 1 611-1 613.
[98] HARIMA-MIZUSAWA N, IINO T, ONODERA-MASUOKA N, et al. Beneficial effects of citrus juice fermented with Lactobacillus plantarum YIT 0132 on Japanese cedar pollinosis[J]. Bioscience of Microbiota, Food and Health, 2014, 33(4):147-155.
[99] HARIRI M, SALEHI R, FEIZI A, et al. A randomized, double-blind, placebo-controlled, clinical trial on probiotic soy milk and soy milk: effects on epigenetics and oxidative stress in patients with type II diabetes[J]. Genes & Nutrition, 2015, 10(6):52.
[100] ABBASI B, GHIASVAND R, MIRLOHI M. Kidney function improvement by soy milk containing Lactobacillus plantarum A7 in type 2 diabetic patients with nephropathy: a double-blinded randomized controlled trial[J]. Iranian Journal of Kidney Diseases, 2017, 11(1): 36-43.
[101] MALIK M, SUBOC T M, TYAGI S, et al. Lactobacillus plantarum 299v supplementation improves vascular endothelial function and reduces inflammatory biomarkers in men with stable coronary artery disease[J]. Circulation Research, 2018, 123(9):1 091-1 102.
[102] KIRPICH I A, SOLOVIEVA N V, LEIKHTER S N, et al. Probiotics restore bowel flora and improve liver enzymes in human alcohol-induced liver injury: a pilot study[J]. Alcohol, 2008, 42(8):675-682.
[103] HIGASHIKAWA F, NODA M, AWAYA T, et al. Improvement of constipation and liver function by plant-derived lactic acid bacteria: a double-blind, randomized trial[J]. Nutrition, 2010, 26(4):367-374.
[104] DUCROTTé P, SAWANT P, JAYANTHI V. Clinical trial: Lactobacillus plantarum 299v (DSM 9843) improves symptoms of irritable bowel syndrome[J]. World journal of gastroenterology, 2012, 18(30):4 012-4 018.
[105] STEVENSON C, BLAAUW R, FREDERICKS E, et al. Randomized clinical trial: effect of Lactobacillus plantarum 299 v on symptoms of irritable bowel syndrome[J]. Nutrition, 2014, 30(10):1 151-1 157.
[106] RUDZKI L, OSTROWSKA L, PAWLAK D, et al. Probiotic Lactobacillus plantarum 299v decreases kynurenine concentration and improves cognitive functions in patients with major depression: A double-blind, randomized, placebo controlled study[J]. Psychoneuroendocrinology, 2018, 100: 213-222.
[107] LEW L C, HOR Y Y, YUSOFF N A A, et al. Probiotic Lactobacillus plantarum P8 alleviated stress and anxiety while enhancing memory and cognition in stressed adults: A randomised, double-blind, placebo-controlled study[J]. Clinical nutrition, 2018, pii: S0261-5614(18):32 448-8.
[108] OL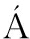 H A, BEL
H A, BEL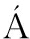 GYI T, ISSEKUTZ A, et al. Randomized clinical trial of specific lactobacillus and fibre supplement to early enteral nutrition in patients with acute pancreatitis[J]. British Journal of Surgery, 2002, 89(9):1 103-1 107.
GYI T, ISSEKUTZ A, et al. Randomized clinical trial of specific lactobacillus and fibre supplement to early enteral nutrition in patients with acute pancreatitis[J]. British Journal of Surgery, 2002, 89(9):1 103-1 107.
[109] LEE D E, HUH C S, RA J, et al. Clinical evidence of effects of Lactobacillus plantarum HY7714 on skin aging: A randomized, double blind, placebo-controlled study[J]. Journal of Microbiology and Biotechnology, 2015, 25(12):2 160-2 168.
[110] IWASAKI K, MAEDA K, HIDAKA K, et al. Daily intake of heat-killed Lactobacillus plantarum L-137 decreases the probing depth in patients undergoing supportive periodontal therapy[J]. Oral Health & Preventive Dentistry, 2016, 14(3): 207-214.
[111] BOSCH GALLEGO M, ESPADALER MAZO J, MÉNDEZ S NCHEZ M, et al. Consumption of the probiotic Lactobacillus planctarum CECT 7315/7316 improves general health in the elderly subjects[J]. Nutricion Hospitalaria, 2011, 26(3):642-645.
NCHEZ M, et al. Consumption of the probiotic Lactobacillus planctarum CECT 7315/7316 improves general health in the elderly subjects[J]. Nutricion Hospitalaria, 2011, 26(3):642-645.