萝卜硫素(1-异硫氰酸-4-甲磺酰基丁烷)又称“莱菔硫烷”,是存在于西兰花、白萝卜、芥蓝、甘蓝等十字花科蔬菜中的生物活性物质[1],因具有良好的抗氧化[2]、抗菌[3]、抗炎[4]、抗肿瘤[5]等生理活性,受到国内外学者及功能性食品行业的广泛关注。天然的萝卜硫素一般从西兰花或甘蓝的种子中提取,常温下为无色或淡黄色油状液体。在烹调过程中,蔬菜中的萝卜硫素会因降解受到损失,提取纯化的萝卜硫素在受热[6]或遇碱[7]时更容易降解,萝卜硫素的不稳定性使其在膳食补充剂和功能性食品中的应用受到限制。因此如何提升其稳定性及生物利用度成为研究的重点任务之一。研究表明,萝卜硫素可与羟丙基-β-环糊精形成包合物,包合作用使得萝卜硫素对热、氧化剂、碱等环境因子的抗性明显增强[8],包合后萝卜硫素的降解活化能可提高3.4~7.7 kJ/mol[9]。WANG等[10]研究了羧甲基壳聚糖-海藻酸微球材料包埋萝卜硫素,结果表明,游离态萝卜硫素210 min内(pH7.4)完全降解,而微球包埋使其在相同条件下的降解率减小到10%以下。TIAN等[11]研究发现羟丙基-β-环糊精、麦芽糊精和大豆分离蛋白分别作为壁材,通过喷雾干燥制备萝卜硫素微胶囊,均能有效提高其稳定性。郭春静等[12]研究了脂质体对姜黄素和萝卜硫素的共包埋技术。DANAFAR等[13]制备了荷载萝卜硫素的MPEG-PCL共聚物纳米颗粒,并考察了纳米颗粒向乳腺癌细胞递送萝卜硫素的性能。以上结果为萝卜硫素的包埋及稳定化提供了重要参考。
近年来,利用玉米醇溶蛋白构建生物活性物质负载体系的研究备受重视[14-15]。玉米醇溶蛋白不溶于水和低盐水溶液,但可溶于低级醇的水溶液,在70%乙醇水溶液具有较好的溶解性。利用这一特性,可将溶解了生物活性物质和玉米醇溶蛋白的乙醇水溶液中滴加到水相中均质,二者共沉淀形成纳米或亚微米颗粒[15-16]。LI等[17]通过反溶剂法制备了负载百里香酚的玉米醇溶蛋白纳米颗粒,通过缓释百里香酚能较好地抑制新鲜M-H肉汤中金黄色葡萄球菌的生长。DA ROSA等[18]研究指出构建的负载抗菌剂百里香酚和香芹酚的玉米醇溶蛋白纳米颗粒具有良好的贮藏稳定性,对抗菌剂的释放均匀持久(72 h内50%释放量)。利用玉米醇溶蛋白的荷载特性,本研究采用反溶剂法制备萝卜硫素-玉米醇溶蛋白纳米水分散体,制备时在水相中添加低浓度的阿拉伯胶为稳定剂,研究其对萝卜硫素的荷载及释放特性,以期为萝卜硫素负载体系构建提供新的途径。
1 材料与方法
1.1 材料与试剂
玉米醇溶蛋白(产品编号Z3625),阿拉伯胶(产品编号G9752),dl-萝卜硫素(产品编号S4441)购自上海Sigma试剂有限公司;dl-萝卜硫素(生化试剂级),购自百灵威科技有限公司;二氯甲烷、乙腈,色谱纯,购于上海迈瑞尔化学技术有限公司;其他试剂均为分析纯,国药集团化学试剂有限公司。
1.2 仪器与设备
HWS-26型数显恒温水浴锅,上海齐欣科学仪器有限公司;85-2A型数显恒温磁力搅拌器,江苏科析仪器有限公司;pHS-25CW型pH计,上海般特仪器制造有限公司;SHB-III型循环水式多用真空泵及RE-5298型旋转蒸发器,上海亚荣生化仪器厂;UV-2600型分光光度计,日本岛津公司;Agilent 1200型高效液相色谱仪,美国安捷伦公司;JEM-1400透射电子显微镜,日本电子株式会社。
1.3 实验方法
1.3.1 萝卜硫素-玉米醇溶蛋白纳米水分散体制备
采取反溶剂法制备萝卜硫素-玉米醇溶蛋白纳米水分散体[17]。首先配制有机相。配制体积分数80%的乙醇水溶液,将一定比例的萝卜硫素和玉米醇溶蛋白溶解,二者质量之比m(萝卜硫素)∶m(玉米醇溶蛋白)为0∶25、1∶25、2∶25、3∶25、4∶25及5∶25,玉米醇溶蛋白质量浓度固定为15 g/L。接着配制水相。称取1 000 mg阿拉伯胶,加热搅拌溶解,0.45 μm滤膜过滤后,定容为500 mL水溶液(去离子水稀释),阿拉伯胶含量为2.0 g/L。有机相与水相混合方式:1倍体积的有机相采用恒压滴液漏斗缓缓滴加到5倍体积水相中,滴加速度约0.1 mL/min,水相中放置电磁搅拌。得到的水分散体采取减压蒸馏去除乙醇,3 000 r/min低速离心10 min去除其中的大颗粒,得到萝卜硫素-玉米醇溶蛋白纳米水分散体。
1.3.2 纳米颗粒的基本性质
纳米颗粒形貌采用透射电子显微镜分析[18],稀释后的纳米水分散体滴加到微栅支持膜载网上,在空气中干燥,质量分数2%的醋酸铀染色30 s,多余的染剂采用滤纸吸走,之后在JEOL JEM-1400电镜上观测,加速电压100 kV。纳米颗粒的粒径及分布、ζ-电位采用Malvern Nano-ZS测定[17]。
1.3.3 萝卜硫素的包封率及载量计算
将一定体积纳米水分散体于高速冷冻离心机,于14 000 r/min离心55 min,得到上清液,用二氯甲烷萃取其中的萝卜硫素,高效液相色谱法测定其含量(m0);将得到的沉淀进行真空冷冻干燥,得到一定量(m1)的冻干粉,采用相同体积的二氯甲烷萃取其中的萝卜硫素,高效液相色谱法分析其含量(m2);纳米颗粒对萝卜硫素的包封率(EE)定义为:纳米颗粒中萝卜硫素的质量与样品中加入萝卜硫素的总质量(mt)之比:
![]()
(1)
对萝卜硫素的载量(LC)定义为:单位质量(g)纳米颗粒中萝卜硫素的质量(g):
![]()
(2)
1.3.4 萝卜硫素定量分析方法
首先,制作萝卜硫素的紫外扫描图谱。将萝卜硫素用二氯甲烷稀释成适当浓度,放置在石英比色皿中,在UV-2600(岛津公司)上获取210~400 nm的紫外扫描图谱,结果如图1-A所示。萝卜硫素在242 nm处有较强的紫外吸收峰。采用二氯甲烷将萝卜硫素稀释成不同质量浓度:0.01、0.02、0.04、0.06、0.08、0.1、0.2、0.4、0.6、0.8、1.0、1.2、1.4、1.6 mg/L,在Agilent 1200型高效液相色谱仪上进行定量分析,色谱柱Eclipse XDB C18(3.0 mm×150 mm,3.5 μm),流动相为30%乙腈+70%水(体积分数),流速1.0 mL/min,柱温35 ℃,检测波长242 nm。
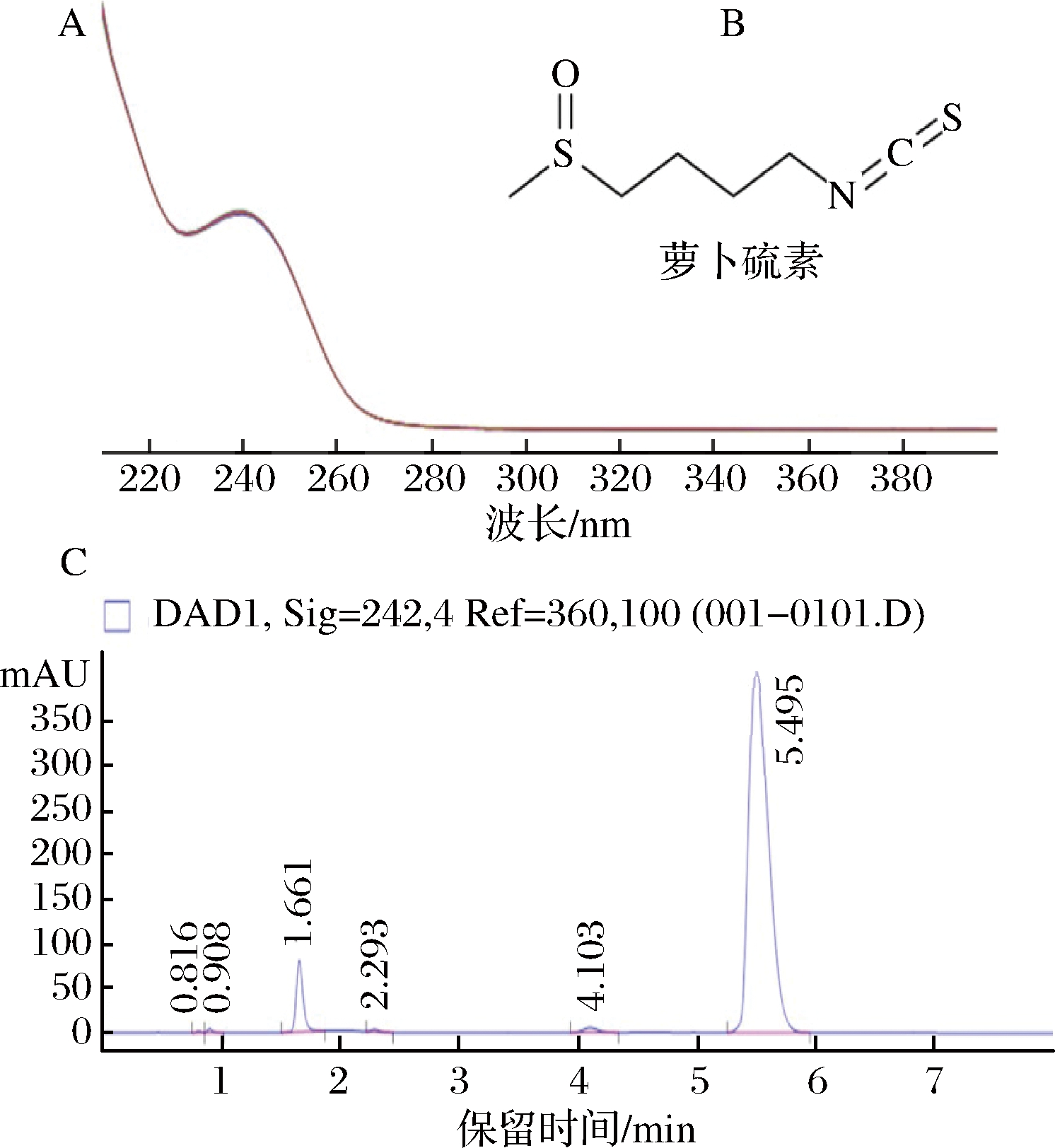
图1 萝卜硫素的紫外扫描图谱(A)、分子结构式(B)及高效液相色谱图(C)
Fig.1 The UV profile (A), structure formula (B) and HPLC chart(C) of sulforaphane
根据其标准品出峰(tR=5.5 min)的峰面积(图1-C)制作工作曲线(图2),得到拟合方程:y=2 617.7x+3.1(R2=0.995),线性范围0.02~1.0 mg/L。
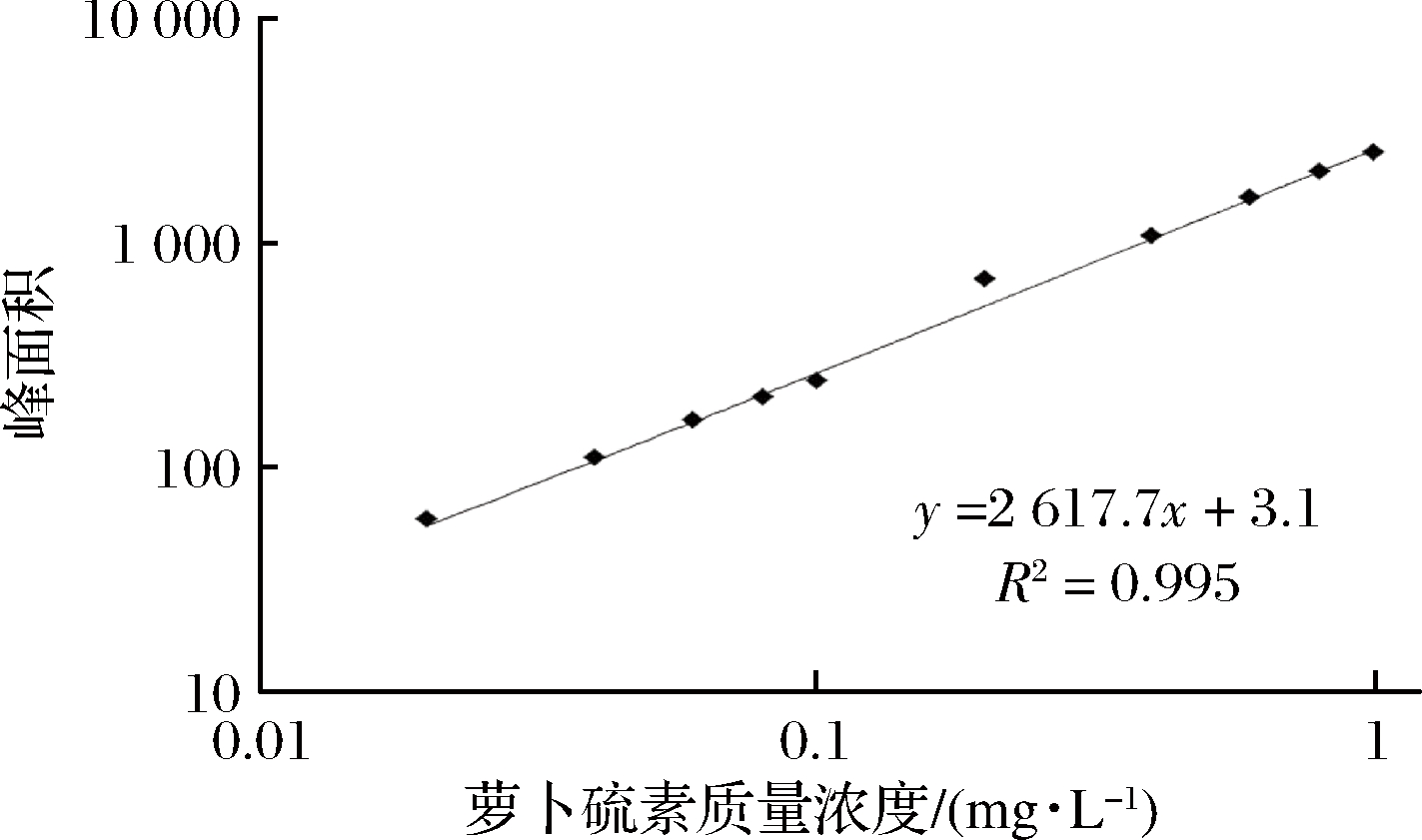
图2 萝卜硫素标准曲线
Fig.2 Calibration of sulforaphane standard
1.3.5 萝卜硫素-玉米醇溶蛋白纳米水分散体的稳定性
考察纳米水分散体在不同pH值和环境温度的平均粒径变化情况。考察pH时,采用1 mol/L的HCl或NaOH调节新制备的纳米水分散体的pH为2、3、4、5、6、7及8,室温静置存放过夜;考察环境温度时,新制备的纳米水分散体在不同水浴温度下(25、35、45、55、65、75及85 ℃)保温电磁搅拌30 min,然后室温静置存放过夜。测定处理前后纳米水分散体的粒径变化。
1.3.6 萝卜硫素从纳米水分散体的释放分析
依次在模拟胃液(0~120 min)和模拟小肠液(120~240 min)中考察萝卜硫素的释放情况。取在37 ℃保温30 min的2 mL新制备纳米水分散体与18 mL模拟胃液(含0.05 mol/L HCl和2.5 g/L胃蛋白酶)混合,37 ℃水浴保温,100 r/min搅拌,定时(0,60,90,120 min)取样,采用超滤离心管(MWCO 100 kDa)处理得到透过液,经二氯甲烷萃取后测定萝卜硫素含量。120 min后,向其中加入模拟小肠液(含2.5 g/L胰酶、30 g/L胆盐,用于0.1 mol/L磷酸钠缓冲液配制),37℃水浴保温,100 r/min搅拌,定时(0,60,90,120 min)取样,测定萝卜硫素含量。
1.3.7 数据处理与统计分析
除电镜分析外,所有试验重复测定3次,结果以平均值±标准偏差表示;采用SPSS 18.0对试验数据进行单因素方差分析,通过Duncan’s多重比较,显著性水平设置为P<0.05。
2 结果与分析
2.1 萝卜硫素-玉米醇溶蛋白纳米水分散体基本性质
由图3-A可知,玉米醇溶蛋白-阿拉伯胶颗粒平均粒径为184 nm,多分散性指数(PDI)0.134,在文献研究报道范围内[15]。负载萝卜硫素后,颗粒平均粒径相对减小(159.8~180.2 nm),当m(萝卜硫素)∶m(玉米醇溶蛋白)为4∶25时为平均粒径的最小值(P<0.05);PDI则在负载萝卜硫素后增大(0.152~0.198),且在m(萝卜硫素)∶m(玉米醇溶蛋白)为1∶25时出现最大值(p<0.05)。玉米醇溶蛋白颗粒在负载后的粒度一般会发生变化。研究显示,经pluronic F68稳定的玉米醇溶蛋白颗粒在负载百里香酚和香芹酚后平均粒径从153.9 nm分别减小到109.2 nm及111.2 nm[18];经茶多糖稳定的玉米醇溶蛋白颗粒在负载紫杉醇后平均粒径和多分散指数均减小,且减小程度与制备时紫杉醇的添加量正相关[19];而对于赖氨酸稳定的玉米醇溶蛋白颗粒在负载叶酸后,平均粒径从164 nm增加到193 nm,多分散指数从0.07增加到0.20。由图3-B可知,负载萝卜硫素对玉米醇溶蛋白颗粒纳米水分散体的ζ-电位影响不大,在-35 mV左右,表明纳米水分散体具有较好的稳定分散特性[20-21]。

图3 萝卜硫素与玉米醇溶蛋白质量比对纳米水分散体的粒径、粒径分布(A)及zeta电位(B)的影响
Fig.3 The effect of sulforaphane to zein weight ratio on the average particle size, PDI (A), and zeta potential (B) of sulforaphane-encapsulated zein aqueous nano-dispersions
注:不同字母上标(a~b) 表示不同样品P<0.05 水平的差异显著性。
由图4可知,玉米醇溶蛋白-阿拉伯胶颗粒及负载萝卜硫素的颗粒近球形,通过电镜自带软件计算其尺寸为纳米级。需要指出,通过透射电镜测得颗粒的直径显著小于通过马尔文Nano-ZS纳米粒度仪测定结果,原因在于二者测量方式存在差异。透射电镜测定干燥样品,颗粒干燥时发生脱水收缩,因此测定尺寸较小;Nano-ZS直接对水分散体进行测定,测得的是水相中颗粒的水力学直径,因此尺寸较大。图中显示部分颗粒之间存在粘连现象,这一方面可能与反溶剂法制备特点有关,有机相滴加到水相时经剪切形成细小液滴,有机相中的乙醇向水相扩散溶解导致液滴收缩“硬化”,未完全“硬化”前,一部分颗粒通过扩散或布朗运动粘连在一起,大部分颗粒通过静电作用向表面沉积阿拉伯胶使得稳定分散[16];另一方面可能与电镜制样过程有关[18]。课题前期研究发现,使用碳支持膜载网观测时,由于碳支持膜为疏水表面,玉米醇溶蛋白-阿拉伯胶颗粒成团聚集,经辉光放电处理碳支持膜,对负载于上样品分散性提升不明显,后改用微栅支持膜载网得到图4结果。
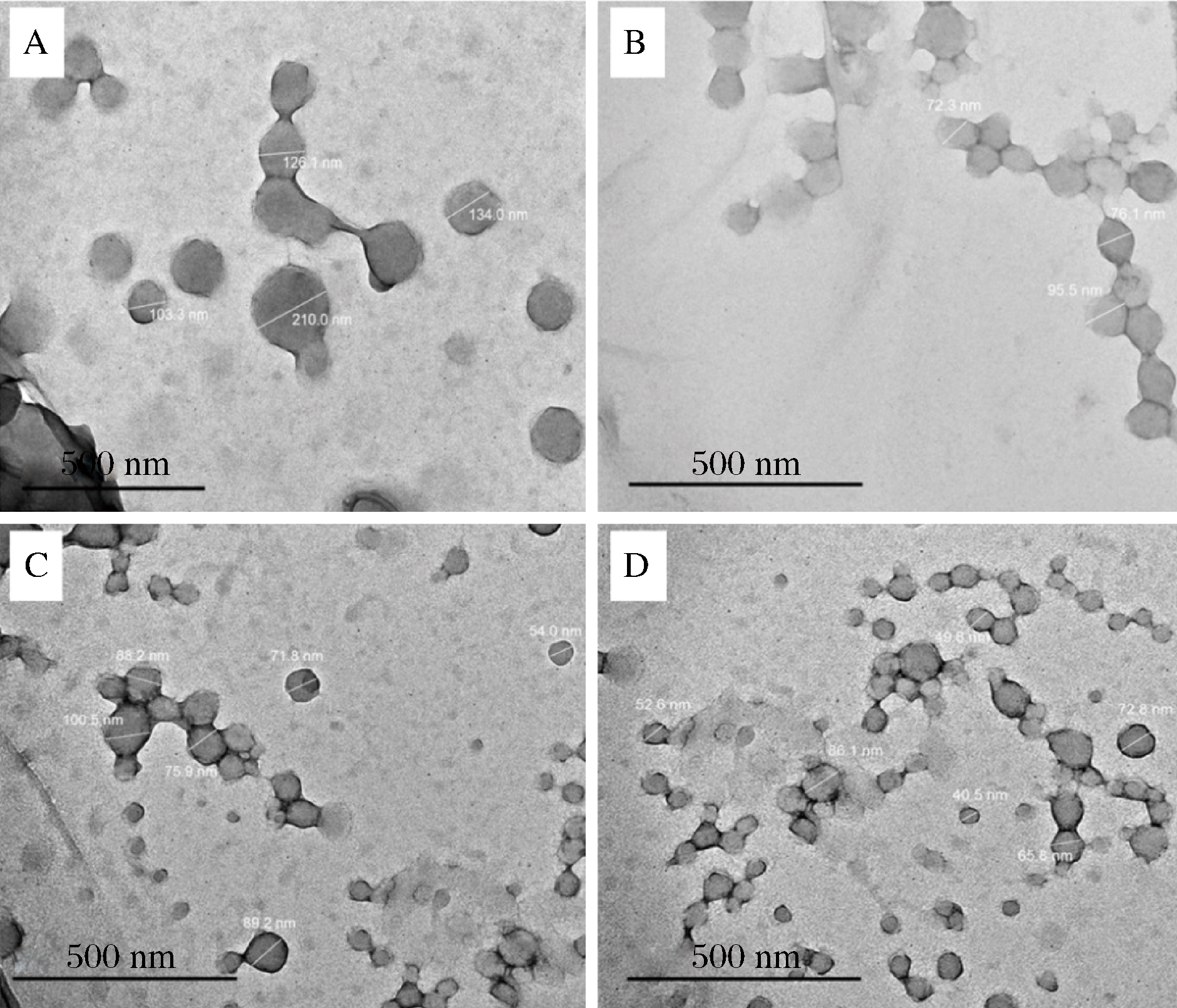
m(萝卜硫素)∶m(玉米醇溶蛋白)分别为:A-0∶25;B-1∶25;C-3∶25;D-5∶25
图4 萝卜硫素-玉米醇溶蛋白纳米水分散体的透射电镜照片
Fig.4 TEM images of sulforaphane-encapsulated zein aqueous nano-dispersions
2.2 玉米醇溶蛋白-阿拉伯胶纳米颗粒对萝卜硫素的包埋特性
由表1可知,当m(萝卜硫素)∶m(玉米醇溶蛋白)为1∶25时,其包封率为92.3%,载量43.4 mg/g;随着m(萝卜硫素)∶m(玉米醇溶蛋白)的增加,玉米醇溶蛋白对萝卜硫素包封率显著降低(P<0.05),当m(萝卜硫素)∶m(玉米醇溶蛋白)为4∶25时,其包封率与以麦芽糊精为壁材经喷雾干燥得到的微胶囊的包封率相当[22]。表1显示,载量随着m(萝卜硫素)∶m(玉米醇溶蛋白)的增加幅度不大,其大小约60.6~78.7 mg/g,与叶酸-玉米醇溶蛋白纳米颗粒体系的载量相当[23]。根据对文献的调研发现,荷载物质的性质是影响玉米醇溶蛋白对荷载物质载量的重要因素。研究显示,玉米醇溶蛋白对疏水性物质(如α-生育酚[24]、姜黄素[25])具有较高的载量,而对于弱极性物质的荷载能力有所下降。研究表明,经酪蛋白酸钠稳定的玉米醇溶蛋白纳米颗粒对阿霉素的包封率为90.06%时载量为15.01 mg/g[21]。
表1 不同m(萝卜硫素)∶m(玉米醇溶蛋白)质量比下的萝卜硫素包封率及载量
Table 1 Encapsulation efficiency and loading capacity at different sulforaphane to zein weight ratios

注:同一列不同字母上标(a~e)表示不同样品P<0.05水平的差异显著性。
2.3 环境条件对萝卜硫素-玉米醇溶蛋白纳米水分散体的影响
水相pH主要影响着玉米醇溶蛋白的电荷频率以及颗粒表面包被的阿拉伯胶带电基团的解离程度。玉米醇溶蛋白等电点为6.8左右[26],在酸性条件下带正电荷,通过静电相互作用与被膜的阿拉伯胶复合在一起。阿拉伯胶为阴离子型阿拉伯半乳聚糖-蛋白质复合物[27],其分子结构中的糖醛酸基pKa值为1.88[28]或2.2[29],在pH 2~8范围内主要带负电荷。由图5-A可知,随着pH升高,pH 2~4时颗粒平均粒径显著减小(P<0.05),表明颗粒逐渐“紧缩”了水力学尺寸,水合能力降低,这与玉米醇溶蛋白颗粒表面的电荷频率降低有关。pH 4~8时形成的纳米颗粒的平均粒径都较小且变化不显著(P>0.05)。本研究结果与关于阿拉伯胶-玉米醇溶蛋白复合纳米颗粒包埋薄荷油的研究一致,即低pH(3.0)时颗粒的平均粒径最大,之后平均粒径随pH的增加而减小[30]。
在食品的加工储藏过程中,温度的变化对产品的货架期有重要的影响,因此有必要研究温度对萝卜硫素-玉米醇溶蛋白纳米水分散体稳定性的影响。由图5-B可知,随着环境温度升高,25~55 ℃时,颗粒平均粒径变化不显著(P<0.05),萝卜硫素-玉米醇溶蛋白纳米水分散体相对稳定;55~85 ℃时,萝卜硫素-玉米醇溶蛋白纳米颗粒的平均粒径从200 nm左右增加到350 nm左右,表明较高温度条件下纳米颗粒发生了“溶胀”,原因可能是玉米醇溶蛋白与阿拉伯胶的结合力减弱,颗粒水合能力增加,导致颗粒水力学尺寸变大。CHEN等[30]的研究显示水相pH 5~8范围内的玉米醇溶蛋白-阿拉伯胶纳米颗粒经高温热处理(80 ℃,30 min)粒径(d4,3)未发生显著变化。这表明玉米醇溶蛋白-阿拉伯胶纳米颗粒的热稳定性相对较好。在对负载橘皮素的玉米醇溶蛋白-β-乳球蛋白复合纳米颗粒的热稳定性研究中,结果显示低温热处理(25~55 ℃)对颗粒粒度影响不显著,但高温热处理(60~90 ℃)导致粒度急剧增加,研究认为β-乳球蛋白热变性导致相互作用力的改变是主要原因[31]。
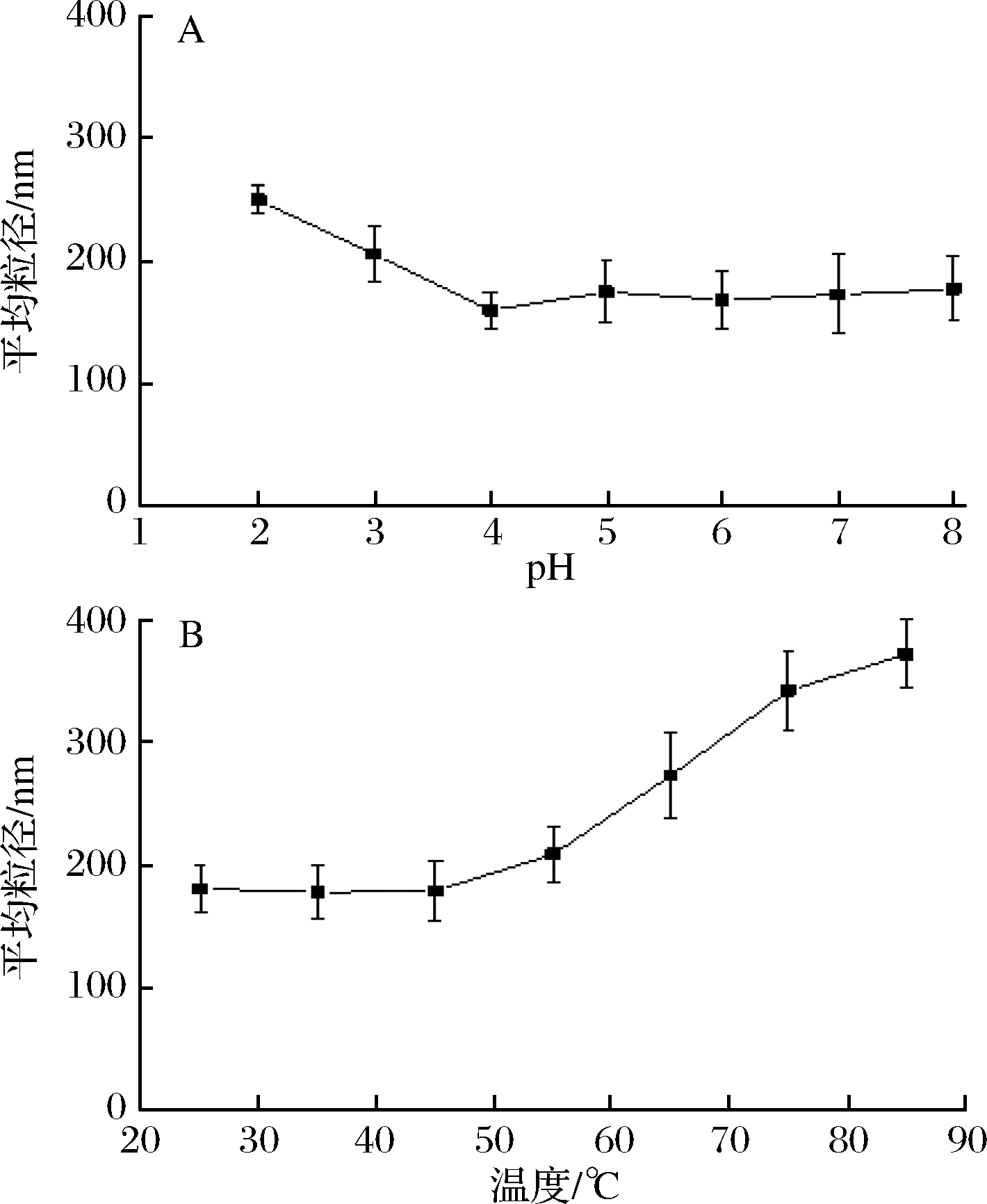
图5 水相pH值(A)及温度(B)对纳米水分散体平均粒径的影响
Fig.5 Effect of pH (A) and temperature (B) on the average size of sulforaphane-encapsulated zein aqueous nano-dispersions
2.4 模拟消化液中萝卜硫素的释放
由图6可知,在模拟胃液中,0~60 min内,m(萝卜硫素)∶m(玉米醇溶蛋白)为1∶25的纳米水分散体中萝卜硫素的累计释放率将近50%,快于m(萝卜硫素)∶m(玉米醇溶蛋白)为2∶25的纳米水分散体,后者约40%,这可能与前一组样品的多分散性(图2-A)有关;之后两者差距逐渐缩小,90 min后的累计释放率无显著差异。0~120 min内,两组样品的累计释放率将近80%,为快速释放型;120~240 min,在模拟小肠液中,纳米水分散体中萝卜硫素的累计释放率将近95%。采用MPEG -PCL共聚物纳米颗粒包埋萝卜硫素,其在pH 5.5的释放速率显著高于pH7.4,原因在于pH变化导致共聚物纳米颗粒结构变化,影响了萝卜硫素的结合能力,从而改变了释放速率[13]。采用聚乳酸-羟基乙酸共聚物微球包埋的萝卜硫素20 d的累计释放率约5%,具有良好的缓释性能[32]。活性成分从载体中的释放与活性成分与载体结合程度、活性成分在溶剂中的溶解性、载体的稳定性、温度等多种因素有关。在不添加消化酶的磷酸盐缓冲液(PBS)体系中,负载在由卵磷脂和pluronic F127稳定的玉米醇溶蛋白纳米颗粒中的叶黄素,在PBS中(pH 7.4,37℃)放置168 h的累计释放率为40%[33];牛至油在玉米醇溶蛋白纳米颗粒中的累计释放率(PBS,pH 7.4,37℃,48 h)为60%左右[34];在模拟消化液中,玉米醇溶蛋白纳米颗粒包埋的表没食子儿茶素没食子酸酯释放速度较快[35]。研究表明,玉米醇溶蛋白纳米颗粒对消化酶具有一定抗性[15],并且阿拉伯胶对消化酶不敏感[36],因此结合图5的数据来看,萝卜硫素的快速释放(图6)主要可能与萝卜硫素在玉米醇溶蛋白-阿拉伯胶纳米颗粒中的分布状态有关。萝卜硫素分子(图3-B)的亚硫酰基赋予其相当的极性(logP=0.23)[37],导致萝卜硫素不太可能聚集在颗粒内核而是分布在外层,由此造成萝卜硫素的快速释放。
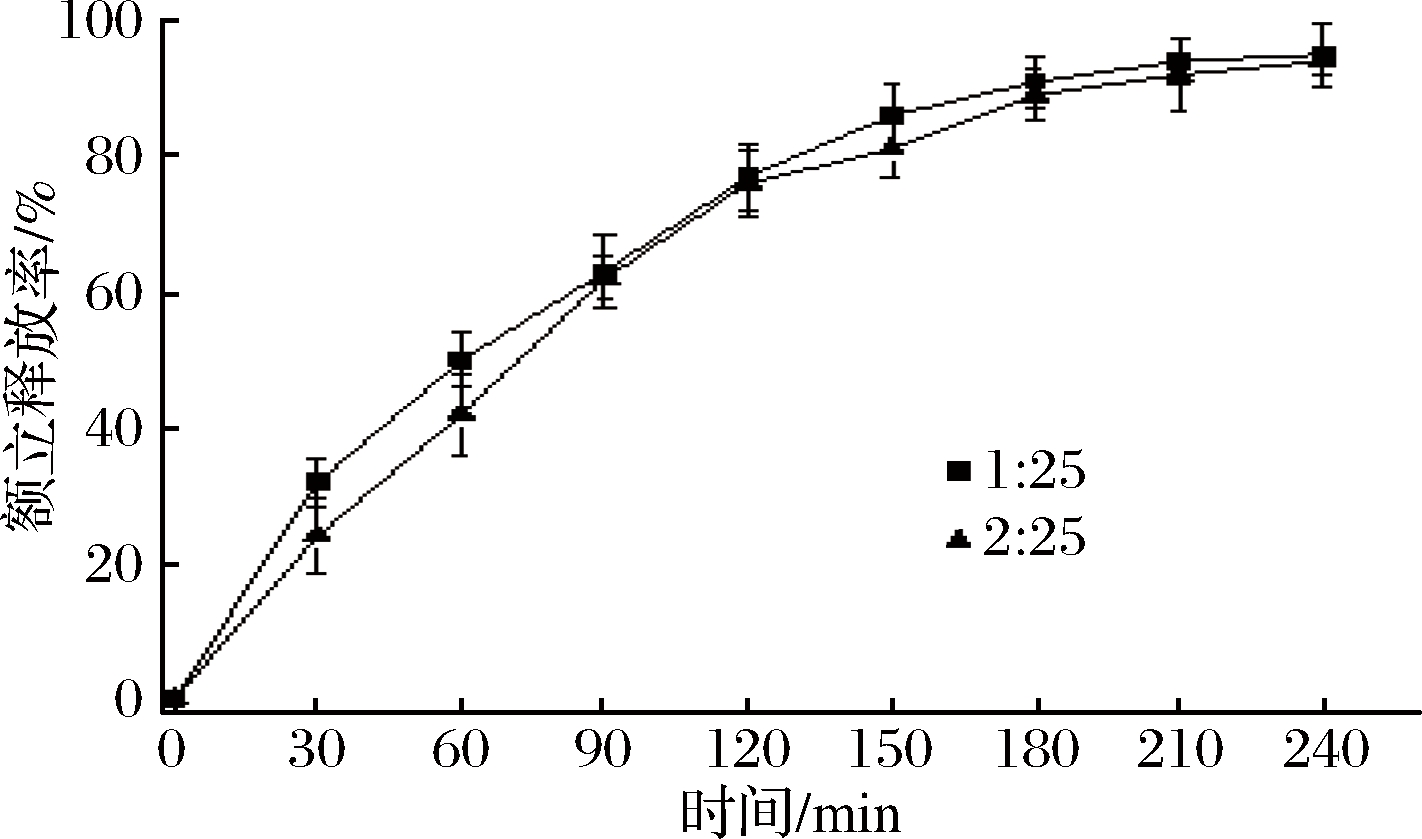
图6 模拟消化液中萝卜硫素的释放情况
Fig.6 The release of sulforaphane from aqueous nano-dispersion upon stimulated gastric/ intestinal fluid
注:0~120 min内在模拟胃液中,120~240 min内在模拟小肠液中
3 结论
本文采用反溶剂法制备萝卜硫素-玉米醇溶蛋白纳米水分散体。结果表明:包埋萝卜硫素的玉米醇溶蛋白-阿拉伯胶纳米颗粒近球形,粒径159.8~180.2 nm,多分散指数0.152~0.198,ζ-电位-32.1~-37.5 mV;当萝卜硫素与玉米醇溶蛋白的质量比为1∶25,包封率为92.3 %,载量43.4 mg/g;随着二者质量比的增加,包封率显著下降,载量增加幅度不大,约60.6~78.7 mg/g。随着pH升高,pH 2~4时颗粒平均粒径显著减小,pH 4~8时其变化不显著;随着环境温度升高,25~55 ℃时,颗粒平均粒径变化不显著,55~85 ℃,平均粒径从200 nm左右增加到350 nm左右。释放实验结果表明,玉米醇溶蛋白纳米颗粒中的萝卜硫素为快速释放型。
参考文献
[1] GLADE M J, Michael M M. A glance at… broccoli, glucoraphanin, and sulforaphane[J].Nutrition, 2015, 31(9):1 175-1 178.
[2] PRASAD A K, MISHRA P C. Mechanism of action of sulforaphane as a superoxide radical anion and hydrogen peroxide scavenger by double hydrogen transfer: a model for iron superoxide dismutase[J]. The Journal of Physical Chemistry, 2015, 119(25): 7 825-7 836.
[3] 吴华彰,费鸿君,赵云利,等. 萝卜硫素对大肠杆菌抑菌机制的研究[J]. 四川大学学报(医学版), 2012, 3(39): 385-390.
[4] ZHAO F, ZHANG J, CHANG N. Epigenetic modification of Nrf2 by sulforaphane increases the antioxidative and anti-inflammatory capacity in a cellular model of Alzheimer's disease[J]. European Journal of Pharmacology, 2018, 824:1-10.
[5] FIMOGNARI C, HRELIA P. Sulforaphane as a promising molecule for fighting cancer[J]. Mutation Research-Reviews in Mutation Research, 2007, 635(2-3): 90-104.
[6] JIN Y, WANG M, ROBERT T R, et al. Thermal degradation of sulforaphane in aqueous solution[J]. Journal of Agriculture and Food Chemistry, 1999, 47(8):3 121-3 123.
[7] 肖倩,梁浩,袁其朋. 温度、pH和光照对莱菔硫烷水溶液稳定性的影响[J]. 中国药学杂志, 2007, 42(3):193-196.
[8] WU H, LIANG H, YUAN Q. Preparation and stability investigation of the inclusion complex of sulforaphane with hydroxypropyl-β-cyclodextrin[J]. Carbohydrate Polymers, 2010, 82(3):613-617.
[9] WU Y, MAO J, MEI L, et al. Kinetic studies of the thermal degradation of sulforaphane and its hydroxypropyl-β-cyclodextrin inclusion complex[J]. Food Research International, 2013, 53(1):529-533.
[10] WANG H, LIANG H, YUAN Q, WANG Tian-xin. A novel pH-sensitive microsphere composed of CM-chitosan and alginate for sulforaphane delivery[J]. Materials Science Forum, 2011, 687:539-547.
[11] TIAN G, LI Y, YUAN Q, et al. The stability and degradation kinetics of sulforaphane in microcapsules based on several biopolymers via spray drying[J]. Carbohydrate Polymers, 2015, 122:5-10.
[12] 郭春静,李晓通,孙蕊,等. 姜黄素-萝卜硫素共包载脂质体制备工艺研究[J]. 食品工业, 2017, 38(11):141-144.
[13] DANAFAR H, SHARAFI A, MANJILI H K. Sulforaphane delivery using mPEG-PCL co-polymer nanoparticles to breast cancer cells[J]. Journal Pharmaceutical Development and Technology[J]. 2017, 22(5):642-651.
[14] 许辰琪,袁芳,高彦祥. 玉米醇溶蛋白作为传递载体研究进展[J]. 中国食品添加剂, 2015, 7:156-161.
[15] PATEL A R, VELIKOV K P. Zein as a source of functional colloidal nano- and micro-structures[J]. Current Opinion in Colloid & Interface Science, 2014, 19(5):450-458.
[16] ZHONG Q, JIN M. Zein nanoparticles produced by liquid-liquid dispersion[J]. Food Hydrocolloids, 2009, 23(8):2 380-2 387.
[17] LI K, YIN S, YIN Y, et al. Preparation of water-soluble antimicrobial zein nanoparticles by a modified antisolvent approach and their characterization[J]. Journal of Food Engineering, 2013, 119(2): 343-352.
[18] da ROSA C G, de OLIVEIRA BRISOLA MACIEL M V, de CARVALHO S M, et al. Characterization and evaluation of physicochemical and antimicrobial properties of zein nanoparticles loaded with phenolics monoterpenes[J]. Colloids and Surfaces A: Physicochemical and Engineering Aspects, 2015, 481:337-344.
[19] LI S, WANG X, LI W, et al. Preparation and characterization of a novel conformed biopolymer paclitaxel-nanoparticle using tea polysaccharides and zein[J]. Carbohydrate Polymers, 2016, 146: 52-57.
[20] HU K, MCCLEMENTS D J. Fabrication of biopolymer anoparticles by antisolvent precipitation and electrostatic deposition: Zein-alginate core/shell nanoparticles[J]. Food Hydrocolloids, 2015, 44:101-108.
[22] DONG F, DONG Xi, ZHOU L, et al. Doxorubicin-loaded biodegradable self-assembly zein nanoparticle and its anti-cancer effect: Preparation, in vitro evaluation, and cellular uptake[J]. Colloids and Surfaces B: Biointerfaces, 2016, 140:324-331.
[22] WU Y, ZOU L, MAO J, et al. Stability and encapsulation efficiency of sulforaphane microencapsulated by spray drying[J]. Carbohydrate Polymers, 2014, 102: 97-503.
[23] PENALVA R, ESPARZA I, GONZALEZ-NAVARRO C J, et al. Zein nanoparticles for oral folic acid delivery[J]. Journal of Drug Delivery Science and Technology, 2015, 30: 450-457.
[24] LUO Y, ZHANG B, WHENT M, et al. Preparation and characterization of zein/chitosan complex for encapsulation of α-tocopherol, and its in vitro controlled release study[J]. Colloids and Surfaces B: Biointerfaces, 2011, 85(2): 145-152.
[25] 傅玉颖,李可馨,王美,等. GA-zein复合纳米粒子运载姜黄色素体系的制备与特性[J]. 农业机械学报, 2017, 48(1): 267-274.
[26] PODARALLA S, PERUMAL O. Influence of formulations factors on the preparation of zein nanoparticles[J]. Aaps Pharmscitech, 2012, 13(3): 919-927.
[27] DROR Y, COHEN Y, YERUSHALMI-ROZEN R. Structure of gum arabic in aqueous solution[J]. Journal of Polymer Science Part B: Polymer Physics, 2006, 44(2):3 265-3 271.
[28] LIU S, ELMER C, LOW N H, et al. Effect of pH on the functional behaviour of pea protein isolate-gum Arabic complexes[J]. Food Research International, 2010, 43(2): 489-495.
[29] MOSCHAKIS T, MURRAY B S, BILIADERIS C G. Modifications in stability and structure of whey protein-coated o/w emulsions by interacting chitosan and gum arabic mixed dispersions[J]. Food Hydrocolloids, 2010, 24(1): 8-17.
[30] CHEN H, ZHONG Q. A novel method of preparing stable zein nanoparticle dispersions for encapsulation of peppermint oil[J]. Food Hydrocolloids, 2015, 43: 593-602.
[31] CHEN J, ZHENG J, MCCLEMENTS D J, et al. Tangeretin-loaded protein nanoparticles fabricated from zein/β-lactoglobulin: Preparation, characterization, and functional performance[J]. Food Chemistry, 2014, 158:466-472.
[32] KO J Y, CHOI Y J, JEONG G J, et al. Sulforaphane-PLGA microspheres for the intra-articular treatment of osteoarthritis[J]. Biomaterials, 2013, 34 (21):5 359-5 368.
[33] CHUACHAROEN T, SABLIOV C M. Stability and controlled release of lutein loaded in zein nanoparticles with and without lecithin and pluronic F127 surfactants[J]. Colloids and Surfaces A: Physicochemical and Engineering Aspects, 2016, 503:11-18.
[34] PARRIS N, COOKE P H, Hicks K B. Encapsulation of essential oils in zein nanospherical particles[J]. Journal of Agricultural and Food Chemistry, 2005, 53(12): 4 788-4 792.
[35] DONSì F, VOUDOURIS P, SANDRA J V, et al. Zein-based colloidal particles for encapsulation and delivery of epigallocatechin gallate[J]. Food Hydrocolloids, 2017, 63:508-517.
[36] ALI B H, ZIADA A, BLUNDEN G. Biological effects of gum arabic: A review of some recent research[J]. Food and Chemical Toxicology, 2009, 47(1):1-8.
[37] FRANKLIN S J, DICKINSON S E, KARLAGE K L, et al. Stability of sulforaphane for topical formulation[J]. Drug Development & Industrial Pharmacy, 2014, 40(4):494-502.