猪肉脯是一种食用方便,制作考究,美味可口,耐贮藏和便于运输的熟干肉制品,具有高蛋白、低脂肪、保藏性好等特点,常作为休闲食品为大众所喜爱[1-2]。在传统工艺条件下,风味主要靠美拉德反应形成,风味单一,满足不了消费者对多种风味的需求和目前休闲肉制品的发展需求[3-4],实现猪肉脯风味的系列化是保证其可持续发展的必然要求。与果蔬复配是改善肉脯风味的常用方法。KIM等[5]向猪肉脯中添加洋葱粉,赋予了猪肉脯浓郁的洋葱味。加工工艺的改进也可以改善风味。蔡金龙等[6]研究了酱卤工艺对肉脯风味的影响。另外,发酵也是改善肉脯风味的途径之一。王新惠等[7]研究发现,以清酒乳酸杆菌和木糖葡萄球菌为复合发酵剂发酵猪肉脯,风味优于对照组。ZHAO等[8]使用保加利亚乳杆菌生产发酵猪肉脯,肉脯的风味得到改善。发酵可以促进蛋白质和脂肪等物质的降解产生多种风味物质的前体物质,促使肉脯形成良好的风味,同时利用发酵过程适度产酸,使肉脯酸甜味适中,提高产品的保藏效果,是丰富猪肉脯风味的一种很好的方法[9-10]。
常用于肉制品发酵的菌株有乳酸菌、葡萄球菌、微球菌、酵母和霉菌。本实验中采用的发酵菌株为植物乳杆菌(Lactobacillus plantarum)和酿酒酵母菌(Saccharomyces cerevisiae)。植物乳杆菌广泛用于奶制品、羊肉、鹿肉等的发酵[11-13],不仅可以产生乳酸抑制病原菌和腐败菌的生长,同时生长代谢产生的酶类还能促进蛋白质等大分子物质的分解,促进产品形成特殊的风味[14]。酿酒酵母菌常用于鱼类、香肠等的发酵,具有一定产酯能力和蛋白酶活性[15-16]。将这2株菌引入到猪肉脯中,通过电子鼻和固相微萃取-气相色谱-质谱(solid-phase microextraction-gas chromatography-mass spectrometry,SPME-GC-MS)联用的手段研究单一菌种和复合菌种发酵对猪肉脯加工过程产香规律和产品风味特点的影响,以期为工业化生产具有天然生物发酵香气特征的新型猪肉脯提供理论支持和技术指导。
1 材料与方法
1.1 材料与试剂
新鲜猪后腿肉、鸡精、鱼露等购于当地超市;红曲红、乙基麦芽酚为市售食品级,其他试剂均为分析纯;MRS肉汤培养基、麦芽汁培养基,广东环凯微生物科技有限公司;植物乳杆菌,上海鲁微科技有限公司;酿酒酵母,广东省微生物菌种保藏中心。
1.2 仪器与设备
SW-CJ-2D型双单立式送风超净平台,苏州净化设备有限公司;LDZX-50FBS立式压力蒸汽灭菌器,上海申安医疗器械厂;SPX型智能生化培养箱,南京金恒实验仪器厂;紫外-可见光分光光度计(UV-2600),上海天美科学仪器有限公司;KBF240型恒温恒湿生化培养箱,德国Binder公司; FE20K型pH计,瑞士梅特勒-托利多;TSQ Quantum XLS三重四级杆气质联用仪,美国赛默飞世尔科技公司;超快速气相色谱电子鼻,Heracles Ⅱ Alpha MOS公司。
1.3 实验方法
1.3.1 发酵菌液的制备
首先将菌种活化,作为种子液。然后按5%接种量接种到100 mL培养基中,并在37 ℃静置培养到对数生长期。将增殖培养液离心(4 000 r/min,10 min),倒掉上清液,菌体沉淀用10 mL质量浓度为8.5 g/L无菌生理盐水悬浮,即得到需要的液体发酵剂。制备的发酵剂,经过活菌计数后用于生产。
1.3.2 发酵猪肉脯加工工艺流程及操作要点
原料选择→预处理→冷冻→切片→发酵→腌制→摊筛→烘干→涂油→烤制→压平→切割。
操作要点如下:
原料选择、预处理:选择新鲜的猪后腿肉去除可见的脂肪和结缔组织。
冷冻、切片:冷冻主要是便于切片,并且顺着肌肉纤维方向将肉切成2 mm厚的薄片,然后自然解冻。
发酵:按108 CFU/g的接种量将制备好的液体发酵剂稀释到所需倍数,然后将稀释后的液体发酵剂添加到洗净的猪肉中,添加1% 葡萄糖作为菌种碳源,湿度恒定为80%,28 ℃发酵24 h。
腌制肉∶m(肉)∶m(蔗糖)∶m(混合料)=100∶26.67∶2.4,混合料中各组分之间配比为m(白胡椒粉)∶m(复合磷酸盐)∶m(鸡精)∶m(味精)∶m(乙基麦芽酚)∶m(红曲米)=15∶25∶25∶33∶4.3∶1。腌制时间为30 min。
摊筛:肉片摊在筛网上,相互之间尽量不留空隙。
烘制:65 ℃烘制5 h;期间每隔30 min翻料1次。
烤制:温度为220 ℃,时间为1 min。
对照组按传统工艺制作,选猪后腿精肉,冷冻,切片,腌制,摊筛,烘干,烤制,冷却。操作要点同上。
1.3.3 不同发酵剂组合
本实验设计4组,分别添加不同组合的发酵剂进行发酵猪肉脯的制作,具体见表1。
表1 不同发酵剂组合
Table 1 Experimental design

1.3.4 采用超快速气相色谱电子鼻Heracles Ⅱ分析不同发酵剂对猪肉脯挥发性风味物质的影响
准确称取绞碎的猪肉脯样品2 g,置于20 mL顶空瓶中。载气(H2) 流量160 mL/min;顶空时间600 s,顶空温度60 ℃;进样量500 μL,进样速度500 μL/s,进样口温度200 ℃;捕集肼温度45 ℃,解析温度250 ℃;柱温50 ℃,1 ℃/s升至80 ℃,2 ℃/s升至250 ℃,保持60 s;氢火焰离子化检测器温度260 ℃;采集时间100 s[17]。
1.3.5 采用SPME-GC-MS分析不同发酵剂对猪肉脯挥发性风味物质的影响
取2.00 g剪碎的猪肉脯样品颗粒置于20 mL顶空瓶中,插入已经老化的50 μm Car/PDMS萃取头,50 ℃顶空萃取 30 min,然后将吸附后的萃取头取出并立即插入气相色谱进样口,于250 ℃下解吸3 min,同时启动仪器采集数据,进行GC-MS分析。
色谱条件[18]:DB-5MS毛细管色谱柱(30 m×2.25 mm,0.25 μm),载气He,1 mL/min,采用不分流进样模式。程序升温为40 ℃保持3 min,5 ℃/min升温至90 ℃,10 ℃/min升温至230 ℃并保持7 min。
质谱条件:电离方式:EI,放射电流80 μA,电子能量70 eV,接口温度为250 ℃,离子源温度200 ℃。全扫描采集数据,扫描范围为质荷比30~500 amu。
定性:结果利用GC-MS数据分析软件处理,化合物经计算机检索,并与NSIT和RTLPEST谱库相匹配,仅报道匹配度大于800的结果。
定量:风味标准溶液的配制:取50.00 μL壬烷用95%乙醇稀释至100 mL,再从定容后的溶液中吸取1 mL用95%乙醇定容至100 mL[19],得到3.6 mg/kg的工作液。分别取0、20、40、80和200 μL置于装有2.00 g不经发酵工艺加工的猪肉脯的20 mL的气质瓶中,加盖密封,采用上述的GC-MS参数进行测定。以挥发性化合物的峰面积为横坐标(x)、以挥发性化合物的含量(μg)为纵坐标(y)绘制标准曲线,标准曲线方程为:
y=4E-10x-0.09
(1)
相关系数R2=0.996 2。
猪肉脯样品中各种挥发性风味物质的定量:采用峰面积归一化法,根据壬烷标准曲线的公式,将所有挥发性风味物质的峰面积带入到公式(1)中计算出风味物质的含量(μg),进而计算求得挥发性风味物质的质量分数(μg/kg)。
1.3.6 相对气味活度值(relative odor activity value, ROAV)
采用ROAV法评价挥发性风味成分对猪肉脯样品风味贡献的大小[20]。各化合物的ROAV按公式2计算:
![]()
(2)
式中:ROAVi为某挥发性风味物质的相对气味活度值;Ci为某挥发性风味物质的相对含量;Tstan为气味贡献最大挥发性风味物质的阈值;Cstan为气味贡献最大挥发性风味物质的相对含量;Ti为某挥发性成分的嗅觉阈值。
1.3.7 感官评定
取4组猪肉脯各2 g,切碎,置于样品瓶中,进行气味感官分析。成立一个由10名食品专业人员组成的感官小组(5名男性和5名女性),事先对其进行专门感官培训和考核。按表2的评定标准进行打分。
表2 猪肉脯气味感官评价标准表
Table 2 Criteria of smell sensory evaluation of pork jerky
1.4 数据处理
采用origin 8.5和SPSS对数据进行计算和主成分分析(PCA),为保证数据的可信性,每个数据重复3次取平均值。
2 结果与分析
2.1 超快速气相色谱电子鼻Heracles Ⅱ分析不同发酵剂对猪肉脯挥发性风味物质的影响
图1为Heracles Ⅱ的PCA分析图。4组样品之间的区分指数为86,说明组分的风味存在显著差异。PC1的风味贡献率为80.5%,PC2的风味贡献率为16.24%,总体贡献率达到96.74%,且各组猪肉脯样品响应值没有重叠区域,区分度较好,说明该PCA分析方法能够准确描述样品之间的差异。在图1中可以看出,S3组和S4组相距较近,说明二者在风味上较为接近,而S1组与其他3组之间存在明显差异,说明发酵对风味产生了明显的影响。
2.2 SPME-GC-MS分析不同发酵剂对猪肉脯挥发性风味物质的影响
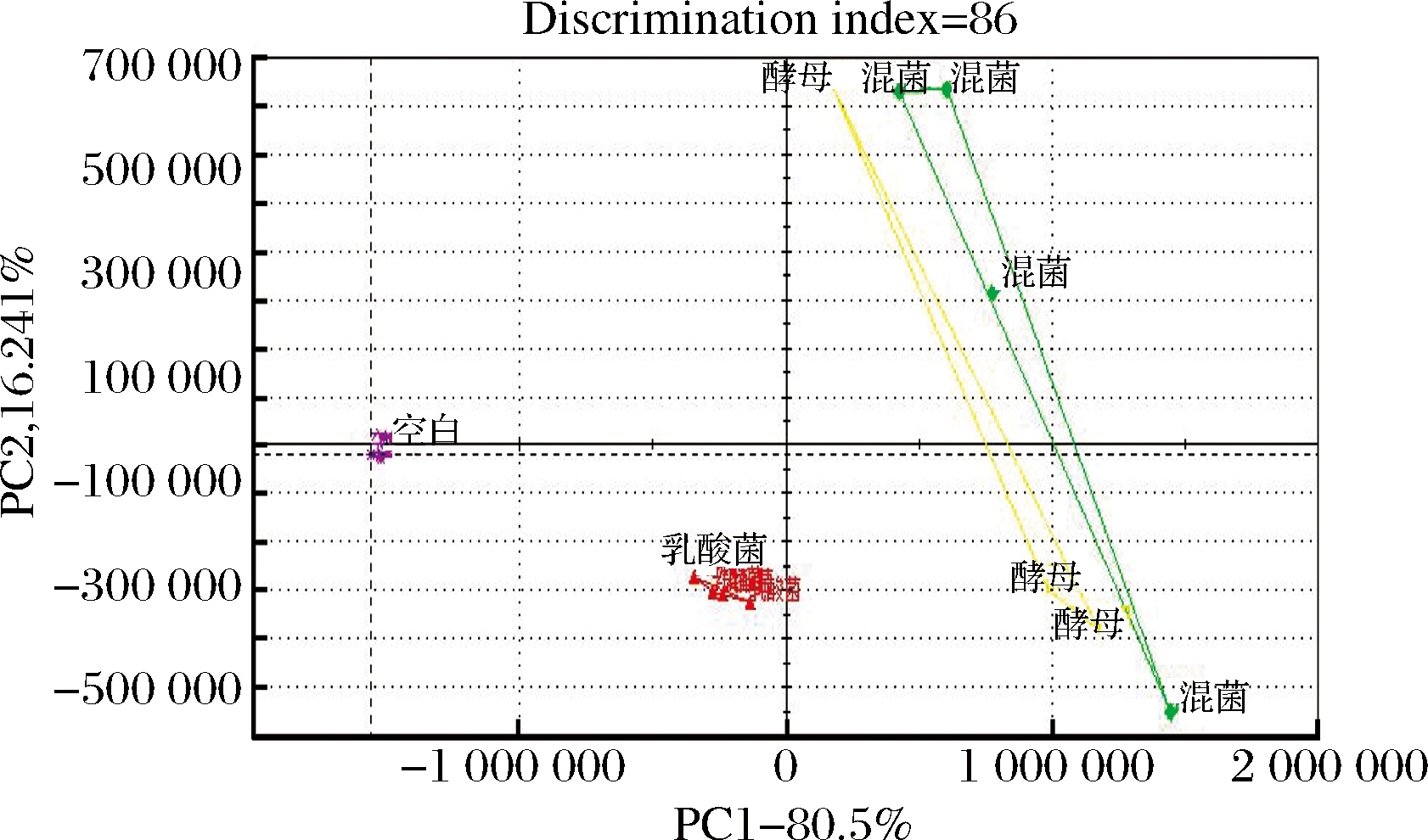
图1 四组猪肉脯样品的Heracles Ⅱ PCA图
Fig.1 The Heracles Ⅱ PCA of four groups of pork jerky samples
利用GC-MS从S1、S2、S3、S4四组猪肉脯样品中分别检测出45、59、56和65种挥发性化合物,主要有由烷烃类、醇类、醛类、酯类、酸类、杂环芳香类等组成。通过预实验发现,用鲜猪肉不经发酵工艺加工的肉脯的挥发性风味成分中没有壬烷,因此采用壬烷作为内标,得到壬烷标准曲线的公式,计算求得猪肉脯中挥发性风味物质的浓度[21]。表3列出了4组样品中各类挥发性成分在肉脯中的质量浓度。
表3 四组猪肉脯样品中挥发性风味化合物分析
Table3 Analysis of volatile flavor compounds in four groups of pork jerky samples
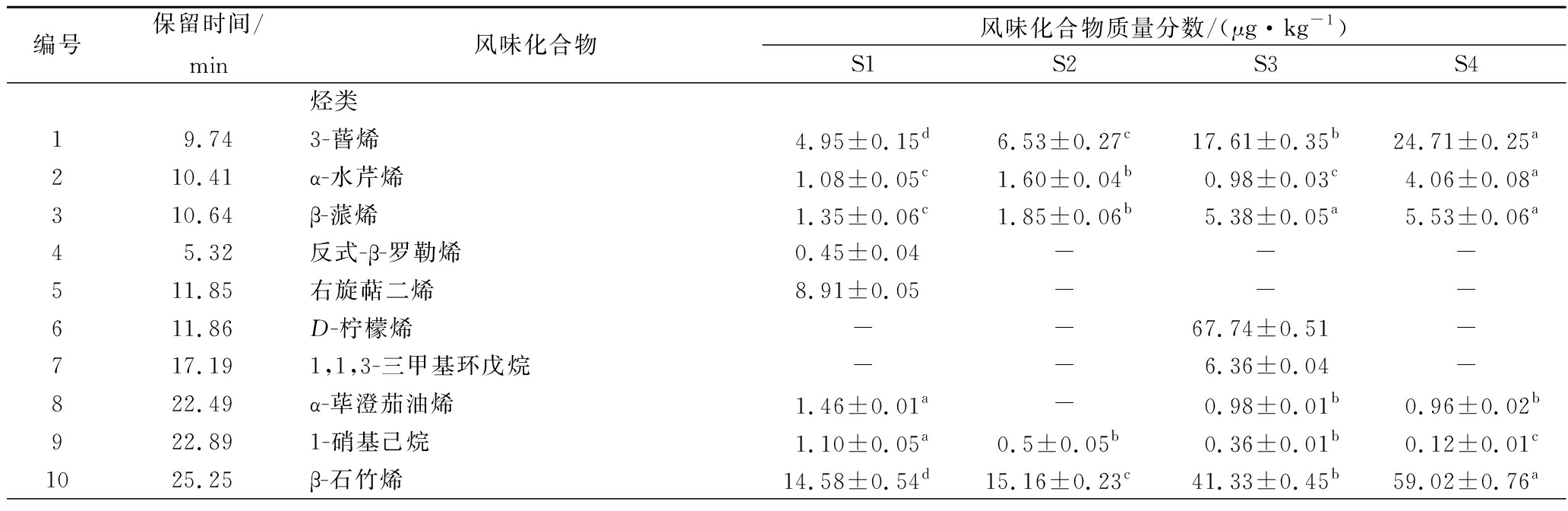
续表3
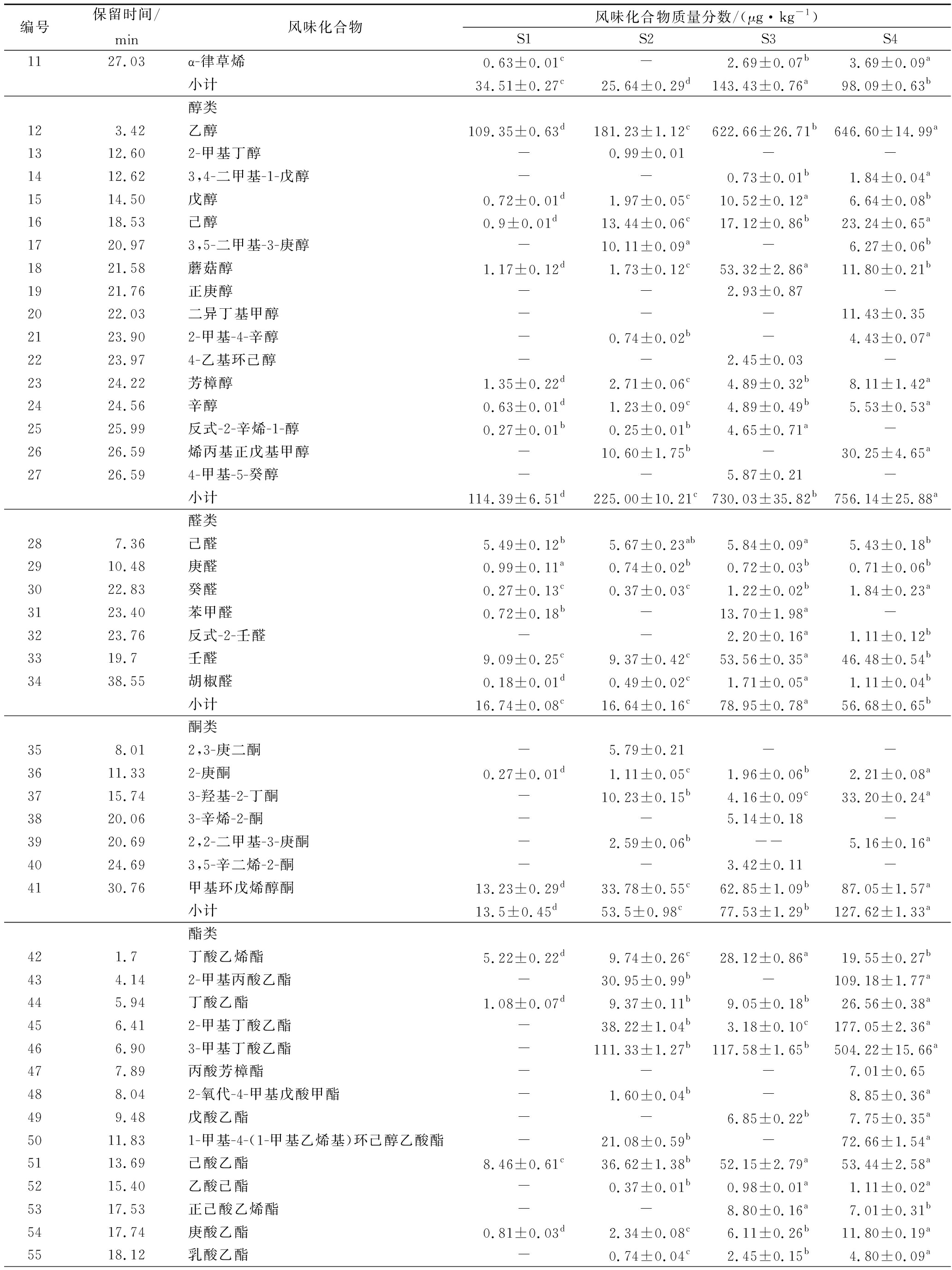
续表3
注:- 为未检出该物质;不同小写字母表示不同猪肉脯样品的差异显著性(p<0.05)。
2.2.1 不同发酵剂对猪肉脯挥发性风味物质的影响
图2是各样品之间风味化合物按类别分析的柱状图,从图中可以更直观的看出各风味物质在各大类之间的差别。就挥发性风味物质的总浓度而言,S1组最低,S4组最高。
从S1、S2、S3、S4四组猪肉脯样品中分别检测9、5、9和7种烷烃类化合物,不同样品中烃类化合物的含量差异显著。其中柠檬烯具有令人愉快的新鲜甜味[22],仅在S3组中检出,由此推断是在S.cerevisiae的发酵过程中产生的。这是由于S.cerevisiae依托甲羟戊酸途径,在胞内形成了少数单萜[23]。
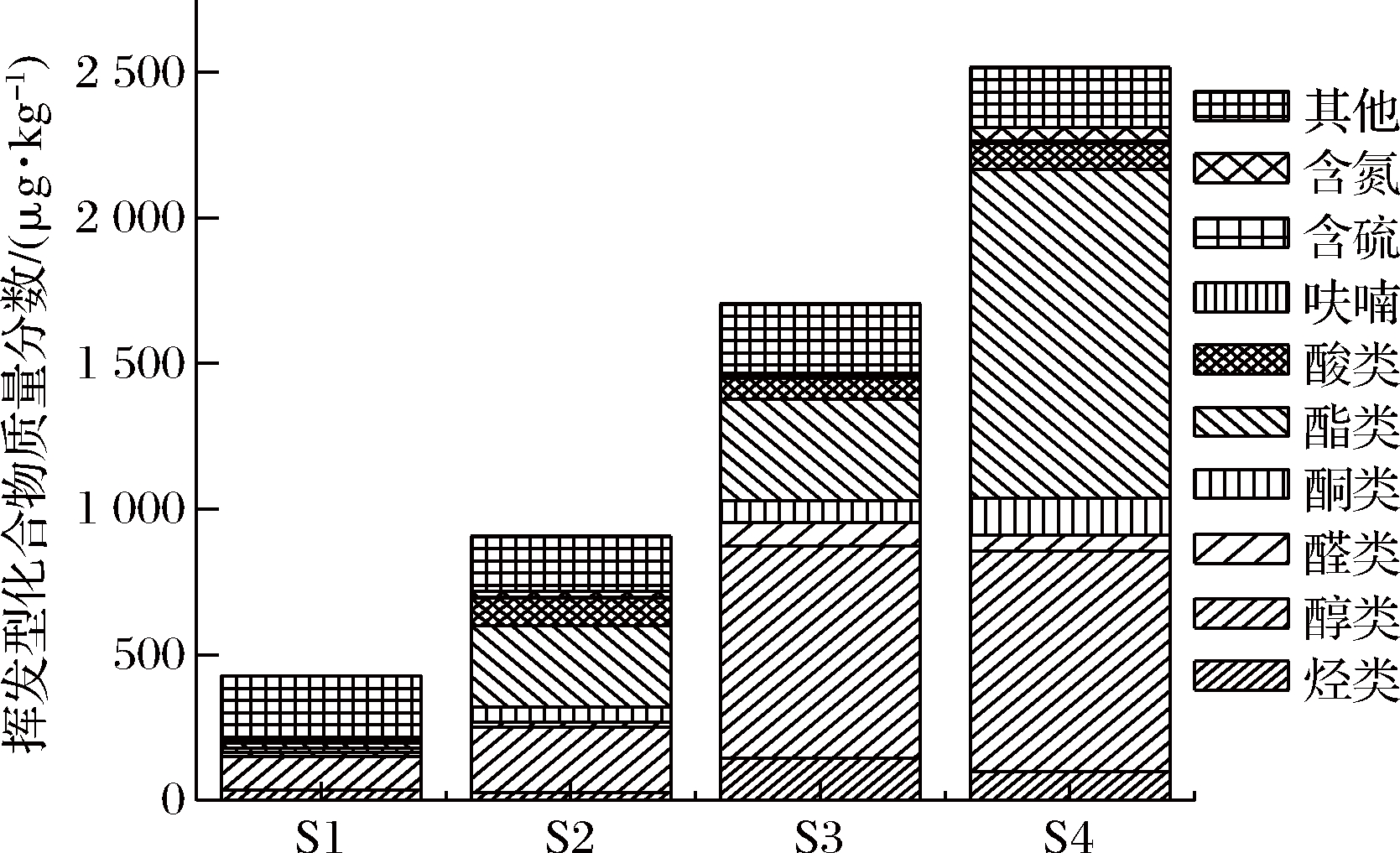
图2 不同猪肉脯样品中挥发性化合物类别统计
Fig.2 Statistics of volatile flavor compounds in different pork jerky samples
从图2可以看出,就挥发性风味物质中醇的总浓度而言,S4组的浓度最高。4组猪肉脯中的醛类化合物总体含量在发酵后显著增多,S4组含量最高。其中S3组与S4组的乙醇含量较高,这与S.cerevisiae经过内酶的作用,把单糖分解为CO2和酒精有关。
4组猪肉脯样品中的酮类化合物种类发酵之后增多,总体含量在发酵后也显著提高。酮类对肉产生花香及果香风味有贡献,并随着碳链的增加产生更强的花香特征[24]。
4组猪肉脯样品中的酯类化合物种类发酵之后明显增多,总体含量在发酵后也显著提高(P<0.05)。酯类物质一般是由发酵或者脂质代谢生成的羧酸和醇酯化后的产物[25],是一种良好的风味物质,少量的酯类物质即可产生明显的香气。2-甲基丁酸乙酯、3-甲基丁酸乙酯、乙酸己酯、丙位己内酯、乳酸乙酯仅存在于3个发酵样品中,说明是通过发酵产生。乙酸乙酯只存在于L.plantarum发酵的样品中,具有明显的酒香和果香,可见是由L.plantarum活动产生。S4组酯类含量最高,达到1 130.29 μg/kg,这些酯类物质可能是由酵母发酵产生的醇类物质与乳酸菌发酵产生的酸类物质通过酶的催化形成的。
4组猪肉脯样品中的酸类化合物种类发酵之后没有变化,总体含量在发酵后显著提高,这归因于2种菌的有机酸代谢。而S2组中酸类化合物含量最高,可见L.plantarum产酸能力更强,这与L.plantarum将食品原料中的糖转变为乳酸有关。
综上所述,经过发酵,猪肉脯的挥发性风味物质浓度显著提升,其中S4组样品挥发性风味物质浓度最高,各类挥发性物质浓度相较于S1组都有提升,特别是酯类物质浓度显著提高,还产生了新的酯类化合物,例如戊酸乙酯等。S3组的挥发性风味物质浓度高于S2组,这可能是由于S.cerevisiae更出色的产香产酯能力。将L.plantarum和S.cerevisiae共同作为发酵起始菌种,可以丰富发酵产物的风味复杂性,增强肉脯风格的独特性。
2.2.2 发酵对关键风味化合物的影响
挥发性风味物质的风味贡献由其在风味体系中的浓度和风味阈值共同决定,仅仅通过风味物质的含量不能准确描述猪肉脯的风味特征[26]。因此,采用相对气味活度值结合风味物质的浓度和风味阈值综合分析各风味物质的风味贡献[27]。
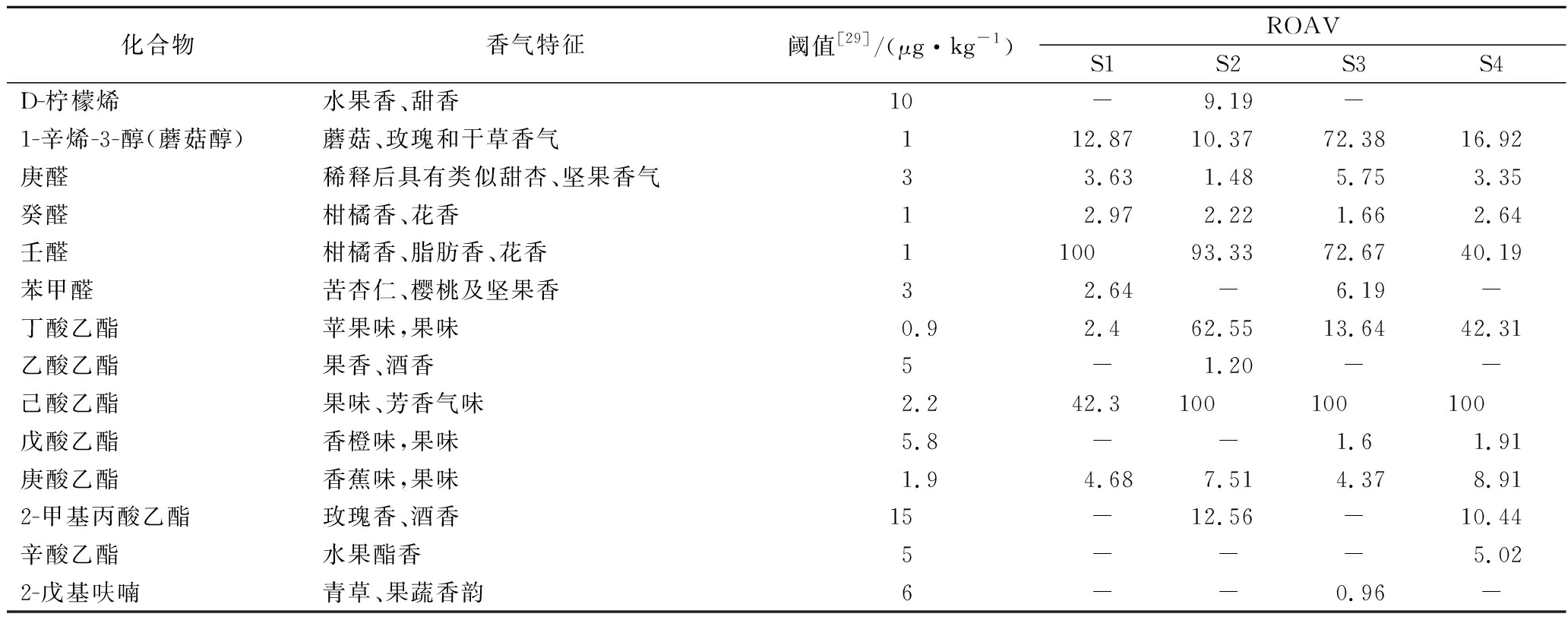
壬醛在S1组中相对含量较高,为2.02%,且风味阈值较低,为1 μg/kg,对S1组风味贡献最大,故定义其ROAV为100。己酸乙酯在S2组、S3组和S4组中的相对含量较高,分别为5.94%、13.26%和8.32%,且其风味阈值相对较低,为2.2 μg/kg,综合分析其对发酵猪肉脯的风味贡献较大,因此将其ROAV定义为100。表3中列出了4组样品重要的挥发性风味物质的ROAV值,由于烷烃类、醇类及酸类等阈值较高,对于风味贡献较小,未列出,只列出ROAV值大于0.1的挥发性化合物。一般认为,当风味物质的ROAV≥1时,对风味体系的风味特征起主要作用,ROAV值越大风味贡献就越大,0.1≤ROAV≤1的风味物质对风味体系的风味特征起重要作用[28]。
表4 猪肉脯样品挥发性成分的香气特征、阈值和相对气味活度值
Table 4 Aroma characteristics, threshold, and relative odor activity value of volatile components of pork jerky samples
注:-为未检出该物质.
从表3中可以看出,S1组的关键风味化合物主要有1-辛烯-3-醇、庚醛、癸醛、壬醛、苯甲醛、丁酸乙酯、己酸乙酯和庚酸乙酯;S2组的关键风味化合物主要有1-辛烯-3-醇、庚醛、癸醛、壬醛、丁酸乙酯、乙酸乙酯、己酸乙酯、庚酸乙酯和2-甲基丙酸乙酯;S3组的关键风味化合物主要有D-柠檬烯、1-辛烯-3-醇、庚醛、癸醛、壬醛、苯甲醛、丁酸乙酯、己酸乙酯、戊酸乙酯、庚酸乙酯和2-戊基呋喃;S4组的关键风味化合物主要有1-辛烯-3-醇、庚醛、癸醛、壬醛、丁酸乙酯、己酸乙酯、戊酸乙酯、庚酸乙酯、2-甲基丙酸乙酯和辛酸乙酯。
图3是S1组的关键风味化合物的含量与其他3组之间的对比,可以看出除了庚醛含量在发酵后降低之外,其他挥发性化合物都有显著性提高。而庚醛有明显的土腥味[30],经过发酵之后含量降低,可见发酵对猪肉脯有一定的脱腥作用。

图3 四组猪肉脯样品的关键风味化合物含量
Fig.3 Key flavor compound content of four groups of pork jerky samples
蘑菇醇具有蘑菇、玫瑰、薰衣草和干草的香气[31],在发酵之后含量都有所提高,S3组中蘑菇醇含量最高达到了53.32 μg/kg,相较于S1组有了显著提高(P<0.05)。壬醛具有强烈的甜橙气息[32],会对猪肉脯气味产生重要影响,S1组中壬醛质量分数为9.09 μg/kg,S3组和S4组分别为53.56 μg/kg和46.48 μg/kg,可见经过S.cerevisiae的发酵肉脯中壬醛含量有了显著提高(P<0.05)。苯甲醛具有类似炒花生的香气,癸醛具有甜味的花香[33],在发酵之后含量显著提高(P<0.05)。丁酸乙酯、己酸乙酯和庚酸乙酯具有果味、芳香气味,在发酵之后含量都显著提高(P<0.05),S4组中含量最高。
2.3 猪肉脯样品的感官特性得分
如图4所示,S1组的感官评分为5.3±0.13分,香味较淡,经过发酵后,感官评分显著提高,S4组评分最高,为8.7±0.16分,香气浓郁。这可能与微生物在猪肉脯发酵过程中的生长代谢生成低阈值的醛类、酯类等挥发性物质有关。如丁酸乙酯、己酸乙酯和乙酸乙酯等酯类物质的产生赋予了发酵猪肉脯浓郁的果香、酒香,掩盖原有的肉腥味。同时发酵可以促进蛋白质和脂肪等物质的降解产生多种风味物质的前体物质,如蛋白质降解产生的部分氨基酸在猪肉脯烘烤的过程中加强美拉德反应可以赋予猪肉脯更浓郁的风味。
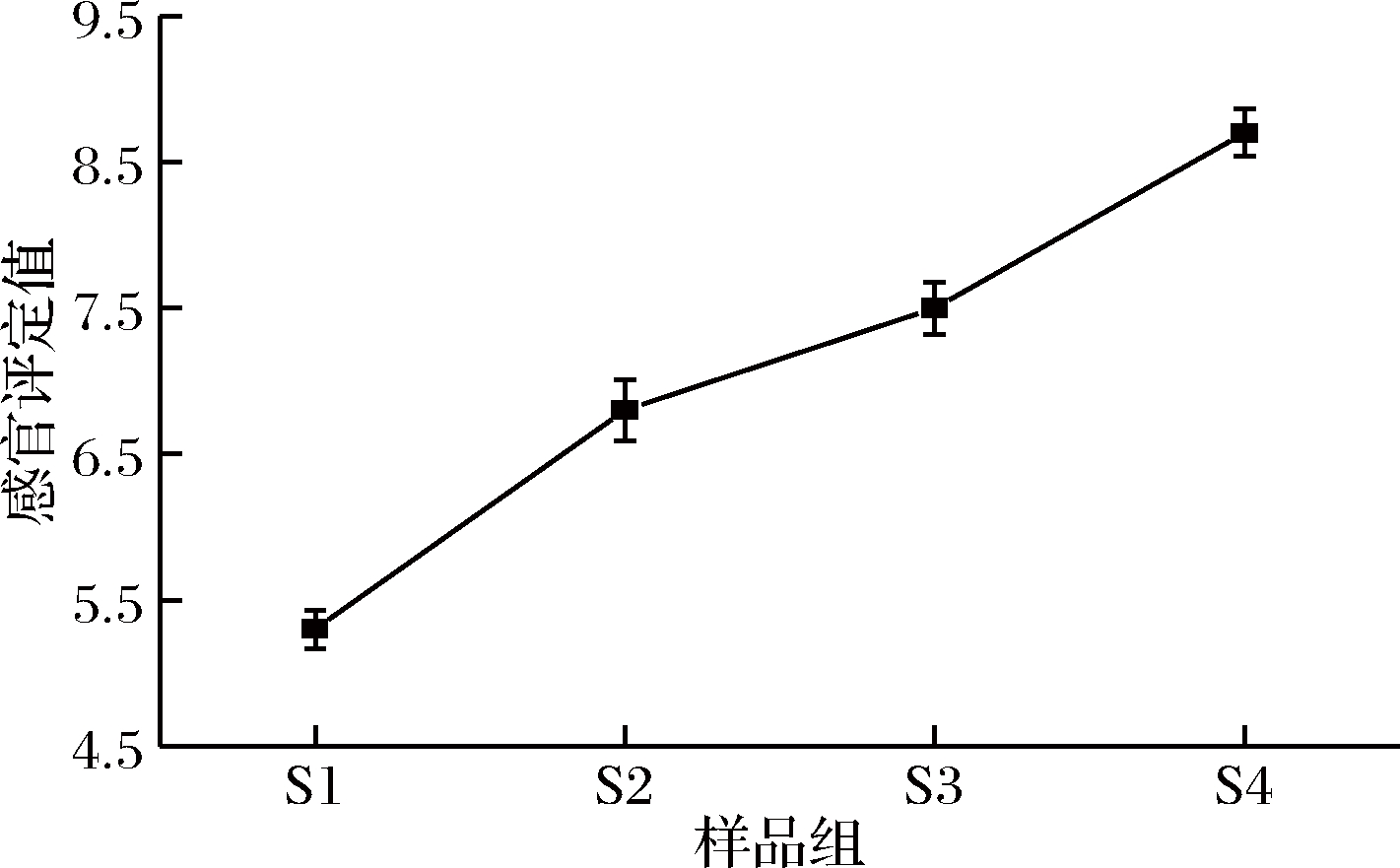
图4 四组猪肉脯样品的感官评定值
Fig.4 Sensory evaluation of four groups of pork jerky samples
3 结论
研究结果表明,4组猪肉脯样品的风味具有显著差异性。根据GC-MS分析,经过发酵猪肉脯的各类挥发性风味物质浓度显著提升,其中复合菌种发酵组样品挥发性风味物质浓度最高。就关键性风味物质的浓度而言,未发酵组中风味贡献较大的物质在发酵后浓度都得到提高。感官评分的结果表明,发酵组的感官评分显著高于未发酵组,复合菌种发酵组的得分最高。综合挥发性物质的总浓度、关键性风味物质浓度和感官评分的结果可以推断,通过发酵可显著提升猪肉脯的风味,复合菌种发酵的猪肉脯风味优于单一菌种发酵猪肉脯。复合发酵猪肉脯的关键风味化合物主要有1-辛烯-3-醇、庚醛、癸醛、壬醛、丁酸乙酯、己酸乙酯、戊酸乙酯、庚酸乙酯、2-甲基丙酸乙酯和辛酸乙酯。
参考文献
[1] KIM H J,PAIK H D.Functionality and application of dietary fiber in meat products[J].Korean Journal for Food Science of Animal Resources,2012,32(6):695-705.
[2] 李培红.嫩化和保湿联合作用改善猪肉脯品质的研究[D].无锡:江南大学,2010.
[3] 杨锋,张晓军,徐丽娜.红茶风味肉脯的加工方法[J].肉类工业, 2015(9):6-9.
[4] ![]() .Quality characteristics of restructured pork jerky according to addition of sliced cheese[J].The Korean Journal of Food and Nutrition,2007,20(3):304-310.
.Quality characteristics of restructured pork jerky according to addition of sliced cheese[J].The Korean Journal of Food and Nutrition,2007,20(3):304-310.
[5] KIM H J,JUNG S,YONG H I,et al.Improvement of microbiological safety and sensorial quality of pork jerky by electron beam irradiation and by addition of onion peel extract and barbecue flavor[J].Radiation Physics & Chemistry,2014,98(5):22-28.
[6] 蔡金龙,万里遥,石秀清.酱香味猪肉脯的研发[J].肉类工业,2017(6):1-5.
[7] 王新惠,张崟,谭茂玲,等.添加复合发酵剂对发酵猪肉干食品安全性的影响[J].食品工业科技,2015,36(20):234-237.
[8] ZHAO C,ZHAO,X,LU Z,et al.Production of fermented pork jerky using Lactobacillus bulgaricus[J].LWT - Food Science and Technology,2016,72:377-382.
[9] ARO J M A,NYAM-OSOR P,TSUJI K,et al.The effect of starter cultures on proteolytic changes and amino acid content in fermented sausages[J].Food Chemistry,2010,119(1):279-285.
[10] CANDOGAN K,WARDLAW F B, ACTON J C.Effect of starter culture on proteolytic changes during processing of fermented beef sausages[J]. Food Chemistry,2009,116(3):731-737.
[11] 徐婧君,安兴娟,张彩娇,等.植物乳杆菌CGMCC8198发酵果蔬奶的制备工艺研究[J].食品工业,2017,38(3):59-63.
[12] 杨帆,盛雅萍,岳建平,等.不同发酵剂对羊肉发酵香肠理化特性及生物胺含量的影响[J].食品科技,2017,42(4):106-112.
[13] 赵岩.果蔬复合发酵鹿肉脯发酵菌种筛选及干燥方法研究[D].长春:吉林大学,2015.
[14] 明庭红,裘迪红,周君,等.基于植物乳杆菌发酵草鱼脱腥增香的研究[J].中国食品学报,2017,17(10):202-210.
[15] 曾雪峰.淡水鱼发酵对酸鱼品质影响的研究[D].无锡:江南大学,2013.
[16] 黄露,郇延军.抗氧化型发酵剂对香肠发酵过程中脂肪氧化的影响[J].食品与发酵工业,2016,42(12):38-44.
![]()
![]() P,DYMERSKI T,et al.Application of electronic nose based on fast GC for authenticity assessment of polish homemade liqueurs called Nalewka[J].Food Analytical Methods,2016, 9(9):2 670-2 681.
P,DYMERSKI T,et al.Application of electronic nose based on fast GC for authenticity assessment of polish homemade liqueurs called Nalewka[J].Food Analytical Methods,2016, 9(9):2 670-2 681.
[18] SONCIN S,PANSERI S,RUSCONI M,et al.Improved determination of 2-dodecylcyclobutanone in irradiated ground beef patties by gas chromatography-mass-spectrometry (GC/MS) coupled with solid-phase microextraction (SPME) technique[J].Food Chemistry, 2012,134(1):440-444.
[19] ANUPAM G,KAZUFUMI O,TOSHIAKI O.Identification and characterisation of headspace volatiles of fish miso, a Japanese fish meat based fermented paste, with special emphasis on effect of fish species and meat washing[J].Food Chemistry,2010,120(2):621-631.
[20] 刘登勇,周光宏,徐幸莲.金华火腿主体风味成分及其确定方法[J].南京农业大学学报,2009,32(2):173-176.
[21] BRAGA C M,ZIELINSKI A A,SILVA K M,et al.Classification of juices and fermented beverages made from unripe, ripe and senescent apples based on the aromatic profile using chemometrics[J].Food Chemistry,2013,141(2):967-974.
[22] 朱清顺,柏如发.养殖中华绒鳌蟹风味品质比较研究[J].中国农学通报,2008,24(3):463-468.
[23] 刘继栋.代谢工程改造酿酒酵母生产单萜的关键问题解析[D].无锡:江南大学,2013.
[24] CHUNG H.Aroma extract dilution analysis of volatile compounds from crab meat[J].Journal of Agricultural and Food Chemistry,1994,42(12):2 867-2 870.
[25] CHEN De-wei,ZHANG Min.Analysis of volatile compounds in Chinese mitten crab[J].Journal of Food and Drug Analysis, 2010,14(3):297-300.
[26] 荣建华,熊诗,张亮子,等.基于电子鼻和SPME-GC-MS联用分析脆肉鲩鱼肉的挥发性风味成分[J].食品科学,2015,36(10):124-128.
[27] 夏延斌.食品风味化学[M].北京:化学工业出版社,2008:9.
[28] 刘登勇,周光宏,徐幸莲.确定食品关键风味化合物的一种新方法:“ROAV”法[J].食品科学,2008,29(7):370-374.
[29] GIRI A,OSAKO K,OHSHIMA T.Identification and characterization of headspace volatiles of fish miso, a Japanese fish meat based fermented paste, with special emphasis on effect of fish species and meat washing[J].Food Chemistry,2010,120(2):621-631.
[30] 解万翠,杨锡洪,章超,等.顶空固相微萃取-气象色谱-质谱法测定北极虾虾头的挥发性成分[J].分析化学,2011,39(12):1 852-1 857.
[31] 戴群,曹大林,刘祥义.基于GC/MS测定的松茸挥发性特征香气研究[J].云南化工,2017,44(1):30-33.
[32] 章建浩,朱健辉,王莉,等.干腌火腿品级风味品质指标分析研究[J].食品科学,2005,26(9):95-100.
[33] 蔺佳良,廖芳芳,苏秀榕,等.中华绒螯蟹不同部位挥发性物质的研究[J].核农学报,2014,28(2):259-269.