香菜(Coriandrum sativum L.)别名芫荽,富含蛋白质、脂肪、矿物质、维生素、胡萝卜素、钙、钠、铁、膳食纤维等人体所需营养物质和微量元素[1-2],成熟香菜含有丰富的饱和及不饱和脂肪酸[3],有特殊浓厚的芳香气味,是最广泛使用的药用植物,具有营养和药用的双重特性[4]。研究发现,超临界CO2萃取的香菜精油对人的增值癌细胞具有良好的抵抗作用[5]。
香菜精油中含有多种活性物质,隋华嵩等[6]在提取泰国和我国云南省香菜的挥发性成分时,鉴定出40种和31种化学成分,主要是醛类和醇类。DUA等[7]测定和分析了香菜种子中的精油含有抗坏血酸(质量分数0.287 mg/g)、生育酚(质量分数0.181 mg/g)、总多酚(质量分数18.7 mg/g)、没食子酸(质量分数0.173 mg/g)、槲皮素(质量分数0.608 mg/g)等抗氧化物质。MSAADA等[8]研究表明,香菜精油对1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl, DPPH)自由基有明显的清除能力。香菜精油对微生物也有抑制作用,李煜彬等研究发现香菜精油对黑曲霉抑菌圈直径为30 mm,酿酒酵母抑菌圈直径为23 mm[9]。粉红单端孢(Trichothecium roseum)可以引起番茄[10]、苹果[11]等果蔬的采后病害,造成一定的经济损失。此外,T. roseum还能分泌单端孢霉烯毒素,属于一类倍半萜环氧化物[12],此类化合物对几乎所有真核生物,包括植物、动物及人类均具有一定的毒性[13]。
长时间使用杀菌剂,尤其是高浓度下,可以引起病原体的抗性,对环境有一定的污染[14]。此外,杀菌剂残留会对消费者产生危害,用精油替代,可以提高水果的安全性[15]。
本研究以香菜为试材,研究香菜精油黄酮类物质在波长510 nm下的吸光度[16],来确定其对温度、紫外、pH值、氧化剂和还原剂以及常见食品添加剂的稳定性,对T. roseum的抑制效果及对ABTS自由基的清除作用。
1 材料与方法
1.1 材料与试剂
新鲜香菜,购自当地市场。
经鉴定并保存于实验室的粉红单端孢(T. roseum),最初从典型霉心病的苹果果实上分离,经马铃薯葡萄糖琼脂(PDA)多次分离,使用前进行活化和致病性检验。
乙醇、马铃薯葡萄糖琼脂培养基(PDA)、过氧化氢(H2O2)、亚硫酸钠(Na2SO3)、苯甲酸钠、羧甲基纤维素钠(CMC)、抗坏血酸、过硫酸钾(K2S2O8)、ABTS等均为分析纯。
1.2 仪器与设备
TDL-5-A离心机,上海安亭科学仪器厂;UV-2550紫外可见分光光度计,岛津仪器(苏州)有限公司;HS-1300-U超净工作台,苏净集团苏州安泰空气技术有限公司;生化培养箱,上海一恒科学仪器有限公司;U-LH50HG奥林巴斯CX31荧光显微镜,北京同舟同德仪器仪表有限公司; RE52-98旋转蒸发仪,上海亚荣生化仪器厂。
1.3 方法
1.3.1 香菜浸出液的制备
取新鲜香菜,去黄叶、洗净、晾干、切段、液氮速冻,然后用组织研磨仪进行研磨,待解冻,用3层无菌纱布过滤得香菜浸出液,作为 100%原液。
1.3.2 乙醇和水提取精油的制备
参考李兴鸣等[17]方法并修改。将上述研磨的香菜,分别用料液比1∶30(g∶mL)的乙醇和水浸泡12 h,抽滤,在5 000 r/min离心20 min,然后弃去沉淀,在旋转蒸发仪浓缩(40 ℃,120 r/min),收集提取液储存备用。
1.4 抑菌作用
1.4.1 菌种的活化及孢子悬浮液配制
将PDA高温灭菌,待培养基冷却至50 ℃左右,按无菌操作法制成平板。然后将供试菌株用接种环挑取少量菌种,按照平板画线法接种于PDA上,放置在24 ℃的恒温箱培养5 d进行活化。
取上述菌株,加入10 mL无菌水(含0.01% Tween 20),用涂布棒刮下菌层转入三角瓶中,振荡15 s,再用双层无菌纱布过滤,用血球计数板计算并稀释孢子浓度到1×106个孢子/mL。
1.4.2 原液及提取液抑菌率测定
采用滤纸片法测定抑菌作用。选用1号定性滤纸,用打孔器制作直径为0.6 cm的圆片,置平皿内高温灭菌(121 ℃,20 min)。取灭菌滤纸片在原液、水提液和醇提液中浸泡12 h,取1.0 mL菌悬液放置在相应的固体培养基上,用无菌三角涂布棒涂匀,将含浸出汁的滤纸片贴在含菌平板上,1个平板等距离放置3片,3次重复。在24 ℃下培养48~96 h后测量抑菌圈直径。以浸无菌水的滤纸片作为对照。
1.4.3 最小抑菌浓度的测定
最小抑菌浓度的测定同1.4.2。准确称取香菜精油配制成体积分数为100%、50%、25%、12.5%、6.25%、3.125%、1.5%的浓度。置于24 ℃下培养观察并测定抑菌圈直径。
1.5 稳定性研究[18-20]
将水提精油配制成体积分数为20 μL/mL的溶液,每只试管中取5 mL。
温度的测定:分别在-20、4、25、40、60、80、100 ℃水浴条件下保温30 min,冷却至室温。
pH的测定:用0.1 mol/L的HCl和NaOH溶液调成pH值为2、3、4、5、6、7、8、9、10、11、12、13的精油样品,以未调pH值的精油作为自然对照管,避光放置30 min。
紫外线的测定:密闭,在30W×2紫外灯照射下放置,分别照射0、5、10、15、20、25、30 min。
氧化剂H2O2和还原剂Na2SO3对香菜精油稳定性的影响:分别配制成体积分数0.5%、1.0%、1.5%、2.0%的H2O2,振荡放置5 min。配制成质量分数0.01%、0.02%、0.03%、0.04%、0.05%的Na2SO3,放置30 min。
将香菜精油配制成体积分数为20 μL/mL的溶液,每只试管中加入5.0 mL,加入抗坏血酸、苯甲酸钠、CMC、柠檬酸、蔗糖、果糖。最终样品分别为质量分数为0.04%、0.08%、0.12%抗坏血酸溶液;质量分数为0.1%、0.15%、0.2%、0.25%苯甲酸钠溶液;质量分数为0.5%、1%、1.5%、2% CMC溶液;质量浓度为0.1、0.2、0.3、0.4 mg/mL柠檬酸溶液,质量浓度为2.5、5.0、7.5、10.0 mg/mL蔗糖和果糖溶液,质量浓度为2.5、5.0、7.5、10.0 mg/mL NaCl溶液,以添加蒸馏水为对照。然后分别测定510 nm吸光值。重复3次。溶液吸光度较空白或自然对照样有明显变化说明溶液中香菜精油发生了变化,不稳定;吸光度保持不变或者略有降低,说明稳定性良好[21]。
1.6 清除ABTS自由基
参照DELGADO-ANDRADE等方法[22]。配制2.0 mmol/L ABTS溶液,吸取50 mL上述溶液与200 mL K2S2O8溶液(70 mmol/L)混合,暗处放置12~16 h,得到ABTS自由基溶液。用磷酸缓冲液(pH 7.4)将ABTS自由基溶液稀释至在734 nm下吸光度为0.70±0.02。用95%乙醇将香菜精油稀释为4个梯度浓度溶液(质量浓度为0.05、0.1、0.15、0.2 mg/mL),取0.1 mL溶液,加入1.9 mL ABTS自由基溶液,在734 nm测其吸光度。按公式(1)计算清除率:
清除率![]()
(1)
其中:A0,ABTS自由基溶液的吸光度;A,加香菜精油溶液后的吸光度。
1.7 数据处理
全部实验数据用Microsoft Excel 2007计算平均值并作图,采用SPSS 19.0进行LSD和Duncan’s分析,做标准误差分析,图中以误差棒的长短表示。
2 结果与分析
2.1 香菜精油原液对T. roseum菌丝生长的抑制效果
由图1可知,香菜原汁、香菜水提物和香菜醇提物对于T. roseum菌丝生长都有显著抑制效果。且抑制效果为水提精油>醇提精油>香菜原汁,其抑制率分别为53.25%、47.83%、39.35%。因此,选择水提精油进行后续实验。
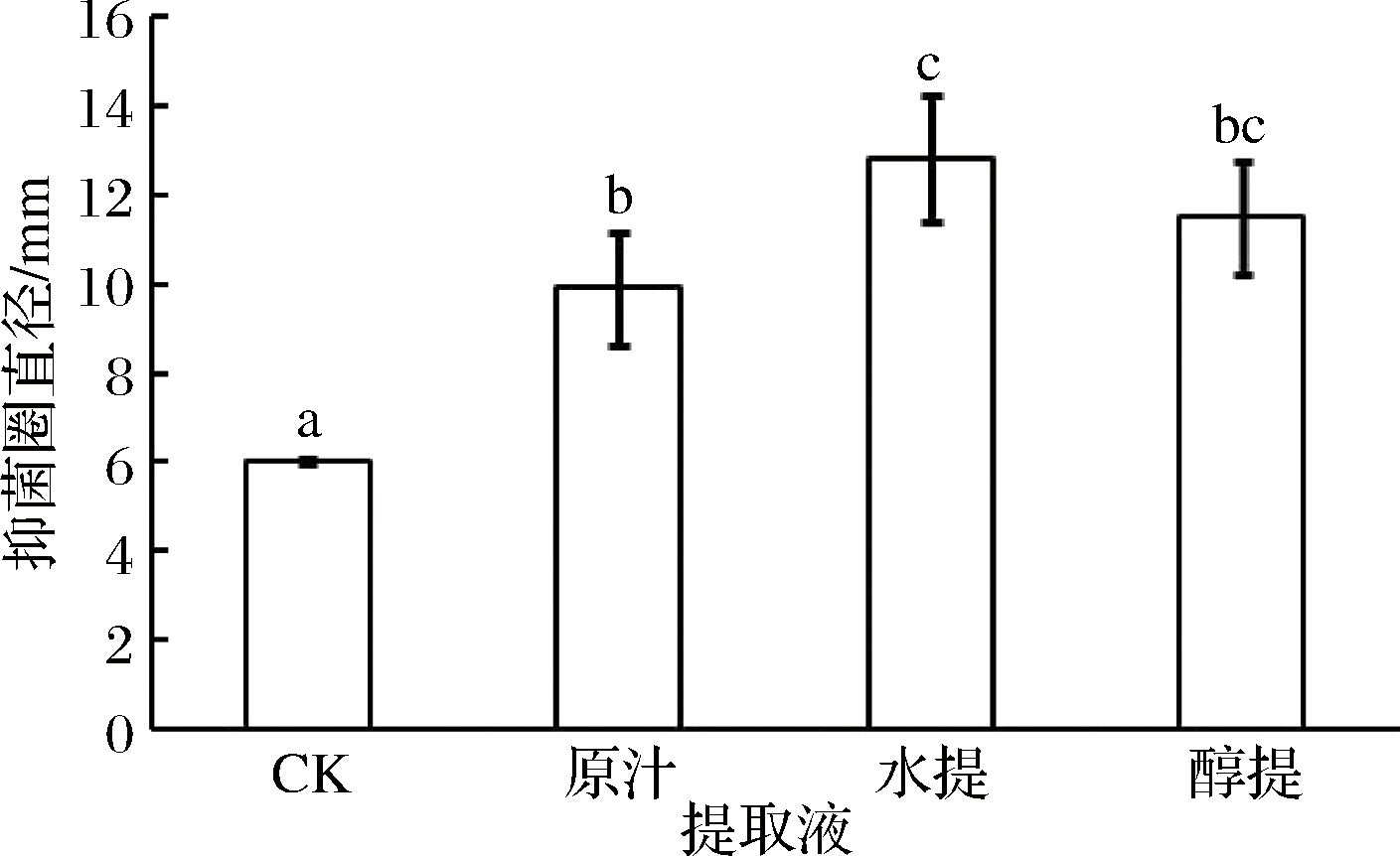
图1 不同香菜提取液对T. roseum菌丝生长的影响
Fig.1 Effects of different coriander extracts on mycelia growth of T. roseum
注:不同小写字母表示差异显著(P<0.05),下同
2.2 水提精油的最小抑菌浓度
由图2可知,在一定的浓度范围内,水提精油对T. roseum菌丝生长具有抑制作用,其中体积分数为3.125%精油的抑菌效果不显著,1.5%无抑菌效果,最小抑菌浓度为6.25%。
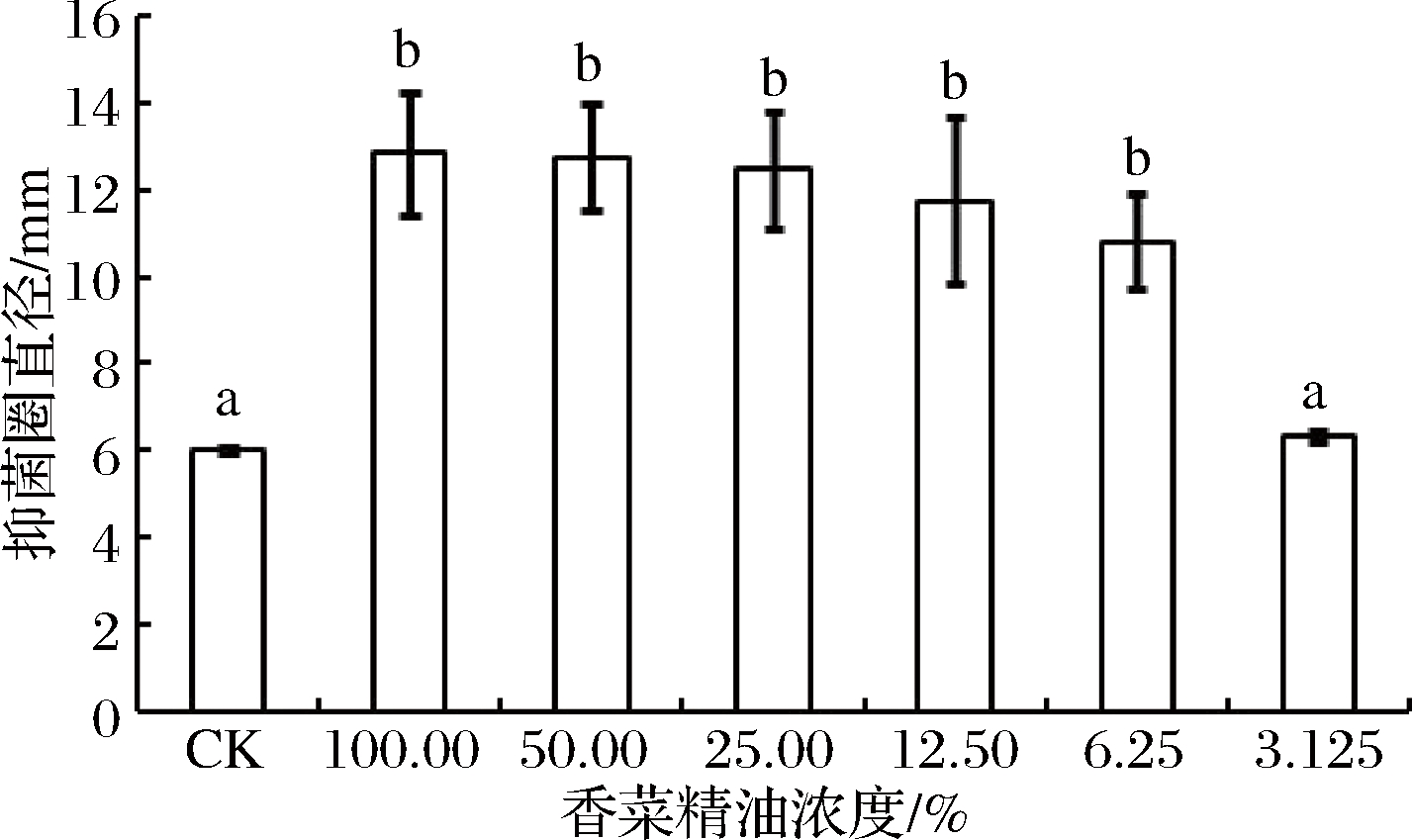
图2 水提香菜精油的最小抑菌浓度测定
Fig.2 The minimum inhibitory concentration (MIC) of coriander essential oil extracted with water
注:图中浓度(%)以药品各自状态在水中的占比表示,下同。
图中小写字母表示差异显著,下同。
2.3 稳定性研究
2.3.1 温度、紫外照射和pH值对香菜精油稳定性的影响
由图3-A可知,香菜精油在25~80 ℃之间,吸光度随温度的变化不大,相对稳定。冷冻(-20 ℃)、冷藏(4 ℃)有微小的影响,超过80 ℃时,精油的吸光度显著增加,可能是由于高温使得黄酮成分分解,产生酚羟基,使得吸光度明显增大。总体来说香菜精油在80 ℃以下有良好的稳定性,要尽量避免高温、冷藏而应该室温保存。
香菜精油经过不同时间的紫外线照射后,吸光度在前15 min没有发生较大的变化。15 min后,吸光度显著增大(图3-B)。说明长时间的紫外照射对香菜精油有一定的影响。
在pH值5.0~8.0可以保持稳定,在其他pH值下,香菜精油的吸光度具有显著性地变化(图3-C)。由此可见,在储存时应避免强酸强碱,在pH值5.0~8.0范围内储存。

图3 温度(A)、紫外照射(B)和pH值(C)对香菜精油稳定性的影响
Fig.3 Effect of temperature (A), UV radiation (B) and pH (C) on the stability of coriander essential oil
2.3.2 还原剂Na2SO3和氧化剂H2O2对香菜提取液稳定性的影响
由图4可知,随着氧化剂H2O2和还原剂Na2SO3浓度的增大,香菜精油的吸光度略有减小,并且氧化剂比还原剂对溶液影响明显。还原剂浓度达到食品最大安全使用量才与体积分数0.5%的氧化剂作用相当,表明还原剂Na2SO3对香菜精油稳定性影响比氧化剂小。香菜精油具有一定的抗还原性,但仍然需要避免接触此类氧化还原物质。
2.3.3 抗坏血酸、柠檬酸、蔗糖、果糖、NaCl、苯甲酸钠、CMC对香菜精油稳定性的影响
由图5-A可知,随抗坏血酸浓度增大,香菜精油水溶液吸光度值显著增大,表明抗坏血酸对香菜精油有明显的促进作用。抗坏血酸是一种常用的食品抗氧化剂,因其具有很强的还原性,一定程度上可以减慢香菜精油自动氧化反应速度。柠檬酸对香菜精油稳定性有较大的影响,使得吸光度降低了50%以上(图5-B)。添加NaCl的香菜精油吸光度随着浓度增大而增大,这与大多数其他植物黄酮类精油有着相反的结果(图5-C)。蔗糖和果糖对香菜精油有增效作用,在0.25%~0.75%之间,效果有所起伏,但是达到1%,2种糖的效果一致(图5-D)。加入苯甲酸钠和CMC有较小幅度的下降,下降程度不显著,只降低了10.1%,证明香菜精油对苯甲酸钠和羧甲基纤维素钠液稳定(图5-E,F)。
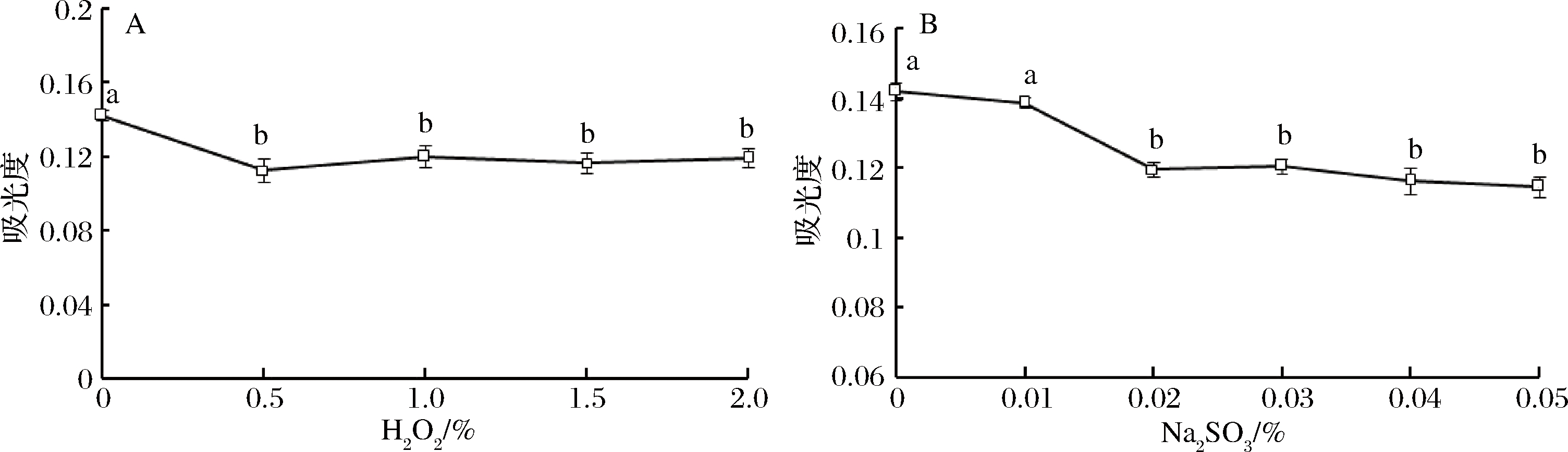
图4 H2O2(A)和Na2SO3(B)对香菜精油稳定性的影响
Fig.4 Effect of H2O2(A) and Na2SO3(B) on the stability of coriander essential oil

图5 抗坏血酸(A)、柠檬酸(B)、NaCl(C)、蔗糖和果糖(D)、苯甲酸钠(E)、羧甲基纤维素钠(F)对香菜精油稳定性的影响
Fig.5 Effect of ascorbic acid (A), citric acid (B), NaCl (C), sucrose and fructose (D), sodium benzoate (E)and CMC (F) on the stability of coriander essential oil
2.4 香菜精油对ABTS自由基的清除作用
由图6可知,香菜精油对ABTS自由基有一定的清除作用,水提物的清除能力最好,且清除率大小为水提物>醇提物>香菜原汁。随着水提精油浓度的增大,清除率依次增加。
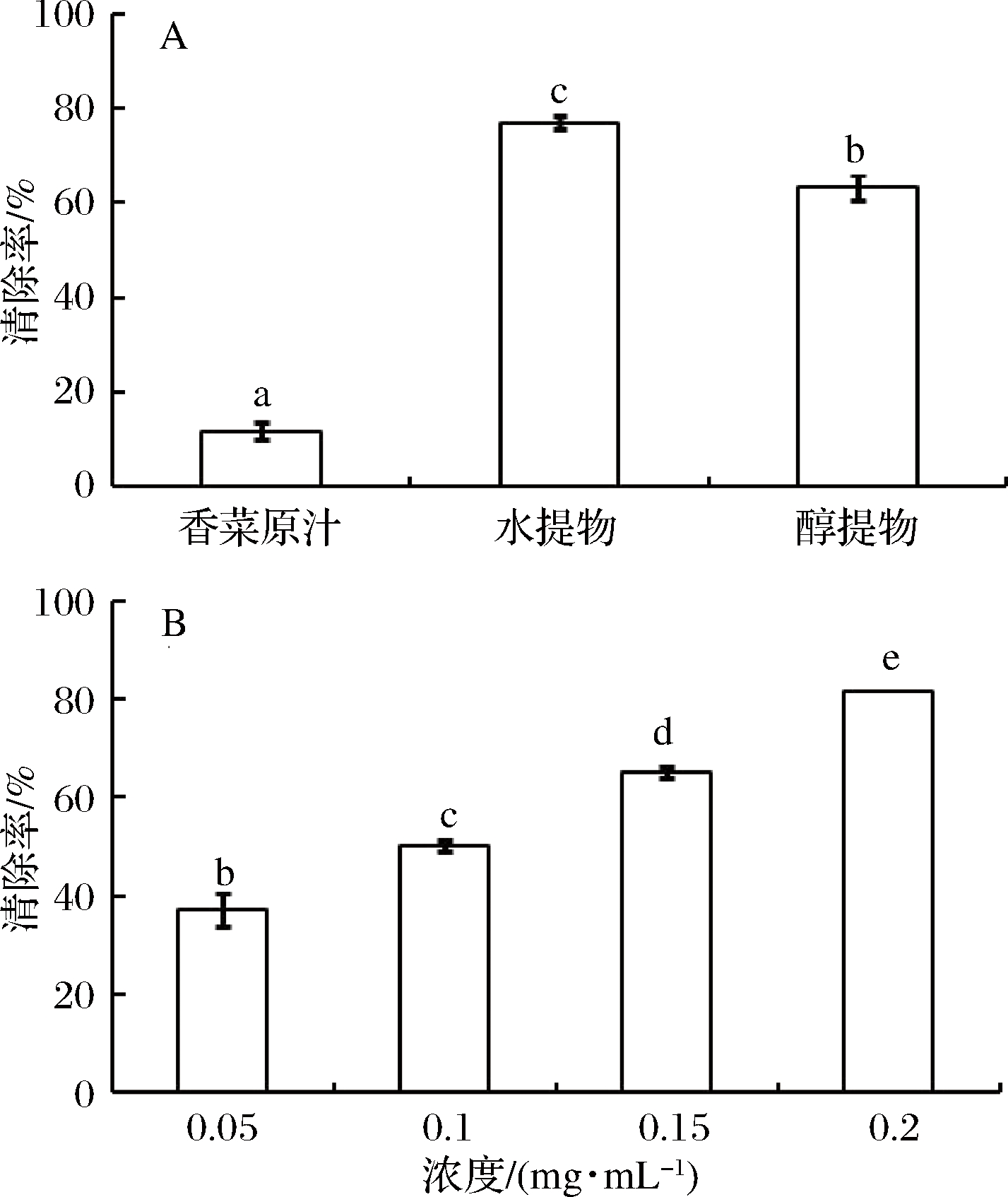
图6 不同提取液的香菜精油(A)和不同浓度的水提香菜精油(B)对ABTS自由基的清除作用
Fig.6 Scavenging effects of different types of coriander essential oil (A) and different concentrations of coriander essential oil extracted with water (B) on ABTS free radicals
3 结论与讨论
香菜精油中含有大量的黄酮类化合物,天然黄酮类化合物以C6-C3-C6为基本碳架,常含有羟基、甲氧基、烃氧基、异戊烯氧基等取代基,使该类化合物多显黄色。本实验提取的香菜水提物为深黄色,而醇提物为绿色。
不同植物的精油,其各种组分的含量以及成分各不相同,不同的外界条件对精油的影响也各有差别。ZEKOVI等[23]通过亚临界提取法在100和150℃下获得以芳樟醇为主要化合物的香菜精油。PIRBALOUTI等[24]研究了日光、阴凉、机械烘箱、微波炉及冷冻干燥方法对芫荽精油的影响,结果表明冷冻干燥提取的精油含量最高,其次是阴凉干燥的样品。此外,精油提取后的环境pH值、温度、食品添加剂等也会影响其功能。黑豆花青素(pH值2.5,4 ℃)和紫玉米花青素(pH 2~6,22 ℃贮藏12周)在酸性和中低温条件下稳定[25-26],用超声波提取法提取的竹叶黄酮有很好的热稳定性,光照、H2O2和Na2SO3对竹叶黄酮的稳定性影响较大[27]。本研究表明香菜精油在80 ℃以下都表现出了较好的稳定性,而冷藏或者高温会导致香菜精油不稳定,在pH值5.0~8.0时表现稳定。
植物精油对微生物有一定的抑制作用,也具有一定的抗氧化性。ZARE-SHEHNEH等[28]研究表明,香菜叶精油对青霉和黑曲霉具有杀菌活性,杀菌质量浓度分别为67.8和62.1 mg/mL,陈志红等[29]研究表明香菜乙醇提取液对超氧阴离子自由基和羟自由基均有清除作用。而精油的抑菌和抗氧化性质也会受到其他因素的影响,如温度、紫外[17]、Ca2+,Fe3+等金属离子。紫皮紫心薯肉中多酚、黄酮和ORAC值与未经加热的生薯肉相比,100 ℃下加热30 min能使其提取精油中黄酮和ORAC值分别提高2.6倍及5.7倍,表明热加工有利于提高番薯中多酚类物质的释放,提高其抗氧化活性[30]。
食品添加剂柠檬酸对许多植物黄酮表现为破坏作用,香菜精油也有同样的研究结果,在食品加工过程中应避免这些物质。本实验结果还研究苯甲酸钠和羧甲基纤维素钠(CMC)对香菜精油的影响较小。NaCl、抗坏血酸对其稳定性具有促进作用,在氧化剂实验中,精油的吸光度只是有轻微减小,表现出较强的抗氧化能力,香菜精油可作为一种效果良好的天然抗氧化剂。在还原剂实验中,香菜黄酮对还原性较强的Na2SO3抗性较弱,因此,香菜精油在生产、贮存及研究使用过程中应注意避免与亚硫酸盐或二氧化硫等还原剂接触。
总之,香菜精油无论是热稳定性、酸稳定性,还是对食品添加剂的稳定性范围都比较宽,是一种较稳定的食品和保健品添加剂。未来要研究新的方法来分析香菜精油中的有效成分,在保持其有效成分的前提下开发果蔬保鲜剂。
参考文献
[1] SARIMESELI A. Microwave drying characteristics of coriander (Coriandrum sativum L.) leaves[J]. Energy Conversion & Management, 2011, 52(2): 1 449-1 453.
[2] BHAT S, KAUSHAL P, KAUR M, et al. Coriander (Coriandrum sativum L.): Processing, nutritional and functional aspects.Afr[J]. African Journal of Plant Science, 2014, 8(1): 25-33.
[3] MOMIN A H, ACHARYA S S, GAJJAR, A V. Coriandrum sativum-review of advances in phytopharmacology[J]. International Journal of Pharmaceutical Sciences & Research, 2012, 3(5): 1 233.
[4] LARIBI B, KOUKI K, M'HAMDI M, et al. Coriander (Coriandrum sativum L.) and its bioactive constituents[J]. Fitoterapia, 2015, 103: 9-26.
[5] ELGNDI M A, FILIP S, ![]() B, et al. Antioxidative and cytotoxic activity of essential oils and extracts of Satureja montana L. Coriandrum sativum L. and Ocimum basilicum L. obtained by supercritical fluid extractio[J]. Journal of Supercritical Fluids, 2017, 128: 128-137.
B, et al. Antioxidative and cytotoxic activity of essential oils and extracts of Satureja montana L. Coriandrum sativum L. and Ocimum basilicum L. obtained by supercritical fluid extractio[J]. Journal of Supercritical Fluids, 2017, 128: 128-137.
[6] 隋华嵩,邹悦,周文忠,等. 泰国香菜与云南香菜不同器官中挥发性成分分析[J]. 食品研究与开发, 2016, 37 (3): 161-165.
[7] DUA A, AGRAWAL S, KAUR A, et al. Antioxidant profile of Coriandrum sativum methanolic extract[J]. International Research Journal of Pharmacy, 2014, 5(3): 220-224.
[8] MSAADA K, JEMIA M B, SALEM N, et al. Antioxidant activity of methanolic extracts from three coriander (Coriandrum sativum L.) fruit varieties[J]. Arabian Journal of Chemistry, 2017, 10: S3 176-S3 183.
[9] 李煜彬,杨洋. 芫荽抑菌成分提取工艺优化研究[J]. 亚太传统医药, 2015, 11 (22): 13-16.
[10] 施俊凤,孙常青,王潇冉,等. 番茄采后病原鉴定及百里香精油生物活性研究[J]. 中国食品学报, 2016, 16(2): 224-232.
[11] 冯红利,杨艳玲,李建朝. 红富士苹果霉心病防治技术[J]. 西北园艺:果树专刊, 2016(2): 29-30.
[12] 史建荣,王裕中,何晨阳,等. 镰刀菌单端孢霉烯毒素及其在植物病程中的作用[J]. 植物病理学报, 1997(4): 298-302.
[13] 章战华. 不同寄主来源的粉红单端孢比较及活性研究[D].合肥:安徽农业大学, 2007.
[14] SHI X, LI B, QIN G, et al. Mechanism of antifungal action of borate against Colletotrichum gloeosporioides, related to mitochondrial degradation in spores[J]. Postharvest Biology and Technology, 2012, 67(6): 138-143.
[15] MEI K O, KAZI F K, FORNEY C F, et al. Effect of gaseous ozone on papaya anthracnose[J]. Food and Bioprocess Technology, 2013, 6(11): 2 996-3 005.
[16] 杨洋,朱晓华,李煜彬,等. 芫荽中黄酮类化合物的提取及其体外抗氧化活性研究[J]. 中国食品添加剂, 2015(6): 114-119.
[17] 李兴鸣,徐学明. 芫荽抑菌成分的提取及其抑菌性能的研究[J]. 食品科技, 2006(10): 89-91.
[18] 李钟美,黄和. 高良姜提取物抑菌活性及稳定性研究[J]. 食品与机械, 2016, 32(2): 55-59.
[19] 王朝宇,张文静,毕艳红,等. 甘蔗皮色素的提取工艺及稳定性研究[J]. 食品与发酵科技, 2017, 53(4): 55-59.
[20] 何莉萍,高维. 食品配料对荷叶黄酮稳定性的影响[J]. 食品工业, 2017(3): 118-120.
[21] 殷丽君,冯淑环,焦翔,等. 沙棘叶黄酮提取物的稳定性研究[J]. 中国食物与营养, 2011(4): 33-36.
[22] DELGADO-ANDRADE C, RUFIAN-HENARES J A, MORALES F J. Assessing the antioxidant activity of Melanoidins from coffee brews by different antioxidant methods[J]. Journal of Agricultural and Food Chemistry, 2005, 53(20): 7 832-7 836.
![]() Z, KAPLAN M,
Z, KAPLAN M, ![]() B, et al. Chemical characterization of polyphenols and volatile fraction of coriander (Coriandrum sativum L.) extracts obtained by subcritical water extraction[J]. Industrial Crops and Products, 2016, 87: 54-63.
B, et al. Chemical characterization of polyphenols and volatile fraction of coriander (Coriandrum sativum L.) extracts obtained by subcritical water extraction[J]. Industrial Crops and Products, 2016, 87: 54-63.
[24] PIRBALOUTI A G, SALEHI S, CRAKER L. Effect of drying methods on qualitative and quantitative properties of essential oil from the aerial parts of coriander[J]. Journal of Applied Research on Medicinal and Aromatic Plants, 2016, 4: 35-40.
[25] LUNAVITAL D, LI Q, WEST L, et al. Anthocyanin condensed forms do not affect color or chemical stability of purple corn pericarp extracts stored under different pHs[J]. Food Chemistry, 2017, 232: 639-647.
[26] MOJICA L, BERHOW M, GONZALEZ D M E. Black bean anthocyanin-rich extracts as food colorants: Physicochemical stability and antidiabetes potential[J]. Food Chemistry, 2017, 229: 628-639.
[27] 谢远红,谢乐芳. 竹叶黄酮的超声波提取及稳定性研究[J]. 内蒙古民族大学学报(自然汉文版), 2017, 32(4): 302-307.
[28] ZARE-SHEHNEH M, ASKARFARASHAH M, EBRAHIMI L, et al. Biological activities of a new antimicrobial peptide from Coriandrum sativum[J]. International Journal of Biosciences, 2014, 4(6): 89-99.
[29] 陈志红,徐美奕. 香菜乙醇提取液的体外抗氧化活性[J]. 食品研究与开发, 2009, 30(11): 69-71.
[30] 陆建超,郑必胜,颜盛繁,等. 不同品种番薯抗氧化活性的对比及热加工稳定性[J]. 现代食品科技, 2017, 33(2): 136-141.