酚类物质是高等植物中广泛存在的一类次生代谢产物,在植物组织中通常以酯化或者糖苷化的形式存在,是植物抗氧化系统的重要组成,具有抗氧化、抗菌、抗癌等多种生物活性[1]。已发现的多酚类化合物有8 000多种,根据其不同的化学结构至少可分为10类,比如简单的小分子物质酚酸,高度聚合的复杂化合物单宁等[2]。人们对植物食品原料中黄酮类物质的研究较多,而对于酚酸类物质的研究相对滞后,直到20世纪80年代初,植物食品原料中酚酸的提取和纯化工艺被系统提出后,酚酸类物质的研究才开展起来[3]。近年来研究表明,酚酸类化合物同样具有抗菌[4],抗氧化[5]和抗癌[6]等一系列生物活性。代沙[7]研究发现,紫苏叶提取物的抗氧化活性主要与酚酸类中的迷迭香酸和咖啡酸呈显著性关系,徐良雄等[8]在比较不同花卉抗氧化能力时发现,抗氧化活性与多酚含量呈显著的线性关系,而与黄酮含量无关。研究酚酸的富集,对提高食品原料的抗氧化能力有一定的帮助。
种子萌发是高等植物生命活动最强烈的一个时期,涉及到一系列形态和生理生化的变化,前人研究表明,大豆萌发能够使大豆中原来含量低或不具有的功能成分如γ-氨基丁酸(γ-aminobutyric acid, GABA)[9]、总酚[10]、总黄酮[11]、异黄酮[12-13]等显著增加。已有研究表明,控制一定发芽条件,可使这些功能性成分富集[14-15]。其中关于酚类物质的富集多集中于盐胁迫下,而关于低浓度盐对大豆酚类物质的影响鲜有报道,基于此,本试验研究了低浓度NaCl、CaCl2及NaCl-CaCl2联合处理对大豆芽苗生长状况,酚类物质含量及抗氧化能力的影响,为开发功能性大豆食品提供理论依据。
1 材料与方法
1.1 材料与试剂
大豆,品种为“云鹤”,由江苏省农业科学院提供。甲醇,乙酸乙酯,氯化钠,购自南京杰汶达生物科技有限公司;1,1-二苯基-2-三硝基苯肼(DPPH),2,2-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐(ABTS), 6-羟基-2,5,7,8-四甲基色烷-2-羧酸(Trolox),购自上海麦克林生化科技有限公司;没食子酸,原儿茶酸,对羟基苯甲酸,香草酸,咖啡酸,紫丁香酸,对香豆酸,阿魏酸,芥子酸,均购自美国Sigma公司。配制以上试剂的水为超纯水,甲醇为色谱纯,其余为分析纯。
1.2 仪器与设备
755B型分光光度计,上海精密科学仪器有限公司;岛津LC-20A高效液相色谱仪,岛津科学仪器;TDL-40B离心机,上海安亭科学仪器厂;WH-3微型旋涡混合仪,上海沪西分析仪器厂;DHG-9030A型电热恒温鼓风干燥箱,上海一恒科技有限公司;DZF-6020型真空干燥器上海一恒科技有限公司;HH-6型数显恒温水浴锅,常州国华电器有限公司;ZFA-1型旋转蒸发仪,上海玻璃仪器二厂;PYX-DHS-50X65-BS隔水式电热恒温培养箱,上海跃进医疗器械厂。
1.3 方法
1.3.1 实验设计
选取适量籽粒饱满、大小均一的优质大豆,用去离子水漂洗除去杂质后置于1%(v/v) NaClO水溶液中浸泡消毒15 min,之后用去离子水冲洗至pH中性后置于30 ℃水浴锅中,用去离子水(1∶5(g∶mL))浸泡6 h。将浸泡后的大豆均匀摊于发芽机的苗盘上,置于30 ℃培养箱中避光发芽。分别设以下处理:
(1)对照(去离子水);
(2)NaCl处理(1.5 mmol/L NaCl);
(3)CaCl2处理(6 mmol/L CaCl2);
(4)NaCl+CaCl2处理(1.5 mmol/L NaCl+6 mmol/L CaCl2);
处理过程中,每隔24 h更换1次培养液,发芽时间4 d,取样清洗后用吸水纸吸干,一部分样品用于测定大豆芽苗生长指标(芽长、鲜重、干重),其余样品真空冷冻干燥,粉碎至过40目筛测定总酚含量、酚酸含量及抗氧化指标(DPPH自由基清除能力、ABTS自由基清除能力)。
1.3.2 生长指标的测定
芽长:随机选取30株大豆芽苗,用游标卡尺测定其芽长,计算平均值。
鲜重:随机选取30株大豆芽苗,用去离子水冲洗干净,吸水纸吸干表面水分,称重。
干重:随机选取30株大豆芽苗,用去离子水冲洗干净,吸水纸吸干表面水分,采用烘干恒重法测定。
1.3.3 游离酚的提取
参考CHEN等[16]的方法。大豆芽苗真空冷冻干燥后,用粉碎机粉碎,过40目筛(0.45 mm孔径)得到不同处理的样品。准确称取2.0 g样品用80%甲醇提取3次(每次20 mL):在振荡器上200 r/min振荡1 h,室温(25 ℃)条件下充氮气避光提取,然后在10 000 r/min,4 ℃下离心15 min,离心后将提取液合并过滤,在40 ℃条件下旋转蒸发至干,用50%甲醇溶解定容至10 mL作为游离酚提取液,充氮气后于-20 ℃放置供分析用。
1.3.4 结合酚的提取
参考CHEN等[16]的方法。提取游离酚后的残余物用40 mL 2 mol/L NaOH水解,混合物放在振荡器200 r/min条件下振荡水解4 h,室温(25 ℃)条件下充氮气避光提取,水解液用6 mmol/L HCl调整pH值在1.5~2.0,取50 mL乙酸乙酯与水解液充分混合15 min后,静置5 min,然后混合液在10 000 r/min,4 ℃下离心5 min,取上层乙酸乙酯层。重复此操作3次,合并乙酸乙酯层于40 ℃条件下旋转蒸发至干,用50%甲醇溶解定容至10 mL作为结合酚提取液,充氮气后于-20 ℃放置供分析用。
1.3.5 总酚含量测定
采用福林-酚法测定[16]。分别取上述提取液200 μL(适当稀释)加入1.5 mL 10倍稀释的福林-酚试剂,涡旋后静置5 min,然后加入1.5 mL 75 g/L Na2CO3溶液混匀,置于室温下避光反应2 h,在765 nm处测定吸光值。以50%甲醇溶液代替提取液作为空白对照。以没食子酸为标准品绘制标准曲线,总酚含量以μg GAE/株计。
1.3.6 酚酸含量测定
参考CHEN等[16]的方法。分别取20 μL上述提取液(1.4.2和1.4.3)经0.45 μm的有机滤膜过滤后采用高效液相进行分析:采用岛津LC-20A高效液相色谱,配备C18 110A色谱柱(5 μm粒径,4.6 mm×150 mm),高效液相的条件如下:流速为0.9 mL/min,流动相A溶液为0.1%的醋酸水溶液,B溶剂为0.1%的醋酸甲醇溶液。高效液相的流动程序为:0~11 min,9%~14% B;11~14 min,14%~15% B;14~17 min,15% B;17~24 min,15%~16.5% B;24~28 min,16.5%~19% B;28~30 min,19%~25% B;30~36 min, 25%~26% B;36~38 min;26%~28% B; 38~41 min,28%~35% B;41~46 min,35%~40% B;46~48 min,40%~48% B;48~53 min,48%~53% B;53~65 min,53%~70% B;65~66 min,70%~90% B;66~75 min,9% B。柱温35 ℃,测定波长280 nm。
1.3.7 抗氧化指标
1. 3.7.1 DPPH自由基清除能力
参考YANG等[17]的方法。取上述提取液200 μL(适当稀释)加入3.8 mL DPPH溶液,涡旋后置于室温下避光反应1 h,在515 nm处测定吸光值A。以50%甲醇溶液代替提取液作为空白对照Acontrol。以Trolox配制标准曲线,DPPH清除率以μmol TE/株计。
1. 3.7.2 ABTS自由基清除能力
参考CHEN等[16]的方法。取上述提取液100 μL(适当稀释)加入3.0 mL ABTS·+溶液,涡旋后置于室温下避光反应30 min,在734 nm处测定吸光值A。以50%甲醇溶液代替提取液作为空白对照Acontrol。以Trolox配制标准曲线,ABTS清除率以μmol TE/株计。
1.4 数据处理
试验数据采用SAS 8.1软件Duncans多重比较法进行方差分析,采用Origin 8.5作图。
2 结果与分析
2.1 不同处理对大豆芽苗生长指标的影响
从图1-A可以看出,与对照相比,低浓度NaCl、CaCl2及NaCl-CaCl2联合处理4 d后均能显著促进大豆芽苗的生长,分别较对照提高了31.9%、77.6%和69.8%,其中CaCl2处理增加幅度最大。图1-B则表明3种不同的盐处理都能增加大豆芽苗的鲜重,增幅分别为6.2%、12.6%和17.3%,而在NaCl处理下,大豆芽苗的干重则有所降低,比对照减少了4.2%(图1-C)。NaCl-CaCl2联合处理的大豆芽苗,其鲜重和干重都要高于其他处理,这说明NaCl和CaCl2都可以调控植物生长,且两者共同处理下效果更明显。

图1 不同处理对大豆芽苗芽长(A)、鲜重(B)和干重(C)的影响
Fig.1 Effects of different treatments on length (A), fresh weight (B) and dry weight (C) of soybean sprouts
注:不同小写字母代表同一指标不同处理间在0.05水平差异显著。下同。
NaCl长期以来被认为是一种重要的非生物胁迫因子,可造成植物盐害,严重影响着世界干旱和半干旱地区作物的生长发育和产量[18]。目前关于NaCl的研究也主要集中在其对植物的胁迫作用及植物的耐盐性方面的研究,关于低浓度NaCl对植物的生长发育方面研究较少[19],然而近年来的一些研究证实,虽然高浓度NaCl对植物有害,但植物生长的确需要一定量的Na+和Cl-。有研究表明,低浓度NaCl(5、10 mmol/L)能够增加荞麦芽苗的可溶性糖和维生素C,提高芽苗产量[20],显著促进菠菜的生长,增加叶绿素和蛋白质的含量并提高产量[21]。这与本实验结果较为一致:低浓度NaCl不仅不产生盐害作用,反而能促进植物生长。
关于CaCl2的研究集中于其在缓解盐胁迫中发挥作用,李华等[22]证实,喷施CaCl2能够显著提高盐胁迫下黄瓜幼苗的干鲜重,显著减少丙二醛和脯氨酸的积累,从而减轻盐胁迫伤害,促进黄瓜植株生长,提高生物量积累。有报道指出,用钙处理幼苗能明显提高玉米幼苗叶片中腐胺(Put)、亚精胺(Spd)、精胺(Spm)的含量,且钙能抑制膜脂在盐胁迫下植物中丙二醛(MDA)的积累,从而减轻对细胞的伤害[23]。这说明一定浓度的CaCl2对植物的生长有促进作用,与本实验结果相符。
2.2 不同处理对大豆芽苗总酚及酚酸含量的影响
多酚类物质以游离和结合两种形式存在于植物中,结合形式又分为可溶性结合和不可溶结合两种形式,其中游离状态多酚物质主要以原花青素、类黄酮类为主,结合酚多为酚酸类,能与纤维素、蛋白质、木质素、类黄酮、葡萄糖、酒石酸等结合的形式存在于植物组织的初生壁和次生壁中[24]。对于谷物籽粒,结合形式多酚占绝大部分(玉米85%、燕麦75%、小麦75%、大米62%)[25],而对于豆类籽粒,其多酚类物质以游离形式为主,主要为黄酮类物质,结合态酚类物质中的酚酸类成分则缺乏深入研究。由图2可以看出,NaCl、CaCl2及NaCl-CaCl2联合处理均能显著提高发芽大豆的游离酚和结合酚含量,其中游离酚含量分别较对照提高了5.5%、12.5%和16.7%,结合酚含量则分别提高了5.7%、21.9%和30.0%。这与低盐处理促进芽苗生长有密切关系,在籽粒发芽过程中,植物细胞壁周围的很多成分降解,从而游离态和结合态的酚类化合物得以释放,进而使总酚含量明显增加[26],一方面芽苗生长过程中结合态的酚类物质逐渐转化为游离态,游离酚含量增加,另一方面芽苗不断生长,植物细胞壁面积增大,结合酚含量也不断增加。另外,适度盐处理使得植物籽粒发芽中酶的合成量增多,活性加大,有利于酚类物质的加速合成。
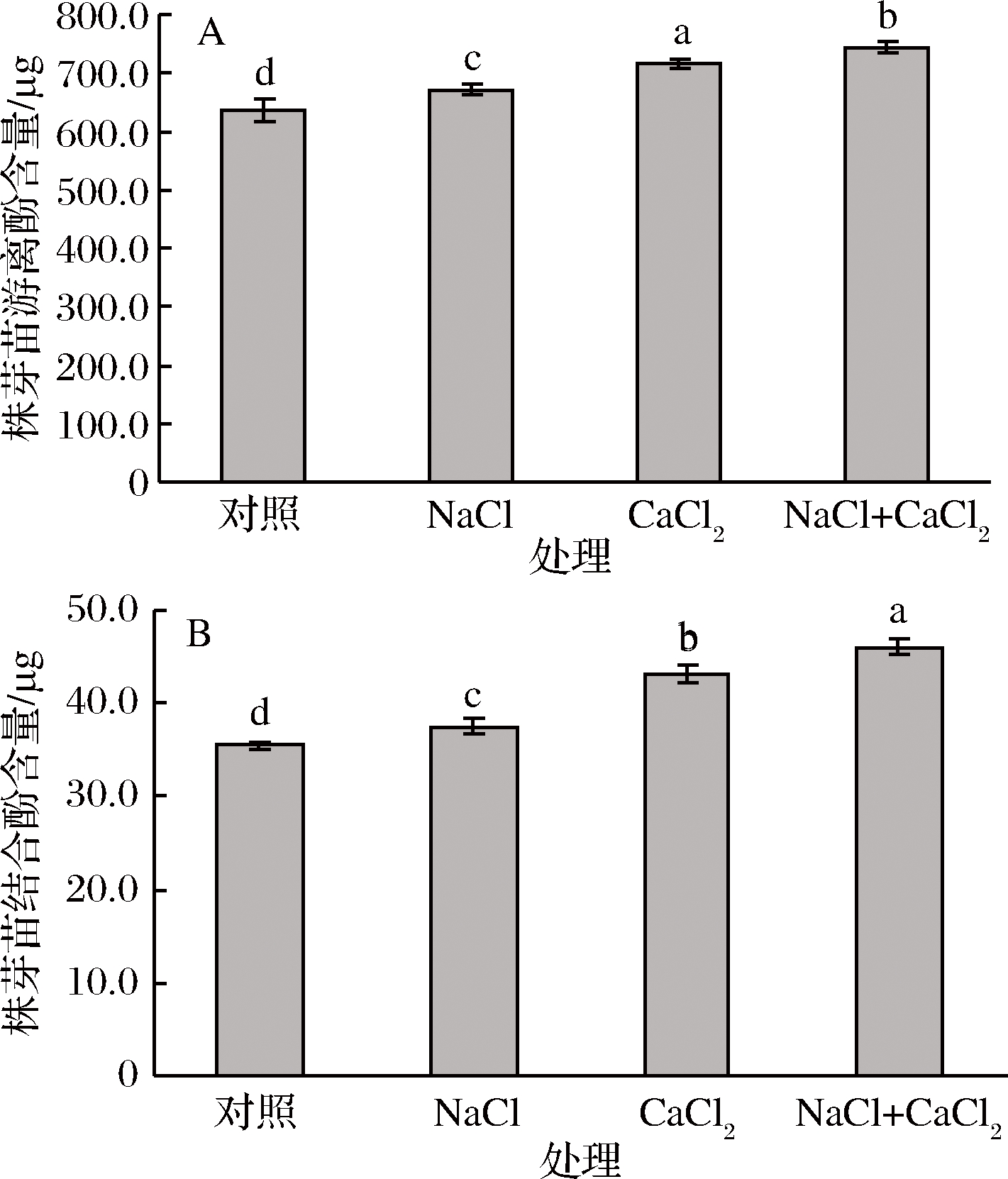
图2 不同处理对大豆芽苗游离酚(A)和结合酚(B)含量的影响
Fig.2 Effects of different treatments on the content of free phenolics (A) and bound phenolics (B) in soybean sprouts
2.3 不同处理对大豆芽苗酚酸含量的影响
酚酸是谷物中主要的酚类化合物[27],具有抗氧化、清除自由基、抑制突变和抗肿瘤、抗血小板凝集、抗菌等重要的生理功能,对人体的健康具有独特的保健作用,是一种极具开发价值的潜在天然化合物。对于大豆中的酚类物质研究主要集中于黄酮和异黄酮,对于酚酸的研究相对较少。由图3-A可看出,对照组发芽大豆中游离酚酸主要是对香豆酸,NaCl单独处理不仅增加了对香豆酸含量,也增加了酚酸种类——香草酸,改变了游离酚酸组成。CaCl2和NaCl-CaCl2联合处理均大幅增加了对香豆酸和香草酸含量,其中CaCl2单独处理分别是对照的2.39和3.96倍,NaCl-CaCl2联合处理则是对照的2.04和4.48倍。这与付晓燕[28]研究发现在燕麦发芽后检测出了原本没有的原儿茶酸和没食子酸一致,说明调控发芽条件可以改变酚酸的种类。从图3-B可看出,大豆芽苗中结合酚酸含量较多的是对香豆酸和紫丁香酸,其次是阿魏酸、香草酸和芥子酸。NaCl处理在一定程度上抑制了结合酚酸的形成,所检测的7种结合酚酸中除了对羟基苯甲酸基本持平外,其他6种都有所降低。而CaCl2处理和NaCl-CaCl2联合处理都能显著提高结合酚酸的含量,其中对香豆酸增加幅度最大,分别较对照提高了100.3%和110.6%;其次为香草酸,分别提高了56.9%和80.9%;紫丁香酸则分别提高了55.8%和41.0%;阿魏酸分别提高了33.7%和41.1%;芥子酸分别提高了52.7%和57.2%。
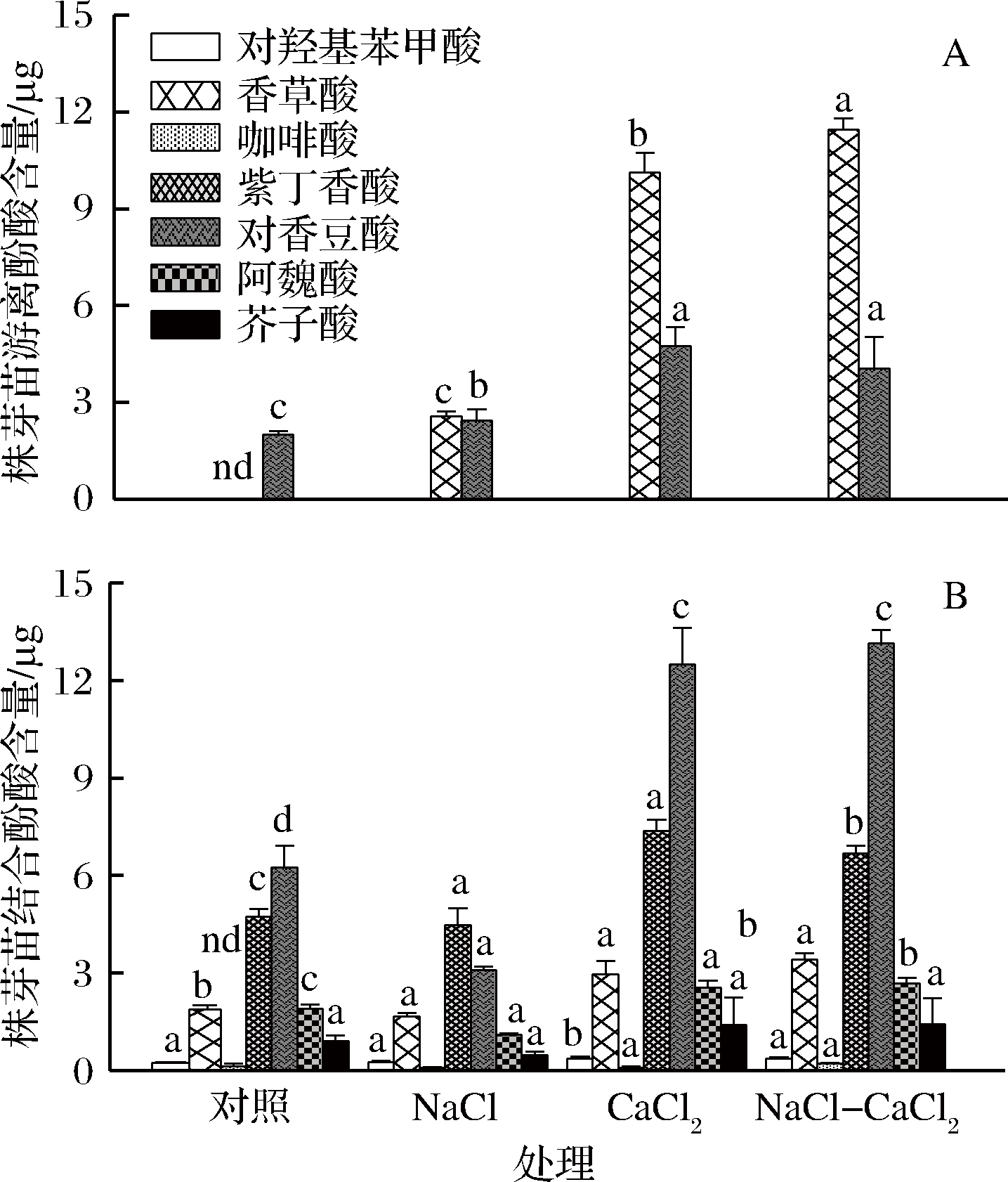
图3 不同处理对大豆芽苗游离酚酸(A)和结合酚酸(B)含量的影响
Fig.3 Effects of different treatments on the contents of free phenolic acids (A) and bound phenolic acids (B) in soybean sprouts
2.4 不同处理对大豆芽苗抗氧化能力的影响

图4 不同处理对大豆芽苗游离酚(A)和结合酚(B)DPPH清除能力的影响
Fig.4 Effects of different treatments on DPPH scavenging capacity of free phenolics (A) and bound phenolics (B) in soybean sprouts
由图4可看出NaCl和CaCl2对大豆芽苗的DPPH清除能力影响很大,无论游离酚还是结合酚的DPPH清除能力在NaCl、CaCl2处理下都得到了很大的提高,且NaCl-CaCl2联合处理的效果最为显著,其中游离酚的DPPH清除能力分别较对照组提高了8.3%,21.5%和27.6%,结合酚则分别提高了66.8%,230.6%和311.2%。不同处理条件下,大豆芽苗的ABTS清除能力变化趋势与DPPH清除能力基本一致,3种低盐处理均能使其显著增加(如图5所示)。通过与总酚、酚酸含量进行分析,可看出游离酚和结合酚的DPPH清除能力、ABTS清除能力与总酚含量呈正相关变化趋势。低盐处理可通过影响总酚和酚酸含量来影响大豆芽苗的抗氧化能力。由此可见,NaCl-CaCl2处理对增强大豆芽苗的酚类物质含量及提高其抗氧化能力具有重要作用。

图5 不同处理对大豆芽苗游离酚(A)和结合酚(B)ABTS清除能力的影响
Fig.5 Effects of different treatments on ABTS scavenging apacity of free phenolics (A) and bound phenolics (B) in soybean sprouts
3 讨论
已有研究表明,盐胁迫可以增加马郁兰中咖啡酸、香草酸、没食子酸和反式-2-羟基肉桂酸等酚酸的含量[29],通过NaCl处理也能在一定程度上提高糯米中对香豆酸、阿魏酸和原儿茶酸的含量[30]以及荞麦苗中酚酸,类胡萝卜素和抗氧化活性水平[31]。本实验证明除了胁迫下,低浓度的NaCl和CaCl2处理可有效提高大豆芽苗总酚和酚酸含量,提高其抗氧化能力。推测其机理,一方面与低盐促进大豆芽苗生长,加速游离态酚类化合物的释放和结合态酚类化合物的形成有关:其中Na+对植物细胞伸展和水分平衡效应有刺激作用,Na+能在液泡中代替K+产生溶质势,从而引起膨压的产生和细胞的伸展[32];而Ca2+在植物体内是以二价阳离子形式存在,是构成细胞壁的重要成分[33],Ca2+可以交联果胶的负电荷,从而维持细胞壁结构的稳定性并且参与植物的生长、发育、调节气孔开合等多个生理过程[34]。另一方面与钙作为植物细胞的第二信使,对环境信号等许多刺激有灵敏反应有关。低盐处理引起了植物胞内Ca2+水平的改变,产生Ca2+信号,钙是一些重要酶和辅酶的活化剂,细胞内的Ca2+可作为第二信使与环状多肽结合形成钙调素,参与多种生理生化过程及酶活性的调节,其中酚类物质合成的第一限速酶PAL能被Ca2+调节[35],进而促进多酚的富集。其他方面可能是由于低盐改变了植物生长环境,引起了植物内源激素水平的改变,进而影响了酚类等次级代谢产物的积累。另外,Ca2+对内源激素的调节功能起着强烈的修饰作用,钙信使系统可能在植物激素信号传递中起着重要作用,钙对激素的响应有放大的作用。外源Ca2+能促进种子乙烯的产生,适宜的Ca2+浓度能促进膜系统中ACC向乙烯的转化[36],而乙烯可诱导植物PAL基因的表达[37],进而引起酚类物质的富集。由此推测,CaCl2可能通过调节乙烯含量刺激酚类物质合成并在其中扮演信号传递的角色,这需要后续实验进行深入研究和系统分析,彻底理清NaCl和CaCl2的调节机制、刺激信号传导以及对其它激素的作用。
参考文献
[1] TERPINC P, ![]() H. A kinetic approach for evaluation of the antioxidant activity of selected phenolic acids[J]. Food Chemistry, 2010, 121: 366-371.
H. A kinetic approach for evaluation of the antioxidant activity of selected phenolic acids[J]. Food Chemistry, 2010, 121: 366-371.
[2] PIETTA P, MINOGGIO M, BRAMATI L. Plant polyphenols: structure, occurrence and bioactivity. studies in natural[J]. Products Chemistry, 2003. 28(3): 257-312.
[3] 陈志杰,吴嘉琪,马燕,等. 植物食品原料中酚酸的生物合成与调控及其生物活性研究进展[J]. 食品科学, 2017, 39(7):1-11.
[4] CUEVA C, MORENO-ARRIBAS M V, MART N- LVAREZ P J, et al. Antimicrobial activity of phenolic acids against commensal, probiotic and pathogenic bacteria[J]. Research in Microbiology, 2010, 161(5): 372-382.
LVAREZ P J, et al. Antimicrobial activity of phenolic acids against commensal, probiotic and pathogenic bacteria[J]. Research in Microbiology, 2010, 161(5): 372-382.
[5] WANG L-Y, TANG Y-P, LIU X, et al. Effects of ferulic acid on antioxidant activity in Angelicae sinensis Radix, Chuanxiong rhizoma, and their combination[J]. Chinese Journal of Natural Medicines, 2015, 13(6): 401-408.
[6] WENG C-J, YEN G-C. Chemopreventive effects of dietary phytochemicals against cancer invasion and metastasis: phenolic acids, monophenol, polyphenol, and their derivatives[J]. Cancer Treatment Reviews, 2012, 38(1): 76-87.
[7] 代沙. 紫苏叶抗氧化物质提取、含量测定及抗氧化活性研究[D]. 雅安:四川农业大学, 2013: 57-59.
[8] XU L, ZENG Y, LONG G, et al. The Antioxidant activities and their relationship with the relative polyphenols and flavonols contents of several flowers extracts[J]. Chinese Wild Plant Resources, 2005, 24(1): 51-54.
[9] LUO X, WANG Y, LI Q, et al. Accumulating mechanism of γ-aminobutyric acid in soybean (Glycine max L.) during germination[J]. International Journal of Food Science & Technology,2018, 53(1): 106-111.
[10] WANG X, YANG R, JIN X, et al. Effect of supplemental Ca2+ on yield and quality characteristics of soybean sprouts[J]. Scientia Horticulturae, 2016, 198: 352-362.
[11] KAYEMBE N C, RENSBURG C J V. Germination as a processing technique for soybeans in small-scale farming[J]. South African Journal of Animal Science, 2013, 43(2): 167-173.
[12] HUANG X, CAI W, XU B. Kinetic changes of nutrients and antioxidant capacities of germinated soybean (Glycine max L.) and mung bean (Vigna radiata L.) with germination time[J]. Food Chemistry, 2014, 143(2): 268-276.
[13] JIAO C, YANG R, ZHOU Y, et al. Nitric oxide mediates isoflavone accumulation and the antioxidant system enhancement in soybean sprouts[J]. Food Chemistry, 2016, 204: 373-380.
[14] YANG R, FENG L, WANG S, et al. Accumulation of γ-aminobutyric acid in soybean by hypoxia germination and freeze-thawing incubation[J]. Journal of the Science of Food & Agriculture, 2016, 96(6): 2 090-2 096.
[15] SWIGONSKA S, AMAROWICZ R, KR L A, et al. Influence of abiotic stress during soybean germination followed by recovery on the phenolic compounds of radicles and their antioxidant capacity[J]. Acta Societatis Botanicorum Poloniae, 2014, 83(3): 209-218.
L A, et al. Influence of abiotic stress during soybean germination followed by recovery on the phenolic compounds of radicles and their antioxidant capacity[J]. Acta Societatis Botanicorum Poloniae, 2014, 83(3): 209-218.
[16] CHEN Z, YU L, WANG X, et al. Changes of phenolic profiles and antioxidant activity in canaryseed (Phalaris canariensis L.) during germination[J]. Food Chemistry, 2016, 194: 608-618.
[17] YANG R, HUI Q, ZHANG W, et al. Effects of CaCl2 on the metabolism of glucosinolates and the formation of isothiocyanates as well as the antioxidant capacity of broccoli sprouts[J]. Journal of Functional Foods, 2016(24): 156-163.
[18] ZAHEDI S M, NABIPOUR M, AZIZI M, et al. Effect of kinds of salt and its different levels on seed germination and growth of basil plant[J]. World Applied Sciences Journal, 2011, 15(7): 1 039-1 045.
[19] 季延海,于平彬,武占会,等. 低浓度NaCl对水培韭菜生长、产量及品质的影响[J]. 中国生态农业学报, 2015, 23(5): 628-633.
[20] 周熠玮,吴冠雄,肖承,等. 低浓度NaCl对荞麦芽苗菜生长和品质的影响[J]. 蔬菜, 2016(7): 6-7.
[21] 周峰,华春. 低浓度NaCl对菠菜生长的效应[J]. 西北农业学报, 2008, 17(6): 127-129.
[22] 李华,贺洪军,朱金英,等. 盐胁迫下氯化钙对黄瓜幼苗生长的影响[J]. 山东农业科学, 2010(8): 46-48.
[23] 戴高兴,彭克勤,皮灿辉. 钙对植物耐盐性的影响[J]. 中国农学通报, 2003, 19(3): 97-101.
[24] VAN H P. Phenolic compounds of cereals and their antioxidant capacity[J]. Critical Reviews in Food Science and Nutrition, 2016, 56(1): 25.
[25] KAFUI KWAMI ADOM, RUI HAI LIU. Antioxidant activity of grains[J]. Journal of Agricultural & Food Chemistry, 2002, 50(21): 6 182-6 187.
[26] KAUKOVIRTA-NORJA A, WILHELNSON A, POUTANEN K. Germination: A means to improve the functionality of oat[J]. Agricultural & Food Science, 2004, 13(1): 100-112.
[27] AMAROWICZ R, WEIDNER S. Content of phenolic acids in rye caryopses determined using DAD-HPLC method[J]. Journal of Food Science, 2001, 19(6): 201-205.
[28] 付晓燕,吴茜,李书艺,等. 燕麦发芽前后酚类物质的组成变化及结构鉴定[J]. 中国农业科学, 2013, 46(17): 3 669-3 679.
[29] OLFA B, HELA M, TARCHOUN I, et al. Salt effect on phenolics and antioxidant activities of Tunisian and Canadian sweet marjoram (Origanum majorana, L.) shoots[J]. Journal of the Science of Food & Agriculture, 2013, 93(1): 134-141.
[30] THAMMAPAT P, MEESO N, SIRIAMORNPUN S. Effects of NaCl and soaking temperature on the phenolic compounds, α-tocopherol, γ-oryzanol and fatty acids of glutinous rice[J]. Food Chemistry, 2015, 175: 218-224.
[31] LIM J H, PARK K J, KIM B K, et al. Effect of salinity stress on phenolic compounds and carotenoids in buckwheat (Fagopyrum esculentum M.) sprout[J]. Food Chemistry, 2012, 135(3): 1 065-1 070.
[32] MARSCHNER H, POSSINGHAM J V. Effect of K+ and Na+ on growth of leaf discs of sugar beet and spinach[J]. Zeitschrift Fü Pflanzenphysiologie, 1975, 75(1): 6-16.
[33] HEPLER P K, WINSHIP L J. Calcium at the cell wall-cytoplast interface[J]. Journal of Integrative Plant Biology, 2010. 52(2): 147-160.
[34] HEPLER P K. Calcium: a central regulator of plant growth and development[J]. Plant Cell, 2005, 17(8): 2 142.
![]() P, P
P, P REZ L M. Calcium ions promote the response of Citrus limon against fungal elicitors or wounding[J]. Phytochemistry, 1996, 42(3): 595-598.
REZ L M. Calcium ions promote the response of Citrus limon against fungal elicitors or wounding[J]. Phytochemistry, 1996, 42(3): 595-598.
[36] 关军锋,李广敏. 钙在植物乙烯生成及信号传递中的生理作用[J]. 植物学报, 2000, 17(5): 413-418.
[37] 刘金福,李晓雁,孟蕊. 苦荞发芽过程中促进黄酮合成的因素初探[J]. 食品工业科技, 2006(10): 106-108.