玉米(Zea mays L.)是禾本科玉蜀黍属1年生草本植物,在全球三大谷物中,总产量和平均单产均居于世界首位,也是我国的主要粮食作物之一。玉米生产季节性强,有研究表明,玉米在储藏过程中水分、可溶性糖、可溶性蛋白含量存在不同程度的下降,呼吸强度增大,直接影响了玉米的风味与食用品质[1]。特殊的玉米香气是玉米气味感官质量的独特特征,也是感官评定的重要指标之一。
食品中挥发性成分的提取方法主要包括超临界萃取法[2]、蒸馏萃取法、固相微萃取法等。顶空-固相微萃取(HS-SPME)技术由于其具有对样品处理简单[4]、萃取温度温和、低沸点挥发物损失少[5]、成本低[6]、环境友好[7]等特点,广泛应用于各类食品挥发性成分分析[8-10]。主成分分析(PCA)是一种多变量统计工具,通过数学降维的方法,用几个综合变量来代替原来众多的变量,可以简化数据并揭示变量间的关系[11]。目前,主成分分析作为一种多元分析技术已广泛应用于不同物质的挥发性风味成分的综合分析中[7, 12-13]。
在玉米挥发性风味物质检测方面,早在1978年,MICHAEL[14]等就采用GC-MS检测了玉米中挥发性风味物质。而近年来,国内学者也对玉米中挥发性成分进行了研究,例如:褚能明等[7]对不同品种的鲜食甜糯玉米挥发性风味进行了分析,宋江峰等对玉米罐头加工[15]和贮藏[16]过程中的挥发性风味进行了分析,马良[17]等研究了玉米常温贮藏下挥发性成分变化,但是目前对鲜食玉米在冻藏过程中挥发性风味成分的研究较少。本实验采用HS-SPME结合GC-MS,对不同冻藏温度下冻藏期间玉米挥发性风味成分的种类和相对含量进行分析,并对主要挥发性成分进行主成分分析,以期明确冻藏温度和时间对玉米风味的影响,为玉米冻藏保鲜提供理论指导。
1 材料与方法
1.1 材料与设备
糯玉米,购于重庆市大足区龙头农产品公司;BSA323S型电子天平,赛多利斯科学仪器(北京)有限公司;HH-S型恒温水浴锅,常州普天仪器制造有限公司;固相微萃取装置(配有50/30μm DVB/CAR/PDMS萃取头),美国Supelco公司;QP2010型气相色谱—质谱联用仪(配有EI离子源及GC-MS solution 2.50工作站),日本岛津公司。
1.2 方法
1.2.1 样品处理
取无损无伤的新鲜玉米,去掉最外一层包衣后,分别在-4、-18、-40℃条件下贮藏,在1、2、3个月时分别取样,对挥发性风味物质进行测定和分析。为方便表示,3个温度依次为T1、T2、T3,3个贮藏时间依次为S1、S2、S3。
1.2.2 挥发性风味成分的提取
采用HS-SPME方法对玉米挥发性风味物质进行采集,参考LAOPONGSIT等[18]和马良等[17]的方法,略做改动。
取3.5 g完整无损的玉米粒样品,加入顶空进样瓶中,用聚四氟乙烯隔垫密封,手动插入50/30 μm DVB/CAR/PDMS萃取头,在70 ℃恒温水浴中萃取60 min。萃取完毕后,迅速插入气相色谱进样口,在250 ℃不分流模式下解析3 min。
1.2.3 气相色谱-质谱检测
气相色谱条件:色谱柱为DB-5MS毛细管柱(30 m×0.25 mm,0.25 μm);程序升温:柱温箱起始温度40 ℃,保持4 min;先以8 ℃/min速率升温至120 ℃,保持5 min;再以6 ℃/min速率升温至250 ℃,保持5 min;载气为高纯氦气,柱流量1.0 mL/min,压力49.7 kPa;进样口温度250 ℃;进样量1 μL;进样方式:不分流模式。
质谱条件:离子源温度200 ℃,接口温度250 ℃;溶剂延迟时间3.1 min;电离方式为EI;电子能量70 eV;质量扫描范围(m/z)为35~400,扫描速度769 u/s,采集方式为SCAN模式。
1.2.4 挥发性成分定性与定量分析
定性分析:经GC-MS分析后,通过计算机检索与仪器所配置的NIST08、NIST08s、PEST_EI、PESTEI_3标准谱库进行对照确定,筛选记录匹配度大于80(最大值为100)的物质。定量分析:按峰面积归一化法进行,求得各挥发性成分的相对百分含量。
1.2.5 数据统计分析
采用IBM SPSS Statistics 20.0软件对玉米挥发性物质进行主成分分析(PCA)。
2 结果与分析
2.1 玉米不同贮藏阶段挥发性成分的总体结果
从9个样品中共检测出259种挥发性成分,其中烃类83种、醇类18种、酮类26种、醛类38种、酸类19种、酯类60种、其他类15种。在S1T1、S1T2、S1T3、S2T1、S2T2、S2T3、S3T1、S3T2、S3T3中分别检测出了106、118、138、78、89、78、99、95、85种挥发性成分,如表1所示。
表1 不同贮藏阶段挥发性成分种类及相对含量
Table 1 Chemical categories and relative amounts of volatile compounds during storage

注:S1、S2、S3分别代表贮藏1、2、3个月,T1、T2、T3分别代表贮藏温度为-4、-18、-40 ℃。
随着贮藏时间的增加,当贮藏温度为-4 ℃(T1)和-18 ℃(T2)时,烃类物质相对含量呈先增加后减少趋势;醇类物质种类数量及相对含量均不断增加;酮类物质种类不断减少。当贮藏温度为-18 ℃(T2)与-40 ℃(T3)时,醛、酸、酯类物质相对含量呈先减少后增加趋势。存在区别的是,当贮藏温度为-4 ℃(T1)时,醛类物质相对含量不断增加;酸类物质的种类数量和相对含量均不断降低。而当贮藏温度为-40 ℃(T3)时,烃类物质相对含量逐渐增加;醇类物质种类数量不断增加,而相对含量呈先增加后降低趋势;酮类物质种类数量与相对含量不断减少。
另外,当贮藏时间为1个月时(S1),贮藏温度越低,烃类、酮类物质种类数量越多,相对含量越小;与-4 ℃和-40 ℃相比,在-18 ℃贮藏环境下,醇类、醛类物质相对含量较大,酸类、酯类物质相对含量较小。当贮藏时间为2个月(S2)时,贮藏温度越低,醇类物质相对含量越大;醛、酸、酯类物质在-4 ℃贮藏环境下相对含量较多;烃类、酮类物质在-18 ℃贮藏环境下种类数量与相对含量较大。当贮藏时间为3个月(S3)时,贮藏温度越低,烃、酮、酯类物质相对含量越大;醛类物质种类数量和相对含量越低;与-4 ℃和-40 ℃相比,-18 ℃贮藏环境下的醇类、酸类物质相对含量较大。
2.2 玉米贮藏过程中主要挥发性成分的变化分析
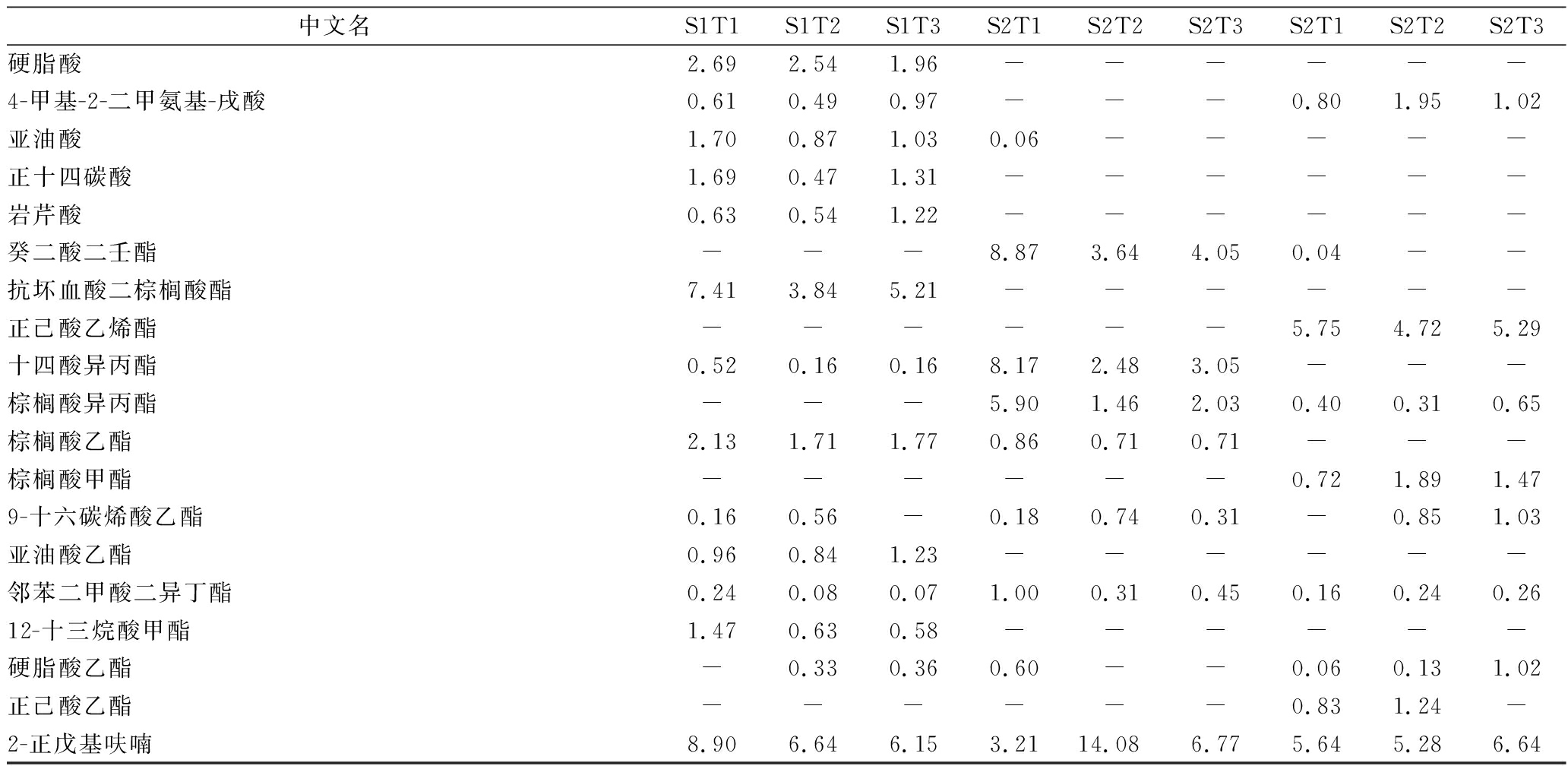
检测到的63种主要挥发性成分在各样品中的相对含量如表2所示。
表2 不同贮藏阶段的主要挥发性成分及相对含量
Table 2 Relative contents and identification of major components during storage

续表2
注:S1、S2、S3分别代表贮藏1、2、3个月,T1、T2、T3分别代表贮藏温度为-4、-18、-40 ℃。
2.2.1 烃类物质变化
烷烃是植物蜡质重要组成部分之一,在自然界植物的叶、茎、花以及果实等器官和组织的表面广泛存在,常应用于植物个体差异性和种群多样性研究[19]。由表2可知,正十七烷、正十六烷、2,6,10-三甲基-十五烷等的相对含量在贮藏期间均呈先上升后下降趋势,且-4 ℃贮藏时变化更明显。虽然烃类物质总相对含量较高,但通常其阈值较高,根据香味物质与分子结构的理论可知[3],烃类物质对玉米风味的贡献不大。
2.2.2 醇类物质变化
在贮藏期间,醇类物质种类由2~4种增加至7~10种,相对含量增加的有饱和醇(正己醇)、半萜醇(芳樟醇、柏木醇)、烯醇(顺-3-壬烯-1-醇)等,这可能来源于脂氧合酶对部分脂肪酸的氧化作用、醇脱氢酶对部分醛类物质的还原作用[20]、酯类物质的水解反应[21]等。通过比较三种贮藏温度发现,-4 ℃与-18 ℃贮藏时的种类数量变化较大,表明-4 ℃与-18 ℃条件下比更低温度贮藏时更易发生上述反应,产生了新的醇类物质。饱和醇风味阈值较高,香味不明显;不饱和醇阈值较低,具有蘑菇香气[21],对玉米香气存在一定贡献。
2.2.3 酮类物质变化
酮类物质具有一定果香味,由表1可知,在贮藏期间酮类物质种类由15~19种减少至10种,相对含量由12.58%~14.45%减少至9.13%~10.39%。与其他两个贮藏温度相比,当贮藏1个月时,-4 ℃贮藏温度下酮类物质相对含量较高,而当贮藏2、3个月时,-40 ℃贮藏温度下酮类物质相对含量较高。从表2可看出,2-庚酮的相对含量在酮类物质中所占比例最大(近一半),由于其具有类似梨的水果香味,对玉米香气风味有一定的保持作用。贮藏2、3个月时,-18 ℃、-40 ℃下的2-庚酮相对含量均高于-4 ℃条件下,表明冻藏温度越低时,保持效果越好。2,3-辛二酮、4-甲基二苯甲酮在三个温度贮藏到第3个月时均变为未检出,而前者具有甜的奶油香,说明在贮藏期间玉米特有的香气风味存在逸散。2-壬酮、3-辛烯-2-酮、3,5-辛二烯-2-酮、1-辛烯-3-酮的相对含量波动较大,可能由于香气的逸散和美拉德反应、不饱和脂肪酸氧化分解反应[16]的共同作用。有研究表明,一些酮类物质在低阈值时与醛类或其他物质存在相互作用,产生气味增强或改变现象[21]。
2.2.4 醛类物质变化
醛类物质是挥发性成分的重要组成,多具有果香等令人愉悦的香味,因为阈值较低,对风味形成起重要的作用[23]。本研究检出的醛类主要包括饱和醛(己醛、庚醛、壬醛等)、单烯醛(反式-2-壬烯醛、反式-2-辛烯醛),多为直链醛。结果表明,癸醛、辛醛、十二醛、7-十六烯醛等醛类物质在贮藏3个月时相对含量均呈下降趋势,壬醛在贮藏2个月时相对含量下降。其中,壬醛有花香和柑橘味、癸醛具有柑橘味和糖果味、辛醛有青草味和水果香、十二醛具有椰子香[17],表明在贮藏期间玉米特有的香气风味逐渐散失。而壬醛相对含量在第3个月时上升,己醛、反式-2-壬烯醛、反式-2-辛烯醛在贮藏3个月期间相对含量呈上升趋势,推测其来源于不饱和脂肪酸的部分氧化。当贮藏3个月时,贮藏温度越高,乙醛相对含量越大,其中-4 ℃下己醛相对含量最高达到32.3%,表明在-4 ℃贮藏温度下存在较大反应。各醛类物质相对含量变化不一,可能由于不饱和脂肪酸氧化分解生成和酯化反应消耗的共同作用。
2.2.5 酸类物质变化
由表1可知,随着贮藏时间的增加,-4、-18、-40 ℃条件下酸类物质种类数量分别由11、9、16种减少至2、2、1种,相对含量分别由19.26%、10.83%、18.59%减少至0.88%、2.08%、1.02%。由表2可知,相对含量较高的反油酸、硬脂酸、亚油酸、十四碳酸等多种酸类物质在3个温度贮藏时均减少至未检出,表明在本实验条件下存在酸类物质的大量减少,这与不饱和脂肪酸存在氧化的推测相符合。贮藏1个月时,贮藏温度越高,反油酸、硬脂酸相对含量越高,这可能与脂肪分解有关。脂肪酸含量通常被视为谷物类品质劣变的重要指标之一[24],玉米在禾谷类粮食中脂肪含量较高,贮藏过程中易发生脂类的分解,产生脂肪酸。而本研究中并无脂肪酸的大量增加,表明玉米在本实验贮藏条件下无大量脂类分解,与马良[17]等的25 ℃常温贮藏存在差异。
2.2.6 酯类物质变化
酯类物质也是玉米挥发性成分的重要组成部分,多具有水果样芳香味[25],对玉米香气起重要作用[26]。随着贮藏时间的增加,酯类物质种类由27~34种减少至16~23种,相对含量由14.15%~21.06%减少至9.61%~12.72%。其中,抗坏血酸二棕榈酸酯、棕榈酸乙酯、亚油酸乙酯、12-十三烷酸甲酯4种酯类在3个贮藏温度下贮藏1个月时含量较高,占酯类总相对含量的近一半,在贮藏3个月时均减少至未检出,表明酯类物质在本实验贮藏条件下减少,可能由于水解反应的结果[21]。其中,棕榈酸乙酯具有奶油香气,表明在贮藏期间玉米特有的香气风味成分存在减少情况。此外,贮藏1个月时,贮藏温度越低,抗坏血酸二棕榈酸酯、棕榈酸乙酯、12-十三烷酸甲酯相对含量越小。癸二酸二壬酯、十四酸异丙酯、棕榈酸异丙酯在贮藏2个月时突然增加,且-4 ℃贮藏下比-18 ℃和-40 ℃增加较多,可能由于酯化反应的结果。
2.3 玉米贮藏过程中主要挥发性成分的主成分分析结果
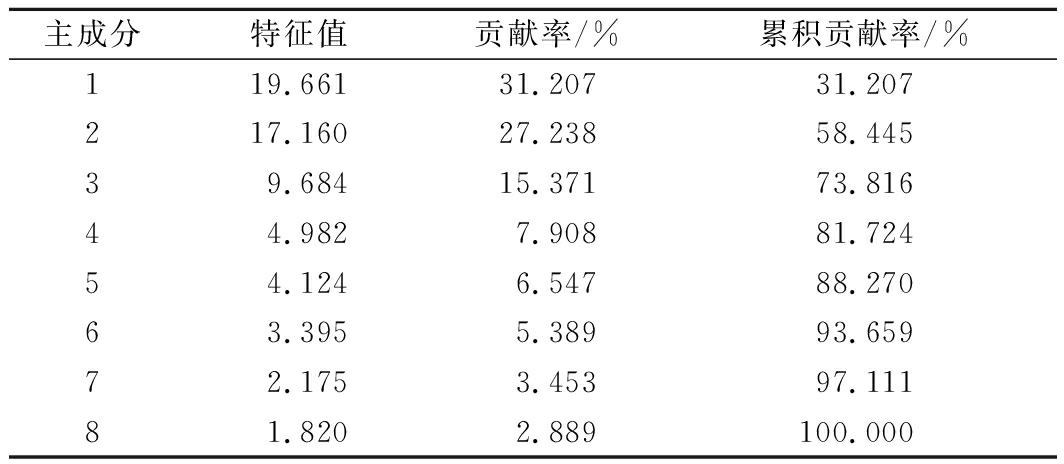
使用SPSS 20.0软件对主要挥发性成分进行主成分分析,提取特征根大于1的主成分,得到主成分的特征值和特征向量见表3。由表3可知,第1主成分的贡献率为31.207%,第2主成分的贡献率为27.238%,第3主成分的贡献率为15.371%,第4主成分的贡献率为7.908%,第5主成分的贡献率为6.547%。前5个主成分的累计贡献率达88.270%,基本代表了样品主要挥发性成分的组成,反映了原始变量的绝大部分信息,达到了降维目的。
表3 主成分的特征值及其贡献率
Table 3 Eigenvalues, contribution and cumulative contribution of 5 principal components
由表4主成分载荷矩阵可知各主成分各变量的载荷值。
第1主成分中载荷较高的正影响挥发性成分有棕榈酸乙酯、癸醛、2,3-辛二酮、4-甲基二苯甲酮、辛醛,载荷值分别为0.839、0.819、0.770、0.741、0.719,主要指向醛、酮类物质;负向影响最大的为正己酸乙烯酯,载荷值为-0.958。
第2主成分中载荷较高的正影响挥发性成分依次为植烷、癸二酸二壬酯、棕榈酸异丙酯、邻苯二甲酸二异丁酯、十四酸异丙酯、2-甲基-3-乙基-1,3-己二烯,载荷值分别为0.962、0.858、0.832、0.798、0.796、0.790,主要指向酯类物质;负向影响最大的为7-十六烯醛,载荷值为-0.817。
第3主成分中载荷较高的正影响挥发性成分的依次为2,6-二甲基-6-(4-甲基-3-戊烯基)双环[3.1.1]庚-2-烯、2-正戊基呋喃、1,7-二甲基-7-(4-甲基-3-戊烯基)-三环[2.2.1.0(2,6)]庚烷、1-甲基-4-(5-甲基-1-亚甲基-4-己烯基)环己烯、3-辛烯-2-酮,载荷值分别为0.953、0.927、0.917、0.880、0.838,主要指向不饱和环烃类物质;负向影响最大的为苯甲醛,载荷值为-0.660。
表4 主成分载荷矩阵
Table 4 Principal component loading matrix
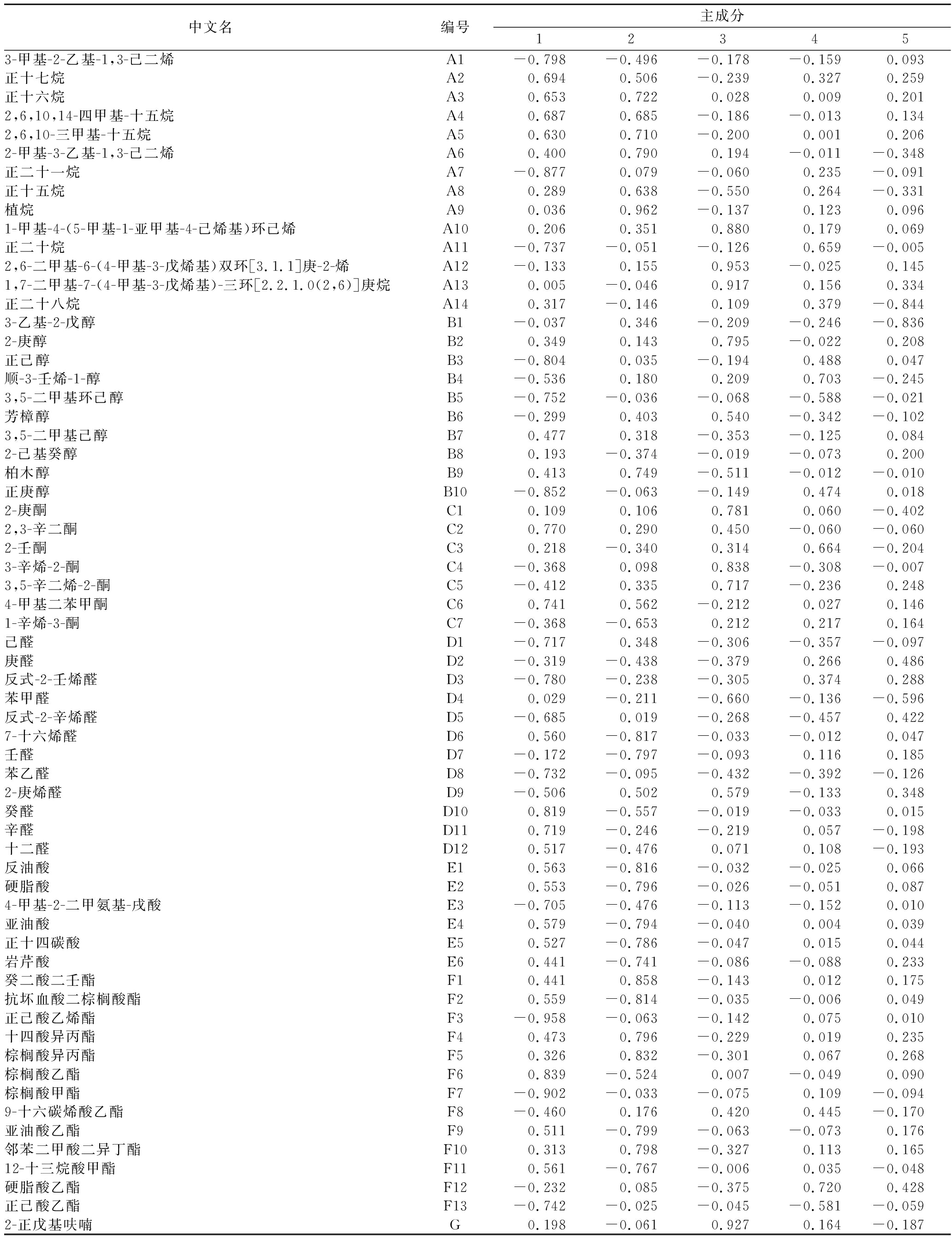
第4主成分中贡献最大的是硬脂酸乙酯、顺-3-壬烯-1-醇,载荷值分别为0.720、0.703;负向影响最大的为3,5-二甲基环己醇,载荷值为-0.588。第5主成分中载荷较高的正影响挥发性成分是庚醛,载荷值为0.486;负向影响最大的为正二十八烷,载荷值为-0.844。
主成分载荷矩阵显示了各变量与各主成分之间的关系,数值的绝对值越大,表明该指标与某一主成分的联系紧密程度越大,反映了该指标在该主成分上的载荷程度;载荷值小的挥发性成分对玉米的挥发性风味贡献小,同时也表明它的含量极低或未检出。第1主成分和第2主成分的累计贡献率为58.445%,说明这2个主成分对玉米挥发性成分的贡献超过一半。由此可见,醛、酮、酯类物质对玉米挥发性成分影响较大,可以认为,棕榈酸乙酯、癸醛、2,3-辛二酮、4-甲基二苯甲酮、辛醛、植烷、癸二酸二壬酯、棕榈酸异丙酯、邻苯二甲酸二异丁酯、十四酸异丙酯是玉米挥发性成分的主要特征化合物。
由表3可知,前2个主成分累计贡献率为58.445%,前3个主成分累计贡献率为73.816%,说明前2、3个主成分对玉米挥发性成分的贡献均超过一半。分别作63种挥发性成分和9个样品的主成分散点图,2D图分别以PCA 1、PCA 2为X、Y轴,3D图分别以PCA 1、PCA 2、PCA 3为X、Y、Z轴,见图1、图2。

图1 63种挥发性成分的主成分散点图
Fig.1 PCA biplot for 63 volatile components
由图1-a图可知,大部分挥发性成分处于一、二、四象限。由图2可以看出,9个样品呈明显的三组分布,S1T1、S1T2、S1T3为一组、S2T1、S2T2、S2T3为一组、S3T1、S3T2、S3T3为一组,表明贮藏时间对挥发性成分影响较大;S1T2、S1T3相比S1T1较为接近、S2T2、S2T3相比S2T1较为接近、S3T1、S3T2、S3T3较为接近,表明在贮藏1、2个月时,-18 ℃和-40 ℃相比-4 ℃贮藏下挥发性成分较为接近,在贮藏3个月时,3种贮藏温度下玉米挥发性成分整体差异不大。
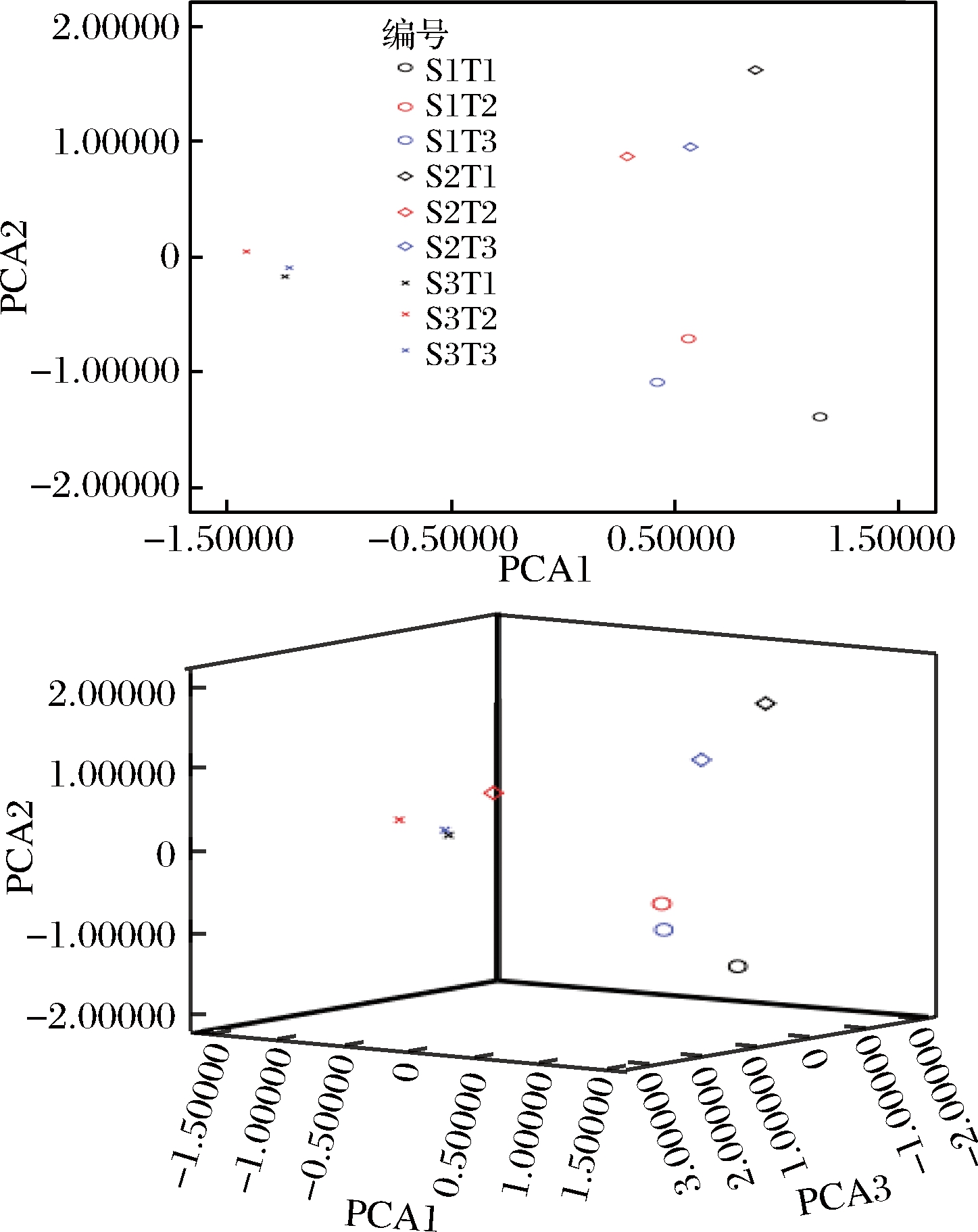
图2 9个样品的主成分散点图
Fig.2 PCA biplot for 9 corn samples
3 结论
通过HS-SPMC结合GS-MS技术,对不同冻藏温度下贮藏期间玉米挥发性风味成分的种类和相对含量进行分析,共检出烃类、醇类、醛类、酮类、酸类、酯类和少量其他类7大类物质,共259种。研究发现,随着贮藏时间的增加,醛、酸、酯类物质在贮藏温度为-18 ℃与-40 ℃时相对含量呈先减少后增加趋势;醇类物质在贮藏温度为-4 ℃和-18 ℃时种类数量及相对含量均不断增加。此外,当贮藏1个月时,贮藏温度越低,烃类、酮类物质相对含量越小;贮藏3个月时,贮藏温度越低,烃、酮、酯类物质相对含量越大;而醛类物质种类与相对含量越小。
选取63种主要挥发性成分,利用多元统计软件进行主成分分析,结果表明,前5个主成分累计贡献率达88.270%,基本反映了玉米挥发性成分的整体信息。挥发性成分主要指向醛、酮、酯类物质,棕榈酸乙酯、癸醛、2,3-辛二酮、4-甲基二苯甲酮、辛醛、植烷、癸二酸二壬酯、棕榈酸异丙酯、邻苯二甲酸二异丁酯、十四酸异丙酯是玉米挥发性成分的主要特征化合物。从样品主成分散点图可看出,9个样品呈明显的3组分布,表明贮藏时间对挥发性成分影响较大;在贮藏1、2个月时,-18 ℃和-40 ℃相比-4 ℃贮藏下挥发性成分较为接近,在贮藏3个月时,3种贮藏温度下玉米的挥发性成分整体差异不大。综合考虑经济因素表明在-18 ℃下贮藏2个月可较好地保存玉米的挥发性风味物质。
参考文献
[1] 谢玉花,宋洪波,刘升,等. 贮藏温度和薄膜包装对甜玉米呼吸强度及品质的影响[J]. 食品科学, 2014,35(2):282-286.
[2] 谢跃杰,贺稚非,李洪军. 超临界CO2流体萃取兔肉腥味物质[J]. 中国农业科学, 2016,49(16):3 208-3 218.
[3] 谢正敏,练顺才,叶华夏,等. 玉米蒸煮香气成分的研究[J]. 酿酒科技, 2012(9):68-71.
[4] FRATINI G, LOIS S, PAZOS M, et al. Volatile profile of atlantic shellfish species by HS-SPME GC/MS[J]. Food Research International, 2012,48(2):856-865.
[5] LV H, ZHONG Q, LIN Z, et al. Aroma characterisation of pu-erh tea using headspace-solid phase microextraction combined with GC/MS and GC-olfactometry[J]. Food Chemistry, 2012,130(4):1 074-1 081.
[6] DU L, LI J, LI W, et al. Characterization of volatile compounds of pu-erh tea using solid-phase microextraction and simultaneous distillation-extraction coupled with gas chromatography-mass spectrometry[J]. Food Research International, 2014,57:61-70.
[7] 褚能明,柯剑鸿,袁亮. 不同鲜食甜糯玉米挥发性风味物质主成分分析[J]. 核农学报, 2017,31(11):2 175-2 185.
[8] SHA S, CHEN S, QIAN M, et al. Characterization of the typical potent odorants in chinese roasted sesame-like flavor type liquor by headspace solid phase microextraction-aroma extract dilution analysis, with special emphasis on sulfur-containing odorants[J]. Journal of Agricultural and Food Chemistry, 2017,65(1):123-131.
[9] JULIAN Cuevas F, MORENO R M, JOSE R M. Assessing a traceability technique in fresh oranges (Citrus sinensis L. Osbeck) with an HS-SPME-GC-MS method. Towards a volatile characterisation of organic oranges[J]. Food Chemistry, 2017,221:1 930-1 938.
[10] DU L, LI J, LI W, et al. Characterization of volatile compounds of pu-erh tea using solid-phase microextraction and simultaneous distillation-extraction coupled with gas chromatography-mass spectrometry[J]. Food Research International, 2014,57:61-70.
[11] BRO R, SMILEDE A K. Principal component analysis[J]. Analytical Methods, 2014,6(9):2 812-2 831.
[12] TIAN X, CAI Q, ZHANG Y. Rapid classification of hairtail fish and pork freshness using an electronic nose based on the PCA method[J]. Sensors, 2012,12(1):260-277.
[13] ZHOU Q, YANG M, HUANG F, et al. Effect of pretreatment with dehulling and microwaving on the flavor characteristics of cold-pressed rapeseed oil by GC-MS-PCA and electronic nose discrimination[J]. Journal of Food Science, 2013,78(7):C961-C970.
[14] LEGENDRE M G, DUPUY H P, ORY R L, et al. Instrumental analysis of volatiles from rice and corn products[J]. Journal of Agricultural and Food Chemistry, 1978,26(5):1 035-1 038.
[15] 刘春泉,宋江峰,刘玉花,等. 京甜紫花糯2号玉米软罐头加工过程中风味成分变化[J]. 核农学报, 2010,24(3):555-561.
[16] 宋江峰,李大婧,刘春泉. 贮藏过程中京甜紫花糯2号玉米软罐头的主要挥发性风味成分的变化[J]. 核农学报, 2011,25(5):980-987.
[17] 马良,王若兰. 玉米储藏过程中挥发性成分变化研究[J]. 现代食品科技, 2015,31(7):316-325.
[18] LAOPONGSIT W, SRZEDNICKI G, CRASKE J. Preliminary study of solid phase micro-extraction (SPME) as a method for detecting insect infestation in wheat grain[J]. Journal of Stored Products Research, 2014,59:88-95.
[19] 段中华,全小龙,乔有明,等. 高寒草甸植物正构烷烃特征分析[J]. 草业学报, 2016,25(6):136-147.
[20] FELLMAN J K, MILLER T W, MATTINSON D S, et al. Factors that influence biosynthesis of volatile flavor compounds in apple fruits[J]. Hort Science, 2000,35(6):1 026-1 033.
[21] 潘冰燕,鲁晓翔,张鹏,等. GC-MS结合电子鼻分析1-MCP处理对线椒低温贮藏期挥发性物质的影响[J]. 食品科学, 2016,37(2):238-243.
[22] 李天元,张鹏,李江阔,等. 贮藏微环境气体调控对蓝莓冷藏期果实品质及挥发性物质的影响[J]. 食品与发酵工业, 2016,42(8):226-234.
[23] 程焕.杨梅风味特征组分鉴定及变化规律的研究[D]. 杭州:浙江大学, 2017.
[24] RANI P R, CHELLADURAI V, JAYAS D S, et al. Storage studies on pinto beans under different moisture contents and temperature regimes[J]. Journal of Stored Products Research, 2013,52(52):78-85.
[25] 唐柯,马玥,徐岩,等. 冰葡萄酒重要风味化合物嗅觉阈值的研究[J]. 食品与发酵工业, 2016,42(1):148-151.
[26] TEOH L S, LASEKAN O, AZEEZ S. Quality characteristics and volatile compounds of foam mat dried corn flour[J]. Journal of Food Quality, 2016,39(5):456-464.