卡马西平是一种神经系统类药物,具有抗惊厥、抗外周神经痛、抗利尿、抗心律失常等作用,临床上广泛应用。但卡马西平副作用很大,如:胃部不适反应、过敏反应、头晕嗜睡、发热、恶心、呕吐、乏力、再生障碍性贫血和中毒性肝炎等。当用药过量时,卡马西平还可透过胎盘屏障,通过乳汁分泌,对孕妇和哺乳人体造成不良影响,对老年人,则可引起精神错乱、焦虑、激动不安、房室传导阻滞或心动过缓等。可见合理使用卡马西平对人体健康有着重要意义。
畜牧业中,为了预防和治疗畜禽疫病,促进畜禽快速增重、催肥,有的甚至为了达到谋取更多经济利益的目的,广泛使用各种药物,其中包括使用大量的抗生素、磺胺类及镇静、抗惊厥药物等。这些药物使用后,部分药物被分解或直接排出体外,另一部分将残留在畜禽体内,残留的药物将对食用者造成不良影响,若长时间食用含这些残留药物的食品,这些药物会在体内蓄积,当达到一定浓度,则会对机体产生毒性作用;使某些细菌产生抗药性,当发生疾病时,再用药物治疗则会相当困难;过敏反应,严重者可造成休克;造成菌群平衡失调,导致长期腹泻或引起维生素缺乏;有的残留药物还具致癌作用等。我国农业部176 号公告规定,严禁在动物饲料和饮用水中添加镇静、抗惊厥药物,在动物源食品中也不得检出此类药物。鉴于此,研究动物源性食品中残留的镇静、抗惊厥药物——卡马西平具有一定意义。目前,国内外检测卡马西平的方法主要有:高效液相色谱法[1-9]、液质联用[10-13]、荧光法[14]、分光光度法[15]、电化学法[16-19] 等。已报道的分光光度法中,文献[15] 的表观摩尔吸光系数只有1.9×103 L/(mol·cm),灵敏度较低。本工作以固绿FCF作探针,采用多波长可见吸收光谱法(表观摩尔吸光系数为5.13×104~1.76×105 L/(mol·cm))来研究畜禽肉中残留卡马西平的含量,尚未见文献报道。
1 材料与方法
1.1 材料与试剂
三羟甲基氨基甲烷(Tris):99.9%,齐一生物科技(上海)有限公司;卡马西平对照品:99.7%,中国食品药品检定研究院,批号:100142-201105;固绿FCF:99%,上海如吉生物科技发展有限公司;盐酸:AR级,重庆川东(化工)集团有限公司;猪肉(1#)、兔肉(2#)、鸭肉(3#):市售。
Tris-HCl溶液:pH值3.0~9.5(用0.20 mol/L Tris与0.10 mol/L HCl混合,酸度计测定);卡马西平(carbamazepine,简写为CAM)标准贮备液:准确称取适量卡马西平对照品,加少量甲醇溶解,转移至100 mL容量瓶中,用水定容,即配成质量浓度为236.3 mg/L的溶液,冰箱4℃ 保存,临用时稀释10倍;固绿FCF(fast green FCF,简写为FCF)溶液:准确称取适量固绿FCF,用水溶解后配成1.00×10-3 mol/L;二次蒸馏水;试剂均为分析纯。
1.2 仪器与设备
精密酸度计:pHS-3C型,上海虹益仪器仪表有限公司;紫外-可见-近红外分光光度计:U-4100型,日本日立公司。
1.3 样品处理
取市场采购的猪(1#)、兔(2#)、鸭(3#)生鲜肉样品洗净、去皮、切条、搅碎成肉末。分别准确称取样品1# 15.000 6 g,2# 15.000 2 g,3# 15.000 5 g于离心试管中,加入10 mL甲醇,搅拌均匀后超声提取40 min(使卡马西平充分溶出),再以4 000 r/min离心20 min,取上清液,再重复提取1次,2次上清液合并,加甲醇20 mL,超声提取30 min,以4 000 r/min离心30 min(使蛋白质变性沉淀),上清液转入100 mL烧杯中,在通风橱内100 ℃恒温水浴中浓缩至3 mL左右,即为待测样品溶液。各平行处理5份。
1.4 实验方法
取10 mL具塞比色管,准确加入0.50 mL pH 3.59 Tris-HCl溶液、适量23.63 mg/L CAM标准溶液及2.00 mL 1.00×10-3 mol/L FCF溶液,用水定容,摇匀,静置10 min后,以试剂空白作参比,在分光光度计上扫描吸收光谱,记录可见光区3个明显负吸收峰处的吸光度A424、A558 及A660,用单波长、双波长或三波长法作显色条件及样品分析。
2 结果与分析
2.1 二元缔合物的吸收光谱特征
由图1可见,CAM基本无吸收;FCF的酸性溶液有强吸收,λmax=625 nm,A=2.33;FCF在pH值3.59 的溶液中加入不同浓度的CAM标准溶液后,体系溶液颜色变浅,发生褪色现象,光谱曲线上出现3个明显的负吸收峰,最大、次大和相对最小的负吸收峰分别位于660 nm(红移35 nm)、558 nm(蓝移67 nm)和424 nm(紫移201 nm)。波移表明,CAM和FCF在酸性Tris-HCl介质中确实生成了新物质;再从CAM和FCF的结构看,FCF是1种三苯甲烷类的酸性染料,结构中含有3个磺酸根离子,CAM结构中有含孤对电子的氮原子,可以接受质子形成阳离子,因此,这二者间可以静电引力结合,这进一步表明CAM和FCF之间确实可以反应生成新物质。从曲线3~10 可知,随着CAM质量浓度的增加,3个负吸收波长处的负吸光强度呈线性增大,即一定质量浓度范围的CAM与新物质的吸光度绝对值(│A│)在424 nm、558 nm及660 nm处呈线性关系,服从朗伯-比尔定律。由于吸光度具有加和性,可用双波长(558 nm+660 nm)或三波长(424 nm+558 nm+660 nm)叠加法测定CAM,并服从朗伯-比尔定律,其灵敏度以可见光(visible light, VIS)区单波长法(single wavelengh method, SWO)、双波长法(double wavelength method, DWO)到三波长法(three wavelength method, TWO)依次增大。故单波长、双波长及三波长法均可用于CAM的定量测定。
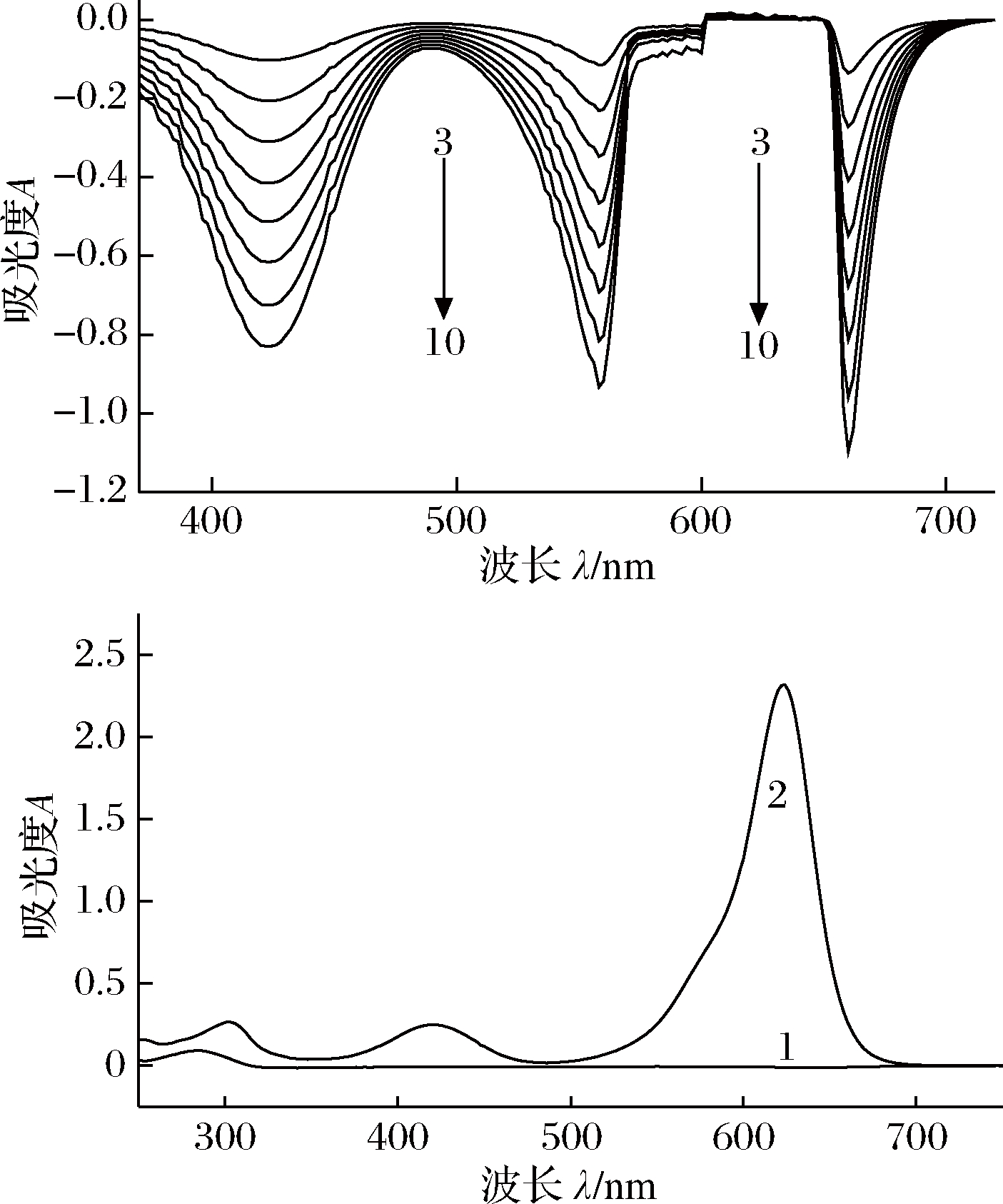
1-CAM(2.36 mg/L), 水作参比;2-FCF (2.00×10-5 mol/L), 水作参比; 3~10-CAM(0.473, 0.945, 1.42, 1.89, 2.36, 2.84, 3.31, 3.78 mg/L)-FCF(2.00×10-4 mol/L), 试剂空白作参比;pH 3.59
图1 CAM-FCF的吸收光谱
Fig.1 The absorption spectra of CAM-FCF
2.2 反应条件
2.2.1 反应介质及pH值的选择
室温下,按实验方法考察了HAc-NaAc、Tris-HCl、HCl、NaOH溶液对体系在可见光区424、558及660 nm 3个波长处的吸光度绝对值(│A│),结果表明,体系在Tris-HCl溶液中,│A│较大且重现性较好,故实验用Tris-HCl作介质。继而考察了不同pH值的Tris-HCl溶液在3个负吸收波长处的│A│,如图2所示。结果表明,pH 3.59时,│A│最大,体系有高灵敏度。实验选用pH值3.59 Tris-HCl溶液,最佳用量为0.50 mL。图2表明,TWO-VIS法的灵敏度最高,DWO-VIS次之。
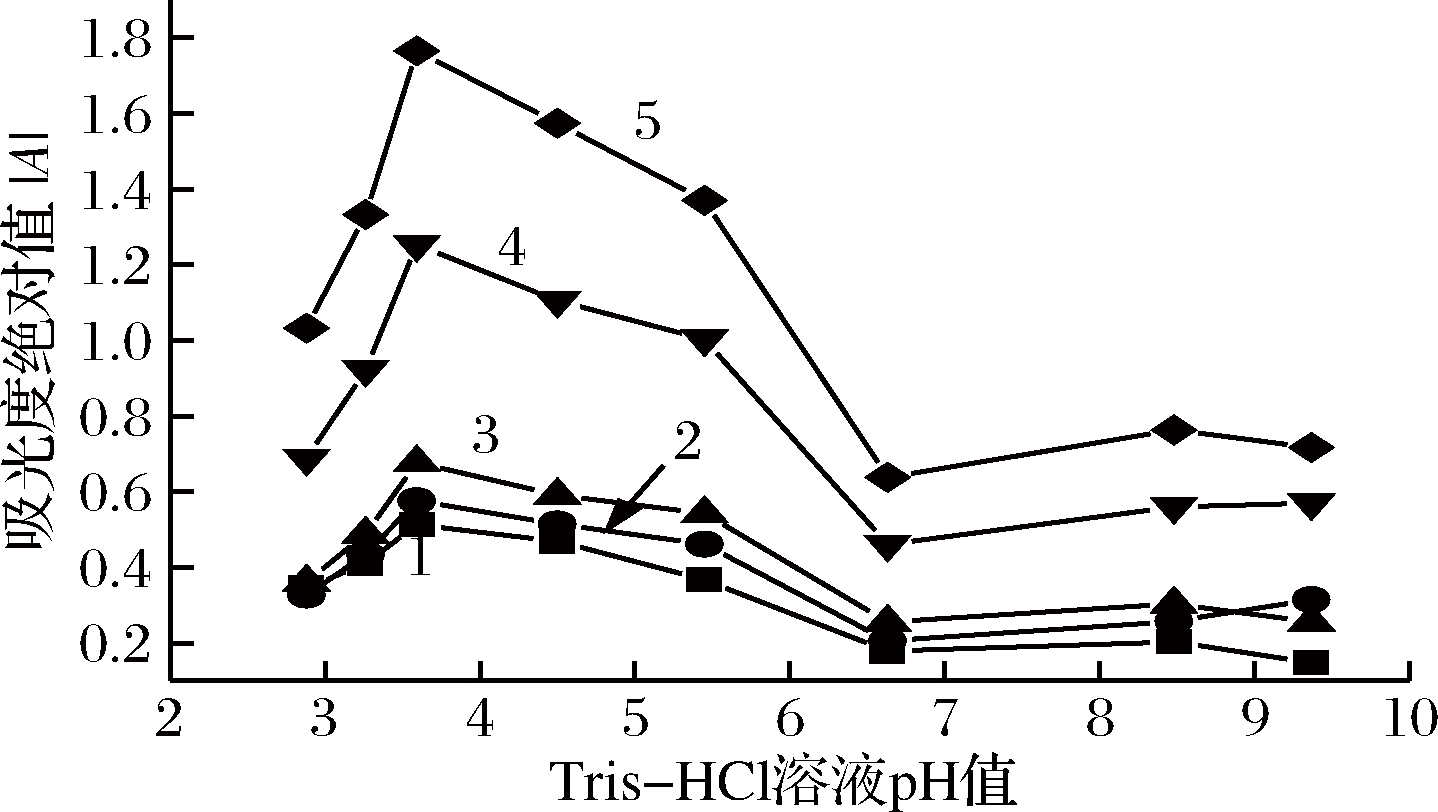
1-424 nm; 2-558 nm; 3-660 nm; 4-(558+660) nm;5-(424+558+660) nm
图2 pH值对│A│的影响
Fig.2 Effect of buffer pH on │A│
2.2.2 FCF溶液浓度的选择
室温下,按实验方法考察了1.00×10-3 mol/L FCF溶液在不同用量时对可见光区424、558及660 nm 3个负吸收波长处的│A│,图3所示。
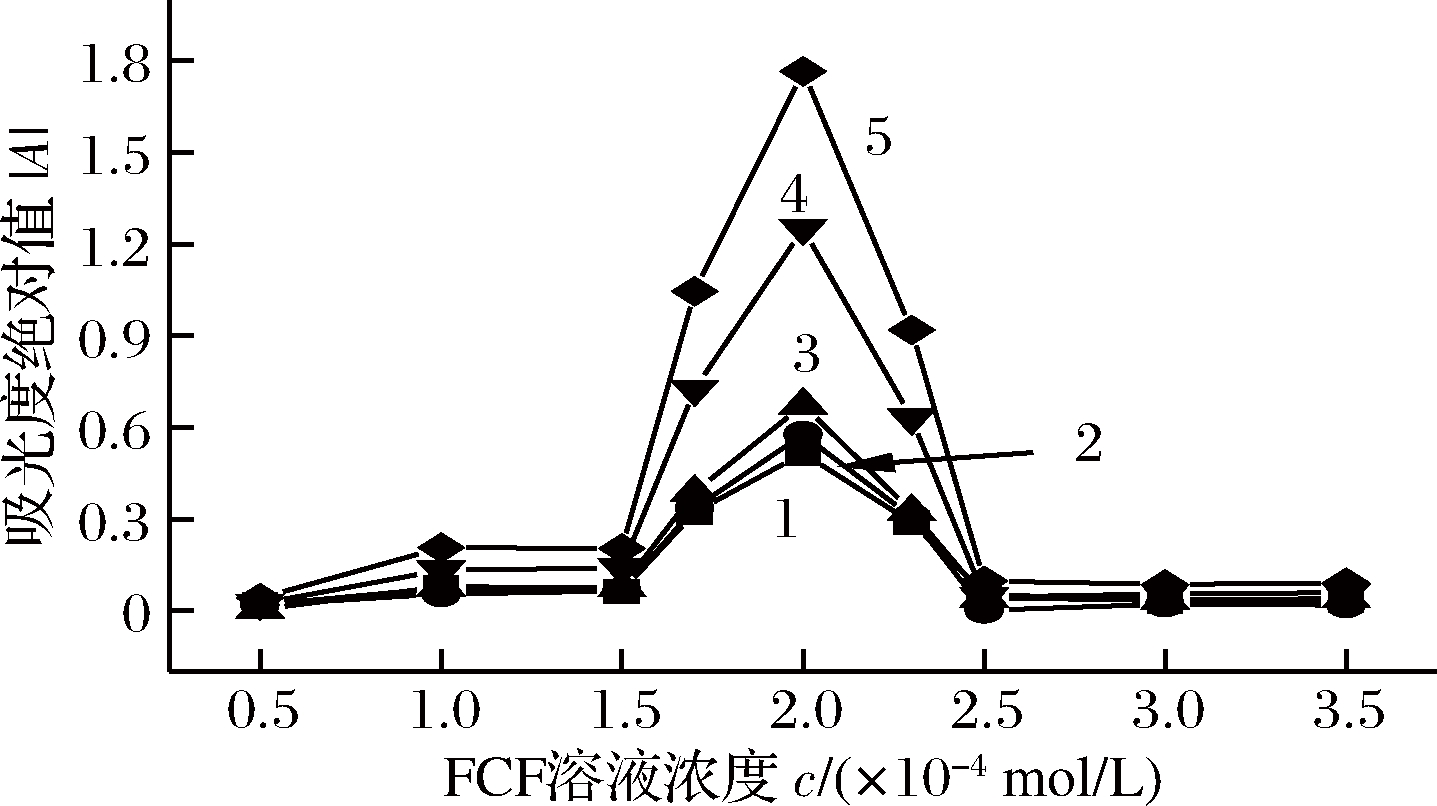
1-424 nm; 2-558 nm; 3-660 nm; 4-(558+660) nm;5-(424+558+660) nm
图3 固绿FCF 溶液浓度对│A│的影响
Fig.3 Effect of fast green FCF concentration on │A│
结果表明,FCF溶液用量为2.00 mL时,│A│最大,灵敏度最高,即FCF溶液浓度为2.00×10-4 mol/L时,体系│A│最大。故实验用2.00 mL 1.0×10-3 mol/L FCF溶液。图3表明,TWO-VIS法的灵敏度最高,DWO-VIS次之。
2.2.3 试剂加入顺序的选择
按实验方法考察了试剂加入顺序对可见光区3个负吸收波长处的│A│。结果表明,加入顺序为Tris-HCl、CAM、FCF时,体系│A│相对最大,灵敏度最高。故实验按试剂最佳加入顺序进行。
2.2.4 反应时间的选择
在最优条件下,考察了时间对体系在可见光区3个负吸收波长处的│A│。结果表明,10 min内,反应即可进行完全。反应开始至10 min前,随着反应时间的增加,可见光区3个负吸收波长处的│A│逐渐增大,│A│- t曲线为一条斜线,说明此段时间内反应并未完全。10 min后,随着反应时间的增加,│A│不再增大,│A│- t曲线处于平稳状态,这说明10 min后反应即已完全,稳定时间至少1.0 h。故实验选在10 min后进行测定。
2.3 标准曲线
在最优条件下,按实验方法配制CAM标准系列溶液,并扫描吸收光谱,作 A -ρ标准曲线,如图4所示。标准曲线相关参数见表1。
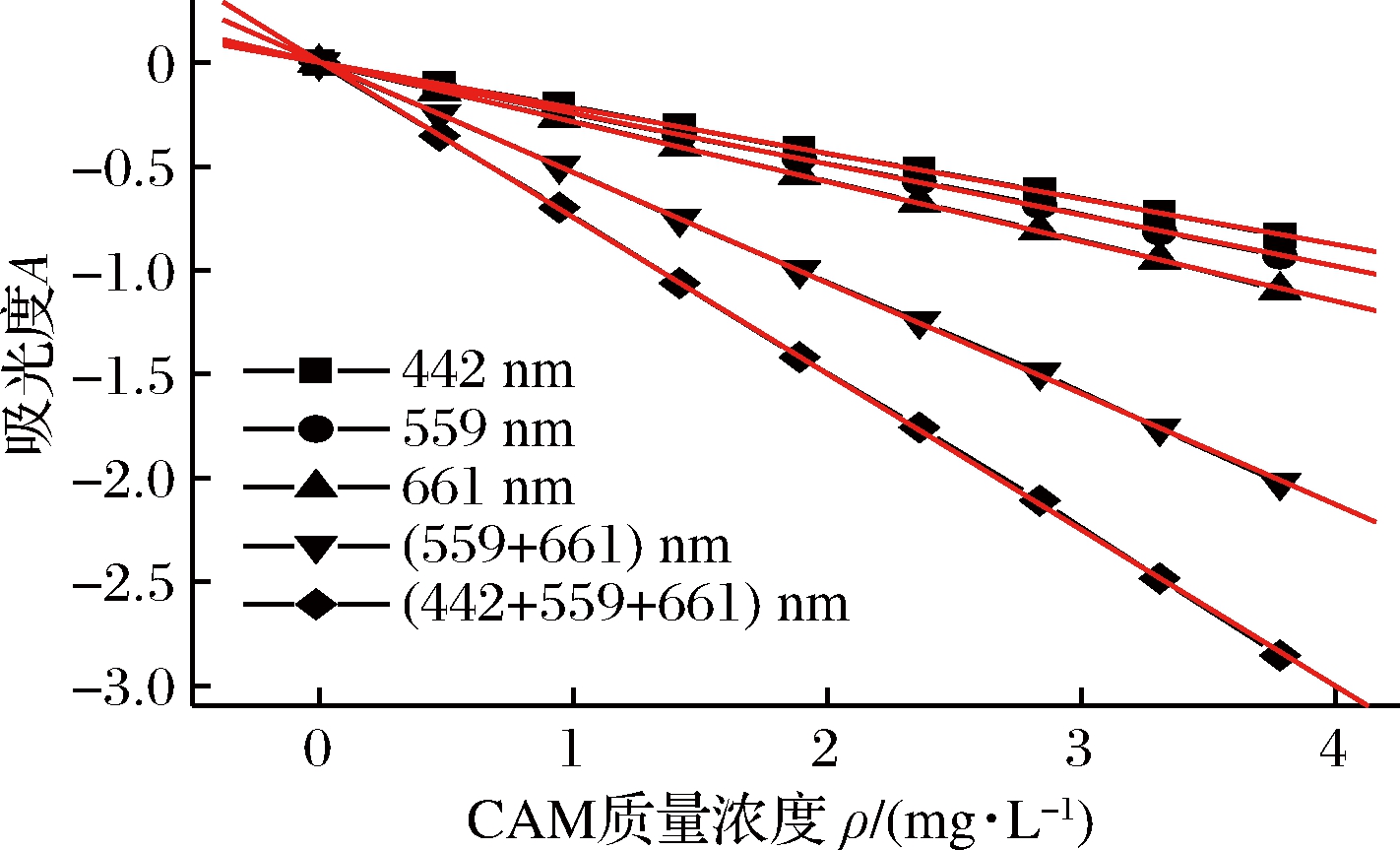
图4 卡马西平标准曲线
Fig.4 Standard curve of carbamazepine
表1 标准曲线相关参数
Table 1 Related parameters of standard curves

2.4 干扰试验
以660 nm为例,在室温下,考察了相对误差≤±5%时,可能存在的干扰物质对2.36 mg/L CAM测定的影响。结果表明,150倍的![]() 赖氨酸、L-色氨酸、L-谷氨酸、葡萄糖、蔗糖、麦芽糖;100 倍的
赖氨酸、L-色氨酸、L-谷氨酸、葡萄糖、蔗糖、麦芽糖;100 倍的![]() 组氨酸、L-白氨酸、甘氨酸、L-亮氨酸、D-果糖;60倍的
组氨酸、L-白氨酸、甘氨酸、L-亮氨酸、D-果糖;60倍的![]() 倍的
倍的![]() 抗坏血酸、淀粉;8倍的Cu2+、Al3+、Fe3+等不干扰CAM的测定。可见方法有良好的选择性。
抗坏血酸、淀粉;8倍的Cu2+、Al3+、Fe3+等不干扰CAM的测定。可见方法有良好的选择性。
2.5 样品分析
取1#~3# 待测液(代替1.4 节中的CAM标准溶液),分别用三波长叠加法(灵敏度相对最高)按实验方法进行分析,求待测样液中卡马西平的含量,并与高灵敏的共振瑞利散射(resonance rayleigh scattering, RRS)法测定结果相比较。同时以空白猪肉样、兔肉样及鸭肉样为样品,分别进行3个不同加标水平的回收试验,每个加标水平平行测定5份,分别计算回收率和相对标准偏差,并以此判断方法的准确度和精密度,结果见表2。
表2 样品分析结果及回收试验(n=5)
Table 2 Analytical results and recovery tests of samples(n=5)
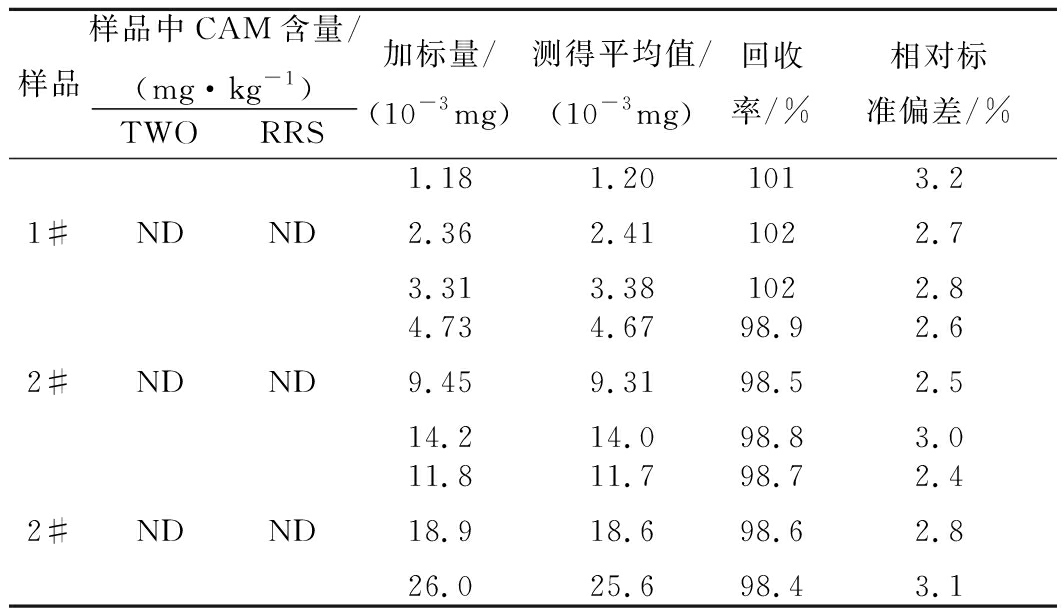
注:ND为未检出
如表2所示,三波长法测定结果与RRS一致,其准确度(98.4%~102%)和精密度(2.4%~3.2%)较高,符合定量分析要求。
3 结论
以FCF作探针的SWO-VIS、DWO-VIS及TWO-VIS法均可用于肉食品中残留卡马西平含量的测定,方法有较高的灵敏度和选择性,准确度和精密度满足定量分析要求,操作简便、快速,所用仪器价廉易于普及。方法适于批量畜禽肉中残留卡马西平的测定。
参考文献
[1] ZAHRA G, BEHZAD A, AHMAD S. Application of cation-modified sulfur nanoparticles as an efficient sorbent for separation and preconcentration of carbamazepine in biological and pharmaceutical samples prior to its determination by high-performance liquid chromatography [J]. Journal of Chromatography B, 2017,1 063:245-252.
[2] 姚韵茜,苗彩云,毛瑛瑛.HPLC法同时测定人血清中3种抗癫痫药物的浓度[J].中国临床药学杂志,2017,26(3):195-197.
[3] 叶云,陶艳红.人血浆中卡马西平血药浓度的测定[J].抗感染药学,2017,14(8):1 467-1 469.
[4] 马爱玲,王漪檬,段虹飞,等.高效液相色谱法检测干血滤纸片中卡马西平的浓度[J].中国医院药学杂志,2017,37(1):40-42.
[5] DAS S, FLEMING D H, MATHEW B S, et al. Determination of serum carbamazepine concentration using dried blood spot specimens for resource limited settings[J]. Value in Health, 2016,19(7):A874-A874.
[6] TUCHILA C, BILEA E D, BACONI D L. Development of a simple HPLC method for determination of carbamazepine in human plasma with application in therapeutic drug monitoring [J]. Toxicology Letters, 2015,238(2):149-S149.
[7] MARYAM V, SHIVA G, MASOUMEH S. Chemometrics enhanced HPLC-DAD performance for rapid quantification of carbamazepine and phenobarbital in human serum samples [J]. Talanta, 2014,119:17-23.
[8] ANA S, GILBERTO A, ANA F, et al. First HPLC-UV method for rapid and simultaneous quantification of phenobarbital, primidone, phenytoin, carbamazepine, carbamazepine-10,11-epoxide,10,11-trans- dihydroxy-10,11-dihydrocarbamazepine, lamotrigine, oxcarbazepine and licarbazepine in human plasma [J]. Journal of Chromatography B, 2013,925:1-9.
[9] HAMMAM A M, FARS K A, GAMAL M E M. Development and validation of an HPLC-UV method for the quantification of carbamazepine in rabbit plasma [J]. Saudi Pharmaceutical Journal,2011,20(1):29-34.
[10] QU Li-hua, FAN Yuan-jie, WANG Wen-jun, et al. Development, validation and clinical application of an online-SPE-LC-HRMS/MS for simultaneous quantification of phenobarbital, phenytoin, carbamazepine, and its active metabolite carbamazepine 10,11- epoxide [J]. Talanta, 2016,158:77-88.
[11] 梅升辉,杨莉,冯卫星,等.LC-MS/MS法测定人血浆中卡马西平的浓度及其在室间质评中的应用[J].中国药房,2016,27(8):1 044-1 047.
[12] 杜晓琳,雍小兰,黄娟,等.HPLC-MS /MS法检测人血浆中卡马西平浓度[J].解放军药学学报,2015,31(6):500-502.
[13] 渠岩,路勇,冯楠,等.基质固相分散-超高效液相色谱-串联质谱法同时测定畜禽肉中残留的13 种镇静药物[J].食品科学,2012,33(8):252-255.
[14] VALERIA A L, GRACIELA M E. Second-order advantage with excitation-emission photoinduced fluorimetry for the determination of the antiepileptic carbamazepine in environmental waters[J]. Analytica Chimica Acta, 2013,782:37-45.
[15] FRAG E Y Z, ZAYED M A, OMAR M M, et al. Spectrophotometric determination of carbamazepine and mosapride citrate in pure and pharmaceutical preparations[J]. Arabian Journal of Chemistry, 2012, 5(3):375-382.
[16] LAVANYA N, SEKAR C, FICARRA S, et al. A novel disposable electrochemical sensor for determination of carbamazepine based on Fe doped SnO2 nanoparticles modified screen-printed carbon electrode[J]. Materials Science & Engineering C, 2016,62:53-60.
[17] JORGE G T, ALFREDINA V, ALFREDO J P C, et al. Electro-oxidation of carbamazepine metabolites: Characterization and influence in the voltammetric determination of the parent drug[J]. Electrochimica Acta, 2013,108:51-65.
[18] WU Shu-chao, XU Wei, SUBHANI Q, et al. Ion chromatography combined with online electrochemical derivatization and fluorescence detection for the determination of carbamazepine in human plasma[J]. Talanta, 2012,101:541-545.
[19] ALFREDINA V, ANA D, PALACE C A J, et al. Ultra-sensitive voltammetric sensor for trace analysis of carbamazepine[J]. Analytica Chimica Acta, 2010,674 (2):182-189.