蛹虫草[Cordyceps militaris(L.ex Fr) Link],分类学上属麦角菌科(Clavicipitaceae)、虫草属(Cordyceps),又称北冬虫夏草,是由子座(草部分)和菌核(虫的尸体部分)两部分组成的复合体,是可与冬虫夏草媲美的我国传统可食用的药用真菌[1-2]。虫草多糖作为蛹虫草中所含活性物质中最丰富、最重要的物质,具有内在的药效功能,特别是抗氧化,免疫调节作用和抗肿瘤功能[3-6]。近年,国内外的研究较多集中在虫草多糖提取纯化工艺的优化和多糖药理活性的研究方面,对多糖构型分析、多糖组成等方面的报道还比较少见。据现代科学论证,虫草等真菌多糖的物理性质和药理作用与多糖的分子质量大小、分子量分布、糖苷键、支化程度以及构象有着密切的联系[7-8]。
采用多角度激光光散射凝胶渗透色谱和示差联用技术(gel permeation chromatographymulti-angle laser light scattering-reflective index, GPC-MALLS-RI)可以直接测定聚合物重均分子量,是分析聚合物结构的有效工具。该技术与传统GPC相比,无需标准样品校正,且能够独立测定多糖的折光指数增量(dn/dc)值,保证检测结果的可靠性。因此本文着重探究虫草多糖的结构,通过GPC-MALLS-RI和气质联用(GC-MS)对柱层析纯化的蛹虫草虫草多糖(Cordyceps militaris polysaccharide,CMP)进行表征,获取单糖组成、分子量分布和构象信息。通过傅里叶变换红外光谱探讨多糖的分子组成。此外,比较了粗多糖与纯化多糖CMP的抗氧化活性。从分子构型、分子量的角度以及抗氧化活性方面评价蛹虫草多糖,旨在为活性研究提供参考依据。
1 材料与方法
1.1 材料与试剂
实验所用蛹虫草为东北长白山野生蛹虫草菌种,通过固态培养基发酵而来的子实体:含水量4.1%,由遵义鸿霖生物技术有限公司提供;二乙氨基乙基纤维素52(DEAE-52)填料,上海源叶生物科技有限公司;BCA蛋白浓度试剂盒,上海碧云天生物技术有限公司;无水葡萄糖、单糖标准品、DPPH和ABTS,上海Sigma-Aldrich公司。其他试剂均为分析纯或者色谱纯,国药集团化学试剂有限公司。实验用水为二次蒸馏水。
1.2 实验仪器与设备
FW80高速粉碎机,天津泰斯特仪器有限公司;AR224CN电子天平,奥豪斯仪器(常州)有限公司;UV-2100紫外分光光度计,尤尼柯仪器有限公司(上海);BC-R206旋转蒸发仪,上海贝凯生物化工设备有限公司;SBS-100自动部分收集器,上海沪西分析仪器有限公司;BT100-1JDG1数显恒流泵,重庆科耐普蠕动泵有限公司;SCIENTZ-10N型冷冻干燥机,宁波新芝生物科技股份有限公司;三重四级杆气质联用仪(TSQ8000),赛默飞世尔科技有限公司;多角度激光光散射凝胶色谱仪(DAWN HELEOS II),美国怀雅特技术公司。
1.3 实验方法
1.3.1 蛹虫草虫草粗多糖的制备
取适量蛹虫草子实体粉末,在微波条件下辅助提取虫草多糖,提取液离心后取上清浓缩,加入多糖浓缩液体积1/4的Sevag试剂[V(氯仿)∶V(正丁醇)=4∶1]离心除去蛋白,如此重复多次。用1.5 g/L的活性炭脱色,再加入4倍体积的无水乙醇沉淀多糖,4 ℃下静置过夜后用分别用95%乙醇、无水乙醇和丙酮洗涤沉淀,最后真空干燥得到粗多糖,备用。用苯酚-硫酸法[9]测定虫草粗多糖的含量。
1.3.2 蛹虫草粗多糖的纯化
样品的预处理:准确称取虫草多糖粗品,用蒸馏水配制成25 g/L的溶液,待柱层析备用。
DEAE-52柱层析纯化虫草多糖:称取100 g填料用蒸馏水浸泡出去悬浮杂质,而后分别用0.5 mol/L的HCl和NaOH浸泡2 h,每次用蒸馏水洗至中性,最后真空抽干填料用蒸馏水浸泡装柱(2.6 cm×30 cm),预先用蒸馏水过夜平衡。用蒸馏水洗脱,流速为4 mL/min,每管收集8 mL。采用苯酚硫酸法检测每管糖含量,并绘制以管数为横坐标,吸光值为纵坐标的洗脱曲线,以洗脱曲线为准收集不同吸收峰段的多糖组分。将收集的多糖组分50 ℃旋转蒸发至原液的1/5后透析(3000D)48 h,而后冷冻干燥得到中性虫草多糖粉末(CMP)。采用1.3.1中苯酚硫酸法测定CMP质量分数,并用BCA试剂盒测定蛋白质质量分数。
1.3.3 光谱分析
1.3.3.1 紫外光谱
准确称取10 mg虫草多糖,用蒸馏水配制成0.5 g/L样品溶液,用蒸馏水做空白对照,使用Shimadzu UV-1800光谱记录CMP的紫外光谱。扫描范围为190~400 nm,间隔1 nm。
1.3.3.2 傅里叶变换红外光谱
按m(CMP)∶m(KBr)约为1∶50,研磨,然后压制成1 mm薄片。采用Nicole IS10 FT-IR光谱仪(Thermo Electron,DTGS检测器,美国)以4 000 cm-1分辨率记录数据,扫描波数范围4 000~400 cm-1,扫描次数为16次。
1.3.4 气相色谱与质谱(GC-MS)分析CMP单糖组成
单糖标准品的预处理:分别准确称取100 mg的阿拉伯糖、岩藻糖、半乳糖、葡萄糖、甘露糖、鼠李糖、木糖溶于100 mL 50%的苯甲酸溶液,4 ℃备用。
CMP的水解与还原:准确称取10 mg多糖样品于安瓿瓶中,加入0.5 mL H2SO4(12 mol/L)溶液后封管,35 ℃水浴1 h后加入2.5 mL超纯水,100 ℃水浴1 h后冷却至室温得到水解样品。取单糖标准品和水解样品各1 mL置于新管,加入2 g/L肌醇为内标,氨水调节溶液至碱性后再加入含200 g/L硼氢化钠的氨水溶液0.2 mL,封管后水浴30 min (40 ℃),加入0.3 mL乙酸漩涡振荡。
单糖的衍生化:取还原后单糖样品0.2 mL,加入乙酸酐和1-甲基咪唑混匀,室温静置10 min后加入超纯水终止反应。待样品冷却至室温后加入二氯甲烷萃取衍生化后的单糖,保留下层有机相并加入无水硫酸钠除去残留的水分。离心后取上清液进行GC-MS分析。
色谱分析条件:使用配备氢火焰离子化检测器的气相色谱仪、毛细管柱(30 m×0.25 mm,Thermo ScientificTM Trace GOLD TG-5MS)。检测器温度:260 ℃,进样口温度:280 ℃,高纯氦气为载气,气体流速:1 mL/min,分流比40∶1,进样量1.0 μL。升温程序如下:50 ℃保持1 min,以10 ℃/min升至150 ℃,再以1 ℃/min升至200 ℃,再以20 ℃/min升至280 ℃,保持5 min。
质谱条件:电子轰击离子源;电子能量70 eV,传输线温度275 ℃,离子源温度200 ℃,母离子m/z 285,激活电压1.5 V,质量扫描范围m/z 33~550。
1.3.5 多角度激光光散射凝胶色谱联用示差(GPC-MALLS-RI)分析虫草多糖分子构象
1.3.5.1 分析条件
MALLS光源:He-Ne激光源,波长633 nm,凝胶排阻色谱装置配备示差折光检测器(RI-2410,Waters,USA)和使用的P100型泵(1525 Binary HPLC Pump)。凝胶柱:UltrahydrogelTM 2000 (7.8 mm×300 mm)。流动相为0.3 mol/L NaNO3溶液(用0.2 μm滤膜过滤除尘,并超声脱气),流速0.5 mL/min;柱温:35 ℃;进样体积:500 μL。多糖的折光指数增量(dn/dc)设定为0.147 cm3/g。光散射仪器的校准采用超纯度甲苯。
1.3.5.2 样品的处理
样品配制质量浓度:2 mg/mL(流动相预溶)并振荡使其充分溶解后,过0.22 μm滤膜后进行GPC-MALLS-RI分析。
1.4 抗氧化活性的研究
1.4.1 DPPH自由基清除活性的测定
按照BLOIS[10]所述的方法测定CMP的DPPH自由基清除活性。简单来说,将1.3.1中粗多糖和CMP溶于去离子水中配制成不同质量浓度梯度(0.1~2.0 mg/mL)的样品溶液。取1 mL DPPH无水乙醇溶液(0.125 mol/L)与1 mL样品在室温下避光剧烈振荡30 min。用抗坏血酸(VC)作阳性对照,在517 nm处测定每个样品的吸光度,按公式(1)计算粗多糖、CMP和VC的DPPH自由基清除率:
DPPH自由基清除率![]()
(1)
其中:A0,空白对照(无水乙醇代替样品或者VC)的吸光值;A1,乙醇代替DPPH溶液的样品或者VC的吸光值;A2,DPPH溶液与样品或者阳性对照VC的吸光值。每个实验重复3次。
1.4.2 ABTS自由基(ABTS+)清除活性的测定
按照WANG等[11]报道的方法,测定ABTS自由基的清除活性。将等体积的ABTS溶液(7 mmol/L)和过硫酸钾(2.45 mmol/L)混合,在暗处储存静置16 h后,用无水乙醇稀释30倍。取0.25 mL样品溶液(0.1~2 mg/mL)加入到5 mL ABTS自由基体系中,在室温避光反应30 min后,在734 nm处测定吸光值。无水乙醇为空白对照,VC为阳性对照。按公式(2)计算粗多糖、CMP和VC的的ABTS自由基清除率:
ABTS自由基清除率![]()
(2)
其中:A0,空白对照(无水乙醇代替样品或者VC)的吸光值;A1,乙醇代替ABTS溶液的样品或者VC的吸光值;A2,ABTS溶液与样品或者阳性对照VC的吸光值。每个实验重复3次。
1.5 数据的处理和统计分析
实验数据除特殊说明外均采用平均值±标准差(mean±SD)的形式表示,采用Astra软件分析GPC-MALLS-RI数据,借助Xcalibur 1.2软件分析GC-MS数据,其余作图均采用Origin Pro软件进行绘制。
2 结果与分析
2.1 虫草多糖的分离纯化与定性分析
利用二乙氨基乙基纤维素52(DEAE-52)的吸附效应,对虫草多糖进行分离纯化,洗脱曲线如图1所示。可以看出,水洗虫草多糖能够得到2个峰(管28~41和管65~98),本次实验收集第2个峰顶部溶液,浓缩透析后进行冷冻干燥,并命名为蛹虫草虫草多糖CMP。
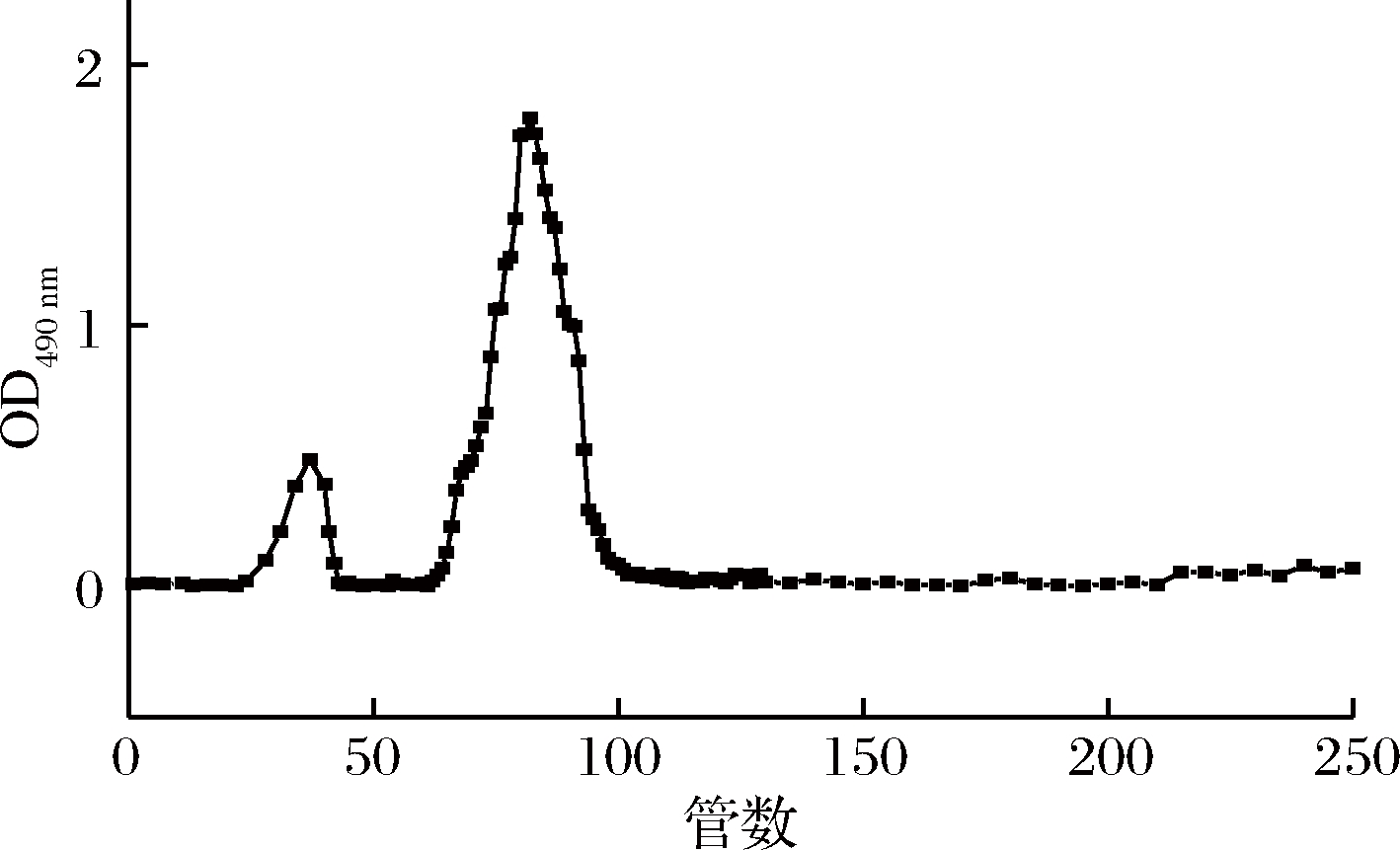
图1 DEAE-52纯化虫草多糖洗脱曲线
Fig.1 The DEAE-cellulose 52 column chromatography elution curve of Cordyceps militaris polysaccharide
按照1.3.1的方法得到葡萄糖的标准曲线,进行线性回归后回归方程为y=6.143 2-0.007 4(R2=0.999 3);CMP质量分数为(76.63±0.12)%。运用BCA试剂盒测定CMP蛋白质质量分数为(2.98±0.06)%。相比虫草粗多糖含量(44.95±0.07)%,DEAE-52柱层析法显著地提高了多糖的质量分数。
2.2 虫草中性多糖(CMP)紫外和中红外图谱
从图2可以看出,CMP在200 nm附近有强吸收峰,且在260或者280 nm处均无明显紫外吸收,表明多糖中几乎不存在核酸,蛋白或者是肽,此分析与2.1中蛋白含量测定结果吻合。图3中可以看出CMP在3 378 cm-1附近有一个宽且强烈的伸展,这代表了O—H的伸缩振动,而在2 931 cm-1周围的较弱的吸收带可能是亚甲基不对称的C—H伸缩振动[12],而在1 151 cm-1,1 079 cm-1则是C—O—C的伸缩振动和醇羟基的变角振动吸收峰,同时在1 031 cm-1附近较强的吸收带则为吡喃环结构中C![]() O的吸收峰。以上基团的吸收均为带有糖苷键多糖的红外特征吸收峰[13]。此外,CMP在1 633 cm-1附近的吸收带可能是非结合水和羧基(C
O的吸收峰。以上基团的吸收均为带有糖苷键多糖的红外特征吸收峰[13]。此外,CMP在1 633 cm-1附近的吸收带可能是非结合水和羧基(C![]() O)的伸缩振动,在1 407 cm-1附近较弱的吸收可能是C—H的平面弯曲振动。同时,在852 cm-1处存在α-构型糖苷键的特征吸收峰,说明CMP是一种单糖残基以α-构型的吡喃型多糖。
O)的伸缩振动,在1 407 cm-1附近较弱的吸收可能是C—H的平面弯曲振动。同时,在852 cm-1处存在α-构型糖苷键的特征吸收峰,说明CMP是一种单糖残基以α-构型的吡喃型多糖。
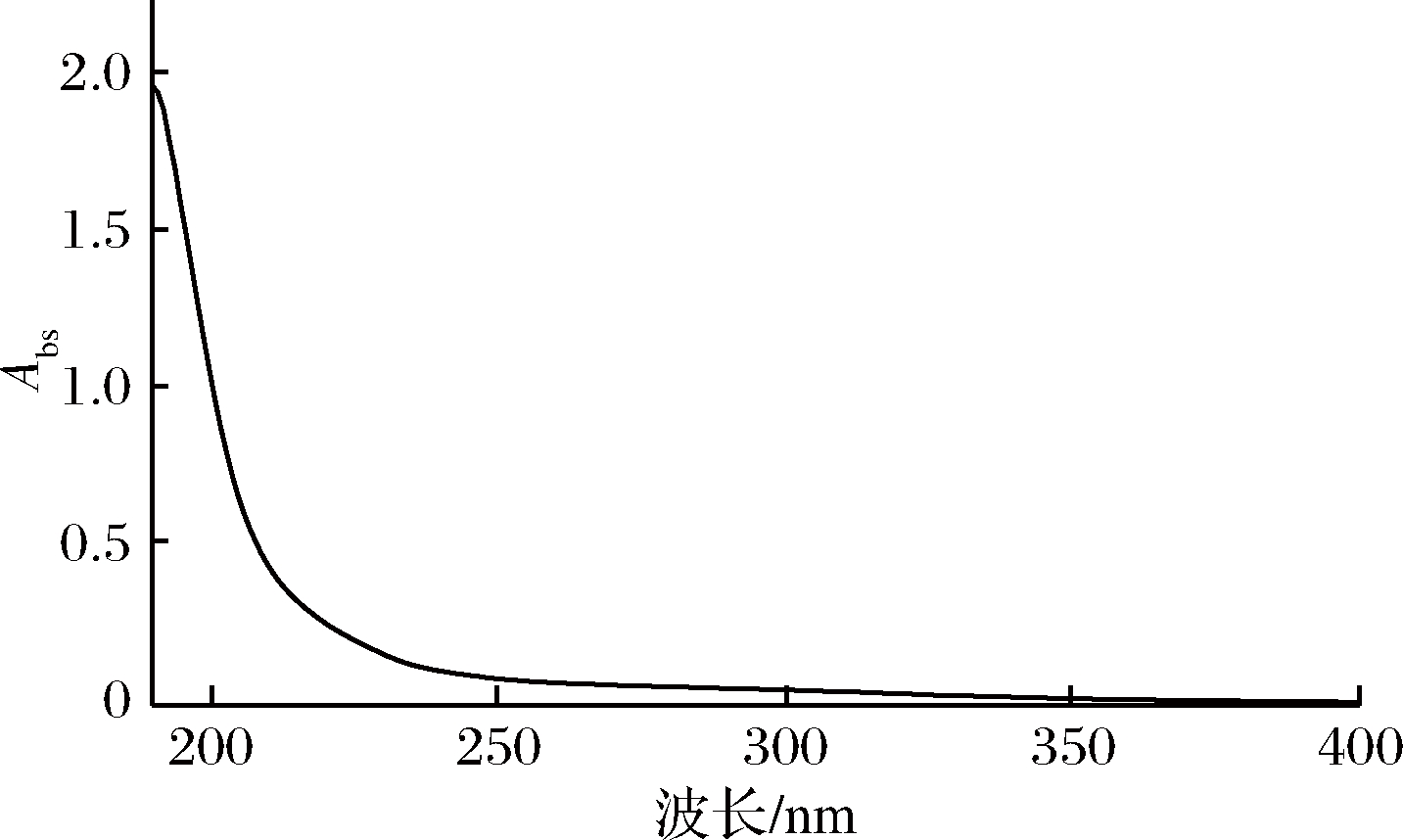
图2 虫草中性多糖(CMP)紫外可见光谱图
Fig.2 The UV-visible spectra of CMP
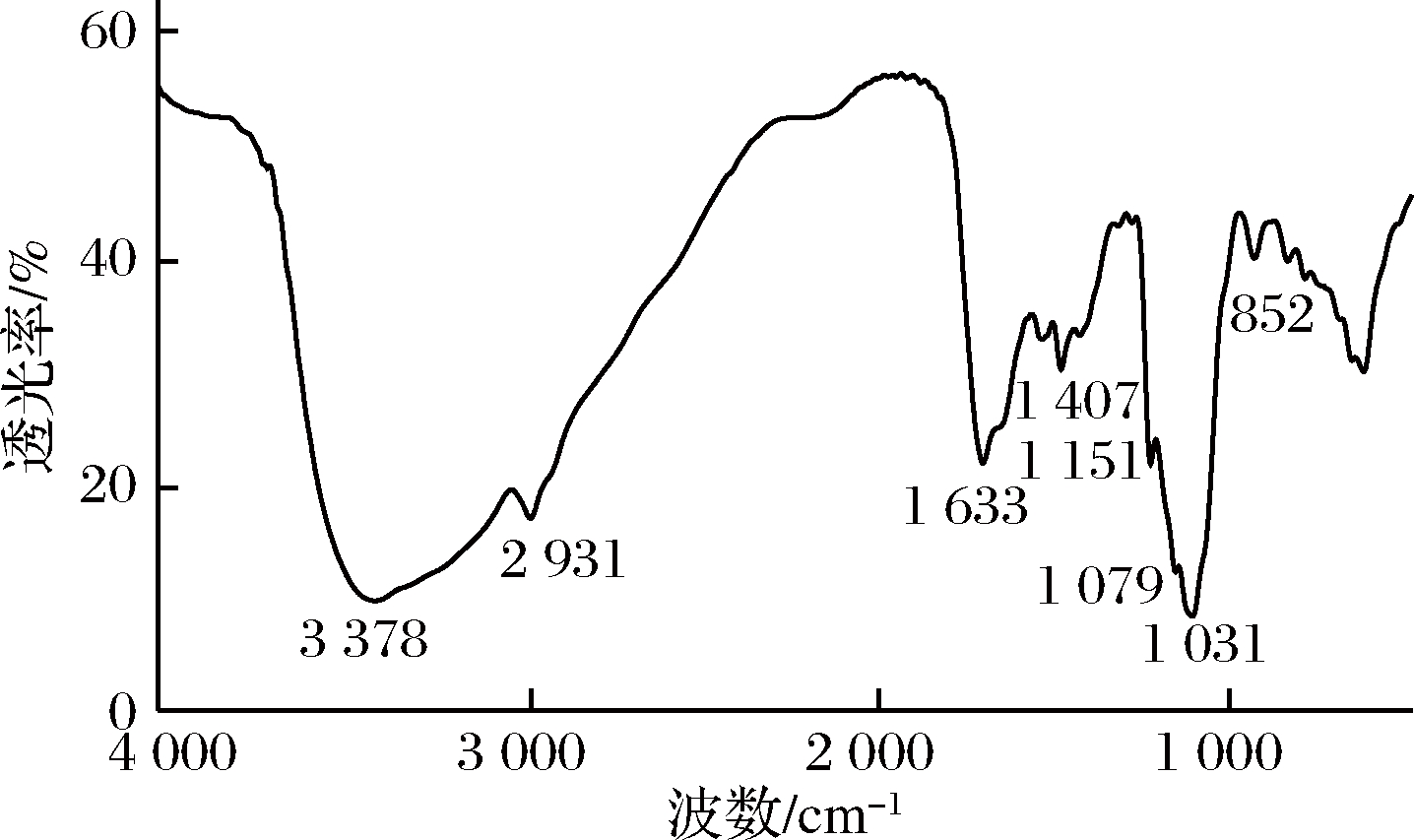
图3 虫草中性多糖(CMP)傅里叶变换红外光谱图
Fig.3 The FT-IR spectra of CMP
2.3 虫草中性多糖(CMP)单糖组成
采用Xcalibur 1.2软件对GC-MS单糖组成数据进行分析。通过与质谱数据库(NIST1.6和Wiley 6.0)比对和与文献中相应化合物的Kovats指数(KI)比对进行化合物的定性。定量方法采用面积归一法,以肌醇为内标。各种标准单糖、CMP衍生物气相色谱图见图4。根据它们的保留时间TR,确定组成单糖的种类,根据峰面积公式(3)计算出其摩尔比。
![]()
(3)
其中:i,标准单糖;s,内标物;M,质量;A,峰面积,求出各单糖相对校正因子fR。各单糖的摩尔比测定条件与校正因子相同,以肌醇为内标,得到各个单糖衍生物的峰面积与内标衍生物的峰面积比后乘以fR/M(M为相对分子质量),得到值之比即为各单糖摩尔比。
由图4可知各标准单糖对应的保留时间分别为:鼠李糖(TR=31.30 min)、阿拉伯糖(31.88 min)、岩藻糖(32.21 min)、木糖(33.49 min)、甘露糖(48.74 min)、葡萄糖(49.50 min)、半乳糖(50.59 min),TR=47.96 min的峰为肌醇。由图4可知CMP中单糖组成为甘露糖、葡萄糖、半乳糖,摩尔比为1∶3.90∶1.51。
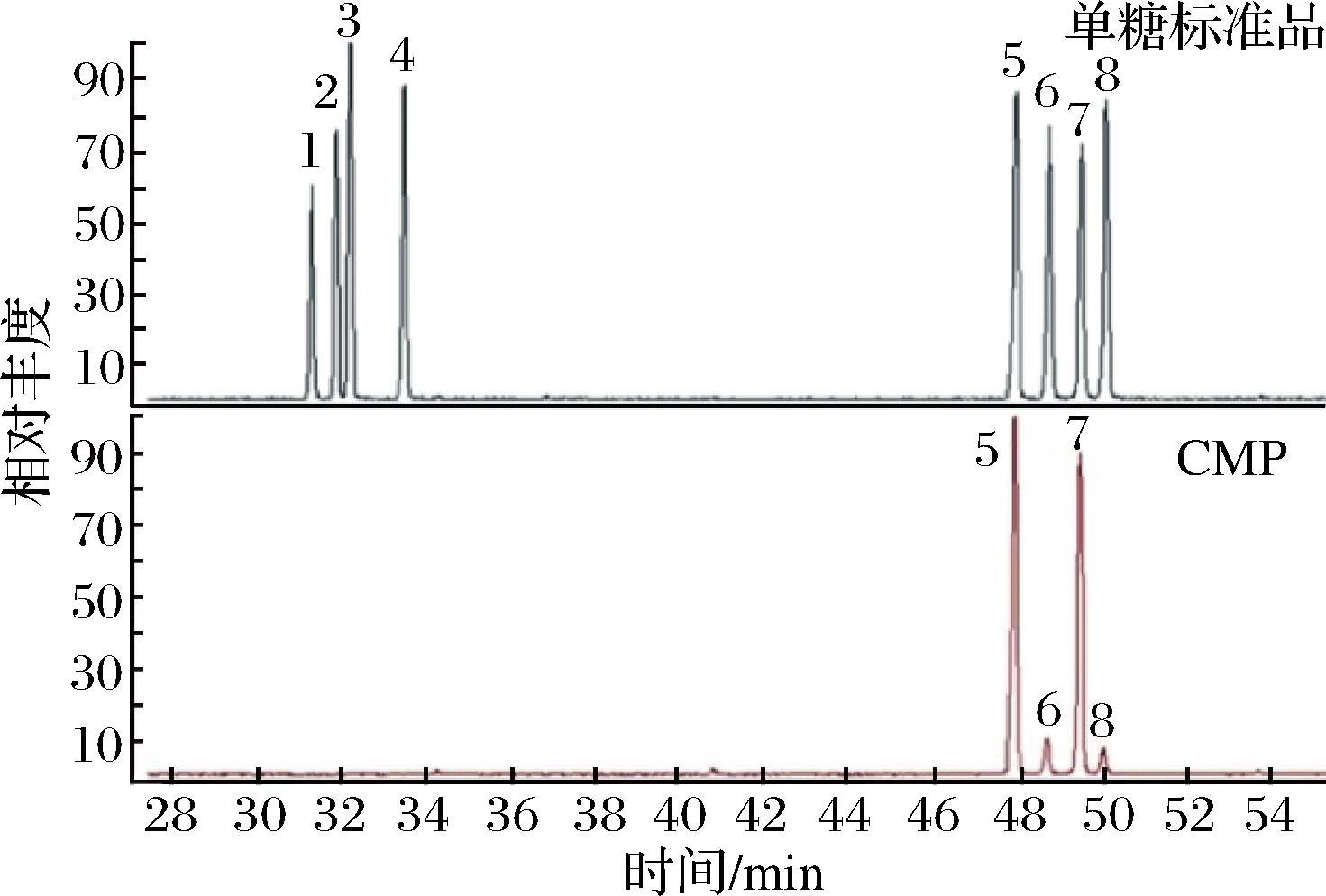
1-鼠李糖;2-阿拉伯糖;3-岩藻糖;4-木糖;5-内标-肌醇;6-甘露糖;7-葡萄糖;8-半乳糖)和虫草多糖(CMP)乙酸酐咪唑衍生后的气相色谱图
图4 单糖标准品
Fig.4 The GC profile of monosaccharide standards
2.4 虫草多糖(CMP)的分子量分布和构象分析
2.4.1 分子量分布
通过多角度激光散射仪自带Astra软件采集数据,以时间为横坐标,多角度和示差响应值为纵坐标作图得到图5。由图5可知,MALLS图谱在洗脱时间在15~22 min范围内呈现出尖而瘦的峰,可以推测多糖的分子量相对比较均一。然而,对比RI图谱发现,多糖的保留时间有了稍许的延迟,出峰时间段在16~22 min和22~35 min。为了确定多糖峰段,图6表示了示差检测虫草多糖(CMP)分子质量与时间的色谱图。由图可知22 min后多糖的分子量质量趋近0,同时对比多次重复实验结果发现,RI检测器均能够采集22 min后的峰,从中可知22 min后出现的峰为溶剂峰。以上两种检测方式均能说明GPC-MALLS-RI能够很好地检测CMP的分子特性。
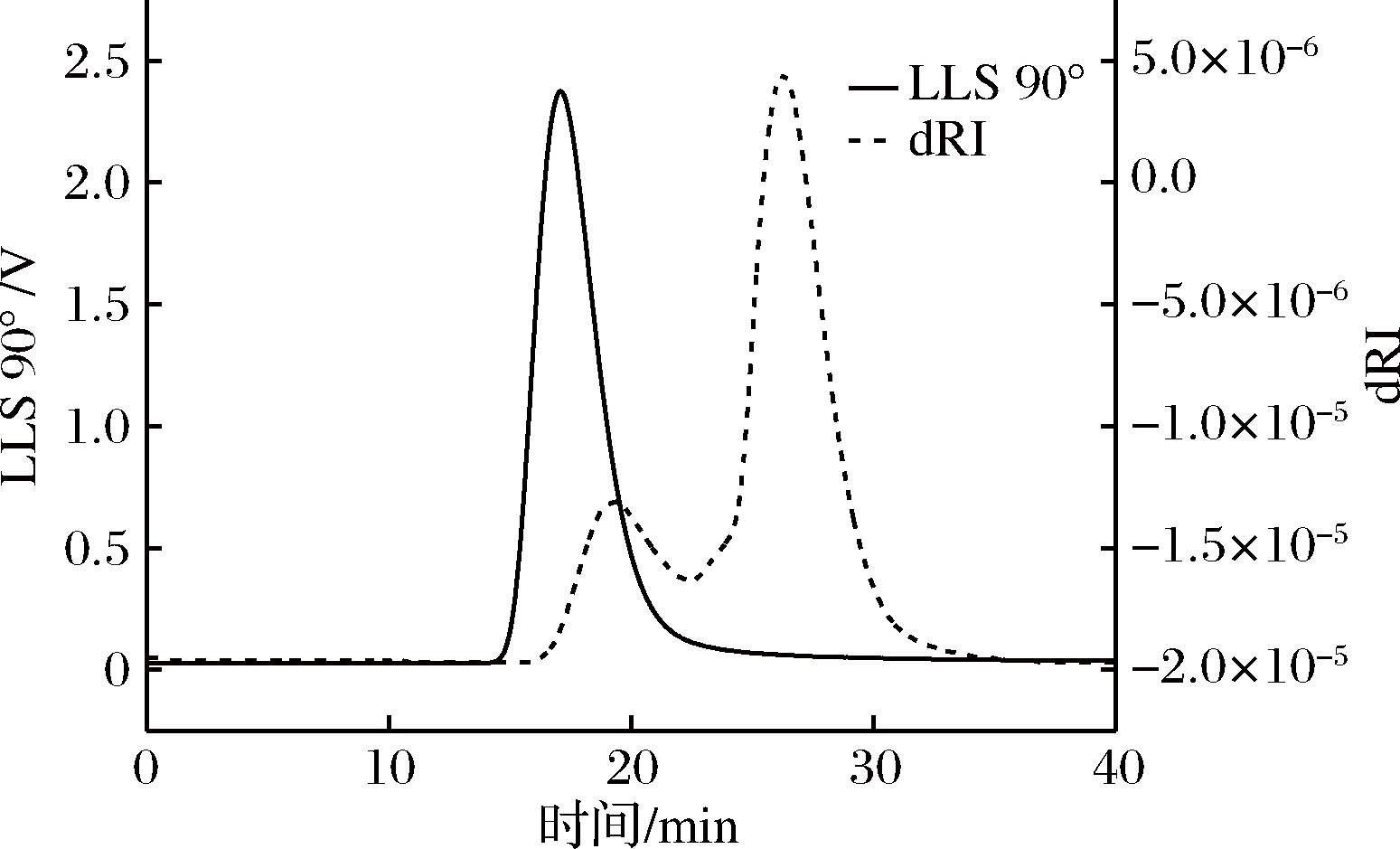
图5 虫草多糖(CMP)的90°激光峰色谱图和示差图
Fig.5 Chromatogram of CMP by LLS at 90°and differential refraction index
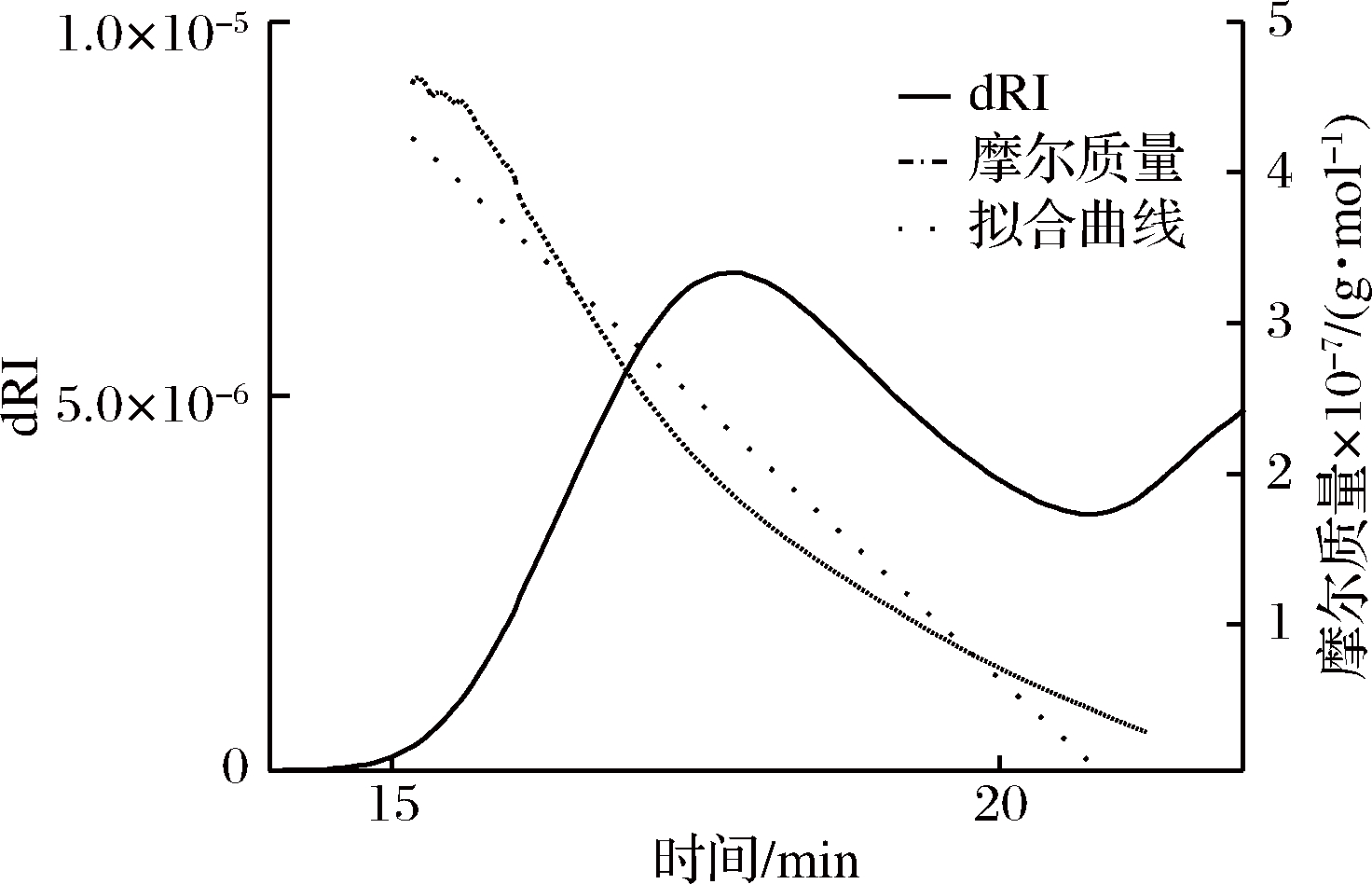
图6 示差检测虫草多糖(CMP)分子质量与时间的色谱图
Fig.6 The chromatograms of the molecular mass vs. time detected by RI
早在1948年,ZIMM等人[14]提出光散射现象与分子量之间关系的理论,而后涌入了一大批科研工作者总结此理论,得到公式(4)和(5)[15]:
![]()
(4)
![]()
(5)
其中:K*为一个光学常数,与分子的折光指数增量和溶剂的折光指数相关;n,溶剂的折光指数;c,溶质分子的质量浓度(g/mL);NA,阿佛加德罗常数;λ0,入射光的波长;dn/dc,溶液折射率与浓度变化的比值,它说明了随溶质浓度变化的溶液折光指数变化;R(θ),不同角度光散射强度;Mw,重均分子量;A2为第二维里系数。而<s2>z平方根即为均方根半径(radii of gyration, Rg),也称回转半径,此数据可以用来表征支化聚合物的尺寸。
将K*c/Rθ对sin2(θ/2)作图,可得到著名的Zimm曲线(图7),拟合曲线线性关系式推算结果见表1,由拟合曲线截距的倒数得到CMP的重均分子摩尔质量Mw为2.432×107g/mol,Mn为1.015×106,计算多糖分布指数d=Mw/Mn为2.396,处于2-3,属于中等分布宽度样品,此结果与图7分子质量分布范围相吻合。同时通过拟合曲线的斜率开方得到Rg值为31.0 nm,一般来说,MALLS准确测定样品均方根旋转半径Rg范围为10~500 nm,这说明本次实验误差相对较小[16]。
表1 CMP的分子特征参数
Table 1 Molecular property of CMP
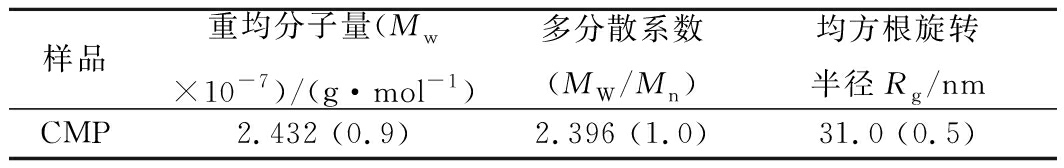
注:表中数值表示为值(RSD%),由统计软件得出。

图7 虫草多糖(CMP)在0.3 mol/L NaNO3水溶液中(K*c/Rθ)c=0对角度的依赖关系图
Fig.7 Angular dependence of (K*c/Rθ)c=0for the CMP in 0.3 mol/L NaNO3 aqueous solution
2.4.2 虫草多糖(CMP)构象
运用Astra软件进一步得到均方根旋转半径Rg分布图(图8)。可以看出,分子量的大小与均方根半径(Rg)呈现正相关,也就是说随着洗脱体积的增加,Rg有逐渐减小的趋势,说明分子的形状也在逐渐减小。
高分子聚合物的分子的形状可以帮助我们更好地理解多糖的构象信息,不论是多峰分布或者分布较宽的样品,皆可以采用GPC-MALLS联用系统测定分子量及分子回转半径得到分子的形状。通过拟合曲线的斜率可以获知分子的形状。一般来说,斜率为0.33时,分子为球型,斜率为0.5~0.6时,分子为无规线团形状,斜率为1时,分子为棒状[17]。由图8构型判断可知,两者的线性关系较差,类似U型曲线,因此可以判断其CMP在流动相溶液中为典型的高枝化度结构。
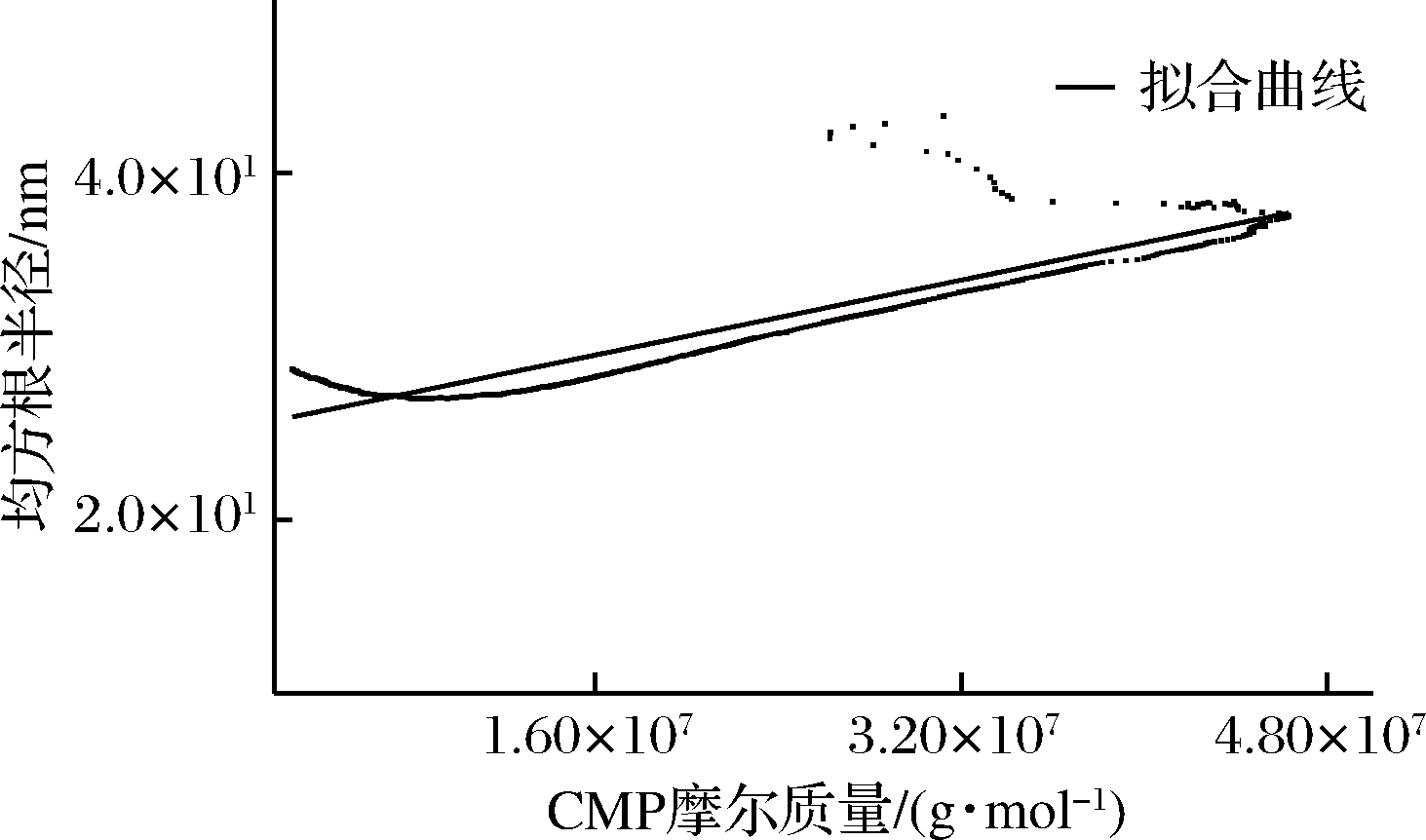
图8 虫草多糖(CMP)分子旋转半径分布图
Fig.8 The distribution diagram of molecular rotation radium
2.5 虫草多糖(CMP)的抗氧化活性
目前DPPH自由基和ABTS自由基清除实验已被广泛用于评价功能成分的抗氧化作用。图9和图10绘制了CMP和VC对DPPH和ABTS自由基的清除活性的结果。从中可以看出CMP均表现明显的DPPH和ABTS自由基清除活性,且清除能力呈现浓度依赖型趋势。此外,CMP对DPPH自由基的清除效果略低于ABTS自由基,但是两种评价方法的曲线显著相似。
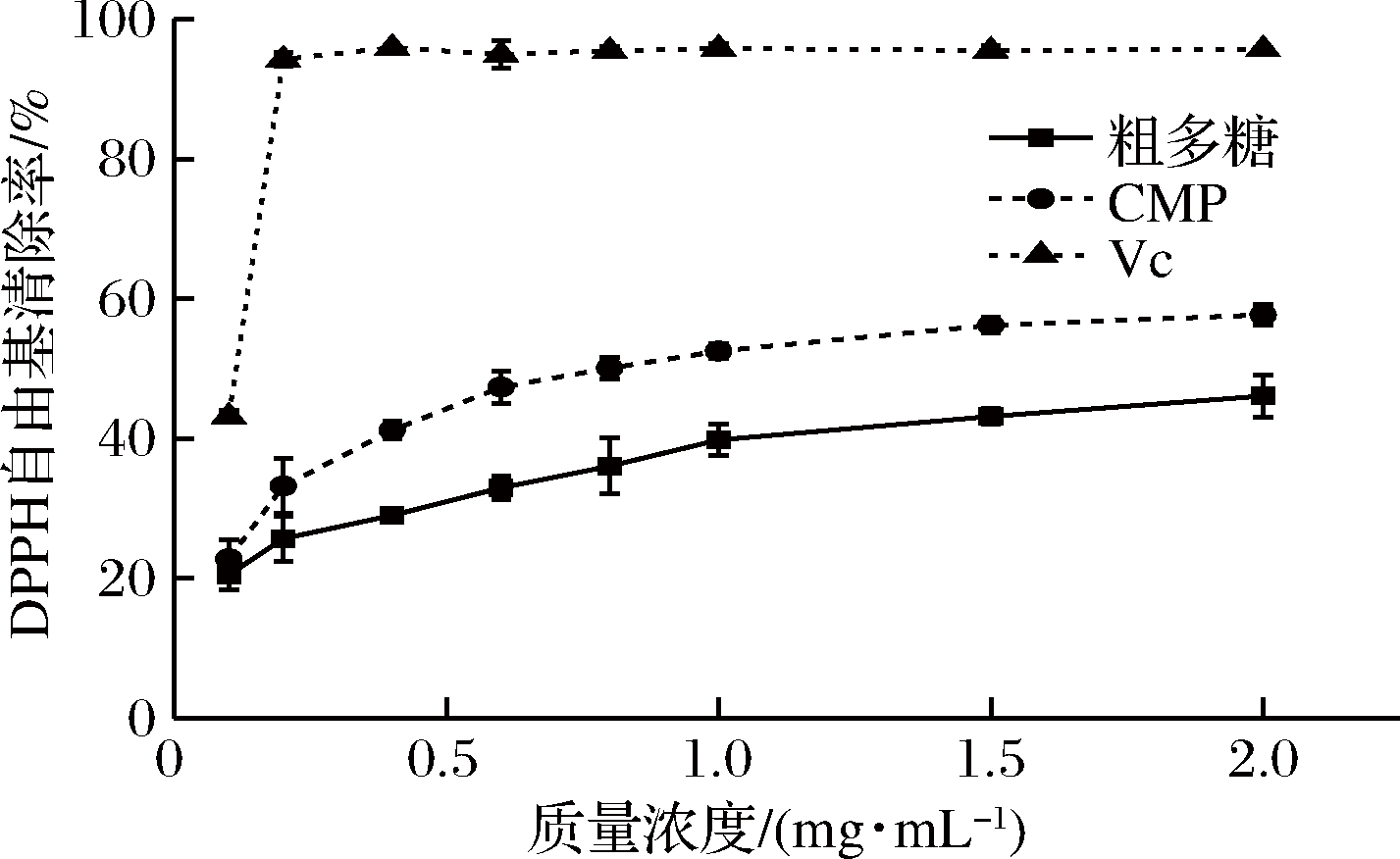
图9 粗多糖、CMP和Vc的DPPH自由基清除率
Fig.9 The scavenging activity of crude polysaccharides,CMP and VC on DPPH radical
从图9可以看出,当质量浓度为1 g/L时,粗多糖、CMP和VC的DPPH自由基清除率分别为39.81%、52.53%和95.81%。相比虫草粗多糖,CMP的DPPH自由基清除率IC50值小于1 g/L,而粗多糖清除率的IC50大于2 g/L。图10中ABTS自由基清除实验也得到类似的结果。因此,CMP的抗氧化活性远大于虫草粗多糖。
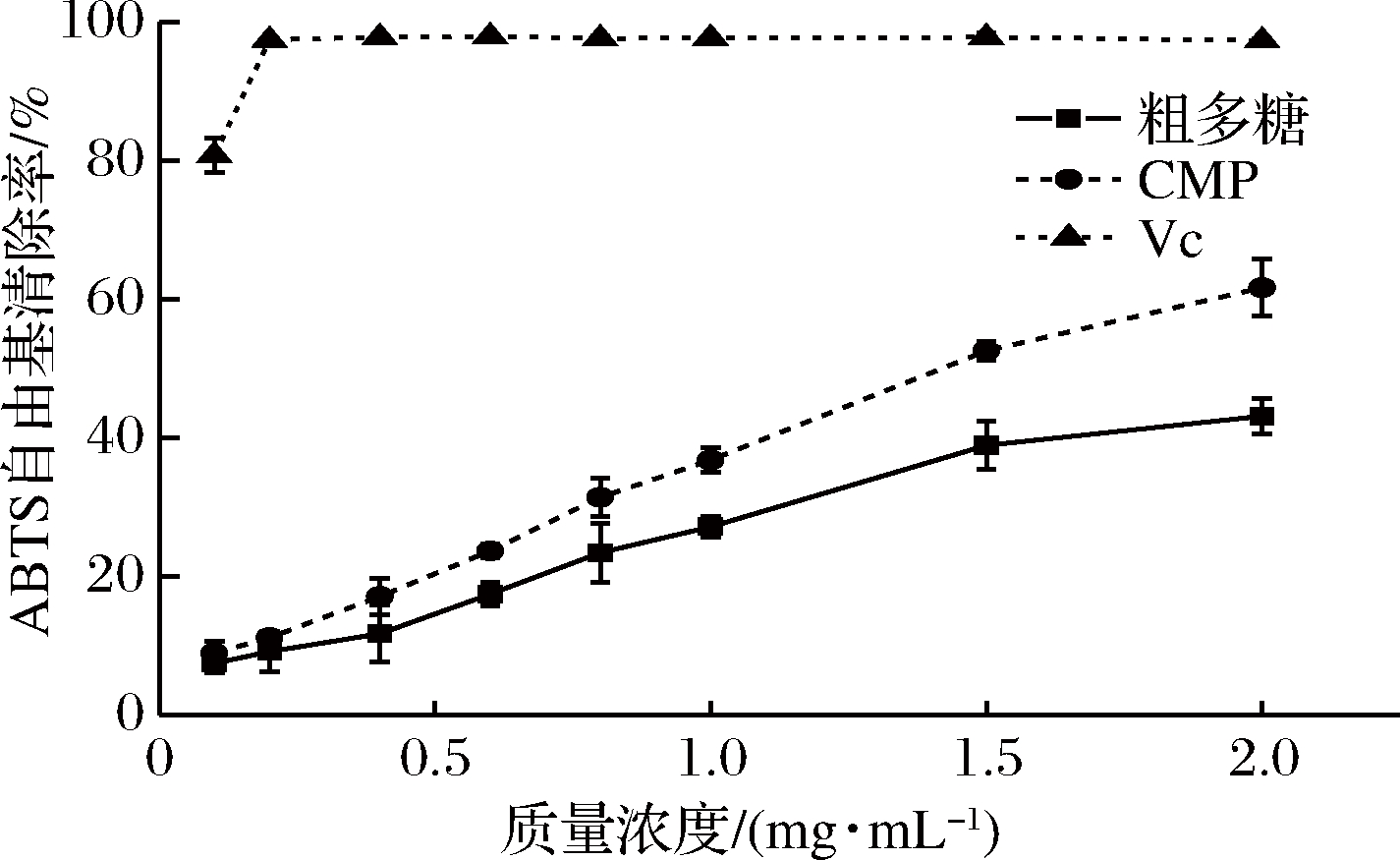
图10 粗多糖、CMP和Vc的ABTS自由基清除率
Fig.10 The scavenging activity of crude polysaccharides,CMP and VC on ABTS radical
3 结论
本研究首次采用GPC-MALLS-RI联用技术,对经DEAE-52分离纯化得到的虫草多糖分子量分布及均方根旋转半径等进行了探究,研究发现CMP质量分数为76.63%,比粗多糖质量分数提高70.48%。CMP的重均分子质量为2.432×107 g/mol,均方根半径为31 nm,单糖组成甘露糖、葡萄糖和半乳糖,其摩尔比为1∶3.90∶1.51,且CMP的抗氧化活性大于粗多糖。本次研究可为进一步了解CMP的构效关系提供理论支持和必要数据。当然,本实验缺少虫草多糖分枝状况和糖苷键构型的分析,这部分内容有待继续研究。
参考文献
[1] DAS S K, MASUDA M, SAKURAI A, et al. Medicinal uses of the mushroom Cordyceps militaris: current state and prospects [J]. Fitoterapia, 2010, 81(8): 961-968.
[2] CUNNINGHA K. Cordycepin, a metabolic product from cultures of Cordyceps militaris (Linn.) link. Part I. Isolation and characterization [J]. Journal of the Chemical Society, 1951, 2: 2 299-2 300.
[3] ZHU Zhenyuan, GUO Mingzhu, LIU FEI, et al. Preparation and inhibition on alpha-d-glucosidase of low molecular weight polysaccharide from Cordyceps militaris [J]. International Journal of Biological Macromolecules, 2016, 93: 27-33.
[4] ZHU SHUANG-JIE, PAN JIAN, ZHAO BIN, et al. Comparisons on enhancing the immunity of fresh and dry Cordyceps militaris in vivo and in vitro [J]. Journal of Ethnopharmacology, 2013, 149(3): 713-719.
[5] PARK B T, NA K W, JUNG E C, et al. Antifungal and anticancer activities of a protein from the mushroom Cordyceps militaris [J]. The Korean Journal of Physiology & Pharmacology, 2009, 13(1): 49-54.
[6] CHEN XIAO-LI, WU GUANG-HONG, HUA ZHUO-LIE. Structural analysis and antioxidant activities of polysaccharides from cultured Cordyceps militaris [J]. International Journal of Biological Macromolecules, 2013, 58(7): 18-22.
[7] LUO Xiao-ping, DUAN Yu-qing, YANG Wen-ya, et al. Structural elucidation and immunostimulatory activity of polysaccharide isolated by subcritical water extraction from Cordyceps militarys [J]. Carbohydrate Polymers, 2017, 157: 794-802.
[8] METHACANON P, MADLA S, KIRTIKARA K, et al. Structural elucidation of bioactive fungi-derived polymers [J]. Carbohydrate Polymers, 2005, 60(2): 199-203.
[9] NY/T 1676—2008, 食用菌中粗多糖含量的测定[S]. 北京:中国农业标准出版社, 2008.
[10] BLOIS M S. Antioxidant determination by use of stable free radicals [J]. Nature, 1958, 29(4617): 1 199-1 200.
[11] WANG Junhui, XU Jinlong, ZHANG Jingcheng, et al. Physicochemical properties and antioxidant activities of polysaccharide from floral mushroom cultivated in Huangshan Mountain [J]. Carbohydrate Polymers, 2015, 131: 240-247.
[12] WANG Rufeng, CHEN Ping, JIA Fang, et al. Optimization of polysaccharides from Panax japonicus C.A. Meyer by RSM and its anti-oxidant activity [J]. International Journal of Biological Macromolecules, 2012, 50(2): 331-336.
[13] YAN Jingkun, LI Lin, WANG Zhaomei, et al. Structural elucidation of an exopolysaccharide from mycelial fermentation of a Tolypocladium sp. fungus isolated from wild Cordyceps sinensis [J]. Carbohydrate Polymers, 2010, 79(1): 125-130.
[14] ZIMM B H. The scattering of light and the radial distribution function of high polymer solutions [J]. Journal of Chemical Physics, 1948, 16(12): 1 093-1 099.
[15] WYATT P J. Light scattering and the absolute characterization of macromolecules [J]. Analytica Chimica Acta, 1993, 272(1): 1-40.
[16] 陈同强, ADILEKOV J,王娟,等. 凝胶渗透色谱-多角度激光散射联用技术研究红芪多糖中4个组分分子特征[J]. 中国中药杂志, 2012, 37(12): 1 798-1 803.
[17] KATO T, OKAMOTO T, TOKUYA T, et al. Solution properties and chain flexibility of pullulan in aqueous solution [J]. Biopolymers, 2010, 21(8): 1 623-1 633.