阿胶是由驴皮经煎煮浓缩而成的固体胶类,具有滋阴补血等功效[1-2],在中成药配伍方面也占有重要地位[3],可做中药材使用,也可作为功效原料添加到保健食品中,与人参、鹿茸并称为滋补三宝[4-5]。近年来,驴资源的减少加之利益的驱使,部分不法商贩在阿胶药材及其保健制品中掺入了廉价的劣质皮类胶充数,甚至完全用劣质皮类胶代替阿胶添加到阿胶药材及其保健制品中[6],严重损害了合法商家的权益和消费者的切身利益,必须采取强有力的措施严加控制。
目前的检测方法中针对阿胶中药材的研究较为集中[7-9],标准也渐成熟。《中国药典》2015年版一部[10]新增了阿胶中药材中阿胶鉴别项;国家食品药品监督管理局的补充件中[11]规定了阿胶中药材中牛皮源的检测和判定方法,在结果判定时将样品与牛皮源对照品同步比较,只要m/z 641.3(双电荷)→726.2和m/z 641.3(双电荷)→783.3离子对不同时出现或同时出现,但峰面积均不超过对照品峰面积即可。在中国药典中,以L-羟脯氨酸、甘氨酸、丙氨酸和L-脯氨酸这4种氨基酸含量的总和作为阿胶含量,作为中药材的阿胶,其主成分阿胶含量应不小于43%[10];与阿胶中药材相比,阿胶类保健食品具有形式多样化、成分构成多样化的特点,且阿胶原材料仅作为其中的一种功效成分而添加,导致部分类型产品中阿胶的含量是较低的,这种情况下即使在阿胶原材料中掺有大部分的牛皮源成分,也会因生产工艺中稀释及其他步骤的进行而使得制得的成品类阿胶保健食品中牛皮源含量较低,最终被判定为合格产品。本文采用UPLC-MS/MS法对6种类型、67份市售阿胶类保健食品中阿胶成分和牛皮源成分进行测定,结合阿胶含量[10]、水分[12]、蛋白质[13]含量的测定情况对每种剂型中阿胶成分和牛皮源成分进行分析,以期对阿胶类保健食品的质量控制和专项标准制定提供重要依据。
1 材料与方法
1.1 材料与试剂
阿胶类保健食品共6种剂型,包括阿胶片35批、阿胶粉3批、阿胶胶囊3批、阿胶口服液11批、阿胶核桃糕13批、阿胶含片2批。
对照品:牛皮特征肽A(中检院,批号111941-201202);阿胶对照药材粉末(中检院,批号:121274-201202);L-羟脯氨酸对照品(中检院,批号:111578-200201,含量:100%);甘氨酸对照品(中检院,批号:140689-201404,含量:99.9%);丙氨酸对照品(中检院,批号:140624-200805,含量:100%);L-脯氨酸对照品(中检院,批号:140677-201206,含量:100%);胰蛋白酶(Sigma公司)。
乙腈,色谱纯,德国默克;甲酸,色谱纯,北京百灵威科技有限公司;醋酸钠,分析纯,上海化学试剂有限公司;碳酸氢铵,分析纯,国药集团化学试剂有限公司。
1.2 仪器与设备
Waters ACQUITY UPLC/Quattro Premier XE超高效液相色谱-串联四极杆质谱联用系统,Waters公司;Agilent 1260高效液相色谱仪,美国安捷伦公司;Sartourious BT125D型电子天平,赛多利斯公司。
1.3 实验方法
1.3.1 阿胶含量测定
1.3.1.1 高效液相色谱条件
色谱柱:Agela Nenusil AA色谱柱(4.6 mm×250 mm,5 μm);流动相:以乙腈∶0.1 mol/L醋酸钠(7∶93)溶液为流动相A,以乙腈∶水(4∶1)为流动相B,进行梯度洗脱(0 min:100%A;11 min:93%A+7%B;13.9 min:88%A+12%B;14 min:85%A+15%B;29 min:66%A+34%B;30 min:20%A+80%B;38 min:20%A+80%B;39 min:100%A;45 min;100%A);流速:1 mL/min;柱温:35 ℃;进样量:5 μL;检测波长:254 nm[10]。
1.3.1.2 对照品溶液的制备
精密称取L-羟脯氨酸对照品0.016 g、甘氨酸对照品0.032 g、丙氨酸对照品0.014 g、L-脯氨酸对照品0.024 g至同一个10 mL量瓶中,用0.1 mol/L的HCl溶液溶解并稀释至刻度,摇匀。精密量取上述溶液100、200、500、1 000、2 000 μL至10 mL量瓶中,用0.1 mol/L的HCl溶液稀释至刻度,摇匀。精密量取上述5种溶液2 mL至5 mL安培瓶中,加HCl 2 mL,150 ℃水解1 h,放至室温,转至蒸发皿中,用10 mL水分次洗涤,洗液并入蒸发皿中,蒸干,残渣用0.1 mol/L的HCl溶液溶解,转移并定容至25 mL量瓶中。
1.3.1.3 样品溶液的制备
阿胶片、阿胶含片、阿胶糕:取样品20 g,粉碎、研细、充分混匀后备用;阿胶胶囊:取20粒样品内容物,研细、充分混匀后备用;阿胶粉:取样品20 g,研细、充分混匀后备用;阿胶口服液:取样前充分振摇,混匀后备用。阿胶片类样品:精密称取0.25 g至25 mL量瓶中,其他几类样品:精密称取2 g至25 mL量瓶中,均加入0.1 mol/L的HCl溶液10 mL,超声处理30 min,放冷,用0.1 mol/L的HCl溶液稀释至刻度,摇匀。精密量取2 mL至5 mL安培瓶中,与1.3.1.2对照品溶液同法处理。
1.3.2 水分和蛋白质测定
样品称样前处理过程同1.3.1.3,按照《中国药典》2015年版通则中水分测定法[12]对样品中水分进行测定;按照凯式定氮法[13]对样品中蛋白质含量进行测定。
1.3.3 阿胶成分和牛皮源成分测定
1.3.3.1 液-质分析条件
色谱柱:ACQUITY UPLC BEH C18色谱柱(2.1 mm×50 mm,1.7 μm);流动相:以0.1%甲酸溶液为流动相A,以乙腈为流动相B,进行梯度洗脱(0 min:95%A+5%B;11 min:88.5%A+11.5%B;12 min:30%A+70%B;19 min:30%A+70%B;20 min:95%A+5%B;23 min:95%A+5%B);流速:0.3 mL/min;柱温:25 ℃;进样量:5 μL[11]。
电喷雾离子源,在ESI+模式下采集数据,经调谐确定质谱参数如下:毛细管电压5.0 kV,萃取锥孔电压5 V,RF Lens2.0 V,源温度110 ℃,脱溶剂气温度350 ℃,脱溶剂气流量600 L/h,锥孔气为氮气,流量为50 L/h,碰撞气为高纯氮气,多反应监测(MRM)模式下检测。选择m/z 539.8(双电荷)→612.4和m/z 539.8(双电荷)→923.8为阿胶检测离子对[9],选择m/z 641.3(双电荷)→726.2和m/z 641.3(双电荷)→783.3为牛皮源检测离子对[10]。
1.3.3.2 对照品溶液的制备
精密称取阿胶对照药材0.1 g和牛皮特征肽A 0.1 g置同一个50 mL量瓶中,加1 g/100 mL的NH4HCO3溶液30 mL,超声处理40 min使溶解,并用1 g/100 mL的NH4HCO3溶液定容至刻度,摇匀,过0.22 μm的滤膜,即得。精密量取过滤后的对照品溶液1 mL置液相小瓶中,精确加入1 mg/mL的胰蛋白酶溶液200 μL,37 ℃恒温酶解12 h,注入高效液相色谱-质谱联用仪进行测定[11]。
1.3.3.3 样品溶液的制备
样品称样之前的处理过程同1.3.1.3,精密称取上述样品各0.1 g至50 mL量瓶中,加1 g/100 mL的NH4HCO3溶液30 mL,超声处理40 min,使胶类成分充分溶解,与对照品溶液同法制备并测定[11]。
2 结果与分析
2.1 阿胶含量、蛋白质含量和水分测定
阿胶中L-羟脯氨酸、甘氨酸、丙氨酸和L-脯氨酸4种氨基酸含量测定图谱见图1。
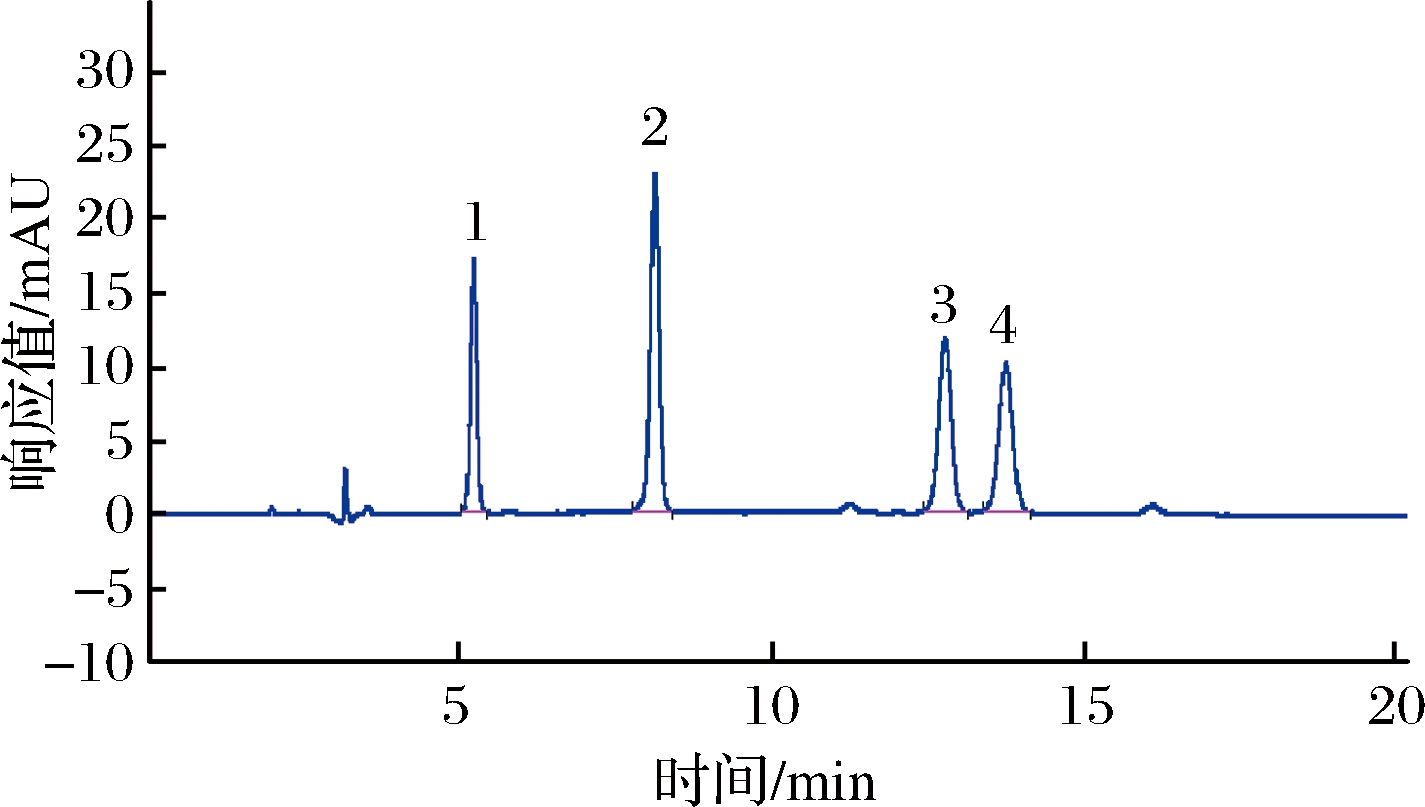
1-L-羟脯氨酸;2-甘氨酸;3-丙氨酸;4-L-脯氨酸
图1 阿胶中4种主要氨基酸含量测定色谱图
Fig.1 The chromatograms of 4 main amino acids in donkey-hide gelatin
按照1.3.1和1.3.2的方法对6种剂型的阿胶类保健食品中阿胶含量、蛋白质含量和水分进行测定,结果见表1。
表1 阿胶类保健食品中阿胶含量和蛋白质含量测定结果
Table 1 Results of content of donkey-hide gelatin and protein in health-care food of donkey-hide gelatin
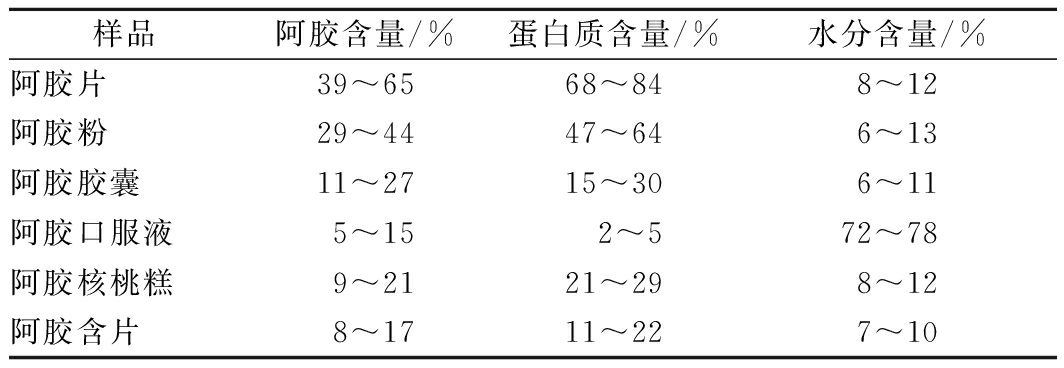
注:阿胶含量为L-羟脯氨酸、甘氨酸、丙氨酸、L-脯氨酸4种氨基酸含量的总和。
阿胶片中以L-羟脯氨酸、甘氨酸、丙氨酸、L-脯氨酸代表的阿胶含量在39%~65%,蛋白质含量在68%~84%,主成分含量较高[14],与阿胶中药材的含量相近。阿胶粉、阿胶胶囊和阿胶含片中,以4种氨基酸代表的阿胶含量差异较大,与阿胶片相比数值较低,蛋白质含量也较低,且该种测定条件下所测得的氨基酸和蛋白质来源除阿胶原材料外还有其他的配方原料,因此实际的阿胶来源的4种氨基酸代表的含量会更低。阿胶口服液中阿胶含量和蛋白质含量均较低,与产品的剂型有一定的关系,该类产品属于液态保健食品,样品中水分的含量较高,在72%~78%范围内。阿胶核桃糕的配比原材料中含有阿胶[2]、黄酒、芝麻[15]、核桃[16]、大枣[17]等,成分较为复杂,以1.3.1和1.3.2方法进行的测定结果可以对阿胶核桃糕的综合营养成分进行评价,以L-羟脯氨酸、甘氨酸、丙氨酸、L-脯氨酸代表的含量在9%~21%,但因阿胶核桃糕成品中L-羟脯氨酸、甘氨酸、丙氨酸和L-脯氨酸4种氨基酸的溯源性未知,所得测定结果不适合说明阿胶口服液中的阿胶含量,专项测定方法有待继续研究。
2.2 阿胶成分和牛皮源成分测定
2.2.1 方法精密度实验
取处理后的对照品溶液按1.3.3方法进行测定,总离子流图见图2,连续测定6次,阿胶检测离子对的2个特征峰保留时间的平均RSD为0.3%;牛皮源检测离子对的2个特征峰保留时间的平均RSD为0.4%,精密度较好。
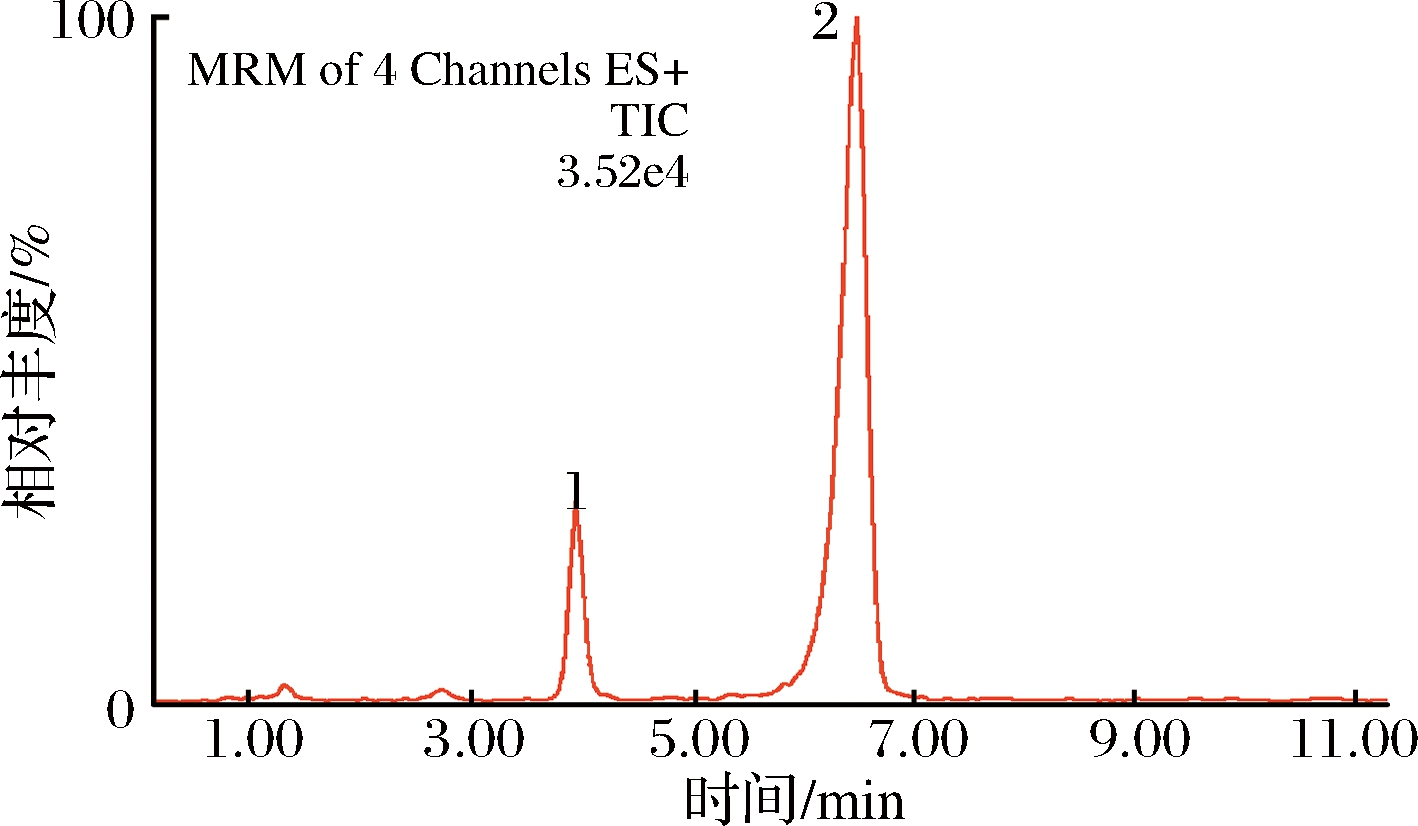
1-牛皮源成分特征峰;2-阿胶成分特征峰
图2 阿胶成分特征峰与牛皮源成分特征峰的多反应监测总离子流图
Fig.2 Total ion chromatograms of MRM of donkey-hide gelatin and bovine-hide gelatin
2.2.2 方法稳定性实验
取处理后的对照品溶液按1.3.3方法,分别在制备完成后0、2、4、8、16、24 h进行测定,阿胶检测离子对的2个特征峰保留时间的平均RSD为0.4%;牛皮源检测离子对的2个特征峰保留时间的平均RSD为0.4%,稳定性较好。
2.2.3 方法检出限实验
取处理后的对照品溶液按1.3.3方法测定,以3倍信噪比计算检出限,牛皮源成分的检出限为9 μg/g;阿胶成分的检出限为42 μg/g。
2.2.4 样品中阿胶成分和牛皮源成分测定
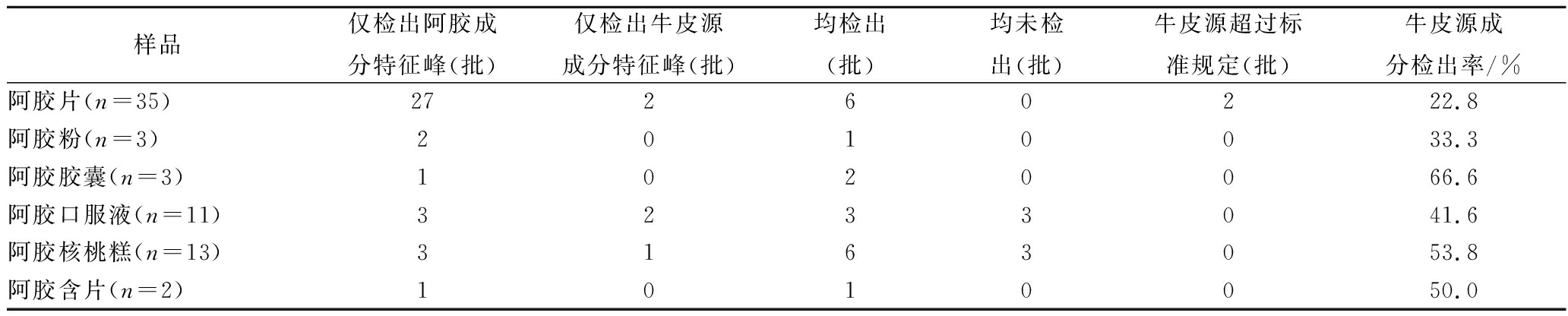
通过1.3.3方法对6种类型共计67份阿胶类保健食品进行测定,样品中阿胶成分和牛皮源成分测定的总离子流图见图3,测定结果见表2。本次测定共计65批合格产品:这些产品中只检出阿胶成分特征峰的有37批,该种产品生产所用的原材料中并未掺入牛皮源成分;产品中检出牛皮源成分特征峰,但并未超过标准规定的有22批,该种产品生产所用的原材料中可能掺入牛皮源成分,一种情况是阿胶原材料中牛皮源成分的掺入比例较低,不超过标准规定,另一种情况是阿胶原材料中牛皮源成分的掺入比例较高,但随着其他原材料和辅料的添加牛皮源成分被稀释,最终在成品中含量不超过标准的规定。本次测定中检出牛皮源成分特征峰且超过标准规定的有2批,即不合格产品,均为阿胶片类型。阿胶成分特征峰和牛皮源成分特征峰均未检出的有6批,主要为阿胶口服液和阿胶核桃糕2种类型。
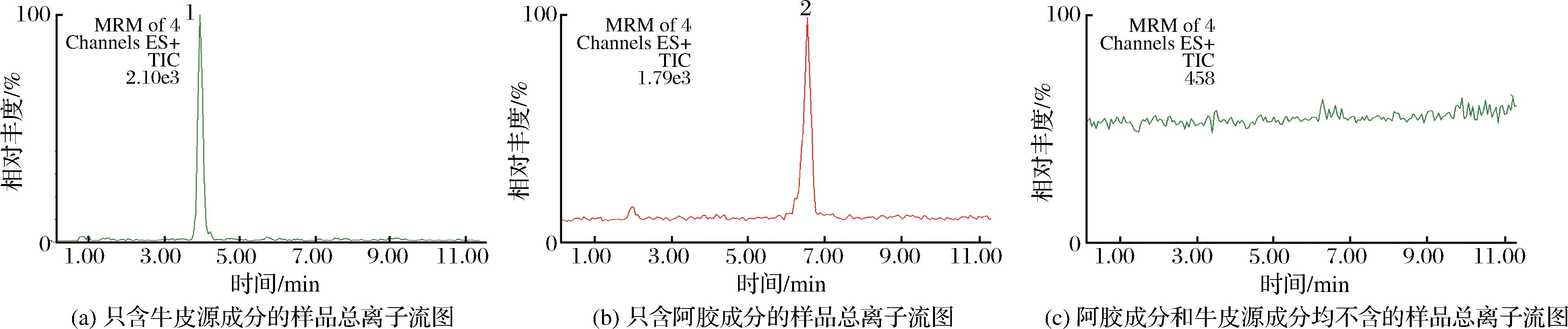
1-牛皮源成分特征峰;2-阿胶成分特征峰
图3 样品中阿胶成分特征峰与牛皮源成分特征峰的多反应监测总离子流图
Fig.3 Total ion chromatograms of MRM of donkey-hide gelatin and bovine-hide gelatin in samples
表2 阿胶类保健食品中阿胶成分和牛皮源成分测定结果
Table 2 Results of determination of donkey-hide gelatin and bovine-hide gelatin in health-care food of donkey-hide gelatin
3 讨论
本文对67批市售的阿胶类保健食品中阿胶成分、牛皮源成分、以4种氨基酸代表的阿胶含量、蛋白质含量均进行了测定,结果发现:与阿胶片相比,其他5种类型的阿胶类保健食品中阿胶含量和蛋白质含量明显较低,这与保健食品的生产工艺及产品配方有着十分密切的关系。以4种氨基酸代表的阿胶含量虽然可以从一定程度上反映出阿胶类保健食品中阿胶原材料的含量,但由于保健食品成品在生产过程中原材料种类较多,这4种氨基酸的溯源性有待进一步研究。
阿胶成分和牛皮源成分的测定结果中,阿胶片类型的保健食品中牛皮源成分的检出率与其他5种类型的保健食品相比较低,但是本次试验中只在阿胶片类保健食品中发现了牛皮源成分峰面积超过标准规定的对照品中牛皮源成分峰面积的样本。一方面是由于阿胶片的各项指标测定结果均与中国药典中规定的标准要求较为一致,所以采用阿胶中药材的牛皮源限值标准来要求阿胶片时有利于发现问题并促进产品质量提高;另一方面,本试验的测定结果可以反映出其他5种类型的保健食品成品中,未发现牛皮源成分检出且峰面积超过标准规定的峰面积的情况,但其生产所用的阿胶原材料中牛皮源的掺入量却无法体现。根据市场上现有的阿胶类保健食品的剂型区别制定牛皮源限值标准是下一步研究的方向。
参考文献
[1] 吴长虹,王若光.阿胶的历史沿革、研究现状及相关思考[J].湖南中医药大学学报,2008,28(6):77-79.
[2] 胡军影,呈显隆,肖新月,等.阿胶的化学成分及质量评价方法研究进展[J].中国药事,2007,21(3):193-195.
[3] 赵曦,翟乙娟,都恒青,等.30种商品阿胶的质量比较[J].中国药学杂志,2000,35(10):690-692.
[4] 高景会,王蕊,范锋.阿胶现代研究进展[J].中国药事,2011,25(4):396-401.
[5] 尚汝瑶,杨昭鹏,冯磊.国家药品补充检验方法管理工作的现状与思考[J].中国药事,2014,28(6):576-579.
[6] 陈慧慧,冯明建,朱海芳,等.阿胶药理研究进展[J].药物研究,2014,31(1):23-26.
[7] 王若光,尤昭玲,刘小丽,等.基于激光解析/离子化-飞行时间质谱技术的中药阿胶蛋白质组分析[J]. 中国组织工程研究与临床康复,2007,13:2 518-2 521.
[8] 吴亚君,王斌,刘鸣畅,等.阿胶中马和驴成分的实时荧光PCR检测[J].食品科学,2014,35(8):85-88.
[9] 张贵锋,刘涛,王前,等.中药阿胶的质量控制方法研究[J]. 药物生物技术,2009,3:250-254.
[10] 国家药典委员会.中华人民共和国药典[M].一部.北京:化学工业出版社,2015:189-190.
[11] 中国食品药品检定研究院.阿胶中牛皮源质量的补充检验方法[EB/OL].[2014-12-21].http://www.doc88.com/p-3137587400245.html.
[12] 国家药典委员会.中华人民共和国药典[M].四部.北京:化学工业出版社,2015:103-104.
[13] GB 5009.5—2010,食品安全国家标准食品中蛋白质的测定[S].北京:中华人民共和国卫生部,2010.
[14] 毛跟年,郭倩,瞿建波,等.阿胶化学成分及药理作用研究进展[J].动物医学进展,2010,31(11):83-85.
[15] 汪学德,崔英德,刘兵戈,等.芝麻各成分相关性分析[J].中国油脂,2015,40(11):99-103.
[16] 陆俊,赵安琪,成策,等.核桃营养成分与生理活性及开发利用[J].食品与机械,2014,30(6):238-242.
[17] 王蓉珍,赵子青,林勤保,等.大枣功效成分检测的研究进展[J].食品工业科技,2012,33(4):423-426.