食用单核细胞增生李斯特菌、沙门菌、弯曲杆菌、大肠杆菌和金黄色葡萄球菌等致病菌污染的食物,会引起食源性疾病甚至死亡,造成沉重的经济负担,这对食品工业和医疗行业是全球性的挑战。我国卫计委网络直报系统在2009-2013年共收到食源性疾病暴发事件1224起,累计中毒人数38 958人,死亡人数749人,其中微生物和生物毒素引发的食源性疾病暴发事件数、患者和死亡人数分别占到72%、76%和66%,说明病原微生物防控依然是我国食品安全的刚性需求[1]。而在美国,每年约有940万人因食用包括致病菌污染在内的食物而患病,其中单纯与食源性疾病爆发有关的疾病约46%是因未使用抗菌剂的即食产品[2]。可见,抗菌剂的使用对食源性疾病的防控起着重要作用。然而,细菌耐药性问题日趋严峻,耐药菌会导致严重疾病甚至死亡。每年仅在美国感染耐药菌的200万人中就有2.3万人死亡,而因食源性病原菌引发的食品安全问题也日趋严重[3]。传统抗菌剂对食源性耐药病原菌的控制也逐渐显现出不足,对抗细菌耐药的新型抗菌剂的研发成为当前的研究热点之一。
早在20世纪初,噬菌体就作为天然抗菌剂被广泛使用。如今,因其特异性裂解细菌且不易引起细菌抗性的特点受到广大研究者的青睐。在食品工业中,噬菌体也越来越多被用于食源性致病菌的防控[4]。
目前,国内对噬菌体在食品工业中应用的概述多集中于噬菌体在检测技术中的作用,而噬菌体在具体食品中对致病菌作用的分析总结相对比较缺乏。因此,本文对噬菌体在肉及肉制品、乳制品、果蔬制品中的应用进行概述,以期为噬菌体作为食品抗菌剂研究提供一定的参考。
1 噬菌体概述
噬菌体(bacteriophage, phage)由法籍加拿大微生物学家D′HERELLE根据其发现于1917年在会议上正式提出[5]。而追溯对噬菌体的相关报道最早应该在1915年,TWORT观察到葡萄球菌培养物的滤液可将其他葡萄球菌菌株裂解并形成清晰的噬菌斑,并将这一现象进行报道[5]。
1.1 生物学特性
噬菌体是最大的病毒群体,可存在于多种生态环境中,种类繁多,数量巨大,约达到1031种,并且能利用细菌和古细菌作为宿主进行繁殖,其大小通常在20~200 nm之间[6]。噬菌体多为有尾结构,按尾部形状,可将其分为多面体(二十面体或准二十面体)、丝状体、多形性噬菌体[7]。噬菌体的尾丝含有能识别宿主细胞壁表面分子的蛋白,这使得噬菌体能专一吸附于宿主细胞。大多数噬菌体较为稳定,能在pH值5~9环境下存活,60 ℃加热30 min才能使其失活。噬菌体的生长繁殖分为吸附、侵入、增殖、装配和裂解5个阶段。根据其生命周期可分为裂解性噬菌体和溶源性噬菌体两类[8]。裂解性噬菌体往往能造成细菌的直接死亡。在其生长繁殖过程中,裂解性噬菌体将自身的基因注入到宿主体内,再复制装配成子代噬菌体颗粒使宿主细胞壁发生裂解,并最终释放出多个噬菌体颗粒,释放的颗粒数取决于噬菌体的类型,整个裂解周期通常在1~2 h即可完成。而溶源性噬菌体则不会使宿主细胞裂解死亡,而是通过改变宿主表型而增强宿主的致病力,它们通常整合自身的遗传物质到宿主的核染色体,长期伴随宿主基因组DNA同步复制[9]。
1.2 抑菌机理
1.2.1 作用宿主细胞
噬菌体对病原菌的杀菌机制主要是通过裂解宿主细胞完成的。裂解过程中主要依赖裂解酶和早期蛋白。相较活性噬菌体,噬菌体裂解酶更易于定向操作,具有更宽的裂解谱,不增殖且几乎不产生细菌抗性。内溶素是目前研究报道最多的噬菌体裂解酶,通常在噬菌体裂解后期释放,其本质是蛋白酶,在噬菌体发挥裂解过程中起关键作用,可特异性作用于细菌细胞壁[10]。
与裂解酶不同,早期蛋白则是通过抑制宿主细胞的正常分裂而达到杀菌抑菌的目的。早期蛋白在噬菌体利用宿主资源的过程中起到关键作用,可以抑制宿主DNA的复制,干扰宿主菌的转录过程[11-12]。
1.2.2 作用宿主菌膜
生物被膜、生物膜或生物菌膜(biofilm,BF)是由食源性致病菌在食品及加工器械表面黏附生长,并在菌体或者菌体与接触面的相互作用下,通过菌体增殖、分泌胞外基质而形成的具有一定空间结构的细菌聚集体。其形成是一个动态过程,包括细菌起始黏附、扩张、分化和成熟扩散等阶段。生物膜细菌对抗生素和宿主免疫防御机制的抗性很强,食源性致病菌BF已经造成多起食源性食物中毒事件[13]。基于BF的危害性,对其进行破除已成为致病菌防控的重要手段。而噬菌体及其编码的酶类在破解BF的过程中体现出极强的效果。
噬菌体对细菌BF的破除主要依赖3条途径,分别是诱导[14]、裂解[15]和抑制[16],如表1所示。
表1 噬菌体裂解BF机制
Table 1 The lysis of biofilm by phages

1.3 噬菌体安全性
与传统抗菌药物如抗生素相比,噬菌体具有足够安全的使用历史,研究声称由于噬菌体是细菌病毒,不可能感染哺乳动物细胞。综合目前对于噬菌体使用的研究报道,表2从噬菌体来源、作用对象、作用方式、作用剂量、免疫反应等方面简单总结噬菌体的安全性。
表2 噬菌体安全评价
Table 2 The safety evaluation of phages
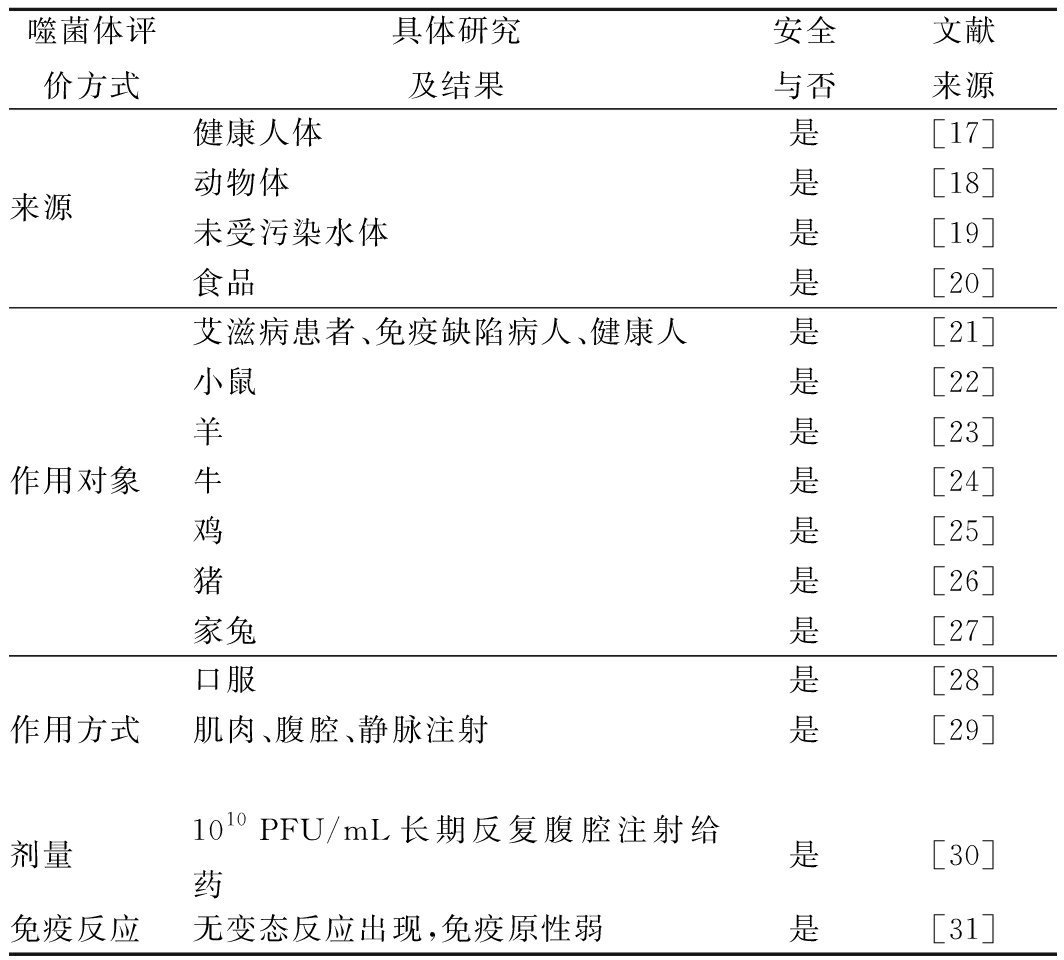
然而,由于噬菌体病毒的本质,其某些结构组分可能是病原性的,加之编码的一些调控因子能够促使宿主毒力因子的表达,将其用作抗菌剂保障食品安全的安全性始终遭受部分学者质疑[32]。某些研究结果暗示噬菌体存在着一定的潜在安全隐患。O’FLYNN等[33]在利用噬菌体混合物清除大肠埃希菌的实验中,出现对噬菌体不敏感突变体。这些突变株与亲代菌株具有相近的生长速率,但在形态学则更倾向于球菌体,尽管这些突变株的发生频率非常低,且不会阻碍噬菌体作为生物防治剂的使用,但是突变体的出现让噬菌体使用的安全性受到一定的质疑。此外,SANTANDER等[34]发现在利用噬菌体作用肠炎沙门菌的过程中,出现缺失噬菌体吸附所需O-多糖层而对噬菌体不敏感的突变株,但这种突变同时也使肠炎沙门菌的毒力丧失。因此,作者提出可通过选择具有低转导频率的噬菌体来预防致病菌毒力的转导。
就目前研究报道结果,噬菌体的使用绝大多数是安全的,而耐受噬菌体突变体的出现却又有发生。因此,作为在食品使用的噬菌体,由于最终面向消费者,更应具有能够保障其安全性的一些特性。如极强的溶解性、能作用于所有重要的流行病学目标微生物菌株、具有尽可能低的转导频率而防止抗性基因的转移、对于抗菌谱较窄的噬菌体则能够通过噬菌体混合液达到改善[35]。
2 噬菌体在食品工业中对食源性致病菌的作用
由于噬菌体来源广泛,具有安全的使用历史,已被尝试用于食品工业多个领域中食源性致病菌的防控。
2.1 肉及肉制品中的应用
O’FLYNN等[33]将e11/2, e4/1c,pp01噬菌体混合液应用于肉类表面, 77%的样本中大肠杆菌O157∶H7被彻底根除。HUDSON等[36]描述了噬菌体AHEc1的分离及特性,并将其用于感染大肠杆菌O157∶H7的牛肉片上,模拟热去骨和常规尸体冷却模式下的作用效果,并对噬菌体作用条件进行优化。结果表明噬菌体以3.2×107PFU/4 cm2的浓度作用牛肉片对大肠杆菌O157:H7清除效果最好。ZHANG等[37]用不同种类的志贺菌污染即食五香鸡肉,再以1×108PFU/g单一噬菌体和3×108PFU/g噬菌体混合液进行喷涂处理,处理后实验样品置于37 ℃培养72 h。结果发现,无论是单一噬菌体还是噬菌体混合液均能一定程度的降低样品中志贺菌的数量,其中噬菌体混合液能在72 h内将样品中污染的志贺菌完全清除,其清除效果优于单一噬菌体。
除单独利用噬菌体对致病菌进行防控外,还有研究者将噬菌体与山梨酸钾、乳酸钠等传统抗菌剂进行效果对比研究。WANG等[38]在沙门菌感染的冷鲜猪肉上应用噬菌体,并将其与传统抗菌剂山梨酸钾和乳链球菌素进行效果对比研究。结果表明,噬菌体与乳链球菌素以及山梨酸钾复配使用能取得最好效果。FIGUEIREDO ACL等[39]用单核细胞增生李斯特菌的混合物接种即食猪肉火腿片,再将噬菌体P100,乳酸链球菌肽和乳酸钠单独或联合施用于即食猪肉火腿片的表面,从而考察对单核细胞增生李斯特菌的抑制效力。研究结果表明,单独处理中噬菌体P100是最有效的,乳酸钠效果最差。
2.2 乳及乳制品中的应用
噬菌体作为致病菌的抗菌剂,在乳及乳制品中也有不少应用研究。TOMAT等[40]从粪便中分离出2种噬菌体,并将它们在牛奶发酵过程中作为致病性大肠杆菌的生物防治剂。结果显示所选噬菌体DT1和DT6单独或混合作用,均能有效降低牛奶发酵过程中产志贺毒素大肠杆菌(Shiga toxin- producing Escherichia coli, STEC)的数量,并且不会对发酵剂嗜热链球菌的培养性能产生任何的不利影响。GUENTHER等[41]对具有广泛抑菌谱的裂性噬菌体FO1-E2在巧克力牛奶中减少鼠伤寒沙门菌的作用效果进行了实验。样品加入1×103 CFU/g鼠伤寒沙门菌后,用3×108 PFU/g噬菌体处理,于8 ℃或15 ℃恒温培养6 d。牛奶中鼠伤寒沙门菌在8 ℃无存活,在15 ℃降低5 lg CFU / mL,说明裂性噬菌体FO1-E2对污染牛奶的鼠伤寒沙门菌能起到有效防治。
TABLA等[42]在巴氏灭菌的全脂牛奶中,通过25 ℃下培养牛奶48 h进行冷链断裂模拟,以期考察噬菌体vB_SauS-phi-IPLA35(phiIPLA35)和vB_SauS-phi-IPLA88(phiIPLA88)及高静水压(HHP)对金黄色葡萄球菌Sa9的联合作用效果,实验对金黄色葡萄球菌设置初染浓度分别为1×104 CFU/mL和1×106 CFU/mL。结果显示在2种初染浓度下,高静水压(HHP)和噬菌体之间均有协同作用,联合作用能将初始金黄色葡萄球菌污染降低至检测限(<10 CFU/mL)以下。在此过程中,噬菌体能使高静水压(HHP)的处理条件更温和,因此噬菌体可认为是最低限度加工食品的一种有效设置。
2.3 蛋及蛋制品中的应用
GUENTHER等[41]在蛋黄中对具有广泛抑菌谱的裂性噬菌体FO1-E2作用鼠伤寒沙门菌的效果进行研究,样品加入1×103 CFU/g鼠伤寒沙门菌后用3×108 PFU/g噬菌体处理,于8 ℃或15 ℃恒温培养6 d。结果显示抑菌效果出现在第2天,且作用效果持续性较差。作者推测噬菌体颗粒容易被蛋黄基质固定,从而丧失扩散和感染靶细胞的能力,使最初的杀伤作用得不到补偿,以至于在实验结束时,出现了抗噬菌体的沙门菌,但实验结果依然能证明裂性噬菌体FO1-E2可以作为食品中的沙门菌生物防治的有效措施。
关于蛋黄基质对噬菌体作用致病菌的影响在另一项研究也得到证实。HONG等[43]将1种广谱沙门菌噬菌体vB_SalS_SJ_2(SJ2,108PFU; MOI=10)用于受沙门菌污染的猪肉和鸡蛋液中,以量化食物基质中的噬菌体抗性株的发展。在不同的时间点用单一噬菌体处理能显著降低猪肉和鸡蛋液中肠炎沙门菌和鼠伤寒沙门菌的污染。在对沙门菌控制过程中作者发现,噬菌体的抑菌效果与温度有关,较高温度能更有效抑制沙门菌的生长。实验还对噬菌体抗性株进行检测,结果显示室温下培养48 h后,噬菌体抗性株在鸡蛋液中显著升高,而猪肉样品中无显著变化。说明食物基质可能会影响噬菌体抗性菌株的出现,且噬菌体抗性菌株在不复杂的食物中发展地更快。
2.4 水产品中的应用
在鱼、海鲜等水产品中,噬菌体对致病菌也有很好的防控效果。GUENTHER等[41]对具有广泛抑菌谱的裂性噬菌体FO1-E2在海鲜中减少鼠伤寒沙门菌的作用效果进行研究,鼠伤寒沙门菌以1×103 CFU/g浓度污染样品,噬菌体以3×108 PFU/g浓度进行处理后,8 ℃和15 ℃恒温培养6 d。结果显示噬菌体FO1-E2在8 ℃条件下能使沙门菌全部死亡。15 ℃时,沙门氏菌降低3 log CFU/g。GALARCE等[44]将肠炎沙门菌接种于混合海鲜组织中,再用噬菌体混合液处理,分别在4 ℃和18 ℃培养10 d。研究结果表明,噬菌体能将混合海鲜组织中的肠炎沙门菌显著降低1.9个对数单位。AHMADI等[45]研究了裂性噬菌体(VP)和高静水压力(HHP)对鲑鱼、贻贝中霍乱弧菌的灭活效果。结果显示,样品在条件为550 MPa或350 MPa HHP作用5 min后添加噬菌体处理,能使霍乱弧菌完全失活。因此,HHP和VP的联合使用,可作为海鲜加工中防控致病菌的有效栅栏技术。
2.5 果蔬类制品中的应用
鲜切农产品行业在过去的10年中一直是食品零售市场增长最快的部分,能为消费者提供便利和营养。然而,由于鲜切果蔬切割表面营养物质的暴露,相较完整产品更容易被病原菌侵染而引起食品安全问题。LEVERENTZ等[46]发现接种单核细胞增生李斯特菌并在10 ℃贮存7 d后,鲜切苹果中单核细胞增生李斯特菌的含量仅略有增加,而在鲜切蜜瓜中却显著增加。此外,他们通过喷洒和注射2种方法对人工污染单核细胞增生李斯特菌的蜜瓜和苹果施用噬菌体,并对噬菌体特异性裂解单核细胞增生李斯特菌的影响进行了研究。结果显示,与对照组相比,噬菌体与乳酸链球菌肽联合使用,可使单核细胞增生李斯特菌在蜜瓜切片和苹果切片分别减少5.7 lg CFU/g和2.3 lg CFU/g,且噬菌体抑菌作用与单增李斯特菌的初始浓度有关。
PERERA等[47]将2×103CUF/g浓度的单核细胞增生李斯特菌菌液以10 mL/kg的量作用于生菜表面作为测试组,相同剂量的无菌水处理对照组,室温下定殖60 min后,测试组给予1×107 PFU/g浓度的噬菌体制剂ListShield TM处理。处理后每组均取样25 g至225 mL蛋白胨水均质,并涂布于单核细胞增生李斯特菌选择培养基于(35±2) ℃温育(24±2) h,以测定单核细胞增生李斯特菌的浓度。而鲜切苹果片则被1×104CFU/g浓度的单增李斯特菌以1.0 mL/kg的比例处理,相同剂量无菌水处理作为对照组,允许菌液在苹果片表面定殖10 min。然后测试组分别用抗氧化剂AS,1.1×106 PFU/g噬菌体制剂ListShieldTM或AS与1.1×106 PFU/g噬菌体制剂ListShieldTM联合处理。处理后所有苹果片样品均置于4 ℃储存,并分别于24、48、72 h取样进行单核细胞增生李斯特菌浓度的测试。结果表明,噬菌体制剂ListShieldTM处理后,生菜中单核细胞增生李斯特菌显著减少91%(1.1 lg)(P<0.05);而单独使用噬菌体制剂ListShieldTM或与抗氧化剂AS联合使用,4 ℃ 24 h后苹果片上单核细胞增生李斯特菌的污染显著性减少93%(1.1 lg)(P<0.001)。且样品的颜色,味道等感官品质不受任何影响。因此,噬菌体制剂ListShieldTM可用于降低食物受单核细胞增生李斯特菌污染的风险。
3 展望
噬菌体是自然存在于周围环境的细菌天敌。目前,将其在兽医、临床、食品等领域作为传统抗生素和抗菌剂替代物的研究都展开了相关工作。
综合研究结果,单就食品领域致病菌的防控,未来还需要深入探索,比如,虽然噬菌体在食物中永远存在,然而消费者对食物添加病毒的看法依然会成为噬菌体广泛用于食品中致病菌生物控制中需要克服的最关键障碍;在食品中对噬菌体功效的研究几乎都是将致病菌进行人工接种,因此这些实验不一定能全面反映真实情况;此外,还应注意致病菌防控过程中抗性菌株的出现,以及食品基质对噬菌体作用效果的影响。
参考文献
[1] 旭日干,庞国芳. 中国食品安全现状,问题及对策战略研究[M].北京:科学出版社,2015:56.
[2] ERICKSON M C, DOYLE M P. The challenges of eliminating or substituting antimicrobial preservatives in foods[J]. Annual Review of Food Science and Technology, 2017, 8: 371-390.
[3] 谈笑,王娉,李睿,等. 动物源性食品中病原菌的耐药性研究进展[J]. 食品科学, 2017, 38(19): 285-293.
[4] KAZI M, ANNAPURE U S. Bacteriophage biocontrol of foodborne pathogens[J]. Journal of Food Science and Technology, 2016, 53(3): 1 355-1 362.
[5] 李刚,胡福泉. 噬菌体治疗的研究历程和发展方向[J].中国抗生素杂志,2017,42(10):807-813.
[6] KUTTER E, SULAKVELIDZE A. Bacteriophages: biology and application s [M]. Boca Raton: CRC Press,2004.
[7] ACKERMANN H W. 5500 Phages examined in the electron microscope[J]. Archives of Virology, 2007, 152(2): 227-243.
[8] ACKERMANN H W. Phage classification and characterization[J]. Methods in Molecular Biology, 2009,501:127.
[9] ELIZABETH KUTTER, ALEXANDER SULAKVELIDZE . Bacteriophages: Biology and applications[M]. CRC, Washington,2005.
[10] ROACH D R, KHATIBI P A, BISCHOFF K M, et al. Bacteriophage-encoded lytic enzymes control growth of contaminating Lactobacillus found in fuel ethanol fermentations[J]. Biotechnology for Biofuels, 2013, 6(1): 20.
[11] MOSIG G, COLOWICK N E, PIETZ B C. Several new bacteriophage T4 genes, mapped by sequencing deletion endpoints between genes 56 (dCTPase) and dda (a DNAdependent ATPase-helicase) modulate transcription[J].Gene, 1998, 223(1-2): 143-155.
[12] KIRO R, MOLSHANSKI M S, YOSEF I, et al. Gene product 0.4 increases bacteriophage T7 competitiveness by inhibiting host cell division[J]. Proceedings of National Academy Sciences, 2013,110(48): 19 549-19 554.
[13] 王虎虎. 肉源沙门氏菌生物菌膜的形成及转移规律研究[D]. 南京:南京农业大学, 2014.
[14] HUGHES G, WALKER J T, SHARP R, et al. Bacteriophage for the treatment of bacterial biofilms: US, 7758856B2[P]. 2010-07- 20.
[15] KWIATEK M, PARASION S, RUTYNA P, et al. Isolation of bacteriophages and their application to control Pseudomonas aeruginosa in planktonic and biofilm models[J]. Research Microbiol, 2017, 168(3): 194-207.
[16] KAISTHA S D, UMRAO P D. Bacteriophage for mitigation of multiple drug resistant biofilm forming pathogens[J]. Recent Pat Biotechnol, 2016, 10(2): 184-194.
[17] KEEN E C, ADHAY S L. Phage therapy: current research and applications[J]. Clinical Infectious Diseases, 2015,61(1): 141-142.
[18] ENDERSEN L, MAHONY J O, HILL C, et al. Phage therapy in the food industry[J]. Annual Review of Food Science and Technology, 2014, 5: 327-349.
[19] BERGH Ø, BØRSHEIM K Y, BRATBAK G, et al. High abundance of viruses found in aquatic environments[J]. Nature, 1989, 340(6 233): 467-468.
[20] WANG C, CHEN Q, ZHANG C, et al. Characterization of a broad host-spectrum virulent Salmonella bacteriophage fmb-p1 and its application on duck meat[J]. Virus Research, 2017, 236: 14-23.
[21] HYMAN P, HYMAN P, ABEDON S T. Bacteriophages in Health and Disease: Bacteriophages in Health and Disease[M]. Wallingford :CABI Publishing, 2012.
[22] HWANG J Y, KIM J E, SONG Y J, et al. Safety of using Escherichia coli bacteriophages as a sanitizing agent based on inflammatory responses in rats[J]. Food Science and Biotechnology, 2016, 25(1): 355-360.
[23] DRILLING A, MORALES S, BOASE S, et al. Safety and efficacy of topical bacteriophage and ethylenediaminetetraacetic acid treatment of Staphylococcus aureus infection in a sheep model of sinusitis[J]. International Forum of Allergy & Rhinology, 2014, 4(3): 176-186.
[24] DUENAS F, RIVERA D, TOLEDO V, et al. Characterization of Salmonella phages from dairy calves on farms with history of diarrhea[J]. Journal of Dairy Science, 2017, 100(3): 2 196-2 200.
[25] HAMMERL J A, JACKEL C, ALTER T, et al. Reduction of Campylobacter jejuni in broiler chicken by successive application of group II and group III phages[J]. Plos One, 2014, 9(12): e114 785.
[26] SEO B J, SONG E T, LEE K, et al. Evaluation of the broad-spectrum lytic capability of bacteriophage cocktails against various Salmonella serovars and their effects on weaned pigs infected with Salmonella Typhimurium[J]. Journal of Veterinary Medical Science, 2018,80(6): 851-860.
[27] YEN M, CAIMS L S, CAMILLI A. A cocktail of three virulent bacteriophages prevents Vibrio cholerae infection in animal models[J]. Nature Communications, 2017, 8: 14 187.
[28] CHA K, OH H K, JANG J Y, et al. Characterization of two novel bacteriophages infecting multidrug-resistant (MDR) Acinetobacter baumannii and evaluation of their therapeutic efficacy in vivo[J]. Frontiers in Microbiology, 2018, 9: 696.
[29] CARLTON R M, NOORDMAN W H, BISWAS B, et al. Bacteriophage P100 for control of Listeria monocytogenes in foods: genome sequence, bioinformatic analyses, oral toxicity study, and application[J]. Regulatory Toxicology and Pharmacology, 2005, 43(3): 301-312.
[30] BISWAS B, ADHYA S, WASHART P, et al. Bacteriophage therapy rescues mice bacteremic from a clinical isolate of vancomycin-resistant Enterococcus faecium[J]. Infection and Immunity, 2002, 70(1): 204-210.
[31] SUNAGAR R, PATIL S A, CHANDRAKANTH R K. Bacteriophage therapy for Staphylococcus aureus bacteremia in streptozotocin-induced diabetic mice[J]. Research in Microbiology, 2010, 161(10): 854-860.
[32] 李萌. 宽裂解谱沙门氏菌噬菌体的基因组学分析及其重组内溶素抑菌活性研究[D]. 青岛:中国海洋大学, 2014.
[33] OFLYNN G, ROSS R P, FITAGERALD G F, et al. Evaluation of a cocktail of three bacteriophages for biocontrol of Escherichia coli O157: H7[J]. Applied and Environmental Microbiology, 2004, 70(6): 3 417-3 424.
[34] SANTANDER J, ROBESON J. Phage-resistance of Salmonella enterica serovar Enteritidis and pathogenesis in Caenorhabditis elegans is mediated by the lipopolysaccharide[J]. Electronic Journal of Biotechnology, 2007, 10(4): 627-632.
[35] MCINTYRE L, HUDSON J A, BILLINGTON C, et al. Biocontrol of foodborne bacteria: past, present and future strategies[J]. Food New Zealand, 2007, 7(5): 25.
[36] HUDSON J A, BILLINGTON C, CORNELIUS A J, et al. Use of a bacteriophage to inactivate Escherichia coli O157: H7 on beef[J]. Food Microbiology, 2013, 36(1): 14-21.
[37] ZHANG H, WANG R, BAO H. Phage inactivation of foodborne Shigella on ready-to-eat spiced chicken[J]. Poultry Science, 2013, 92(1): 211-217.
[38] WANG C, YANG J, ZHU X, et al. Effects of Salmonella bacteriophage, nisin and potassium sorbate and their combination on safety and shelf life of fresh chilled pork[J]. Food Control, 2017, 73: 869-877.
[39] FIGUEIREDO A C L, ALMEIDA R C C. Antibacterial efficacy of nisin, bacteriophage P100 and sodium lactate against Listeria monocytogenes in ready-to-eat sliced pork ham[J]. Brazilian Journal of Microbiology, 2017,48(4):714-729.
[40] TOMAT D, MERCANTI D, BALAGUE C, et al. Phage biocontrol of enteropathogenic and Shiga toxin-producing Escherichia coli during milk fermentation[J]. Letters in Applied Microbiology, 2013, 57(1): 3-10.
[41] GUENTHER S, HERZIG O, FIESELER L, et al. Biocontrol of Salmonella typhimurium in RTE foods with the virulent bacteriophage FO1-E2[J]. International Journal of Food Microbiology, 2012, 154(1): 66-72.
[42] TABLA R, MARTINEZ B, REBOLLO J E, et al. Bacteriophage performance against Staphylococcus aureus in milk is improved by high hydrostatic pressure treatments[J]. International Journal of Food Microbiology, 2012, 156(3): 209-213.
[43] HONG Y, SCHMIDT K, MARKS D, et al. Treatment of salmonella-contaminated eggs and pork with a broad-spectrum, single bacteriophage: Assessment of efficacy and resistance development[J]. Foodborne Pathogens and Disease, 2016, 13(12): 679-688.
[44] GALARCE N E, BRAVO J L, Robeson J P, et al. Bacteriophage cocktail reduces Salmonella enterica serovar Enteritidis counts in raw and smoked salmon tissues[J]. Revista Argentina de Microbiologia, 2014, 46(4): 333-337.
[45] AHMADI H, ANANY H, WALKLING R M, et al. Biocontrol of Shigella flexneri in ground beef and Vibrio cholerae in seafood with bacteriophage-assisted high hydrostatic pressure (HHP) treatment[J]. Food and Bioprocess Technology, 2015, 8(5): 1 160-1 167.
[46] LEVERENTZ B, CONWAY W S, CAMP M J, et al. Biocontrol of Listeria monocytogenes on fresh-cut produce by treatment with lytic bacteriophages and a bacteriocin[J]. Applied and Environmental Microbiology, 2003, 69(8): 4 519-4 526.
[47] PERERA M N, ABULADZE T, LI M, et al. Bacteriophage cocktail significantly reduces or eliminates Listeria monocytogenes contamination on lettuce, apples, cheese, smoked salmon and frozen foods[J]. Food Microbiology, 2015, 52: 42-48.