低聚半乳糖(galactooligosaccharides,GOS)是由0~6个半乳糖连接到乳糖分子的半乳糖基一侧形成的一种杂低聚糖,即Gal-(Gal)n-Glc/Gal(n为0~6)。在自然界中,GOS主要存在于动物乳汁中,人类母乳中的GOS含量较多[1]。因其具有热值低,促进双歧杆菌增殖,低龋齿性,防止便秘,改善脂质代谢以及提高免疫力等生理功能,被广泛应用于食品、医药等行业[1-2]。GOS的制备方法主要有:从天然原料中提取、化学合成法、直接发酵法和酶法合成等[2]。其中,酶法合成具有反应条件温和、操作简单和效率高等优点,是目前工业生产上最常用的方法[3]。它主要是以乳清或乳糖为底物,利用β-半乳糖苷酶催化合成GOS。然而,由于β-半乳糖苷酶同时具有水解活性和转苷活性,反应后期随着底物浓度的降低,酶的水解活性更加突出,从而将合成的GOS二次水解,导致GOS的收率较低,这是GOS酶法制备中面临的主要问题[4]。
内切β-1,4-半乳聚糖酶(endo-β-1,4-galactanase,EC 3.2.1.89)属于糖苷水解酶第53(GH53)家族,可以特异性地水解β-1,4-半乳聚糖和鼠李半乳糖醛酸聚糖I(简称RGI,来源于非木本植物细胞壁中的果胶)中的β-1,4糖苷键产生低聚半乳糖[5-6]。此外,它在木质纤维素的生物转化[6]、果汁和葡萄酒加工、动物饲料的改良、洗涤剂、纺织和造纸等行业也有广泛的应用[7-8]。目前,国外学者对内切β-1,4-半乳聚糖酶做了大量研究,包括分离纯化、异源表达、酶学性质研究、三维结构解析和分子改造等,国内目前尚未见相关研究。已报道的内切β-1,4-半乳聚糖酶主要来源于细菌和丝状真菌,其中大部分属于青霉和曲霉属[9]。
该研究拟采用分子克隆技术,将黑曲霉CICIM F0510中的内切β-1,4-半乳聚糖酶基因在毕赤酵母中进行克隆表达,进行初步纯化后,系统解析其生化特征,并初步探讨其水解土豆浆制备低聚半乳糖的可行性,为该酶在低聚半乳糖制备行业中的应用提供材料和技术支持。
1 材料与方法
1.1 材料
1.1.1 菌株、质粒和培养条件
黑曲霉CICIM F0510[10]和大肠杆菌JM109为本实验室保存菌株。毕赤酵母GS115及表达质粒pPIC9K购自Invitrogen公司。重组毕赤酵母GS115 (pPIC-aghA)研究中构建、筛选和保藏。黑曲霉和大肠杆菌分别采用PDA和LB培养基进行培养;毕赤酵母所用培养基MD、YPD、BMGY和BMMY等按照Invitrogen公司的Pichia Expression Kit进行配制。
1.1.2 主要试剂
PyrobestTM DNA聚合酶和蛋白分子量标准,美国Thermo公司产品;RNA抽提试剂盒(High Pure RNA Isolation Kit)和cDNA合成试剂盒(Transcriptor High Fidelity cDNA Synthesis Kit),Roche公司产品;无氨基酵母氮源、胰蛋白胨和酵母抽提物,英国OXOID公司提供;半乳聚糖(galactan(potato)),爱尔兰Megazyme公司;色谱纯乙腈和薄层层析硅胶板分别由生工生物工程(上海)股份有限公司和烟台德信生物科技有限公司提供;其他试剂均为国产分析纯。
1.2 实验方法
1.2.1 重组毕赤酵母的构建
黑曲霉总RNA的提取、cDNA的制备、PCR及产物的纯化、质粒的提取、酶切、连接以及转化等均采用实验室常规方法[11],使用试剂盒时按照试剂盒说明书进行。其中,PCR过程中所用的引物![]() 下划线部分为限制性酶切位点)由生工生物工程(上海)股份有限公司合成。
下划线部分为限制性酶切位点)由生工生物工程(上海)股份有限公司合成。
1.2.2 内切β-1,4-半乳聚糖酶的异源表达及分离纯化
将重组毕赤酵母GS115(pPIC-aghA)的单菌落接种到25 mL YPD液体培养基中,于30 ℃、200 r/min培养至OD600值为2.0~6.0(约16~18 h)。然后按体积分数为1%的接种量接入25 mL BMGY培养基中,30 ℃、200 r/min培养至对数生长期。再离心(4 ℃,5 000 r/min)5 min回收酵母细胞,并将其重悬于50 mL BMMY培养基中,使其OD600值为1.0,于30 ℃、200 r/min继续培养。每隔24 h补加无水甲醇至终体积分数为0.5%,以维持诱导,并同时取样进行酶活测定,直至酶活不再增加。发酵结束后,12 000 r/min离心10 min收集发酵液,即为粗酶液。
将粗酶液用饱和度分别为30%和90%的硫酸铵进行分级沉淀,再通过PD-10脱盐柱去除盐离子。最后,采用凝胶柱Superdex 75 10/300 GL对其进行纯化,并通过酶活测定和SDS-PAGE分析重组酶的纯化情况。其中,SDS-PAGE按照文献[12]进行,浓缩胶和分离胶的浓度分别为5%和12%。
1.2.3 重组β-1,4-半乳聚糖酶的酶学特征解析
1.2.3.1 重组β-1,4-半乳聚糖酶的酶活测定
按照文献方法[6],在反应体系中加入用100 mmol/L的醋酸-醋酸钠缓冲液(pH 4.5)配制的5 mg/mL半乳聚糖溶液和0.1 mL经适当稀释的酶液(对照组为沸水灭活的酶液)。振荡混匀后,于45 ℃下反应10 min。然后加入1 mL 3,5-二硝基水杨酸(DNS)溶液,100 ℃下煮沸10 min。最后,测定反应液在540 nm下的吸光值,并根据半乳糖标准曲线计算酶活力。在上述条件下,1 min内产生对应于1 mg D-半乳糖的还原力所需的酶量为1个酶活力单位(U)。
采用BCA试剂盒(北京索莱宝科技有限公司)测定蛋白浓度,以牛血清白蛋白V部分为标准参照。
1.2.3.2 重组酶的最适反应温度及热稳定性测定
将纯化后的酶液进行适当稀释,然后分别在30、35、40、45、50、55、60、65、70和80 ℃下进行反应。再按照1.2.3.1的方法进行酶活测定,以酶活最高者为100%,计算各温度下的相对酶活力,以确定重组酶的最适反应温度。将纯化后的酶液进行适当稀释,分别在30、40、50、60、70和80 ℃下保温2 h,每隔30 min取样,在冰上放置10 min后测定酶活力,以未进行热处理酶液的酶活力为100%,计算相对酶活,确定重组β-1,4-半乳聚糖酶的热稳定性。
1.2.3.3 酶的最适反应pH值及pH稳定性测定
在不同pH值(pH 3.0~8.0),以溶于相应pH值的缓冲液的0.5 mg/mL半乳聚糖为底物进行反应,然后按照1.2.3.1的方法测定酶活。以酶活最高者为100%,计算相对酶活,从而确定重组半乳聚糖酶的最适作用pH值。将纯化后的酶液分别用不同pH值(3.0、4.0、5.0、6.0、7.0和8.0)的缓冲液进行适当稀释后,再于相应pH值的缓冲液中孵育(温度为40 ℃)1 h后测定酶活。以酶活最高者为100%,计算残余酶活力,确定酶的pH稳定性。所用缓冲液为0.1 mol/L醋酸和0.2 mol/L醋酸钠缓冲液。
1.2.3.4 金属离子或化学试剂对酶活的影响
在重组酶与其底物进行反应的体系中加入金属离子Ca2+、Zn2+、Mn2+、Co2+、Hg2+和Fe3+,使其终浓度为1 mmol/L,在最适作用温度和pH值下测定重组酶的酶活,以未加金属离子的反应体系的酶活为100%,计算相对酶活力。
1.2.3.5 动力学参数的测定
分别以0.02、0.025、0.03、0.035、0.04和0.05 mg/mL的半乳聚糖为底物,在重组半乳聚糖酶的最适反应温度和pH值条件下进行反应,按照1.2.3.1的方法测定酶活。然后以1/V对1/S作图,根据双倒数法计算米氏常数Km及最大反应速度Vmax。
1.2.4 重组酶水解土豆的产物分析
利用打浆机将土豆打碎,成为糊状。再利用G3砂芯漏斗对处理后的土豆浆进行反复清洗,并采用DNS法检测滤出液中的残糖,直至滤出液中无残糖存在,清洗完毕。在1 mL酶促反应体系中加入300 g/L上述预处理的土豆浆和10 U/mL酶液。在45 ℃、pH值4.5下反应2 h后,沸水浴10 min灭酶。再于13 000 r/min离心10 min,取上清。适当稀释后,用0.22 μm滤膜过滤,再利用高效液相色谱检测过滤液中的产物组成。
在1 mL酶促反应体系中,加入300 g/L预处理的土豆浆和10 U/mL酶液,于pH值4.5和45 ℃进行反应。分别在反应15、30、60、120和180 min时取样,于100 ℃煮沸10 min灭酶。离心取上清后,采用高效液相色谱法分析每种组分含量随着时间的变化情况。
色谱条件:色谱柱为GRACE Prevail Carbohydrate ES 5u (250 mm×4.6 mm;5 μm);流动相为V(乙腈)∶V(水)=60∶40;流速:1.0 mL/min;进样量:5 μL,柱温:30 ℃。检测器:蒸发光散射检测器;检测条件:漂移管温度90 ℃,空气载气流速2.2 L/min,增益为1。
2 结果与分析
2.1 β-1,4-半乳聚糖酶基因的克隆表达与分离纯化
2.1.1 内切β-1,4-半乳聚糖酶基因的异源表达
以黑曲霉CICIM F0510的cDNA为模板,利用引物AghA1和AghA2对其内切β-1,4-半乳聚糖酶基因aghA进行PCR扩增。PCR产物经Xba Ⅰ酶切后,与经过SnaB Ⅰ和Avr Ⅱ酶切的质粒pPIC9K连接,获得重组表达质粒pPIC-aghA。DNA测序的结果表明,所克隆的aghA基因具有完整的开放阅读框,且其序列与A. niger CBS 513.88基因组公布的序列完全一致。其大小为1 065 bp,编码354个氨基酸残基。进一步将重组质粒用Sac I线性化后,电转化入毕赤酵母中,获得重组菌GS115 (pPIC-aghA)。在250 mL三角瓶培养条件下,发酵进行到120 h时,重组菌的内切半乳聚糖酶活性达到最大,为130 U/mL。
2.1.2 重组β-1,4-半乳聚糖酶的分离纯化
进一步采用盐析、脱盐和凝胶过滤层析法将重组β-1,4-半乳聚糖酶进行纯化,各步骤的纯化倍数和回收率如表1所示。
表1 重组半乳聚糖酶AghA的分离纯化
Table 1 Purification of recombinant galactanase AghA
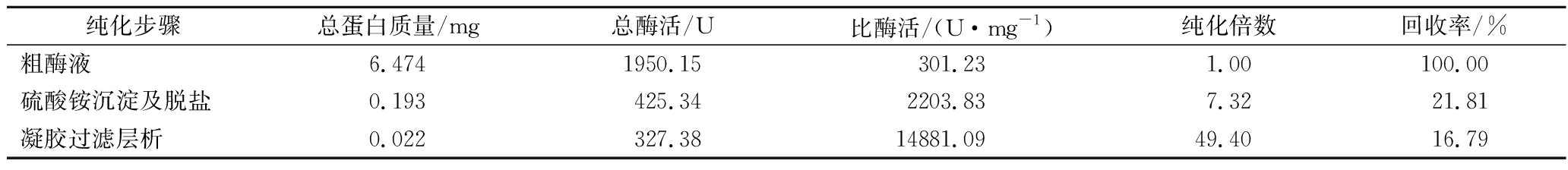
纯化后,AghA的比酶活为14 881.09 U/mg,是纯化前的49.4倍,回收率约为16.79%。SDS-PAGE分析结果表明,重组酶AghA的分子质量约为42.0 ku(图1),略高于其理论分子质量(37.0 ku),可能是该酶已经被糖基化修饰了。通过在线软件ISOGlyP(http://isoglyp.utep.edu/)预测可知,AghA含有2个糖基化位点。此外,重组酶的纯度基本满足生化特征分析的要求。
2.2 重组β-1,4-半乳聚糖酶酶学性质的解析
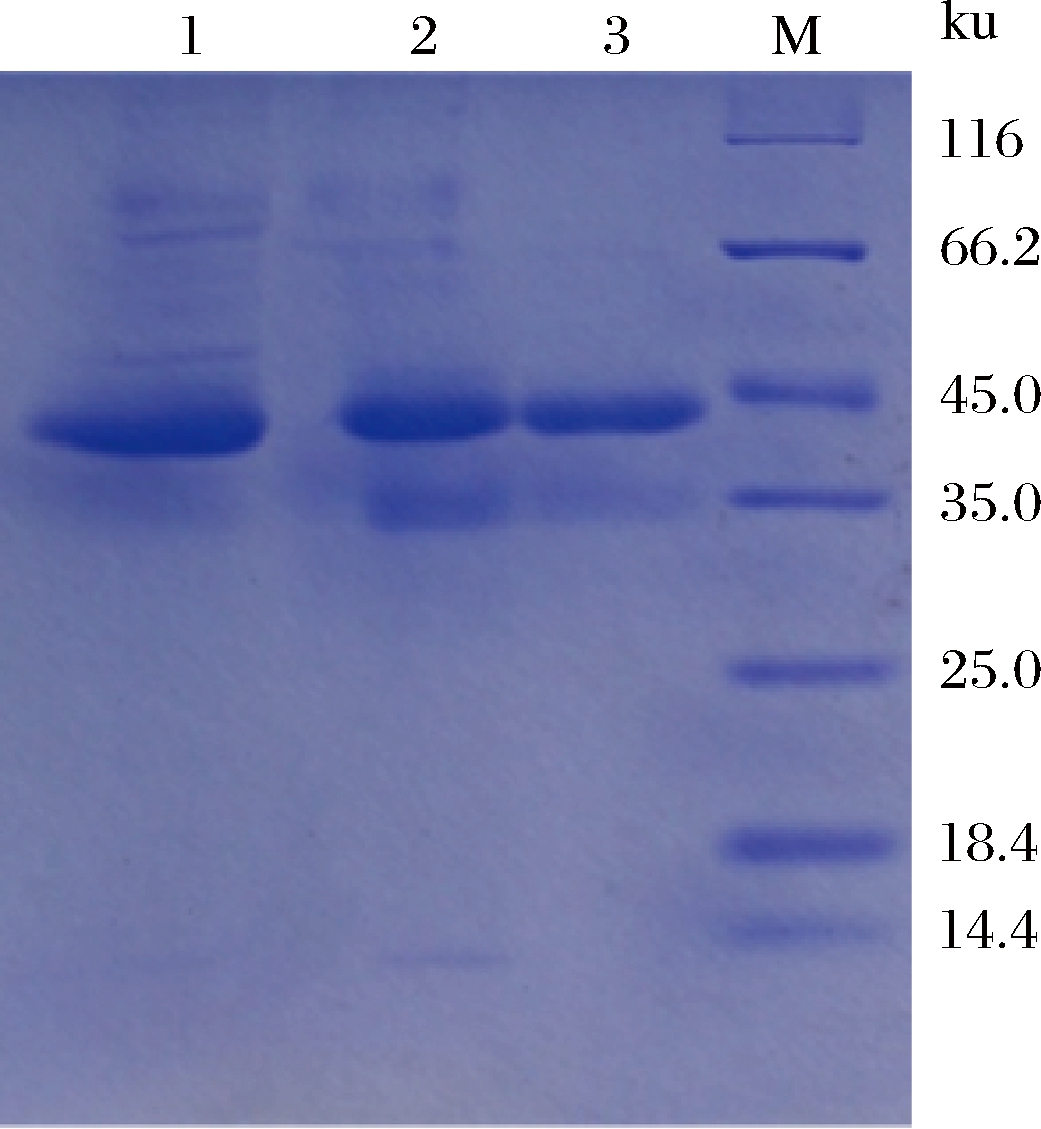
1-粗酶液;2-盐析和脱盐后的AghA;3-凝胶过滤层析后的AghA;M-蛋白分子量标准
图1 SDS-PAGE分析重组酶AghA的纯化情况
Fig.1 SDS-PAGE analysis of the purification of recombinant enzyme AghA
2.2.1 最适反应pH值和pH稳定性
分别在不同pH(3.0~8.0)条件下测定重组酶AghA的酶活,结果如图2-a所示。重组酶AghA的最适作用pH值为4.5,它在较宽泛的pH值范围内(3.0~5.5)的相对酶活保持在80%以上。AghA还具有良好的pH值稳定性,在pH 4.0~6.0的缓冲液和40 ℃孵育1 h后,残余酶活力仍能保持80%以上(图2-b)。
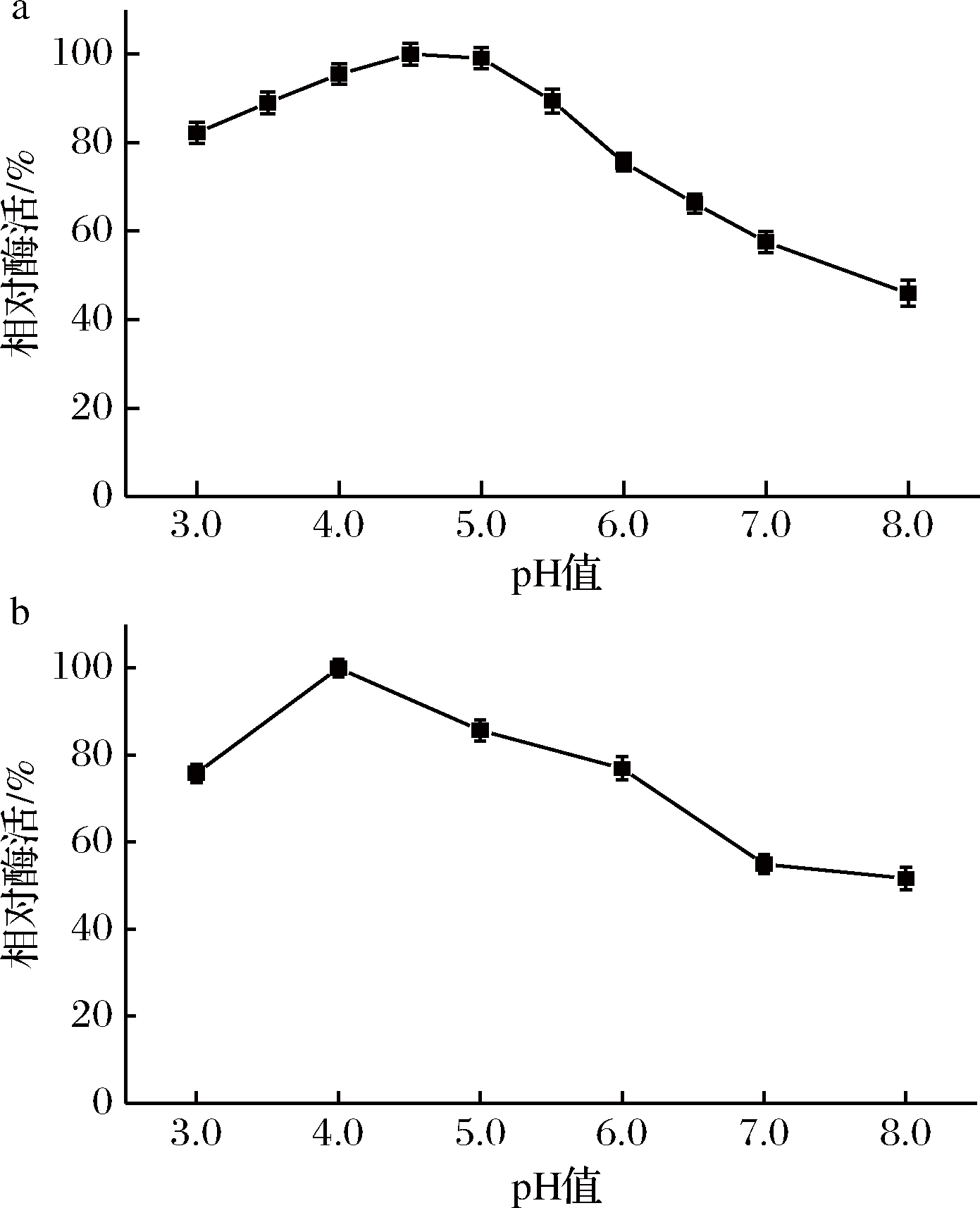
a-最适反应pH;b-pH稳定性
图2 重组半乳聚糖酶AghA的最适反应pH及pH稳定性
Fig.2 The pH optimum and pH stability of recombinant galactanase AghA
2.2.2 最适作用温度和热稳定性
分别将重组酶AghA在不同温度(30~80 ℃)和pH 4.5条件下进行反应,然后按照1.2.3.1的方法测定酶活,结果如图3-a所示。
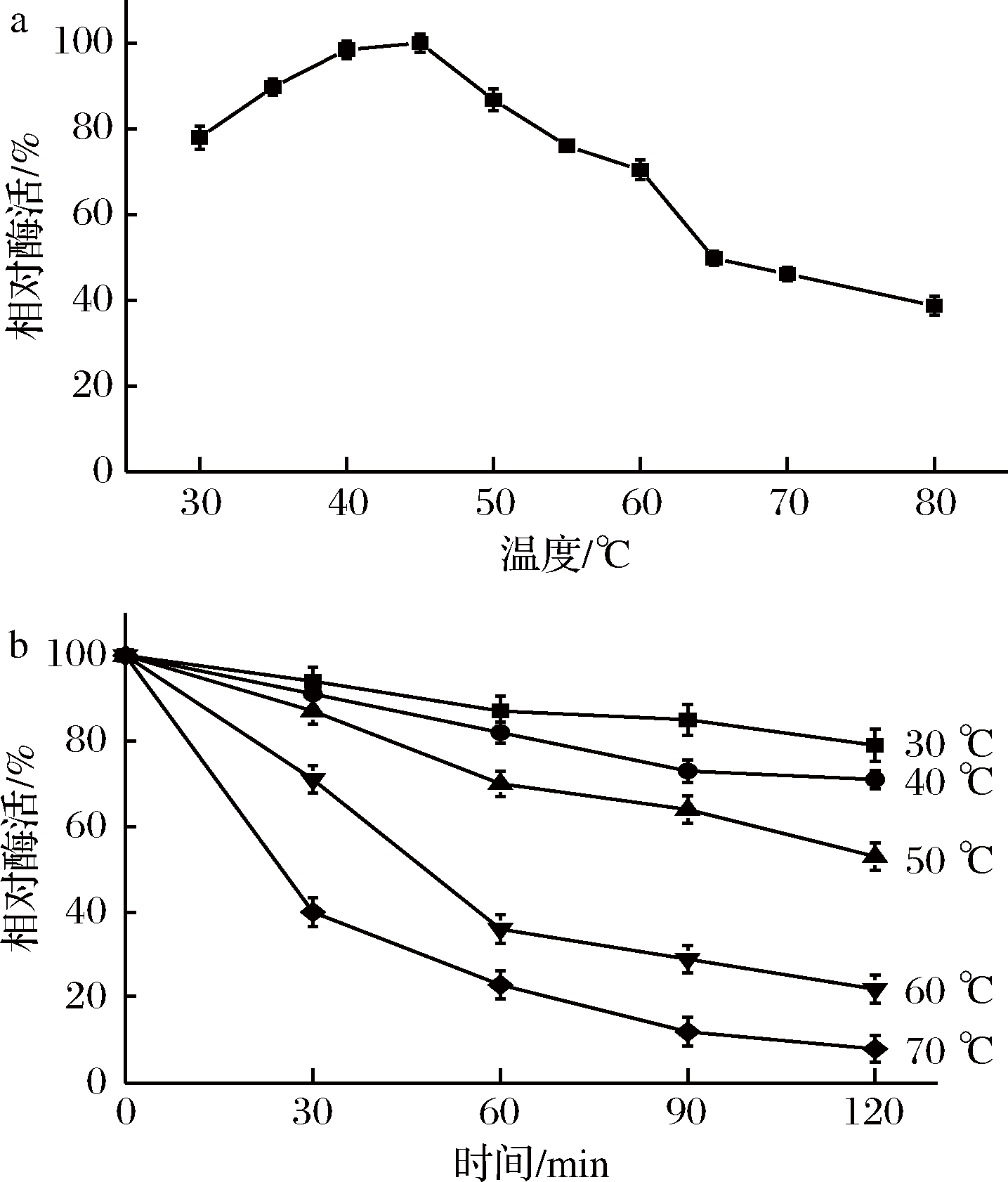
a-最适作用温度;b-热稳定性
图3 重组半乳聚糖酶AghA的最适作用温度及热稳定性
Fig.3 The temperature optimum and thermostability of recombinant galactanase AghA
由图3可知,重组酶AghA的最适反应温度为45 ℃,在35~50 ℃范围内,其相对酶活在80%以上;而当反应温度超过60 ℃以后,酶活力显著下降。热稳定性的研究表明,重组酶AghA在30~50 ℃的稳定性较好,孵育2 h后,其残留酶活仍在60%左右(图3-b);在60 ℃和70 ℃保温1 h后,该酶的残余酶活力分别为40%和20%左右;而在这2个温度下孵育2 h后,重组酶AghA只能保持20%和10%左右的相对酶活。
2.2.3 金属离子或化学试剂对AghA酶活的影响
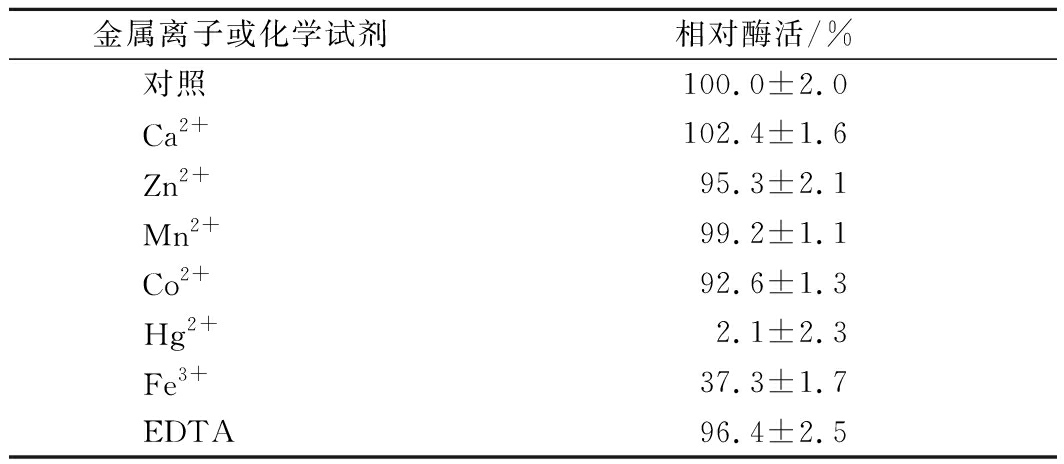
分别在AghA与其底物进行反应的体系中添加不同的金属离子或化学试剂,使其终浓度为1 mmol/L,以研究它们对AghA酶活的影响,结果见表2。由表2可知,大部分金属离子对内切β-1,4-半乳聚糖酶AghA的酶活没有显著影响,这使其更适用于工业应用过程中[13]。此外,EDTA也对该半乳聚糖酶的酶活没有显著影响,这与其他报道一致[6, 14]。Zn2+和Co2+对该酶的活性有轻微的抑制作用;Fe3+对AghA有强烈的抑制作用;而Hg2+可使AghA几乎完全失去活性。
表2 金属离子或化学试剂对AghA酶活的影响
Table 2 Effects of metal ions or chemicals on the activity of AghA
2.2.4 动力学参数的测定
以不同质量浓度(0.02~0.05 mg/mL)的半乳聚糖为底物,在重组酶AghA的最适作用pH值和温度下反应,然后按照1.2.3.1的方法测定酶活。采用双倒数作图法,绘制重组酶AghA水解半乳聚糖的动力学曲线,求得该酶对半乳聚糖的最大反应速率Vmax和米氏常数Km分别为400 mg/(mL·min)和0.08 mg/mL。该Km值远小于Bacillus licheniformis[6]、Emericella nidulans[13]以及Penicillium citrinum[15]来源内切β-1,4-半乳聚糖酶的Km值(分别为2.3 mg/mL、0.51 mg/mL和0.055%)。可见,重组酶AghA对半乳聚糖具有较强的亲和性。
2.3 重组酶对土豆中半乳聚糖的水解作用
2.3.1 土豆浆酶解产物的HPLC分析
以300 g/L预处理后的土豆浆为底物,在45 ℃、pH值4.5下准确反应2 h后取样,采用HPLC对酶解产物进行分析,结果如图4所示。重组半乳聚糖酶AghA将土豆水解后,其产物主要是半乳糖、半乳二糖和半乳三糖,还有极少量的半乳四糖。
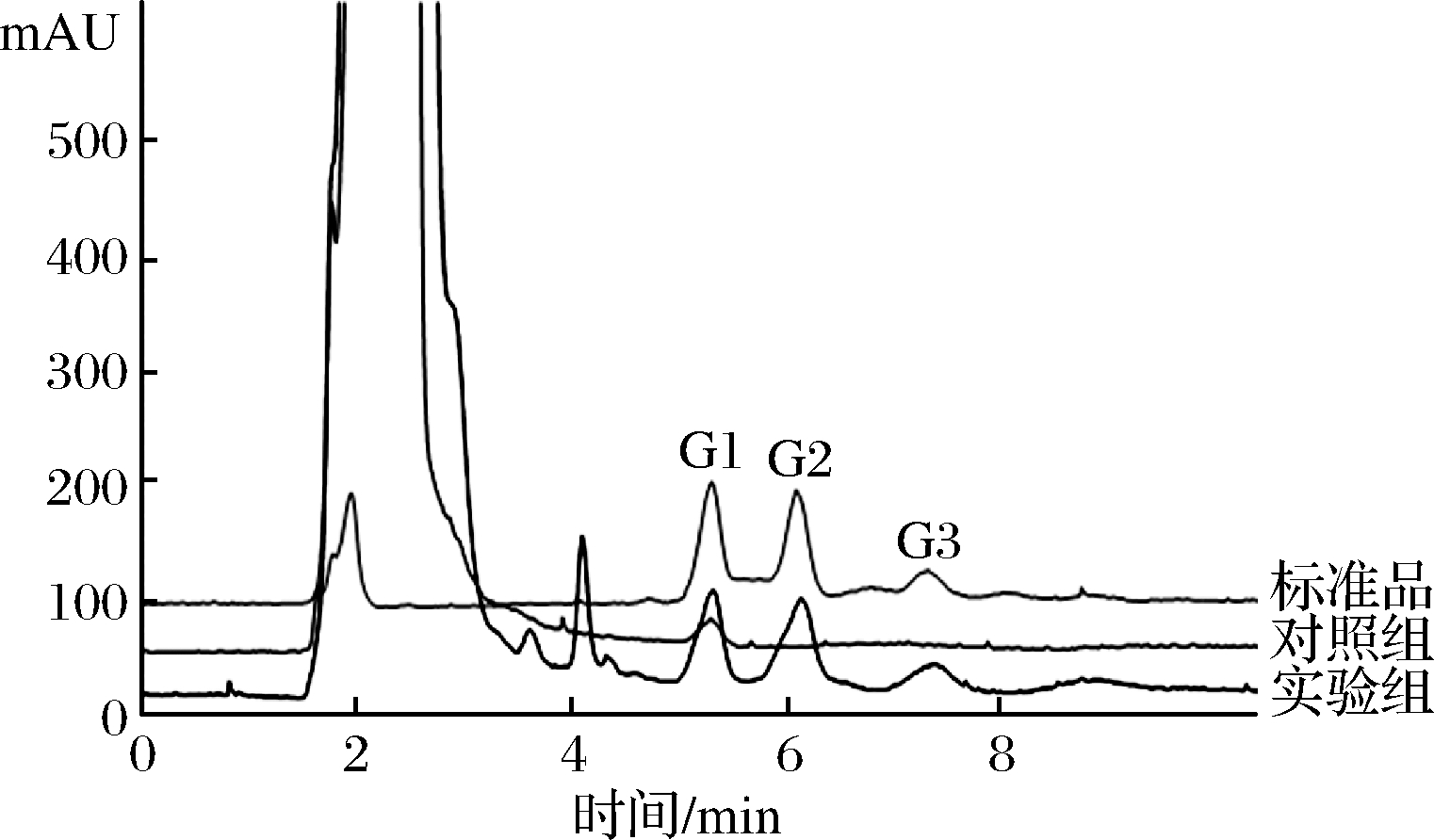
G1-半乳糖;G2-半乳二糖;G3-半乳三糖
图4 半乳聚糖酶AghA作用于土豆浆的产物分析
Fig.4 HPLC profiles of potato pulp hydrolyzed by recombinant galactanase AghA
2.3.2 重组酶AghA水解土豆浆的反应进程
将重组酶AghA与300 g/L预处理的土豆浆在pH值4.5和45 ℃下进行反应。并于不同的时间取样,采用HPLC测定每种组分含量随着时间的变化情况。以反应时间为横坐标,每种组分的含量为纵坐标绘制曲线,结果如图5所示。反应初始阶段,内切-β-1,4-半乳聚糖酶AghA水解土豆浆生成半乳三糖、半乳二糖和半乳糖;反应15 min后,半乳三糖的含量不断减少,而半乳二糖和半乳糖的含量则不断地增加。而反应进行到180 min时,半乳三糖的相对含量仅为0.38 mg/mL,反应的最终产物主要是半乳糖和半乳二糖,二者的质量浓度分别为5.94和4.03 mg/mL。
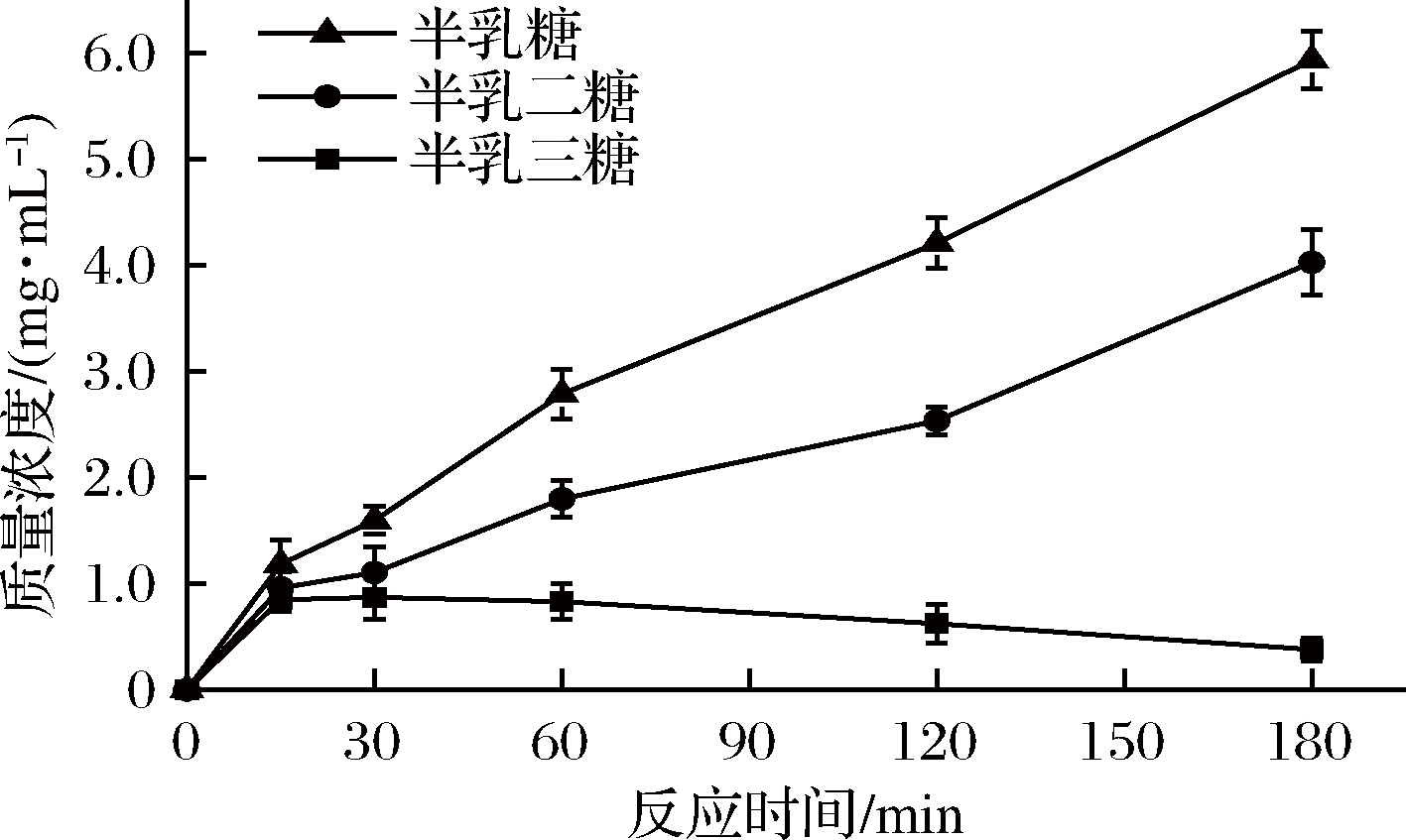
图5 重组酶AghA水解土豆浆的反应进程
Fig.5 Hydrolysis of potato pulp by recombinant enzyme AghA
3 讨论
该研究采用分子克隆与遗传重组技术成功将黑曲霉CICIM F0510来源的内切β-1,4-半乳聚糖酶基因在毕赤酵母中进行了异源表达。摇瓶培养条件下,重组酶AghA的总酶活和比酶活分别为130 U/mL和301.23 U/mg(表1),高于大多数已报道的内切β-1,4-半乳聚糖酶的酶活,比如B. licheniformis[6]、E. nidulans[13]、P. chrysogenum[16]、P. citrinum[15]和Thermotoga maritima[17]来源内切β-1,4-半乳聚糖酶的酶活分别为127 U/mg、109 U/mL、0.127 U/mL、48.96 U/mg和21.8 U/mg,具有潜在的工业化前景。
酶学性质的研究表明,重组内切半乳聚糖酶AghA的最适反应温度和pH值分别为45 ℃和4.5,且在30~50 ℃或pH值4.0~6.0具有较好的稳定性(图2和图3),这与低聚半乳糖的制备条件(30~50 ℃;pH 5.6~7.0)[2]比较吻合,适用于GOS的制备过程。此外,它与B. licheniformis[6]、E. nidulans[13]、P. chrysogenum[16]、A. aculeatus[18]以及Talaromyces stipitatus[19]等来源内切半乳聚糖酶的最适反应温度和pH值相似。但其最适反应温度和热稳定性却低于嗜热微生物来源的内切β-1,4-半乳聚糖酶[17, 20]。后续可以进一步通过分子改造来提高其热稳定性,以适应不同的工业需求[19]。
土豆浆是土豆淀粉生产行业的副产物,具有价格低、产量大等特点。它主要是由土豆的细胞壁组成,含有大量的果胶,特别是鼠李半乳糖醛酸聚糖I(RGI)和同型半乳糖醛酸聚糖(HG)[21]。其中,RGI的侧链主要含有以β-1,4糖苷键连接的半乳聚糖。该研究利用重组酶AghA水解土豆浆,可以释放半乳二糖、半乳三糖和半乳四糖等低分子量的半乳聚糖(图4);且随着反应时间的延长,半乳三糖被不断水解成半乳二糖和半乳糖(图5),这与其他真菌内切β-1,4半乳聚糖酶的作用特征相似。而细菌来源的半乳聚糖酶则优先作用于高分子量半乳聚糖,且水解产生的低聚半乳糖的聚合度≥4[22-23],这是由于它们的底物结合凹槽的结构不同造成的[5, 24]。此外,由于内切β-1,4半乳聚糖酶只具有水解作用,通过条件控制应该不会产生GOS的二次水解,有望解决产品回收率低的问题。
综上所述,该研究成功将黑曲霉CICIM F0510来源的内切β-1,4半乳聚糖酶在毕赤酵母中进行了克隆表达和酶学特征解析。重组半乳聚糖酶AghA较高的表达量、良好的酶学性质以及对土豆浆的水解作用,为其工业化生产以及在低聚半乳糖制备中的应用奠定了坚实的基础。
参考文献
[1] 卢丽丽,李正义,肖敏. 微生物酶法合成低聚半乳糖的新进展[J]. 微生物学报, 2008, 48(7): 980-985.
[2] 孙槐胜. 基于乳酸克鲁维酵母菌的高纯度低聚半乳糖绿色生产工艺开发[D]. 天津:天津大学, 2016.
[3] OSMAN A, TZORTZIS G, RASTALL R A, et al. High yield production of a soluble bifidobacterial β-galactosidase (BbgIV) in E. coli DH5α with improved catalytic efficiency for the synthesis of prebiotic galactooligosaccharides[J]. Journal of Agricultural & Food Chemistry, 2013, 61(9): 2 213-2 223.
[4] JOHANNSEN H, PRESCOTT S L. Practical prebiotics, probiotics and synbiotics for allergists: how useful are they?[J]. Clinical and Experimental Allergy, 2009, 39(12): 1 801-1 814.
[5] TORPENHOLT S, DE MARIA L, OLSSON M H M, et al. Effect of mutations on the thermostability of Aspergillus aculeatus beta-1,4-galactanase[J]. Computational and Structural Biotechnology Journal, 2015, 13: 256-264.
[6] LIMA E A D, MACHADO C B, ZANPHORLIN L M, et al. GH53 endo-beta-1,4-galactanase from a newly isolated Bacillus licheniformis CBMAI 1609 as an enzymatic cocktail supplement for biomass saccharification[J]. Applied Biochemistry & Biotechnology, 2016, 179(3): 415-426.
[7] BJOERNVAD M E, CLAUSEN I G, SCH LEIN M, et al. Bacterial galactanases and use thereof: US 2003/0022347 A1[P]. 2001-02-06.
[8] LE NOURS J, DE MARIA L, WELNER D, et al. Investigating the binding of beta-1,4-galactan to Bacillus licheniformis beta-1,4-galactanase by crystallography and computational modeling[J]. Proteins-Structure Function and Bioinformatics, 2009, 75(4): 977-989.
[9] ZAVALETA V, EYZAGUIRRE J. Penicillium purpurogenum produces a highly stable endo-beta-(1,4)-galactanase[J]. Applied Biochemistry & Biotechnology, 2016, 180(7): 1 313-1 327.
[10] 董自星,李伟国,佟新新,等. 黑曲霉内切β-1,3(4)-葡聚糖酶的基因克隆与酶学特性分析[J]. 食品与发酵工业, 2016, 42(11): 58-64.
[11] 诸葛健,王正祥. 工业微生物实验技术手册[M]. 北京:中国轻工业出版社, 1994: 413-450.
[12] 奥斯伯F,金斯顿R,塞德曼J,等. 精编分子生物学实验指南[M]. 北京:科学出版社, 2008: 42-50.
[13] MICHALAK M, THOMASSEN L V, ROYTIO H, et al. Expression and characterization of an endo-1,4-beta-galactanase from Emericella nidulans in Pichia pastoris for enzymatic design of potentially prebiotic oligosaccharides from potato galactans[J]. Enzyme and Microbial Technology, 2012, 50(2): 121-129.
[14] SAKAMOTO T, ISHIMARU M. Peculiarities and applications of galactanolytic enzymes that act on type I and II arabinogalactans[J]. Applied Microbiology and Biotechnology, 2013, 97(12): 5 201-5 213.
[15] NAKANO H, TAKENISHI S, WATANABE Y. Purification and properties of two galactanases from Penicillium citrinum[J]. Journal of the Agricultural Chemical Society of Japan, 2014, 49(12): 3 445-3 454.
[16] SAKAMOTO T, NISHIMURA Y, MAKINO Y, et al. Biochemical characterization of a GH53 endo-beta-1,4-galactanase and a GH35 exo-beta-1,4-galactanase from Penicillium chrysogenum[J]. Applied Microbiology and Biotechnology, 2013, 97(7): 2 895-2 906.
[17] YANG H, ICHINOSE H, YOSHIDA M, et al. Characterization of a thermostable endo-beta-1,4-D-galactanase from the hyperthermophile Thermotoga maritima[J]. Bioscience Biotechnology and Biochemistry, 2006, 70(2): 538-541.
[18] CHRISTGAU S, SANDAL T, KOFOD L V, et al. Expression cloning, purification and characterization of a beta-1,4-galactanase from Aspergillus aculeatus[J]. Current Genetics, 1995, 27(2): 135-141.
[19] LARSEN D M, NYFFENEGGER C, SWINIARSKA M M, et al. Thermostability enhancement of an endo-1,4-beta-galactanase from Talaromyces stipitatus by site-directed mutagenesis[J]. Applied Microbiology and Biotechnology, 2015, 99(10): 4 245-4 253.
[20] LE NOURS J, RYTTERSGAARD C, LO LEGGIO L, et al. Structure of two fungal beta-1,4-galactanases: Searching for the basis for temperature and pH optimum[J]. Protein Science, 2003, 12(6): 1 195-1 204.
[21] THOMASSEN L V, MEYER A S. Statistically designed optimisation of enzyme catalysed starch removal from potato pulp[J]. Enzyme and Microbial Technology, 2010, 46(3/4): 297-303.
[22] BONNIN E, LAHAYE M, VIGOUROUX J, et al. Preliminary characterization of a new exo-beta-(1,4)-galactanase with transferase activity[J]. International Journal of Biological Macromolecules, 1995, 17(6): 345-351.
[23] ZHANG J H, PAKARINEN A, VIIKARI L. Synergy between cellulases and pectinases in the hydrolysis of hemp[J]. Bioresource Technology, 2013, 129(2): 302-307.
[24] RYTTERSGAARD C, LE NOURS J, LO LEGGIO L, et al. The structure of endo-beta-1,4-galactanase from Bacillus licheniformis in complex with two oligosaccharide products[J]. Journal of Molecular Biology, 2004, 341(1): 107-117.