共轭亚油酸(conjugated linoleic acid,CLA)是多种含有共轭双键十八碳二烯酸的总称,它具有多种营养和保健功能,如抗癌、抗动脉粥样化和延缓机体免疫力衰退、减肥等[1-3]。目前合成CLA的方法主要有化学法和生物法2种。化学法合成的CLA产品中各种异构体形式并存,而且产品还存在溶剂残留问题[4]。生物法转化CLA产物中具有生理活性的异构体形式含量较高,产品安全性较高。目前研究表明,一些瘤胃微生物、丙酸杆菌、乳酸菌和双歧杆菌能够将亚油酸(linoleic acid,LA)转化为CLA[5]。相比于严格厌氧且生长较慢而难以用于大规模生产的瘤胃菌、具有致病性的痤疮丙酸杆菌,乳酸菌具有易大规模培养、食品级微生物等优点,所以利用乳酸菌转化CLA已经是当前的研究热点[6-7]。
研究表明,大部分乳酸菌将LA转化为CLA的通路是先将LA水合为10-羟基-顺 12-十八碳烯酸(10-hydroxy-cis 12-octadecenoic acid,10-HOE),后经脱氢、双键移位、水合、脱水等多步反应而转化为CLA,需要脂肪酸水合酶(fatty acid hydratase,CLA-HY)、羟基脂肪酸脱氢酶(hydroxy fatty acid dehydrogenase,CLA-DH)与乙酰乙酸脱羧酶(fatty acid isomerase,CLA-DC)组成的亚油酸异构酶系共同参与代谢过程[8]。CLA-DH在亚油酸在乳酸菌的代谢中起着重要的作用,可以将10-HOE转化为10-氧代-顺-12-十八碳烯酸。很多羟基脂肪酸都可以作为良好底物被转换为相应的氧代脂肪酸[9],并且很多氧代脂肪酸也被发现有独特的生理功能,例如10-氧代-顺-12-十八碳烯酸激活过氧化物酶体增生激活受体(peroxisome proliferative activated receptor, PPARg)诱导脂肪细胞分化,13-氧代-9,11-十八碳二烯酸可以改善肥胖症引起的血脂异常和肝脂肪变性等[10]。
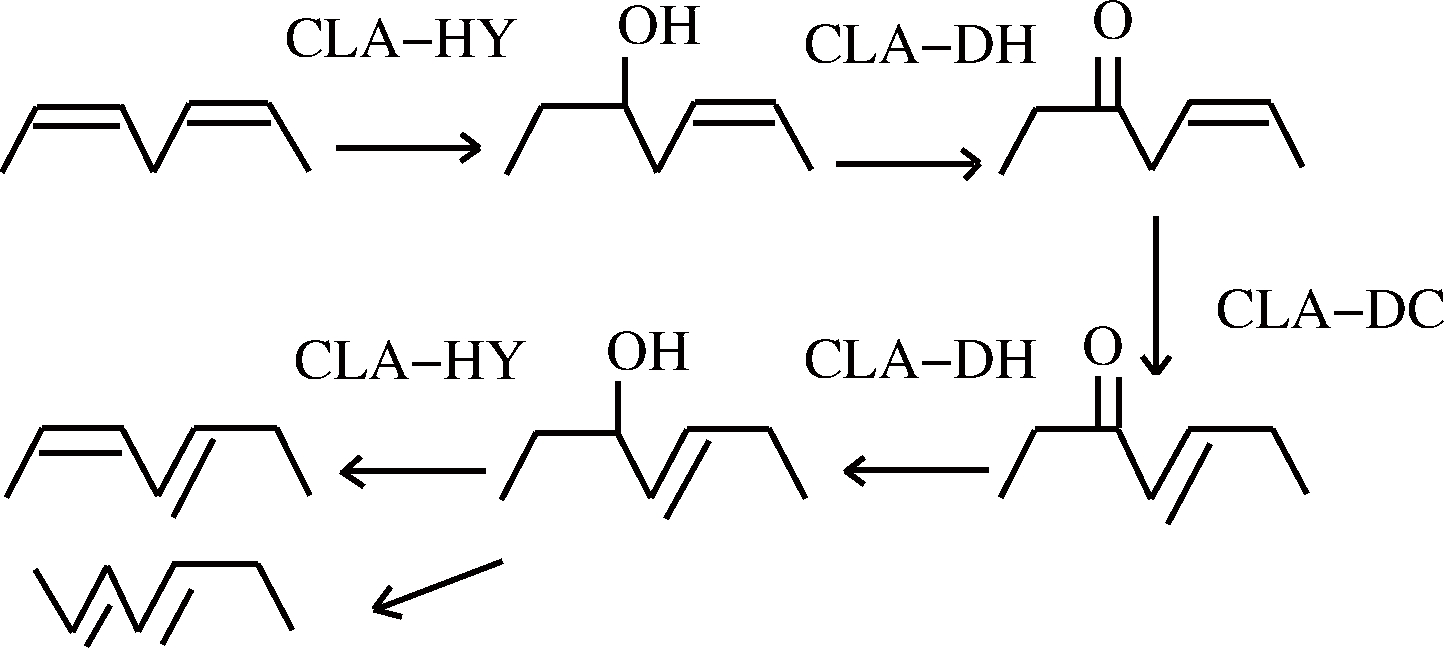
图1 部分乳酸菌中LA转化为CLA的过程
Fig.1 The process of LA conversion to CLA inLactobacillus plantarum
内蒙古是乳制品生产研发大省,植物乳杆菌P-8是源自内蒙古乌拉特中旗的优良发酵菌种,经研究表明该菌具有产生CLA的能力,但产量较小且具体机制尚不清楚[11]。本研究对植物乳杆菌P-8中的羟基脂肪酸脱氢酶基因进行了克隆和生物信息学分析,并将其在大肠杆菌中表达,经诱导表达后得到有活性的重组酶CLA-DH。为进一步研究植物乳杆菌P-8中羟基脂肪酸脱氢酶的性质和功能提供了必要条件,为提高植物乳杆菌P-8转化CLA的产量并将其应用于食品、保健品奠定了重要理论基础。
1 材料与方法
1.1 材料
1.1.1 菌种和载体质粒
本实验所用植物乳杆菌P-8和pET-28a(+) Vector由本实验室保藏,大肠杆菌E.coli DH5α Chemically Competent Cell购自北京天根生化科技有限公司,大肠杆菌E.coli Transetta (DE3) Chemically Competent Cell购自北京全式金生物技术有限公司。
1.1.2 酶和试剂
本实验所用限制性内切酶EcoRⅠ、限制性内切酶XhoⅠ、T4连接酶均购自于北京全式金生物技术有限公司;高保真DNA聚合酶KOD plus购自Toyobo公司;细菌基因组DNA提取试剂盒、琼脂糖凝胶DNA回收试剂盒和质粒小提试剂盒均购自北京天根生化科技有限公司;亚油酸购自Sigma公司;其他试剂均为国产或进口分析纯。
1.2 方法
1.2.1 引物设计
利用Primer 5.0软件,根据NCBI中已知的植物乳杆菌P-8的CLA-DH序列以及pET-28a(+)载体的多克隆位点,设计了1对特异性引物(表1),由华大基因完成。
表1 引物序列
Table 1 Primers used in this study

注:划线部分为引入的酶切位点。
1.2.2 CLA-DH基因的扩增与序列分析
以植物乳杆菌P-8基因组为模板用高保真KOD plus酶进行PCR扩增,PCR反应条件:95℃预变性5 min;95℃变性30 s,50℃退火40 s,68℃延伸1 min,30个循环;68℃保温10 min。产物用1%琼脂糖凝胶进行电泳,并将目的条带切胶后用琼脂糖凝胶DNA回收试剂盒进行回收,送往华大基因进行测序。测序结果使用Blast进行确认,使用DNAstar翻译成氨基酸序列进行分析。使用Proparam对序列进行蛋白质理化性质的预测分析,使用Protscal进行蛋白质亲疏水性预测分析,使用TMHMM进行跨膜区预测分析,使用Net Phos3.1 Server进行磷酸化位点分析,使用PSLpred进行亚细胞定位分析,使用SOPMA和Predict Protein进行二级结构分析。
1.2.3 重组菌的构建
将纯化后的PCR产物和pET-28a(+)质粒分别通过EcoRⅠ和XhoⅠ进行双酶切,切胶回收后16 ℃连接过夜,将连接产物转化至大肠杆菌E.coli DH5α,涂布含50 μg/mL卡那霉素的LB平板进行筛选。挑取转化子,扩大培养后提取质粒,经菌液PCR和质粒双酶切验证后,获得重组质粒pET-28a-DH。将重组质粒pET-28a-DH转化至大肠杆菌E.coli Transetta (DE3),同时转化pET-28a(+)空质粒作为阴性对照,获得重组菌E.coli Transetta/pET-28a-DH和对照菌E.coli Transetta/pET-28a。
1.2.4 重组酶的诱导表达
挑取重组菌E.coli Transetta/pET-28a-DH和对照菌E.coli Transetta/pET-28a单菌落分别接种于20 mL LB培养基(含有50 μg/mL卡那霉素和150 μg/mL氯霉素)中37 ℃、180 r/min培养过夜,按2%接种量转接入1 L LB培养基中,37 ℃、180 r/min振荡培养至OD600为0.6,加入IPTG至终浓度0.1 mmol/L,16 ℃、130 r/min诱导培养16 h。离心收集菌体并重悬于KPB缓冲液(20 mmol/L,pH值6.5)中,在冰浴中进行超声破碎,12 000 r/min离心1 h,得上清和沉淀。通过12% SDS-PAGE进行分离后,转至NC膜上,加入封闭液封闭过夜。然后用一抗(1∶2000稀释)、二抗(1∶1000稀释)先后孵育结合1 h,通过DAB显色法进行显色反应。
1.2.5 纯化重组酶
利用pET-28a(+)质粒中的his-tag标签,使用镍柱对重组酶进行纯化。将离心得到的上清加入到镍柱中,用含有不同浓度咪唑的缓冲液进行洗脱,分别收集洗脱液进行SDS-PAGE分析。
1.2.6 重组酶活性检测
实验室之前已成功构建有活性的植物乳杆菌P-8的脂肪酸水合酶工程菌E.coli BL21/pET-28a-HY,实验证明其能够将LA水合为10-HOE。收取1.2.4中的离心上清液作为粗制酶液进行活性检测,反应体系为1 mL,其中包含4 μg亚油酸、2 μg吐温80、0.1 mmol/L FAD、5 mmol/L NADH、200 μL CLA-HY粗酶液、200 μL CLA-DH粗酶液,KPB缓冲液补至1 mL。对照组包含4 μg亚油酸、2 μg吐温80、0.1 mmol/L FAD、5 mmol/L NADH、200 μL CLA-HY粗酶液、200 μL pET-28a(+)空质粒粗酶液,KPB缓冲液补至1 mL。反应在37 ℃、120 r/min的条件下进行6 h后,加入5 mL正己烷充分振荡30 s,3 000×g离心5 min,吸取上层正己烷至干净试管中用N2吹干,加入2 mL 4%盐酸-甲醇溶液50 ℃水浴20 min进行甲酯化,再次萃取脂肪酸后用N2吹干,加入100 μL正己烷回溶,使用GC-MS检测分析。GC-MS条件: Finnigan Trance GC /FinniganTrance MS (美国Thermo),色谱柱: Agilent DB-WAX(30 m×0.250 mm×0.25 μm)。升温程序: 40 ℃保持0.5 min后以20℃/min的速度升至280 ℃,保持10 min。
2 结果与分析
2.1 CLA-DH基因的扩增
在NCBI中查找到植物乳杆菌P-8的CLA-DH序列,全长861 bp。以植物乳杆菌P-8基因组为模板,PCR扩增短链脱氢酶CLA-DH基因,经1%琼脂糖凝胶电泳鉴定,得到约860 bp大小的片段(图2),与预期的理论值大小相同。将PCR产物胶回收后,送往华大基因测序,测序结果使用Blast验证,结果显示得到正确的植物乳杆菌P-8中CLA-DH。
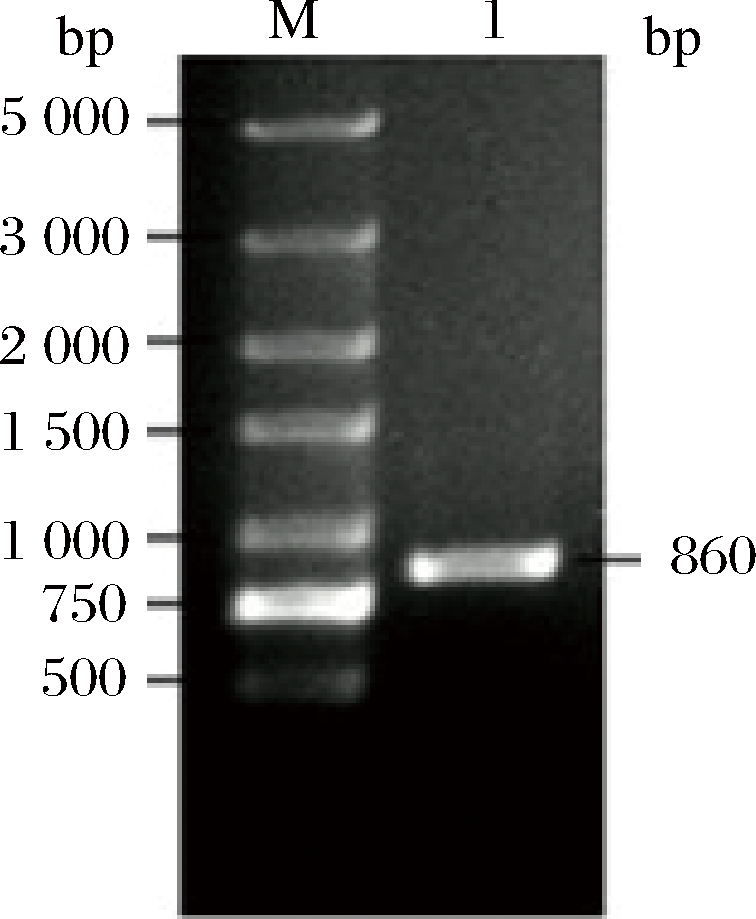
M-DNA Marker; 1-CLA-DH PCR产物
图2 CLA-DH基因PCR产物电泳图
Fig.2 Electrophoresis gram of PCR product of CLA-DH
2.2 CLA-DH的生物信息学分析
经序列分析表明,CLA-DH基因序列共编码286个氨基酸(图3),其中极性氨基酸127个,非极性氨基酸132个,编码蛋白的理论分子质量为32.091 8 kDa,理论等电点为5.15。不稳定指数为25.53,属于稳定蛋白,脂肪系数为85.48。
对CLA-DH进行磷酸化位点分析,结果表明存在3个Ser磷酸化位点、3个Thr磷酸化位点和7个Tyr磷酸化位点。对CLA-DH进行疏水性分析,结果表明第142位的丙氨酸疏水性最强,第201位的组氨酸亲水性最强,总平均亲水系数为-0.179,所以CLA-DH是1个亲水性蛋白。对CLA-DH进行跨膜区分析,结果表明CLA-DH不含跨膜区。对其进行细胞定位预测,结果显示CLA-DH为细胞质蛋白。对CLA-DH二级结构进行预测,发现其二级结构主要为40%左右的α-螺旋、30%左右的无规则卷曲和20%左右的β-折叠。

图3 CLA-DH的氨基酸序列
Fig.3 Amino acid sequence of CLA-DH
2.3 重组质粒的构建
将纯化后的CLA-DH基因和pET-28a(+)质粒分别经EcoRⅠ和XholI双酶切后回收酶切产物,连接后转化至大肠杆菌E.coli DH5α感受态细胞,挑取转化子进行培养后提取质粒进行双酶切验证,获得大小分别为5 300 bp和860 bp的片段(图4),与理论值相符。为进一步验证阳性克隆,将酶切验证正确的质粒测序,结果显示已经插入正确的目的基因,将重组质粒保藏并命名为pET-28a-DH。
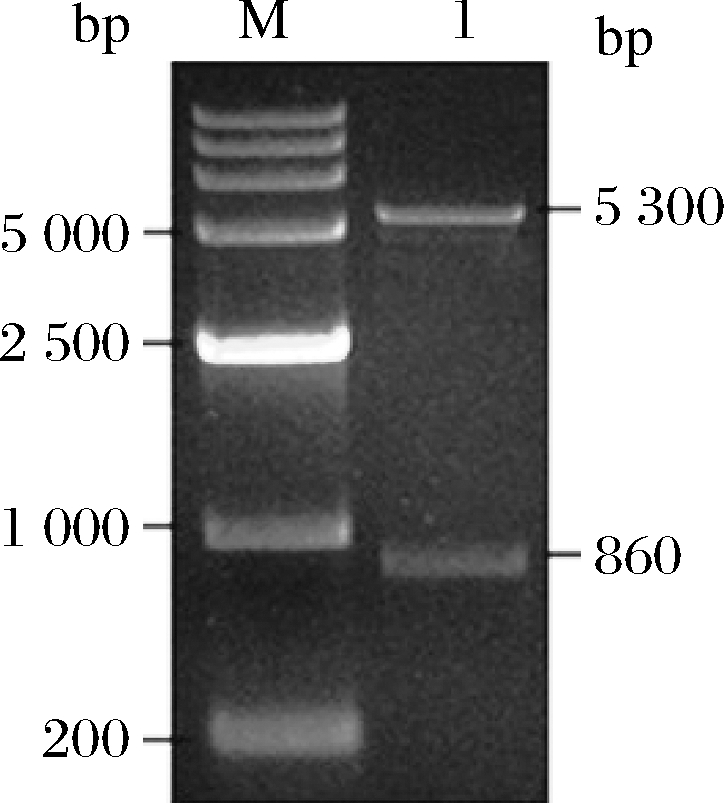
M-DNA marker;1-双酶切产物
图4 重组质粒pET-28a-DH双酶切鉴定电泳图
Fig.4 Electrophoresis gram of recombined plasmid pET-28a-DH by two enzymes digestion
2.4 重组菌的构建与诱导表达
将pET-28a-DH和pET-28a(+)空质粒转化至E.coli Transetta (DE3)感受态细胞中,获得重组菌E.coli Transetta/pET-28a-DH和对照菌E.coli Transetta/pET-28a。将诱导表达后菌体用KPB缓冲液洗涤2遍。超声破碎离心后收集上清和沉淀进行SDS-PAGE分析和Western Blot分析。结果显示与对照菌相比,重组菌E.coli Transetta/pET-28a-DH在上清部分约38 kDa处有1条明显的目标蛋白条带(图5),与预测目标蛋白大小基本一致,表明获得CLA-DH的可溶性表达,Western Blot结果也再次验证目标蛋白成功表达。

A-诱导表达后重组菌株蛋白的SDS-PAGE;B-Western Blot检测;M-蛋白Marker;1-阴性对照全细胞;2-上清;3-沉淀
图5 诱导表达后重组菌株蛋白的SDS-PAGE和Western Blot检测
Fig.5 SDS-PAGE analysis of the proteins from recombinants induction
2.5 重组酶的纯化
粗酶液与镍柱亲和后,分别用20、40、60、80、100、200 mmol/L咪唑洗脱液进行梯度洗脱,将洗脱液进行SDS-PAGE分析,结果显示200 mmol/L咪唑洗脱液中得到大量单一的目的蛋白(图6)。

M-蛋白Marker;1-破碎上清液;2-20 mmol/L咪唑洗脱液;3-40 mmol/L咪唑洗脱液;4-60 mmol/L咪唑洗脱液;5-80 mmol/L咪唑洗脱液;6-100 mmol/L咪唑洗脱液;7-200 mmol/L咪唑洗脱液
图6 镍柱纯化重组酶的SDS-PAGE分析
Fig.6 SDS-PAGE analysis of purification of recombinant enzymes by Ni-NTA affinity chromatography
2.6 重组酶活性检测
实验室前期已成功构建的工程菌亚油酸水合酶大肠杆菌工程菌E.coli BL21/pET-28a-HY。亚油酸标准品经GC检测在12.12 min出峰,加入CLA-HY粗酶液与亚油酸反应后经GC-MS检测在14.8 min出现新的产物峰,经MS碎片结果及理论断裂方式分析确定为10-HOE。同时加入CLA-HY和CLA-DH粗酶液进行反应后,经GC-MS检测在14.11 min出现新的产物峰(图7),结合MS结果及理论断裂方式(图8)分析该物质为10-氧代-顺-12-十八碳烯酸,证明CLA-DH能够将10-HOE转化为10-氧代-顺-12-十八碳烯酸。
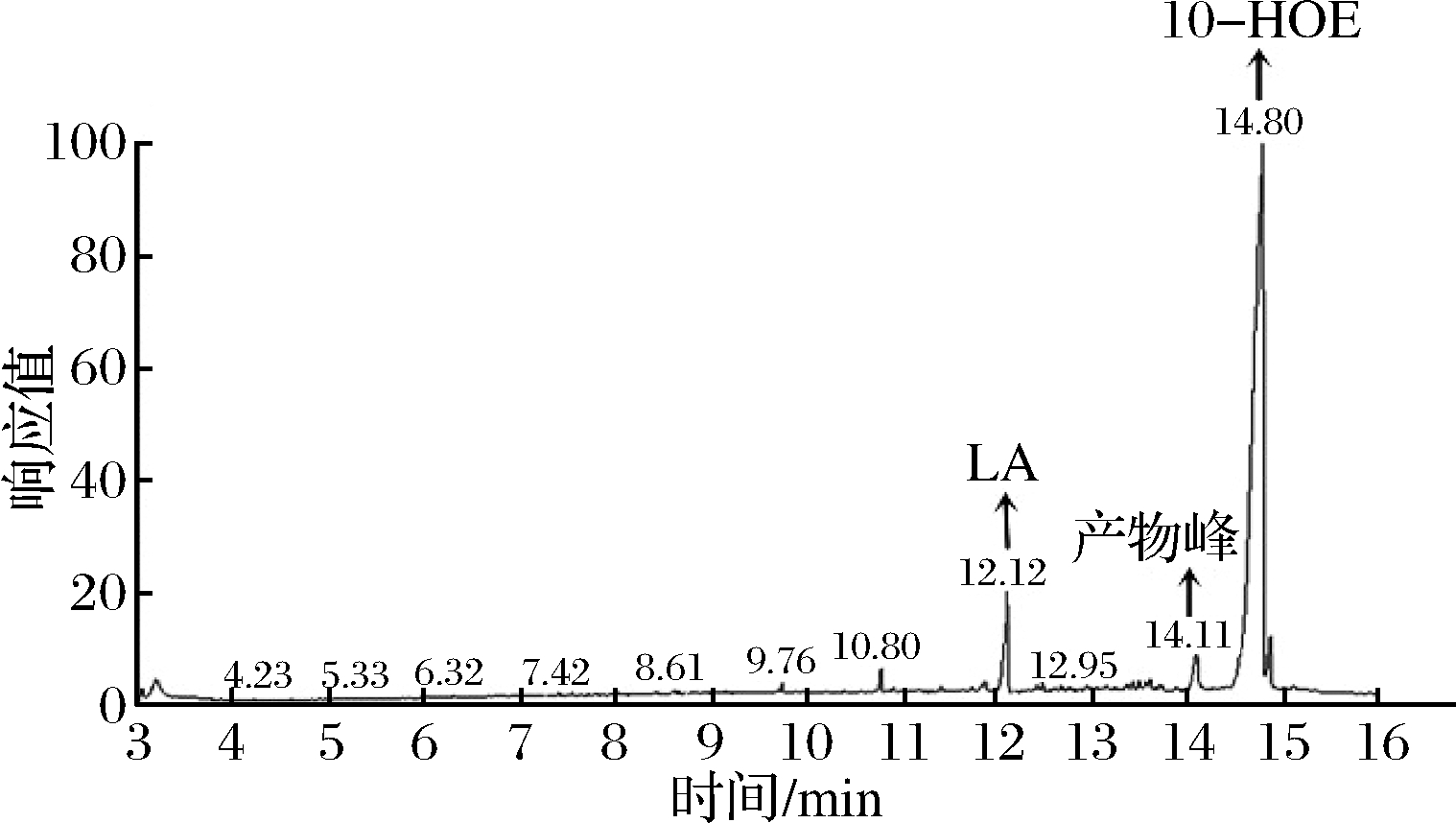
图7 E.coli BL21/pET-28a-HY和E.coli BL21/pET-28a-DH共同反应LA的GC结果
Fig.7 GC results of LA co-reacting with E.coli BL21/pET-28a-HY and E.coli BL21/pET-28a-DH
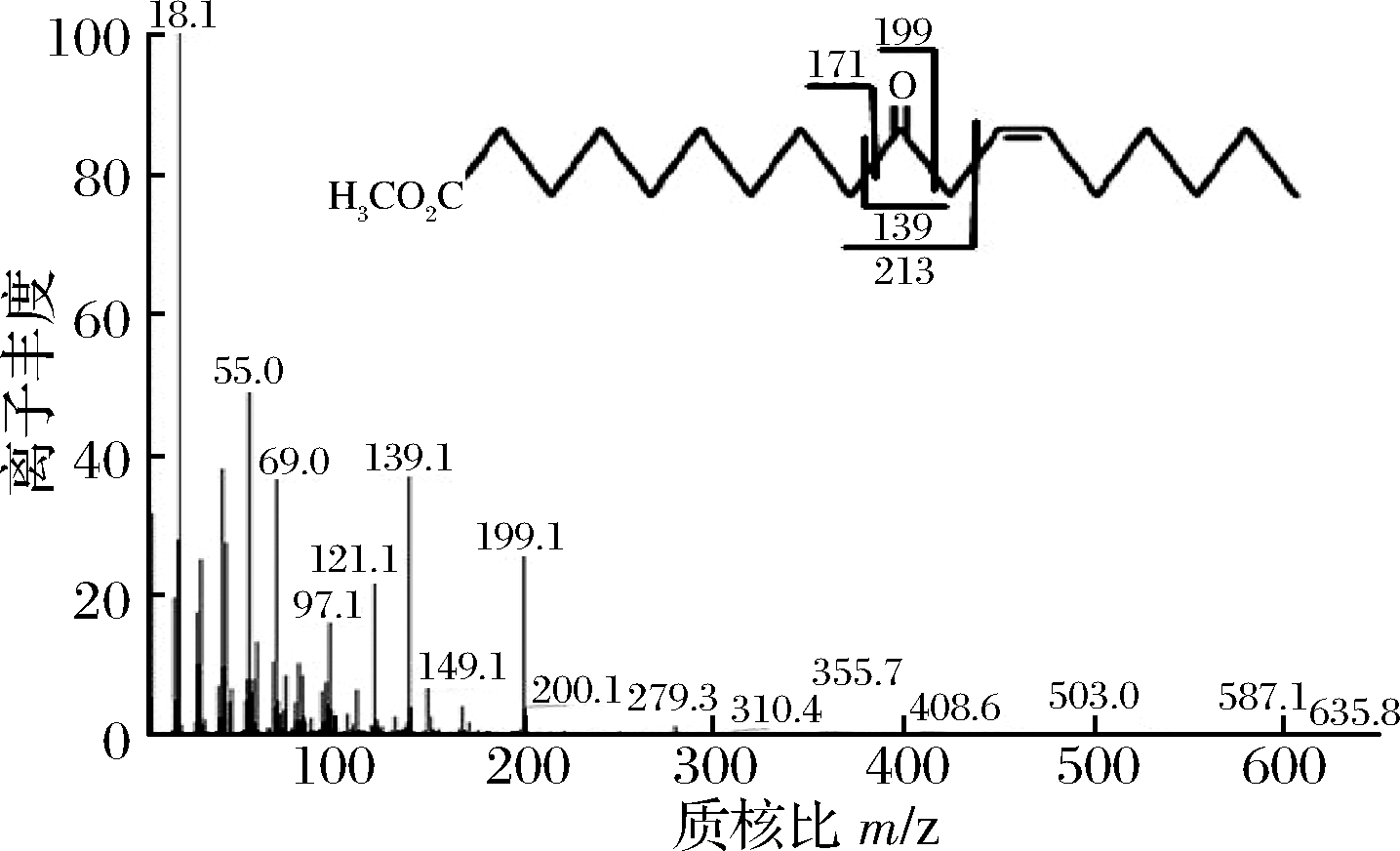
图8 产物的MS碎片结果及理论断裂方式
Fig.8 MS fragmentation results of the product and theoretical fracture mode
3 讨论
植物乳杆菌转化LA生成CLA需要CLA-HY、CLA-DH和CLA-DC组成的亚油酸异构酶系共同参与代谢过程。植物乳杆菌P8可以转化LA生成CLA,而且基因组中也存在这3种酶,但其转化CLA能力较弱,说明可能是3种酶性质不同造成转化能力不同。CLA-DH分别催化具有内部羟基或氧代基团的脂肪酸的脱氢和氢化,是植物乳杆菌生物转化CLA过程中的关键步骤。有研究表明CLA-DH属于短链脱氢酶/还原酶(SDR)家族,与其他SDRs有很大的相似性,但关于SDR家族中的羟基脂肪酸脱氢酶报道很少[8]。研究CLA-DH的酶学性质有助于探明植物乳杆菌P-8转化CLA能力较弱的原因,所以本实验克隆得到植物乳杆菌P-8中的CLA-DH基因,对其进行了生物信息学分析,并构建了CLA-DH的重组大肠杆菌,通过诱导表达得到有活性的CLA-DH重组酶,为深入研究CLA-DH的酶学性质提供了实验基础,而且为进一步提高CLA产量并将其广泛应用于食品、药品、保健品中奠定了理论基础。
参考文献
[1] PARIZA M. Perspective on the safety and effectiveness ofconjugated linoleic acid[J]. American Journal of Clinical Nutrition,2004,79:1 132S-1 136S.
[2] JONES E L,SHINGFIELD K J,KOHEN C,et al.Chemical,physical,and sensory properties of dairy products enriched with conjugatedlinoleic acid [J]. Journal of Dairy Science,2005,88 (8):2 923-2 937.
[3] CRUMB D J. Conjugated linoleic acid (CLA)- An overiew[J]. Internatiomal Journal of Applied Research in Natural Products,2011,4(3): 12-18
[4] COOK M E, PARIZA M W. Dietetic foods containing conjugated linoleic acids: WO, US 5760082 A[P]. 1998.
[5] 刘晓华,曹郁生,陈燕. 微生物生产共轭亚油酸的研究[J]. 食品与发酵工业, 2003, 29(9):69-72.
[6] LIN T Y, HUANG T H, CHEN G T S J. Conjugated linoleic acid production by immobilized cells of lactobacillus delbruckii ssp bulgaricus and lactobacillus acidophilus[J]. Food Chem, 2005, 92(1): 23-28
[7] 杨波. 乳酸菌生物转化共轭亚油酸的研究[D]. 无锡:江南大学, 2014.
[8] TAKEUCHI M, KISHINO S, PARK S B, et al. Characterization of hydroxy fatty acid dehydrogenase involved in polyunsaturated fatty acid saturation metabolism in Lactobacillus plantarum, AKU 1009a[J]. Journal of Molecular Catalysis B Enzymatic, 2015, 117:7-12.
[9] KISHINO S, PARK S B, TAKEUCHI M, et al. Novel multi-component enzyme machinery in lactic acid bacteria catalyzing CC double bond migration useful for conjugated fatty acid synthesis[J]. Biochemical & Biophysical Research Communications, 2011, 416(1-2):193.
[10] KIM Y, HIRAI S, GOTO T, et al. Potent PPARα activator derived from tomato juice, 13-oxo-9,11-Octadecadienoic acid, decreases plasma and hepatic triglyceride in obese diabetic mice[J]. Plos One, 2012, 7(2):e31 317.
[11] 杜美婷,陈慧泽,赵国芬. 植物乳杆菌P8产共轭亚油酸条件的优化[J]. 生物学杂志, 2012, 29(3):92-95.