微藻具备光效高,生长速度快,投入低等优点,是多种高附加值天然产物、生物活性化合物的重要来源[1]。此外,微藻可在海水、苦咸水、市政污水等非农用水中培养,减少了新鲜水消耗;也可在滩涂、盐碱地等边际土地上大规模培养,做到“不与人争粮、不与人争地”[2]。但是微藻生物量浓度低,造成收获耗能大、新鲜水消耗多,导致微藻及其油脂生产成本高。因此,优化微藻培养条件,提高微藻的油脂产率和培养操作的灵活性,对充分开发利用湛江等鞭金藻具有重要的意义。
影响微藻生长和油脂积累的因素一般包括:光、碳源、氮磷等无机成分、营养方式等。光强对微藻生长的影响可分为光限制、光饱和及光抑制。到达光饱和之前,增强光强可以促进微藻生长[2],但是油脂积累量不高,有利于微藻生长和油脂积累的最佳光强往往是不同的[3]。氮是组成核酸和蛋白质的主要元素,与微藻初级代谢相关[4]。充足的氮可以促进微藻生长,但缺氮条件却有利于油脂积累[2]。微藻营养方式分为光自养、异养、兼养等,对其生长和油脂积累具有不同影响[5]。一般情况下,微藻在生长条件不利情况时能够大量产生油脂,作为碳和能量的储存形式[2],但通常以较低的生物量产率为代价。油脂产率代表油脂含量和生物量综合影响,是表征微藻油脂生产能力最合适的性能指标,为提高湛江等鞭金藻开发利用的经济性,需要优化微藻培养条件,提高其油脂产率[6]。目前,微藻培养的操作模式已进行了广泛研究,主要包括分批、分批补料、连续、半连续、两步法等[5],但这些培养操作模式均有不足之处。如两步培养需将微藻从营养丰富培养基转换到营养缺乏培养基,大规模培养时操作成本高;补料分批和连续培养常在营养充足条件下进行,微藻油脂/多糖含量未必高,往往导致下游加工成本更高。如果可以通过一步培养操作实现微藻培养和油脂积累的目标,可以降低生产成本,提高操作效率。
因此,本文以湛江等鞭金藻为研究对象,通过测定生长和生化组分变化,研究NaNO3浓度,光强和营养方式对生长和油脂积累的影响,并探究生长和氮消耗间的关系,以期为微藻油脂的商业化提供指导。
1 材料与方法
1.1 藻种和培养基
湛江等鞭金藻(Isochrysis zhanjiangensis)来自山东省农科院生物技术中心藻种资源库,藻株用人工海水改良f/2培养基培养[7]。
1.2 分批培养实验设计
湛江等鞭金藻在500 mL的锥形瓶中培养,使用300 mL灭菌的改良f/2培养基,光周期为14∶10,日光灯管提供光照,温度控制在(25±1) ℃,通入纯空气或含CO2的空气。培养条件见表1。
表1 不同培养条件的特征
Table 1 Characteristics of different cultivation conditions

对于光自养培养,提供不同光强,无机碳作碳源(含2% CO2空气流)。对于兼养培养,用葡萄糖(0.2 g/L)和无机碳(含2% CO2空气流)作碳源;对于光异养培养,培养基中提供葡萄糖(0.2 g/L),并添加10-6 mol/L 3-(3, 4-二氯苯基)-1, 1-二甲脲(DCMU),持续通入空气。所有通气培养中,通气比为0.2 vvm。为评估氮浓度对湛江等鞭金藻生长和油脂积累影响,以NaNO3为氮源,培养物分别接种于氮质量浓度分别为75、375和750 mg/L的改良f/2培养基中。分别选取低光强为100 μmol/(m2·s)(low light, LL)和高光强为200 μmol/(m2·s)(high light, HL)的光照,以研究光强对湛江等鞭金藻生长和油脂积累的影响。实验过程中,每天测细胞密度和培养基中氮浓度,培养结束后测干重和各生化组分含量。
1.3 微藻生长和生化成分测定
细胞个数采用显微镜直接镜检计数。微藻在6 000×g条件下离心5 min,纯化水洗涤2次,放入预干燥和称重的培养皿中,40 ℃干燥至恒重,重量分析法测干重。总脂采用BLIGH等的方法测定[8]。多糖采用苯酚硫酸法,葡萄糖为标准物质[9]。蛋白质采用考马斯亮蓝染色法测定,以牛血清白蛋白为标准[10]。采用DONG等[11]的方法将藻类生物质直接甲酯化,气相色谱分析脂肪酸甲酯组成。
1.4 生物量产率和油脂产率测定
生物量产率(Pbiomass)按公式(1)计算:
![]()
(1)
油脂产率(Plipid)按公式(2)计算:
![]()
(2)
1.5 氮浓度测定
通过紫外分光光度法测OD220nm[12],由标准曲线换算成NaNO3浓度,该方法原理是人工海水主要成分在紫外域具有吸收光谱。
1.6 统计学分析
所有结果以平均值±标准偏差表示。所有数据用SPSS 10(Chicago,IL,USA)中的单向ANOVA(方差分析)和Duncan多重范围试验(P<0.05)进行评估。
2 结果与分析
2.1 培养条件和营养方式对湛江等鞭金藻生物量浓度影响
如图1所示,光强分别为100和200 μmol/(m2·s)时,不同营养方式下,随NaNO3质量浓度升高(从75 mg/L升高到750 mg/L),微藻生物量浓度在逐步增大。培养9 d后,NaNO3质量浓度为75 mg/L、光强为100 μmol/(m2·s)光异养时生物量浓度最低为0.46 g/L,NaNO3质量浓度为750 mg/L,光强为200 μmol/(m2·s)兼养时生物量质量浓度最高为2.20 g/L。氮是合成蛋白质、核酸等生物大分子的必需元素,增加氮供应生物量浓度将增加,这与其他研究结果一致[13],也有研究证明,氮浓度较低时会导致细胞营养不足,从而影响微藻的正常生长[4]。
在相同的光强和NaNO3质量浓度条件下,兼养培养可获得最高的生物量浓度(0.78~2.2 g/L,平均为相同条件下光自养培养的1.34倍,光异养培养的2.28倍),表明湛江等鞭金藻可同时利用CO2和葡萄糖2种碳源,并获得更高产量。兼养培养具有将有机碳和无机碳同化的优势,可将外部提供的或呼吸过程中产生的CO2进行同化[14]。特别是葡萄糖存在下,通过光合作用将有氧呼吸时释放的CO2进行再固定被证明是兼养培养条件下生物质合成的关键[15]。此外,兼养培养还可以减少自养培养时的自遮蔽问题,也可以降低异养时的成本增加问题[14],因此兼养培养(以有机碳如葡萄糖作为补充)在微藻生物质和次生代谢产物生产中被广泛应用[16]。
在相同的NaNO3质量浓度条件下,光自养培养湛江等鞭金藻时,高光强(200 μmol/(m2·s))时生物量浓度增大,最高为1.76 g/L;光异养和兼养培养湛江等鞭金藻时,低光强(100 μmol/(m2·s))时生物量浓度高,兼养时最高为2.2 g/L,光异养时最高为0.97 g/L。光是合成ATP和NADPH所必需的因素,它驱动产生碳骨架光合作用的暗反应[4],对微藻的生化组成和生物量有影响[17],因此光强是微藻培养的主要限制因素之一。光强过低或过高,微藻均不能有效生长[2]。较高的光强会使光合速率逐步增加到最大点,之后逐渐降低,直到光合速率被光呼吸和光抑制平衡。本实验结果显示,增加光强提高了湛江等鞭金藻光自养时生物量浓度,RODOLFI等[18]在平板式光生物反应器中培养微拟球藻Nannochloropsis时也发现随光强增加生物量产率升高的现象。LV等[19]证明与低光强和高光强相比,光强为60 μmol/(m2·s)时,小球藻C. vulgaris生物量浓度和油脂含量均升高。
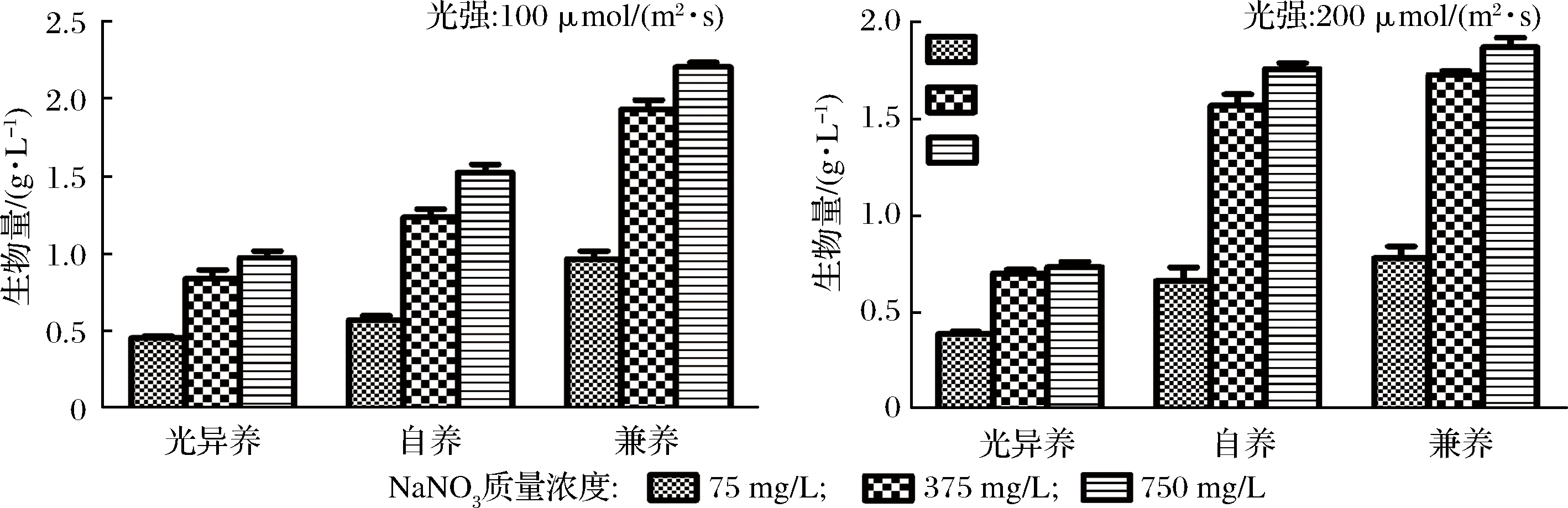
图1 不同营养方式、光强、NaNO3质量浓度对湛江等鞭金藻生物量的影响
Fig.1 Biomass production performance of I. zhanjiangensis grown on f/2 media under different trophic modes (photoautotrophic,mixotrophic and photoheterotrophic cultivation), light intensity, and NaNO3 concentrations
综合分析以上结果可知,NaNO3质量浓度为750 mg/L、光强为100 μmol/(m2·s)、兼养培养可获得最高生物量,因此是分批培养湛江等鞭金藻时获得生物量的合适培养条件。
2.2 培养条件和营养方式对湛江等鞭金藻生化成分影响
不同培养条件和营养方式下湛江等鞭金藻生化成分见图2。
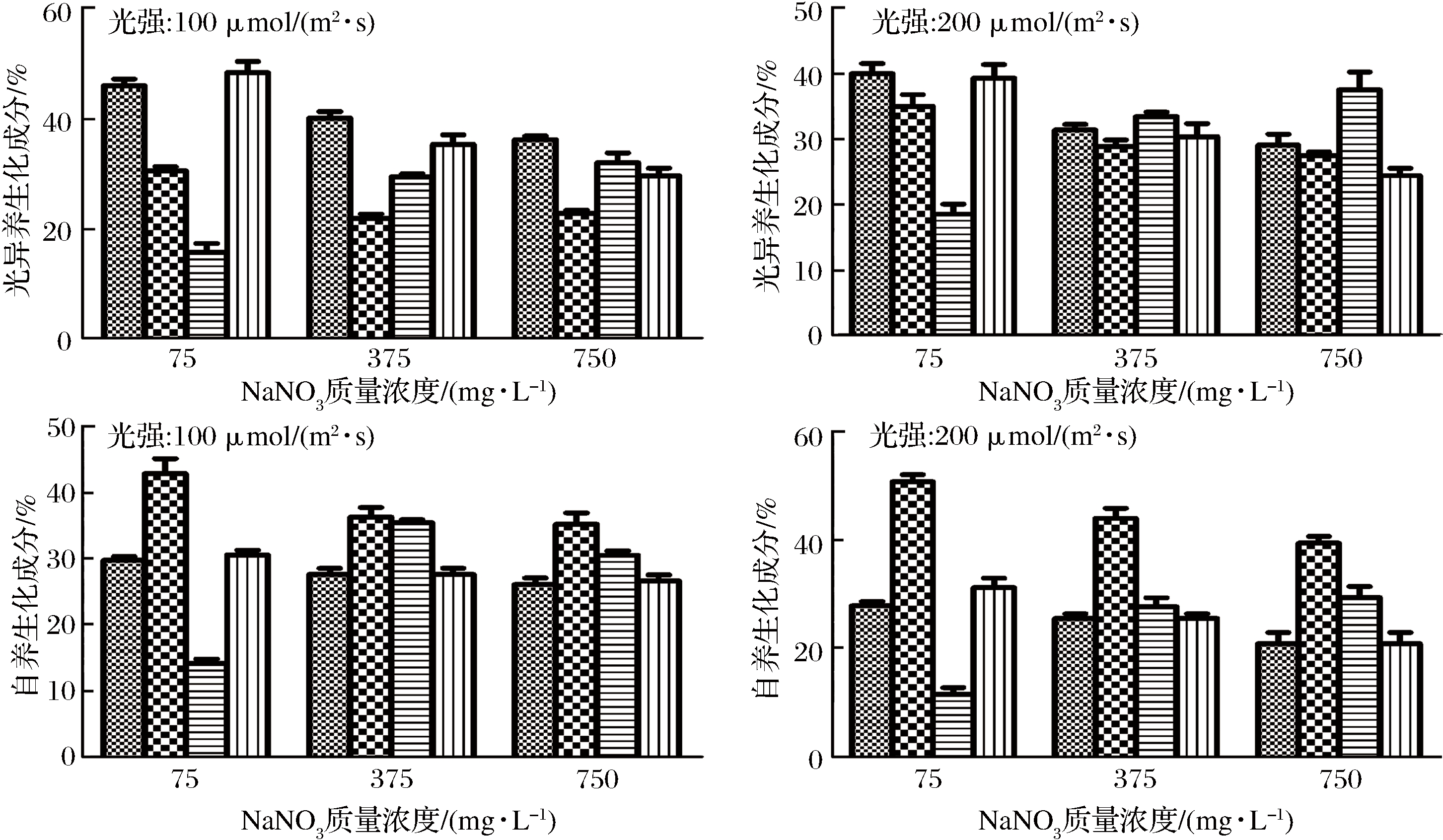
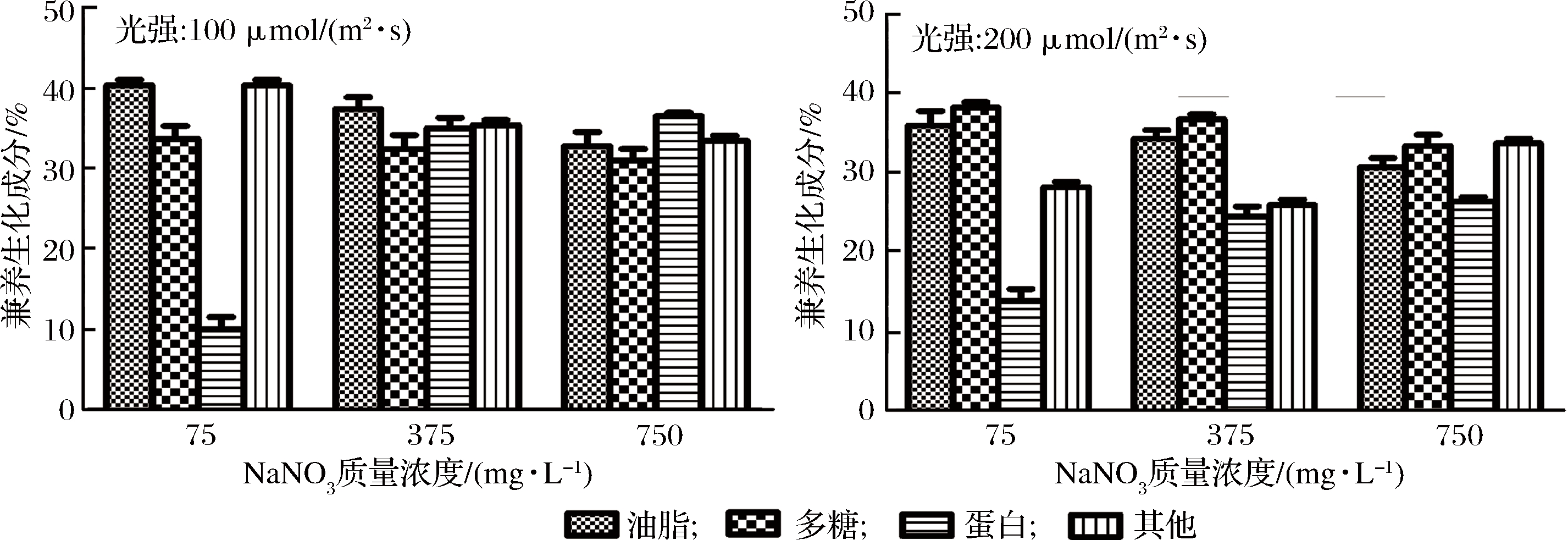
图2 不同营养方式(光自养、兼养、光异养)、光强和NaNO3质量浓度对湛江等鞭金藻生化成分的影响
Fig.2 Biochemical components of I. zhanjiangensis grown on f/2 medium under different trophic modes (photoautotrophic, mixotrophic, and photoheterotrophic cultivation), light intensity, and NaNO3 concentration
在通入CO2气体条件下(光自养和兼养),多糖含量是30%~40%;当使用葡萄糖为唯一碳源条件下(光异养),多糖含量稍低。与光自养相比,兼养和光异养条件下多糖含量下降,而总脂含量增加。最高多糖含量(50.8%)在NaNO3质量浓度为75 mg/L、光强为200 μmol/(m2·s)、光自养条件下获得,最高油脂含量(46.0%)在NaNO3质量浓度为75 mg/L、光强为100 μmol/(m2·s)、光异养条件下获得。兼养培养时油脂含量高于光自养培养。一般而言,兼养培养时,部分能量用于生长,其余能量以碳水化合物和油脂形式储存,使得微藻细胞肿胀,体积增大,油脂含量升高[20]。碳水化合物和油脂的数值成反比,如GOODSON等[21]和LI等[16]分别在研究C. sorokiniana和Chlamydomonas reinhardtii时发现,油脂合成在很大程度上依赖于淀粉降解,因为叶绿体中淀粉较少时,可以为储存油脂提供更多空间。
在相同的营养方式和光强下,NaNO3浓度越低,湛江等鞭金藻油脂和多糖含量越高;NaNO3浓度越高,蛋白质含量越高。缺氮培养是微藻油脂生产中应用最广泛的营养胁迫,氮饥饿下刺激油脂积累主要包括以下两种机制。一方面,由于大多数氨基酸合成中需要氮,所以在氮饥饿时蛋白质含量降低,并且导致细胞通常处入细胞周期的停滞期,可表达更高水平的应激标记代谢物如碳水化合物和油脂[22]。另一方面,氮饥饿条件下,微藻积累更多的油脂,也可能是将碳水化合物转化和重新分配成脂肪,从而使油脂含量增加[23]。WASE等[24]通过基于GC-MS的代谢组学和ITRAQ标记的蛋白质组学分析发现,氮饥饿时,糖酵解、TCA循环、淀粉、油脂代谢、氮同化、氨基酸代谢和氧化磷酸化所涉及的酶增强,相反,卡尔文循环、光收获复合体、乙醛酸循环、一碳代谢、戊糖磷酸途径和核糖体的酶则减少。
相同营养方式下,氮浓度相同时,光强增加导致湛江等鞭金藻总脂含量降低,对绿色巴夫藻Pavlova lutheri和三角褐指藻Phaeodactylum. tricornutum研究中也发现了相同规律[25-26]。一般而言,光强升高时蛋白含量降低,而总脂和多糖含量增加[22]。微藻倾向于积聚油脂,而不是碳水化合物,因为积累油脂可以避免光损伤现象发生,同时油脂作为能量储存比碳水化合物更有效[2]。如HO等[27]研究发现,高光强在微藻积累中性脂(TAG)或类胡萝卜素时起刺激作用,在高光强(300 μmol/(m2·s))时,衣藻Chlamydomonas sp. JSC4油脂产率为312 mg/(L·d),油脂含量显著高于低光强(30 μmol/(m2·s))时的油脂含量。本研究结果表明,湛江等鞭金藻在光强和NaNO3浓度升高时总脂含量降低,低氮和低光强利于促进湛江等鞭金藻总脂积累。这可能是多种压力下导致活性氧(reactive oxygen species, ROS)增加,造成脂肪酸和TAG生物合成相关的酶发生氧化损伤,使得碳流向其他储存组分,从而造成油脂含量降低[28]。
2.3 培养条件和NaNO3浓度对油脂产率的影响
从表2中看出,光强为200 μmol/(m2·s)条件下,油脂产率呈现先增大后降低的趋势;光强为100 μmol/(m2·s)条件下,油脂产率逐步增大,最大油脂产率80.16 mg/(L·d)在低光强兼养时得到;但在低光强兼养培养、NaNO3质量浓度为375 mg/L时,油脂含量更高(37.40%)。综合考虑油脂含量和最终获得的生物量浓度,光强为100 μmol/(m2·s)、NaNO3质量浓度为375 mg/L兼养培养是湛江等鞭金藻大量培养生产油脂的最适培养条件,同时,较高的油脂含量利于下游处理,降低油脂生产成本。此外,与等鞭金藻Isochrysis sp. 的37.8 mg/(L·d)[19],小球藻Chlorella zofingiensis的 36.00 mg/(L·d),小球藻C. vulgaris的27.0~35.0 mg/(L·d),微拟球藻Nannochloropsis oceanica的56.91 mg/(L·d),绿球藻Chlorococcum pamirum的41.00 mg/(L·d),栅藻Scenedesmus sp.的20.70 mg/(L·d)[29]等研究结果相比,本实验中获得的油脂产率更高。
表2 不同NaNO3质量浓度、营养方式和光强下湛江等鞭金藻的油脂产率
Table 2 Lipid productivity of I. zhanjiangensis grown on f/2 medium with different NaNO3 concentration under different trophic modes (photoautotrophic, photoheterotrophic and mixotrophic cultivation) and light intensity
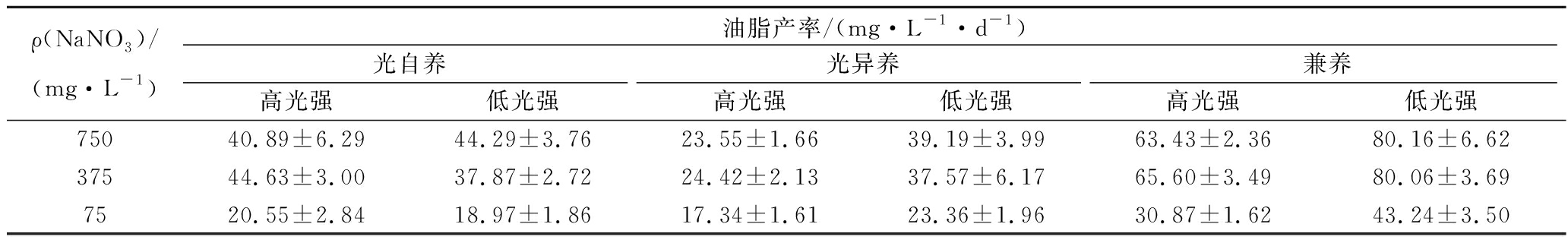
注:高光强: 200 μmol/(m2·s);低光强: 100 μmol/(m2·s)
2.4 培养条件和营养方式对微藻生长和氮源消耗的影响
不同培养条件和营养方式下,细胞密度和氮消耗比较见图3。
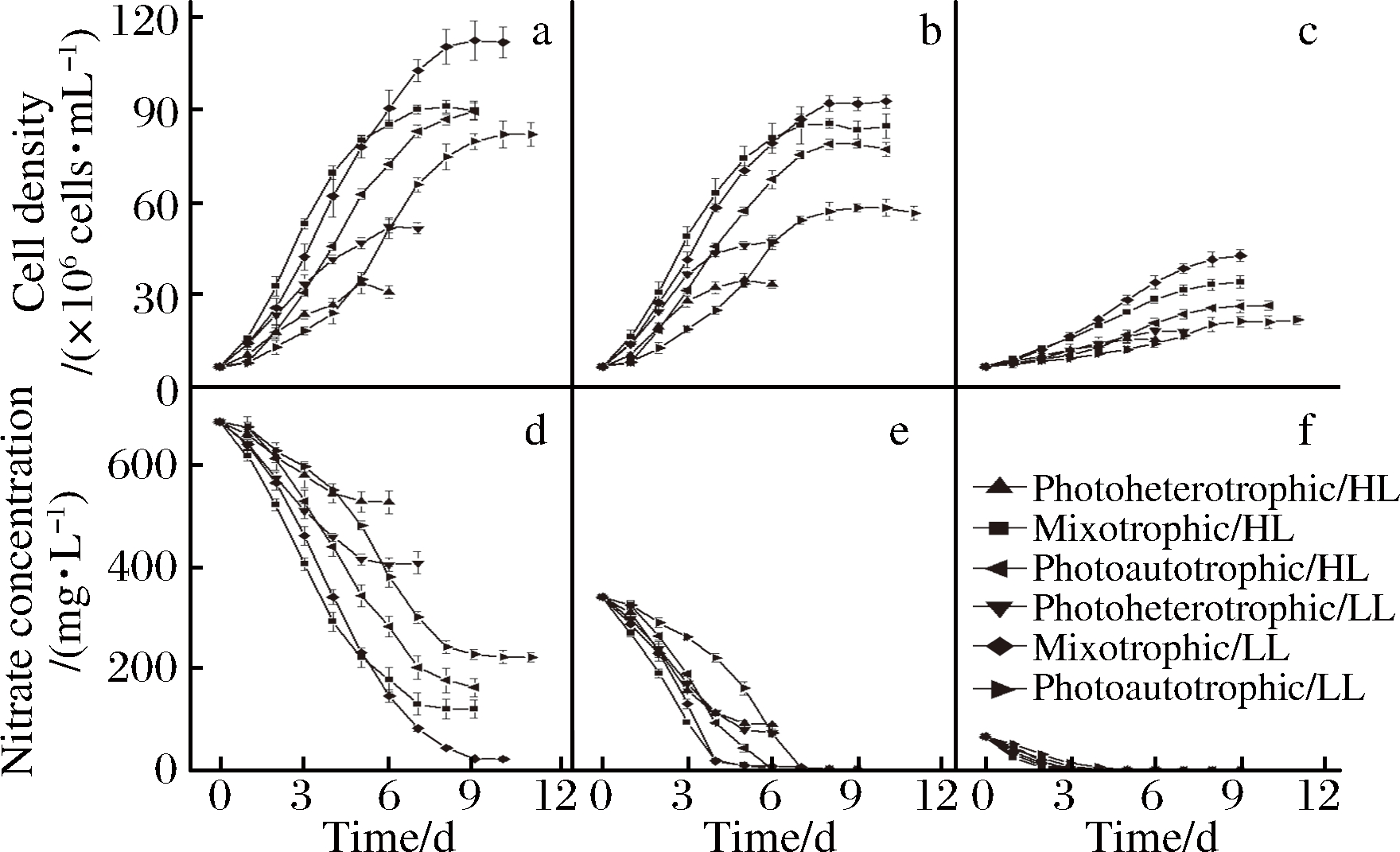
▲-光异养/高光强;■-兼养/高光强;◀-光自养/高光强;▼-光异养/低光强;◆-兼养/低光强;□-光自养/低光强
图3 f/2培养基中不同培养条件下湛江等鞭金藻生长动力学和相应的氮消耗
Fig.3 Growth kinetics of I. zhanjiangensis grown on f/2 medium under different cultivation conditions and corresponding nitrogen consumption
注:每个点代表3次重复的平均值。a, d分别为NaNO3质量浓度为75 mg/L时的生长和氮消耗曲线;b, e分别为NaNO3质量浓度为375 mg/L时的生长和氮消耗曲线;c, f分别为NaNO3质量浓度为750 mg/L时的生长和氮消耗曲线。
随培养时间延长,各组细胞密度均有不同程度增加。光异养条件下生长慢,最高细胞密度仅为52×106 cells/mL,兼养培养比光自养和光异养培养生长快,兼养和光自养培养9 d最大细胞密度分别可达到112 × 106 cells/mL和92× 106 cells/mL (图3-a~图3-c)。
氮为湛江等鞭金藻生长的限制因子,这在其他微藻中也已证实[30]。氮消耗曲线显示,NaNO3质量浓度为75和375 mg/L培养基中,光自养和光异养时,氮先后在指数阶段中期完全耗尽(图3-e,图3-f);兼养条件下,氮源的消耗主要用于生长,产生大量微藻(图3-d,图3-e,图3-f),因此兼养的氮消耗比光自养和光异养条件下快。在氮源充足(NaNO3质量浓度为750 mg/L)时,3种营养方式下氮均没有耗尽,但与NaNO3质量浓度为75和375 mg/L时的氮消耗特点一致,均是兼养最快,光异养消耗最慢,这也与生长曲线一致。NaNO3质量浓度为375 mg/L时,兼养方式培养湛江等鞭金藻,既可以获得较高的生物量和油脂产率,同时氮消耗率可达90%以上,利于培养基中营养物质的充分利用。在研究其他微藻时也发现,氮浓度能够影响氮消耗率,如GONCALVES等[31]发现小球藻C. vulgaris,月芽藻Pseudokirchneriella subcapitata,集胞藻Synechocystis salina和铜绿微囊藻Microcystis aeruginosa等微藻对氮的利用率达到近90%。
2.5 湛江等鞭金藻的脂肪酸组成
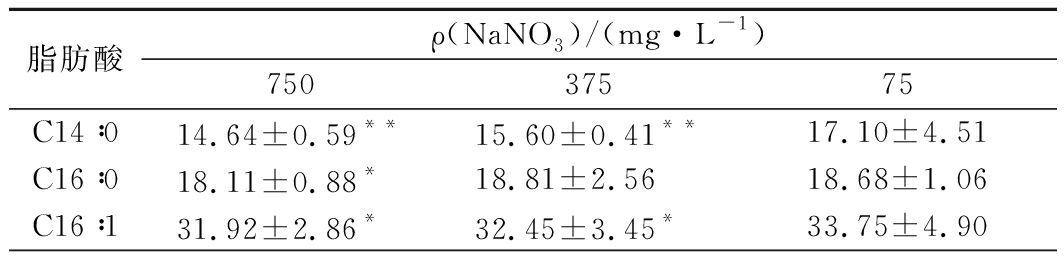
在光强为100 μmol/(m2·s)兼养条件下,不同NaNO3浓度生长的微藻培养物中主要脂肪酸组成用GC分析(表3)确定。
表3 光强为100 μmol/(m2·s)兼养培养条件下不同NaNO3质量浓度时湛江等鞭金藻的脂肪酸组成
Table 3 Fatty acid compositions of I. zhanjiangensis grown on f/2 medium with different nitrogen concentration under mixotrophic cultivation conditions at the light intensity of 100 μmol/(m2·s) (% of total FAME)
续表3
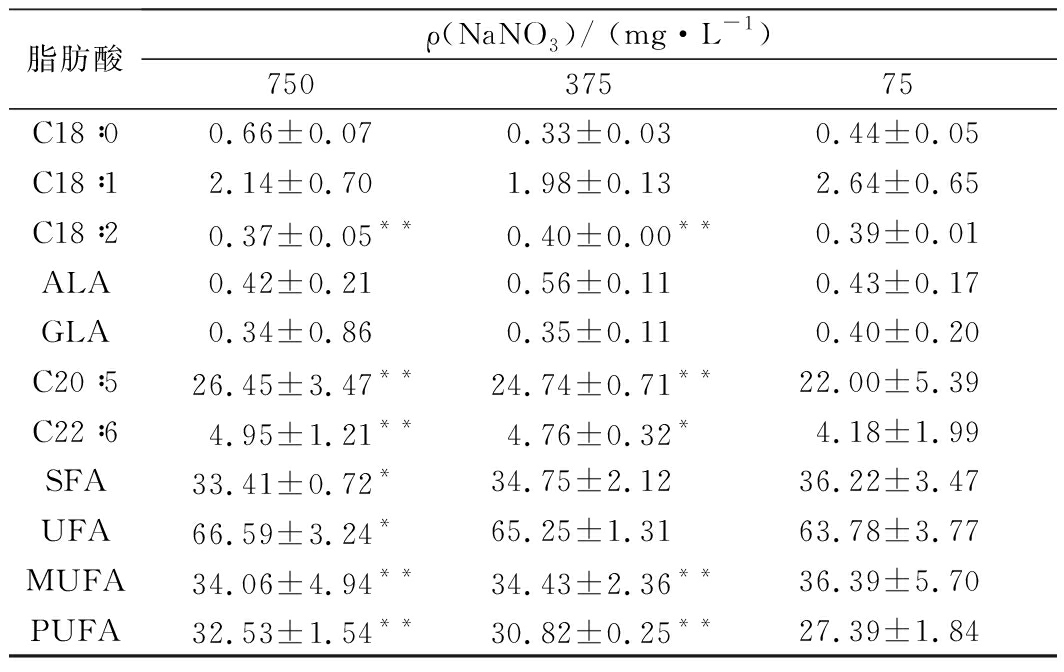
注:SFA表示饱和脂肪酸;UFA表示不饱和脂肪酸;MUFA表示单不饱和脂肪酸;PUFA表示多不饱和脂肪酸;每个点代表3次重复的平均值。均与质量浓度为75 mg/L的情况进行比较,*代表P<0.05,**代表P<0.01。
不同NaNO3浓度条件下湛江等鞭金藻脂肪酸种类没有明显差异,主要脂肪酸为棕榈油酸(palmitoleic acid,16∶1)、EPA(eicosapentaenoic acid,20∶5n3)、棕榈酸(palmitic acid,16∶0)和肉豆蔻酸(myristic acid,14∶0),微量组分则包括硬脂酸(stearic acid,C18∶0),油酸(oleic acid,C18∶1)、亚油酸(linoleic acid,C18∶2)、γ-亚麻酸(γ-linolenic acid,18∶3n6,GLA)、α-亚麻酸(alpha linolenic acid,18∶3n3,ALA)和docasahexaenoic acid (22∶6n3, DHA)。
湛江等鞭金藻的脂肪酸分布与FENG等[13]报道一致,主要脂肪酸是短链脂肪酸(C14-C18)和多不饱和脂肪酸组分。实验结果表明,不同NaNO3浓度培养的湛江等鞭金藻中脂肪酸分布变化具有规律性,即随着NaNO3浓度增加,MUFA和SFA水平升高而多不饱和脂肪酸水平降低。PINCHETTI等[32]研究表明,氮饥饿时脂肪酸合成过程继续进行,SFA和MUFA增加到最大值72.2%,而多不饱和脂肪酸减少到27.7%,这与本研究中观察到的脂肪酸分布一致。FENG等[13]研究发现湛江等鞭金藻中多不饱和脂肪酸是DHA,最高比例为14.9%,而在本研究发现其主要的多不饱和脂肪酸是EPA,最高比例为26.45%,可作为营养制品、功能食品和化妆品的合适来源。湛江等鞭金藻脂肪酸组成与生物柴油的最佳组成(C16∶1∶C18∶1和C14∶0比例为5∶4∶1)不同,EPA和DHA组分也会影响点火质量和氧化稳定性,因此不适用于生物柴油的开发利用[33]。
3 结论
综上所述,分批培养湛江等鞭金藻时,最高油脂含量(46.00%)在NaNO3质量浓度为75 mg/L、光强为100 μmol/(m2·s)光异养生长时得到,最高生物量浓度(2.20 g/L)在NaNO3质量浓度为750 mg/L、光强为100 μmol/(m2·s)兼养培养时获得。综合考虑油脂含量和生物量浓度,在光强为100 μmol/(m2·s)、NaNO3质量浓度为375 mg/L兼养培养时获得最佳油脂产率80.06 mg/L/d,这利于油脂下游加工,降低生产成本。此外,与已经报道的其他微藻生物量和油脂产率结果相比,本实验获得的生物量和油脂产率更高,尤其是可提高具有商业价值的不饱和脂肪酸EPA的产量,能够为湛江等鞭金藻的开发利用提供指导。
参考文献
[1] RENUKA N, GULDHE A, PRASANNA R, et al. Microalgae as multi-functional options in modern agriculture: current trends, prospects and challenges [J]. Biotechnology Advances, 2018,S0734-9750(18):30076-4.
[2] 张方,熊绍专,何加龙,等. 用于生物柴油生产的微藻培养技术研究进展[J]. 化学与生物工程, 2018, 35(1): 5-11.
[3] CHEIRSILP B, TORPEE S. Enhanced growth and lipid production of microalgae under mixotrophic culture condition: effect of light intensity, glucose concentration and fed-batch cultivation [J]. Bioresource Technology, 2012, 110(2): 510-516.
[4] 董联,袁振宏,王忠铭,等. 光强与氮源对绿球藻GN38生长和油脂积累的影响[J]. 可再生能源, 2014, 32(1):73-80.
[5] HO SH, YE X, HASUNUMA T, et al. Perspectives on engineering strategies for improving biofuel production from microalgae-a critical review [J]. Biotechnology Advances, 2014, 32(8):1 448-1 459.
[6] GRIFFITHS MJ, HARRISON STL. Lipid productivity as a key characteristic for choosing algal species for biodiesel production [J]. Journal of Applied Phycology, 2009, 21(5):493-507.
[7] GUILLARD RRL, RYTHER JH. Studies of marine planktonic diatoms I. cyclotella nanai hustedt and detonula confervacea cleve[J]. Canadian Journal of Microbiology, 1975, 8(2): 229-239.
[8] BLIGH E, DYER W. A rapid method of total lipid extraction and purification [J]. Canadian Journal of Biochemistry and Physiology, 1959, 37(8): 911-917.
[9] DUBOIS M, GILLED KA, HAMILTON JK, et al. Colorimetric method for determination of sugars and related substances [J]. Analytical Chemistry, 1956, 28(3): 350-356.
[10] BRADFORD MM. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding [J]. Analytical Biochemistry, 1976, 72(1): 248-254.
[11] DONG XW, HE QF, PENG ZY, et al. Production of γ-linolenic acid and stearidonic acid by Synechococcus sp. PCC7002 containing cyanobacterial fatty acid desaturase genes [J]. Chinese Journal of Oceanology and Limnology, 2016, 34(4):772-780.
[12] COLLOS Y, MORNET F, SCIANDRA A, et al. An optical method for the rapid measurement of micromolar concentrations of nitrate in marine phytoplankton cultures [J]. Journal of Applied Phycology, 1999, 11(2):179-184.
[13] FENG D, CHEN Z, XUE S, et al. Increased lipid production of the marine oleaginous microalgae Isochrysis zhangjiangensis (Chrysophyta) by nitrogen supplement [J]. Bioresource Technology, 2011, 102(12): 6 710-6 716.
[14] LI T, ZHENG Y, YU L, et al. Mixotrophic cultivation of a Chlorella sorokiniana strain for enhanced biomass and lipid production [J]. Biomass & Bioenergy, 2014, 66(3):204-213.
[15] MARTINEZ ME, CAMACHO F, JIMENEZ JM, et al. Influence of light intensity on the kinetic and yield parameters of Chlorella pyrenoidosa mixotrophic growth [J]. Process Biochemistry, 1997, 32(3):93-98.
[16] LI T, GARGOURI M, FENG J, et al. Regulation of starch and lipid accumulation in a microalga Chlorella sorokiniana [J]. Bioresource Technology, 2015, 180(3):250-257.
[17] KRZEMINSKA I, PAWLIK-SKOWRONSKA B, TRZCINSKA M, et al. Influence of photoperiods on the growth rate and biomass productivity of green microalgae [J]. Bioprocess Biosystems Engineering, 2014, 37(4):735-741.
[18] RODOLFI L, CHINI ZITTELLI G, BASSI N, et al. Microalgae for oil: strain selection, induction of lipid synthesis and outdoor mass cultivation in a low-cost photobioreactor [J]. Biotechnology and Bioengineering, 2009, 102(1): 100-112.
[19] LV JM, CHENG LH, XU XH. Enhanced lipid production of Chlorella vulgaris by adjustment of cultivation conditions [J]. Bioresource Technology, 2010, 101(17): 6 797-6 804.
[20] JUNTILA DJ, BAUTISTA MA, MONOTILLA W. Biomass and lipid production of a local isolate Chlorella sorokiniana under mixotrophic growth conditions [J]. Bioresource Technology, 2015, 191(3):395-398.
[21] GOODSON C, ROTH R, WANG ZT, et al. Structural correlates of cytoplasmic and chloroplast lipid body synthesis in acetate boost [J]. Eukaryotic Cell, 2011, 10(12):1 592-1 606.
[22] MANDAL S, MALLICK N. Microalga Scenedesmus obliquus as a potential source for biodiesel production [J]. Applied Microbiology and Biotechnology, 2009, 84(2):281-291.
[23] JOHNSON X, ALRIC J. Central carbon metabolism and electron transport in Chlamydomonas reinhardtii: metabolic constraints for carbon partitioning between oil and starch [J]. Eukaryotic Cell, 2013, 12(6):776-793.
[24] WASE N, BLACK PN, STANLEY BA, et al. Integrated quantitative analysis of nitrogen stress response in Chlamydomonas reinhardtii using metabolite and protein profiling [J]. Journal of Proteome Reseach, 2014, 13(3):1 373-1 396.
[25] GUEDES AC, MEIRELES LA, AMARO HM, et al. Changes in lipid class and fatty acid composition of cultures of Pavlova lutheri, in response to light intensity [J]. Journal of the American Oil Chemistry Society, 2010, 87(7): 791-801.
[26] CHRISMADHA, BOROWITZKA MA. Effect of cell density and irradiance on growth, proximate composition and eicosapentaenoic acid production of Phaeodactylum tricornutum grown in a tubular photobioreactor [J]. Journal of Applied Phycology, 1994, 6(1): 67-74.
[27] HO SH, NAKANISHI A, YE X, et al. Dynamic metabolic profiling of the marine microalga Chlamydomonas sp. Jsc4 and enhancing its oil production by optimizing light intensity [J]. Biotechnology for Biofuels, 2015, 8(1): 48.
[28] 印尤强,黄罗东,胡强,等. 光强和氮源及其浓度对缺刻缘绿藻生长、油脂和花生四烯酸积累的影响[J]. 植物科学学报, 2017, 35(4):592-602.
[29] SHIN YS, CHOI HI, CHOI JW, et al. Multilateral approach on enhancing economic viability of lipid production from microalgae: A review [J]. Bioresource Technology, 2018, 258(5):335-344.
[30] PARK J, SEO J, KWON EE. Microalgae production using wastewater: effect of light-emitting diode wavelength on microalgal growth [J]. Environmental Engineering Science, 2012, 29(11):995-1 001.
[31] GONCALVES AL, SIMOES M, PIRES JCM. The effect of light supply on microalgal growth, CO2 uptake and nutrient removal from wastewater [J]. Energy Conversion and Management, 2014, 85(4):530-536.
[32] PINCHETTI JLG, FERNANDEZ EC, DIEZ PM. Nitrogen availability influences the biochemical composition and photosynthesis of tank-cultivated Ulva rigida (Chlorophyta) [J]. Journal of Applied Phycology, 1998, 10(3): 383-389.
[33] SCHENK PM, THOMAS-HALL SR, STEPHENS E, et al. Second generation biofuels: high-efficiency microalgae for biodiesel production [J]. Bioenergy Research, 2008, 1(1): 20-43.