郫县豆瓣是川味食谱中常用的调味佳品,有“川菜之魂”之称,它是以脱壳蚕豆为蛋白质原料,与面粉混合后经微生物作用发酵制成的一种半流动状态黏稠的调味品,具有辣而不燥、鲜红油润、回味香醇的特点[1]。蚕豆曲的制备是郫县豆瓣制作的一个关键过程,发酵阶段利用蚕豆曲中微生物生长繁殖产生的酶系,将原料中的蛋白质、淀粉等分解成多肽、游离氨基酸、糖类等小分子物质[2],这些物质对豆瓣酱风味及色泽的形成起着至关重要的作用,因此提高豆瓣成曲酶活力,是豆瓣生产中最重要的质量控制点。
复合菌株制曲主要是利用多菌株共培养制曲过程中分泌的酶系进行互补,来提高原料利用率、氨基酸生成率,以增强产品风味[3]。近年来,不少学者都致力于复合菌株制曲在传统酿造酱制品中的研究,林晓华等[4]在传统生产工艺的基础上利用米曲霉和黑曲霉混合制曲,对豆豉制曲工艺条件进行了优化;PENG等[5]对酱油发酵过程中酶活力、抗氧化剂和酚类化合物进行了研究,发现米曲霉HG-26和黑曲霉HG-35混合制曲比单菌制曲发酵能力高。然而采用复合菌株制曲在郫县豆瓣中的研究和应用还鲜有报道。
传统郫县豆瓣生产是以霉菌为主要微生物经自然发酵而成[6]。目前,郫县豆瓣生产企业大都采用纯种米曲霉单一菌株制曲,而米曲霉主要以产中性蛋白酶为主,产酸性蛋白酶和纤维素酶能力较弱[7]。这些中性蛋白酶在发酵过程中的偏酸性条件下往往受到抑制,导致原料利用率低、产品风味不足[8]。黑曲霉产酸性蛋白酶和纤维素酶等活力较强,尤其是产酸性蛋白酶活力远高于米曲霉[9],因此,在郫县豆瓣制曲中如能利用米曲霉和黑曲霉菌株共培养制曲,可有效弥补单一米曲霉制曲中酶活力不足、产品氨基酸态氮含量低、鲜味不足等缺点。
本研究从传统酿造酱制品中分离筛选高产蛋白酶优势米曲霉和黑曲霉菌株,进行了形态学和分子生物学鉴定,利用米曲霉和黑曲霉共培养制曲,对制曲过程中的主要酶系活力进行研究,旨在为生产优质郫县豆瓣提供参考。
1 材料与方法
1.1 菌种、材料与试剂
传统酿造郫县豆瓣,四川省郫县豆瓣股份有限公司;酱油酱醅,千禾味业食品股份有限公司;麸皮、豆粕、蚕豆、面粉,郫县红光农贸市场。
福林试剂、氯化钠、无水葡萄糖、麦芽糖、三氯乙酸、磷酸二氢钠、磷酸氢二钠、硼砂、氢氧化钠、干酪素、L-酪氨酸、盐酸、酒石酸钾钠、二硝基水杨酸、重苯酚、亚硫酸钠、1水柠檬酸、2水柠檬酸钠、淀粉、对硝基苯胺,成都科龙化工试剂厂;乳酸,天津市科密欧化学试剂有限公司;乳酸钠,天津市光复精细化工研究所; L-亮氨酸对硝基苯胺,上海麦克林生化科技有限公司;DNA提取试剂盒、DNA Marker、Taq DNA连接酶、dNTPs,北京天根生化科技有限公司。
1.2 仪器与设备
PHS-320酸度计,成都世纪方舟科技有限公司;SGSP-02电热恒温隔水式培养箱,黄石市恒丰医疗器械有限公司;HNY-2102C恒温培养振荡器,天津市欧诺仪器仪表有限公司;WFJ7200型可见分光光度计,尤尼柯(上海)仪器有限公司;E200MV生物显微镜,南京尼康江南光学仪器有限公司;BPG-9070A精密鼓风干燥箱,上海一恒科学仪器有限公司;DK-98-Ⅱ电热恒温水浴锅,天津市泰斯特仪器有限公司;Biometra PCR仪,德国Analytik Jena AG公司;Powerpac Basic凝胶成像系统,美国Bio-Rad公司。
1.3 实验方法
1.3.1 主要培养基
察氏培养基:蔗糖30 g, NaNO3 3 g, MgSO4·7H2O 0.5 g,KCl 0.5 g,FeSO4·4H2O 0.01 g,K2HPO4 1 g,琼脂15 g,蒸馏水1 000 mL,pH值6.0~6.5。
酪蛋白培养基:干酪素4 g,KH2PO4 0.36 g,Na2HPO4 1.07 g,ZnCl2 0.014 g,NaCl 1.2 g,CaCl2 0.002 g,MgSO4·7H2O 0.5 g,FeSO4 0.002 g,琼脂20 g,蒸馏水1 000 mL,pH值6.5~7.0。
PDA培养基:去皮马铃薯200 g切块,加1 000 mL蒸馏水煮沸20 min,纱布过滤,补蒸馏水至1 000 mL,加葡萄糖20 g,琼脂20 g,pH值自然。
种曲培养基:麸皮8 g,豆粕2 g,蒸馏水5 mL,封装后121 ℃灭菌20 min[10]。
1.3.2 菌株筛选
用无菌生理盐水对郫县豆瓣、酱醅分别进行梯度稀释,选择适当浓度的稀释液在察氏培养基上涂布分离,30 ℃倒置培养,观察,筛选单菌落进行划线分离,多次分离纯化直到得到纯培养物;挑选生长较快、菌丝粗壮的单菌落用点接法点接到酪蛋白筛选培养基,30 ℃培养3 d,观察记录透明圈直径D和菌落直径d之比,挑选D/d值较大的菌落接种于PDA培养基斜面保存[11]。
1.3.3 菌株鉴定
1.3.3.1 菌株的形态学观察
在PDA固体培养基中30 ℃培养3 d,参照《真菌鉴定手册》对菌株进行形态学鉴定[12]。
1.3.3.2 菌株的分子学鉴定
采用真菌试剂盒提取菌株基因组DNA,用真菌基因序列扩增通用引物ITS4(5’-TCCTCCGCTTATTGATATGC-3’)和ITS5(5’-GGAAGTAAAAGTCGTAACAAGG-3’)扩增真菌的ITS序列[13]。50 μL反应体系:模板DNA 1.5 μL,ITS4 1 μL,ITS5 1 μL,10×PCR Buffer 5 μL,Mixed dNTP 1 μL,Taq DNA聚合酶0.5 μL,ddH2O 40 μL;PCR扩增程序:94 ℃预变性5 min,94 ℃变性30 s,50 ℃退火45 s,72 ℃延伸2.5 min,30个循环,最后于72 ℃保温扩展10 min。PCR产物经1%的琼脂糖凝胶电泳检测并将扩增产物连接到pGM-T载体后克隆入感受态细胞 E. coli DH5α中,提取重组质粒对ITS序列测序[14],所得序列提交至NCBI进行Blast比对。通过BLAST程序将所测的序列和NCBI GenBank数据库进行同源性比较,然后利用MEGA 7.0软件和Neighbor-Joining法构建系统发育树[15]。
1.3.4 单菌株及复合菌株共培养制曲酶活力分析
1.3.4.1 豆瓣制曲工艺流程
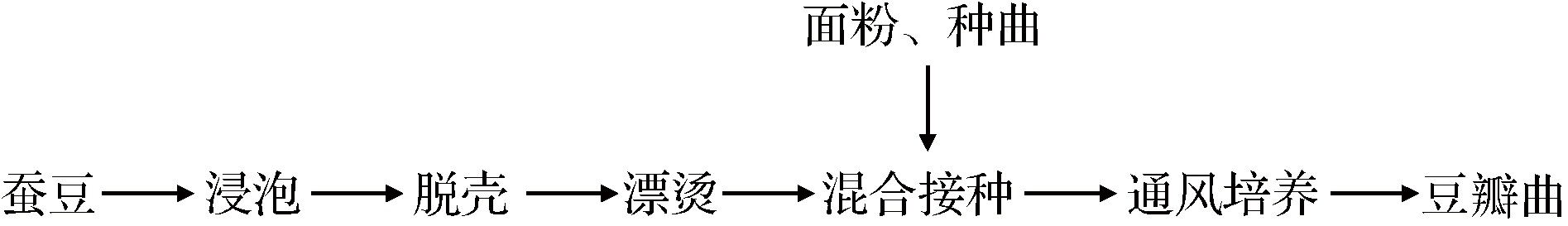
1.3.4.2 种曲制备
将分离获得的霉菌菌悬液(孢子浓度107个/mL) 按1%的接种量分别接种到种曲培养基上,置于30 ℃培养72 h,定时翻曲,防止曲料结块[16]。
1.3.4.3 单菌株制曲
脱壳蚕豆95 ℃开水漂烫3 min后,放入40 ℃温水搅拌冷却5 min,蚕豆与面粉质量比为4∶1,种曲接种量0.5% (种曲质量占蚕豆与面粉总质量),先将种曲与面粉混合均匀,再装入三角瓶与蚕豆充分混合,8层纱布包扎,30 ℃培养,期间定时翻曲[17],分别对单菌株制曲过程中曲料变化进行监测[24]。
1.3.4.4 复合菌株共培养制曲
方法同1.3.4.3,蚕豆与面粉质量比为 4∶1,种曲接种量0.5%(种曲质量占蚕豆与面粉总质量),米曲霉、黑曲霉接种质量比为3∶1[18],对复合菌株制曲过程中曲料变化进行监测。
1.3.4.5 样品粗酶液的制备
称取5 g蚕豆曲于研钵中充分研磨,少量多次加入25 mL相应pH缓冲溶液,生理盐水定容至100 mL,40 ℃水浴提取1 h,每隔10 min搅动1次,离心取上清液,即得粗酶液[19]。
1.3.4.6 酶活力测定方法
蛋白酶活力:采用福林酚法[20],酶活力定义为:在40 ℃下每分钟水解酪蛋白产生1 μg酪氨酸,定义为1个蛋白酶活力单位。
淀粉酶活力:采用DNS法[21],酶活力定义为:在40 ℃下每分钟水解可溶性淀粉产生1 mg麦芽糖,定义为1个淀粉酶活力单位。
纤维素酶:采用DNS法[22],酶活定义为:在50 ℃下每小时水解底物CMC生成1 μmol葡萄糖所需酶量,定义为1个酶活单位。
氨肽酶:参照CHIEN等[23]的方法,在40 ℃下每分钟分解L-亮氨酸-对硝基苯胺产生1 μg对硝基苯胺所需酶量,定义为1个酶活单位。
1.3.5 数据处理
每组实验3个水平取平均值,利用Origin 8.0软件进行数据处理。
2 结果与分析
2.1 菌株的分离鉴定
2.1.1 菌株的分离与筛选
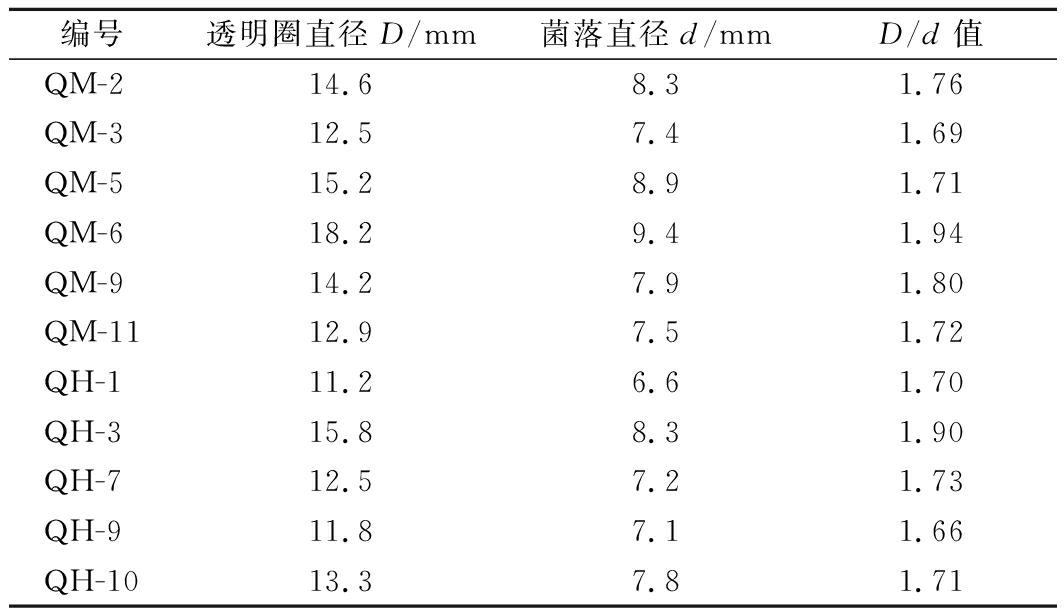
分离纯化得到23株霉菌,分别编号为QM-1~QM-12以及QH-1~QH-11,其中筛选到出现酪蛋白水解圈菌株分别有6株和5株,初步测定其HC值,结果如表1所示,选取D/d值较大的2株菌QM-6和QH-3用于后续实验。
表1 产蛋白酶菌株筛选
Table 1 Screening of protease producing strains
2.1.2 菌株的形态学特征
菌株QM-6在PDA培养基上30 ℃培养,菌落初始呈白色,24 h后开始长孢子,初为嫩绿色,后逐渐变为黄绿色,老后颜色变暗,背面无色;显微镜观察菌丝发达,有隔膜,分生孢子头呈放射状,顶囊近球形,如图1-A、图1-B所示,依据《真菌鉴定手册》将其初步鉴定为曲霉菌。
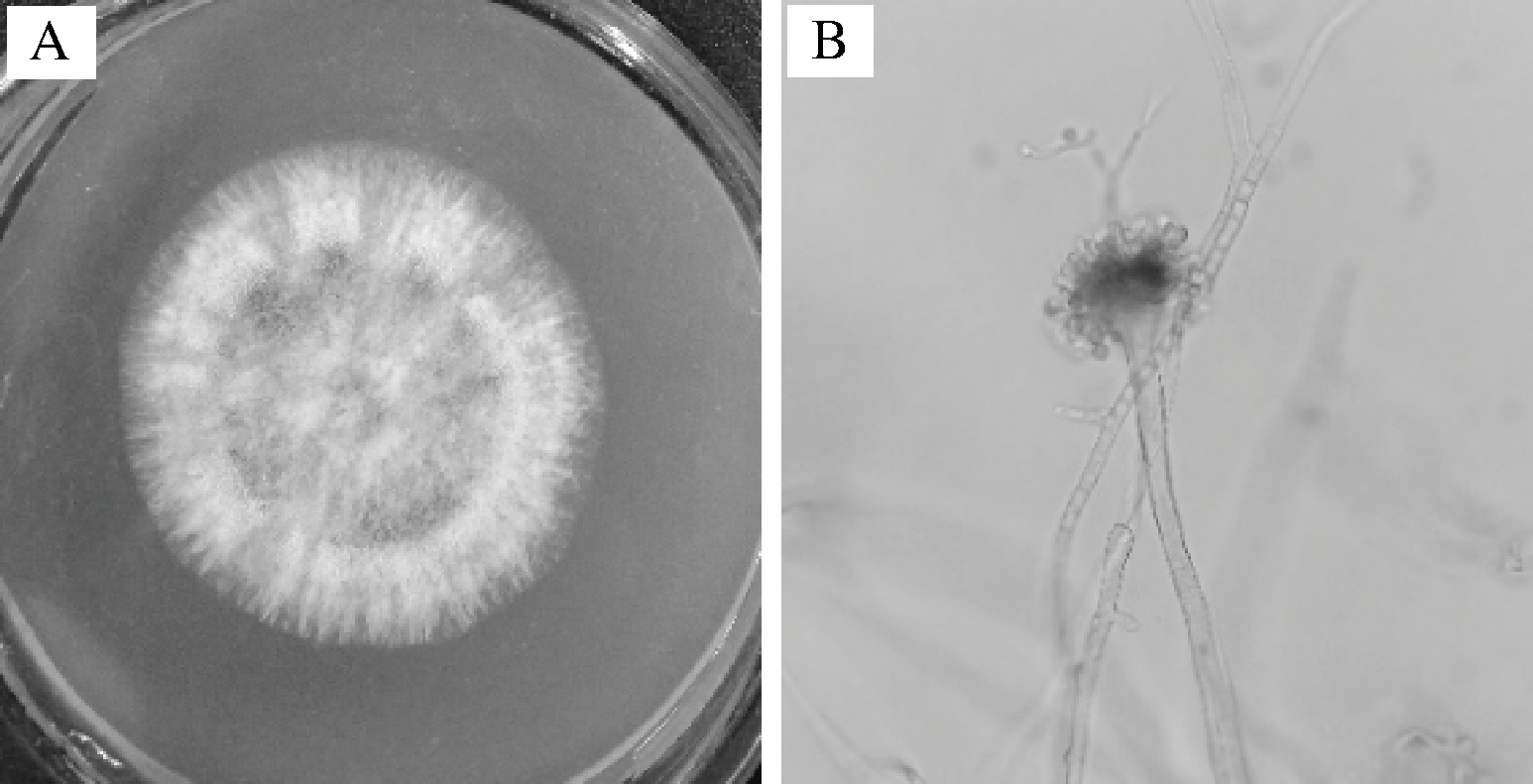
A-菌落形态; B-显微形态(×10)
图1 菌株QM-6的菌落形态和显微形态
Fig.1 Colony and microscopic morphology of strain QM-6
菌株QH-3菌落初始为白色,24 h后呈亮黄色,开始长黑色孢子,老熟后呈黑色厚绒状,背面无色。显微镜观察菌丝发达,有隔膜,囊内产生孢囊孢子,顶囊近球形,如图2-A、图2-B所示,依据《真菌鉴定手册》将其初步鉴定为曲霉菌。

A-菌落形态; B-显微形态(×10)
图2 菌株QH-3的菌落形态和显微形态
Fig.2 Colony and microscopic morphology of strain QH-3
2.1.3 分子鉴定与系统发育树构建
为了明确菌株QM-6、QH-3的分类学地位和系统发育关系,对其进行ITS序列分析,并利用MEGA 7.0软件构建系统发育树。菌株QM-6、QH-3基因组DNA的ITS序列扩增电泳图如图3-A和图3-B所示,PCR产物条带明亮清晰,条带长度约为600 bp。

A-菌株QM-6; B-菌株QH-3
图3 PCR扩增产物琼脂糖凝胶电泳图
Fig.3 Agarose gel electrophoresis of PCR amplification products
将测序结果与NCBI数据库BLAST进行比对,利用MEGA 7.0软件和Neighbor-Joining法对同源性较高的模式菌株进行系统发育分析,结果如图4。
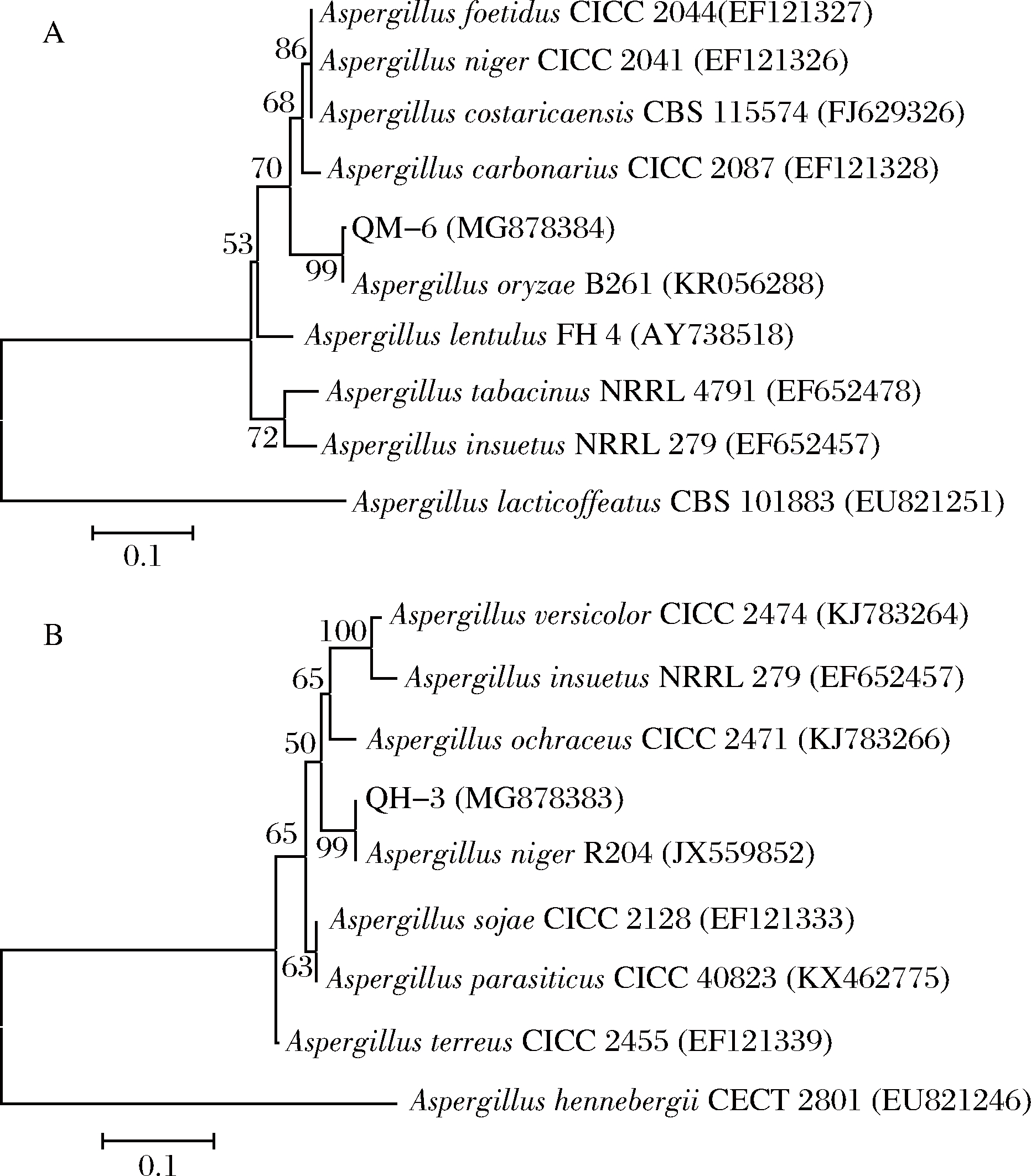
A-菌株QM-6; B-菌株QH-3
图4 菌株QM-6、QH-3基于ITS序列的系统发育树
Fig.4 Phylogenetic trees of strain QM-6 and QH-3 based on ITS gene sequence
由系统发育分析可知,菌株QM-6与Aspergillus oryzae B261同源性达99% (图4-A),菌株QH-3与Aspergillus niger R204同源性达99% (图4-B),结合菌株的形态学特征,将2株菌分别鉴定命名为米曲霉QM-6和黑曲霉QH-3。
2.2 制曲过程的变化
单一菌株和复合菌株共培养制曲过程中蚕豆曲的变化结果见表2。由表2可以看出,单一米曲霉制曲,米曲霉生长较慢,第2天开始长孢子,成曲曲芯颜色较淡,曲香较浓,无不良气味,曲料第6天开始变软;单一黑曲霉制曲,黑曲霉生长较快,第1天开始长黑色孢子,成曲曲芯颜色较淡,曲香较单一,曲料第4天开始变软;而米曲霉QM-6和黑曲霉QH-3共培养复合制曲生长较快,第1天曲芯已经变红,成曲曲芯颜色较深,曲香浓郁,无不良气味,曲料第6天开始变软。米曲霉QM-6和黑曲霉QH-3共培养制曲较单一米曲霉制曲原料利用率高、周期短,制曲第5天,成曲曲香浓郁,品质优良。结果表明,米曲霉QM-6和黑曲霉QH-3共培养复合制曲能有效改善成曲风味。
2.3 单菌株及复合菌株制曲过程中酶活变化
2.3.1 蛋白酶活力变化
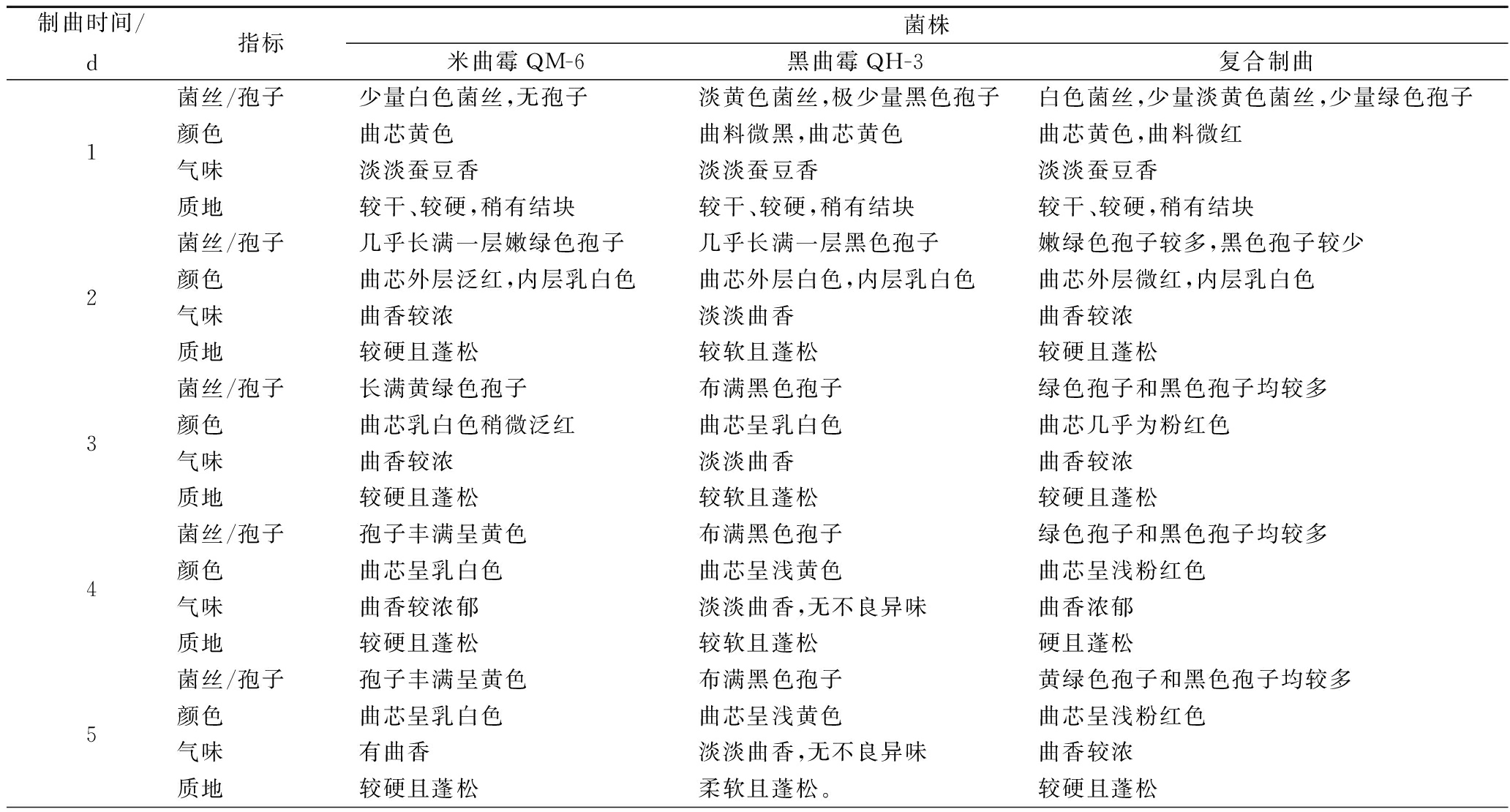
制曲时间直接影响微生物产酶活力以及对原料的利用率,制曲时间过短,霉菌菌丝不能完全深入到基质,导致微生物对原料的利用率降低且酶活力不高;制曲时间过长,容易感染杂菌,且孢子大量生长不利于微生物对原料的利用[24]。单菌株及复合菌株制曲产蛋白酶(酸性蛋白酶、中性蛋白酶和碱性蛋白酶)活力随时间变化如图5A~C所示。在制曲第1天,处于孢子萌发期,菌丝大量生长,单菌和复合菌制曲蛋白酶活力均较低;第2天开始,孢子大量生长,蛋白酶活力逐渐增大。
表2 制曲过程曲料的感官变化
Table 2 Sensory changes during the process of koji making
续表2

A-酸性蛋白酶; B-中性蛋白酶; C-碱性蛋白酶
图5 制曲过程蛋白酶活性变化
Fig.5 Changes of protease activity during koji making process
单一黑曲霉QH-3产酸性蛋白酶活力增长较快,第6天酶活力达最大值1 233 U/g;单一米曲霉QM-6产酸性蛋白酶活力增长缓慢且酶活力较低,第3天酶活力最高为277 U/g;米曲霉QM-6和黑曲霉QH-3共培养复合制曲酶活力在第5天达最大值为513 U/g,比单一米曲霉制曲酶活力高。
单一黑曲霉QH-3制曲前3 d几乎不产中性蛋白酶,第4天中性蛋白酶活力开始增加,第6天开始趋于平稳,酶活力最高为400 U/g;单一米曲霉QM-6制曲、米曲霉QM-6和黑曲霉QH-3共培养复合制曲初期产中性蛋白酶活力呈对数增长,单一米曲霉制曲第5天酶活力最高为1 397 U/g,之后产酶能力降低,复合制曲第5天酶活力最高为1 532 U/g,之后趋于平稳。
单一黑曲霉制曲前4 d产碱性蛋白酶活力较低,第4天开始酶活力缓慢增加,到第6天酶活力达最大值268 U/g;单一米曲霉制曲,产碱性蛋白酶活力增长较快,在第5天酶活力最高为1 090 U/g,之后酶活力降低并趋于平稳;米曲霉QM-6和黑曲霉QH-3共培养复合制曲,产碱性蛋白酶活力增长较快,在第6天酶活力最高为1 164 U/g,之后趋于平稳。
由于制曲过程中蛋白质被微生物利用,产生大量氨,使pH值保持在较高水平,而米曲霉产酸性蛋白酶最适pH值为5左右,较黑曲霉低[25],所以米曲霉单独制曲时产酸性蛋白酶活力较低,产中性和碱性蛋白酶活力较高,黑曲霉产酸性蛋白酶活力较高,产中性和碱性蛋白酶活力较低,而研究表明,发酵醪呈酸性条件下,酸性蛋白酶对于蛋白质降解至关重要[26]。李幼筠[27]在利用沪酿3.042米曲霉纯种制曲时,得到的酸性、中性和碱性蛋白酶活力分别仅为309.1、194.5和83.5 U/g,利用米曲霉QM-6和黑曲霉QH-3共培养制曲可以有效提高豆瓣成曲中蛋白酶活力,使各种蛋白酶活力更加均衡。
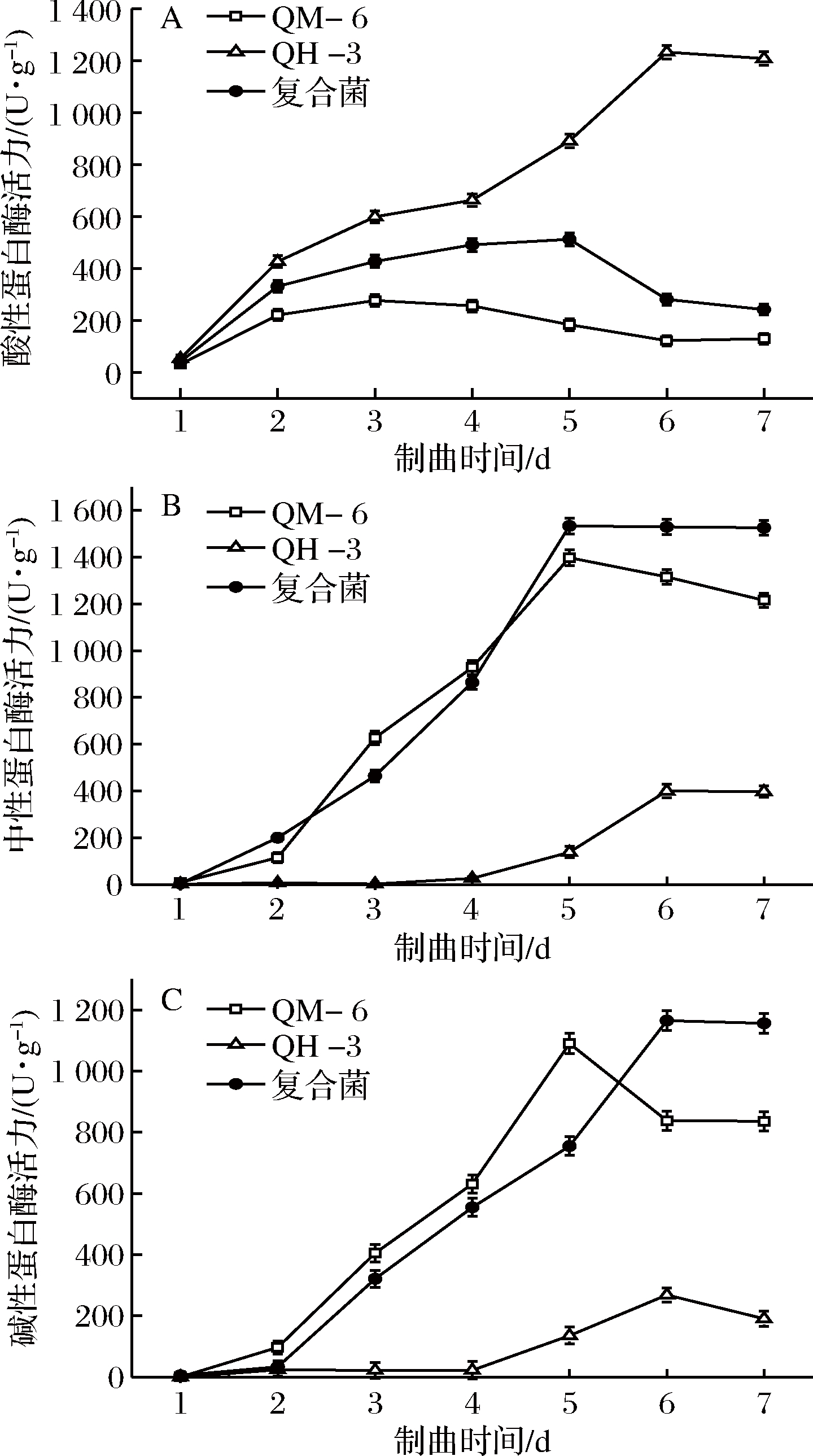
2.3.2 淀粉酶活力变化
淀粉酶可使原料中的淀粉糖化,为微生物生长提供碳源,并且在发酵阶段继续催化淀粉糖化形成甜味物质[28]。单一菌株及复合菌株制曲产淀粉酶活力随时间变化如图6所示,单一黑曲霉制曲,淀粉酶活力增长缓慢,第7天达最大值270 U/g,之后趋于平稳;单一米曲霉制曲,前7 d淀粉酶活力呈显著上升趋势,第7天达最大值1 026 U/g;米曲霉QM-6和黑曲霉QH-3共培养复合制曲比单一黑曲霉制曲淀粉酶活力高1倍,并在第8天达最大值574 U/g,之后趋于平稳。
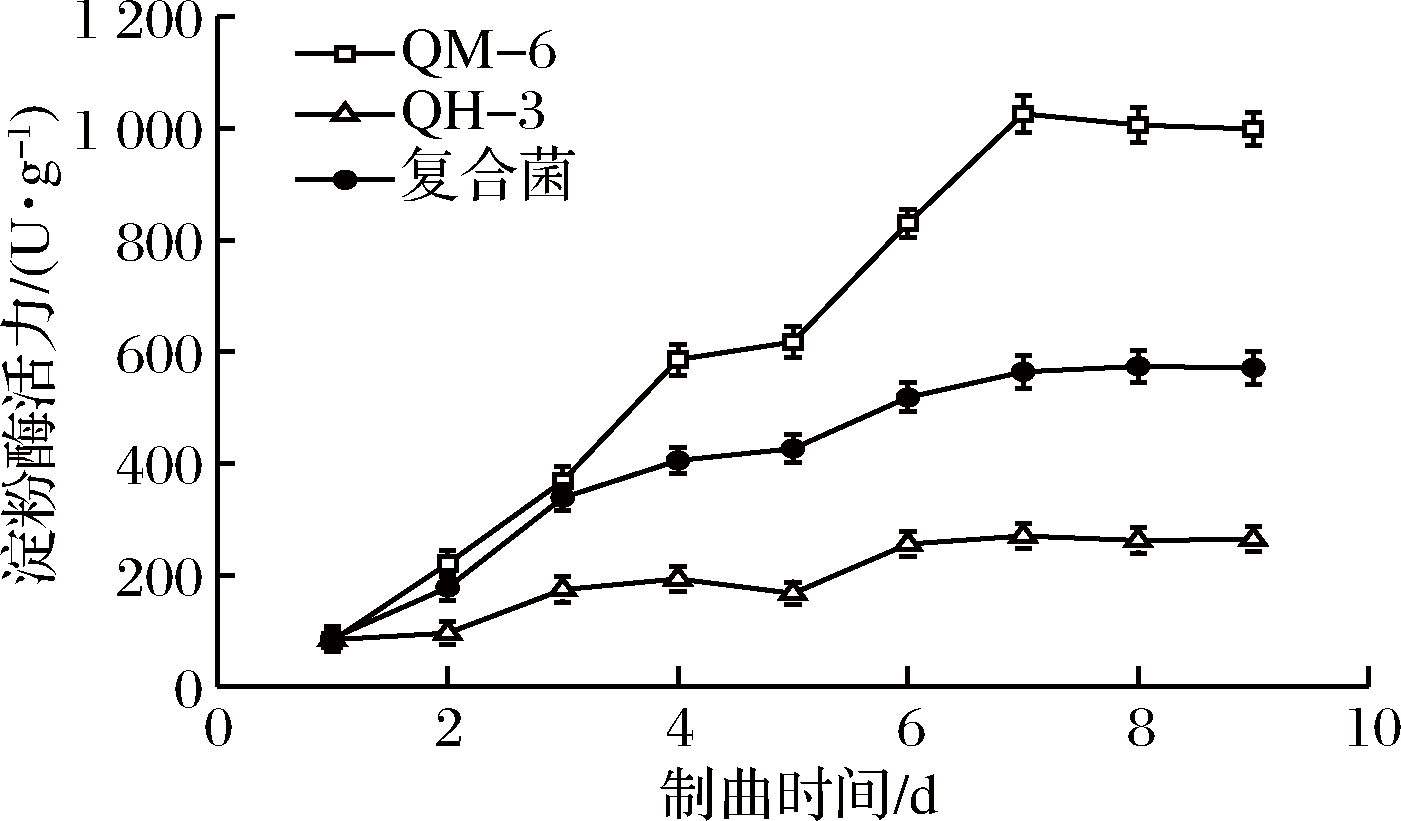
图6 制曲过程淀粉酶活性变化
Fig.6 Changes of amylase activity during koji making process
2.3.3 纤维素酶活力变化
蚕豆作为生产郫县豆瓣的主要原料,有纤维素外壳保护着,纤维素酶可以水解包在蛋白质和淀粉外的纤维素保护层,从而使物料中的有效成分被充分水解[29]。单一菌株及复合菌株制曲产纤维素酶活力随时间变化如图7所示。单一米曲霉制曲产纤维素酶活力增长缓慢,第4天达最大值50 U/g,之后趋于平稳;单一黑曲霉产纤维素酶活力能力比米曲霉强菌株强,在第6天酶活力最高为217 U/g,之后开始下降;米曲霉QM-6和黑曲霉QH-3共培养复合制曲比单一米曲霉制曲酶活力高,在第5天酶活力达最大值121 U/g,约是单一米曲霉制曲成曲纤维素酶活力的2.5倍,之后开始下降并趋于平稳。

图7 制曲过程CMC纤维素酶活性变化
Fig.7 Changes of cellulase (CMC) activity during koji making process
2.3.4 氨肽酶活力变化
蛋白酶水解蛋白质过程中可能产生苦味肽,氨肽酶可以从多肽链的N端水解氨基酸,使其变成游离的氨基酸,从而达到脱苦的目的[30]。单一菌株及复合菌株制曲产亮氨酸氨肽酶活力随时间变化如图8所示。单一菌株制曲和复合制曲产氨肽酶活力增长趋势大致相同,都是先上升后降低并趋于平稳。单一黑曲霉氨肽酶活力在第4天最高为64 U/g,单一米曲霉氨肽酶活力第5天最高为128 U/g,而米曲霉QM-6和黑曲霉QH-3共培养复合制曲产氨肽酶在第5天达最大值151 U/g,比单一菌株最大氨肽酶活力高。
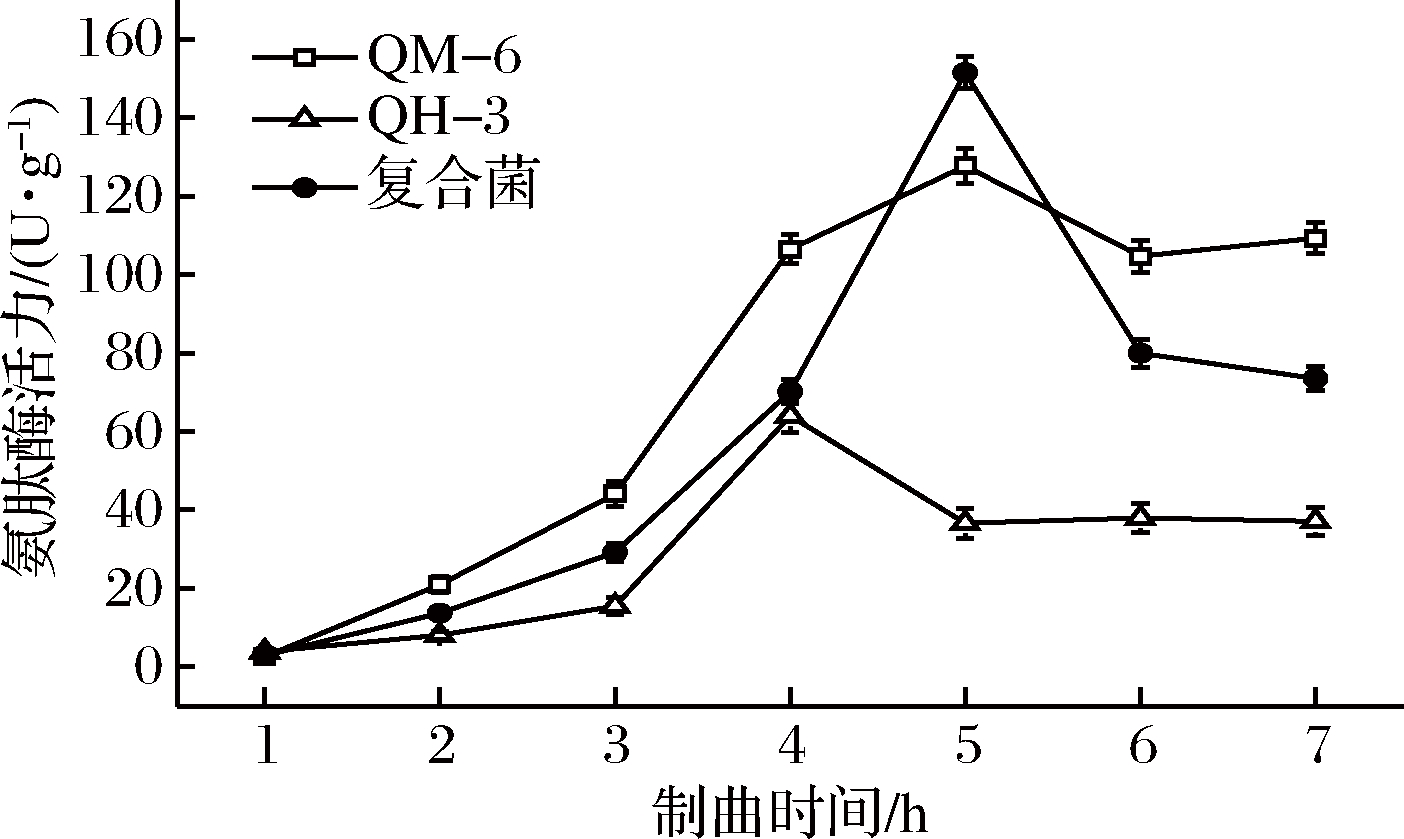
图8 制曲过程亮氨酸氨肽酶活性变化
Fig.8 Changes of Leucine aminopeptidase activity during koji making process
综合以上分析可知,单一米曲霉QM-6制曲产中性蛋白酶、碱性蛋白酶、淀粉酶和氨肽酶活力较高,产酸性蛋白酶和纤维素酶活力较弱;单一黑曲霉QH-3制曲产酸性蛋白酶和纤维素酶活力较高,产中性蛋白酶、碱性蛋白酶、淀粉酶和氨肽酶活力较低;米曲霉QM-6和黑曲霉QH-3共培养制曲产各种酶活力大小比较均衡,且都高于米曲霉或黑曲霉单独制曲,尤其是产中性蛋白酶、碱性蛋白酶和氨肽酶活力都高于米曲霉单独制曲,并且由于黑曲霉的协同作用,复合制曲产酸性蛋白酶和纤维素酶活力也较米曲霉单独制曲增大了约1倍,达到了酶系互补的明显效果。
3 结论
从传统酿造酱制品中分离鉴定得到高产蛋白酶米曲霉QM-6和黑曲霉QH-3,与单一接种米曲霉制曲相比,2株曲霉共培养能促进提高豆瓣曲中中性蛋白酶、酸性蛋白酶、碱性蛋白酶、纤维素酶以及氨肽酶的产生和酶活力,弥补米曲霉纯种制曲中主要酶活力不足的缺陷,使豆瓣曲酶系组成更优,且制备的郫县豆瓣成曲品质优良,风味浓郁。研究表明,米曲霉QM-6和黑曲霉QH-3共培养制曲在郫县豆瓣酿造中有很好的应用潜力。
参考文献
[1] 徐炜桢,赵红宇,杨懿,等.郫县豆瓣后发酵过程中细菌群落与呈香物质相关性研究[J]. 食品与发酵工业, 2018, 44(9): 22-28.
[2] 刘云珍,许喜林,刘永琪,等. 豆瓣酱制曲工艺条件优化[J]. 中国酿造, 2016, 35(11):108-111.
[3] HU H L, BRINK J V D, GRUBEN B S, et al. Improved enzyme production by co-cultivation of Aspergillus niger and Aspergillus oryzae and with other fungi[J]. International Biodeterioration & Biodegradation, 2011, 65(1):248-252.
[4] 林晓华,陈钢,王柳杨. 响应面法优化曲霉型豆豉的双菌种制曲工艺[J]. 食品科学, 2013, 34(3): 233-238.
[5] PENG M Y, LIU J Y, HUANG Y, et al. Effects of a mixed koji culture of Aspergillus oryzae HG-26 and Aspergillus niger HG-35 on the levels of enzymes, antioxidants and phenolic compounds in soy sauce during the fermentation process[J]. Food Science and Technology, 2017, 52(7): 1 585-1 593.
[6] 孟甜,黄韬睿,李玉锋. 响应面法优化郫县豆瓣制曲工艺[J]. 食品科学, 2014, 35(15): 193-197.
[7] 李峰,赵萍,周昌豹,等. 郫县豆瓣高酶活米曲霉选育鉴定及复合菌制曲改善酶系组成研究——郫县豆瓣复合菌制曲改善酶系组成研究[J]. 中国酿造, 2012, 31(12):30-32.
[8] VISHWANATHA K S, RAO A G A, SINGH S A. Characterisation of acid protease expressed from Aspergillus oryzae MTCC 5341[J]. Food Chemistry, 2009, 114(2):402-407.
[9] SOUZA P M, WERNECK G, ALIAKBARIAN B, et al. Production, purification and characterization of an aspartic protease from Aspergillus foetidus[J]. Food & Chemical Toxicology, 2017, 109:1 103-1 110.
[10] RAHARDJO Y S P, SIE S, WEBER F J, et al. Effect of low oxygen concentrations on growth and α-amylase production of Aspergillus oryzae in model solid-state fermentation systems[J]. Biomolecular Engineering, 2005, 21(6):163-172.
[11] 余培斌,陈亮亮,张波,等. 双菌种制曲改善黄酒麦曲品质的研究[J]. 食品与发酵工业, 2012, 38(9):1-6.
[12] 魏景超. 真菌鉴定手册[M]. 上海:科学技术出版社, 1979: 405-642.
[13] 陈静,郝伟伟,王春梅,等. 产β-葡萄糖苷酶真菌的筛选鉴定、纯化及酶学性质分析[J]. 食品科学, 2013, 34(5):191-196.
[14] 赵婷婷,卢倩文,宋菲菲,等. 1株产香真菌的筛选及其协同米根霉对米酒发酵的影响[J]. 食品科学, 2017, 38(14):42-48.
[15] 曾林,谭霄,张庆,等.生物转化γ-氨基丁酸酿酒酵母的筛选及其在桑葚酒酿造中的应用[J]. 食品与发酵工业, 2017, 44(6):122-128.
[16] DEY T B, BANERJEE R. Purification, biochemical characterization and application of α-amylase produced by Aspergillus oryzae, IFO-30103[J]. Biocatalysis & Agricultural Biotechnology, 2015, 4(1):83-90.
[17] 丁祖志. 原料预处理工艺对蚕豆酱品质的影响[D]. 无锡:江南大学, 2011.
[18] ZHAO J X, JIANG Q X, XU Y S, et al. Effect of mixed kojis on physiochemical and sensory properties of rapid-fermented fish sauce made with freshwater fish by-products[J]. Food Science and Technology, 2017, 52(9): 2 088-2 096.
[19] 张青,许学书,谢静莉,等. 米曲霉蛋白酶动力学特性的研究[J]. 食品科学, 2007, 28(6):213-217.
[20] BELMESSIKH A, BOUKHALFA H, MECHAKRA-MAZA A, et al. Statistical optimization of culture medium for neutral protease production by Aspergillus oryzae. Comparative study between solid and submerged fermentations on tomato pomace[J]. Journal of the Taiwan Institute of Chemical Engineers, 2013, 44(3): 377-385.
[21] MUSHTAQ Q, IRFAN M, TABSSUM F, et al. Potato peels: A potential food waste for amylase production[J]. Journal of Food Process Engineering, 2017, 40(4): 369-376.
[22] SHI C, WU Y, FANG D, et al. Effect of nanocomposite packaging on postharvest senescence of Flammulina velutipes[J]. Food Chemistry, 2017, 246:414-421.
[23] CHIEN H C, LIN L L, CHAO S H, et al. Purification, characterization, and genetic analysis of a leucine aminopeptidase from Aspergillus sojae[J]. Biochimica et Biophysica Acta (BBA) - Gene Structure and Expression, 2002, 1 576(1-2): 119-126.
[24] SAHNOUN M, KRIAA M, ELGHARBI F, et al. Aspergillus oryzae S2 alpha-amylase production under solid state fermentation: optimization of culture conditions[J]. International Journal of Biological Macromolecules, 2015, 75:73-80.
[25] 赵强强. 酱油制曲及螺旋藻酱油生产工艺的研究[D]. 青岛:中国海洋大学, 2012.
[26] XU D, PAN L, ZHAO H, et al. Breeding and identification of novel koji molds with high activity of acid protease by genome recombination between Aspergillus oryzae and Aspergillus niger[J]. Journal of Industrial Miorobiology & Biotechnology, 2011, 38(9):1 255-1 265.
[27] 李幼筠. “郫县豆瓣”剖析[J]. 中国酿造, 2008, 27(6):19-23.
[28] 何胜华,罗聪,李海梅,等. 米曲霉KFRI 888产中性蛋白酶、α-淀粉酶酶学性质的研究[J]. 食品工业科技, 2006, 27(9):49-50.
[29] 张艳芳. 多菌株制曲促进酶系优化与提高酱油质量的研究[D]. 无锡:江南大学, 2009.
[30] KIM K M, LIM J, LEE J J, et al. Characterization of Aspergillus sojae isolated from meju, Korean traditional fermented soybean bricks[J]. Journal of Microbiology & Biotechnology, 2016, 27(2):251-261.