5-羟甲基糠醛(5-hydroxymethylfurfural,HMF)是食品中的一种内源污染物,低浓度的HMF具有抗氧化、抗心肌缺血的作用[1];但高浓度的HMF具有细胞毒性[2]、遗传毒性[3]和致癌性[4],对眼睛、黏膜和皮肤都有刺激作用[5]。除此之外,HMF容易氧化形成致癌物羟甲基糠酰磺酸盐(5-sulfoxymethyfurfural,SMF)[6],HOIE课题组[7]证明了,HMF通过转变为SMF对人体产生危害,DE LA CUEVA[8]等证明了HMF能够在人体内转化成SMF,后者与DNA形成加合物,具有致癌活性。
HMF的形成与碳水化合物含量丰富食品的热加工过程密切相关[9],其主要产生途径有以下2种:一是果糖或葡萄糖在高温条件下,烯醇化、脱水、环化生成HMF[10],其中3-脱氧奥苏糖和不饱和奥苏糖是2种重要的前体物质[11-12];二是蔗糖或果糖裂解成果糖呋喃阳离子,它是HMF的直接前体物质[13],能够在高温干燥的条件下快速转化为HMF[14],是比3-脱氧奥苏糖更高效的形成途径[15]。HMF在食品热加工中还受到pH[16]、水分活度、糖的种类[17]和二价阳离子[18]的影响。
我们的前期研究发现,食品中形成的HMF可与氨基酸结合形成氨基酸-HMF加合物[19],从而降低食品中HMF含量。食物在胃肠道消化过程中,蛋白质会水解成氨基酸,pH也发生变化。但对HMF含量高的食物在消化过程中HMF的变化规律缺少研究。本研究选用4种市面上常见的热加工食品作研究对象(咖啡、饼干、薯片、方便面),探讨4种食品经过模拟胃肠道消化前后的HMF变化规律,以期为HMF的风险评估提供依据。
1 实验材料与设备
1.1 材料与试剂
康师傅油炸方便面(香菇炖鸡),康师傅控股有限公司;乐事薯片(原味),乐事薯片公司;太平梳打饼干(奶盐味),亿滋食品有限公司;雀巢咖啡(原味),雀巢中国有限公司。
胃蛋白酶(猪源,15 000 u/g)、唾液淀粉酶(1 500 u/g),上海阿拉丁生化科技股份有限公司;胰酶(4 000 u/g),合肥博美生物科技有限责任公司。
1.2 仪器与设备
LC-20AT高效液相色谱仪(配备SPD-M20A光电二极管阵列检测器),日本岛津公司;Zorbax SB-Aq C18(4.6 mm×250 mm,5 μm),安捷伦仪器有限公司;紫外分光光度计UV-900,北京瑞利分析仪器公司。
2 实验方法
2.1 系列模拟消化液配备
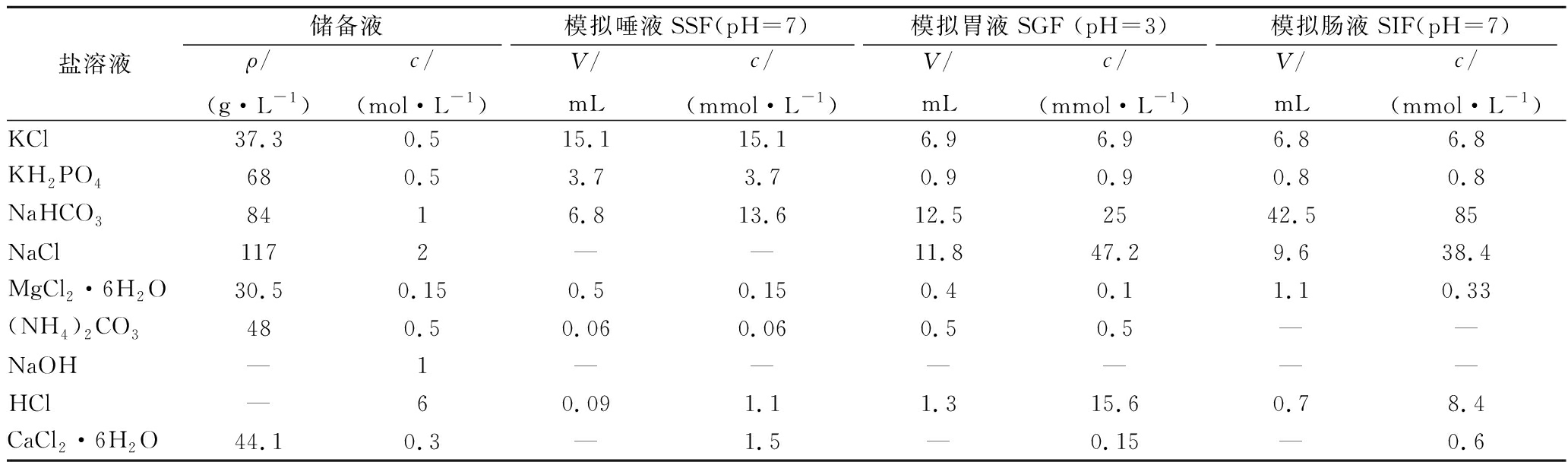
按MINEKUS[20]等的方法配制模拟唾液(simulated salivary fluid,SSF)并进行模拟消化试验,模拟胃液(simulated gastric fluid,SGF)和模拟肠液(simulated intestinal fluid,SIF),具体配方见表1。
表1 不同模拟消化液储备液的配制
Table 1 Preparation of stock solutions for simulated digestion fluids
2.2 体外模拟消化过程
(1)模拟口腔消化
取5 g供试食品研磨成粉末放入锥形瓶中,加入3.5 mL的模拟唾液、25 μL的CaCl2储备液、975 μL水和0.5 mL 1 500 U唾液淀粉酶液,混合均匀后于37 ℃恒温振荡器上消化水解2 min,以模拟口腔咀嚼消化过程。
(2)模拟胃部消化
将模拟口腔消化产物中加入7.5 mL的模拟胃液、5 μL的CaCl2储备液、695 μL的水和1.6 mL 25 000 U的胃蛋白酶液,用0.2 mL的1 mol/L HCl调节消化体系的pH值至3,混合均匀后于37 ℃恒温振荡器上消化2 h,模拟胃部消化过程。
(3)模拟肠道消化
于模拟胃部消化产物中加入16 mL的模拟肠液、40 μL的CaCl2储备液、860 μL的水、2.5 mL胆盐和1 g胰酶,用0.6 mL的1 mol/L NaOH调节消化体系的pH值至7,混合均匀后于37 ℃恒温振荡器上消化2 h,模拟肠部消化过程。
每个食品重复3次。每段模拟消化后取样,采用HPLC法测定HMF含量。色谱分析条件:色谱柱为ZORBAX SB-Aq(4.6 mm×250 mm,5 μm),检测波长284 nm,流动相为去离子水,柱温40 ℃,流速0.6 mL/min,进样量10 μL。
2.3 4种食品消化后的氨基酸分析
氨基酸总量采用茚三酮显色法进行测定,游离氨基酸采用氨基酸自动分析仪进行测定。
2.3.1 食品模拟消化物中氨基酸总量测定
分别取饼干、咖啡、方便面、薯片胃消化产物和肠消化产物2 mL于离心管中,加入等体积水稀释,然后加入4 mL石油醚混合摇匀,静置沉降15 min后以3 000 r/min离心15 min,去除有机层(脱脂),测定水相中氨基酸含量。
取上述处理后样品液0.5 mL于比色管中加水定容至5 mL,从中取出0.5 mL液体与0.5 mL柠檬酸-磷酸缓冲液和1 mL茚三酮溶液均匀混合,置于沸水浴15 min后取出,冷却至室温后于分光光度计测定吸光值(波长570 nm)。以亮氨酸作为标准氨基酸,绘制标准曲线,计算样品中氨基酸总量。
2.3.2 食品消化物中游离氨基酸含量的测定
在国标GB/T 5009.124—2003《食品中氨基酸的测定方法》[21]基础上调整方法测定饼干、咖啡、方便面和薯片胃肠道消化产物中游离氨基酸含量。主要分为以下4个步骤:定容→脱脂→沉淀蛋白质→衍生→上机检测。
取4种食品的模拟胃肠消化产物2 mL,加入等体积水,旋涡混合。加入等体积石油醚旋涡萃取,静置30 min后离心(4 000 r/min,15 min)除去脂肪。取水相2 mL于试管中,加入2 mL三氯乙酸,静置1 h后离心(4 000 r/min,15 min),除去蛋白质。取上清液,过0.45 μm滤膜。
准确吸取0.200 ml混合氨基酸标准液,用pH 2.2的缓冲液稀释至5 mL,此标准稀释液浓度为5.00 nmol/50 μL,作为上机测定用的氨基酸标准,采用氨基酸自动分析仪测定氨基酸含量。其检测条件为:进样量20 μL;离子交换柱磺酸型阳离子树脂(4.6 mm ×60 mm, 3 μm);柱温57 ℃;分离缓冲液流速0.4 mL/min;反应温度135 ℃;茚三酮反应液流速0.35 mL/min;检测波长440 nm和570 nm。
3 结果与分析
3.1 4种食品在模拟消化条件下HMF的变化
4种食品经过体外模拟消化后的HMF含量见表2。
表2 饼干、咖啡、薯片、方便面胃肠道消化产物HMF含量变化
Table 2 Changes in the amount of HMF in the simulated digests of biscuits, coffee, chips and instant noodle
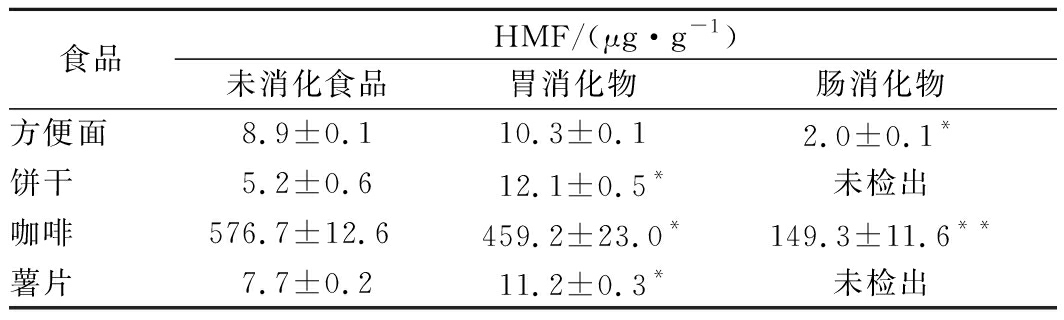
注:*和**表示与未消化食品相比,HMF含量分别在5%和1%水平上存在差异。
由表2可知,方便面、饼干和薯片中HMF含量相近而咖啡中含量很高。经过模拟胃消化后,方便面、薯片及饼干中的HMF含量均升高,分别增加15.5%,44.9%和135%,但咖啡消化后HMF却下降。
模拟肠消化后,4种食品的HMF含量均大幅下降,方便面和咖啡的HMF残留量分别下降78.4%和74.1%,饼干和薯片中HMF的残留量低于检测限。由此可见,在胃消化过程中被释放的HMF于肠消化环境中被大量消除,消除机理可能是食品中的蛋白质酶解出大量的游离氨基酸,氨基酸与食品里面的5-HMF反应重新形成加合物[19]。
3.2 4种食品消化产物中HMF的可能消减机理
HAMZALIOGLU和GOKMEN[22]认为,食品高温加工过程中产生的HMF前体物质3-脱氧奥苏糖(3-DG)和不饱和奥苏糖(3,4-DG)累积在食品当中,在胃环境下3-DG和3,4-DG能够转化为HMF,从而使HMF含量增加。但这很难解释咖啡中出现的相反现象。我们推测速溶咖啡中半胱氨酸含量较高,HMF在酸性条件下会形成加合物[23],从而降低HMF含量。
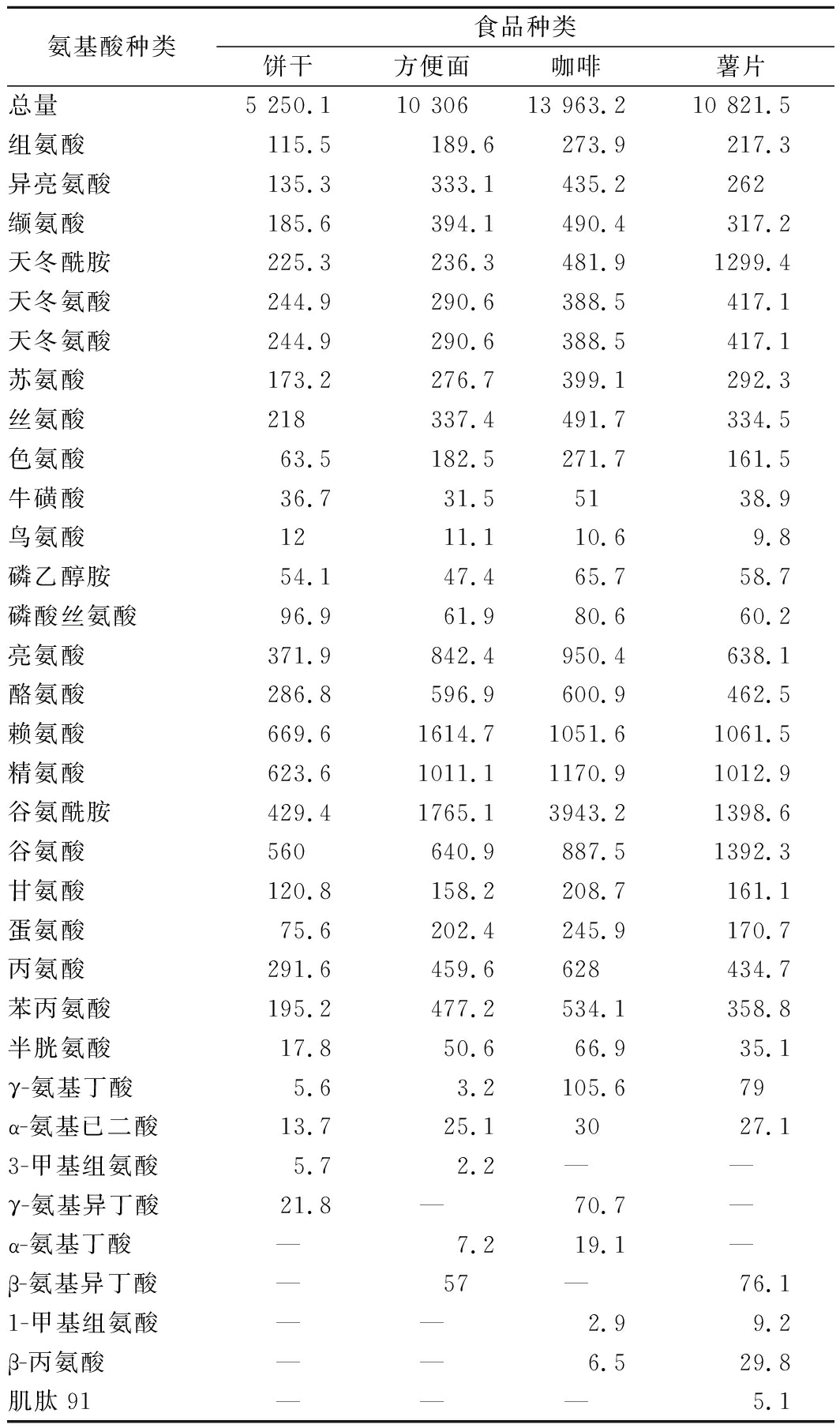
为了验证上述推测,我们测定了模拟胃肠消化后游离氨基酸含量(表3)。结果表明,被试食品的氨基酸总量均有大幅度增长,由多及少顺序依次为咖啡>薯片>方便面>饼干。半胱氨酸对HMF的消除能力最强[19],表3结果表明,释放的半胱氨酸含量顺序依次为咖啡>方便面>薯片>饼干,而表2中HMF增加量顺序依次为饼干>薯片>方便面,咖啡中的HMF含量下降,说明蛋白质中释放的半胱氨酸在HMF的消减中起重要作用。
基于我们的近期研究[23],加合物的形成会降低HMF对细胞的毒性。因此,在摄食HMF含量高的食品的同时,适量摄入蛋白质可消除HMF的危害。
表3 饼干、咖啡、薯片、方便面模拟胃肠消化产物氨基酸含量 单位:μg/mL
Table 3 Amount and numbers of amino acids in biscuits,coffee, chips and instant noodles after simulated gastrointestinal digestion
4 结论
除咖啡外,相比食品原样,方便面、薯片和饼干经模拟胃消化后HMF的含量均增加,推测食品中HMF加合物在胃的低pH环境下被释放HMF。经过模拟肠消化后,所有食品中HMF的含量大幅降低,主要是因为HMF与食品蛋白质水解后的游离氨基酸结合形成氨基酸-HMF加合物,其中半胱氨酸可能起重要作用。加合物的细胞毒性大大低于HMF,因此摄入足够量的蛋白质可缓解HMF的危害。
参考文献
[1] 裴珂晗, 欧仕益. 食品中5-羟甲基糠醛的形成与控制[J]. 食品安全质量检测学报, 2016, 7(1):251-256.
[2] QIN Lei, ZHANG Yuying, XU Xianbing, et al.Isotope dilution HPLC-MS/MS for simultaneous quantification of acrylamide and 5-hydroxymethylfurfural (HMF) in thermally processed seafood[J]. Food Chemistry, 2017, 232:633-638.
[3] BRUCE W R, ARCHER M C, CORPET D E, et al. Diet, aberrant crypt foci and colorectal-cancer[J]. Mutation Research, 1993, 290(1):111-118.
[4] ABRAHAM K, GUERTLER R, BERG K. Toxicology and risk assessment of 5-Hydroxymethylfurfural in food[J]. Molecular Nutrition & Food Research, 2011, 55(5):667-678.
[5] 张玉玉,宋弋,李全宏. 食品中糠醛和5-羟甲基糠醛的产生机理、含量检测及安全性评价研究进展[J]. 食品科学, 2012, 33(5):275-280.
[6] CAPUANO E, FOGLIANO V. Acrylamide and 5-hydroxymethylfurfural (HMF): A review on metabolism, toxicity, occurrence in food and mitigation strategies[J]. LWT-Food Science and Technology, 2011,44(45):793-810.
[7] HOIE A H, SVENDSEN C, BRUNBORG G, et al. Genotoxicity of three food processing contaminants in transgenic mice expressing human sulfotransferases 1A1 and 1A2 as assessed by the in vivo alkaline single cell gel electrophoresis assay [J]. Environmental & Molecular Mutagenesis, 2015, 56(8):709-714.
[8] DE LA CUEVA S, ALVAREZ J, VEGVARI A, et al. Relationship between HMF intake and SMF formation in vivo: An animal and human study [J]. Molecular Nutrition & Food Research, 2017, 61(3):DOI:10.1002-mnfr.201600773.
[9] WANG JIN-YUAN, SCHNUTE W C. Simultaneous quantitation of 2-acetyl-4-tetrahydroxybutylimidazole, 2-and 4-methylimidazoles, and 5-hydroxymethylfurfural in beverages by ultrahigh-performance liquid chromatography-tandem mass spectrometry[J]. Journal of Agricultural & Food Chemistry, 2012,60(4):917.
[10] KOWALSKI S, LUKASIEWICZ M, DUDACHODAK A. 5-Hydroxymethyl-2-furfural (HMF) heat-Induced formation, occurrence in food and biotransformation: A review[J]. Polish Journal of Food Nutrition Sciences, 2013, 63(4): 207-225.
[11] CAPUANO E, FOGLIANO V. Acrylamide and 5-hydroxymethylfurfural (HMF): A review on metabolism, toxicity, occurrence in food and mitigation strategies[J]. LWT-Food Science and Technology, 2011,44(4):793-810.
[12] KOCADAGLI T, GOKMEN V. Effect of sodium chloride on α-dicarbonyl compound and 5-hydroxymethyl-2-furfural formations from glucose under caramelization conditions: A multiresponse kinetic modeling approach[J]. Journal of Agricultural and Food Chemistry, 2016, 64(32):6 333-6 342.
[13] LOCAS C P, YAYLAYAN V A. Isotope labeling studies on the formation of 5-(hydroxymethyl)-2-furaldehyde (HMF) from sucrose by pyrolysis-GC/MS[J]. Journal of Agricultural and Food Chemistry, 2008, 56(15):6 717-6 723.
[14] ANESE M, SUMAN M. Mitigation strategies of furan and 5-hydroxymethylfurfural in food[J]. Food Research International, 2013, 51(1): 257-264.
[15] 温超,王紫梦,石星波,等. 食品中丙烯酰胺与5-羟甲基糠醛的研究进展[J]. 食品科学, 2015, 36(13):257-264.
[16] GOKMEN V, SENYUVA H Z. Improved method for the determination of hydroxymethylfurfural in baby foods using liquid chromatography-mass spectrometry[J]. Journal of Agricultural and Food Chemistry, 2006, 56(8):2 845-2 849.
[17] GOKMEN V, ACAR O C, KOKSEL H, et al. Effects of dough formula and baking conditions on acrylamide and hydroxymethylfurfural formation in cookies[J]. Food Chemistry, 2007, 104(3):1 136-1 142.
[18] WEN Chao, SHI Xingbo, WANG Zimeng, et al. Effects of metal ions on formation of acrylamide and 5-hydroxymethylfurfural in asparagine-glucose model system [J]. International Journal of Food Science & Technology, 2015, 51(2):279-285.
[19] ZOU Yueyu, PEI Kehan, PENG Xichun, et al. Possible adducts formed between hydroxymethylfurfural and selected amino acids, and their release in simulated gastric model[J]. International Journal of Food Science and Technology, 2016, 51(4):1 002-1 009.
[20] MINEKUS M, ALMINGER M, ALVITO P, et al. A standardised static in vitro digestion method suitable for food-an international consensus [J]. Food & Function, 2014, 5(6): 1 113-1 124.
[21] 中华人民共和国卫生部GB/T5009.124—2003. 食品中氨基酸的测定[S]. 北京:中国标准出版社,2004.
[22] HAMZALIOGLU A, GOKMEN V. Formation and elimination reactions of 5-hydroxymethylfurfural during in vitro digestion of biscuits[J]. Food Research International, 2017, 99:308-314.
[23] ZHAO Qianzhu, ZOU Yueyu, HUANG Caihuan, et al. Formation of a hydroxymethylfurfural-cysteine adduct and its absorption and cytotoxicity in caco-2 Cells[J]. Journal of Agricultural and Food Chemistry, 2017,65(45):9 903-9 909.