离子束重组异常汉逊酵母菌Ar_Han0458的转录组学分析 及谷胱甘肽代谢途径富集
张寒玉1,唐朝1,冯光文1,毛培宏1*,蔡长龙2*
1(新疆大学 物理科学与技术学院,放射生态与离子束生物技术中心,新疆 乌鲁木齐,830046) 2(西安工业大学,离子束生物工程与生物多样性研究中心,陕西 西安,710032)
摘 要 研究可稳定遗传的重组异常汉逊酵母Ar_Han0458在发酵过程中的差异基因表达信息及与谷胱甘肽代谢相关基因的表达变化。利用生物信息学方法分析重组异常汉逊酵母Ar_Han0458的5个发酵时间点的RNA-seq数据。重组异常汉逊酵母Ar_Han0458各发酵时间与0 h相比,下调表达基因数量多于上调表达;除发酵96和72 h外,相邻时间点的差异表达基因数目均以下调为主;发酵48和72 h时的基因表达谱相近。各发酵时间点间差异表达基因显著富集的GO功能均以细胞过程、细胞和催化活性为主。KEGG富集分析显示,10个差异表达基因参与了谷胱甘肽的代谢,谷胱甘肽的合成速率分别在24和96 h达到峰值,与实验测得胞外GSH产量变化趋势一致。重组异常汉逊酵母Ar_Han0458在发酵96 h时差异表达基因数目以上调为主,且谷胱甘肽合成速率最快。该研究为重组异常汉逊酵母的代谢调控研究及其分子育种提供了理论依据。
关键词 重组异常汉逊酵母菌;转录组;差异表达基因;谷胱甘肽;代谢
第一作者:硕士研究生(毛培宏研究员和蔡长龙教授为共同通信作者,E-mail:phmao@china.com,changlongcai@126.com)。
基金项目:国家自然科学基金项目(11575149;31760016)
收稿日期:2019-01-10,改回日期:2019-02-25
DOI:10.13995/j.cnki.11-1802/ts.019909
低能离子注入介导外源DNA的遗传转化技术和方法是目前远缘、超远缘物种间遗传物质交流的重要手段和方法之一[1],毛培宏等人利用低能离子注入介导外源DNA转化异常汉逊酵母菌As2340,获得了遗传稳定的产生物碱的重组异常汉逊酵母菌Ar_Han0458[2-4]。
异常汉逊酵母菌具有较强的产酯生香能力,不仅作为外源基因的受体菌,还是微生物发酵生产谷胱甘肽(glutathione,GSH)的常用菌种之一。GSH作为细胞重要的氧化还原缓冲剂,具有解毒、抗氧化、维持机体氧化平衡、调节细胞增生等重要生理作用,少量的胞内GSH即可保持细胞活力[5-8]。
本研究基于转录组(RNA-Seq)测序技术,以期获得重组异常汉逊酵母菌Ar_Han0458不同发酵时期的转录本信息,通过构建其转录组数据库、分析其差异基因表达信息,筛选与GSH代谢相关的基因,为人们深入认识GSH的代谢途径及其调控机制提供依据。
1 材料与方法
1.1 菌株
重组异常汉逊酵母Ar_Han0458 (Hansenula anomala Ar_Han0458)[2-3],来源于低能氩离子注入介导外源DNA随机转化异常汉逊酵母As2340 (Hansenula anomala As2340)获得的遗传稳定的产生物碱的重组酵母菌。
1.2 培养基
YPD斜面培养基[9]:酵母膏10 g,蛋白胨20 g,葡萄糖20 g,琼脂粉10 g,蒸馏水1 000 mL。
液体培养基:葡萄糖·H2O 100 g,NaNO3 10 g,酵母膏粉 5 g,K2HPO4·3H2O 1 g,MgSO4·7H2O 0.5 g,蒸馏水1 000 mL,用质量浓度100 g/L的NaOH调pH至7.0。
1.3 方法
将YPD斜面培养基上培养48 h的新鲜重组异常汉逊酵母Ar_Han0458菌种接种至液体培养基中,置摇床230 r/min、28~30 ℃发酵96 h。每间隔24 h取样(含0 h),于4 ℃、8 000× g离心5 min,充分弃上清,迅速将菌体置于液氮速冻保存。本研究设置3个生物学重复,每个生物学重复的0、24、48、72、96 h的样品均设置6个技术重复。
分别制备各发酵时间点菌体样本的mRNA,并应用Illumina进行RNA-seq测序,每个样本的测序数据量5G。将获得的每个样本的转录组文库经过CASAVA碱基识别分析转化为raw data (原始测序序列),再经过去除接头和过滤低质量reads处理,所获得的RNA序列(clean data),作为本研究的基本数据。同时,制备重组异常汉逊酵母Ar_Han0458基因组DNA,并应用PacBio单分子测序技术进行全基因组De novo测序,所获得的全基因组DNA序列[10],作为RNA-seq的参考基因组。
根据RNA-seq规程[11],选取HISAT2方法[12]和HTSeq方法[13]分别作为重组异常汉逊酵母菌Ar_Han0458不同发酵时间点差异表达基因的表达量的比对分析方法和FPKM (fragments per kilobase of transcript per million fragments mapped)定量方法。
酵母菌胞外GSH测定样本的制备及操作步骤参考文献[14]和[15]的方法,GSH的DTNB检测方法参考文献[16]。
本研究应用HTSeq方法对差异表达基因的表达量进行FPKM定量和count定量,对表达基因通过BLAST2GO[17]和KAAS(KEGG automatic annotation server)[18]分别比对到GO(gene orthology)数据库和KEGG(kyoto encyclopedia of genes and genomes)数据库,利用DESeq2方法[19]对定量结果进行差异表达分析并获得差异表达基因列表,再通过GOSeq方法[20]采取超几何分布样本抽取方法进行差异表达的基因功能的GO富集和KEGG代谢通路(KEGG pathway)富集。筛选与谷胱甘肽代谢的相关基因,对其表达量进行预测,并测定GSH含量进行验证。
2 结果与分析
2.1 RNA-seq数据质量控制及序列比对
应用FASTQC[21]方法对RNA-seq获得的clean reads进行统计,结果显示15个转录组样本中Q30(0.1%碱基识别错误率)最小的样本值为89.21%,Q20(1%碱基识别错误率)最小的样本值为95.45%,表明转录组测序数据质量较高,可满足后续分析要求(表1)。
表1 重组酵母菌Ar_Han0458转录组样本测序质量及匹配率
Table 1 The quality and mapping identity of RNA-Seq of recombinant yeast Ar_Han0458
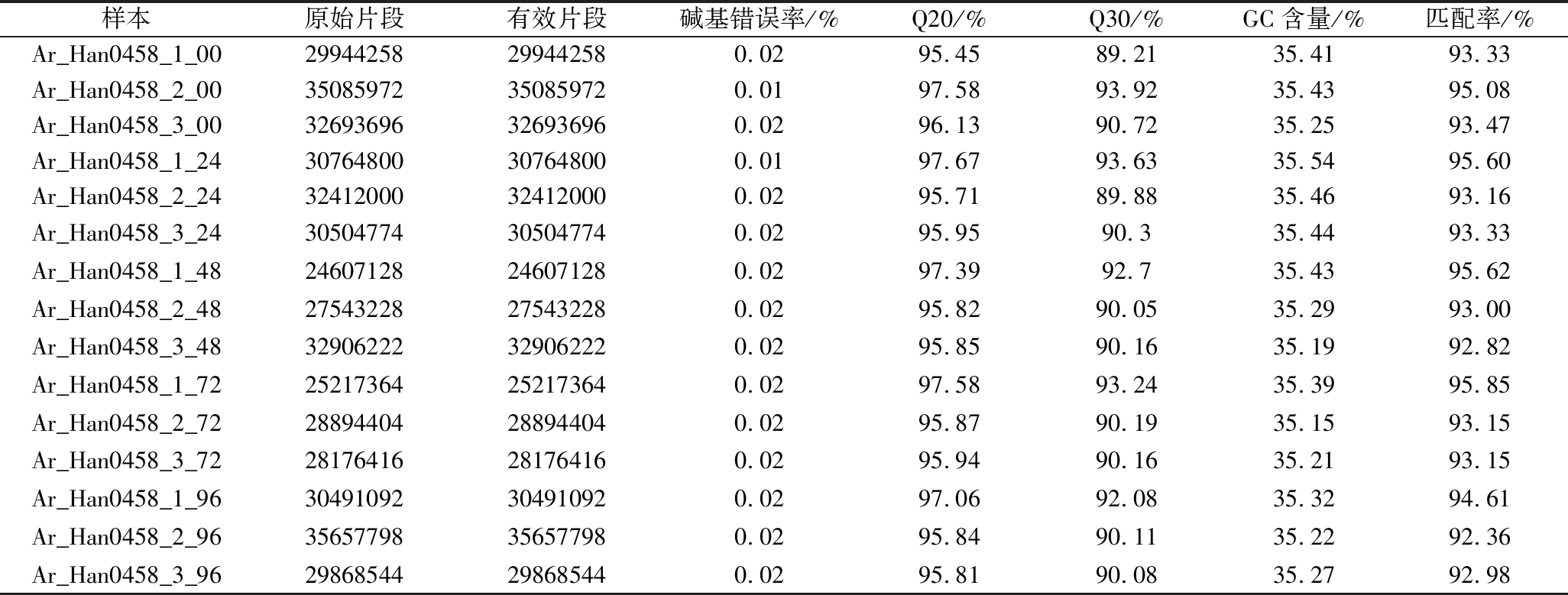
样本原始片段有效片段碱基错误率/%Q20/%Q30/%GC含量/%匹配率/%Ar_Han0458_1_0029944258299442580.0295.4589.2135.4193.33Ar_Han0458_2_0035085972350859720.0197.5893.9235.4395.08Ar_Han0458_3_0032693696326936960.0296.1390.7235.2593.47Ar_Han0458_1_2430764800307648000.0197.6793.6335.5495.60Ar_Han0458_2_2432412000324120000.0295.7189.8835.4693.16Ar_Han0458_3_2430504774305047740.0295.9590.335.4493.33Ar_Han0458_1_4824607128246071280.0297.3992.735.4395.62Ar_Han0458_2_4827543228275432280.0295.8290.0535.2993.00Ar_Han0458_3_4832906222329062220.0295.8590.1635.1992.82Ar_Han0458_1_7225217364252173640.0297.5893.2435.3995.85Ar_Han0458_2_7228894404288944040.0295.8790.1935.1593.15Ar_Han0458_3_7228176416281764160.0295.9490.1635.2193.15Ar_Han0458_1_9630491092304910920.0297.0692.0835.3294.61Ar_Han0458_2_9635657798356577980.0295.8490.1135.2292.36Ar_Han0458_3_9629868544298685440.0295.8190.0835.2792.98
基于基因组de novo测序结果[10],将RNA-seq测序得到的clean reads与基因组进行序列比对,比对结果显示样本中最低匹配率为92.36%,表明样本均不存在污染,基因组选取合适。
2.2 差异表达基因
差异表达基因分析结果显示,与0 h相比, Ar_Han0458在发酵24、48、72、96 h时分别有553、751、719、720个上调基因和1 113、1 289、1 221、989个下调基因;与24 h相比,发酵48、72、96 h时分别有444、500、724个上调基因;与48 h相比,发酵72 h和96 h分别有2、895个上调基因;发酵96 h与72 h相比,有343个上调基因和665个下调基因。
对相邻时间点的差异基因表达的结果进行比较分析,结果表明,无论是上调表达还是下调表达的差异基因数量都是从24~72 h下降,然后增加。发酵96 h时,其上调的差异表达基因数量高于24 h,下调表达基因仅高于72 h。72 h与48 h相比,上调基因和下调基因数量均为2(图1)。
图1 重组酵母菌Ar_Han0458液体发酵不同时间点间的差异表达基因
Fig.1 Differential expressed genes of recombinant yeast Ar_Han0458 at different culture time in liquid culture
注: t1/t2表示以t1时间样本为处理组、t2为对照组。图3同。
所有发酵时间点与0 h相比(图2),均为上调表达基因数量小于下调表达,且上调和下调表达基因数量变化趋势一致,皆为24~48 h增加,然后下降;24、48、72、96 h下调表达基因数量分别占总差异表达基因数量的66.80%、63.19%、62.94%、57.87%,表明与0 h相比差异表达基因数量逐渐趋向于上调。
a-24 h vs 0 h; b-48 h vs 0 h; c-72 h vs 0 h; d-96 h vs 0 h
图2 重组酵母菌Ar_Han0458液体发酵各时间点与0 h比较的差异表达基因
Fig.2 Differentially expressed genes of recombinant yeast Ar_Han0458 in liquid fermentation at different time compared with 0 h
注:横坐标表示差异倍数,由于FC跨度范围较大,对其取以2为底的对数。
总体结果显示,只有96 h时上调表达的差异基因数量大于下调表达的基因数量,其余发酵时间点差异表达的基因均以下调为主,这表明重组酵母菌Ar_Han0458 在发酵96 h时进入第2轮基因表达,也意味着菌体进入第2次生长。
2.3 GO功能富集
GO富集结果显示,差异表达基因在GO功能二级分类下共涉及28个生物学过程(biological process,BP),9个细胞组分(cellular component,CC),17个分子功能(molecular function,MF)。在BP、CC和MF的功能中,与细胞过程功能的差异基因和具有催化活性功能的差异基因数目居多。
对相邻时间点的差异表达基因功能进行富集分析,结果表明,发酵24 h的上调富集的差异表达基因功能只涉及胆红素运输,其余25种功能均为下调富集,主要涉及过氧化物酶体膜、层黏连蛋白-3复合物、蛋白质结合,桥接、胞质小核糖体亚基等。发酵48 h富集的所有11种差异基因的表达均为下调,其涉及的功能与24 h相同。发酵72 h由于上调和下调差异基因较少,均无功能富集。发酵96 h时,下调富集的功能仅有谷胱甘肽代谢过程,与发酵24、48 h不同的是,与层粘连蛋白-3复合物、蛋白质结合、桥接、质子转运ATP酶活性、防御反应、胞质小核糖体亚基等功能相关的差异基因表现为上调富集。
非相邻时间点的差异表达基因功能富集结果显示,除96 h外,其余发酵时间富集结果均以下调为主(图3),下调的基因功能主要涉及转移酶活性、蛋白质结合、胞质小核糖体亚基、层粘连蛋白-3复合物、过氧化酶体膜、rDNA染色体沉默、防御反应、生物激素的生物合成过程。
2.4 KEGG代谢通路富集
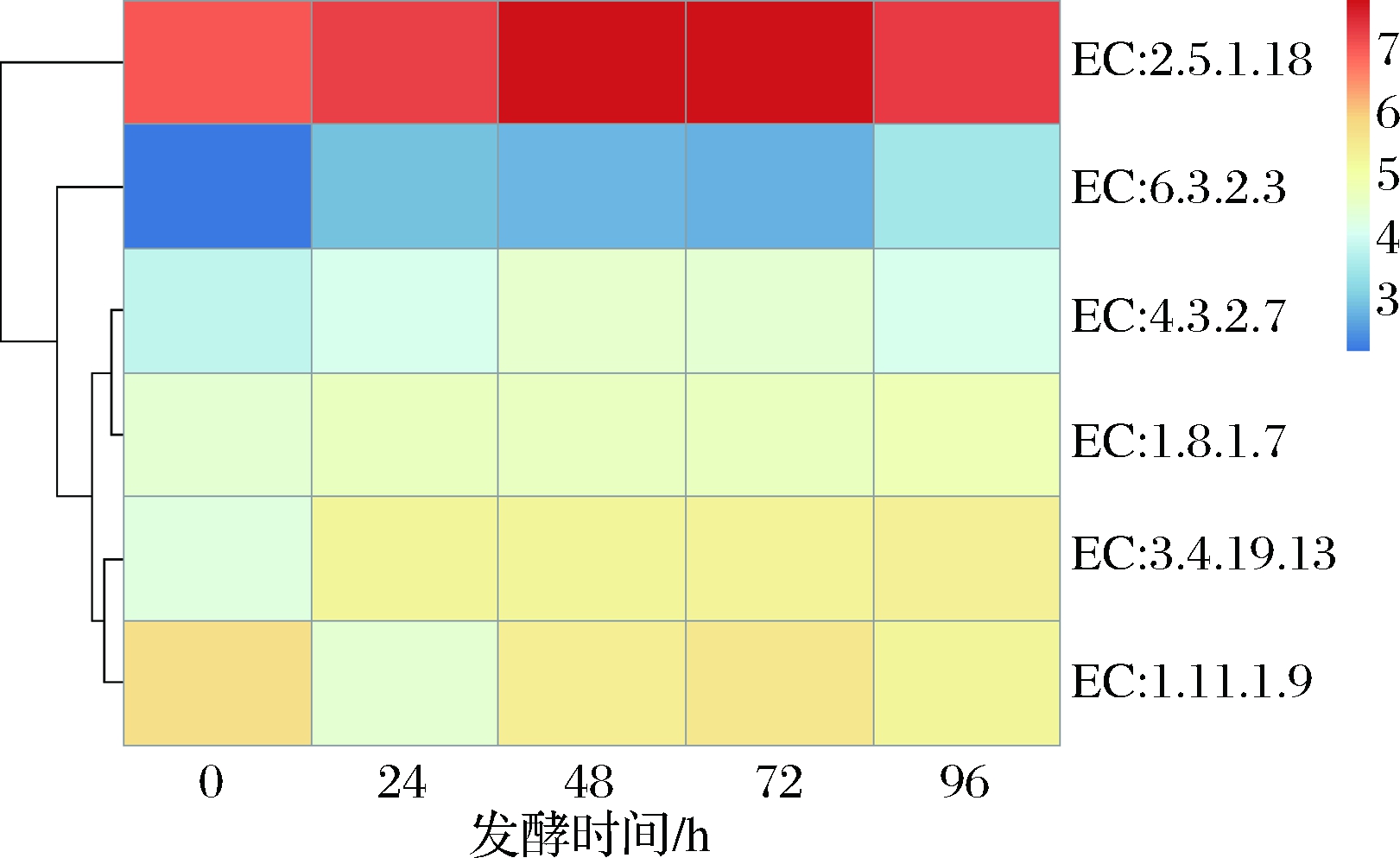
为了认识重组酵母菌Ar_Han0458在各个时间点差异表达基因参与的代谢途径,通过超几何样本抽样方法对差异表达的基因进行KEGG富集分析。富集结果显示,差异表达基因参与66条代谢途径,通过谷胱甘肽相应的代谢途径,发现了分解和合成谷胱甘肽的关键基因,其差异基因表达的矩阵分析结果如图4所示。同时,我们对不同发酵时间的重组异常汉逊酵母菌Ar_Han0458进行了胞外GSH产量测定(图5),其产量分别在24和96 h达到峰值。
谷胱甘肽-S-转移酶(glutathione S-transferase, GSTs, EC:2.5.1.18 4个基因)是催化不同类型外源化学物与还原型谷胱甘肽结合的酶,能使外源化学物结合于酯的表面,保护细胞的重要成份不受破坏[22],参与细胞对多种生物内源物质和生物异源物质的解毒过程[23]。重组酵母菌Ar_Han0458的GST表达量在0~48 h逐渐增加,48~96 h降低。
图3 重组酵母菌Ar_Han0458液体发酵的各时间点差异表达基因的GO功能及其类别
Fig.3 GO term enrichment of differential expressed genes of recombinant yeast Ar_Han0458 in different culture time at liquid culture
图4 重组酵母菌Ar_Han0458的各时间点谷胱甘肽代谢相关酶的表达矩阵
Fig.4 The synthesis for metallic of glutathione at recombinant yeast Ar_Han0458 liquid culture
图5 酵母菌Ar_Han0458不同发酵时间的胞外GSH产量
Fig.5 Extracellular GSH production of yeast Ar_Han0458 at different fermentation times
谷胱甘肽合成酶(glutathione synthase,GSH-Ⅱ,EC:6.3.2.3 单基因)是催化谷胱甘肽生物合成的关键酶[24],其表达量在重组酵母菌Ar_Han0458的整个发酵过程中呈起伏上升态势,表现为0~24 h逐渐增加,24~72 h逐渐减少,而后继续增加。
γ-谷氨酰基转移酶(glutathione-specific gamma-glutamylcyclotransferase,GGT,EC:4.3.2.7 单基因)是位于细胞膜上含SH基的糖蛋白,其天然底物是谷胱甘肽,通过γ-谷氨酰基循环促使细胞外游离氨基酸进入细胞,还与组织中氨基酸和肽的分泌及合成过程有关[25]。重组酵母菌Ar_Han0458的GGT表达量在前48 h逐渐增加,48 h达到峰值,48~96 h逐渐降低。
谷胱甘肽还原酶(glutathione reductase,EC:1.8.1.7 单基因)是催化氧化型谷胱甘肽(G-S-S-G)还原为还原型谷胱甘肽(G-SH)的酶,其表达量在0~24 h增加,24~48 h减少,之后增加,其中96 h表达量高于0 h。这一变化趋势与我们对不同发酵时间的重组异常汉逊酵母菌Ar_Han0458进行的胞外GSH产量变化趋势一致。
谷胱甘肽水解酶(glutathione hydrolase,EC:3.4.19.13 2个基因)催化谷胱甘肽分解成L-半胱氨酰甘氨酸和L-谷氨酸,与γ谷氨酰基转移酶功能类似,其表达量在0 h最低,之后一直逐渐增加。
谷胱甘肽过氧化物酶(glutathione peroxidase, GPx,EC:1.11.1.9 单基因)是机体内广泛存在的一种重要的催化过氧化物分解的酶,它特异地催化谷胱甘肽对氢过氧化物的还原反应[26],将脂质氢过氧化物还原为其相应的醇类并将游离过氧化氢还原为水,在控制脂质过氧化水平以保护细胞膜完整性方面起重要作用。GPx表达量变化趋势为0~24 h下降,24~72 h 上升,72~96 h下降,其中0 h表达量最高,24 h表达量最低。
3 讨论
本研究通过对离子束重组异常汉逊酵母菌Ar_Han0458的5个发酵时间点共15个生物学样本进行转录组测序,共获得表达基因5 809个。各发酵时间点基因表达谱的分析结果显示,48~72 h差异较小,说明48~72 h酵母菌体处于生长延滞期[27]。与0 h相比,各个发酵时间点均存在大量下调基因,这是由于采取常规接种方法,将生长在对数期的新鲜酵母斜面菌种接入液体培养基(0 h),此时酵母细胞代谢旺盛,当其进入新环境后,其表达的基因出现大量下调。
GO功能富集结果显示,重组酵母菌Ar_Han0458在0~72 h差异基因的表达量均已下调为主,96 h时以上调为主,说明基因进入第2轮表达,酵母细胞进入第2次生产。在重组酵母菌Ar_Han0458的GO功能富集结果中未发现芳香族氨基酸富集,而其原始菌株异常汉逊酵母菌As2340中能够富集到色氨酸[28],这说明在重组酵母菌Ar_Han0458发酵中,芳香族氨基酸作为生物碱的生物合成前体被消耗。
重组酵母菌Ar_Han0458发酵24 h时,胆红素运输上调,谷氨酸合酶(NADH,还原型辅酶I)活性下调,48、96 h时谷胱甘肽代谢过程下调,这一结果与胆红素可以抑制GST(谷胱甘肽-S-转移酶)的活性相符[29]。
谷胱甘肽合成酶的变化,指示着GSH的合成速率变化。重组酵母菌Ar_Han0458不同发酵时间的KEGG代谢通路的分析结果显示,GSH的合成速率,整体呈起伏上升趋势,在24和96 h有2次峰值,其中96 h时谷胱甘肽合成速率最快。从GSH、GSSG平衡来看,GSH/GSSG标志着细胞内的氧化还原状态[30],谷胱甘肽还原酶在0~24 h和48~96 h的增加说明此阶段酵母菌体代谢增强,产生ROS较多[31],而其余分解酶的增加(其产物分别有半胱氨酸、甘氨酸、谷氨酸),与添加半胱氨酸、甘氨酸、谷氨酸能增加谷胱甘肽产量的研究结果相符[28]。重组酵母菌Ar_Han0458发酵至96 h,GSH合成速率达到第2次峰值,是否与其次生代谢产物生物碱的合成相关,还有待进一步研究。
本研究结果将为重组异常汉逊酵母菌的代谢调控研究及其分子育种提供理论依据。
参考文献
[1] FENG H Y, YU Z L, CHU P K. Ion implantation of organisms[J].Materials Science and Engineering R: Reports,2006,54(3-4):49-120.
[2] 毛培宏,马向东,金湘,等.氩离子注入介导麻黄基因组DNA转化获得产麻黄碱重组酵母菌[J].微生物学报,2007 (5):905-909.
[3] LYU Jie, JIN Xiang, MAO Peihong, et al.Transfer of Ephedra genomic DNA to yeasts by ion implantation[J].Appl Biochem Biotechnol,2009,158(3):571-581.
[4] 毛培宏,吕杰.离子束重组酵母菌Ar_Han0458的RAPD与SSH的初步研究[J].基因组学与应用生物学,2015,34(3):449-453.
[5] HATEM E, BERTHONAUD V, DARDALHON M, et al. Glutathione is essential to preserve nuclear function and cell survival under oxidative stress [J]. Free Radical Biology and Medicine, 2014, 67:103-114.
[6] LUSHCHAK V I. Glutathione homeostasis and functions: potential targets for medical interventions[J].Journal of amino acids,2012, 2012:1-26.
[7] BURSELL S E,KING G L.The potential use of glutathionyl hemoglobin as a clinical marker of oxidative stress[J].Clinical Chemistry,2000,46(2):145-146.
[8] JAIN A, MARTENSSON J, STOLE E, et al. Glutathione deficiency leads to mitochondrial damage in brain [J].Proceedings of the National Academy of Sciences,1991,88(5):1 913-1 917.
[9] BURKE D, DAWSON D, STEARNS T. Methods in Yeast Genetics: A Cold Spring Harbor Laboratory Course Manual[M].New York: Cold Spring Harbor Lab Press,2000:171-172.
[10] 张寒玉,唐朝,王婷,等.离子束重组酵母菌Han0458基因组重复序列的分布特征[J].微生物前沿,2018,7(3):115-123.
[11] TRAPNELL C, WILLIAMS B A, PERTEA G, et al. Transcript assembly and quantification by RNA-Seq reveals unannotated transcripts and isoform switching during cell differentiation[J]. Nature biotechnology,2010,28(5):511-515.
[12] KIM D, LANGMEAD B, SALZBERG S L. HISAT: A fast spliced aligner with low memory requirements[J].Nature methods,2015,12(4):357.
[13] ANDERS S, PYL P T, HUBER W. HTSeq—a Python framework to work with high-throughput sequencing data[J].Bioinformatics,2015,31(2):166-169.
[14] 钱卫东,吴启航,刘昱辰,等.谷胱甘肽高产酵母融合子的制备及发酵工艺[J].陕西科技大学学报,2017,35(2):132-136.
[15] 钱卫东, 付云芳. 利用变温提高汉逊酵母发酵生产谷胱甘肽的研究[J].食品工业科技,2013, 34(6):207-210.
[16] 攀跃平,于健春,余跃,等.谷胱甘肽的生理意义及其各种测定方法比较、评价[J].中国临床营养杂志,2003,11(2):136-139.
[17] CONESA A, GÖTZ S, GARC A-G
A-G MEZ J M, et al. Blast2GO: A universal tool for annotation, visualization and analysis in functional genomics research [J]. Bioinformatics, 2005, 21(18): 3 674-3 676.
MEZ J M, et al. Blast2GO: A universal tool for annotation, visualization and analysis in functional genomics research [J]. Bioinformatics, 2005, 21(18): 3 674-3 676.
[18] MORIYA Y, ITOH M, OKUDA S, et al. KAAS: An automatic genome annotation and pathway reconstruction server[J].Nucleic Acids Research, 2007, 35(suppl_2): W182-W185.
[19] ANDERS S, HUBER W. Differential expression analysis for sequence count data [J].Genome Biology,2010,11:R106.
[20] YOUNG M D, WAKEFIELD M J, SMYTH G K, et al. Gene ontology analysis for RNA-seq: Accounting for selection bias[J]. Genome Biology, 2010, 11(2): R14.
[21] COCK P J A, FIELDS C J, GOTO N, et al. The Sanger FASTQ file format for sequences with quality scores, and the Solexa/Illumina FASTQ variants[J].Nucleic Acids Research,2010,38(6):1 767-1 771.
[22] HAYES J D, FLANAGAN J U, JOWSEY I R. Glutathione transferases[J]. Annual Review of Pharmacology and Toxicology,2005,45:51-88.
[23] 陆苑,潘洁,杨淑婷,等. 艾迪注射液对肝癌大鼠谷胱甘肽-S-转移酶的影响[J].中国药理学通报,2018,34(8):1 170-1 174.
[24] 王玮玮,唐亮,周文龙,等.谷胱甘肽生物合成及代谢相关酶的研究进展[J].中国生物工程杂志,2014,34(7):89-95.
[25] 杨玉林,贺志安.临床肝病实验诊断学[M].北京:中国中医药出版社,2007:68-69.
[26] 侯少范,薛泰麟,谭见安.高等植物中的谷胱甘肽过氧化物酶及其功能[J].科学通报,1994(6):553-556.
[27] 张倩雯,王春霞,杨丽芸,等.影响酿酒酵母发酵过程的因素分析[J].中国酿造,2015,34(12):14-19.
[28] 唐朝,张寒玉,毛培宏,等.基于转录组测序的异常汉逊酵母菌不同发酵时期差异表达基因功能分析[J].食品与发酵工业,2019, 45(4):1-6.
[29] 夏初临,陈惠黎.胆红素对人胎盘谷胱甘肽S-转移酶的别构效应[J].生物化学杂志,1989(4):301-306.
[30] 毛丽娟,许豪文.运动对大鼠肝脏GSH、GSSG含量及GSH/GSSG的影响[J].体育与科学,2004(1):60-63;34.
[31] 刘影,谢为天,徐春厚,等.胶红酵母J6发酵培养基的优化及其生长曲线的绘制[J].河南农业科学,2018,47(2):125-129.
Transcriptomic analysis and glutathione metabolic pathway enrichment in recombinant Hansenula anomala Ar_Han0458
ZHANG Hanyu1, TANG Chao1, FENG Guangwen1, MAO Peihong1*, CAI Changlong2*
1 (Research Center of Radiation Ecology and Ion Beam Biotechnology, College of Physics Science and Technology, Xinjiang University, Urumqi 830046, China) 2 (Research Center of Ion Beam Biotechnology and Biodiversity, Xi’an Technological University, Xi’an 710032, China)
ABSTRACT This study aimed to investigate differential expression genes and changes in genes that are related to glutathione metabolism in a Hansenula anomala mutant, Ar_Han0458, during fermentation. The RNA-seq high-throughput sequencing data of Ar_Han0458 at five fermentation time points (0, 24, 48, 72, 96 h) were analyzed by bioinformatics methods. It was found that in comparison to 0 h, the number of down-regulated genes was more than that of up-regulated genes at each fermentation time. Except fermenting for 96 h and 72 h, the number of differential expression genes at adjacent time points was mainly down-regulated. Besides, the gene expression profiles were similar between 48 and 72 h. Moreover, the GO functions of differentially expressed genes at various time points mainly involved in cell process, cells and catalytic activity. The results of KEGG enrichment indicated that 10 differentially expressed genes participated in glutathione metabolism. The synthesis rate of glutathione reached the highest in 24 and 96 h, which was consistent with the variation trend of extracellular glutathione production. In conclusion, the number of differentially expressed genes in Ar_Han0458 was mainly up-regulated and it had the highest glutathione synthesis rate at 96 h. This study provides a theoretical basis for metabolic regulation of recombinant H. anomala and its molecular breeding.
Key words recombinant Hansenula anomala;transcriptome;differential expression genes;glutathione;metabolism





 A-G
A-G MEZ J M, et al. Blast2GO: A universal tool for annotation, visualization and analysis in functional genomics research [J]. Bioinformatics, 2005, 21(18): 3 674-3 676.
MEZ J M, et al. Blast2GO: A universal tool for annotation, visualization and analysis in functional genomics research [J]. Bioinformatics, 2005, 21(18): 3 674-3 676.