李娟1,3,许雪儿1,3,胡卫成2,余培斌3,鲁振杰1,3,陈正行1,3*
1(江南大学 食品学院,江苏 无锡,214122) 2(江苏省环洪泽湖生态农业生物技术重点实验室(淮阴师范学院),江苏 淮安,223300) 3(江南大学粮食发酵工艺与技术国家工程实验室,江苏 无锡,214122)
摘 要 利用静电纺丝技术制备负载百里香酚的玉米醇溶蛋白基纳米纤维抗菌膜,并研究其微观结构、表面接触角、水汽透过率和抗菌物质释放率等性质。实验结果表明,当玉米醇溶蛋白与百里香酚质量比为10∶1时,纳米纤维膜具有一定缓释抗菌物质的能力,其水汽透过率为4.32 g·mm/(m2·h·kPa),表面接触角为104.36°,表明该膜具有良好的透气性及疏水稳定性,且由于其安全性特别适合医用敷料等方面的应用。当玉米醇溶蛋白与百里香酚质量比为5∶1~1∶1时,纳米纤维抗菌膜对大肠杆菌有一定的抗菌效果,最小抑菌圈直径为8.68 mm,最大抑菌圈直径为20.42 mm。
关键词 静电纺丝技术;玉米醇溶蛋白;阿拉伯胶;百里香酚;纳米纤维;抗菌膜
第一作者:博士,副研究员(陈正行教授为通讯作者,E-mail:zxchen2007@126.com)。
基金项目:国家自然科学基金青年项目(编号:31501407);江苏省环洪泽湖生态农业生物技术重点实验室开放课题(项目编号:HZHLAB1701);江南大学自主科研计划青年基金项目(JUSRP11705)
收稿日期:2018-09-27,改回日期:2018-11-15
DOI:10.13995/j.cnki.11-1802/ts.018916
静电纺丝法制备纳米纤维膜具有较强透气性、较大比表面积、孔隙率及柔韧性[1]。传统的静电纺丝多使用环糊精、尼龙、聚氧环乙烯等作为纺丝液原料,但因其对环境污染较大、不可食用性、和毒性等限制其应用。而玉米醇溶蛋白(zein)作为食源性原材料,其成膜性,无毒无害性和良好的生物相容性被广泛应用于生物膜材料的制备。WANG等制备zein基纳米纤维膜作为药物控释体系,包裹姜黄素等药物为研究其缓释溶出机理提供理论依据[2];刘永佳等将zein与羟基磷灰石共纺制备得到的纳米纤维膜,可作为细胞生长载体以培养骨髓间充质干细胞,并有效提高细胞存活率[3]。本实验中研究制备的纳米纤维抗菌膜采用了玉米醇溶蛋白和阿拉伯胶2种生物大分子进行构建,鉴于玉米醇溶蛋白和阿拉伯胶良好的生物相容性和安全性,因此比较适合用于食品以及医药等对安全性要求较高的领域。
百里香酚作为天然抗菌剂可有效抑制微生物的繁殖,但因其疏水性强、具有刺激性气味和生物利用率低等缺陷限制了其应用。本研究中将所制备的玉米醇溶蛋白-阿拉伯胶运载体系负载以百里香酚制备抗菌膜,尤其适用于医药领域对革兰氏阴性菌的抗菌作用。此外,本研究中采用的静电纺丝技术所制备的纳米纤维膜较其他技术所制备的纳米纤维膜具有透水透气性好的优点,因此本实验制备的纳米纤维抗菌膜特别适用于医药领域对透气性要求高的材料,例如:用于制备接触皮肤的药物敷料等。因此,本论文以zein为基质负载百里香酚并利用静电纺丝技术制备得纳米纤维抗菌膜,不仅提高了百里香酚等疏水性物质的生物利用率,而且起到一定的缓释作用,在生物医药行业具有广泛的应用前景。
玉米醇溶蛋白(纯度91%),购于河南华瑞生物科技有限公司;阿拉伯胶(GA)和百里香酚,购自美国Sigma试剂公司;无水乙醇等试剂,购自上海国药集团化学试剂有限公司。
自制静电纺丝装置:DW-P203-10AC型高压数显电源,天津市东文高压电源厂;MS-MP8数显磁力搅拌器,大韩WiseStir公司;SU8220冷场发射扫描电子显微镜,日本日立株式会社;OCA15EC视频光学接触角测量仪,德国徕卡公司。
1.3.1 玉米醇溶蛋白与阿拉伯胶纳米颗粒的结构测定
zein-GA纳米颗粒的制备方法见许雪儿等研究[4]。
1.3.1.1 荧光光谱分析
取1 mL新鲜制备的质量浓度为1 g/L的zein-GA纳米颗粒(zein初始储备液质量浓度为50 g/L、m(zein)∶m(GA) =1∶1.5)于离心管中,并使用10 mmol /L的pH=4.0的缓冲液稀释至100倍。按照不同比例分别加入NaCl制备得到含1、2、5 mmol/L NaCl的zein-GA纳米颗粒;按照不同比例分别加入十二烷硫酸钠(SDS)制备得到SDS质量浓度为2.5、5.0、 10.0 g/L的zein-GA纳米颗粒。将制备好的不同NaCl浓度影响的zein-GA纳米颗粒和不同SDS浓度影响的zein-GA纳米颗粒,在发射光谱为400~600 nm,激发波长为370 nm、发射波长为490 nm的条件下,检测不同zein-GA纳米颗粒的荧光强度[5]。其中横坐标为发射光谱波长,纵坐标为荧光强度。
1.3.1.2 傅立叶变换红外光谱(FTIR)
取100 mL新鲜制备的zein-GA纳米颗粒m(zein)∶m(GA)=1∶1.5)于45 ℃下旋转蒸发以除去乙醇,然后4 000 r/min离心10 min以除去大分子,所得样品冷冻干燥72 h得zein-GA纳米颗粒固体粉末。称取0.2 g zein、0.2 g GA和0.2 g zein-GA纳米颗粒固体粉末分别与纯溴化钾以1∶100充分研磨混合。最后,将混合粉末用压片机压制成圆形片状并置于载物台上以测定结构。其中,以纯溴化钾片为基线,设定扫描范围为550~4 000 cm-1对样品进行扫描[6]。所得红外图像采用OMNIC 8.2软件进行分析。
1.3.2 静电纺丝法制备抗菌膜
利用静电纺丝机制备zein-百里香酚复合纳米纤维膜。首先,称取0.5 g zein溶解于冰乙酸中,并按照不同zein与百里香酚质量比为1∶1、2∶1、5∶1、10∶1、50∶1、 100∶1称取百里香酚溶解到zein的冰乙酸中,置于磁力搅拌器上搅拌120 min后得到纺丝液。其中设定空白对照为不添加百里香酚的zein纺丝液。其次,将锡箔纸均匀覆盖在垂直放置于针筒的接收滚筒上,应避免出现褶皱导致膜的完整性受到影响。电极两端分别连接注射针头和接收滚筒,注射器针头水平放置并垂直于接收滚筒的中央,喷头处距离接收滚筒距离为15 cm。设定纺丝电压为15.23 kV,控制温度为25 ℃,空气湿度为50%。纺丝过程中将柜门关闭,以确保空气湿度和温度不受外界影响。纺丝结束后,取下锡箔纸,将所得纳米纤维膜置于干燥器内常温避光保存[3]。
1.3.3 抗菌膜性质的测定
1.3.3.1 抗菌膜电子扫描显微镜观察
将抗菌膜剪成1 cm×1 cm大小的膜片并放置于导电胶上固定后喷金,采用电子束对样品进行微观形貌拍摄,设定电压为30 kV,电流为50 pA,电子束加速电压为5 kV,镜头放大倍数为5 000倍。
1.3.3.2 抗菌膜中百里香酚释放率测定
称取负载不同zein与百里香酚质量比的zein-百里香酚静电纺纳米纤维膜各10 mg,将zein-百里香酚纳米纤维膜放入透析袋中,加入50 mL去离子水,用夹子将透析袋两端夹紧并浸入足够的透析介质中,使得透析袋内外有足够的液体进行介质交换。设定烧杯内转子转速设为100 r /min,每隔一定时间移取适量体积的释放液加入2 mL乙酸乙酯进行涡旋,并用分光光度计在276 nm下测定吸光值,带入标准曲线计算释放百里香酚浓度,按照公式(1)计算释放率[7]。
释放率![]()
(1)
1.3.3.3 抗菌膜表面接触角测定
将抗菌膜剪成1 cm×1 cm大小的膜片并置于载物台上,调节注射器针头使得针头垂直于膜片并且距离膜片中心1 cm的位置,用注射器吸入一定量的去离子水并由电动注射控制单元推出水滴,用视频摄像系统在15 s内每隔一定时间连续采集液滴的外形并及时保存图片,用自带的接触角测量系统分析测定接触角大小,每张膜片平行测定3次,每张抗菌膜剪取3张膜片,去除误差较大值后计算平均值定为该膜片的接触角。
1.3.3.4 抗菌膜透气性(WVP)的测定
首先,将足量固体CaCl2置于105 ℃烘箱烘干至恒重后,将其放入称量瓶中。分别将zein-百里香酚复合纳米纤维膜和医用创可贴绷紧并尽可能的密封于称量瓶口上。将密封好的称量瓶置于干燥器中,干燥器下方放置饱和BaCl2溶液以确保干燥器内相对湿度90%。在24 h内每隔一定时间称取称量瓶重量,通过固体CaCl2的质量变化和公式(2)来计算纳米纤维膜的透气性[8]。
![]()
(2)
式中:C表示水蒸气通透速率,即氯化钙质量与时间关系曲线的斜率,g/h;X表示膜厚度,mm;ΔP表示膜两侧水蒸气压差,膜两侧相对湿度为90%,25 ℃时水蒸气饱和蒸汽压为3.17 kPa,则ΔP=3.17×90%=2.85 kPa;A表示膜的有效面积,m2。
1.3.4 抗菌膜抑菌效果测定
将不同百里香酚荷载量的抗菌膜裁剪成直径为6 mm的圆形膜片并于紫外灯下照射15 min,用镊子分别移置于接种有大肠杆菌菌液的LB固体培养基上,在37 ℃条件下与大肠杆菌一同恒温培养24 h,24 h 后观察抑菌情况并测量抑菌圈直径[9]。
1.3.5 数据统计与分析
实验均重复测定3次,并用标准差对数据进行平均数分析。利用SPSS软件对所得实验数据进行统计学分析,采用Duncan检验法进行显著性分析。所有图形均由Origin 9.0进行绘制分析。
2.1.1 荧光光谱分析
为确定zein-GA纳米颗粒的相互作用方式,使用8-苯胺-1-萘磺酸(ANS)结合氨基酸疏水残基以表现不同条件下zein-GA纳米颗粒的荧光强度。随着GA含量的增加,纳米颗粒结合的ANS的荧光强度显著(P<0.05)降低,而当zein与GA质量比为1∶1.5、1∶2、 1∶2.5、1∶5时,zein-GA纳米颗粒的荧光强度有所降低但无显著变化,其中zein与GA质量比为1∶1.5时,纳米颗粒荧光强度变化最大。ANS与zein纳米颗粒中的疏水残基的结合显示此时ANS的荧光强度最高,而GA的增加进一步减小其荧光强度,可能是因为zein纳米颗粒表面疏水基团的变化影响了ANS的结合能力,同时zein表面的疏水区域被阻断进而体现为荧光强度降低[10]。
当zein与GA质量比为1∶1.5 时,随着纳米颗粒体系中NaCl和SDS浓度的增加,zein-GA纳米颗粒荧光强度均显著增加(P<0.05)。 可能是由于NaCl破坏了带负电的GA和带正电的zein氨基酸残基间的静电相互作用力,导致zein的疏水性残基和ANS之间的结合使得荧光强度增大,即NaCl阻断了zein和GA的结合位点。增大的SDS浓度对zein-GA纳米颗粒的荧光强度的影响是因为当SDS浓度增大时破坏了zein和GA的疏水作用力即破坏zein和GA的作用位点导致荧光强度增大[5]。综上所述,zein-GA纳米颗粒可能是由zein和GA产生静电相互作用以及疏水相互作用力所形成的。
2.1.2 红外光谱分析
zein、GA和zein-GA纳米颗粒的FTIR光谱如图1所示。在FTIR光谱图中,从左往右第1个特征峰在3 200~3 400 cm-1,分别为3 412.8 cm-1、3 303.38 cm-1和3 369.65 cm-1,表明在zein、GA和zein-GA纳米颗粒中存在羟基。此外,zein-GA纳米颗粒羟基的峰值发生在3 303.38 cm-1(zein)和3 412.81 cm-1(GA)之间,这说明zein中谷氨酰胺的酰胺基团和GA的羟基之间有可能形成氢键。第2个特征吸收峰是在1 500~1 700 cm-1的伸缩振动峰。在1 654.28 cm-1、1 535.78 cm-1、1 449.79 cm-1的zein的特征峰分别代表了酰胺Ⅰ、Ⅱ和Ⅲ带[11]。而在zein-GA纳米颗粒中,这些拉伸振动峰的出峰位置分别为1 653.9 cm-1、1 545.69 cm-1和1 419.79 cm-1。数据表明酰胺Ⅰ和Ⅲ带的峰值红移,酰胺Ⅱ的特征峰蓝移,可能是分子内部相互作用力的形成改变了酰胺带环境。DAI等[6]研究zein-卵磷脂复合纳米颗粒时表明,在zein纳米颗粒中酰胺Ⅱ基团的拉伸振动峰为1 527 cm-1,当形成了zein-卵磷脂纳米颗粒时,酰胺Ⅱ基团的拉伸振动峰蓝移至1 533 cm-1,表明卵磷脂和zein之间可能存在静电和疏水相互作用力。综上所述,在zein和GA之间可能存在静电相互作用或疏水相互作用促进纳米颗粒的形成。第3个特征峰1 616.68 cm-1和1 420.11 cm-1代表的是GA中羧基的不对称和对称振动峰[12-13]。然而,位于的特征峰1 616.68 cm-1在zein-GA纳米颗粒中未出现,只有1 419.78 cm-1的峰值仍然存在。因此,可能是由于zein和GA的相互作用改变了zein-GA红外光谱中的结构。
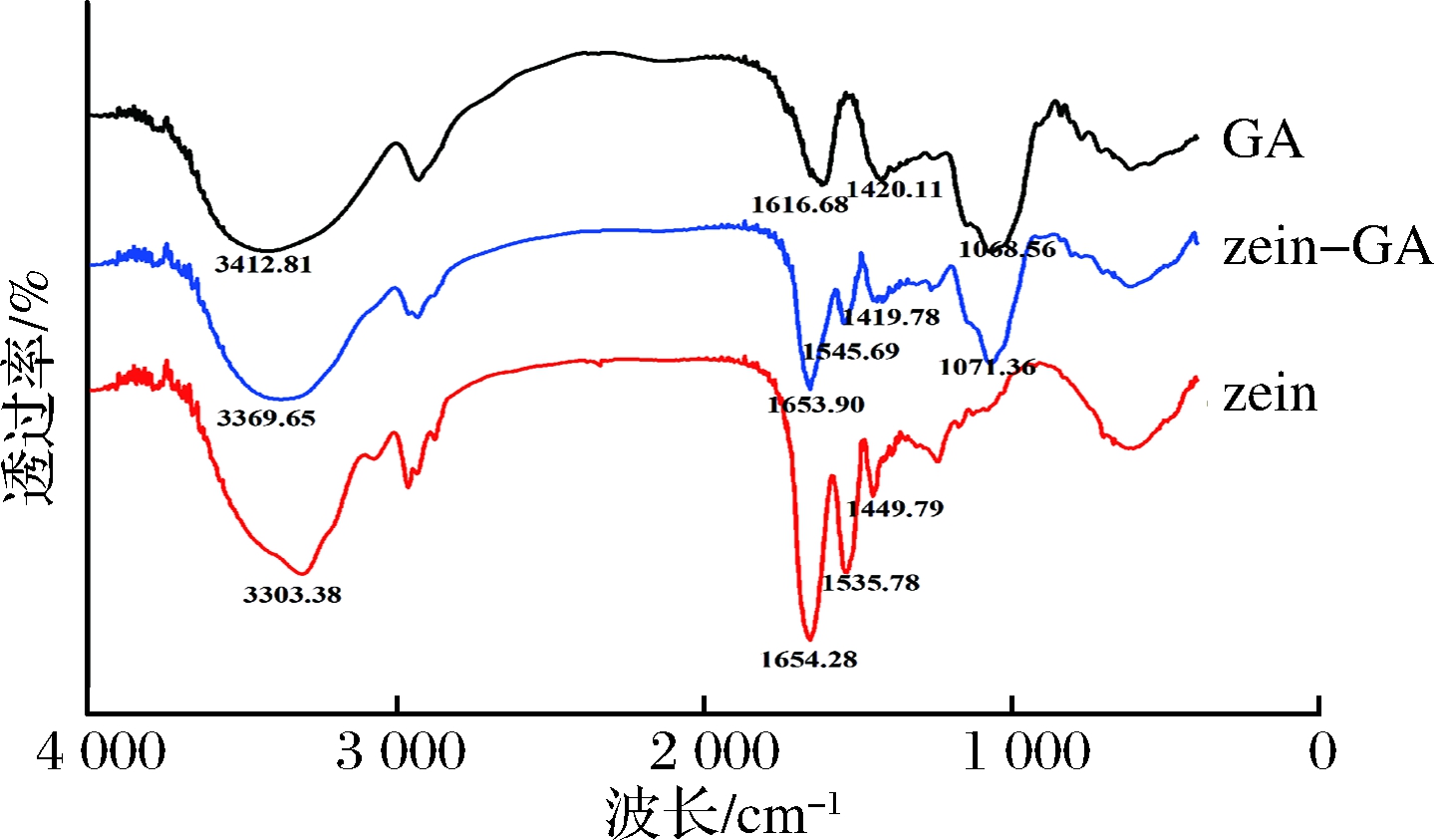
图1 zein、GA和zein-GA纳米颗粒红外光谱图
Fig.1 FTIR spectra of zein, GA and zein-GA nanoparticles
如图2所示为不同百里香酚负载量的zein静电纺纳米纤维抗菌膜微观结构形貌图。所有微观结构图片都是纳米纤维无规则堆砌成孔隙率较高的膜。其中,图2-a、图2-b分别为zein与百里香酚质量比为1∶1、2∶1时的纳米纤维膜,可以看出高负载量的纺丝液可纺性较差,当百里香酚负载量较高时,部分纳米纤维直径变粗、粘连和断丝现象,并且出现少量百里香酚结晶引起的串珠现象,这可能是由于百里香酚的加入使得纺丝液黏度增大,电导率升高进而使得静电纺丝射流在喷嘴处阻塞,出现射流方向不稳定、不连续等问题[14]。

a-m(zein)∶m(百里香酚)=1∶1;b-m(zein)∶m(百里香酚)=2∶1;c-m(zein)∶m(百里香酚)=5∶1;d-m(zein)∶m(百里香酚)=10∶1;e-m(zein)∶m(百里香酚)=50∶1;f-m(zein)∶m(百里香酚)=100∶1
图2 不同zein与百里香酚质量比对抗菌膜微观形貌影响
Fig.2 Effects of the different mass ratios of zein∶thymol on the micromorphology of zein-thymol nanofiber films
由图2-c、图2-d、图2-e、图2-f中可得,百里香酚负载量逐渐减小时,静电纺丝纳米纤维形貌为均匀的圆柱体,纤维表面光滑,没有串珠和断丝现象。此外,纤维直径均为纳米级,平均直径在200~300 nm,表明在一定的百里香酚负载量内,zein和百里香酚能够较好的共混溶解和分散于纺丝液中,且百里香酚可以被包裹于zein静电纺纤维中。
如图3所示,当释放时间达到12 h时,zein与百里香酚质量比为100∶1的纳米纤维抗菌膜的释放率为78.57%, 且不同zein与百里香酚质量比下所得抗菌膜的释放速率随着百里香酚含量的增大而增大至95.24%。这可能是由于纳米纤维较大的比面积使得纤维膜与药物接触的面积增大,当百里香酚负载量过高时,药物不能够完全包裹,游离部分发生突释;当百里香酚负载量较低时,药物被包裹于纤维内部需缓慢释放至完全[7]。此外,纳米纤维抗菌膜中百里香酚释放率均随着时间的推进而趋于稳定。其中,在前1 h 内即百里香酚释放初期不同zein与百里香酚质量比的抗菌膜均存在突释效应,这可能是因为部分存在于纳米纤维表面的百里香酚通过扩散作用立刻释放出来,且随着百里香酚比例的增大,初期的突释效应变得更加明显,推测是由于未被包裹的药物扩散效应较强,此时药物扩散速率大于溶出速率[15]。在后期的释放过程中,所有纳米纤维膜都呈现缓释效应,包裹于纤维内部的百里香酚逐渐从纤维中释放出来,释放速率逐渐减小,但释放介质中百里香酚浓度逐渐升高,一定程度上抑制了扩散作用[16]。

图3 不同zein与百里香酚质量比对抗菌膜中百里香酚释放率影响
Fig.3 Effects of the different mass ratios of zein∶thymol on the release rates of thymol from zein-thymol nanofiber films
如图4所示,不同zein与百里香酚质量比下所得抗菌膜表面接触角随着百里香酚占比的增大而逐渐增大。表面接触角能体现纳米纤维抗菌膜的润湿性,单独的zein纤维膜表面接触角为93.81°,呈现疏水性,这与zein本身含75%的疏水氨基酸及zein不溶于水的性质相符合[17]。随着百里香酚含量的提高,静电纺抗菌膜纤维直径变粗,且存在药物结晶现象,这使得纳米纤维横纵分布形成的纤维孔隙变小,因此抗菌膜的疏水作用变强,表面接触角逐渐增大至112.21°,对水的阻隔性变大,同时百里香酚为疏水性物质也使得体系接触角向疏水性转变[18]。因此,负载百里香酚的zein纳米纤维抗菌膜水稳定性随着时间的增大而提高。
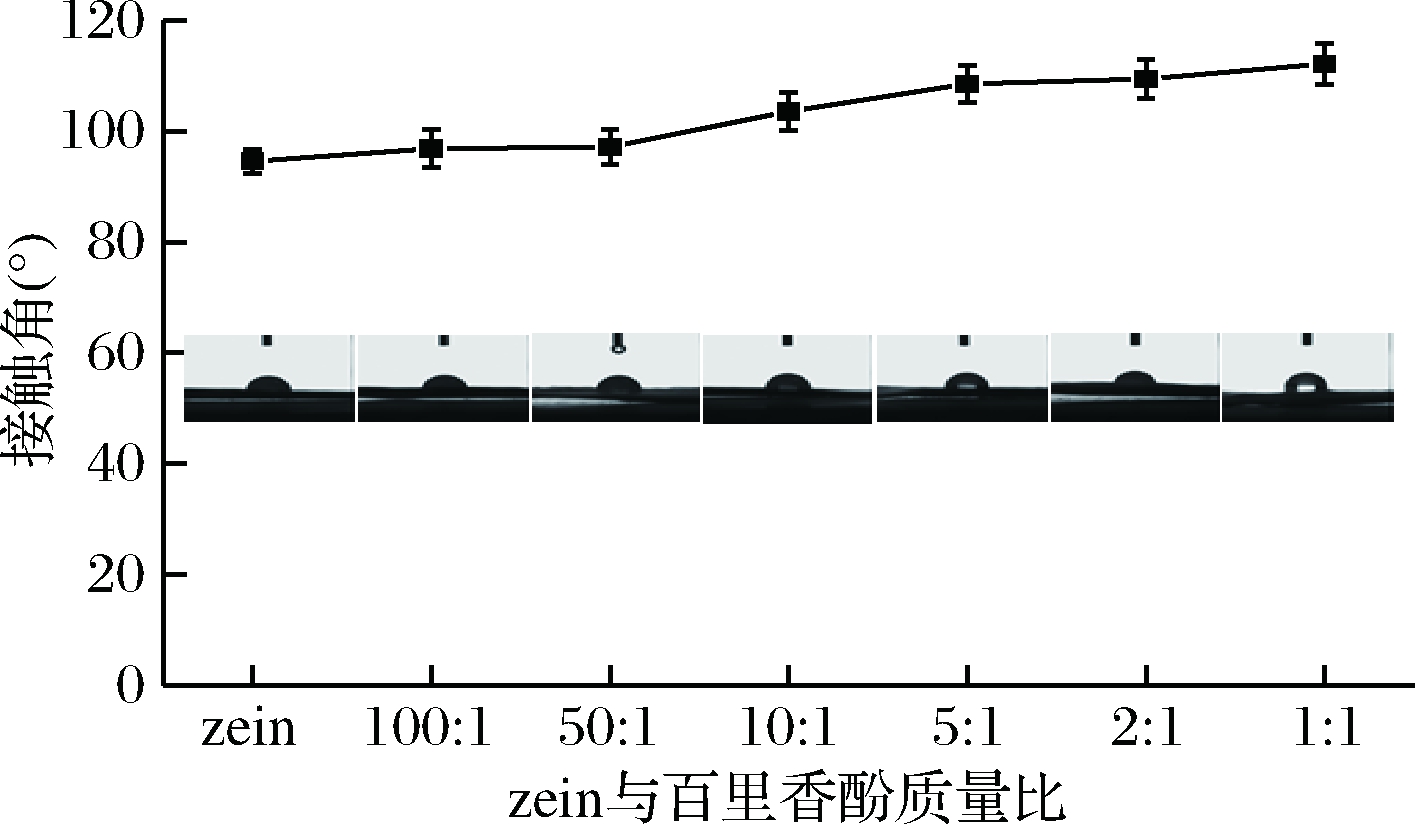
图4 不同zein与百里香酚质量比对抗菌膜表面接触角的影响
Fig.4 Effects of the different mass ratios of zein:thymol on contact angles of zein-thymol nanofiber films
由表1可以看出,不同zein与百里香酚质量比下所得抗菌膜在15.43 s内能够被水完全浸湿。同时,百里香酚比例含量越大,浸湿所需时间越长,有利于其在医用伤口敷料中具备一定防水性。因此在制备抗菌膜时,考虑在不改变纳米纤维性质的同时尽可能提高药物负载量,以降低成本,达到提高药效和防水性作用。
表1 不同zein与百里香酚质量比对抗菌膜完全润湿的影响
Table 1 Effects of the different mass ratios of zein∶thymol on the complete wetting time of zein-thymol nanofiber films

注:不同字母a、b、c代表差异显著(P<0.05)。
不同zein与百里香酚质量比对抗菌膜的水汽透过率影响如表2所示,负载百里香酚的zein纳米纤维抗菌膜的水汽透过率显著(P<0.05)高于创可贴的水汽透过率。负载百里香酚的zein均匀纺成丝,错综交叉形成层层纤维膜,改变水汽迁移途径为曲折型,影响水分子从膜中的迁移效率[19]。随着百里香酚负载量的降低,zein-百里香酚纳米纤维抗菌膜的透气性逐渐变好至4.72 g·mm/(m2·h·kPa),可能是因为当百里香酚负载量较高时纳米纤维较为粗壮扁平,不利于水汽的透过,而当负载量减小时,百里香酚被完全包裹于纳米纤维膜中,水汽透过率因此提高[20]。该结果与微观结构图及接触角数据相一致,表明负载合适比例的百里香酚的zein纳米纤维膜具有较好的医用前途。李鑫等[21]在制备zein纳米纤维膜时也发现,纳米纤维膜的水汽透过率与医用纱布的水汽透过率相差较小,表明其较大的孔隙率促进其水蒸气的透过率的提高。
表2 不同zein与百里香酚质量比对抗菌膜水汽透过率的影响
Table 2 Effects of the different mass ratios of zein∶thymol on the WVP of zein-thymol nanofiber films

注:不同字母a、b、c代表差异显著(P<0.05)。
如表3所示,不同zein-百里香酚比的抗菌膜对大肠杆菌菌群形成的抑菌圈直径也有所不同。其中当zein与百里香酚质量比为1∶1、2∶1、5∶1、10∶1时,zein-百里香酚纳米纤维抗菌膜对大肠杆菌有显著(P<0.05) 抑菌效果,随着百里香酚含量的减小,抑菌圈直径从20.42 mm减小至8.68 mm。当zein与百里香酚质量比为50∶1、 100∶1和未负载百里香酚的zein纳米纤维膜时,未有抑菌圈出现。可能是纳米纤维膜百里香酚含量较低导致抑菌效果较弱[22]。
表3 不同zein与百里香酚质量比对抑菌圈的影响 表3 Effects of the different mass ratios of zein∶thymol on the diameters of inhibition zone

注:“-”代表未检出抑菌圈;不同字母a、b、c代表差异显著(P<0.05)。
结合图5,zein与百里香酚质量比为1∶1、2∶1、5∶1 时抑菌圈显著(P<0.05)出现,且膜面及膜圆周都未有大肠杆菌形成;当zein与百里香酚质量比为10∶1时,zein-百里香酚纳米纤维抗菌膜已无抑菌圈出现,且存在较多单个大肠杆菌菌群,表明该比例下zein-百里香酚抗菌膜抑菌能力下降,但膜面未形成大肠杆菌菌落;当zein与百里香酚质量比为100∶1时,zein-百里香酚抗菌膜无抑菌圈出现,且膜面形成大肠杆菌菌群。同时可以发现zein纳米纤维膜对于大肠杆菌菌群也未形成抑菌圈,且大肠杆菌长满整个膜面,外观结构来看膜的颜色已由原来的黄色变成暗灰色。综上所述,zein与百里香酚质量比为1∶1、2∶1、5∶1的zein-百里香酚纳米纤维抗菌膜有显著抑菌特性。
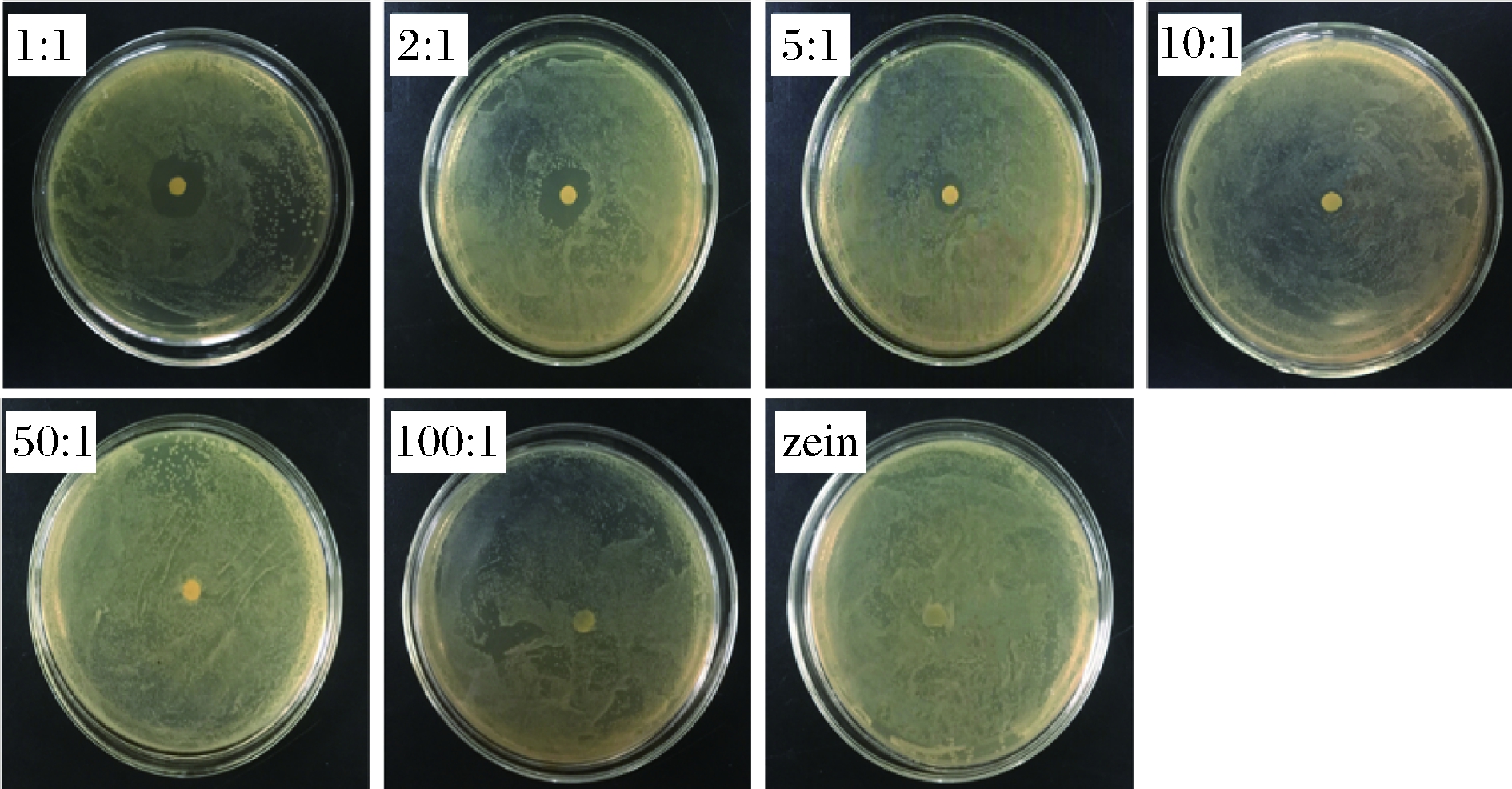
图5 不同zein与百里香酚质量比对抗菌膜抑菌圈的影响
Fig.5 Effects of the different mass ratios of zein- thymol on the inhibition zone of zein-thymol nanofiber films
通过静电纺丝法制备得到zein-百里香酚纳米纤维膜,其水汽透过率和疏水稳定性良好,安全性和生物兼容性好,在生物医药行业具有广泛的应用前景。此外,可有效实现对诸如百里香酚等疏水性物质的缓释,提高其生物利用率。
参考文献
[1] QURESHI U A,KHATRI Z,AHMED F,et al. Electrospun zein nanofiber as a green and recyclable adsorbent for the removal of reactive black 5 from the aqueous phase [J]. Acs Sustainable Chemistry & Engineering,2017,5(5): 4 340-4 351.
[2] WANG H,HAO L,WANG P,et al. Release kinetics and antibacterial activity of curcumin loaded zein fibers [J]. Food Hydrocolloids,2017,63: 437-446.
[3] 刘永佳. 静电纺丝法制备系列玉米醇溶蛋白纳米纤维及性能研究[D]. 长春:吉林大学,2014.
[4] 许雪儿,李娟,陈正行等. 玉米醇溶蛋白-阿拉伯胶纳米颗粒的制备及性质表征[J]. 食品与发酵工业,2018,44(7):179-184.
[5] 王涛. 物理相变耦联机械胁迫的大米蛋白溶解机制及自乳化载体的控释行为[D]. 无锡:江南大学, 2017.
[6] DAI L, SUN C, WANG D, et al. The interaction between zein and lecithin in ethanol-water solution and characterization of zein-lecithin composite colloidal nanoparticles [J]. Plos One, 2016, 11(11):1-20.
[7] ZHU J Y,TANG C H,YIN S W,et al. Development and characterisation of polylactic acid-gliadin bilayer/trilayer films as carriers of thymol [J]. International Journal of Food Science and Technology,2018,53(3): 608-618.
[8] 黎亢抗. 玉米醇溶蛋白纳米粒子的制备及其抗菌膜材料的研究[D]. 广州:华南理工大学,2013.
[9] 尹业充. 玉米醇溶蛋白基抗菌输送载体的构建及表征[D]. 广州:华南理工大学,2014.
[10] JOVE I J, DAVIDOV-PARDO G, LUDESCHER R D, et al. Fluorescence quenching study of resveratrol binding to zein and gliadin: Towards a more rational approach to resveratrol encapsulation using water-insoluble proteins [J]. Food Chemistry, 2015, 185: 261-267.
[11] LUO Y, ZHANG B, WHENT M, et al. Preparation and characterization of zein/chitosan complex for encapsulation of alpha-tocopherol, and its in vitro controlled release study [J]. Colloids and Surfaces B-Biointerfaces, 2011, 85(2): 145-152.
[12] 牛付阁, 王晨莹,刘枫等. 卵白蛋白-阿拉伯胶复合凝聚物为乳化剂的油包水型乳液性质研究[C]. 中国食品科学技术学会第十一届年会,杭州, 2014.
[13] RAEESI M, MIRABEDINI S M, FAMOOD R R. Preparation of microcapsules containing benzoyl peroxide initiator with gelatin-gum arabic/polyurea-formaldehyde shell and evaluating their storage stability [J]. Acs Applied Materials & Interfaces, 2017, 9(24): 20 818-20 825.
[14] WANG Y,CHEN L. Electrospinning of prolamin proteins in acetic acid: The effects of protein conformation and aggregation in solution [J]. Macromolecular Materials and Engineering,2012,297(9): 902-913.
[15] ULLOA P A,GUARDA A,VALENZUELA X,et al. Modeling the release of antimicrobial agents (thymol and carvacrol) from two different encapsulation materials [J]. Food Science and Biotechnology,2017,26(6): 1 763-1 772.
[16] LEE H,XU G,KHARAGHANI D,et al. Electrospun tri-layered zein/PVP-GO/zein nanofiber mats for providing biphasic drug release profiles [J]. International Journal of Pharmaceutics,2017,531(1): 101-107.
[17] 王丽娟. 玉米醇溶蛋白胶体颗粒的制备及应用研究[D]. 广州:华南理工大学,2014.
[18] ZHANG M,LI X,LI S,et al. Electrospun poly (l-lactide) /zein nanofiber mats loaded with Rana chensinensis skin peptides for wound dressing [J]. Journal of Materials Science-Materials in Medicine,2016,27(9): 135-136.
[19] JIANG Y N,MO H Y,YU D G. Electrospun drug-loaded core-sheath PVP/zein nanofibers for biphasic drug release [J]. International Journal of Pharmaceutics,2012,438(1-2): 232-239.
[20] JAFARI H,PIROUZIFARD M,KHALEDABAD M A,et al. Effect of chitin nanofiber on the morphological and physical properties of chitosan/silver nanoparticle bionanocomposite films [J]. International Journal of Biological Macromolecules,2016,92: 461-466.
[21] 李鑫,张伟,张彩云,等. 丹参酮ⅡA/玉米醇溶蛋白纳米复合纤维膜的制备和性能研究[J]. 中国新药杂志,2015,33(3): 16-43.
[22] COSSU A,WANG M S,CHAUDHARI A,et al. Antifungal activity against Candida albicans of starch Pickering emulsion with thymol or amphotericin B in suspension and calcium alginate films [J]. International Journal of Pharmaceutics,2015,493(2): 233-242.
LI Juan1,3, XU Xueer1,3, HU Weicheng2, YU Peibin3, LU Zhenjie1,3, CHEN Zhengxing1,3*
1(School of Food Science and Technology, Jiangnan University, Wuxi 214122, China)2(Jiangsu Key Laboratory for Eco-Agricultural Biotechnology around Hongze Lake (Huaiyin Normal University), Huaian 223300, China)3(National Engineering Laboratory for Cereal Fermentation Technology, Jiangnan University, Wuxi 214122, China)
ABSTRACT Zein-thymol nanofiber films were prepared by electrospinning in this study. The microstructure, contact angle, water vapor transmission rate, and the rate of releasing anti-bacterial substances from the film were investigated. The results showed that when the mass ratio of zein to thymol was 10∶1, the film exhibited a slow-releasing property. Moreover, the water vapor transmission rate of the film was 4.32 g·mm/(m2·h·kPa), and the contact angle was 104.36°. This demonstrated that the zein-thymol nanofiber film had good air permeability and hydrophobicity. Furthermore, the antibacterial effect of the film on Escherichia coli was effective when the ratio of zein to thymol was in a range of 5∶1-1∶1. The minimum and maximum diameters of inhibition zone was 8.68 mm and 20.42 mm, respectively. Besides, due to the safety of the film, it is suitable for medical purpose, such as medical wound dressings.
Key words electrospinning technology; zein; gum arabic; thymol; nanofiber; antibacterial film