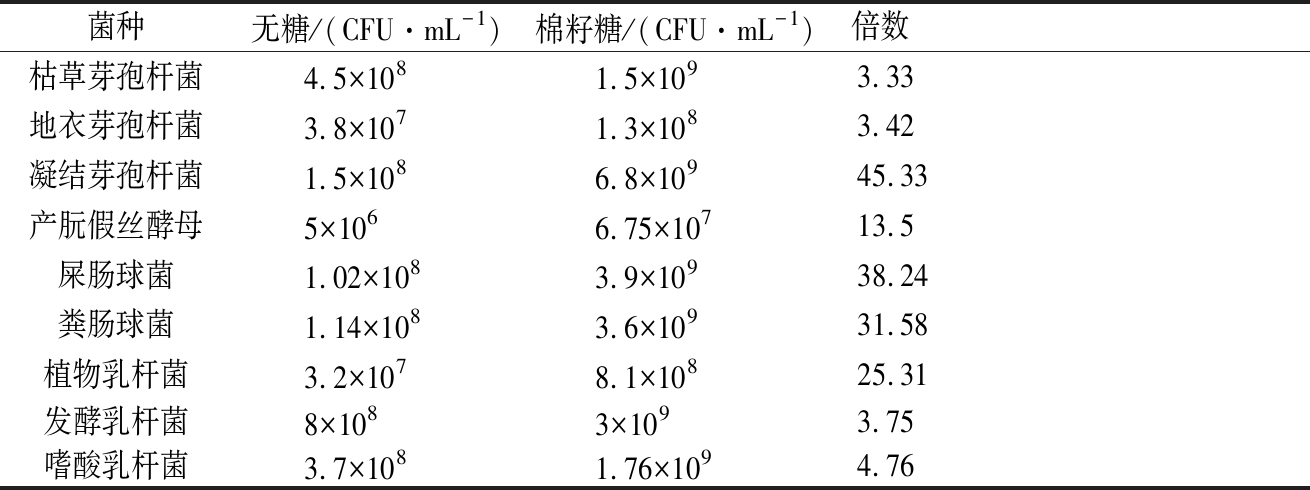
表1 不同菌种生物量
Table 1 Biomass of different strains
陈磊,刘羽彤,童群义*
(江南大学 食品学院,江苏 无锡,214122)
摘 要 为筛选出可高效利用棉籽糖的菌种并对其酶学性质进行研究,采用高效液相色谱法测定了棉籽糖含量,平板计数法测定菌种生长量,pNPG法测定α-半乳糖苷酶酶活。结果显示,该实验筛选出屎肠球菌、粪肠球菌和凝结芽孢杆菌3株可以高效利用棉籽糖的菌种,发酵后培养基中棉籽糖剩余含量分别为0、0.36%和1.05%(质 量分数)。屎肠球菌α-半乳糖苷酶最适pH值为5,最适温度为45 ℃。粪肠球菌α-半乳糖苷酶最适pH为5,最适温度为50 ℃。凝结芽孢杆菌α-半乳糖苷酶最适pH为8,最适温度为45 ℃。所产α-半乳糖苷酶具有较为稳定的酶学性质,可为今后饲料和食品中棉籽糖的去除提供研究方向。
关键词 棉籽糖利用;菌种筛选;酶学性质
第一作者:硕士研究生(童群义教授为通讯作者,E-mail:tqyjn@163.com)。
收稿日期:2019-01-22,改回日期:2019-02-26
DOI:10.13995/j.cnki.11-1802/ts.020041
我国作为一个农业大国,拥有大量的棉粕和豆粕资源,且棉籽与豆粕具有售价低、氨基酸组成合理等特点,是我国饲料原料的首选[1-2]。但由于棉籽和大豆中含有的抗营养因子——低聚糖,尤其是棉籽糖的含量较高,严重的影响了应用及营养因子的吸收利用。棉籽糖(raffinose)是一种由一分子的半乳糖、葡萄糖、果糖组成的功能性低聚糖,非还原糖,又称为蜜三糖、棉实糖、棉子糖,分子式为C18H32O16,相对分子质量为504.46。棉籽糖在热和酸的环境中有较强的稳定性[3],很难通过常规理化方法去除。
α-半乳糖苷酶(α-galactosidase)又称密二糖酶,能水解通过α-1, 6-键结合的末端半乳糖残基类物质(蜜二糖、棉籽糖、糖鞘脂、糖蛋白等)[4]。由于人和单胃动物体内不含有α-半乳糖苷酶,所以无法消化棉籽糖,棉籽糖在进入大肠后被发酵产酸产气,从而引起胀气、呕吐、腹泻等不良现象。利用α-半乳糖苷酶可将结构复杂的低聚半乳糖分解为小分子糖而成被利用,从而有效避免胀气等[5-6]。
此外α-半乳糖苷酶水解半乳甘露聚糖的侧链促进β-甘露聚糖酶水解[7],或通过转糖苷合成α-低聚半乳糖及其他重要的新型糖苷化合物[8]。微生物中α-半乳糖苷酶常见于细菌和真菌中,仅有少数来自于古菌。近年用于基因克隆和酶活高效表达的菌种有Bacteroides fragilis NCTC9343[9]、Dictyoglomus thernaophilum[10]、Mesorhizobium sp. JB07[11]、Porrtibacter sp.HJ8[12]、Neosartorya fischeri P1[13]、Talaromyces leycettanus JCM12802[14]。本实验旨在筛选出可以高效利用棉籽糖的菌种,并对其酶学性质进行研究,为含有棉籽糖原料中棉籽糖的消除应用研究提供参考。
由饲料工厂附近土壤中筛选和实验室保存的菌种。
对硝基苯α-D-半乳糖苷、对硝基酚、棉籽糖:麦克林公司;其余试剂均为国药集团化学试剂有限公司提供。
SJ-CJ-1FD超净工作台,苏净公司;GI80T灭菌锅,致微(厦门)仪器有限公司;UV-2800a型分光光度计,尤尼柯(上海)仪器有限公司;One Shot 1532型超高压破碎机,Constant Systems LTD;FE28型pH计,梅特勒-托利多公司;ZQZY-70BF型双层振荡培养箱,上海知楚仪器有限公司;GH-400BC型恒温培养箱,北京市永光明医疗仪器厂;RJ-TGL-1850R高速冷冻离心机,无锡瑞江分析仪器有限公司。
LB培养基(g/L):蛋白胨10,牛肉膏3,NaCl 5。
YPD培养基(g/L):胰蛋白胨10,葡萄糖20,酵母膏10。
MRS培养基(g/L):蛋白胨10,牛肉膏10,酵母粉5,葡萄糖20,三水醋酸钠5,吐温80 1,柠檬酸三铵2.0,K2HPO4 2.0,MgSO4·7H2O 0.2,MnSO4·4H2O 0.05。
发酵培养基:将上述生长培养基中的葡萄糖用等量的棉籽糖取代。
1.5.1 生物量的测定
取发酵液选择2~3个连续的适宜稀释浓度,每个稀释度分别吸取200 μL均匀涂布于培养基平板上,37 ℃恒温培养48 h后计数,每个浓度做 3次平行。
1.5.2 棉籽糖降解能力研究
棉籽糖含量采用GB 5009.258—2016测定。
1.5.3 α-半乳糖苷酶活力测定方法
α-半乳糖苷酶酶活测定参考GARROAO等[15]的方法并做适当修改。取适量发酵液,10 000×g离心15 min, 收集细胞沉淀。用柠檬酸钠缓冲液洗涤细胞体,悬浮于1 mL缓冲液中,置于高压细胞破碎机破壁,12 000×g离心20 min,上清液即为粗酶液。
将10 mmol/L pNPG溶液200 μL,柠檬酸缓冲液100 μL和粗酶液100 μL混合,37 ℃反应15 min,加入3 mL Na2CO3缓冲液,于405 nm处测定吸光度[15]。
1.5.4 酶学性质研究
1.5.4.1 α-半乳糖苷酶的最适pH和pH稳定性
将粗酶液在不同的pH下,以pNPG法37 ℃测定不同pH值下的酶活。以测得的最高值为100%,其余数据折算。
将粗酶液在37 ℃,不同pH缓冲液中反应2 h,以各pH值下反应15 min时测得的酶活为基准酶活(100%),其余的数据折算,绘制pH稳定性曲线。
1.5.4.2 α-半乳糖苷酶的最适温度和热稳定性
将粗酶液在不同的温度下,以pNPG法最适pH值下测定不同温度时的酶活。以测得的最高值为100%,其余数据折算。
将粗酶液在最适pH值时,不同温度中反应2 h,每30 min取样以pNPG法测定酶活,以各温度值时反应15 min时测得的酶活为基准酶活(100%),其余的数据折算,绘制热稳定性曲线。
1.5.4.3 不同金属离子对酶活的影响
用浓度为 10 mmol/L的Zn2+、Cu2+、Mn2+、Ca2+、Fe2+、Fe3+、K+、Na+、Mg2+、Pb2+、Co2+、Ni2+、Ag+、Hg2+溶液分别与粗酶液以1:1的比例进行混合,37 ℃保存1 h后,在最适条件下测定酶活。以未处理的酶液的酶活为100%计[16]。
1.5.4.4 粗酶液对蛋白酶的抗性研究
将粗酶液与1 g/L的胰蛋白酶、蛋白酶K、枯草杆菌蛋白酶A、碱性蛋白酶溶液按 10:1比例反应30 min, 按pNPG法测定酶的剩余酶活。以未处理的酶液的酶活为100%计[17]。
各菌种分别用无碳源培养基和棉籽糖为唯一碳源培养基分别培养48 h,梯度稀释后选取3个适宜的稀释度涂布平板,培养48 h后进行计数,结果如表1所示。
表1 不同菌种生物量
Table 1 Biomass of different strains

由表可知所有菌种都可利用棉籽糖进行生长,凝结芽孢杆菌、屎肠球菌、粪肠球菌在棉籽糖培养基中比无碳源培养基中分别高出了45.33、38.24、31.58倍,说明3种菌可更好地利用棉籽糖进行生长。
以GB 5009.258—2016所述方法测定发酵结束后棉籽糖的剩余含量,结果如表2所示。
表2 不同菌种对棉籽糖的降解能力 单位:%(质量分数)
Table 2 Degradation ability of different strains to raffinose
由表可以看出,发酵48 h小时后各菌种均表现出对棉籽糖良好的降解能力,乳酸菌表现出优于芽孢杆菌和酵母的分解能力。乳酸菌可分解85%以上的棉籽糖,屎肠球菌和粪肠球菌可以完全或基本完全分解棉籽糖。枯草芽孢杆菌和地衣芽孢杆菌分解能力低于乳酸菌,但凝结芽孢杆菌也表现出优异的分解棉籽糖的能力,发酵48 h可分解98.95%的棉籽糖。
由上述实验可看出屎肠球菌、粪肠球菌、凝结芽孢杆菌可利用棉籽糖进行良好的生长,并且3种菌都表现出优异的分解棉籽糖的能力,基于以上结果,本部分实验将进一步对3种菌的粗酶液的酶学性质进行研究。
2.3.1 α-半乳糖苷酶的最适温度和热稳定性
以pNPG法测定3种菌不同温度时的酶活,结果如图1所示。由图1可知,凝结芽孢杆菌和屎肠球菌的最适温度均为45 ℃,粪肠球菌的最适温度为50 ℃。 随着温度升高酶活逐渐增加,当达到最适温度后酶活随着温度的升高而快速下降。
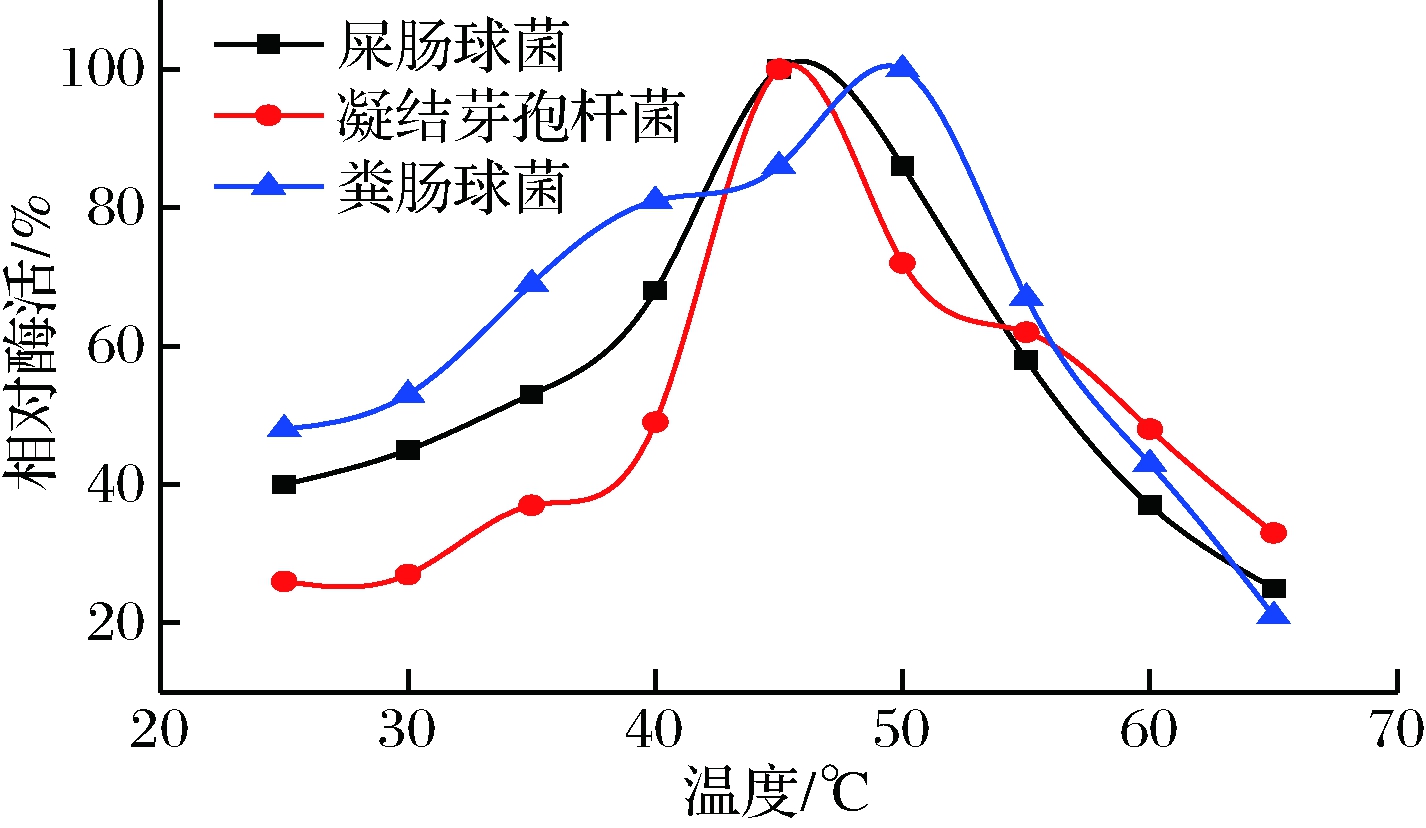
图1 不同菌种的α-半乳糖苷酶的最适温度
Fig.1 Optimum temperature of α-galactosidase from different strains
在实际生产中对酶的热稳定性有着不同的要求,例如在饲料加工工艺中关键控制点调质温度一般为55~65 ℃,制粒和膨化温度可达到70 ℃以上[16],且完整加工过程中物料会在高温环境下保持较长的时间,所以酶的热稳定性对于酶的应用至关重要。将3种粗酶液分别置于37、50、55、60、65 ℃下保持120 min,每30 min以pNPG法测定剩余酶活,结果如图2所示。由图可知:随着加热时间的延长酶活逐渐降低。粪肠球菌在37 ℃时酶活可保持较高水平,超过50 ℃后酶活严重下降,65 ℃, 120 min后基本失活。屎肠球菌在37和50 ℃酶活可保持在80%以上,55与60 ℃ 在120 min后酶活维持在45%以上,65 ℃时酶活仅剩20%。凝结芽孢杆菌在37和50 ℃时酶活可保持在90%以上,55 ℃时也可保持在近65%,在65 ℃ 时30 min仍可保持55%左右,但时间继续增加后酶活严重下降,酶活在120 min时为18%。3种α-半乳糖苷酶都表现出优于普通菌种[18-19]的热稳定性,但差于嗜热菌Neosartorya fischeri P1[20]、Geobacillus stearotherrnophilus[21]、新阿波罗栖热袍菌[22]所产α-半乳糖苷酶的热稳定性。

a-粪肠球菌;b-屎肠球菌;c-凝结芽孢杆菌
图2 α-半乳糖苷酶的热稳定性
Fig.2 Thermal stability of α-galactosidase
2.3.2 α-半乳糖苷酶的最适pH和pH稳定性
在37 ℃条件下,以pNPG法测定3种α-半乳糖苷酶在不同pH缓冲液时的酶活,结果如图3所示。

图3 不同菌种的α-半乳糖苷酶的最适pH
Fig.3 Optimum pH of α-galactosidase from different strains
由图3可以看出,粪肠球菌和屎肠球菌α-半乳糖苷酶在pH值为4~8具有较高的酶活,均可保持60%以上,最适pH值为5。凝结芽孢杆菌α-半乳糖苷酶最适pH值为8,其在6~11具有>60%的较高的酶活。
将粗酶液在37 ℃各pH值条件下反应120 min,以pNPG法测定3种酶在不同pH缓冲液时的剩余酶活,以各pH值时反应15 min时测得的酶活为基准酶活(100%),结果如图4所示。
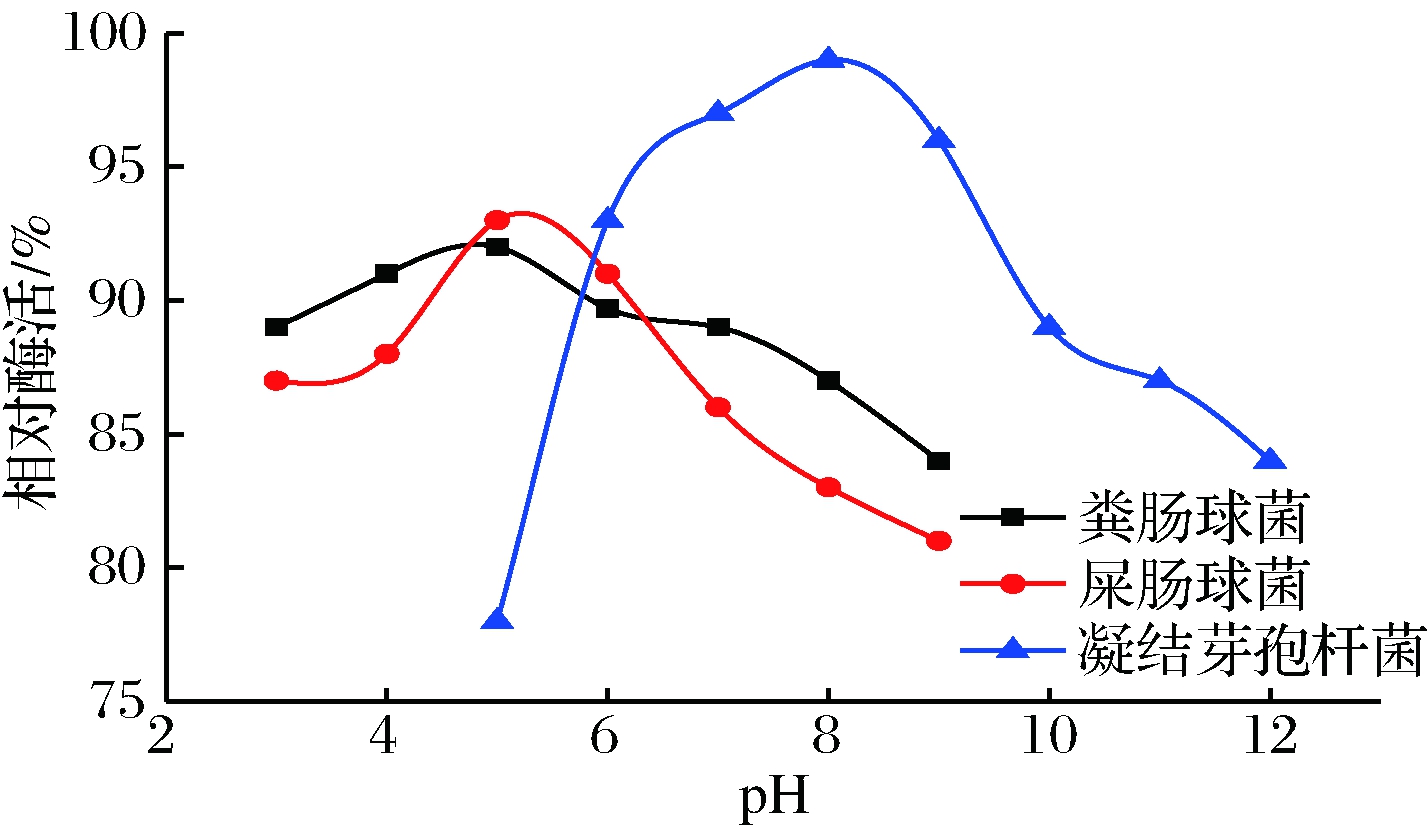
图4 不同菌种的α-半乳糖苷酶的pH稳定性
Fig.4 pH stability of α-galactosidase from different strains
由图4可知, 3种α-半乳糖苷酶在最适pH处都具有最高的稳定性。这与董岩岩[16]、DU[23]、HU[24]已报道的α-半乳糖苷酶的pH稳定性的结论相同,但与叶雪飞等[25]的结论相反。屎肠球菌和粪肠球菌α-半乳糖苷酶在pH 3~9都可保持在80%以上,但在最适pH处屎肠球菌α-半乳糖苷酶酶活高于粪肠球菌α-半乳糖苷酶。凝结芽孢杆菌α-半乳糖苷酶在pH 6~9具有90%以上的酶活,尤其是在最适pH处具有98%的相对酶活。
2.3.3 金属离子对α-半乳糖苷酶酶活的影响
由表3可以看出,不同金属离子对α-半乳糖苷酶有着不同的影响,且同一种金属离子对不同的α-半乳糖苷酶的影响程度也不尽同。
表3 金属离子对α-半乳糖苷酶酶活的影响
Table 3 Effect of metal ions on α-galactosidase activity
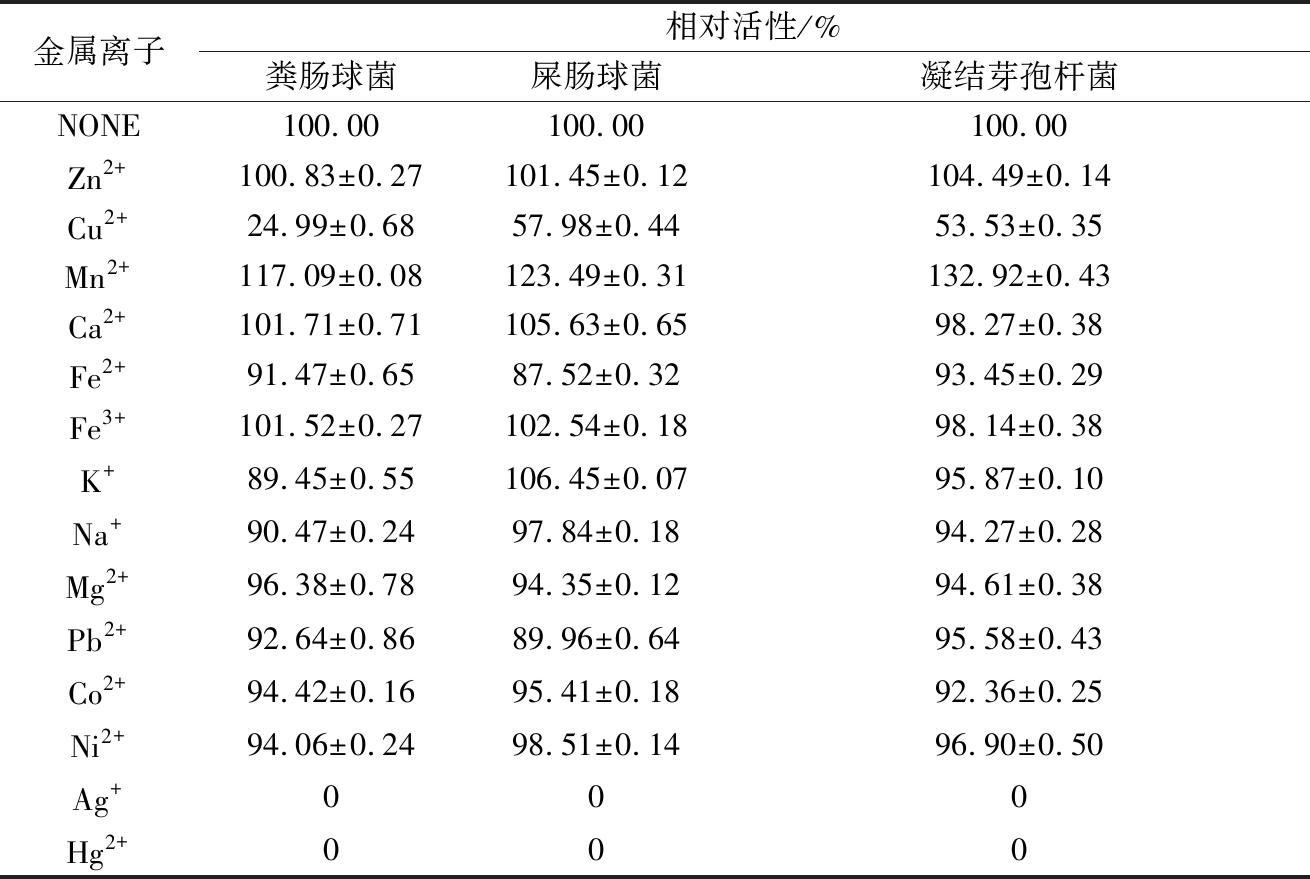
注:数据由3个独立试验的均值± SD所示。
大部分金属离子会对3种不同的α-半乳糖苷酶产生轻微的抑制作用,Zn2+离子对3种α-半乳糖苷酶有轻微的促进作用,Mn2+对α-半乳糖苷酶酶活具有明显的促进作用。Ag+、Hg2+可完全抑制3种不同的α-半乳糖苷酶的酶活,这也与之前的报导结果[24,26-27]相一致。
2.3.4 α-半乳糖苷酶对蛋白酶的抗性研究
将粗酶液与胰蛋白酶、蛋白酶K、枯草杆菌蛋白酶A、糜蛋白酶溶液按 10∶1比例反应30 min,按pNPG法测定酶的剩余酶活。由图5可看出,粪肠球菌α-半乳糖苷酶对蛋白酶K有较好的抗性,但对其余蛋白酶的抗性较差。屎肠球菌α-半乳糖苷酶对糜蛋白酶的抗性较差为72%,其余3种酶抗性较好均>80%。凝结芽孢杆菌α-半乳糖苷酶对4种蛋白酶均表现出优异的抗性,剩余酶活均>89%。
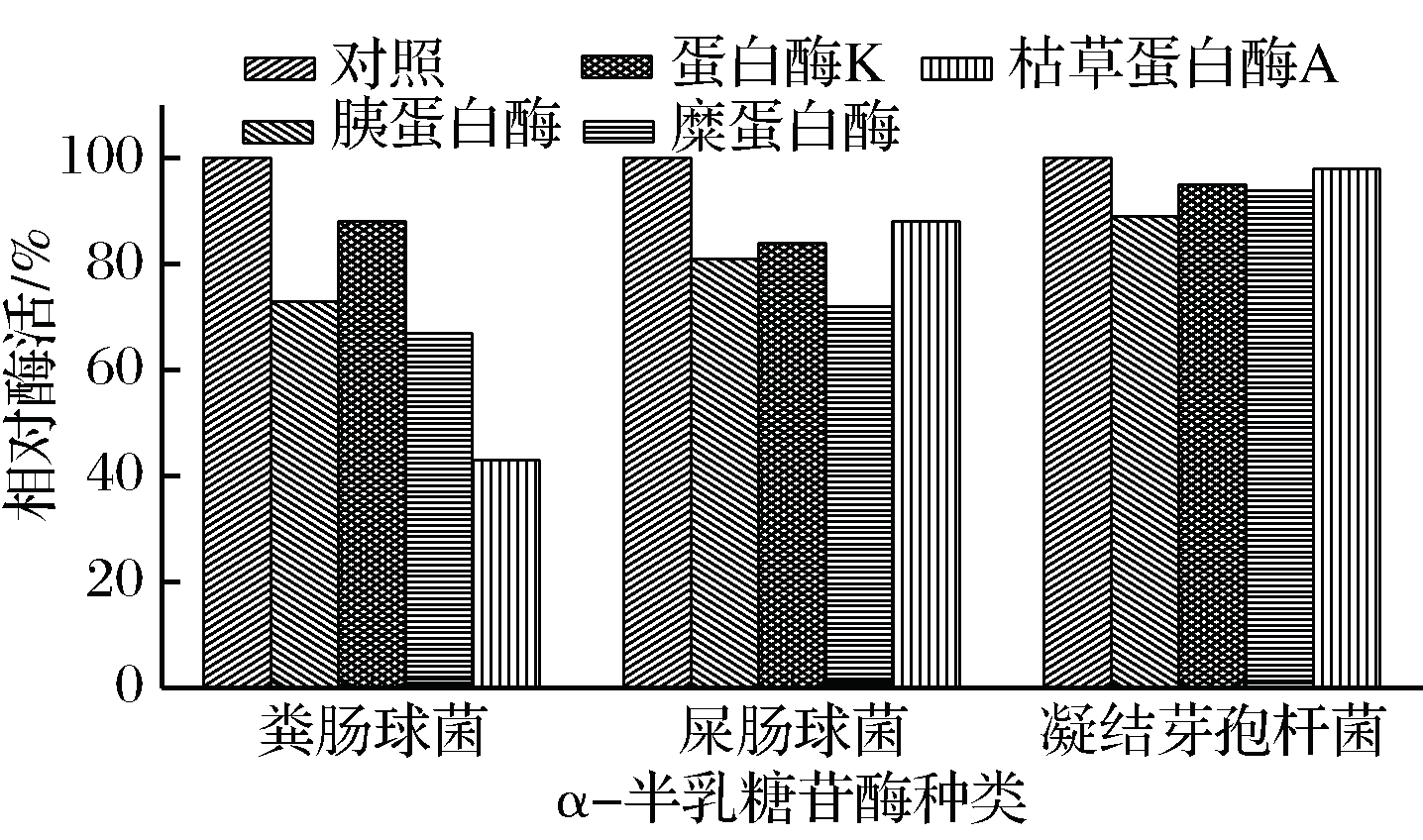
图5 蛋白酶对α-半乳糖苷酶酶活的影响
Fig.5 Effect of protease on α-galactosidase activity
从饲料工厂土壤中和实验室已保存菌种中筛选出了3种可高效利用棉籽糖的菌种,分别是屎肠球菌、粪肠球菌和凝结芽孢杆菌。
对粗酶液的酶学性质研究表明:屎肠球菌α-半乳糖苷酶最适温度为45 ℃,在55 ℃内有较高的热稳定性,对4种蛋白酶有较好的抗性。粪肠球菌α-半乳糖苷酶最适温度为50 ℃,对蛋白酶K有较好的抗性。屎肠球菌α-半乳糖苷酶与粪肠球菌α-半乳糖苷酶最适pH值均为5,在pH 3~9可保持较高酶活。凝结芽孢杆菌α-半乳糖苷酶最适温度为45 ℃,最适pH为8,在55 ℃内和pH 6~12可保持较高酶活,对4种蛋白酶有优异的抗性。Mn2+对3种α-半乳糖苷酶酶活具有明显的促进作用,Ag+、Hg2+可完全抑制其酶活。
本实验筛选到的3种菌种可为饲料、豆奶等中棉籽糖的消除提供理论基础。下阶段将对粗酶液进行高效表达并分离纯化得到高活性的α-半乳糖苷酶,并探究其实际应用效果。
参考文献
[1] 姚琨,李兆勇.发酵豆粕生产工艺的最新研究进展[J].饲料工业,2011,32(23):65-70.
[2] 方华,秀春源,银红娟.高赖氨酸发酵豆粕发酵条件的优化[J].粮食与饲料工业,2008(3):31-32.
[3] 周冬丽,宋伟光,郭文峰,等.棉籽低聚糖—棉籽糖研究概况[J].粮食与油脂,2010(12):39-41.
[4] KATROLIA P,RAJASHEKHARA E,YAN Q,et al. Biotechnological potential of microbial α-galactosidases[J].Critical Reviews in Biotechnology, 2014, 34(4):307-317.
[5] 邓春,易弋,李平,等.α-半乳糖苷酶的研究进展[J].食品工业,2016,37(2):255-260.
[6] ROOPASHRI A N.VARADARAJ M C. Hydrolysis of flatulence causing oligosaccharides by α-d-galactosidase of a probiotic Lactobacillus plantarum MTCC 5422 in selected legume flours and elaboration of probiotic attributes in soy-based fermented product[J].European Food Research and Technology, 2014, 239(1):99-115.
[7] MALGAS S,VAN DYK J S,PLETSCHKE B I.A review of the enzymatic hydrolysis of mannans and synergistic interactions between β-mannanase, β-mannosidase and α-galactosidase[J].World Journal of Microbiology and Biotechnology, 2015, 31(8):1 167-1 175.
[8] BAKUNINA I Y,BALABANOVA L A,PENNACCHIO A,et al. Hooked on α-d-galactosidases: From biomedicine to enzymatic synthesis[J].Critical Reviews in Biotechnology,2016,36(2):233-245.
[9] GONG W,XU L,GU G,et al. Efficient and regioselective synthesis of globotriose by a novel α-galactosidase from Bacteroides fragilis[J].Appl Microbiol Biotechnol,2016,100(15):6 693-6 702.
[10] CAROLA SCHRÖDER, JANZER V A, SCHIRRMACHER G,et al. Characterization of two novel heat-active α-galactosidases from thermophilic bacteria[J]. Extremophiles, 2016, 21(1):1-10.
[11] ZHOU J,LU Q,ZHANG R,et al. Characterization of two glycoside hydrolase family 36 α-galactosidases:Novel transglycosylation activity, lead-zinc tolerance, alkaline and multiple pH optima, and low-temperature activity[J].Food Chemistry,2016,194:156-166.
[12] ZHOU J, LIU Y, LU Q, et al. Characterization of a glycoside hydrolase family 27 α-galactosidase from pontibacter reveals its novel salt-protease tolerance and transglycosylation activity[J].Journal of Agricultural and Food Chemistry, 2016:64(11):2 315-2 324.
[13] WANG H, MA R,SHI P, et al. Insights into the substrate specificity and synergy with mannanase of family 27 α-galactosidases from neosartorya fischeri, P1[J].Applied Microbiology and Biotechnology, 2015, 99(3):1 543-1 543.
[14] WANG C,WANG H,MA R,et al. Biochemical characterization of a novel thermophilic a-alactosidase from Talarorrayces leycettanus JCM12802 with significant transglycosylation activity[J]. Journal of Bioscience and Bioengineering, 2016, 121 (1):7-12.
[15] GARRO M S, VALDEZG F D, GIORI G S D.Temperature effect on the biological activity of Bifidohacterium lougum CRL 849 and Lactobacillus fermentum CRL 251 in pure and mixed cultures grown in soymilk[J].Food Microbiology,2004,21(5):511-518.
[16] 董岩岩,张燕婕,黄遵锡,等.产α-半乳糖苷酶菌株的筛选、鉴定及其酶学特性的研究[J].饲料工业,2011,32(14):20-25.
[17] 刘小丹.来源于Pedobacter sp.MJ11的α-半乳糖苷酶基因克隆、表达及其性质研究[D].哈尔滨:东北农业大学,2009.
[18] 王剑锋,陈今朝,李江,等.根霉胞内α-半乳糖苷酶的分离及其酶学性质[J].食品与发酵工业,2012,38(5):65-69.
[19] 许尧兴,李艳丽,柳永,等.黑曲霉变种RM48 α-半乳糖苷酶的分离纯化及其酶学性质研究[J].浙江大学学报(农业与生命科学版),2009,35(2):147-152.
[20] WANG H, SHI P, LUO H, et al. A thermophilic α-galactosidase from Neosartorya fischeri P1 with high specific activity, broad substrate specificity and significant hydrolysis ability of soymilk[J]. Bioresource Technology, 2014, 153:361-364.
[21] KING M R,WHITE B A,BLASCHEK H P,et al. Purification and characterization of a thermostable α-galactosidase from Thermoanaerobacterium polysaccharolyticum[J]. J Agric Food Chem, 2002, 50(20):5 676-5 682.
[22] 毕云枫,徐琳琳,姜珊,等.Thermotoga neapolitana中α-半 乳糖苷酶基因的克隆表达与酶学性质研究[J].中国酿造,2017,36(1):61-65.
[23] DU F,ZHU M,WANG H,et al. Purification and characterization of an α-galactosidase from Phaseolus coccineus seeds showing degrading capability on raffinose family oligosaccharides[J]. Plant Physiology and Biochemistry,2013,69:49-53.
[24] HU Y,ZHU M,TIAN G,et al. Isolation of a protease-resistant and pH-stable α-galactosidase displaying hydrolytic efficacy toward raffinose family oligosaccharides from the button mushroom Agraicus bisporus[J]. International Journal of Biological Macromolecules,2017,104(PtA):576-583.
[25] 叶雪飞,阮晖,李青青,等.产α-半乳糖苷酶乳酸菌的筛选及酶学特性研究[J].中国食品学报,2009,9(4):64-69.
[26] CAO Y,YUAN T,SHI P,et al.Properties of a novel α-galactosidase from Streptomyces sp.S27 and its potential for soybean processing[J]. Enzyme and Microbial Technology,2010,47(7):305-312.
[27] HU Y,TIAN G,GENG X,et al.A protease-resistant α-galactosidase from Pleurotus citrinopileatus with broad substrate specificity and good hydrolytic activity on raffinose family oligosaccharides[J]. Process Biochemistry,2016,51(4):491-499.
CHEN Lei, LIU Yutong,TONG Qunyi*
(School of Food Science and Technology, Jiangnan University, Wuxi 214122,China)
ABSTRACT This study aimed to screen strains that could efficiently utilize raffinose and to illustrate their enzymatic characteristics. The raffinose content, strain growth, and α-galactosidase activity were measured. The isolates that could efficiently utilize raffinose belonged to Enterococcus faecium, Enterococcus faecalis, and Bacillus coagulans. The residual contents of raffinose in the medium after fermenting with E. faecium, E. faecalis, and B. coagulans were 0, 0.36%, and 1.05%, respectively. The optimum pH of the α-galactosidase from E. faecium, E. faecalis and B. coagulans were 5, 5, and 8, respectively, and the optimum temperatures were 45 ℃, 50 ℃ and 45 ℃, respectively. This study provides research directions for removing raffinose from feeds and foods in the future.
Key words raffinoseutility; strain screening; enzymatic properties