邝小贤1,2,张敏婕1,2,何冠浩1,2,卢迪勋1,2,谭俊豪1,2,康梦3,刘飞4,方祥1,曹庸1,2,苗建银1,2*
1(华南农业大学 食品学院,广东 广州,510642)2(广东省功能食品活性物重点实验室,广东 广州,510642) 3(东北农业大学 食品学院,黑龙江 哈尔滨,150030)4(广州绿萃生物科技有限公司,广东 广州,510665)
摘 要 为研究乳源锌螯合肽酶解制备最佳工艺条件及其螯合特性,从而为促锌吸收活性物质的研究提供基础,以牛乳酪蛋白为原料,以锌螯合率为指标,确定胰蛋白酶酶解制备锌螯合肽的最佳工艺条件,并对最优条件下酶解物的分子质量分布及氨基酸组成进行测定,同时通过傅里叶变换红外扫描和紫外扫描手段对酶解物和肽锌复合物进行结构表征对比分析。结果显示,最佳酶解条件为时间3 h,温度50 ℃,pH 8.5,底物质量浓度为70 g/L,加酶量0.6%(质量分数)。最佳条件下,酶解物的锌螯合率为87.78%,分子肽分子质量小,人体必需氨基酸含量丰富。螯合前后光谱存在明显差异,Zn2+与羧基等进行了配位结合。乳源锌螯合肽具有较高的锌螯合活性,实验结果为补锌剂的生产应用奠定了基础。
关键词 牛乳酪蛋白;酶解;锌螯合肽;分子质量分布;氨基酸组成;螯合特性
第一作者:本科生(苗建银副教授为通讯作者,E-mail:miaojy8181 @scau.edu.cn)。
基金项目:广东省自然科学基金(2016A030310442);国家自然科学基金青年基金(31601474);广州市科技计划项目(201707010415);广东省高等教育教学改革项目(粤教高函[2016]166号);华南农业大学教育教学改革与研究项目(JG16012)
收稿日期:2018-10-09,改回日期:2019-01-19
DOI:10.13995/j.cnki.11-1802/ts.019192
自1979年发现了具有类吗啡活性的短肽[1]以来,酪蛋白来源的生物活性肽研究进展迅速,日趋成为乳品领域研究的焦点[2-4]。酪蛋白占牛乳蛋白总量的78.8%[5],其中含有人体必需的8种氨基酸。经不同的酶水解可得到具有不同生物活性[6]的酪蛋白肽,是不同氨基酸的混和物。与游离氨基酸相比,这些小分子多肽更易被机体较快地吸收利用,而且它们具有的多种特殊生理功能也十分有价值,如免疫调节、延缓衰老、促进矿物质吸收[7]等。
人体中元素锌含量占体重的0.002%,是重要的微量金属元素之一,是机体内近2 000种转录因子的必需组成部分。在人类酶中,锌与超过300种代谢酶的活性有关[8]。因此细胞中的锌直接调节着这些酶的活性,在机体代谢中有重要作用[9]。然而,由于人体内的吸收代谢种种因素限制而造成的锌缺乏,已成为我国及许多发展中国家的公共卫生问题[10]。缺锌最常见的症状是味觉减退、厌食、人体细胞免疫功能低下,以及消瘦、下肢浮肿、皮肤溃疡和生长延迟[11]。近年来,利用锌肽螯合技术提高锌的吸收成为研究热点[12-13],因为螯合物结构为Zn2+嵌合在2个肽分子中,肽分子像“蟹钳”一样钳着Zn2+,形成稳定的螯合结构,利用可以直接通过肠黏膜细胞进入血液的小肽带着Zn2+一起进入机体进而促进人体吸收。机体通过合成蛋白质的中间产物肽锌复合物,在提高锌离子吸收效率的同时,也减少了许多生化过程及能量消耗,具有较高的生物学效价[14],为促锌吸收活性物质的研究提供基础。
水解酪蛋白的方法主要有3种:物理法,化学法,酶解法。物理水解一般有加热和高温两种,其中HUSTINX等[15-16]对加热法水解酪蛋白进行了探讨。而化学水解主要是利用酸、碱进行水解,杨叶昆等[17]用盐酸对酪蛋白的水解实验中,酪蛋白的水解度约为75%。当前应用最为普遍的方法是酶解法[18],因酶解法的条件温和,水解过程易于控制,水解产生的副反应小,水解产物氨基酸组成更接近原料,是水解酪蛋白的最佳方法[19]。人体消化道中酪蛋白的酶解常以胰蛋白酶为主,为模拟肠道消化机理,本研究将以胰蛋白酶进行实验,优化胰蛋白酶对酪蛋白酶解程度以达到最佳促锌吸收效果。
综上,本文以牛乳酪蛋白为原料,以胰蛋白酶为水解酶进行水解工艺的研究,通过单因素实验和正交试验获得酶解的最佳工艺条件,旨在得到含有最强活性的促锌吸收蛋白肽,并对酶解物的分子质量分布及氨基酸组成进行分析,同时通过紫外扫描、傅里叶变换红外光谱技术对肽锌复合物的螯合特性进行研究。本研究可为乳源锌螯合肽作为补锌剂的开发和应用提供技术支持和参考。
酪蛋白,广州绿萃生物科技有限公司;胰蛋白酶(酶活力1.3×106 U/g),诺维信(中国)生物技术有限公司;乙酸锌(分析纯),天津市福晨化学试剂厂;乙二胺四乙酸二钠(分析纯),天津市大茂化学试剂厂;其余试剂为国产分析纯。
pH计,赛多利斯科学仪器(北京)有限公司;HH-4数显恒温水浴锅,金坛市华城海龙实验仪器厂;HZS-H水浴振荡器,哈尔滨市东联电子科技开发有限公司;UV-3010紫外-可见光谱仪,日本日立公司;Vertex70傅立叶变换红外光谱仪,布鲁克公司;LC-10ATVP高效液相色谱仪,日本岛津仪器有限公司;JA2003电子天平,上海舜宇恒平科学仪器有限公司;DHG-9070电热恒温鼓风烘干箱,上海齐欣科学仪器有限公司。
1.3.1 牛乳酪蛋白酶解物制备
称取牛乳酪蛋白于5 mL离心管,调节pH,按预定加酶量加入胰蛋白酶,设定预定温度后在水浴锅中振荡酶解。所得酶解物经90 ℃加热10 min灭酶,冷却至室温,精确调pH至4.6,使未酶解的酪蛋白沉淀,随后4 000 r/min离心20 min,取上清液即得牛乳酪蛋白酶解物。
1.3.2 单因素试验
1.3.2.1 酶解时间对锌螯合活性的影响
在加酶量0.5%(质量分数),底物质量浓度60 g/L,pH 8.0,酶解温度50 ℃条件下分别酶解1、2、3、4、5、6 h, 灭酶、离心,测定离心上清液锌螯合活性。
1.3.2.2 加酶量对锌螯合活性的影响
调节pH至8.0,底物质量浓度60 g/L,分别按质量分数0.3%、0.5%、0.7%、0.9%加入酶,50 ℃条件下酶解3 h,灭酶、离心,测定离心上清液锌螯合活性。
1.3.2.3 底物浓度对锌螯合活性的影响
调节pH至8.0,加酶量0.5%,底物质量浓度分别为40、60、80、100 g/L的酶解体系于50 ℃条件下酶解3 h,灭酶、离心,测定离心上清液锌螯合活性。
1.3.2.4 温度对锌螯合活性的影响
调节pH至8.0,加酶量为0.5%,底物质量浓度60 g/L,分别在40、45、50、55 ℃下酶解3 h,灭酶、离心,测定离心上清液锌螯合活性。
1.3.2.5 酶解pH对锌螯合活性的影响
在加酶量0.5%,底物质量浓度60 g/L,pH分别为7.5、8.0、8.5、9.0,酶解温度50 ℃条件下酶解3 h,灭酶、离心,测定离心上清液锌螯合活性。
1.3.3 正交试验
以酶解物锌螯合活性为评价指标,在单因素试验基础上选取底物浓度、酶解温度、酶解pH、加酶量为试验因素,选用L9(34)正交表进行4因素3水平正交实验优化,确定胰蛋白酶酶解牛乳酪蛋白制备锌螯合肽的最佳条件。
1.3.4 锌螯合活性测定
1.3.4.1 肽锌复合物制备
根据本课题组螯合条件优化结果,取3 mL 0.05 mol/L 的Zn2+溶液(乙酸锌溶液)于50 mL离心管中,加入3 mL牛乳酪蛋白酶解物,将混合液调pH至5.0。47 ℃振荡水浴80 min,加入5倍体积无水乙醇混匀以便去除游离锌。混合物4 000 r/min离心20 min, 所得沉淀用20 mL无水乙醇再次混匀清洗,4 000 r/min 离心20 min,沉淀即肽锌复合物。随后在55 ℃烘箱干燥至恒重。
1.3.4.2 锌螯合率测定
采用乙二胺四乙酸滴定法。将在步骤1.3.4.1获得的每份肽锌复合物称量后,加入10 mL NH3-NH4Cl缓冲溶液溶解,后滴入2滴铬黑T指示剂,用0.01 mol/L的乙二胺四乙酸二钠滴定,溶液由紫色变为淡蓝色停止滴定,记录消耗乙二胺四乙酸二钠的体积,按公式(1)、(2)计算锌的螯合率:
![]()
(1)
式中,X ,肽锌复合物含锌量,%;M为锌的摩尔质量,g/mol;C,乙二胺四乙酸二钠的浓度,mol/L;V,滴定乙二胺四乙酸二钠的体积,mL;m,称取肽锌复合物的质量,g。
![]()
(2)
式中,Y,锌的螯合率,%;X ,肽锌复合物含锌量,%;m,肽锌复合物的质量,g;m’,锌的投入量,g。
1.3.5 肽相对分子质量分布测定
待测样品溶液经0.45 μm微孔过滤膜过滤后上TSKgel G2000色谱柱,以胰岛素(MW5808)、杆菌肽(MW1422)、甘氨酸-甘氨酸-酪氨酸-精氨酸(MW451)、甘氨酸-甘氨酸-甘氨酸(MW=189)为标准品,测定样品的相对分子质量分布。高效液相色谱条件:岛津高效液相色谱仪(配紫外检测器);色谱柱为TSKgel G2000 SWXL(300 mm×7.8 mm);流动相为V(乙腈)∶V(水)∶V(三氟乙酸)=20∶80∶0.1;检测波长为220 nm;流速为0.5 mL/min;柱温为室温。
1.3.6 氨基酸组成分析
参照GB 5009.124—2016食品安全国家标准对样品中氨基酸进行测定分析。
1.3.7 紫外扫描分析
用去离子水将锌螯合肽酶解物及肽锌复合物分别配制成10 g/L溶液,采用全自动紫外扫描仪分别进行全波长扫描,扫描200~400 nm,分析小肽进行螯合反应前后其吸光度的变化情况,以去离子水作为空白调零。
1.3.8 傅里叶变换红外光谱分析[20]
分别取锌螯合肽酶解物以及肽锌复合物样品经提纯后,除去样品中的游离水或结晶水,将固体样品2 mg和干燥的光谱纯KBr 200 mg放入玛瑙研钵中,混合研磨均匀(在红外灯下进行),使其粒度在2.5 μm以下,装入压片模具,抽气加压,压力约为60 MPa,维持5 min。卸掉压力得到透明的薄片,放入岛津红外光谱仪进行扫描分析,在400~4 000 cm-1测定其红外吸收光谱。
2.1.1 酶解时间对锌螯合活性的影响
酶解时间对牛乳酪蛋白酶解物锌螯合率的影响如图1所示。

图1 酶解时间对牛乳酪蛋白酶解物锌螯合率的影响
Fig.1 Effect of enzymatic hydrolysis time on zinc chelation rate of casein hydrolysate
在1~3 h,锌螯合率随酶解时间的延长缓慢增长,当酶解时间为3 h时,酶解物锌螯合率达到最大值73.30%。随着酶解时间继续延长,锌螯合率急速下降。因此可知,酶解时间适当,酶解程度适中时,酶解物锌螯合率更高,而当酶解时间越长,酶解物锌螯合率反而降低。所以选取3 h为酶解最适时间。
2.1.2 pH值对锌螯合活性的影响
在其他因素不变的条件下,图2表示在不同的酶解pH下测定pH值对牛乳酪蛋白酶解物锌螯合率的影响。由图2可知,随pH的增大,牛乳酪蛋白酶解物锌螯合率的总趋势逐渐增高。在pH=8.0时,锌螯合率达到最大值74.50%。当pH增大时,锌螯合率有所下降并波动。因此,选取pH=8.0为酶解的最适pH。

图2 酶解pH对牛乳酪蛋白酶解物锌螯合率的影响
Fig.2 Effect of pH on zinc chelation rate of casein hydrolysate
2.1.3 酶解温度对锌螯合活性的影响
不同酶解温度对酶解物锌螯合率的影响见图3。可以看出,酶解温度在50 ℃时,锌螯合率出现峰值,锌螯合率为83.79%,继续升高温度至55 ℃,锌螯合率下降较快。原因可能是酶解温度高于50 ℃时,升温对酶活力有抑制作用,影响酶解效果。最终确定50 ℃为该酶解实验的最适温度。
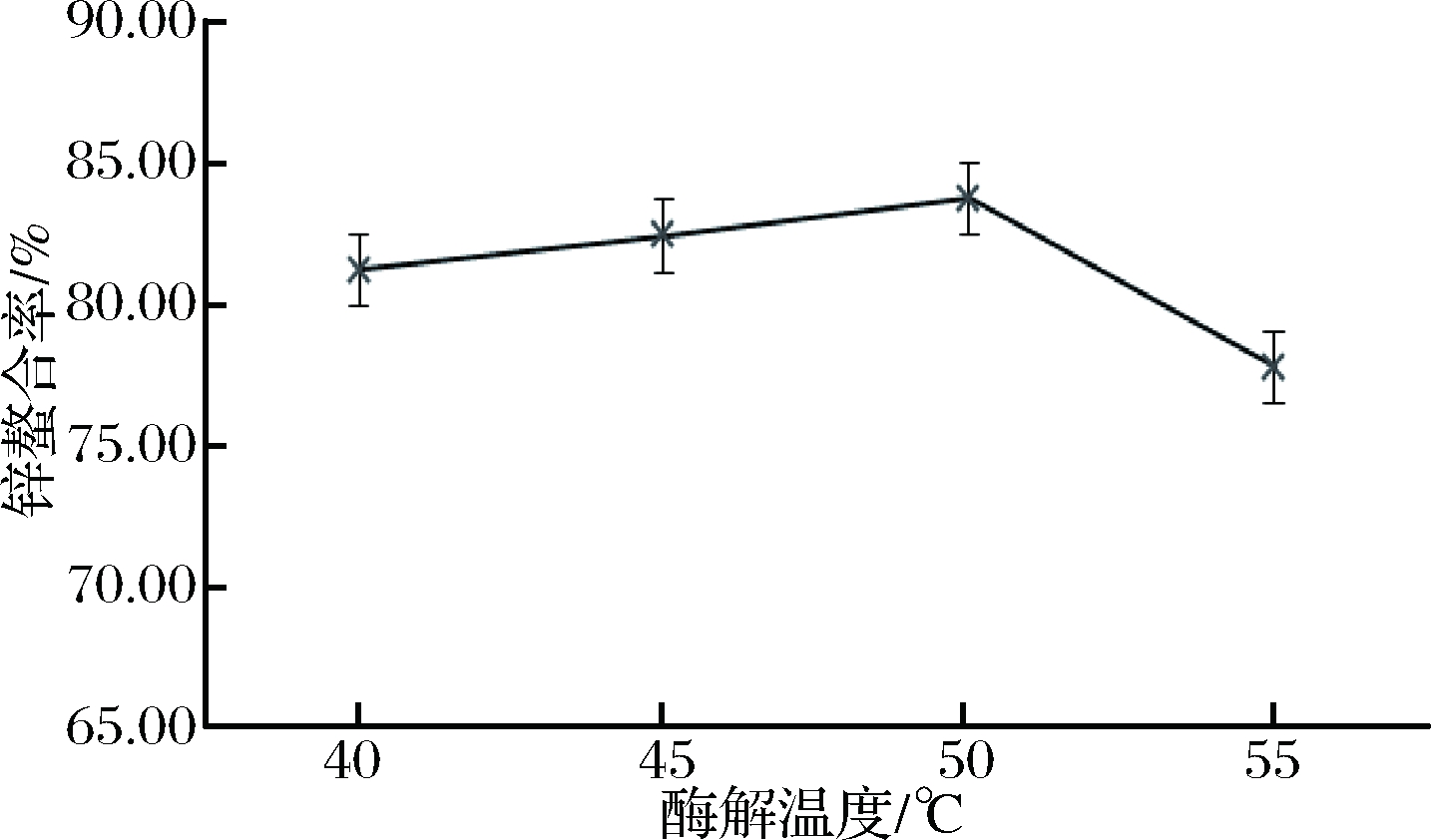
图3 酶解温度对牛乳酪蛋白酶解物锌螯合率的影响
Fig.3 Effect of temperature on zinc chelation rate of casein hydrolysate
2.1.4 底物质量浓度对锌螯合活性的影响
不同底物质量浓度对酪蛋白酶解物锌螯合率的影响如图4。可以看出,当底物质量浓度为40 g/L时,酶解物锌螯合率较低,增加为60 g/L时,锌螯合率达到最大值为79.14%。继续增加到80 g/L以后,酶解物锌螯合率趋于平稳。因此,确定最优酶解底物质量浓度是60 g/L。
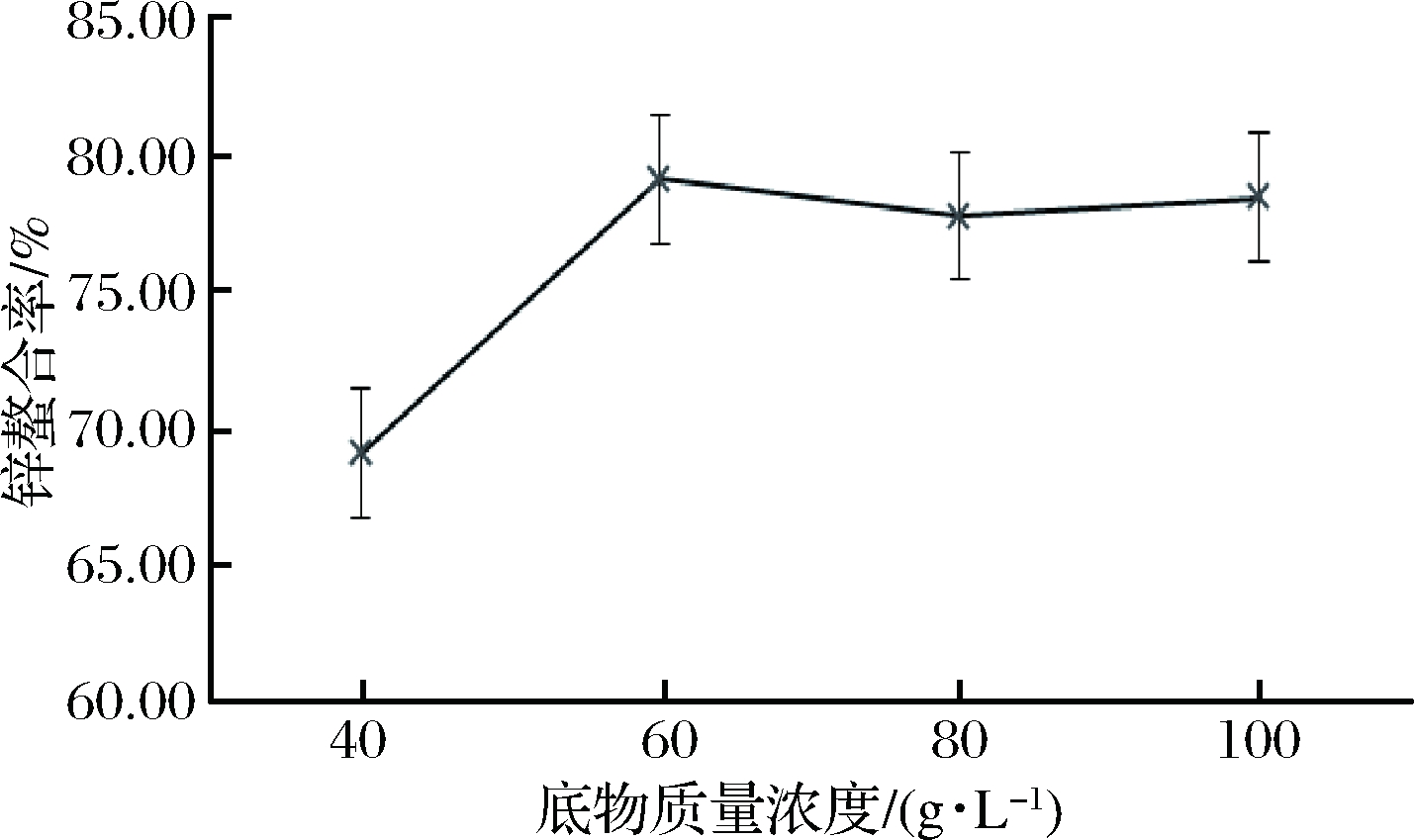
图4 底物质量浓度对牛乳酪蛋白酶解物锌螯合率的影响
Fig.4 Effect of substrate concentration on zinc chelation rate of casein hydrolysate
2.1.5 加酶量对锌螯合活性的影响
图5表示了不同加酶量对酪蛋白酶解物锌螯合率的影响。一般而言,在底物浓度充足的情况下,加酶量越多,酶解效果越好。可以看出加酶量为0.5%时,酶解物锌螯合率最高,继续增加胰蛋白酶用量,锌螯合率反而下降,原因可能是酶解过于彻底,分子质量小的分子肽螯合活性低。综合实验效果和经济考虑,加酶量为0.5%时最为合适。
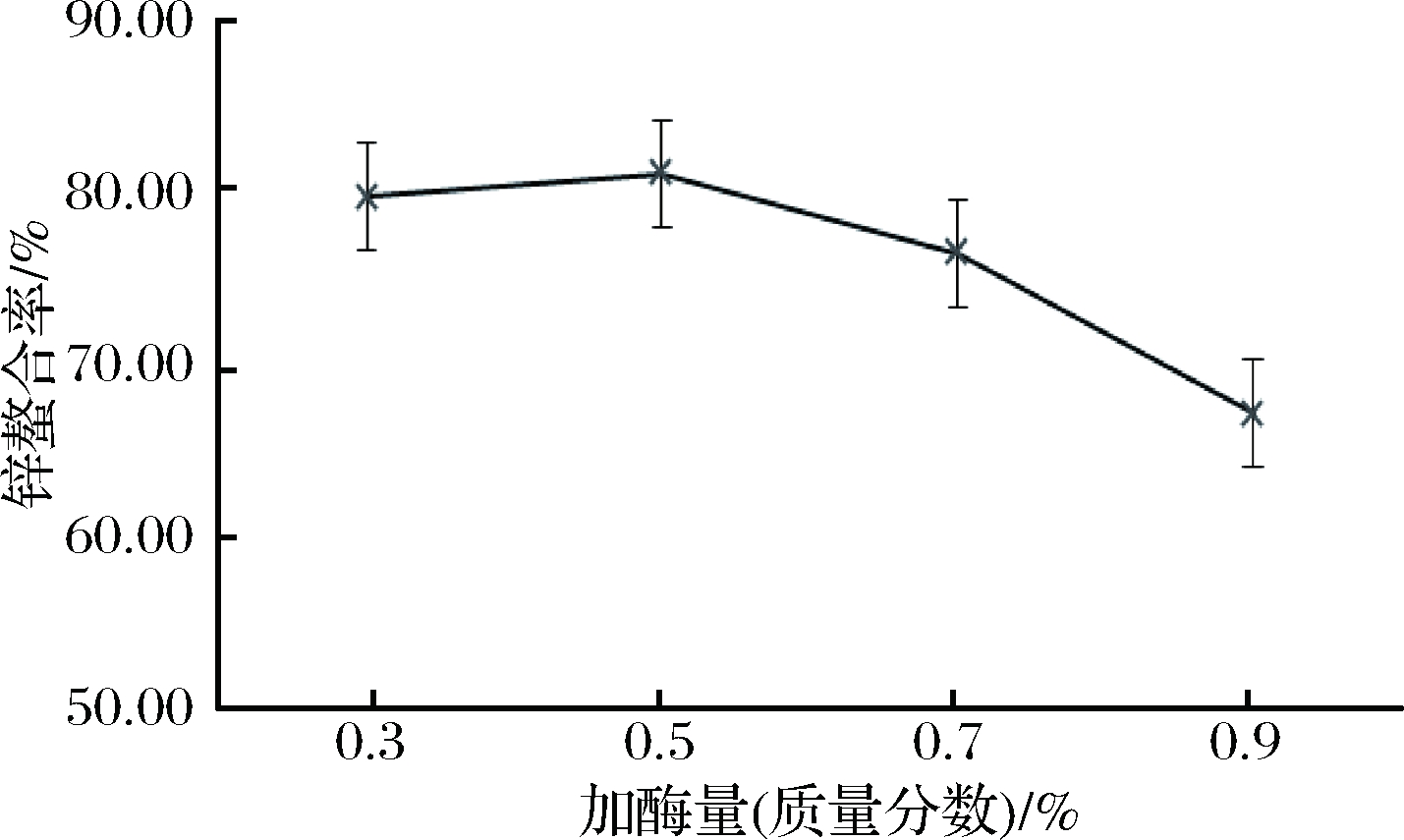
图5 加酶量对牛乳酪蛋白酶解物锌螯合率的影响
Fig.5 Effect of enzyme content on zinc chelation rate of casein hydrolysate
在单因素试验基础上,以底物浓度、酶解温度、酶解pH、加酶量为试验因素,设置3个不同的水平,如表1所示。
表1 影响胰蛋白酶酶解酪蛋白因素的 正交试验水平设计
Table 1 Orthogonal design of factors affecting casein Hydrolysis by trypsin
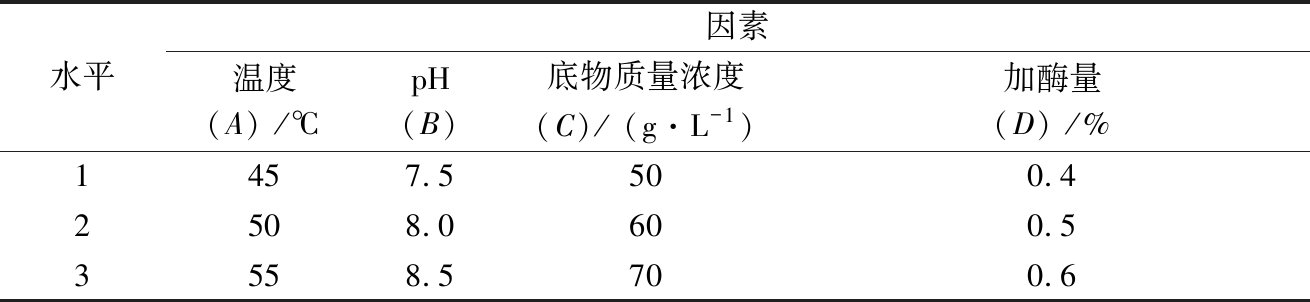
选用L9(34)正交表,安排9组试验。以酶解物锌螯合率为评定指标,确定胰蛋白酶酶解牛乳酪蛋白的最佳条件组合和各条件影响效果排序。
由表2中R值可知,试验中加酶量对牛乳酪蛋白酶解物锌螯合率影响最大,其次为酶解pH,而影响最小为酶解温度。这4个因素的主次关系是加酶量>酶解pH>底物质量浓度>酶解温度。胰蛋白酶水解牛乳酪蛋白的最佳工艺组合为A2B3C3D3,即:底物质量浓度70 g/L,初始pH 8.5,温度50 ℃,加酶量为0.60%。为验证正交试验优选工艺条件,将优选组合进行验证试验。酶解时间均采取3 h。通过试验得出锌螯合率为87.78%。该优选结果为胰蛋白酶水解牛乳酪蛋白的最佳工艺条件,即酪蛋白质量浓度70 g/L, 加酶量0.60%,初始酶解pH 8.5,于50 ℃下酶解3 h,最终水解产物中锌螯合率达到实验组中的最大值,87.78%。
表2 胰蛋白酶水解牛乳酪蛋白的正交优化试验结果
Table 2 Results of orthogonal optimization test on hydrolysis of casein from milk by trypsin
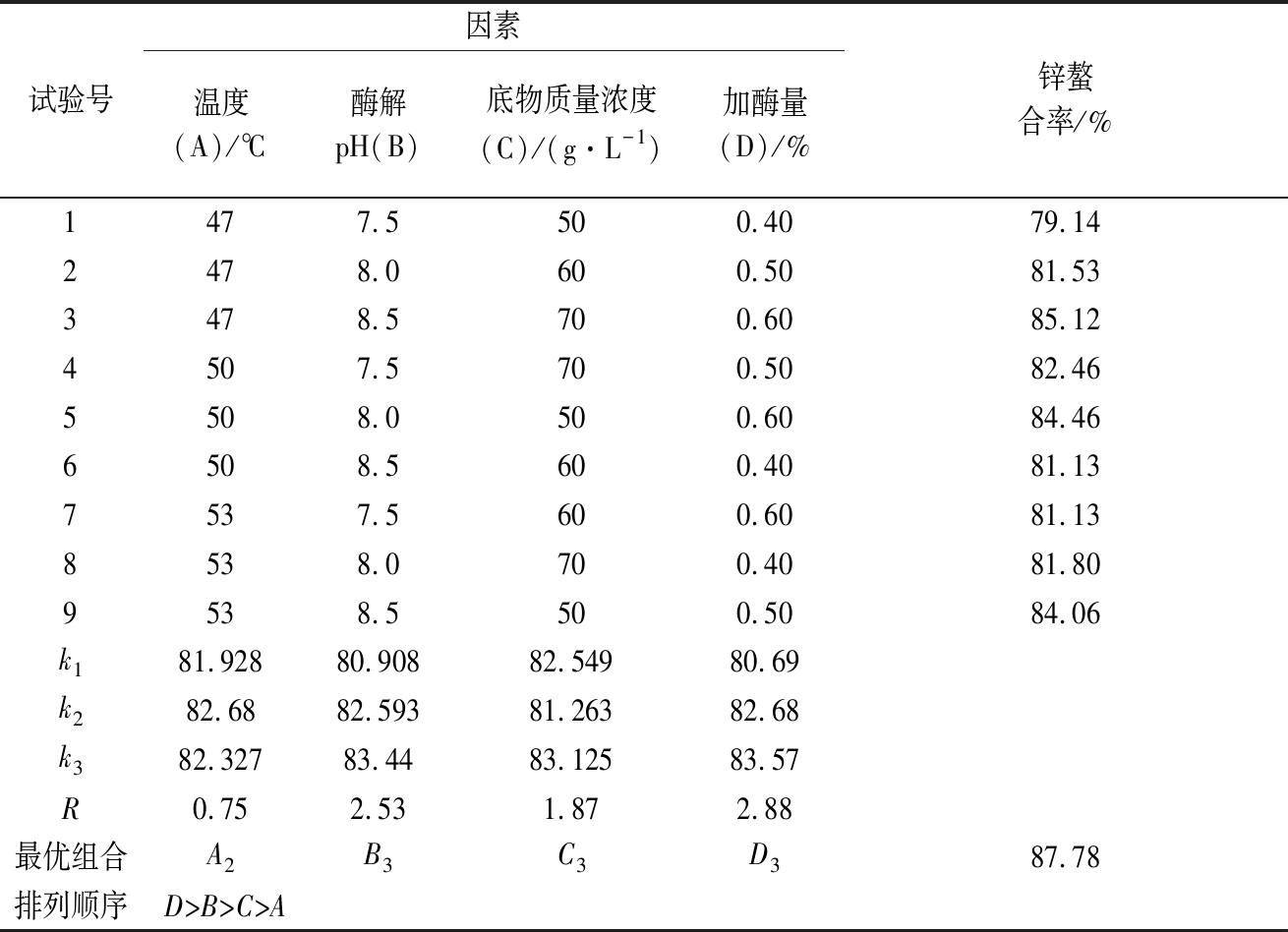
表3为在最优组合条件下酶解后,利用高效凝胶过滤色谱法检测的牛乳酪蛋白酶解物的分子质量结果。根据结果可知,分子质量>3 000 Da的肽类仅占4.53%,而分子质量<1 000 Da的小分子肽占65.26%,分子质量<500 Da的酪蛋白酶解物占了39.47%, 按照氨基酸平均相对分子质量为137 Da计算,酶解物主要由八肽以下的小分子肽段构成,并且四肽至八肽所占比例最高。可知牛乳酪蛋白酶解充分,大部分酶解物分子质量较小。表3可表明,酪蛋白酶解物作为螯合反应的蛋白源较好,因肽的分子质量越小越容易与金属离子反应形成水溶性螯合物[21-22],推测因分子质量小可以暴露多肽内部的活性基团[23]或肽链的空间位阻小。
表3 牛乳酪蛋白酶解物分子质量分布
Table 3 Molecular weight distribution of casein hydrolysates in milk
肽的金属离子螯合能力与肽的氨基酸组成、羧基和酸性氨基酸的侧链氨基等有关[24]。由表4可知,乳源酪蛋白酶解物的氨基酸总量为84.21%(质量分数)。其中,谷氨酸含量最多,达到了17.26%,其次为脯氨酸9.33%,赖氨酸、亮氨酸等含量也较高。从酶解物的氨基酸含量可以发现,除苯丙氨酸含量稍低外,其他氨基酸基本接近人体必需氨基酸比例,具有较高营养价值。
表4 牛乳酪蛋白酶解物中多肽的氨基酸测定结果 单位:%
Table 4 Determination of amino acids in casein hydrolysates of milk
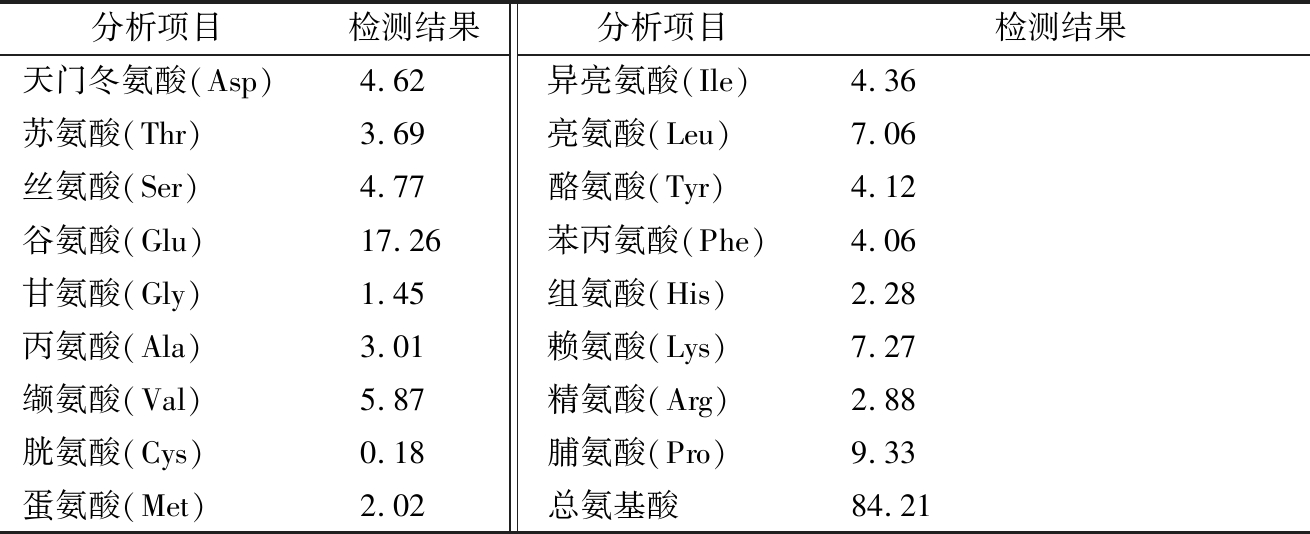
注:酸水解处理样品中色氨酸全破坏,胱氨酸、蛋氨酸被部分破坏,检测结果会不准。检测结果为氨基酸质量分数。
已有研究[24]表明,组氨酸(His)、赖氨酸(Lys)和脯氨酸(Pro)等有较高的金属螯合活性。STORCKSDIECK等[25]研究表明,当蛋白质或肽中富含谷氨酸(Glu)时,易与金属离子结合,因谷氨酸的γ-COO-[26]易与金属离子结合。同时研究[20]表明,金属离子(Cu2+,Zn2+,Ni2+)易与肽或蛋白质表面的组氨酸咪唑基结合,且组氨酸残基越多,肽的锌螯合率越大。而CHEN和PARK等分离出的金属螯合生物活性肽中均含有组氨酸[27-28],本实验酪蛋白酶解物中也含一定量组氨酸。总之,本实验测定结果在一定程度上验证了以上研究,谷氨酸、赖氨酸、脯氨酸有较高含量,其中如谷氨酸结构中含有2个羧基,与Zn2+有较好的螯合能力。
据ZHANG等[29]的研究,在螯合物中过渡金属离子因会吸收紫外区的某一部分波长的光而发生电子的跃迁,配体内部也可能因吸收紫外光而发生跃迁。而螯合物中的配合体内部电子的跃迁与游离配位体内部电子的跃迁时要求的能量不相同,即吸收光的波长会发生相应改变,所以可以利用紫外光谱扫描方法反映不同条件下的锌的螯合情况。
由图6可知,锌螯合肽酶解物和肽锌复合物同浓度的紫外吸收光谱图显示的吸收波长及强弱有所不同,在螯合后肽锌复合物的紫外吸收光谱发生了蓝移,峰强度变小,可能因为锌螯合肽配位后电子云向Zn2+移动,使得多肽中某些氨基酸的共扼效应强度降低[30]:肽锌复合物在200~250 nm波长处的吸收均比锌螯合肽酶解物的弱,可能是Zn2+与羰基(C=O)产生了络合作用,影响了羰基(C=O)n→δ*的电子跃迁所导致[20];在250~300 nm波长处的锌螯合肽酶解物有一个很强的吸收峰,而肽锌复合物此处吸收很弱,且趋于平缓,可能是Zn2+与配体(N—C—O)络合后,影响了配体(N—C—O)δ→δ*的电子跃迁所导致[20]。肽锌复合物在300 nm波长处后的吸收逐渐稳定,与锌螯合肽相比较,肽锌复合物的紫外谱图发生了明显变化,说明有锌螯合肽与Zn2+有螯合反应的迹象。因为乙酸锌的吸收峰在196.7 nm[31],而在300~400 nm波长没有吸收峰,进一步确认有螯合物的生成,综合比较与大豆多肽锌螯合盐的结果[31]较为相似,可得出肽锌复合物是一种不同于锌的新物质。
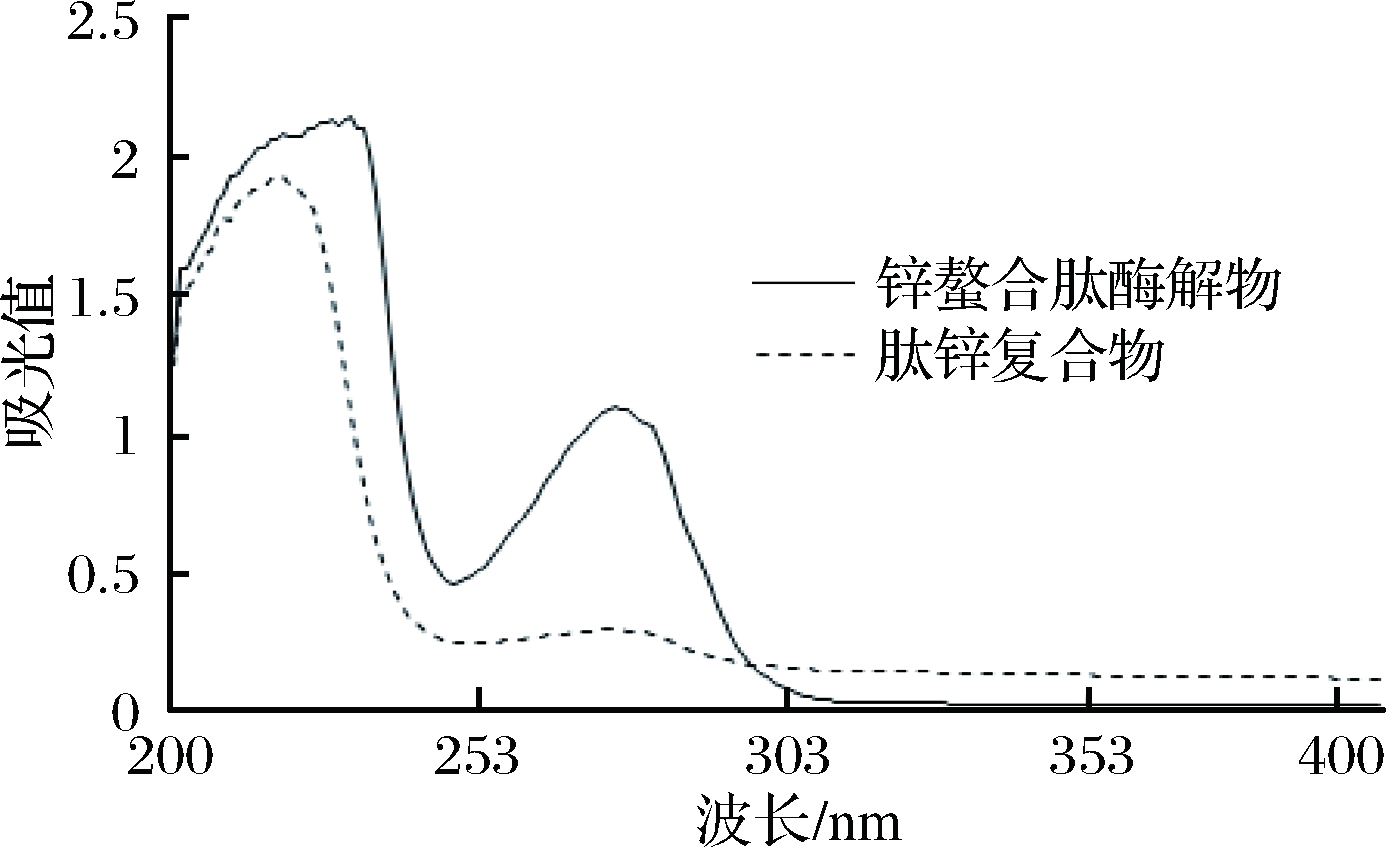
图6 紫外吸收光谱图
Fig.6 UV spectra of Zinc chelating peptidase and Zinc peptide complex
肽锌复合物与锌螯合肽酶解物谱图对比,一些主要的吸收峰发生明显的位移,强弱也发生了相应的变化。如图7所示,锌螯合肽酶解物在3 297.96 cm-1处出现宽吸收峰,同时在指纹区922.47 cm-1处有O—H弯曲振动的吸收峰,推测有—COOH存在;而肽锌复合物在3 300.5 cm-1处出现宽吸收峰,但总体变窄,且955~915 cm-1没有吸收峰,说明肽锌复合物中无裸露—COOH结构,—COOH可能与锌离子形成了配位键,这与周亮和张智[22,32]的研究结果接近;而且,羧基离子反对称振动于1 650 cm-1附近,羧基离子的对称振动于1 400 cm-1附近,这两处均有较强吸收峰。
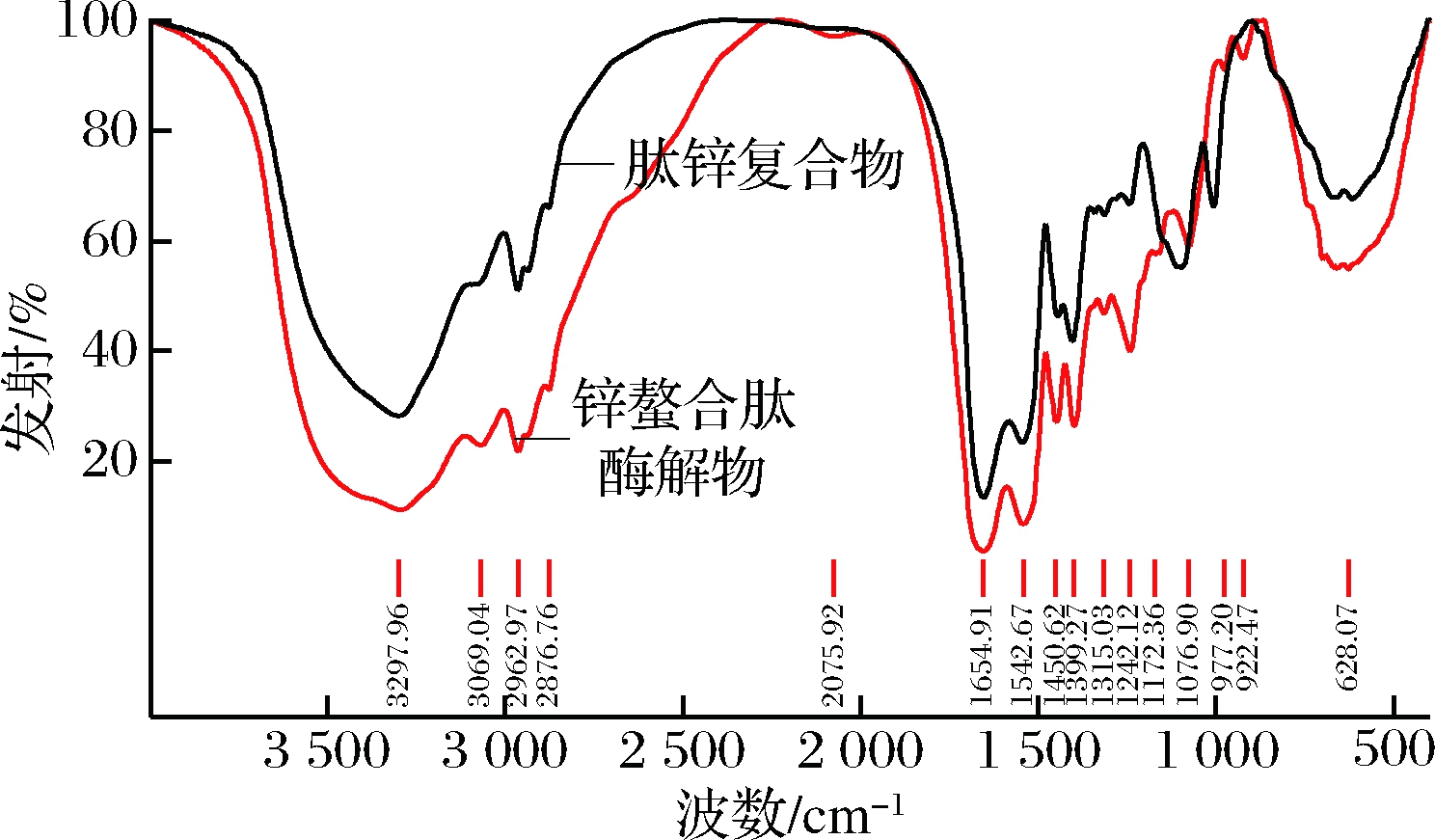
图7 傅里叶变换红外光谱图
Fig.7 FT-IR spectra of zinc chelating peptidase and peptide zinc complex
反对称振动是判断—COO-键共价程度的量度,而反对称振动与对称振动的差值γΔυ是羧基离子与金属离子配位方式的有力判据[33],推测羧基可能也以共价建的方式与锌离子结合。在谱图中,—NH的吸收峰由3 297.96 cm-1移至3 300.05 cm-1,说明在螯合过程中,肽的—NH发生变化,其透射率明显降低,推测Zn原子替代了H原子[34],这与玄依凡[24]的研究相似。肽锌复合物在3 069.04 cm-1处NH4+吸收峰消失,而1 097.91 cm-1处出现了Zn—NH2吸收峰,说明—NH2 已与Zn2+结合[35]。肽锌复合物在1 097.91 cm-1处出现C—N键强吸收峰,可能这是氮原子的共用电子对对锌作用而使C—N键偶极性的增强[22]。综上所述,配合物以内盐形式存在,Zn2+与O、N原子形成了配位键,即形成螯合物。
(1)胰蛋白酶酶解牛乳酪蛋白制备锌螯合肽最佳工艺为:底物质量浓度70 g/L,加酶量0.60%,初始pH 8.5,酶解温度50 ℃,酶解时间3 h,在此条件下酶解物锌螯合率为87.78%。
(2)根据最优酶解条件下酶解物的分子质量分布检测结果,分子质量<1 000 Da的分子肽占65.26%,表明酪蛋白酶解物较大部分是小分子肽,而人体能够更好地吸收小分子肽,因此肽锌复合物中Zn2+能够随着小分子肽进入机体,更易于其吸收。根据酶解物的氨基酸组成测定发现,酶解物中的氨基酸富含易于与锌螯合的谷氨酸等,有较强的锌螯合能力,既补充了必需氨基酸又提高了锌的生物利用率,是补锌的较佳形式。
(3)通过红外光谱、紫外扫描的测定分析,发现酪蛋白酶解物与肽锌复合物的区别主要是一些吸收峰发生变化,配合物以内盐形式存在,Zn2+与O、N原子形成了配位键;锌肽螯合反应前后分子肽的吸收峰发生改变,表明分子肽与Zn2+确实发生了反应形成新的物质;因此本研究的肽锌复合物为功能食品提供了一种新的功能制剂,具有一定的市场优势和前景。
参考文献
[1] BRANTL V, TESCHEMACHER H, HEMSCHEN A, et al. Novel opioid peptides derived from casein(β-casomorphins)Ⅰ.isolation from bovine casein peptoides[J]. Hoppe Seyler’s Z Physiol Chem,1997, 360: 1 211-1 216.
[2] 刘珊珊,敖静,谢宁宁,等.酪蛋白抗氧化肽的胃肠消化稳定性研究[J].中国食品学报,2014,14(2):47-54.
[3] 高芸芳,王金水,苏银杰.酪蛋白结构及其酶解特性研究进展[J].农产品加工(学刊),2013(5):1-4;9.
[4] 于洋,祁艳霞,靳艳.乳源生物活性肽研究进展[J].食品与发酵工业,2017,43(9):259-266.
[5] 张虎刚,张志翔,万端极.酪蛋白酶解制活性肽的工艺条件[J].食品研究与开发,2010,31(11):201-203.
[6] 王战勇.牛乳酪蛋白ACE抑制肽的Caco-2细胞水平转运吸收机制研究[D].西安:陕西科技大学,2017.
[7] 闫萍.大豆小分子多肽的抗疲劳作用及其机制研究[D].长春:吉林大学,2008
[8] PRASAD A S. Discovery of human zinc deficiency: 50 years later[J]. Journal of Trace Elements in Medicine and Biology, 2012, 26(2-3):66-69.
[9] XIE Ningning, HUANG Jingjing, CHENG Jianghua,et al. Affinity purification and characterization of zinc chelating peptides from rapeseed protein hydrolysates: Possible contribution of characteristic amino acid residues[J]. Food Chemistry, 2015, 173: 210-217.
[10] 高林,翟成杰,吴继红,等.改善人类锌营养途径的研究进展[J].食品安全质量检测学报,2013,4(5):1 550-1 555.
[11] 曹继琼,何长华.锌缺乏对人体健康的影响[J].现代医药卫生,2014,30(7):1 016-1 019.
[12] 陈丽丽,余江稳,潘博,等.克氏原螯虾壳肽螯合锌的制备其性质研究[J].江西科技师范大学学报,2017(6):65-70.
[13] 林谢凤.鱼类副产物胶原肽螯合锌的制备及其性质研究[D].厦门:集美大学,2015.
[14] 闫伟.真鲷鱼鳞皮胶原肽锌的制取、结构和性质研究[D].天津:天津科技大学,2013.
[15] HUSTINX J C A, SINGH T K, FOX P F. Heat-induced hydrolysis of sodium caseinate [J]. International Dairy Journal, 1997,7(4): 207-212.
[16] VAN BOEKEL M A J S. Heat-induced deamidation, dephosphorylation and breakdown of caseinate[J]. International Dairy Journal, 1999,9(36): 237-241.
[17] 杨叶昆,李雪梅,唐自文,等.酪蛋白的酸水解及其棕色化反应产物在卷烟加香中的应用[J].烟草科技,2001(1):8-10.
[18] 徐红梅,左凌波,高立娣.胰蛋白酶酶解酪蛋白工艺条件的优化[J].化工时刊,2015,29(3):1-5.
[19] 荆莹.酪蛋白的酶水解改性研究[D]. 呼和浩特:内蒙古农业大学,2010.
[20] 王晓萍.小麦胚芽蛋白源锌螯合肽的分离纯化、表征及生物活性研究[D].无锡:江南大学,2014.
[21] 李雪芬,杜斌,丁轲,等.金属螯合肽分离纯化及其抗氧化活性的研究进展[J].中国食物与营养,2016,22(3):35-39.
[22] 周亮.鱼鳞胶原小肽螯合锌的制备研究[D].武汉:湖北工业大学,2014.
[23] 陈紫红,花朋朋,周文斌,等.多肽-矿质元素螯合物的研究进展[J].食品工业科技,2017,38(8):350-355.
[24] 玄依凡.乳清蛋白肽—锌离子螯合物的制备及特性研究[D].哈尔滨:哈尔滨工业大学,2017.
[25] STORCKSDIECK S,BONSMANN G,HURRELL R F. Iron-binding properties, amino acid composition, and structure of muscle tissue peptides from in vitro digestion of different meat sources[J]. Journal of Food Science,2007,72(1): S019-S029.
[26] HUANG G,REN Z,JIANG J. Separation of iron-binding peptidesfrom shrimp processing by-products hydrolysates[J]. Food and Bioprocess Technology,2011,4(8):1 527-1 532.
[27] CHEN H M, MURAMOTO K, YAMAUCHI F, et al. Antioxidative properties of histidine-containing peptides designed from peptide fragments found in the digests of a soybean protein[J]. Journal of Agricultural and Food Chemistry, 1998, 46(1): 49-53.
[28] PARK P J, JUNG W K, NAM K S, et al. Purification and characterization of antioxidative peptides from protein hydrolysate of lecithin-free egg yolk[J].Journal of the American Oil Chemists' Society, 2001,78(6):651-656.
[29] ZHANG L, LI J R, ZHOU K. Chelating and radical scavenging activities of soy protein hydrolysates prepared from microbial proteases and their effect on,eat lipid peroxidation[J]. Bioresource Technology, 2010, 101(7): 2 084-2 089.
[30] 左瑞雅.L-丙氨酰-L-谷氨酰胺-Zn2+螯合物制备及表征[D].重庆:重庆大学,2007.
[31] 高素蕴.大豆多肽锌螯合盐的制备及生理活性研究[D].杨凌:西北农林科技大学,2003.
[32] 张智,刘慧,刘奇,等.玉米肽-锌螯合物对小鼠免疫功能的影响[J].食品科技,2016,41(12):45-49.
[33] 中本一雄.无机及配位化合物的红外和拉曼光谱(中译本)[M].北京:化学工业出版社,1981:257.
[34] LIAO W Z, LAI T, CHEN L Y, et al. Synthesis and characterization of a walnut peptides-zinc complex and its antiproliferative activity against human breast carcinoma cells through the induction of apoptosis[J]. Journal of Agricultural and Food Chemistry, 2016, 64(7):1 509-1 519.
[35] 张智,刘慧,刘奇,等.玉米肽-锌螯合物结构表征及抗氧化活性分析[J].食品科学,2017,38(3):131-135.
KUANG Xiaoxian1,2, ZHANG Minjie1,2, HE Guanhao1,2, LU Dixun1,2, TAN Junhao1,2, KANG Meng3, LIU Fei4, FANG Xiang1, CAO Yong1,2, MIAO Jianyin1,2*
1(Collage of Food Science, South China Agricultural University, Guangzhou 510642, China) 2(Guangdong Provincial Key Laboratory of Nutraceuticals and Functional Foods, Guangzhou 510642, China) 3(Collage of Food Science, Northeastern Agricultural University, Harbin 150030, China) 4(Guangzhou Greencream Biotechnology Co.,Ltd, Guangzhou 510665, China)
ABSTRACT This research aimed to study the condition for enzymatically preparing zinc chelating peptides from dairy sources and to illustrate their chelating characteristics. Trypsin was used for enzymolysis, and the molecular weight distribution and amino acid composition of the hydrolysates, as well as their structures and peptide zinc compounds were determined under the optimal preparation condition. The results showed that the optimal hydrolysis condition was at 50 ℃ and pH=8.5 for 3 h with 70 g/L casein and 0.6% trypsin. Under the optimized condition, the zinc chelating rates of hydrolysates were 87.78%. Moreover, the hydrolysates had small molecular peptides and were rich in essential amino acids. Furthermore, significant changes in spectra were observed before and after chelation, as Zn2+ could coordinate with carboxyl and other groups of peptides. In conclusion, dairy zinc chelating peptides have high zinc chelating activity. This study lays a foundation for producing and applying zinc supplements, and also for further studies on promoted absorption of active substances by zinc.
Key words casein; enzymolysis; zinc chelating peptide; molecular weight distribution; amino acid composition; chelating property