浩楠1,马腾臻1,贠建民1,杨学山1,李爱霞1,陈彦雄2,韩舜愈1*
1(甘肃农业大学 食品科学与工程学院,甘肃省葡萄与葡萄酒工程学重点试验室,甘肃省葡萄与葡萄酒产业技术研发中心,甘肃 兰州,730070) 2(甘肃祁连葡萄酒业有限责任公司,甘肃 高台,734304)
摘 要 为解决葡萄酒专用乳酸菌依赖国外进口,导致葡萄酒品质同质化严重的问题,以甘肃河西走廊产区处于自然苹果酸-乳酸发酵(苹乳发酵)的葡萄酒为来源,筛选具有本土特色的优势乳酸菌。通过改良MRS培养基分离乳酸菌,经生理生化、16S rDNA基因同源性分析等鉴定,并对筛选菌株进行酿酒特性分析。获得3株具有启动苹乳发酵的小片球菌(Pediococcus parvulus,P.parvulus)且均具有较强的降酸能力,较商品乳酸菌差异不显著,其中菌株C30在低温(15 ℃)、高乙醇体积分数(14%)和高SO2质量浓度(50 mg/L)条件下的生物量显著高于商品乳酸菌。菌株C30可作为启动苹乳发酵的优势菌株,对提升河西走廊产区葡萄酒品质具有一定的应用潜力,在一定程度上推动葡萄酒品质同质化问题的解决。
关键词 葡萄酒;苹乳发酵;菌株筛选;小片球菌
第一作者:硕士研究生(韩舜愈教授为通讯作者,E-mail:gsndhsy@163.com)。
基金项目:甘肃省科技厅重点研发项目(17YF1NA060);甘肃农业大学盛彤笙科技创新基金项目(GSAU-STS-1741)
收稿日期:2018-12-11,改回日期:2019-02-22
DOI:10.13995/j.cnki.11-1802/ts.019590
乳酸菌(lactic acid bacteria, LAB)是苹果酸-乳酸发酵(malolactic fermentation, MLF)过程中的关键菌株,在葡萄酒发酵中发挥重要的作用,其通过将葡萄酒中的L-苹果酸转化为L-乳酸和![]() 可降低葡萄酒的总酸,同时进一步提高葡萄酒的微生物稳定性,修饰葡萄酒的风味[3-4]。所以,筛选优良乳酸菌菌株对葡萄酒发酵具有重要意义。
可降低葡萄酒的总酸,同时进一步提高葡萄酒的微生物稳定性,修饰葡萄酒的风味[3-4]。所以,筛选优良乳酸菌菌株对葡萄酒发酵具有重要意义。
对乳酸菌的筛选方向主要以MLF的高耐受性、高抗氧化活性、产香能力[5-8]等方面为主。目前,已确定可进行苹乳发酵的乳酸菌分别为酒球菌属(Oenococcus)、明串珠菌属(Leuconostoc)、乳杆菌属(Lactobacillus)和片球菌属(Pediococcus)[9-10]。在推广应用方面,酒类酒球菌(Oenococcus oeni)因其快速启动苹乳发酵、耐受性能优良等优点在葡萄酒发酵中得到广泛使用[11-13]。然而,我国目前所用的主导MLF的乳酸菌主要是国外商品菌株,国内本土菌株使用较少,造成不同产区葡萄酒品质同质化严重,不利于国产葡萄酒的发展[14-15],因此加强本土乳酸菌资源的开发与利用,筛选出适合我国不同地域葡萄酒生产的优良乳酸菌菌株具有重要意义。
甘肃河西走廊是我国酿酒葡萄的主要种植区之一,蕴藏着丰富的野生乳酸菌资源,有待科研和酿酒工作者的开发使用。本实验采用改良MRS分离培养基从甘肃祁连葡萄酒有限责任公司处于自然苹乳发酵的干红葡萄酒中分离得到乳酸菌,对其进行形态学、生理生化试验和分子生物学鉴定,并研究其在葡萄酒环境下对pH值、SO2质量浓度、乙醇体积分数和发酵温度的耐受性,以期得到酿酒性状优良的乳酸菌,为提升河西走廊产区葡萄酒品质提供理论依据和技术支持。
1.1.1 试验材料
本试验所用葡萄酒样采样于2016年10月甘肃祁连葡萄酒业有限责任公司,酿造实验采用实验室酒精发酵结束的葡萄酒(残糖3.02 g/L;pH 3.44;总酸7.07 g/L)。
1.1.2 药品与试剂
商品乳酸菌2株:OMEGA和VP41,法国Lallemand公司;放线菌酮:美国Sigma公司;L-苹果酸、L-乳 酸含量测定试剂盒:爱尔兰Megazyme公司;蛋白胨、酵母浸粉、牛肉膏、结晶紫等其他试剂均为天津市光复精细化工研究所;酚酞指示剂、NaOH标准液等均按GB/T 603—2002《化学试剂试验方法中所用制剂及制品的制备》进行配制;革兰氏染色剂等按GB 478935—2010《食品安全国家标准食品微生物学检验乳酸菌检验》进行配制。
1.1.3 主要仪器
生化培养箱,上海新苗医疗器械制造有限公司;YXQ-LS-5011立式压力蒸汽灭菌锅,上海博讯实业有限公司医疗设备厂;827型pH,计上海雷磁公司;Genesis 10S型紫外-可见分光光度仪,美国Thermo Scientific公司;CP 214型电子天平,上海奥豪斯仪器有限公司;1810D超纯水机,重庆摩尔水处理设备有限公司;光学显微镜,尼康仪器(上海)有限公司;S·SW-CJ-1FD超净工作台、S·HH·W21·600S水浴锅、GZX-GF101-Ⅱ恒温干燥箱,上海跃进医疗器械有限公司。
1.2.1 培养基与乳酸菌分离纯化
基础液体改良MRS培养基[16](g/L):蛋白胨10,酵母浸粉5,牛肉膏10,葡萄糖20,无水醋酸钠3,柠檬酸铵2,吐温-80 1,K2HPO4 2,MgSO4·7H2O 0.2,MnSO4·4H2O 0.05, 盐酸半胱氨酸0.5;番茄汁的体积分数20%;用1 mol/L NaOH调节pH 6.2~6.4,蒸馏水配制,121 ℃灭菌20 min。固体培养基:在液体培养基中加入20琼脂。分离培养基:基础液体MRS培养基加50 mg/L放线菌酮。
模拟葡萄酒的配制[17](g/L):苹果酸3.0,酒石酸3.0,柠檬酸0.5,无水葡萄糖4.0,NaCl 0.2,(NH4)2SO4 1.0,KH2PO4 2.0,MgSO4·7H2O 0.2,MnSO4 0.05,酵母浸粉4;用10 mol/L NaOH调节模拟酒pH至3.4,蒸馏水配制,121 ℃灭菌20 min。SO2(以偏重亚硫酸钾计)20 mg/L, 乙醇的体积分数为10%,灭菌后加入。
乳酸菌的分离纯化:采用梯度稀释平板法[16],将葡萄酒样按梯度10-1、10-2、10-3、10-4、10 -5、10-6、10-7、10-8稀释后,吸取0.1 mL涂于分离培养基上对菌株进行分离,27 ℃恒温培养箱中培养5~7 d,挑取分离培养基上菌落形态为乳白色、光滑、菌落直径小于1 mm的单菌落反复进行划线分离直至纯化。
1.2.2 菌株的鉴定
形态学鉴定:用快速压片法对初筛菌株进行制片,光学显微镜下油镜镜检[18]。
革兰氏染色实验按照以下步骤进行:
涂菌→干燥→初染→媒染→脱色→复染→镜检
过氧化氢酶实验:取一环纯化后的培养菌,涂于干净的载玻片上,然后在其上滴加3%(体积分数)的H2O2,于半分钟内有气泡则为阳性反应,无气泡为阴性反应[19]。
生理生化鉴定:根据文献及Bergey’S细菌鉴定手册[19-20]对乳酸菌生理生化特征的描述标准,并结合其酿酒适应性对初筛菌株进行鉴定。
1.2.3 苹果酸分解能力及降酸能力测定
苹果酸分解能力:在无菌条件下,将初筛菌株接入含有L-苹果酸(3 g/L)的MRS液体培养基中,每隔24 h进行1次纸层析监测,并观察苹果酸斑点的变化,苹果酸斑点消失即为苹果酸分解完毕[21]。
降酸能力测定:将供试菌株以107 CFU/mL接种至模拟酒中,20 ℃条件下培养,采用酸碱滴定法[22],在发酵过程中每隔24 h取样2 mL,加入50 mL蒸馏水,2滴酚酞指示剂,用0.05 mol/L NaOH标准溶液滴定至终点并计算,结果以酒石酸计(g/L)。
1.2.4 分子生物学鉴定
初筛菌株的分子生物学鉴定采用16S rDNA分析的方法,由上海生工生物工程有限公司对菌株进行测序。测序结果通过DNA STAR完成序列处理,将处理好的乳酸菌的16S rDNA及基因序列提交到NCBI/Gen Bank,用BLAST程序与Gen Bank数据库中已知的乳酸菌的16S rDNA基因序列进行相似性比较分析。
对pH值、SO2、乙醇浓度适应性筛选:分别将供试菌株与商品酒类酒球菌OMGEA与VP41以107 CFU/mL 的接种量接种至不同pH值(3.0、3.2、3.4、 3.6、3.8),不同SO2质量浓度(10、30、50、70、90 mg/L), 不同乙醇体积分数(8%、10%、12%、14%、16%)的模拟葡萄酒(121 ℃灭菌20 min)中,20 ℃ 静置培养,观察菌株生长情况并用分光光度法对菌密度OD600进行测定。
对发酵温度适应性筛选:将供试菌株与商品酒类酒球菌OMGEA与VP41以107 CFU/mL的接种量接种至模拟葡萄酒中以不同发酵温度(12、15、18、21、25 ℃) 静置培养并对菌密度OD600进行测定。
将供试菌株与商品酒类酒球菌OMGEA与VP41以107 CFU/mL的接种量接种至酒精发酵结束的葡萄酒中进行苹乳发酵,发酵温度20 ℃,采用纸层析法进行过程监测,发酵结束后采用酶试剂盒测定葡萄酒中L-苹果酸和L-乳酸的含量。
试验数据采用Excel 2010和SPSS 19.0分析处理。
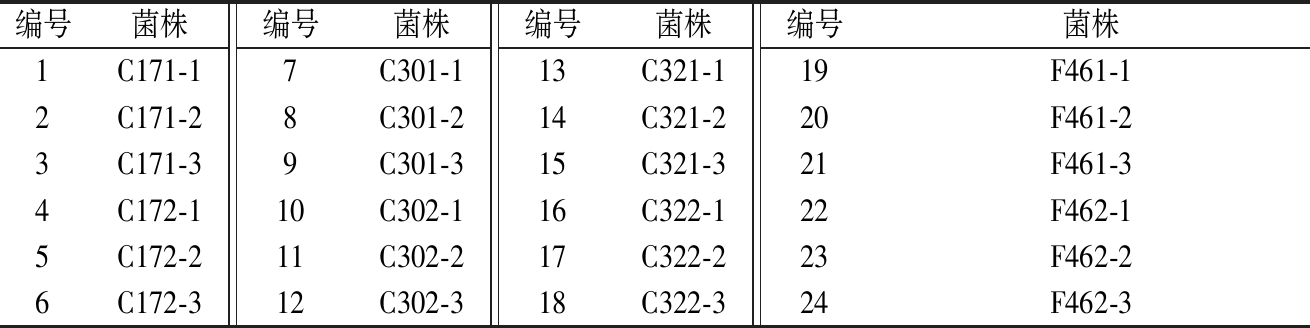
通过稀释涂布平板分离法和平板划线分离法,在MRS分离培养基上分离纯化得到24株菌株,对筛选菌株进行了编号(见表1)。
表1 分离菌株一览表
Table 1 Isolated strains
2.2.1 形态学鉴定
27 ℃条件下培养5 d,菌株在固体培养基表面形成直径小于1 mm的光滑乳白色菌落,随着培养时间的延长,也存在大于1 mm的情况。分离菌株在MRS固体培养基上的生长情况,符合文献[23]对乳酸菌的描述。通过革兰氏染色和显微镜对菌株进行镜检,结果发现,菌株细胞革兰氏染色均为阳性,且细胞均呈椭圆或球形、成对排列。符合《乳酸菌分类鉴定及实验方法》[19]中对细菌形态学的描述标准。
2.2.2 过氧化氢酶实验
初步筛选的菌株(表1)经过氧化氢酶实验,得到如下结果(表2)。所筛选的24株菌株中有14株菌株为阴性,符合对乳酸菌过氧化氢酶实验的描述[19]。
表2 菌株过氧化氢酶实验
Table 2 Catalase experiment of Isolates strains
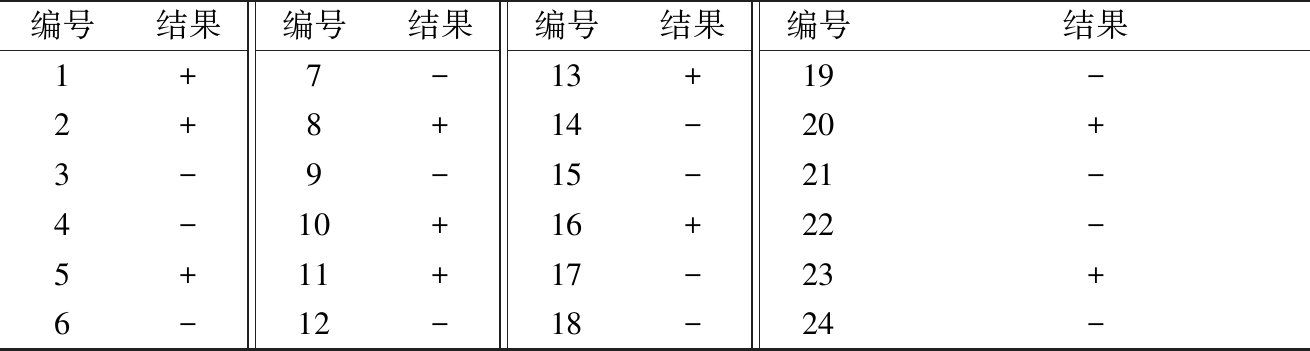
注:+:阳性,-:阴性;菌株及编号参照表1。
2.2.3 生理生化鉴定
对上述14株初筛菌株进行糖发酵试验(表3),结果表明菌株符合《细菌鉴定手册》[20]对乳酸菌属生理生化特征的描述标准。其中编号4,14,17,18的菌株符合对短乳杆菌(Lactobacillus brevis)的特征描述,编号9,22的菌株符合对Lactobacillus kunkeei的特征描述。编号3,6,7,12,15,19,21,24的菌株符合对小片球菌(Pediococcus parvulus)的特征描述。
表3 初筛菌株糖发酵实验
Table 3 Sugar fermentation experiment of preliminary screening strains
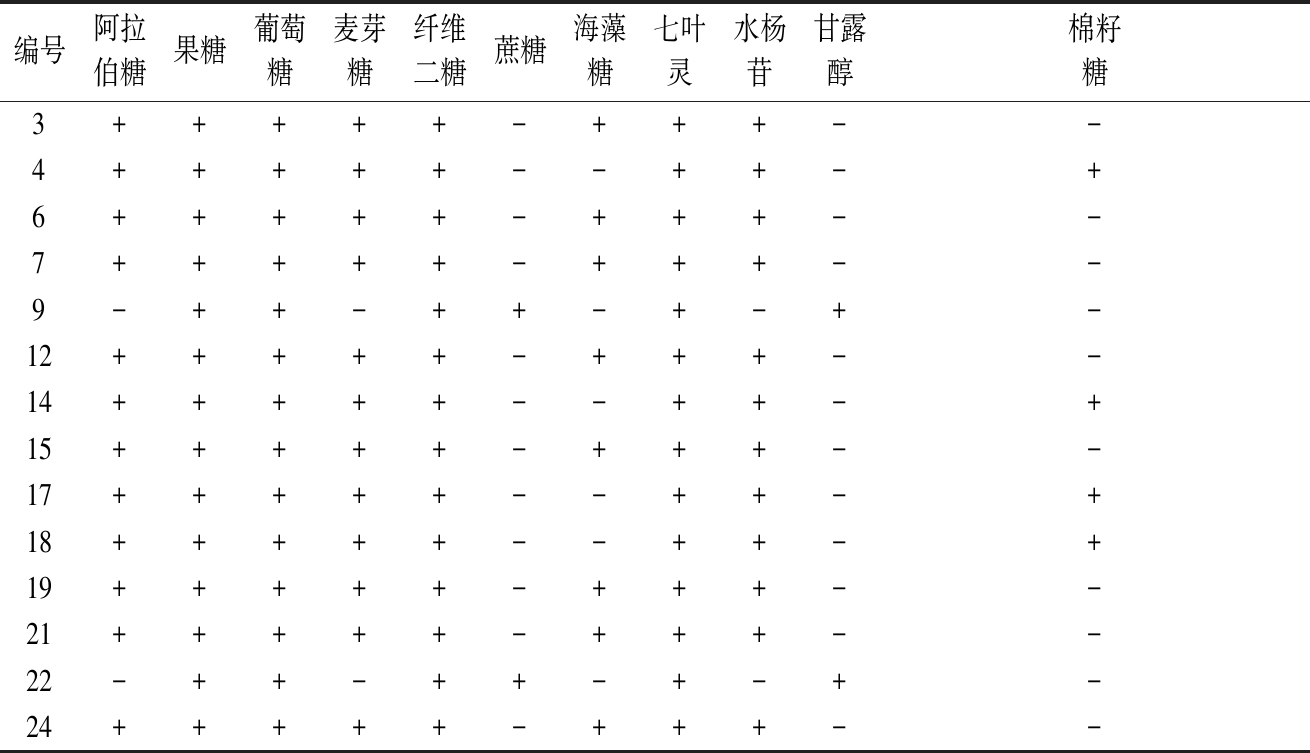
注:+:阳性,-:阴性;菌株及编号参照表1。
2.3.1 苹果酸分解实验
乳酸菌的苹果酸分解能力是评估其降酸能力的主要指标。将上述菌株的苹果酸分解能力由纸层析进行初步确定。由图1可以看出,编号为3,7,12,15,19的5株菌株具有较好的苹果酸分解能力,分别在发酵的72,72,84,96,84 h苹果酸斑点消失。编号为6,21,24的菌株分解苹果酸能力较差,基本不具备苹果酸分解能力。而编号为4,9,14,17,18,22的菌株完全不具有苹果酸分解能力(数据未显示)。

图1 初筛菌株苹果酸分解实验
Fig.1 Malic acid decomposition test of primary screening strains
注:M:L-苹果酸标品; L:L-乳酸标品;菌株及编号参照表1。
2.3.2 降酸能力实验
将上述具有苹果酸分解能力的5株菌株进行降酸能力测定,结果见图2。随着发酵时间的增加,发酵液中的总酸含量逐渐减少。在发酵的第1~2天菌株处于适应期,对发酵液中的酸分解缓慢,但在发酵的第3~6天各菌株发酵液中的总酸含量下降最快(按酒石酸计)。与商业菌株OMEGA和VP41对比,筛选得到的菌株都具有较好的降酸能力。其中,C302-3、C321-3菌株在发酵的初期降酸缓慢,但随着菌株对发酵液环境的适应最终能与商业菌株的降酸能力差异不显著。而C171-1、C301-1、F461-1菌株的整个降酸过程的趋势与商品菌株相似。

图2 初筛菌株的降酸能力
Fig.2 The ability of primary screening strains to degrade acid
将经过上述实验筛选出的菌株C171-1、C301-1、C302-3、C321-3、F461-1进行分子生物学鉴定。
2.4.1 凝胶电泳检测结果
电泳检测5株菌株的PCR扩增产物。由图3可知,5个扩增产物均在1 500~2 000 bp有1条扩增带。
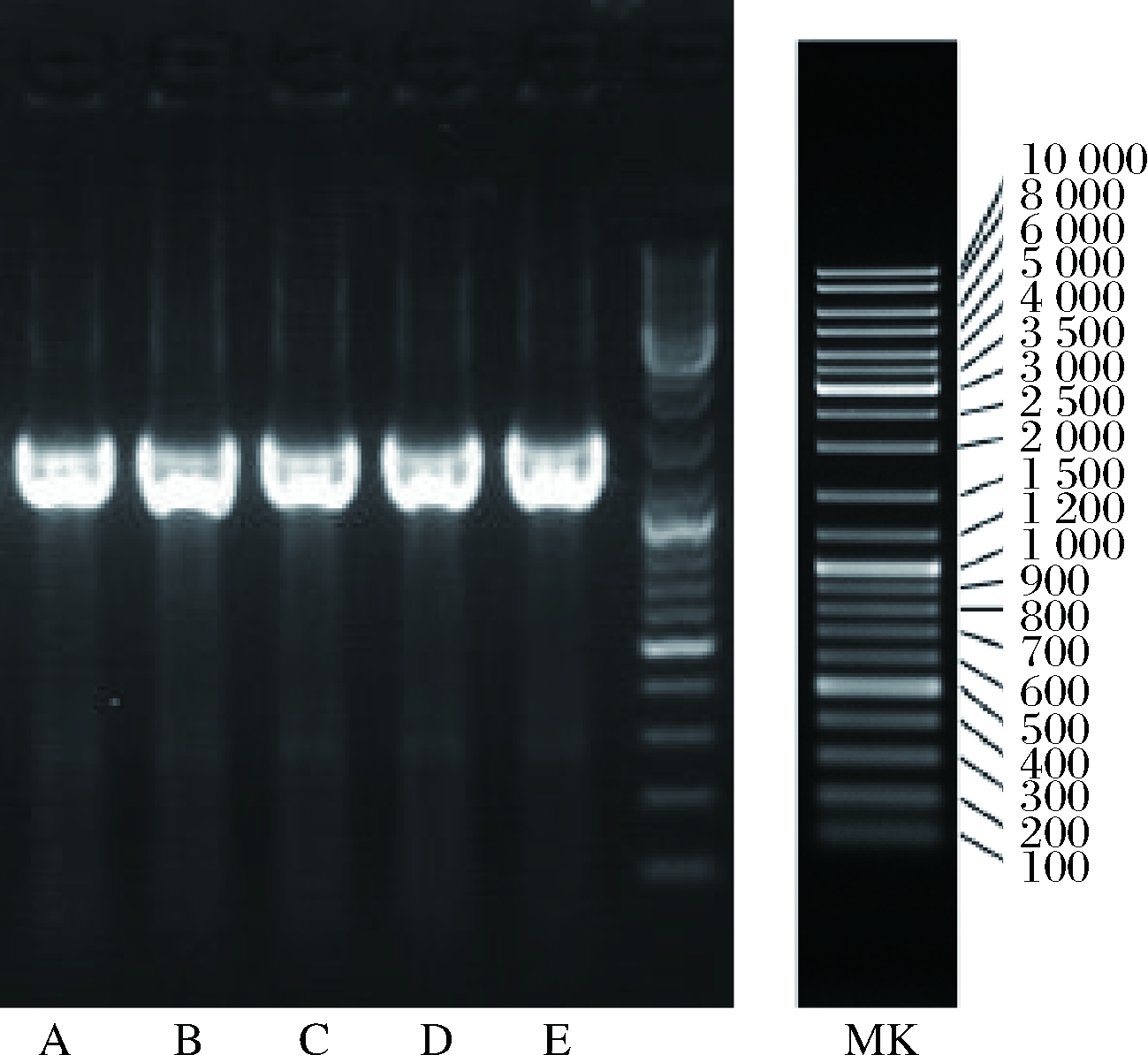
图3 初筛菌株的PCR电泳图
Fig.3 The PCR electrophoretogram of screened strains
注:MK-Marker,A-C171-3、B-C301-1、C-C302-3、D-C321-3、E-F461-1。
2.4.2 16S rDNA测序比对
将5个初筛菌株的16S rDNA序列测定结果在Gen Bank用BLAST程序进行比对,基因系统进化树见图4,比对结果如下:C171-3与C321-3为Pediococcus parvulus Ni555(登录号:AB601176.1);C301-1与C302-3为Pediococcus parvulus MA55(登录号:KY425789.1);F461-1为Pediococcus parvulus gp116(登录号:KM495950.1)。最终得知这3株菌株均为乳酸菌属的小片球菌(Pediococcus parvulus)。

图4 初筛菌株的基因系统进化树图谱
Fig.4 Phylogenetic tree establishment of lactic acid bacteria from 5 species
将上述鉴定的3株菌株(简化为C30、C17、F46)进行酿酒适应性测定,通过对pH值、SO2质量浓度、乙醇体积分数与发酵温度这4个酿造条件的耐受性进行分析。
2.5.1 pH
pH值是影响乳酸菌生长的重要因素。从图5可以看出,pH值对菌株的生长影响十分显著。随着pH的升高,菌株的OD600值呈上升趋势,即菌株的生长能力随着pH的升高而增强。干红葡萄酒的pH值多为3.4~3.6[15],pH为3.4时,与商品菌株OMEGA及VP41比较,菌株C30的OD600值与商品菌株差异不显著(P>0.05)且表现出良好的耐受性。尽管菌株F46和C17生长能力较商品菌株弱,但也能启动苹乳发酵。
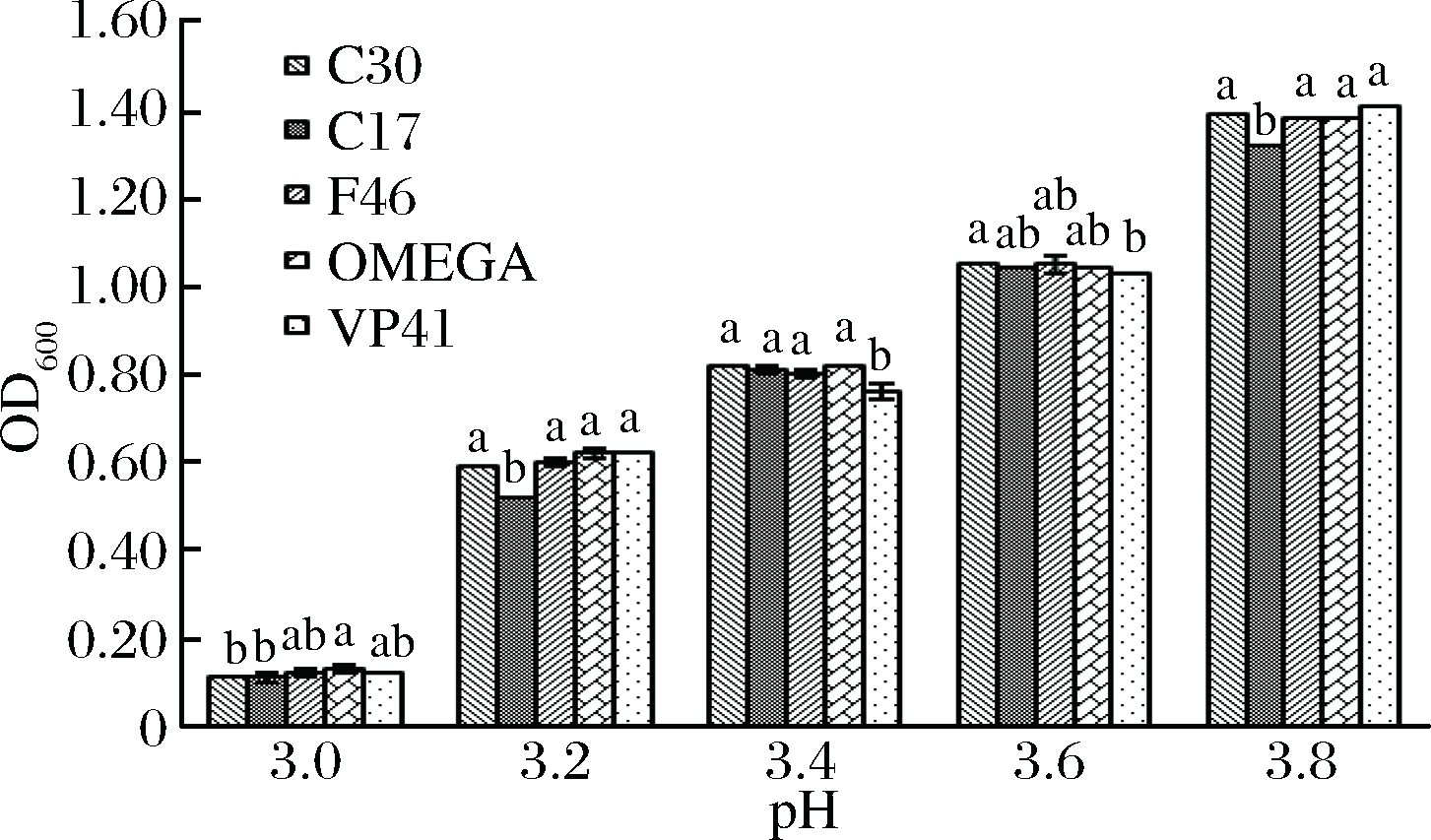
图5 菌株的pH耐受能力
Fig.5 The ability of the strain to tolerate pH
2.5.2 SO2质量浓度
加入适量的SO2对葡萄酒中的有害微生物具有抑制作用,同时可达到抗氧化等作用[21]。因此,需对菌株进行SO2的耐受性考察。从图6可以看出,随着SO2浓度的增加,菌株的OD600值呈下降趋势,即菌株的生长能力随着SO2浓度的增加而降低。当SO2质量浓度为50 mg/L时,与商品菌株比较,菌株C30与F46表现出强于商品菌株的SO2耐受性,表明筛选的C30与F46菌株在一般葡萄酒含有的SO2浓度下具有较强的耐受性。然而当SO2质量浓度为90 mg/L时,所有菌株均已不能生长。

图6 菌株的SO2耐受能力
Fig.6 The ability of the strain to tolerate SO2
2.5.3 乙醇体积分数
葡萄酒的乙醇体积分数也是抑制乳酸菌生长的主要因素,当乙醇体积分数达到10%时就会抑制菌株的生长[17]。从图7可以看出,随着乙醇体积分数的增加,菌株的OD600值呈下降趋势,即菌株的生长能力随着乙醇体积分数的增加而降低。当乙醇体积分数为10%时,筛选的3株菌株表现出较商品乳酸菌更好的耐受性。一般葡萄酒的酒精度在12%~14%,当乙醇体积分数为14%时,菌株C30的OD600值为0.23,与商品菌株差异显著(P<0.05),但在乙醇体积分数为16%时,5株菌株的生长均受到强烈抑制。
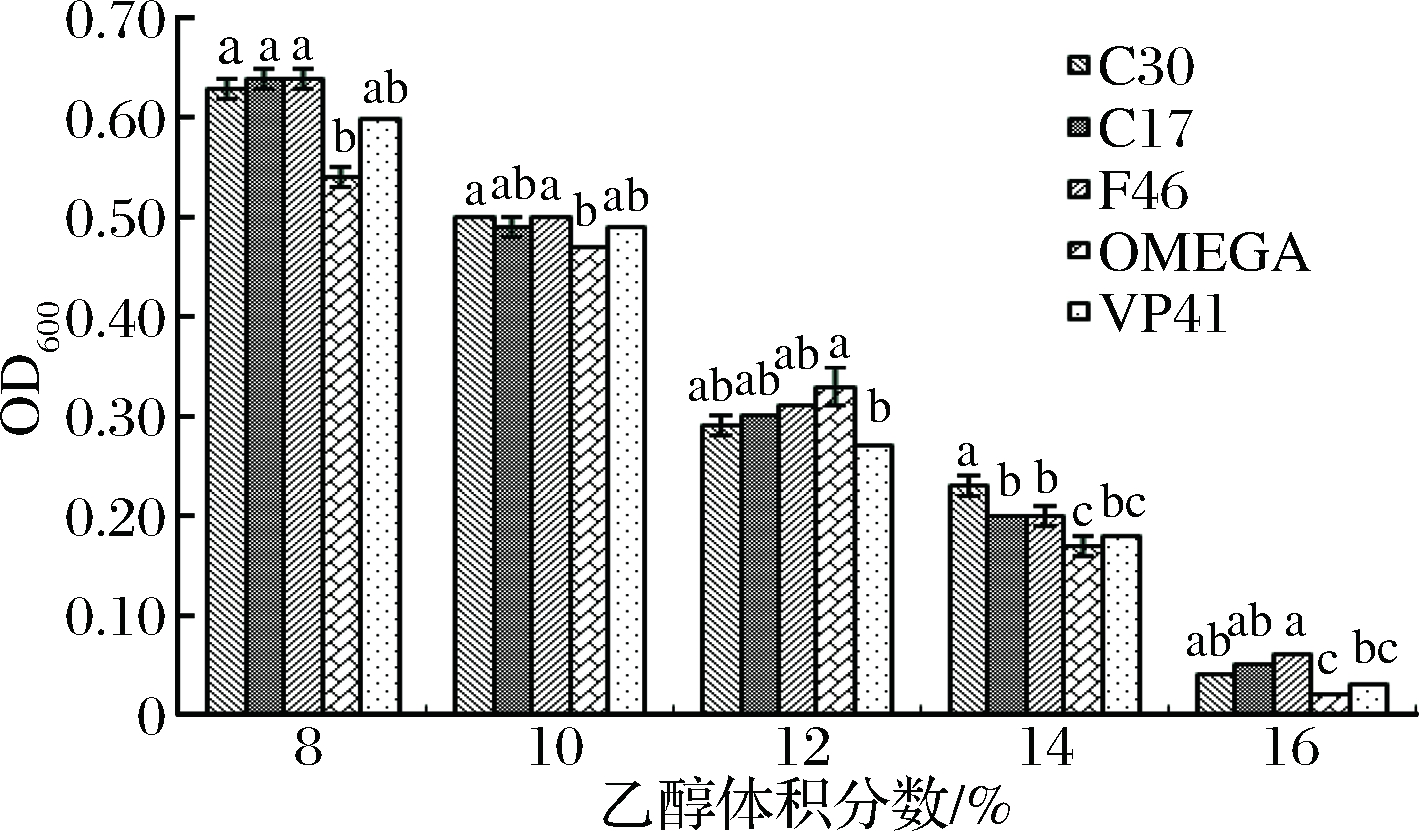
图7 菌株的乙醇耐受能力
Fig.7 The ability of the strain to tolerate alcohol
2.5.4 发酵温度
干红葡萄酒的苹乳发酵温度为18~20 ℃[17]。此次筛选出的菌株来自于河西走廊地区,该地区属于冷凉的地区,由于该地区在苹乳发酵时发酵温度较低,因此菌株需对发酵温度具有一定的耐受性[24]。从图8可以看出,随着发酵温度的升高,菌株的OD600值呈上升趋势,即菌株的生长能力随着发酵温度的升高而增强。图中筛选的3株菌株在不同的发酵温度条件下的生长能力较2株商品菌株强。但当发酵温度为15 ℃时,筛选的3株菌株与商品菌株差异显著(P<0.05),表明其在较低温度条件下也有较强的生长能力。

图8 菌株的发酵温度耐受能力
Fig.8 The ability of the strain to tolerate the temperature of the fermentation
在经供试菌株与商品酒类酒球菌OMGEA与VP41发酵的葡萄酒中,L-苹果酸和L-乳酸的含量见表4。数据显示,酒样中的L-苹果酸被菌株消耗转化为L-乳酸,与商品菌株OMEGA和VP41发酵酒样比较,菌株C30、C17、F46发酵酒样中L-苹果酸和L-乳酸含量差异不显著,表明筛选的菌株具有较好的分解L-苹果酸的能力。
表4 葡萄酒中L-苹果酸和L-乳酸的含量
Table 4 The content of L-malic acid and L-lactic acid in wine

注:表中同一指标内不同字母代表差异显著,样本量n=3,P<0.05。
本试验筛选的菌株均为小片球菌(P.parvulus),而最终分离的菌株当中没有酒类酒球菌,这可能与其生长力较弱有关[14]。在液体培养基中,由于没有乙醇等的抑制,生长能力强的乳杆菌、片球菌等乳酸菌争夺了培养基中的大部分营养,使酒类酒球菌等长势较弱的菌株无法生长,分离的菌种受到限制[20]。在葡萄酒中分离到的片球菌中,有害片球菌(P.damnosus)和小片球菌(P.parvulus)较常见。研究表明,片球菌可能会产生一些发酵食品的风味物质[11,18],增加发酵食品风味的复杂性,但也有研究表明片球菌通过利用发酵饮料中的残留糖而引起酒体黏稠、影响葡萄酒过滤,从而降低葡萄酒质量[25-26]。本试验中,自然苹乳发酵后的酒样并未观察到黏稠现象,这可能是由于模拟酒糖含量低(4 g/L),片球菌主要以苹果酸为碳源,故无多糖产生所致。然而,以单一片球菌株进行苹乳发酵对葡萄酒品质的影响还需进一步研究。所以,将葡萄酒中的小片球菌进行酿造分析对葡萄酒发酵及其品质具有重要意义。
采用MRS分离培养基从甘肃祁连葡萄酒业有限责任公司干红葡萄酒中分离获得24株乳酸菌,经形态学鉴定、生理生化鉴定、苹果酸分解实验等,得到其中5株具有较好的降酸能力。
经16S rDNA分析得到3株菌株均为小片球菌(Pediococcus parvulus)。分别为Pediococcus parvulus Ni555(登录号:AB601176.1);Pediococcus parvulus MA 55(登录号:KY425789.1);Pediococcus parvulus gp116(登录号:KM495950.1)。
与商品乳酸菌比较,3株小片球菌均表现出较好的酿酒适应性,其中菌株C30对低发酵温度(15 ℃)、高SO2质量浓度(50 mg/L)和高乙醇体积分数(14%)耐受性较强,具有较强的苹果酸-乳酸发酵适应性。
参考文献
[1] ZAPPAROLI G, TOSI E, AZZOLINI M, et al. Bacterial inoculation strategies for the achievement of malolactic fermentation in high alcohol wines[J].South African Society for Enology & Viticulture, 2009, 30(1): 49-55.
[2] BARTOWSKY E, COSTELLO P, HENSCHKE P. Management of malolactic fermentation-wine flavor manipulation[J].Australian & New Zealand Grapegrower & Winemaker, 2002, 46(1): 10-12.
[3] BAUER R, DICKS L M T. Control of malolactic fermentation in wine. A review[J].South African Society for Enology & Viticulture, 2004,25(2): 74-88.
[4] BORDAS M, ARAQUE I, BORDONS A, et al. Differential expression of selected Oenococcus oeni genes for adaptation in wine-like media and red wine[J].Annals of Microbiology, 2015, 65(4):2 277-2 285.
[5] CINQUANTA L, DE STEFANO G, FORMATO D, et al. Effect of pH on malolactic fermentation in southern Italian wines[J]. European Food Research and Technology, 2018, 244(7):1 261-1 268.
[6] 乔慧,卢柯,杨世玲,等.中国主要葡萄酒产区酒酒球菌糖苷酶活性[J].食品科学,2014,35(23):144-150.
[7] 苏静.高抗氧化活性酒酒球菌的筛选及提升葡萄酒品质的研究[D].杨凌:西北农林科技大学,2016.
[8] MESAS J M, RODRIGUEZ M C, ALEGRE M T. Basic characterization and partial purification of β-glucosidase from cell-free extracts of Oenococcus oeni ST81[J]. Applied Microbiology, 2012, 55(3):247-255.
[9] SICO M A, BONOMO M G, SALZSNO G. Isolation and characterization of Oenococcus oeni from Aglianico wines[J].World Journal of Microbiology and Biotechnology, 2008, 24 (9): 1 829-1 835.
[10] CRUZPIO L E, POVEDA M, ALBERTO M R, et al. Exploring the biodiversity of two groups of Oenococcus oeni isolated from grape musts and wines: Are they equally diverse?[J]. Systematic & Applied Microbiology, 2017, 40(1):1-10.
[11] ROMERO J, ILABACA C, RUIZ M, et al. Oenococcus oeni in chilean red wines:Technological and genomic characterization[J]. Frontiers in Microbiology, 2018, 9:1-12.
[12] RODR GUEZ-NOGALES J M, VILA-CRESPO J, FERN
GUEZ-NOGALES J M, VILA-CRESPO J, FERN -NDEZ-FERN
-NDEZ-FERN NDEZ E. Immobilization of Oenococcus oeni in lentikats to develop malolactic fermentation in wines[J]. Biotechnology Progress, 2013, 29(1):60-65.
NDEZ E. Immobilization of Oenococcus oeni in lentikats to develop malolactic fermentation in wines[J]. Biotechnology Progress, 2013, 29(1):60-65.
[13] BORDAS, M, ARAQUE I, ALEGRET J O, et al. Isolation, selection, and characterization of highly ethanol-tolerant strains of Oenococcus oeni from south Catalonia[J]. International Microbiology the Official Journal of the Spanish Society for Microbiology, 2013, 16(2):113-123.
[14] JIANG J, SUMBY K M, SUNDSTROM J F, et al. Directed evolution of Oenococcus oeni strains for more efficient malolactic fermentation in a multi-stressor wine environment[J]. Food Microbiology, 2018, 73:150-159.
[15] JUEGA M, COSTANTINI A, BONELLO F, et al. Effect of malolactic fermentation by Pediococcus damnosus on the composition and sensory profile of Albari o and Cai
o and Cai o white wines[J]. Journal of Applied Microbiology, 2014, 116(3):586-595.
o white wines[J]. Journal of Applied Microbiology, 2014, 116(3):586-595.
[16] 李平兰,贺稚非.食品微生物学实验原理与技术[M].北京:中国农业出版社,2014.
[17] 任晓宁,张宇,陈其玲,等.不同发酵条件对模拟葡萄酒中酒酒球菌柠檬酸代谢的影响[J].食品工业科技,2017,38(4):180-185.
[18] 钱存柔,黄仪秀.微生物学实验教程[M].北京:北京大学出版社,1999.
[19] 凌代文.乳酸细菌分类鉴定及实验方法[M].北京:中国轻工业出版社,1999.
[20] BUCHANAN R E.伯杰细菌鉴定手册.中国科学院微生物研究所,译[M].北京:科学出版社,1984.
[21] HENICKLING T, SANDINE W E, HEATHRBELL D A. Evaluation of malolactic bacteria isolated from Oregon wine[J]. Appl Environ Microbiol, 1989, 55(8): 2 010-2 016.
[22] OTIENO D O, ASTHTON J F, SHAH N P. Isoflavone phytoestrogen degradation in fermented soymilk with selected β-glucosidase producing L. acidophilus strains during storage at different temperatures[J]. International Journal of Food Microbiology, 2007, 115(1):79-88.
[23] DICKS L M T, DELLAGLIO F, COLLINS M D. Proposal to rechssify Leuconostoc oenos as Oenococcus oeni[J]. Bacteriol, 1995, 45(2): 395-397.
[24] WU Chongde, HUANG Jun, ZHOU Rongqing. Progress in engineering acid stress resistance of lactic acid bacteria[J]. Applied Microbiology and Biotechnology, 2014, 98(3):1 055-1 063.
[25] BLATTEL V, LARISIKA M, PFEIFFER P, et al. β-1,3-glucanase from Delftia tsuruhatensis strain MV01 and its potential application in vinification[J]. Applied & Environmental Microbiology, 2011, 77(3):983-990.
[26] BETTERIDGE A L, SUMBY K M, SUNDSTROM J F, et al. Application of directed evolution to develop ethanol tolerant Oenococcus oeni for more efficient malolactic fermentation[J]. Appl Microbiol Biotechnol, 2018, 102(2):921-932.
HAO Nan1, MA Tengzhen1, YUN Jianmin1, YANG Xueshan1, LI Aixia1, CHEN Yanxiong2, HAN Shunyu1*
1(Gansu Agricultural University, Gansu Key Lab of Viticulture and Enology, Gansu Research and Development Center of Wine Industry, College of Food Science and Engineering, Lanzhou 730070, China)2(Gansu Qilian Winery Co.,Ltd, Gaotai 734304,China)
ABSTRACT The lactic acid bacteria (LAB) for wine making in China are mostly imported from foreign manufactures, which has caused serious homogenization of wine quality. In this study, wild-type LABs from natural malolactic fermented red wine in Gansu Hexi Corridor were isolated, identified and their fermentation adaptability was examined. Three strains that could initiate malolactic fermentation and degrade acids were identified as Pediococcus parvulus. Of which, strain C30 showed significantly higher biomass yield at low fermentation temperature (15℃), high ethanol concentration (14%) and high SO2 concentration (50 mg/L) than that of commercial LAB. In conclusion, strain C30 could be used as a malolactic fermentation starter for wines and has potential value in improving the wine quality in Gansu Hexi Corridor.
Key words wine; malolactic fermentation; strain selection; Pediococcus parvulus