表1 青稞、青稞酒糟营养成分 单位:g/100 g
Table 1 The nutrient content in highland barley and distiller’s grains

游茂兰1,邓婧1,覃小丽1,金剑波2,叶正荣2,易川虎3,刘雄1,3*
1(西南大学 食品科学学院,重庆,400715)2(昌都市农业科学研究所,西藏 昌都, 854000) 3(昌都君亲农业科技开发有限公司,西藏 昌都,854000)
摘 要 探究β-葡聚糖与传统青稞酒发酵间存在的相互影响,为传统青稞酒生产提供科学指导。检测传统青稞酒发酵过程中总糖、β-葡聚糖和乙醇的动态变化及营养成分在青稞酒与酒糟中的分布;采用青稞淀粉和β-葡聚糖模拟酿造工艺并利用显微镜观察β-葡聚糖与淀粉混合发酵物的形态。随发酵时间的延长酒醅总糖先增后减,β-葡聚糖含量逐渐下降,酒精度逐渐上升,部分β-葡聚糖溶入青稞酒而酒糟富集了蛋白质、粗纤维、总糖、β-葡聚糖(8.42 g/100g)和氨基酸(16 570.08 mg/100g);模拟工艺中淀粉分解率、还原糖生成量、酒精产量随β-葡聚糖浓度的升高而显著降低(P<0.05),且β-葡聚糖在酒精发酵过程中被部分降解。β-葡聚糖对淀粉的包裹作用可延缓或抑制酒曲对淀粉的分解,且其浓度越高抑制效果越明显。该研究为传统青稞酒酿造品质的提高和酒糟的高值化利用提供了科学参考。
关键词 传统青稞酒;β-葡聚糖;淀粉;发酵
第一作者:硕士研究生(刘雄教授为通讯作者,E-mail:liuxiong 848@hotmail.com)。
基金项目:国家大麦青稞产业技术体系(CARS-05-18)
收稿日期:2019-01-10,改回日期:2019-03-01
DOI:10.13995/j.cnki.11-1802/ts.019921
青稞是西藏地区的特色农作物,除加工传统糌粑外,多用于酿造青稞酒[1]。青稞酒是青藏高原的特色产品,距今已有2 000多年的历史[2]。据报道,2015年西藏青稞产量为70.85万t,而用于酿酒的青稞高达13万t[3]。西藏传统青稞酒的酿造是以蒸煮摊凉后的青稞为原料,加入酒曲糖化后装罐密封发酵而成[4]。酿造过程中青稞淀粉的分解率和利用效率是影响青稞出酒率的关键因素。本课题组发现青稞β-葡聚糖形成的高黏性环境会抑制淀粉的体外消化分解,且随β-葡聚糖分子质量和浓度的增大抑制效果越明显[5]。叶海生等[6]发现在糖化过程中释放的大量β-葡聚糖会影响麦汁或啤酒的过滤速度、酒体的稳定性及清晰度等。近年来,青稞酒的研究多集中于发酵工艺[7-9]、酒体风味特征[10-11]和菌种分析及筛选[12-14]等方面,关于β-葡聚糖对淀粉发酵影响的研究鲜见报道。此外,传统青稞酒酿造过程中存在的淀粉发酵效率低、产酒量低和酒品参差不齐等问题是否与β-葡聚糖含量有关尚未可知。
基于上述问题,本文以青稞为原料酿制传统青稞酒,并研究酿造过程中的总糖、β-葡聚糖和乙醇等成分的动态变化规律,以及青稞酒和青稞酒糟的营养组分的变化。并采用青稞淀粉和不同浓度梯度的β-葡聚糖模拟酿造工艺,分析不同浓度的β-葡聚糖对淀粉分解率、还原糖生成量和乙醇产量等的影响,从而探究β-葡聚糖对传统青稞酒发酵的影响,以期为提高传统青稞酒产量和改善其酿造品质提供基础理论依据和科学参考。
青稞,由西藏昌都市君亲农业科技开发有限公司提供;安琪酿酒曲,湖北安琪酵母股份有限公司;交联β-葡聚糖测定试剂盒,爱尔兰Megazyme公司;AAS18氨基酸混标、FNO6988水合茚三酮,购于国家标准物质标准样品信息中心;其他试剂均为国产分析纯。
HWS恒湿恒温培养箱,浙江宁波江南仪器厂;4K15型高速离心机,德国Sigma公司;UV-2450型紫外分光光度计,日本岛津公司;日立L-8900全自动氨基酸分析仪,日本日立公司。
1.3.1 传统青稞酒酿造工艺
传统青稞酒的酿造工艺基于文献[4,15-16]进行了改进。取适量青稞,洗净后浸泡过夜,于常压蒸煮90 min,当青稞籽粒吸水膨胀开裂(吸水率在150%~155%)、软硬适度即可。冷却至30 ℃后按煮前青稞质量的0.4%添加酒曲,装罐密封,并于30 ℃恒温发酵箱中发酵72 h。发酵结束后,在酒醅中按1∶1.5 (g∶mL)的比例添加凉开水,浸泡12 h后用两层纱布过滤,滤液即为青稞酒。
1.3.2 基本组分测定
β-葡聚糖采用NY/T 2006—2011《谷物及其制品中β-葡聚糖含量的测定》[17];还原糖采用GB 5009.7—2016《食品安全国家标准食品中还原糖的测定》[18];淀粉采用GB 5009.9—2016《食品安全国家标准食品中淀粉的测定》[19];酒醅中酒精度测定采用重铬酸钾比色法[20];青稞酒酒精度测定采用GB 5009.225—2016《食品安全国家标准酒中乙醇浓度的测定》[21];酸度和可溶性固形物测定采用GB/T 15038—2006《葡萄酒、果酒通用分析方法》[22];总糖含量是将样品水解后按还原糖方法测定。
1.3.3 青稞、青稞酒糟和青稞酒中氨基酸测定
青稞、青稞酒糟氨基酸测定:参照GB 5009.124—2016《食品安全国家标准食品中氨基酸的测定》[23]。青稞酒中氨基酸测定基于文献[24-26]进行改进,即取5 mL青稞酒于20 mL的水解管中,添加5 mL质量浓度为0.08 g/L 5-磺基水杨酸,混匀,并于4 ℃静置22 h;振荡水解管以混匀样液,取5 mL样液于离心管中并离心(8 000 r/min,20 min),取1 mL上清液于25 mL容量瓶中,用0.02 mol/L盐酸溶液稀释并定容,取适量稀释液过滤(膜孔径为0.22 μm),滤液置于进样小瓶中,上机测定。
1.3.4 青稞β-葡聚糖对淀粉发酵的影响
取6支试管按1~6进行编号,分别添加2 g青稞淀粉和10 mL蒸馏水,然后沸水浴糊化处理10 min; 待其冷却至室温,分别加入质量浓度为0、0.02、 0.04、0.06、0.08、0.1 g/mL的β-葡聚糖溶液10 mL,再以青稞淀粉质量的0.4%添加酒曲,并均质混匀,密封后于30 ℃条件下恒温发酵72 h,其中每次间隔12 h取样检测,测定淀粉水解率、还原糖、酒精度和β-葡聚糖的含量在整个发酵过程的变化情况。
另取5支试管并添加10 mL蒸馏水到试管中,然后分别加入质量浓度为0.02、0.04、0.06、0.08、0.1 g/mL的β-葡聚糖溶液10 mL,分别添加0.008 g酒曲(酒曲添加量与实验组相同),均质混匀,密封后于30 ℃条件下恒温发酵72 h,每次间隔12 h取样检测,检测β-葡聚糖含量在整个发酵过程中的变化情况。
本研究中每个试验重复3次,以平均值±标准偏差来表示试验结果。同时运用Microsoft Excel 2010和SPSS 19.0分析软件对数据进行整理与显著性分析(P<0.05为显著性差异),利用Origin 8.5和Microsoft Excel 2010对试验数据进行图与表的绘制。
由表1可知,与青稞原料相比,酒糟中的淀粉含量明显降低而蛋白质、粗纤维、总糖、β-葡聚糖的含量均显著升高(P<0.05)。这可能是因为在传统酿造过程中青稞淀粉被大量分解并发酵生成酒精,而其他营养成分残留、富集于酒糟中,从而使得青稞酒糟中除淀粉外的其他营养成分显著提高。
表1 青稞、青稞酒糟营养成分 单位:g/100 g
Table 1 The nutrient content in highland barley and distiller’s grains

注:表中不同小写字母代表差异显著,P<0.05。
如表2所示,与已报道的黄酒和日本清酒的基本理化指标相比,传统青稞酒的总糖、总酸、总固形物和酒精度均低于黄酒,但其总酸和总固形物含量均高于日本清酒,这与杜木英报道的研究结果一致[27]。此外,传统青稞酒中还含有少量β-葡聚糖。
表2 青稞酒基本理化指标
Table 2 Physical and chemical indexes of traditional highland barley wine

注:“-”表示未检出。
由表3可知,青稞酒中含有11种游离氨基酸,总量为318.43 mg/L;青稞和青稞酒糟均含有17种氨基酸,但青稞酒糟的氨基酸总量(16 570.08 mg/100 g)远高于青稞中的氨基酸总量(7 671.55 mg/100 g)。结合表1和表3可知,青稞酒糟中氨基酸种类全面且营养丰富,这说明传统发酵青稞酒的酒糟是一种高营养价值的食品加工副产物,可以进一步加工生产更高附加值的产品。
表3 青稞、青稞酒糟、青稞酒的氨基酸组成
Table 3 The amino acids content in highland barley, distillers' grains and wine
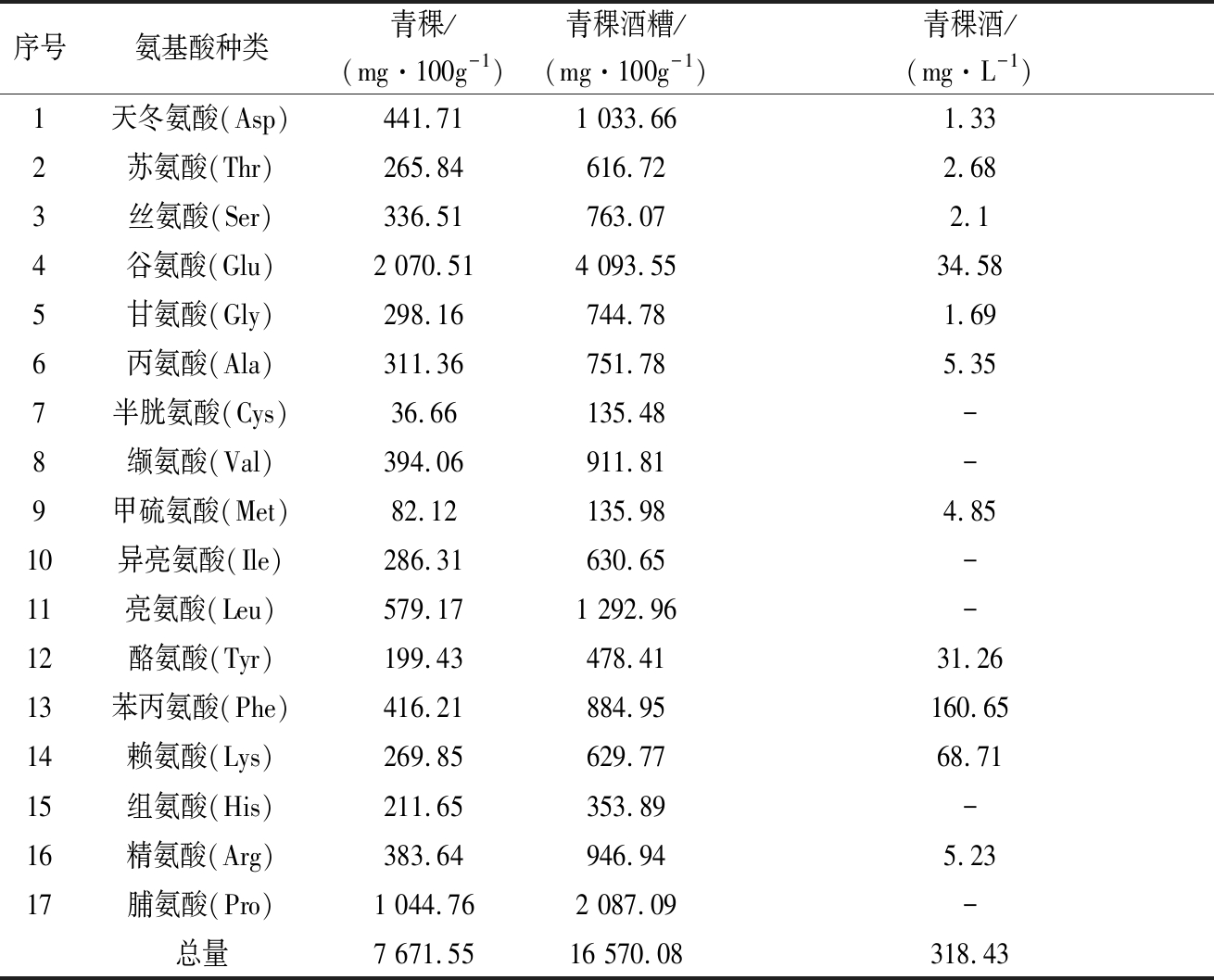
如图1所示,在传统青稞酒酿造过程中,酒醅的酒精度呈显著性增高(P<0.05),在60 h后急剧增加。
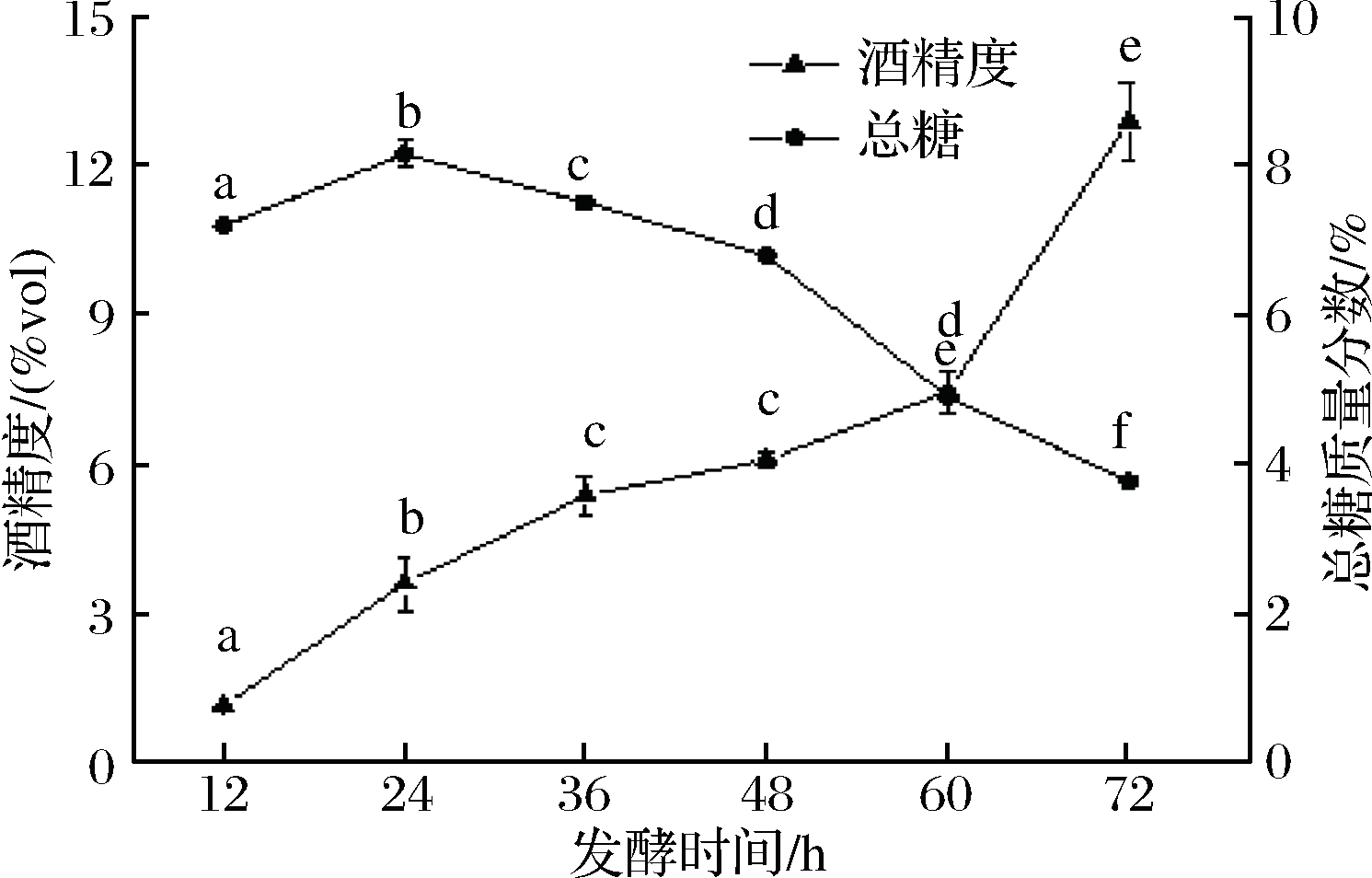
图1 发酵酒醅中总糖含量和酒精度变化情况
Fig.1 Change of total sugar content and ethanol content
注:图中不同小写字母代表差异显著,P<0.05。下同。
总糖含量在12~24 h呈上升趋势,24 h后开始降低,在48~72 h显著性降低(P<0.05)。这可能是因为青稞中糊化的淀粉在曲霉糖化酶的作用下首先转化生成可发酵糖,从而反映出总糖含量在12~24 h呈上升趋势;后期由于酵母菌大量利用可发酵糖转化为酒精和CO2,使得总糖含量在24~72 h呈下降趋势。
如图2所示,在发酵初期(12~24 h)β-葡聚糖含量缓慢下降;在发酵的中、后期(48~72 h)β-葡聚糖含量急剧下降。该变化趋势可能与青稞淀粉水解的可发酵糖的利用速度有关,在发酵后期可发酵糖绝大部分被分解转化成乙醇后(图1结果中48h后总糖急剧减少),微生物开始加速利用β-葡聚糖,导致后期β-葡聚糖含量急剧下降。
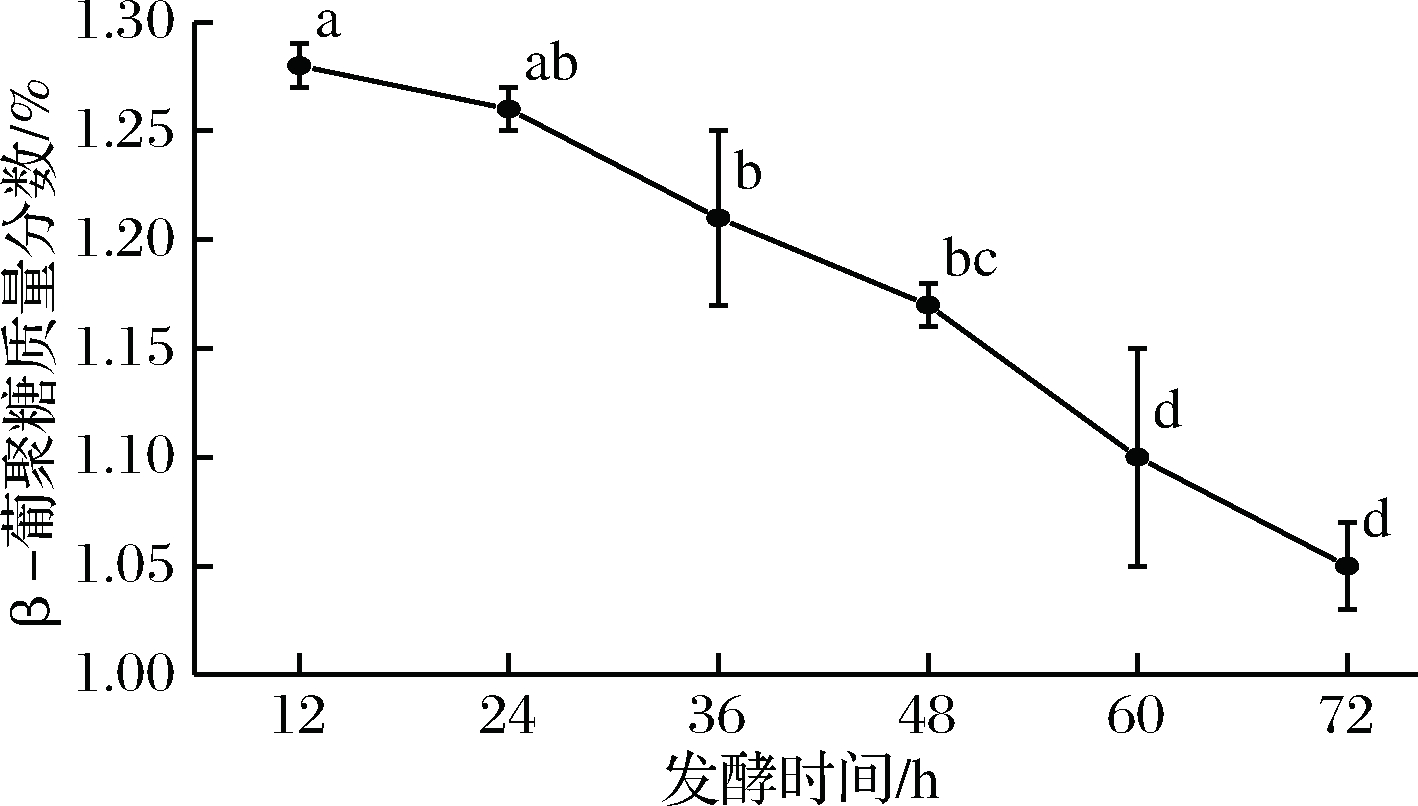
图2 发酵酒醅中β-葡聚糖含量变化情况
Fig.2 Change of highland barley β-glucan content
传统青稞酒的酿造首先是由曲霉糖化酶将青稞淀粉水解成可发酵糖类,再由酵母菌利用可发酵糖转化生成酒精。青稞中β-葡聚糖的存在对酒曲中微生物及其产生的酶水解利用淀粉产生阻碍。因此,采用青稞淀粉和不同浓度梯度的β-葡聚糖来模拟传统青稞酒的酿造过程,进一步了解β-葡聚糖在青稞酒发酵过程中对淀粉水解和发酵的影响情况。
2.5.1 不同浓度青稞β-葡聚糖对淀粉分解的影响
如图3所示,在同一发酵时间下β-葡聚糖浓度越高其淀粉的分解率越低。
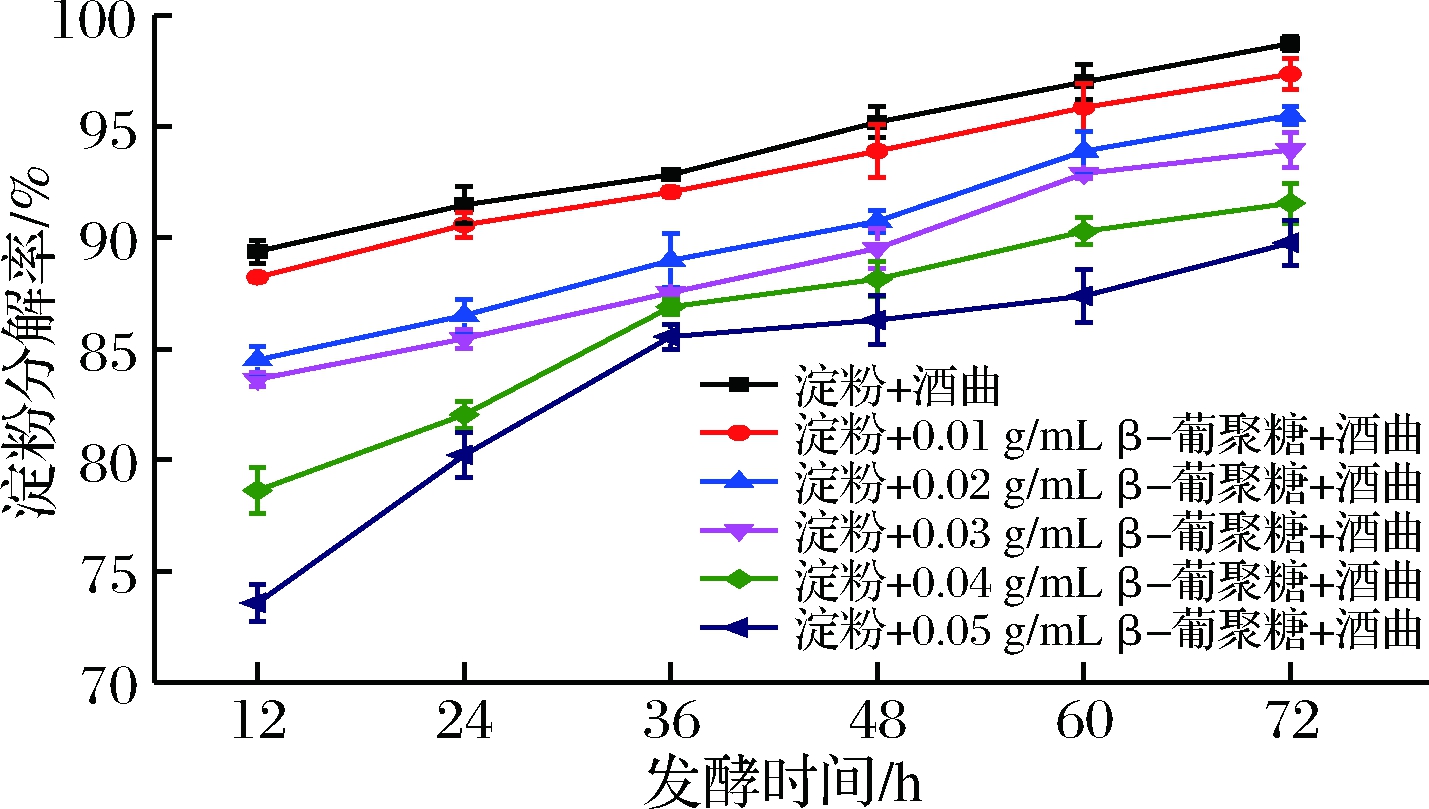
图3 不同质量浓度青稞β-葡聚糖与淀粉分解率的关系
Fig.3 The relationship between starch decomposition rate and highland barley β-glucan solutions at different concentrations
这说明高浓度的青稞β-葡聚糖能有效延缓或抑制淀粉被微生物分解利用。此外,随发酵时间延长,淀粉分解率逐渐增加。在高浓度β-葡聚糖存在的条件下(0.04和0.05 mg/mL),发酵前期(12~36 h)淀粉水解率增加幅度明显大于发酵后期(36~72 h),可能是因为β-葡聚糖在发酵初期大量包裹淀粉阻碍淀粉水解[5,28],因而淀粉水解率低,但随着包裹淀粉的β-葡聚糖被酒曲分解的水解酶水解,暴露淀粉量增多,淀粉水解率大幅提高,在发酵后期酒曲中酶量与所需水解的淀粉量间逐步达到供应平衡,因而水解率增幅放缓。由图3可知,在低浓度的β-葡聚糖存在时淀粉的分解情况与未添加β-葡聚糖组淀粉的分解趋势相似,但是β-葡聚糖浓度越高淀粉分解率越低。这也进一步说明了β-葡聚糖可能会延缓或抑制淀粉分解且其抑制效果与浓度有关。
2.5.2 不同浓度青稞β-葡聚糖对还原糖影响
由图4可知,添加β-葡聚糖的试验中还原糖含量呈先增(12~24 h)后减(24~60 h)再缓增(60~72 h)的趋势;空白组还原糖含量呈先增(12~24 h)后减(24~36 h)再缓增(36~72 h)。
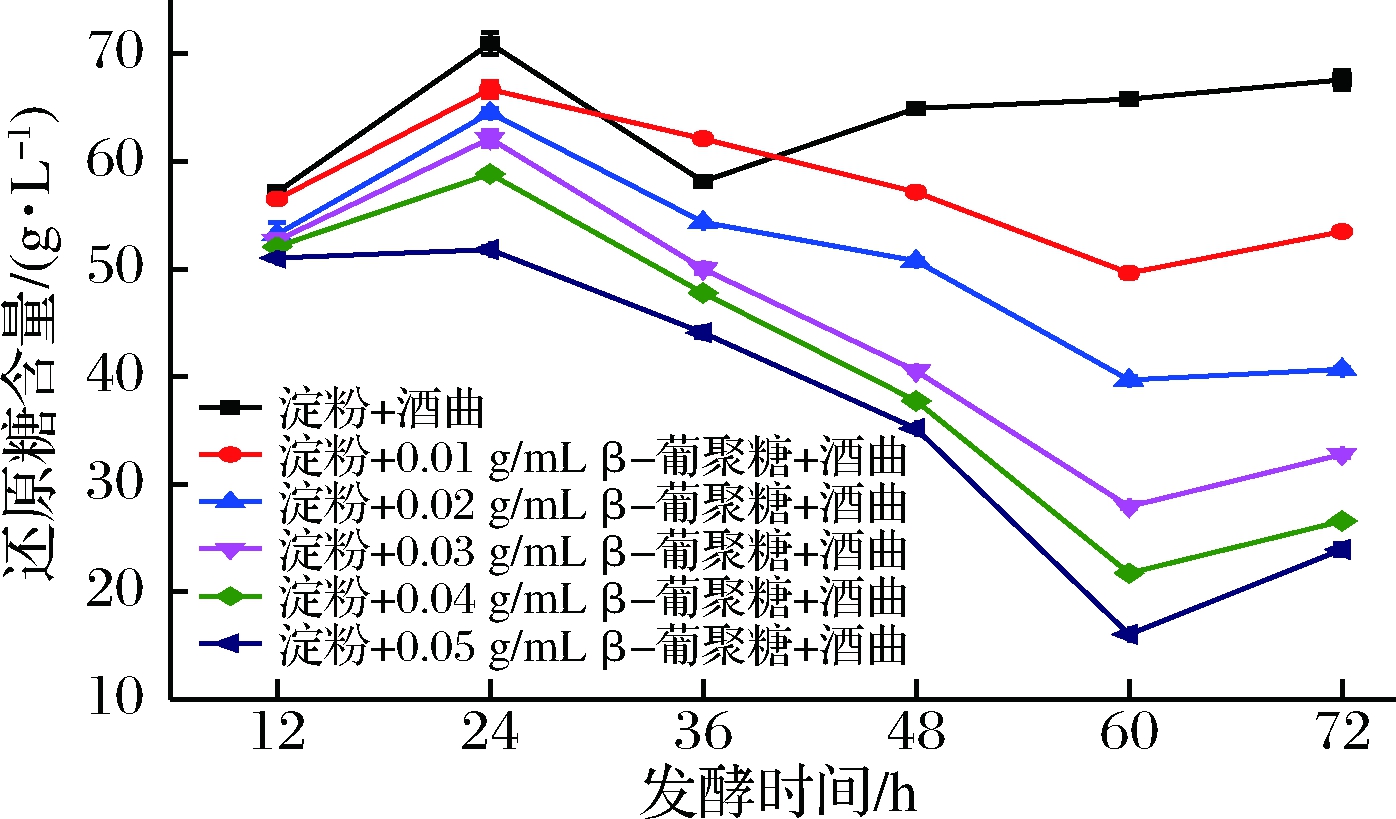
图4 不同质量浓度青稞β-葡聚糖与还原糖含量的关系
Fig.4 The relationship between reducing sugar content and highland barley β-glucan solutions at different concentrations
从空白组和试验组还原糖含量变化的时间可以看出,试验组整体较空白组明显延迟,并且在同一发酵时间下,青稞β-葡聚糖浓度越高的试验组,生成还原糖含量越低。此外,在0~12 h,酒醅中微生物开始生长并分泌出大量糖化酶分解淀粉产糖以满足酒曲中微生物繁殖需要,因此12 h时检测到还原糖存在;在12~24 h糖化过程占主导,曲霉继续大量分泌糖化酶使淀粉继续被分解,从而表现出还原糖含量在12~24 h持续升高;在24~60 h发酵过程占主导,此时由于发酵底物中淀粉减少,曲霉等微生物代谢减弱且酵母菌完成增殖后开始大量利用葡萄糖等可发酵糖产酒,从而表现出还原糖含量在24~60 h持续减少;在60~72 h,由于可发酵糖类已大量被转化为酒精,因此酵母菌等代谢活动减弱,而曲霉等继续糖化底物中残留的淀粉,从而表现出还原糖含量在60~72 h缓慢增加。该过程充分展示了一边糖化一边发酵的“双边”工艺。
2.5.3 不同浓度青稞β-葡聚糖对酒精度影响
由图5可知,酒精含量随β-葡聚糖浓度的增加而降低;在同一发酵时间下,β-葡聚糖浓度越高,淀粉发酵产生的酒精越少。这可能是随β-葡聚糖浓度的增加,阻碍了微生物分解利用淀粉,从而延缓或抑制淀粉发酵生成酒精。此外,菌种发酵时间会直接影响着乙醇产率,酒精度在12~48 h呈逐渐上升趋势,在48 h时酒精度达到最高,之后48~72 h酒精度呈逐渐下降趋势。这可能是在发酵初期(12~48 h)曲霉糖化酶分解淀粉产糖后不断被酵母菌在厌氧条件下发酵为酒精,在发酵后期(48~72 h)由于糖分减少,酵母可能开始利用发酵产物—酒精作为碳源来维持自身的生长和繁殖,从而使酒精度降低[29]。
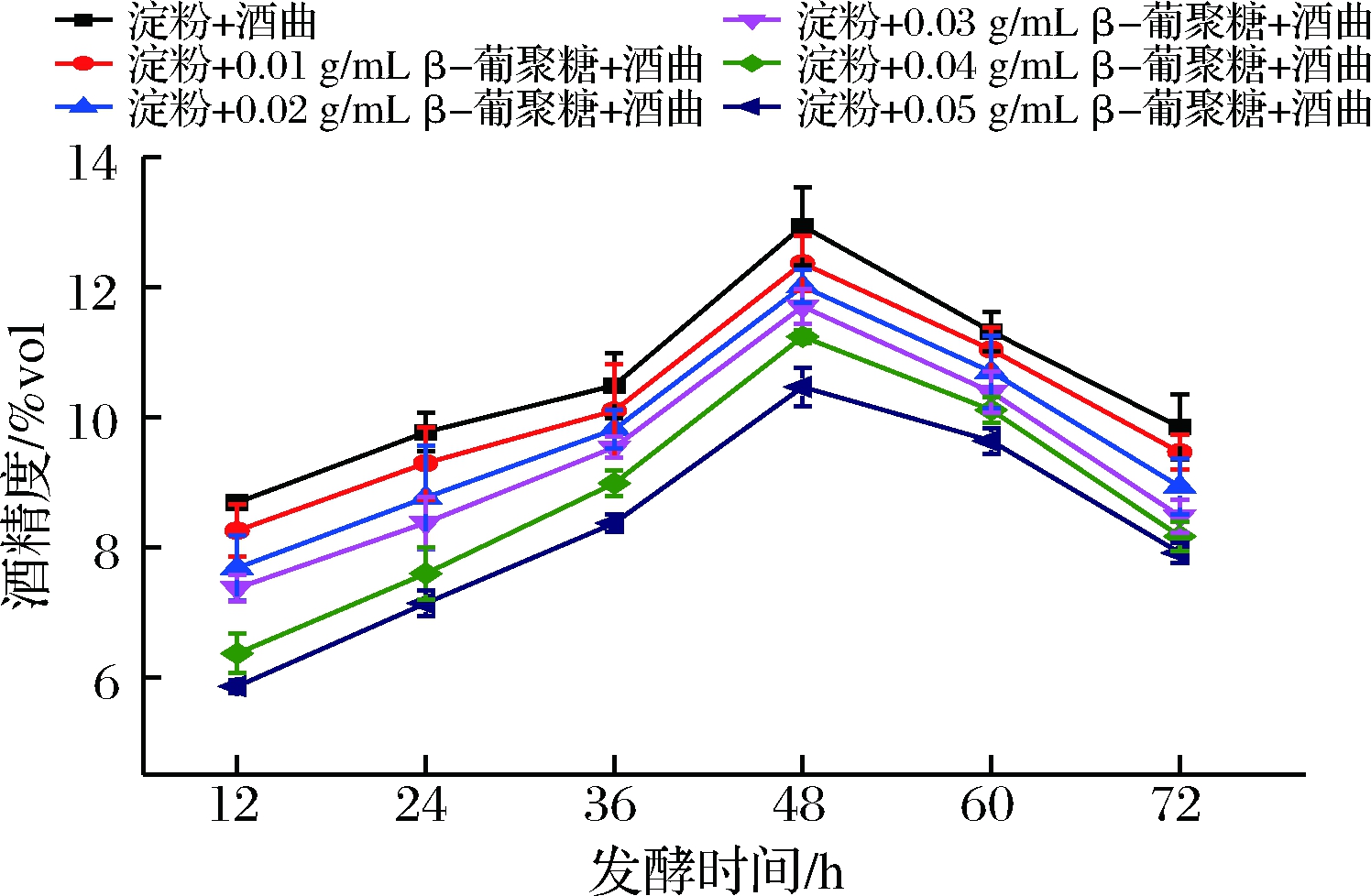
图5 不同浓度青稞β-葡聚糖与酒精度的关系
Fig.5 The relationship between ethanol content and highland barley β-glucan solutions at different concentrations
2.5.4 发酵过程中青稞β-葡聚糖含量变化情况
由图6可知,β-葡聚糖含量均随发酵时间延长而逐渐降低,且β-葡聚糖含量的减少趋势呈现先急后缓的特点。

图6 发酵过程中青稞β-葡聚糖含量变化情况
Fig.6 Change of highland barley β-glucan content during the fermentation period
如β-葡聚糖质量浓度为0.05 g/mL的试验组,β-葡聚糖在12~24 h减少迅速,24~60 h逐渐减少,60~72 h减少趋缓。这可能是因为β-葡聚糖浓度越高越易形成凝胶并包裹在淀粉颗粒表面[5,28],从而阻碍酒曲中微生物分解利用底物中的淀粉,致使微生物在发酵过程中首先分解利用包裹在淀粉颗粒表面的β-葡聚糖;当包裹在淀粉颗粒表面的β-葡聚糖被大量消耗利用后,淀粉颗粒“暴露”出来,酒曲中微生物又会大量分解利用淀粉,从而减缓了对β-葡聚糖的分解。
为探究酒曲中微生物对青稞β-葡聚糖的利用情况,在不添加淀粉仅添加β-葡聚糖和酒曲的情况下,模拟传统青稞酒发酵过程,对发酵过程中β-葡聚糖含量进行实时监测。由图7可知,随发酵时间延长,β-葡聚糖含量均显著降低(P<0.05),下降幅度远高于有淀粉的发酵(对比图6),说明酒曲中的微生物对β-葡聚糖利用能力强,但当有淀粉水解糖作为碳源时,可减缓酒曲微生物对β-葡聚糖的利用。因此,在青稞酒实际发酵过程中应控制发酵时间,减少功效成分β-葡聚糖被过度降解。
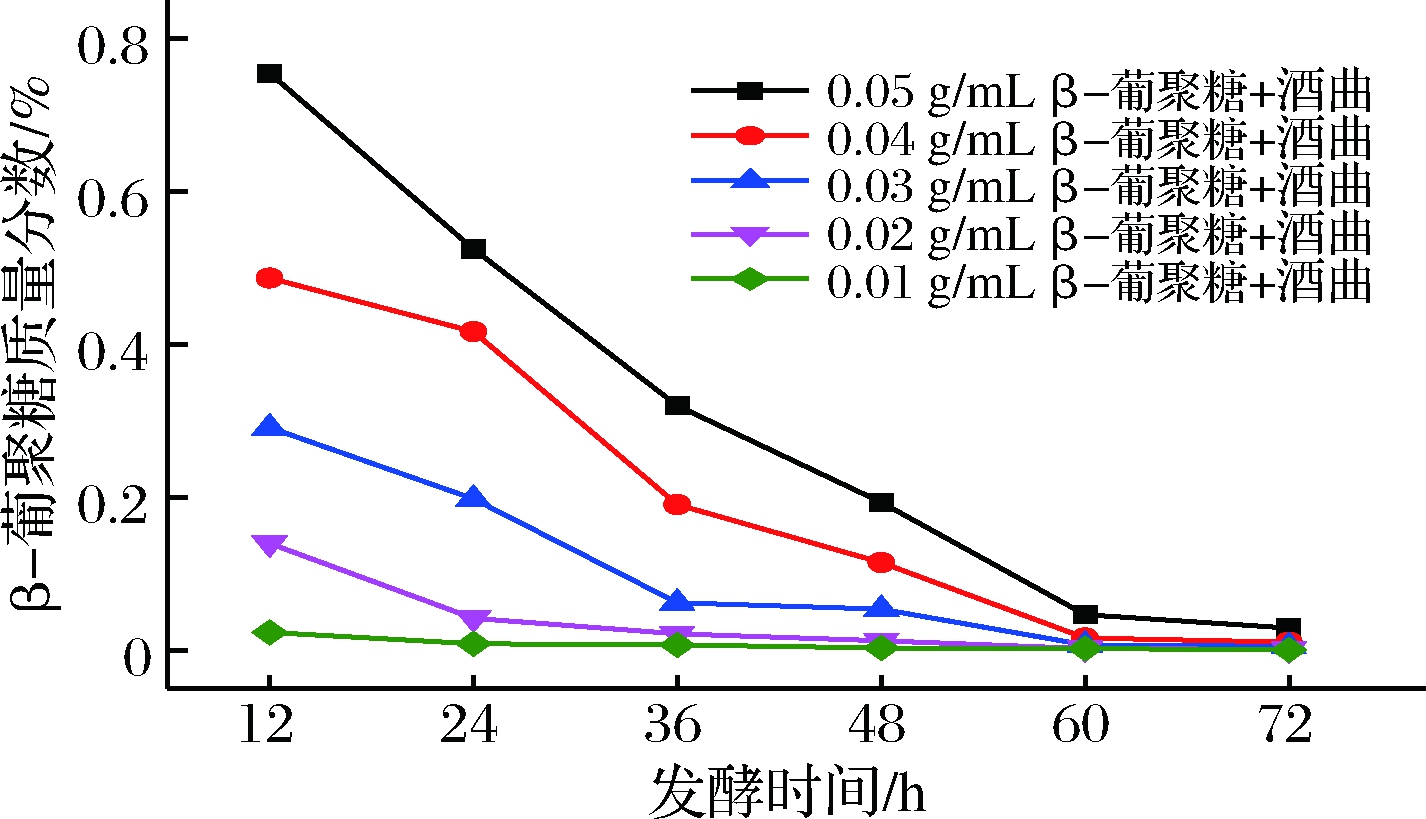
图7 酒曲中微生物对青稞β-葡聚糖利用情况
Fig.7 Utilization of highland barley β-glucan by microorganisms in yeast
为进一步研究β-葡聚糖与淀粉的相互作用,利用光学显微镜观察纯青稞淀粉以及β-葡聚糖和青稞淀粉的混合发酵物(如图8)。

A-纯青稞淀粉颗粒; B~F-发酵过程中青稞β-葡聚糖和青稞淀粉混合物; A~D-放大倍数为目镜×40; E和F-放大倍数为目镜×10
图8 青稞β-葡聚糖和青稞淀粉光学显微镜观察图
Fig.8 Optical micrographs of highland barley β-glucan and starch
由图8-A可知,纯青稞淀粉呈现清晰完整的大分子颗粒形态。图8-B~图8-F)是青稞β-葡聚糖和青稞淀粉混合发酵物的显微镜图,可以看出淀粉颗粒变得模糊且周围被呈凝胶块状的β-葡聚糖包裹覆盖,当淀粉颗粒大面积被β-葡聚糖包裹附着后会凝聚成团。这说明高浓度的青稞β-葡聚糖易形成凝胶并包裹淀粉使其凝集成团,这与FUMNAMI等[28]的研究一致。结合前面不同浓度β-葡聚糖对淀粉发酵的影响,可进一步说明β-葡聚糖对淀粉分解的抑制作用是由于β-葡聚糖对淀粉的包裹作用,淀粉与酶类接触的可能性降低,从而降低淀粉的发酵效率。
在传统青稞酒的酿造过程中,淀粉被水解利用,酒糟中的蛋白质、粗纤维、总糖、β-葡聚糖和氨基酸含量增加,且青稞酒糟的氨基酸总量(16 570.08 mg/100 g)远高于青稞的氨基酸总量(7 671.55 mg/100 g)。此外,随发酵时间延长,酒醅中总糖含量先增后减,β-葡聚糖含量逐渐下降,酒精度逐渐上升;在模拟酿造工艺中,淀粉分解率、还原糖生成量、酒精产量随β-葡聚糖浓度的升高而显著降低(P<0.05);显微镜结果表明β-葡聚糖对淀粉颗粒有包裹作用,可能阻碍了糖化酶与淀粉颗粒的接触,从而降低了青稞淀粉的发酵效率和产酒量。以上研究结果表明,β-葡聚糖能延缓或抑制淀粉乙醇发酵,且β-葡聚糖浓度越高抑制效果越明显。
研究还发现,传统发酵青稞酒的酒糟富集了蛋白质、β-葡聚糖、膳食纤维,可作为一种高营养价值的食品加工副产物,进一步深加工为高附加值产品。但酒曲中的微生物也能有效分解利用β-葡聚糖,因此,需要适度控制青稞酒发酵时间,减少β-葡聚糖损耗。
参考文献
[1] 刘新红,杨希娟,吴昆仑,等.青稞品质特性及加工利用现状分析[J].农业机械,2013 (14):49-53.
[2] 王丽华.西藏传统青稞酒的生产菌株选育及生产技术研究[D].重庆:西南大学,2008:10-11.
[3] 黄迪宇.青稞酒糟饮料的制备及稳定性研究[D].无锡:江南大学,2017:8-9.
[4] 杜木英,伍怡郦,阚建全,等.传统青稞酒发酵过程中化学成分动态变化的研究[J].食品工业科技,2007,28(9):94-98.
[5] 邓婧,马小涵,赵天天,等.青稞β-葡聚糖对淀粉体外消化性的影响[J].食品科学,2018,39(10):106-111.
[6] 叶海生.β-葡聚糖对啤酒酿造过程的影响及控制[J].啤酒科技, 2007(12):47-48.
[7] 王异静,杜丽娟,薛洁.青稞酒液态发酵工艺的研究[J].酿酒科技,2008 (6):59-61;64.
[8] 王晓芹,刘兴平,秦辉,等.新型青稞酒发酵前淀粉液化及糖化条件的优化研究[J].食品与发酵科技,2015,51(2):77-81;86.
[9] 张杰,曲宗,朗珍,等.拉萨地区传统青稞酒酿造工艺探究[J].中外食品工业,2014 (12): 1-3.
[10] 王雪薇,江伟,孙志伟,等.藏区传统青稞发酵酒的风味特征剖析[J].食品与发酵工业,2018,44(11):286-291.
[11] 高文俊.青稞酒重要风味成分及其酒醅中香气物质研究[D].无锡:江南大学,2014:7-8.
[12] 马斌,隋超,马长中.林芝青稞酒曲酵母菌的分离鉴定及性能测定[J].中国酿造,2017,36(2):80-84.
[13] 孔宇. 青稞酒酵母原位代谢特征及组合发酵技术研究[D].无锡:江南大学, 2014:8-9.
[14] 袁亦舟,张伟国,徐建中.青稞酒曲微生物多样性分析及米根霉制曲条件优化[J].食品与发酵工业,2018,44(5):39-45.
[15] 伍怡郦. 西藏传统青稞酒发酵技术的研究[D].重庆:西南大学, 2006:11-12.
[16] 曹妍,杜木英,阚建全,等.多菌种发酵青稞酒化学成分变化研究[J].食品科学,2012,33(11):252-256.
[17] NY/T 2006—2011 谷物及其制品中β-葡聚糖含量的测定[S].北京:中国标准出版社,2011.
[18] GB 5009.7—2016食品中还原糖的测定[S].北京:中国标准出版社,2016.
[19] GB 5009.9—2016 食品中淀粉的测定[S].北京:中国标准出版社,2016.
[20] 岳元媛,向文良,张文学,等.白酒发酵糟醅中残余酒精含量检测方法的探讨[J].中国酿造,2005,24(7):55-57.
[21] GB 5009.225—2016 酒中乙醇浓度的测定[S].北京:中国标准出版社,2016.
[22] GB/T 15038—2006葡萄酒、果酒通用分析方法[S].北京:中国标准出版社,2006.
[23] GB 5009.124—2016 食品中氨基酸的测定[S].北京:中国标准出版社,2016.
[24] 王翔,杨晓燕,张钰萍.侗家奇液酒中游离氨基酸含量测定分析[J].中国酿造,2012,31(2):182-186.
[25] 苗雨田,杨悠悠,王浩,等.全自动氨基酸分析仪法测定不同年份黄酒中游离氨基酸的含量[J].食品安全质量检测学报, 2015,6(4):1 154-1 161.
[26] 齐宁利,龚霄,马丽娜,等.超高效合相色谱法测定火龙果果酒中游离氨基酸的含量[J].食品与发酵工业, 2017,43(12):199-204.
[27] 杜木英.西藏青稞酒发酵微生物及酿造技术研究[D].重庆:西南大学,2008:54-55.
[28] FUNAMI T, NAKAUMA M, NODA S, et al. Effects of some anionic polysaccharides on the gelatinization and retrogradation behaviors of wheat starch: Soybean-soluble polysaccharide and gum arabic[J]. Food hydrocolloids, 2008, 22(8): 1 528-1 540.
[29] 张继泉,王瑞明,关凤梅,等.玉米秸秆同时糖化发酵生产燃料酒精的研究[J].纤维素科学与技术,2002,10(3):35-39.
YOU Maolan1, DENG Jing1, QIN Xiaoli1, JIN Jianbo2, YE Zhengrong2, YI Chuanhu3, LIU Xiong1, 3*
1 (College of Food Science, Southwest University, Chongqing 400715, China) 2 (Qamdo Institute of Agricultural Science, Qamdo 854000, China) 3 (Qamdo Jun Qin Agricultural Science and Technology Development Co., Ltd, Qamdo 854000, China)
ABSTRACT This research studied the effects of β-glucan on traditional highland barley wine fermentation. The dynamic changes in total sugar, β-glucan, and ethanol during fermentation, as well as the distribution of nutrients in traditional highland barley wine and distiller's grains were investigated. It was found that the total sugar content in the wine cellar increased first and then decreased, the β-glucan content gradually decreased while the alcohol content gradually increased, and some β-glucan dissolved into the highland barley wine with increasing fermentation time. On the other hand, the distiller's grains were enriched with protein, crude fiber, total sugar, β-glucan (8.42 g/100g), and amino acids (16 570 mg/100g). Moreover, the starch hydrolysis rate, the level of reducing sugar, and the amount of alcohol produced decreased significantly with increasing β-glucan (P<0.05). Besides, β-glucan was partially degraded during alcoholic fermentation. In conclusion, the encapsulation effect of β-glucan on starch delayed or inhibited starch hydrolysis dose-dependently. This study provides a scientific reference for improving the brewing quality of traditional highland barley wine and also for high value utilization of distiller’s grains.
Key words traditional highland barley wine; β-glucan; starch; fermentation