蔡国林1,2,3,刘逸凡2,李晓敏2,陆健1,2,3*
1(工业生物技术教育部重点实验室(江南大学),江苏 无锡,214122) 2(粮食发酵工艺与技术国家工程实验室(江南大学),江苏 无锡,214122) 3(江南大学 生物工程学院,江苏 无锡,214122)
摘 要 研究解淀粉芽孢杆菌JN4的胞外多糖(exopolysaccharide, EPS-JN4)对乳酸菌生长及代谢的调控作用,有利于阐明EPS-JN4定向增殖乳酸菌的作用机制。采用PCR-变性梯度凝胶电泳技术分析EPS-JN4的定向增殖作用,并考察其对主要乳酸菌生长、主要代谢产物、肠道耐受性和表面疏水性的影响。EPS-JN4可以定向增殖罗伊氏乳杆菌,其对罗伊氏乳杆菌JN125的前期增殖速度较葡萄糖慢,但最高菌浓为葡萄糖的5.25倍,代谢产物中乳酸和醋酸含量则较葡萄糖分别降低了12.2%和32.4%。EPS-JN4增殖的罗伊氏乳杆菌JN125的肠道耐受性和表面疏水性显著提高,对其原因初步分析表明细胞膜蛋白和脂类物质含量提高了40.8%和105.7%,细胞膜组成中的十八碳脂肪酸和不饱和脂肪酸显著提高。EPS-JN4可以作为潜在的益生元,用于调节动物肠道健康。
关键词 解淀粉芽孢杆菌;胞外多糖;乳酸菌;益生元;生长;代谢
第一作者:博士研究生,副研究员(陆健教授为通讯作者,E-mail:jlu@jiangnan. edu.cn)。
基金项目:国家重点基础研究发展计划(973计划,2013CB7336 02);高等学校学科创新引智计划(111计划)资助项目(111-2-06);江苏高校优势学科建设工程资助项目
收稿日期:2018-12-29,改回日期:2019-02-22
DOI:10.13995/j.cnki.11-1802/ts.019814
微生物胞外多糖(exopolysaccharides, EPS)是微生物在生长、代谢过程中分泌到细胞外的一类长链多糖[1-2]。对微生物细胞而言,EPS可以保护其对抗干燥、有毒害物质、噬菌体和渗透压等环境胁迫[3-4]。EPS具有水溶性、保湿性、增稠性和乳化性等物理化学特性,因此被广泛应用于食品工业中,如乳酸菌EPS可以改善发酵乳的黏度、质构和口感,是一种潜在的食品稳定剂[5-7]。此外,EPS还具有特殊的生理活性,如降低胆固醇、抗肿瘤和调节机体免疫能力等[8-9],是功能性保健产品和医药产品的重要成分。
近年来,EPS作为益生元促进肠道内有益微生物的生长和活性,进而调节肠道菌群、改善宿主健康成为EPS的研究热点[10-11]。由于EPS产生菌不同,这些EPS具有不同的组成和结构,因此其对有益菌的增殖效应也不相同。然而,目前对这些EPS的益生特性仅仅停留在是否增殖上,对增殖的益生菌的代谢及生理特性是否有影响和影响机制都缺乏深入的研究。目前,研究EPS的益生元特性主要集中在乳酸菌和双歧杆菌等公认安全的菌株,它们产生的EPS主要包括β-葡聚糖,β-果聚糖,α-葡聚糖和一些异元多糖[12-15]。然而,乳酸菌和双歧杆菌胞外多糖产量有限,大部分菌株EPS产量在1 g/L以下,限制其商业化应用[12]。而在我们前期的研究中发现,解淀粉芽孢杆菌JN4是一种潜在的益生菌,且EPS产量在20 g/L以上[16],远高于乳酸菌的EPS产量,但其益生元特性还尚未有文献报道。
本研究主要通过考察解淀粉芽孢杆菌JN4的胞外多糖EPS-JN4对肠道微生物的增殖作用及其对乳酸菌生长和代谢产物的影响,同时研究EPS-JN4对增殖的乳酸菌肠道耐受性和表面疏水性的影响及其初步影响机制,为其作为益生元的应用提供良好的基础。
将实验室保藏的解淀粉芽孢杆菌JN4活化,并接种至添加100 g/L蔗糖的LB培养基上,37 ℃、200 r/min发酵72 h,发酵液12 000×g、4 ℃离心20 min,向上清液中加入3倍体积的预冷无水乙醇进行过夜醇沉,12 000×g, 4 ℃离心20 min,用去离子水重新溶解沉淀,加入1/4体积的Sevage试剂(V(正丁醇)∶V(氯仿)=1∶5)除去蛋白质。将水相置于截留分子质量为8 000 u的透析袋中,透析72 h,每8 h换1次水,然后真空冷冻干燥,得到粗多糖。将粗多糖溶于50 mmol/L,pH 7.0的磷酸盐缓冲液中(10 g/L),用Hitrap DEAE FF离子交换色谱进行分离纯化,用含有1 mol/L NaCl的磷酸盐缓冲液线性梯度洗脱,按峰收集含糖组分并冷冻干燥。取经过离子交换柱纯化的多糖组分溶于适量50 mmol/L磷酸盐缓冲液中,用Sepharose Cl-6B进行凝胶过滤层析,用磷酸盐缓冲液进行洗脱,收集合并多糖组分,透析,冷冻干燥,得到纯化多糖EPS-JN4。
以健康成年鸡的新鲜粪便为样本,采用体外发酵的方法考察EPS对肠道微生物群落的增殖作用[17]。基础培养基(g/L):酪蛋白胨 2,明胶蛋白 2,酵母粉 7.5,半胱氨酸盐酸盐 0.5,氯化血红素 0.05,MnCl2·4H2O 0.05,NaHCO3 2,CaCl2 0.2,MgSO4 0.2,K2HPO41,NH4Cl 0.5,CoCl2·6H2O 0.05。以不添加碳源的基础培养基作为阴性对照,添加10 g/L葡萄糖作为阳性对照,添加10 g/L EPS-JN4作为实验组,121 ℃灭菌20 min。各组培养基灭菌冷却后,加入0.1% 过滤除菌的维生素溶液(mg/L):VK3 1,生物素2,VB12 0.5,泛酸钙10,烟酰胺5,对氨基苯甲酸5,硫胺素4。
收集4只健康成年鸡的粪便于250 mL灭好菌的离心管中,将其悬浮于无菌的0.1 mol/L pH 7.3的PBS缓冲液中,加无菌玻璃珠涡旋1 min,静置取上清液。将上清液以1%分别接种于上述发酵培养基中,37 ℃厌氧培养24 h。发酵液离心(8 000×g,4 ℃,10 min), 收集菌体进行DNA提取。采用粪便基因组抽屉试剂盒进行DNA提取。采用具有细菌16S rDNA基因的V3区通用引物F341-GC和R518进行扩增,随后进行变性梯度凝胶电泳(denaturing gradient gel electrophoresis, DGGE),对DGGE上的优势条带进行切胶回收并测序。
以常见的益生元低聚半乳糖(galactooligosaccharides,GOS)为参照,考察EPS-JN4对罗伊氏乳杆菌JN125生长的影响,罗伊氏乳杆菌JN125分离至上述鸡粪便发酵液。GOS和EPS-JN4的储备液(10%)用去离子水溶解,并经0.45 μm过滤除菌。GOS和EPS作为唯一碳源按10 g/L分别添加至基础MRS培养基中,接种5%的乳酸菌菌悬液(105 CFU/mL),在35 ℃ 静置培养72 h。以添加葡萄糖或不添加碳源分别作为阳性和阴性对照,每隔12 h取样检测乳酸菌数。
采用1.3的培养方法,分别在24、48和72 h取样,样品经离心,采用HPLC方法分析发酵液中有机酸(乳酸和醋酸)组成[18]。
在上述培养基中接种5%的乳酸菌菌悬液(108 CFU/mL), 过夜培养,5 mL离心,用pH 7.0的磷酸缓冲液洗涤3次,溶解在500 μL PBS中。取100 μL菌悬液加至900 μL的人工模拟肠液中,37 ℃振荡水浴处理2 h后进行活菌计数[19],每个处理重复3次。人工模拟肠液:取KH2PO4 6.8 g,加蒸馏水500 mL溶解,用0.1 mol/L的NaOH调节pH至6.8,加水定容至1 000 mL,加入1.0 g胰蛋白酶和3.0 g牛胆盐,充分溶解后经0.22 μm的微孔滤膜过滤除菌。
将待测菌液于4 ℃,10 000×g下离心5 min,收集菌体,用无菌的PBS缓冲液(pH=7.2)洗涤两次,用PBS缓冲液调整菌体浓度使其吸光度为1.00(OD560)。取3 mL菌液,分别加入0.6 mL的十六烷和甲苯,充分混合,待其静置分层后,取下层水相测定吸光度(OD560)[20]。表面疏水性计算见公式(1):
表面疏水性![]()
(1)
式中,A0为菌液与吸附剂混合前的吸光度;A为菌液与吸附剂混合后的吸光度。
离心获得菌体,分别用蛋白质和脂类提取缓冲液重新悬浮,80 000 Hz超声提取5 min,离心去掉残渣,并测定蛋白质和脂类物质的含量,结果以占细胞干重的比例显示[18]。
细胞膜脂肪按照邱然等的方法进行制备和甲基化,然后采用GC-MS的方法进行测定(Thermo Scientific TRACE 1310,ISQ LT)。细胞膜脂肪酸峰面积总和认为是100%,根据每种脂肪酸峰面积占总峰面积的比例计算脂肪酸的相对质量分数[21]。
数据分析采用SPSS 17.0进行,每个实验均重复3次,数据以平均值±标准偏差表示,并进行单因素方差分析(P<0.05)。
以不添加碳源和添加葡糖糖分别作为阴性和阳性对照,通过RCR-DGGE的方法研究EPS在厌氧情况下对肠道细菌体外发酵24 h后微生物群落结构的变化情况,结果如图1所示,对图1中的主要条带进行测序,比对结果如表1所示。由图1可以看出,在不添加碳源培养基中的优势菌有沙门氏菌和盲肠肠球菌;添加葡萄糖培养基中的优势菌主要有粪肠球菌和盲肠肠球菌,粪肠球菌是一种常见的乳酸菌,它的增殖有效抑制了沙门氏菌的生长;添加EPS-JN4培养基中的优势菌主要有罗伊氏乳杆菌、粪肠球菌、盲肠肠球菌和乳酸链球菌,与葡萄糖相比,EPS-JN4组乳酸菌的种类比较丰富,可能和其可以特异性增殖罗伊氏乳杆菌和乳酸链球菌,而这两种乳酸菌在实验样品中的数量较少有关。
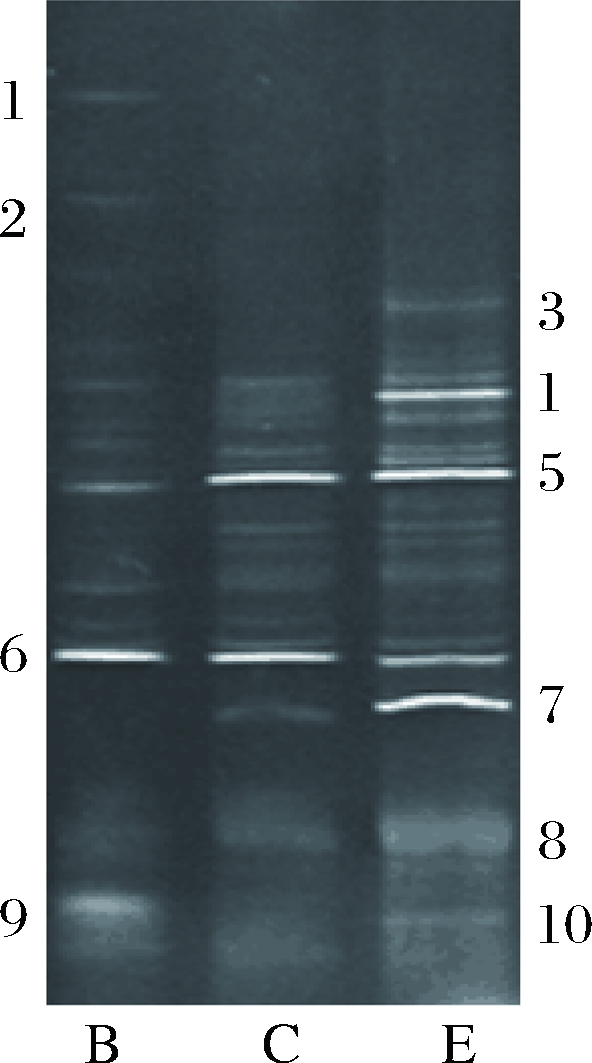
B-不添加碳源的阴性对照;C-添加葡萄糖的阳性对照;E-添加EPS的试验组
图1 EPS-JN4对鸡粪便菌群PCR-DGGE图谱的影响
Fig.1 Effect of EPS-JN4 on the DGGE fingerprint of faeces microbial community
表1 PCR-DGGE主要条带测序比对结果
Table 1 Sequence comparison of main bands in PCR-DGGE by sequencing and BLAST analysis

从EPS-JN4的鸡粪便发酵液中分离获得乳杆菌和乳球菌159株,经16S rDNA鉴定,将其中的1株罗伊氏乳杆菌JN125用于后续研究,考察EPS-JN4对其生长和代谢的影响。
以葡萄糖和常见的益生元GOS为对照,考察EPS-JN4对罗伊氏乳杆菌JN125生长的影响,结果如图2所示。
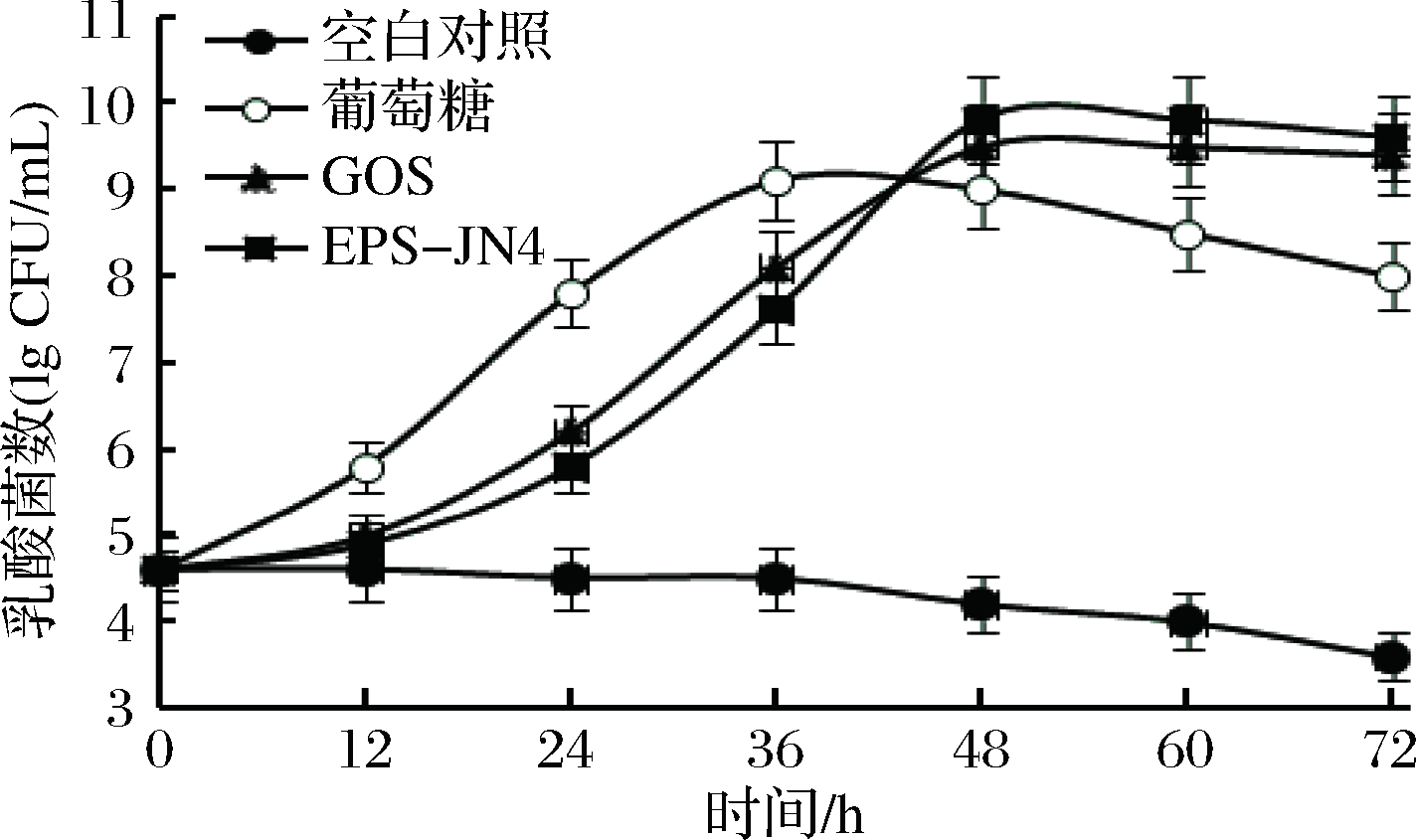
图2 EPS-JN4对罗伊氏乳杆菌JN125生长的影响
Fig.2 Effect of EPS-JN4 on the growth of Lactobacillus reuteri JN125
由图2可知,EPS-JN4对罗伊氏乳杆菌JN125具有明细的增殖作用。在前24 h里,葡萄糖组的增殖速度最快,达到6.3×107 CFU/mL,而GOS和EPS-JN4组增长较慢,分别为1.3×106 CFU/mL和6.3×105 CFU/mL。但在随后的24 h里,葡萄糖组基本保持稳定,达到最高的1.2×109 CFU/mL,而GOS和EPS-JN4组的增殖速度加快,在48 h时达到了3.2×109和6.3×109 CFU/mL, 分别为葡萄糖组最高时的2.67和5.25倍。GOS是1种以半乳糖为主要成分的益生元,前期的研究结果表明,EPS-JN4的主要成分为葡萄糖、半乳糖和氨基半乳糖,两者都富含半乳糖,这可能是它们具有相似的特异性增殖作用的原因。
乳酸和醋酸是乳酸菌的主要代谢产物,EPS-JN4对罗伊氏乳杆菌JN125代谢产生乳酸和醋酸的影响如表2所示。
表2 EPS-JN4对罗伊氏乳杆菌JN125代谢产生 乳酸和醋酸的影响
Table 2 Effect of EPS-JN4 on the production of lactic acid and acetic acid by Lactobacillus reuteri JN125
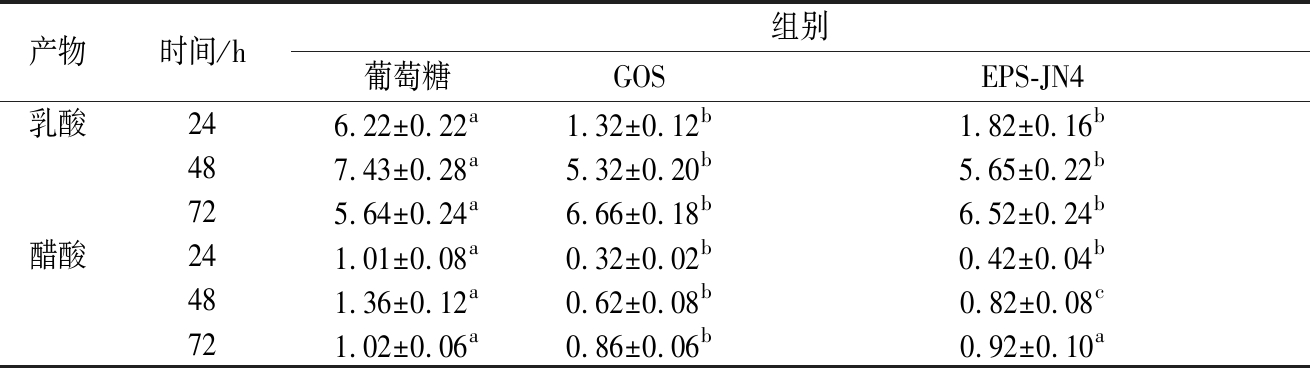
注:同一行相同字母表示不存在显著性差异。下同。
由表2可以看出,葡萄糖组较GOS组和EPS-JN4组产生更多的乳酸和醋酸,表明GOS和EPS-JN4可能更多地被罗伊氏乳杆菌JN125用于菌体生长,或代谢形成其他产物有关。另外,较低的乳酸和醋酸含量也可能降低了产物抑制作用[22],从而达到更高的菌浓。
比较葡萄糖、GOS和EPS-JN4增殖的罗伊氏乳杆菌JN125的肠道耐受性结构如表3所示。由表3可知,EPS-JN4和GOS增殖的罗伊氏乳杆菌JN125的肠道耐受性显著提高,这也意味着其在肠道存活下来并定殖的可能性增加。胆盐能够改变乳酸菌细胞膜的通透性,从而抑制其生长,同一菌株在不同培养基下肠道耐受性的改变,表明其细胞膜组成可能发生变化。
表3 EPS-JN4对罗伊氏乳杆菌人工肠液耐受性的影响
Table 3 Effect of EPS-JN4 on the intestinal juice tolerance of Lactobacillus reuteri JN125

比较葡萄糖、GOS和EPS-JN4增殖的罗伊氏乳杆菌JN125表面疏水性的影响,结果如图3所示。
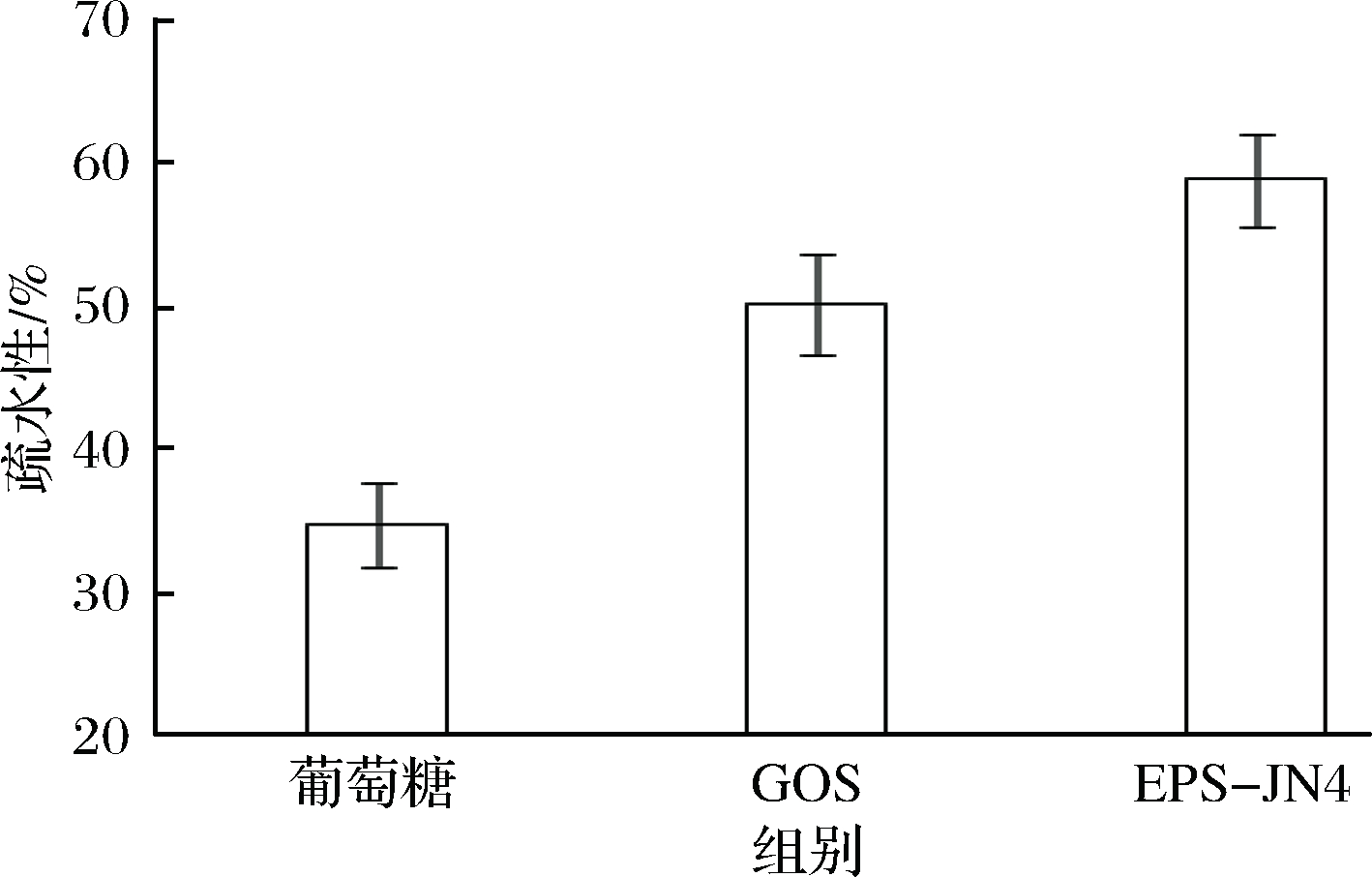
图3 EPS-JN4对罗伊氏乳杆菌JN125表面疏水性的影响
Fig.3 Effect of EPS-JN4 on thehydrophobicity of Lactobacillus reuteri JN125
由图3可知,EPS-JN4和GOS增殖的罗伊氏乳杆菌JN125表面疏水性显著提高,分别提高了69.7%和44.5%。由于菌株对肠道黏膜的黏附特性与表面疏水性成正相关,表面疏水性高的菌株更有利于肠道定殖[23]。结合肠道耐受性改变的结果分析,表明和葡萄糖增殖的罗伊氏乳杆菌JN125相比,EPS-JN4和GOS增殖的罗伊氏乳杆菌JN125的细胞膜组成可能发生了改变。
比较葡萄糖、GOS和EPS-JN4增殖的罗伊氏乳杆菌JN125细胞膜蛋白质和脂类物质含量的影响,结果如图4所示。由图4可知,GOS和EPS-JN4增殖的罗伊氏乳杆菌JN125细胞膜蛋白质和脂类物质含量显著提高,其中蛋白质含量提高了36.8%和40.8%,脂类物质含量增加了97.9%和105.7%。细胞膜是乳酸菌与外界环境接触的重要细胞结构,其组成与细胞应对环境胁迫密切相关[24]。
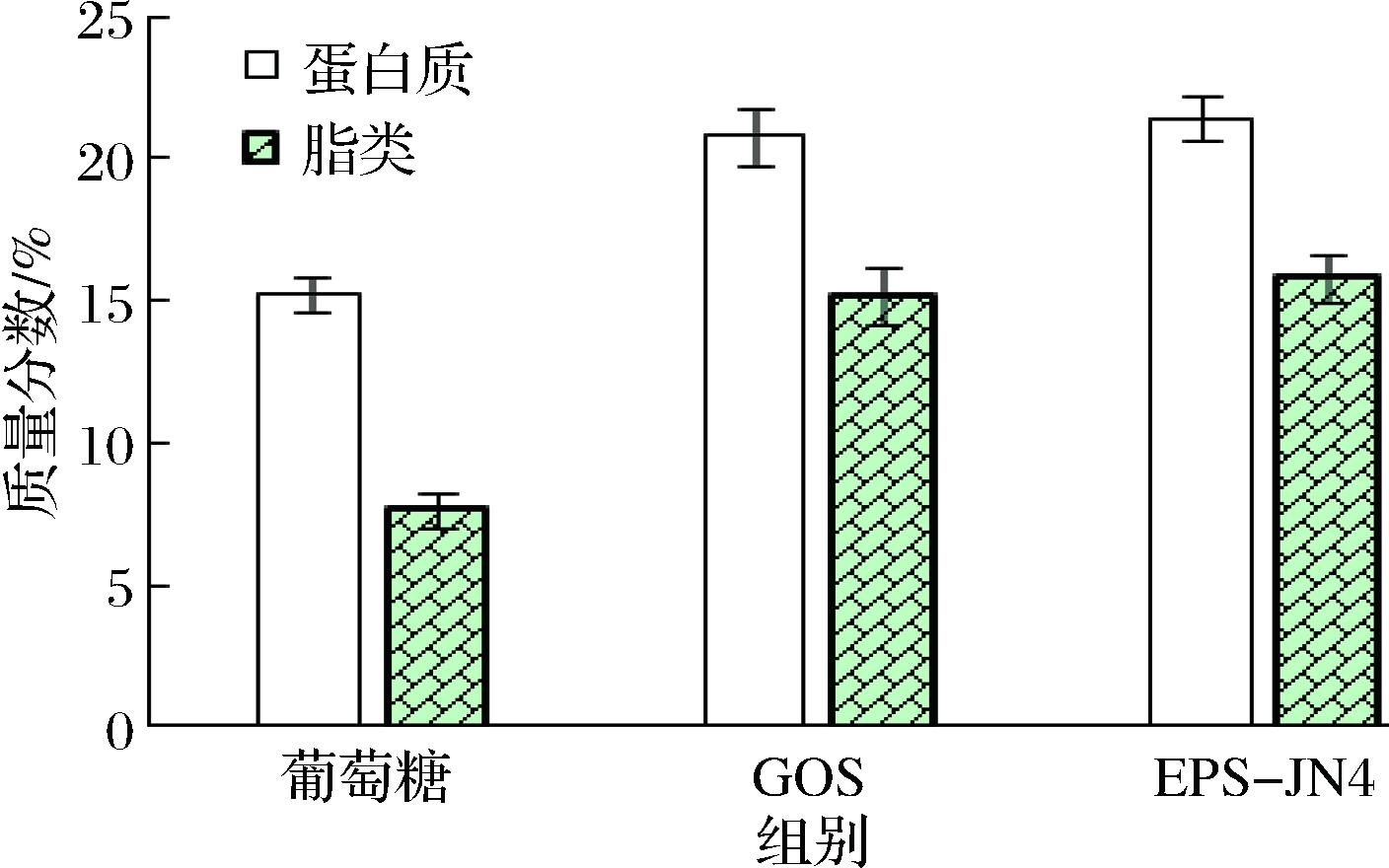
图4 EPS-JN4对罗伊氏乳杆菌JN125细胞表面蛋白和脂类含量的影响
Fig.4 Effect of EPS-JN4 on the protein and lipid content of Lactobacillus reuteri JN125
进一步对细胞膜脂肪酸组成进行分析,结果如表4所示。
表4 EPS-JN4对罗伊氏乳杆菌细胞膜脂肪酸组成的影响 单位:%(质量分数)
Table 4 Effect of EPS-JN4 on the fatty acid profile of Lactobacillus reuteri JN125

注:“-”表示未检出。
由表4可知,罗伊氏乳杆菌JN125细胞膜脂肪酸主要由十六碳,十七碳和十八碳脂肪酸组成,不同培养基增殖的罗伊氏乳杆菌JN125这3类脂肪酸占总脂肪酸的比例差异不显著,但GOS和EPS-JN4组的十八碳脂肪酸和不饱和脂肪酸比例明显高于葡萄糖组。由于乳酸菌膜脂肪酸组成在其耐受乙醇胁迫和酸胁迫方面也起到重要的调控作用,而且乳酸菌细胞膜脂肪酸的不饱和度决定了细胞膜的厚度和黏度,进而提高对环境胁迫的适应性[25]。因此,可推测在EPS-JN4存在的情况下,罗伊氏乳杆菌JN125细胞膜脂肪酸碳链长度增加,使得脂肪酸能容易横跨膜双分子层,并通过疏水作用与其他脂类和蛋白质结合,使脂肪酸链显得更紧凑,增加膜的稳定性,从而提高肠道耐受性和疏水性[25]。
解淀粉芽孢杆菌JN4的胞外多糖EPS-JN4对鸡粪便菌群中乳酸菌具有特异性的增殖作用,特别是对罗伊氏乳杆菌和乳酸链球菌具有很好的增殖作用。EPS-JN4对罗伊氏乳杆菌JN125的前期增殖速度较葡萄糖慢,但最高菌浓为葡萄糖的5.25倍。EPS-JN4还对罗伊氏乳杆菌JN125代谢产酸有影响,乳酸和醋酸含量较葡萄糖组分别降低了12.2%和32.4%。EPS-JN4增殖的罗伊氏乳杆菌JN125的肠道耐受性显著提高,表面疏水性提高了69.7%,对其影响原因初步分析表明细胞膜蛋白和脂类物质含量提高了40.8%和105.7%,十八碳脂肪酸和不饱和脂肪酸的比例显著提高。
参考文献
[1] SUTHERLAND I W. Novel and established applications of microbial polysaccharides[J]. Trends in Biotechnology, 1998, 16(1):41-46.
[2] ONER E T, HEMANDEZ L, COMBIE J. Review of Levan polysaccharide: From a century of past experiences to future prospects[J]. Biotechnology Advances, 2016, 34(5): 827-844.
[3] SCHMID J. Recent insights in microbial exopolysaccharide biosynthesis and engineering strategies[J]. Current Opinion in Biotechnology, 2018, 53:130-136.
[4] LIANG T W, WANG S L. Recent advances in exopolysaccharides from Paenibacillus spp.: Production, isolation, structure, and bioactivities[J]. Marine Drugs, 2015, 13(4): 1 847-1 863.
[5] BADEL S, BERNARDI T, MICHAUD P. New perspectives for Lactobacilli exopolysaccharides[J]. Biotechnology Advance, 2011, 29(1):54-66.
[6] FELS L, JAKOB F, VOGEL R F, et al. Structural characterization of the exopolysaccharides from water kefir[J]. Carbohydrate Polymers, 2018, 189: 296-303.
[7] ZHANG H, REN W, GUO Q B, et al. Characterization of a yogurt-quality improving exopolysaccharide from Streptococcus thermophilus AR333[J]. Food Hydrocolloids, 2018, 81, 220-228.
[8] YU X, AVALL-JAASKELAINEN S, KOOT J, et al. A comparative characterization of different host-sourced Lactobacillus ruminis strains and their adhesive, inhibitory, and immunomodulation functions[J]. Frontiers in Microbiology, 2017, 8:657.
[9] FUCHS V I, SCHMIDT J, SLATER M J, et al. Influence of immunostimulant polysaccharides, nucleic acids, and Bacillus strains on the innate immune and acute stress response in turbots (Scophthalmus maximus) fed soy bean- and wheat-based diets[J]. Fish Physiology and Biochemistry, 2017, 43(6): 1 501-1 515.
[10] POURABEDIN M, ZHAO X. Prebiotics and gut microbiota in chickens[J]. FEMS Microbiology Letters, 2015, 362(15): fnv122.
[11] GOULET O. Potential role of the intestinal microbiota in programming health and disease[J]. Nutrition Reviews, 2015, 73(Supp 1):32-40.
[12] SALAZAR N, GUEIMONDE M, DW LOS REYES-GAVIL N C G, et al. Exopolysaccharides produced by Lactic acid bacteria and Bifidobacteria as fermentable substrates by the intestinal microbiota[J]. Critical Reviews in Food Science and Nutrition, 2016, 56(9):1 440-1 453.
N C G, et al. Exopolysaccharides produced by Lactic acid bacteria and Bifidobacteria as fermentable substrates by the intestinal microbiota[J]. Critical Reviews in Food Science and Nutrition, 2016, 56(9):1 440-1 453.
[13] GOMAA E Z. Effect of prebiotic substances on growth, fatty acid profile and probiotic characteristics of Lactobacillus brevis NM101-1[J]. Microbiology, 2017, 86(5): 618-628.
[14] MOZZI F, GERBINO E, DE VADEZ G F, et al. Functionality of exopolysaccharides produced by lactic acid bacteria in an in vitro gastric system[J]. Journal of Applied Microbiology, 2009, 107(1): 56-64.
[15] TOLSTOGUZOV V. Why were polysaccharides necessary? [J]. Origins of Life and Evolution of Biospheres, 2004, 34(6): 571-597.
[16] 蔡国林, 冯文旭,刘逸凡,等. 高产抑制大肠杆菌血凝性的胞外多糖的解淀粉芽孢杆菌[J]. 食品与发酵工业,2019,45(5):14-18.
[17] JACOBS C M, UTTERBACK P L, PARSONS C M. Cecal microbial populations of young chicks fed several prebiotic-type compounds as determined by DGGE and quantitative PCR[J]. Journal of Dairy Science, 2010, 93:283-283.
[18] GOMAA E Z. Effect of prebiotic substances on growth, fatty acid profile and probiotic characteristics of Lactobacillus brevis NM101-1[J]. Microbiology, 2017, 86(5):618-628.
[19] DAS D, BARUAH R, GOYAL A. A food additive with prebiotic properties of an α-d-glucan from Lactobacillus plantarum DM5[J]. International Journal of Biological Macromolecules,2014, 69:20-26.
[20] 杨亚威, 赵爱梅,王辑,等. 传统奶豆腐中产胞外多糖乳酸菌的分离筛选及其潜在益生菌特性[J]. 中国乳品工业, 2015, 43(12):8-13.
[21] 邱然, 陆健. 啤酒污染菌的鉴定及其细胞膜脂肪酸的组成分析[J].食品与发酵工业, 2017, 43(7):55-61.
[22] DE PRETER V, HAMER H M, WINDEY K, et al. The impact of pre- and/or probiotics on human colonic metabolism: Does it affect human health?[J]. Molecular Nutrition and Food Research, 2011, 55(1):46-57.
[23] ZHANG B, WANG Y P, TAN Z F, et al. Screening of probiotic activities of Lactobacilli strains isolated from traditional Tibetan Qula, a raw yak milk cheese[J]. Asian-Australasian Journal of Animal Sciences, 2016, 29(10):1 490-1 499.
[24] SUZUKI K,IIJIMA K,SAKAMOTO K,et al. A review of hop resistance in beer spoilage lactic acid bacteria[J]. Journal of the Institute of Brewing, 2006, 112(2):173-191.
[25] MYKYTCZUK N C S, TREYORS J T, LEDUC L G, et al. Fluorescence polarization in studies of bacterial cytoplasmic membrane fluidity under environmental stress [J]. Progress in Biophysics and Molecular Biology, 2007, 95(3):60-82.
CAI Guolin1,2,3, LIU Yifan2, LI Xiaomin2, LU Jian1,2,3*
1 (Key Laboratory of Industrial Biotechnology, Ministry of Education (Jiangnan University), Wuxi 214122, China) 2 (National Engineering Laboratory for Cereal Fermentation Technology (Jiangnan University), Wuxi 214122, China) 3 (School of Biotechnology,Jiangnan University, Wuxi 214122, China)
ABSTRACT This study aimed to investigate the effects of exopolysaccharides from Bacillus amyloliquefaciens JN4 (EPS-JN4) on the propagation and metabolism of probiotics. The specific proliferative effects of EPS-JN4 were analyzed by PCR-denaturing gradient gel electrophoresis, and their effects on the growth, metabolites, intestinal tolerance, and surface hydrophobicity of lactic acid bacteria were also determined. It was found that EPS-JN4 had a specific proliferative effect on Lactobacillus reuteri. Compared to glucose, the early proliferation rate of L. reuteri JN125 treated with EPS-JN4 was slower, but its highest biomass was 4.25 times higher. In addition, the contents of lactic acid and acetic acid reduced by 12.2% and 32.4%, respectively. The intestinal tolerance and surface hydrophobicity of EPS-JN4-treated L. reuteri JN125 significantly improved, which could be due to the protein and lipid contents in cell membranes increased by 40.8% and 105.7%, respectively. Besides, the proportions of 18 C fatty acids and unsaturated fatty acids in cell membranes significantly increased. In conclusion, EPS-JN4 can be used as a potential prebiotic to regulate the intestinal health of animals.
Key words Bacillus amyloliquefaciens; exopolysaccharide; lactic acid bacteria; prebiotic; growth; metabolism