杨朝霞1,2*,李梅1,2,盛贤斌2, 董建军1,2
1(啤酒生物发酵工程国家重点实验室,山东 青岛,266061)2(青岛啤酒股份有限公司,山东 青岛,266061)
摘 要 为研究啤酒苦味物质组成,利用高效液相色谱法(high performance liquid chromatography,HPLC)建立了啤酒中的葎草灵酮、希鲁酮和异α-酸的检测新技术。以高甲酸颗粒酒花为原料,60 ℃高温空气氧化后,采用Alltima C18色谱柱分离,以体积分数为0.05%的磷酸和乙腈为流动相梯度洗脱,结合色谱图和紫外光谱特性得到葎草灵酮和希鲁酮的参考标样;用C18 固相萃取柱(solid-phase extraction, SPE)进行样品前处理。该方法的相对标准偏差2.18%~3.59%;葎草灵酮、希鲁酮和异α-酸的最小检出限分别为0.03、0.03和0.05 mg/L;回收率95%~115%。分析了市售不同品类啤酒中苦味物质组成,淡色Lager、皮尔森、小麦啤酒和黑啤酒中,葎草灵酮和希鲁酮含量均不高(<2 mg/L);而IPA啤酒中葎草灵酮、希鲁酮和异α-酸含量较高,且不同品牌苦味物质组成存在较大差异。该方法为后续开展葎草灵酮、希鲁酮的苦感研究及IPA啤酒苦味物质调控提供了有效的检测手段。
关键词 啤酒;苦味;葎草灵酮;希鲁酮;异α-酸;高效液相色谱
第一作者:硕士,高级工程师(本文通讯作者,E-mail:yangzx@tsingtao.com.cn)。
基金项目:国家高技术研究发展(863)计划(2013AA102109)
收稿日期:2018-09-29,改回日期:2019-02-28
DOI:10.13995/j.cnki.11-1802/ts.018940
苦感是啤酒区别于其他酒种最重要的风味特征之一。啤酒的苦味物质来源复杂,主要来自于酒花的苦味酸(α-酸和β-酸)、以及苦味酸的异构化、氧化、降解等产物[1-5]。通常情况下,最受酿酒师们关注的是酒花α-酸在麦汁煮沸过程的异构化产物——异α-酸,因其苦感强度和含量较高,成为Lager啤酒中最重要的苦味物质;另外,异α-酸的还原制品(二氢、四氢和六氢异α-酸)也具有不同的苦感强度和苦味特性,可在发酵后期少量添加用于苦感修饰。国内对啤酒中苦味物质的检测方法研究多集中在异α-酸及其还原制品[6-8]。
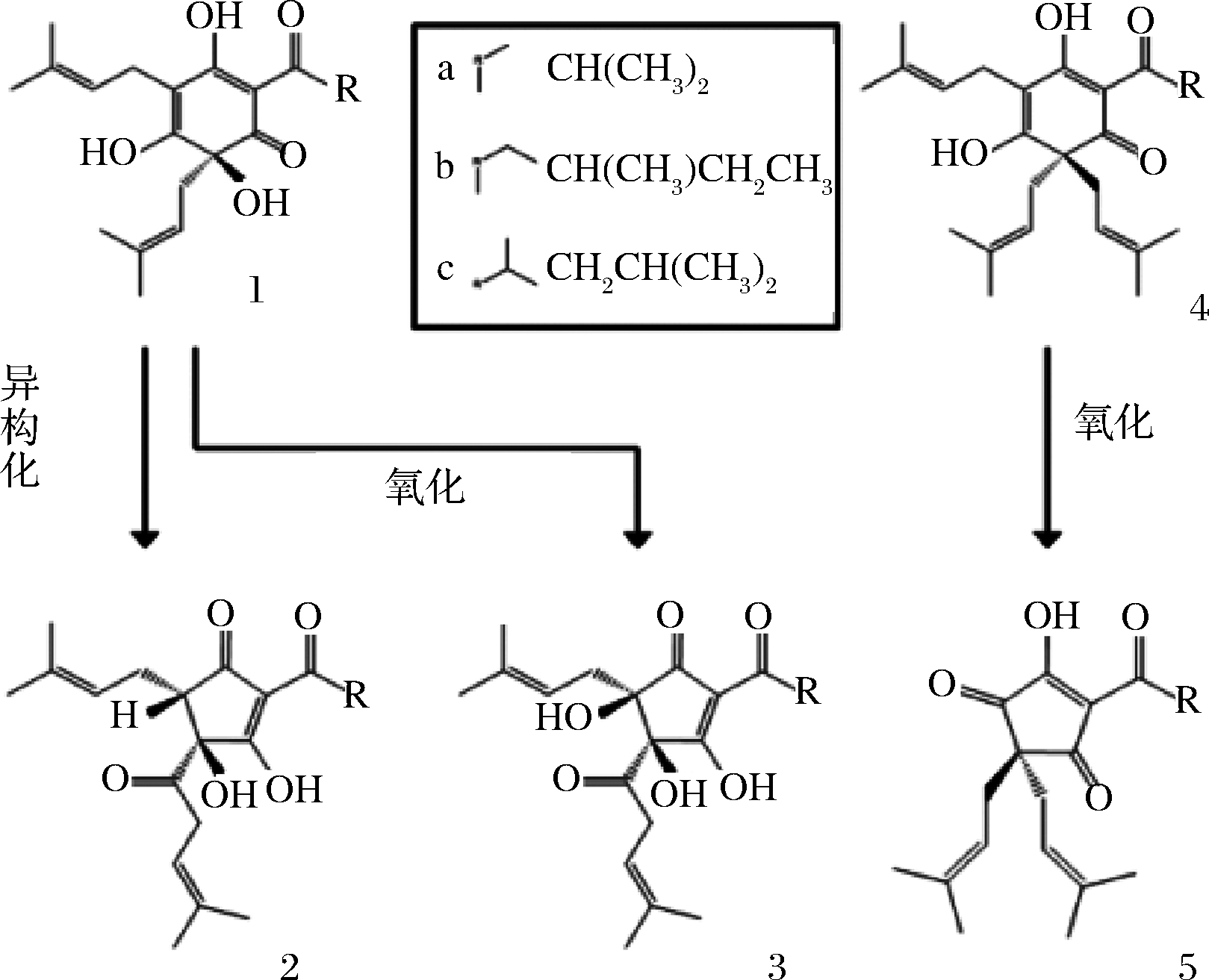
近年来,随着现代分析技术的应用,对苦味酸氧化物的物质组成、结构鉴定取得了较大进展,诸多新型的氧化、衍生产物得到确认[9-12]。在众多苦味酸衍生物中,α-酸氧化物——葎草灵酮和β-酸氧化物——希鲁酮是目前较受酿酒师们关注的新型苦味物质。特别是在高酒花添加量的啤酒品类(如India Pale Ale,IPA)中,葎草灵酮和希鲁酮的含量可达几个~几十个毫克级,是仅次于异α-酸的苦味物质,这与其特殊的酒花添加工艺和添加量有关。有文献报道,葎草灵酮和希鲁酮的苦感强度分别可达到异α-酸的66%和84%[13]。图1显示了源自酒花的主要苦味物质[13],包括α-酸、β-酸及其主要的异构化和氧化产物,其中每一类化合物都因其R-取代基的不同,成为一系列结构相似的同系物(如α-酸主要包括:合葎草酮、律草酮、加律草酮)。

1-α-酸;2-异α-酸;3-葎草灵酮;4-β-酸;5-希鲁酮;a、b、c为R-的不同取代基
图1 源自酒花的主要苦味物质
Fig.1 Bitter compounds of interest and their origins
对于葎草灵酮和希鲁酮的检测,国外文献报道中是通过将酒花浸膏中的α-酸和β-酸进行提纯,分别获得含量较高的α-酸和β-酸的浸膏,然后通过强氧化剂(如过氧化氢异丙苯)进行氧化,经提纯后得到纯度较高的葎草灵酮和希鲁酮,作为液相色谱(high performance liquid chromatography,HPLC)分析的标准品[9,13-14]。图2为提纯后的葎草灵酮、希鲁酮和异α-酸的紫外吸收光谱[13]。啤酒样品经过液液萃取等方式富集后,利用HPLC进行定性定量[14]。该方法得到葎草灵酮和希鲁酮纯度高,有利于后续对样品中待测组分的定性和定量;但缺点是首先要对酒花原料进行提纯,且使用强氧化剂,试验条件要求高,操作步骤繁琐,普通实验室难以实现,尚无商业化产品。目前国内在此方面尚未开展研究。
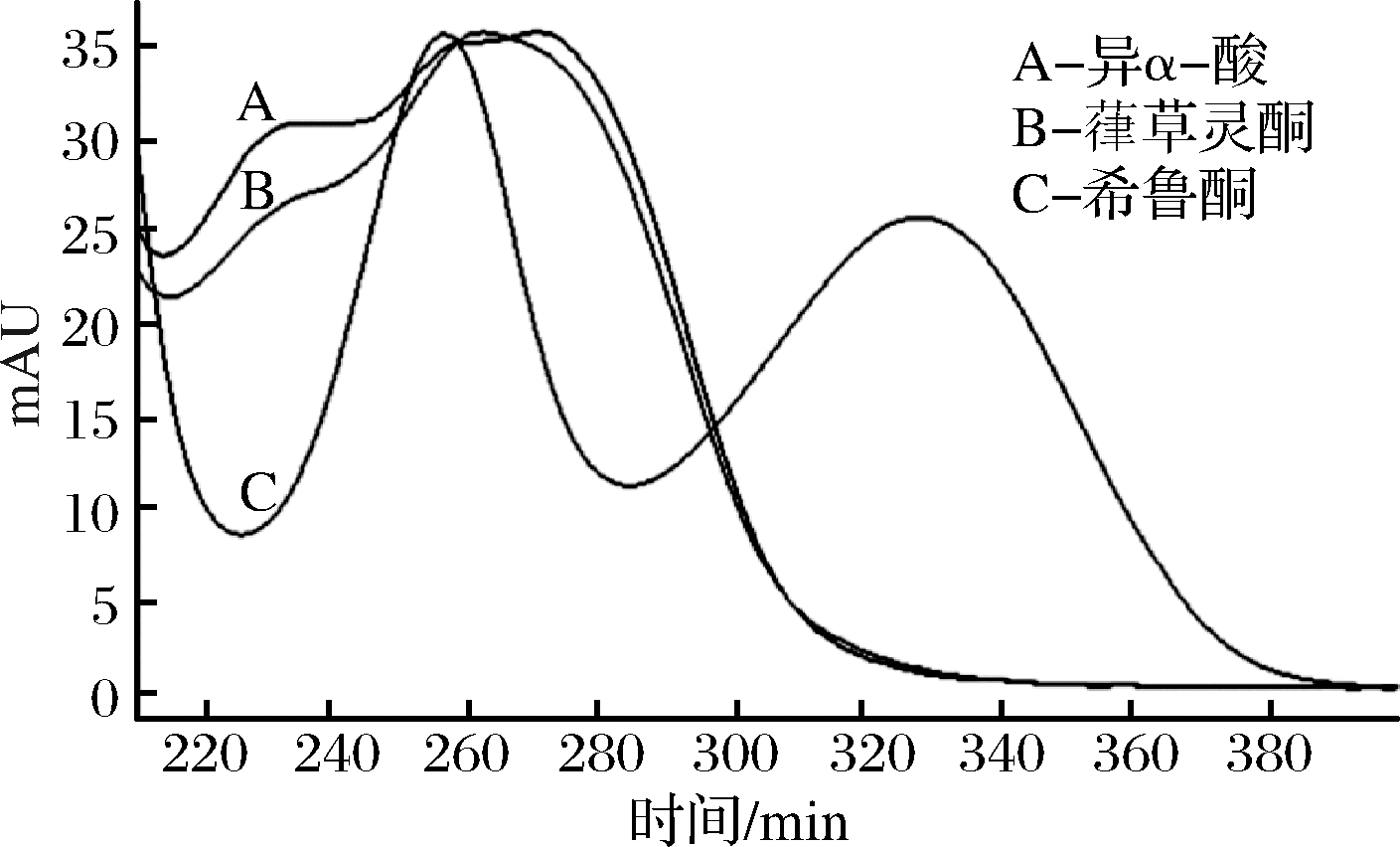
图2 异α-酸、葎草灵酮和希鲁酮的紫外吸收光谱
Fig.2 Absorbance spectra of isocohumulone, cohumulinone and cohulupone
本文采用高甲酸酒花颗粒作为原料,在高温下进行空气氧化,获得酒花苦味酸氧化物的混合物;经过乙醇浸提后通过HPLC进行分离,结合文献报道的葎草灵酮和希鲁酮的色谱图和色谱峰的紫外光谱特性进行定性,并以此作为HPLC分析的定性参考标样。同时,结合与葎草灵酮结构相似的商业化异α-酸标准品进行相对定量。啤酒样品则通过固相萃取(solid-phase extraction, SPE)方式进行前处理,将其中的葎草灵酮、希鲁酮和异α-酸进行富集浓缩后进行HPLC定量分析。本方法操作简单,重现性强,可用于啤酒中葎草灵酮、希鲁酮和异α-酸的同时检测,为研究不同品种啤酒苦味物质组成和各组分对苦感的影响提供技术手段。
C18和PEP固相萃取SPE柱(Supelclean ENVI-18,3 mL,Supelco公司);高甲酸Herkules酒花颗粒(其中含有质量分数为18%的α-酸18%、质量分数为5%的β-酸,斯丹纳酒花公司);啤酒样品均为市售啤酒。
乙腈(色谱纯,Burdick & Jackson),无水乙醇(分析纯,南京化学试剂),磷酸(质量分数85%,国药集团),异-α酸标样(质量分数64.3%,American Society of Brewing Chemists)。
Alliance e2695 液相色谱仪、2998二极管阵列检测器,美国Waters公司;Milli-Qntegral 5超纯水机,美国Millipore公司;6110 Balance电子天平,德国Sartorius公司。
将粉碎后的酒花颗粒置于60 ℃烘箱中,高温空气氧化0~4 d。将氧化产物用乙醇浸提,利用HPLC进行分析,采集每个色谱峰从200~400 nm的紫外吸收光谱,通过对比文献中已定性的葎草灵酮和希鲁酮的紫外吸收光谱定性分析氧化产物中的葎草灵酮和希鲁酮,从而得到参考标样。
色谱柱:Alltima C18 (150 mm×4.6 mm,5 μm);柱温:30 ℃;检测波长:260 nm;进样量:10 μL;流动相: A体积分数为0.05%的磷酸溶液,经过滤后超声脱气;B为乙腈,高纯He脱气;流速:1.0 mL/min。梯度洗脱程序:0~40 min,90%~48%A;40~45 min,48%A;45~49 min,48%~25%A;49~55 min,25%~15%A;55~56.5 min,15%A;56.5~57.5 min,15%A~90%A;57.5~65 min,90%A。
将脱气后的啤酒分别通过SPE-C18和SPE-PEP小柱进行吸附,分别使用体积分数为0、20%、40%、60%、80%、100%的乙醇洗脱液进行洗脱,对比二者对目标物的吸附效果,确定样品前处理条件。
2.1.1 葎草灵酮和希鲁酮的参考标样的制备
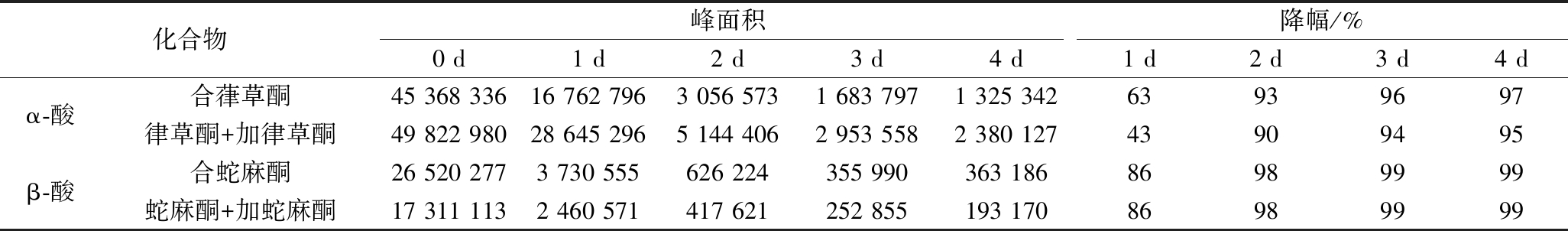
将高甲酸酒花颗粒(α-酸18%、β-酸5%)粉碎后置于60 ℃烘箱中高温空气氧化,0~4 d每天取样,HPLC分析α-酸和β-酸的衰减[15],见表1。
从表1可以看出,在60 ℃时随着氧化时间的延长,α-酸和β-酸的各组分都在逐渐衰减,在氧化第2天各组分的衰减都已达90%以上,因此确定酒花颗粒的氧化条件为60 ℃高温空气氧化2 d。
2.1.2 参考标样的定性
将2.1.1中氧化2 d的酒花颗粒经过无水乙醇浸提30 min后,进行HPLC分析。采用分离效率较高的Alltima C18色谱柱对酒花氧化物的乙醇浸提液进行分离,采集每个色谱峰从200~400 nm紫外吸收光谱。结合文献报道中酒花颗粒氧化后在Alltima C18色谱柱分离的色谱图[4],以及葎草灵酮和希鲁酮的紫外吸收光谱[3],对浸提液中这2种氧化物进行定性分析。
表1 60 ℃空气氧化条件下酒花颗粒中α-酸和β-酸的衰减
Table 1 Attenuation of α-acid and β-acid in hop pellets in 60 ℃ air
注:每类酒花苦味酸都是由一系列结构相似的同系物组成。
图3和图4分别为葎草灵酮的4个主要组分(L1、L2、L3、L4)在260 nm的HPLC谱图和200~400 nm的紫外光谱图。图5和图6分别为希鲁酮的2个主要组分(X1、X2)在330 nm的HPLC谱图和200~400 nm 的紫外吸收光谱图。
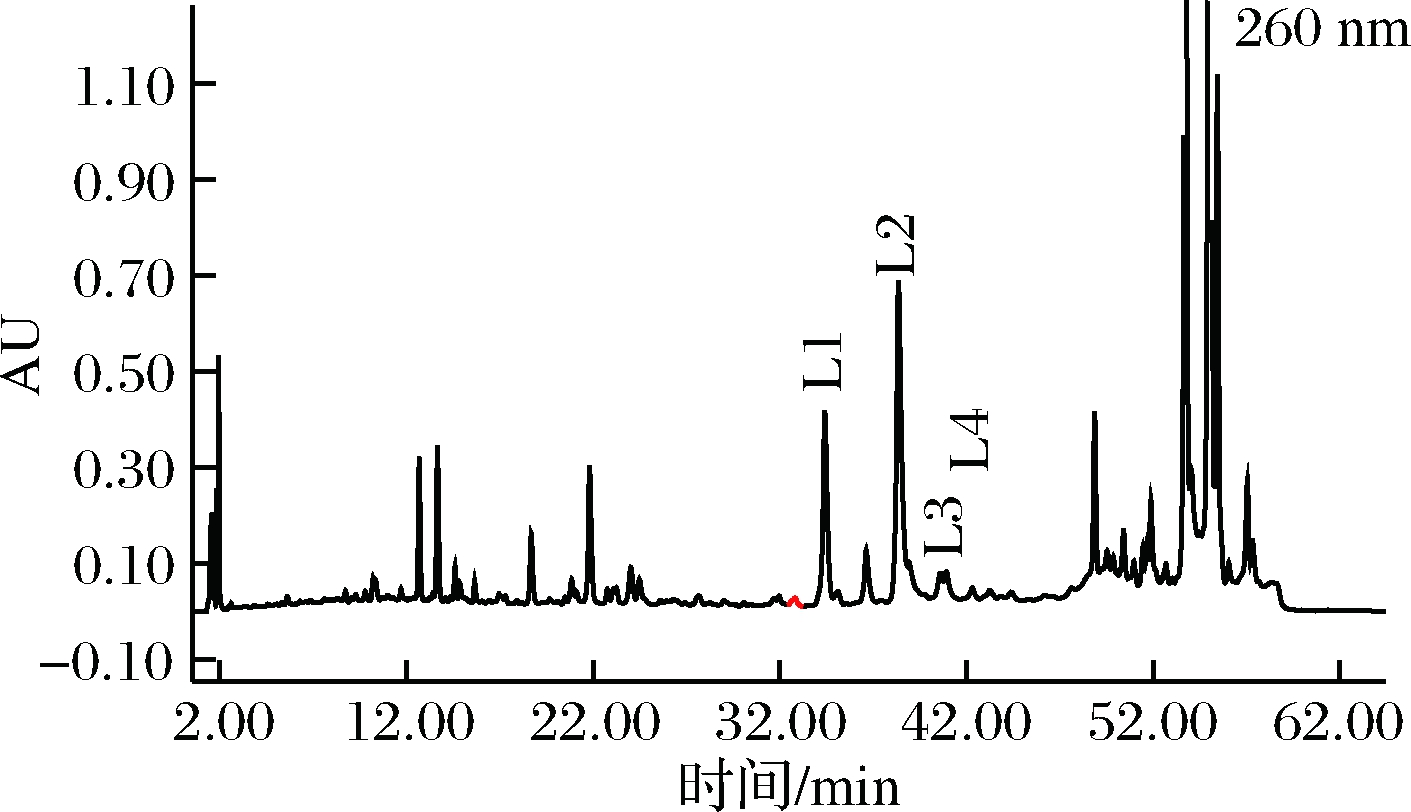
图3 葎草灵酮(L1~L4)的HPLC谱图(260nm)Fig.3 HPLC chromatogram of humuliones
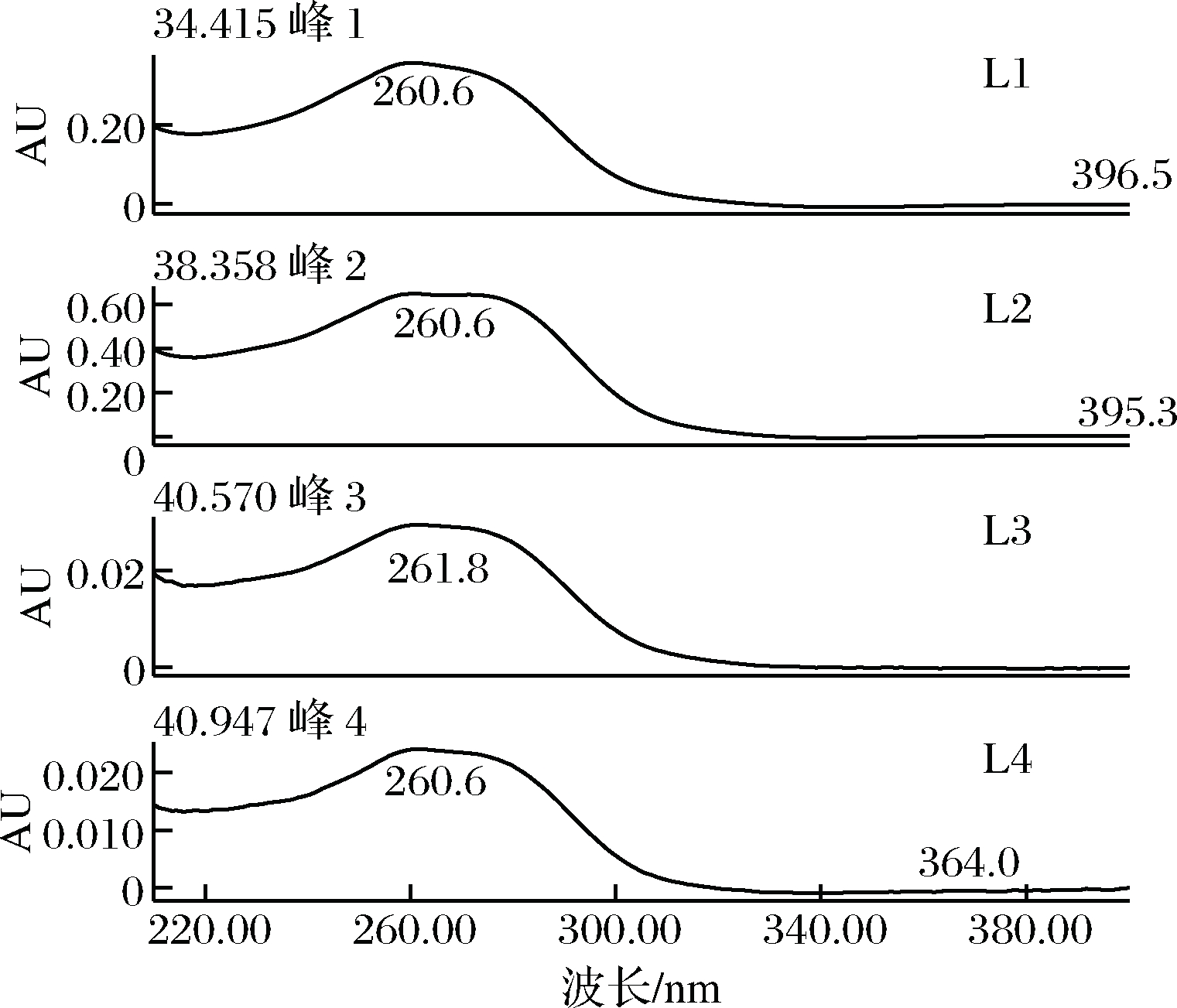
图4 葎草灵酮(L1~L4)的紫外吸收光谱
Fig.4 Ultraviolet absorption spectrum of humuliones
该方法简便易行,虽未获得高纯度的葎草灵酮和希鲁酮的独立标样,但在对实际样品分析时,利用这些已定性的组分的出峰时间和紫外光谱来对样品中的待测组分进行定性,同时结合与葎草灵酮结构相似且含量确定的异-α酸标样进行相对定量测定,可以满足对啤酒中葎草灵酮和希鲁酮开展初步研究的需求。
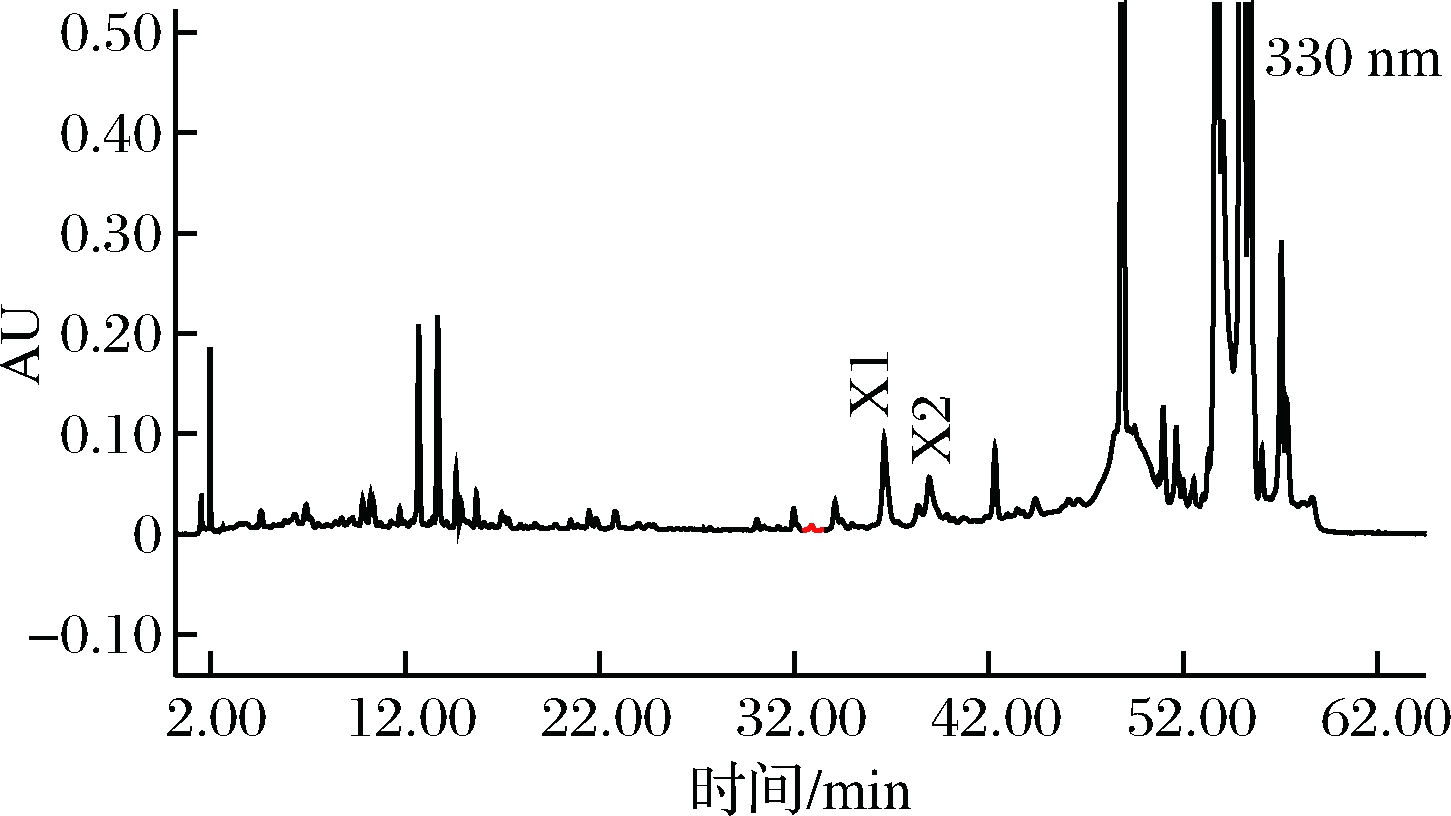
图5 希鲁酮(X1~X2)的HPLC谱图(330 nm)Fig.5 HPLC chromatogram of hulupones
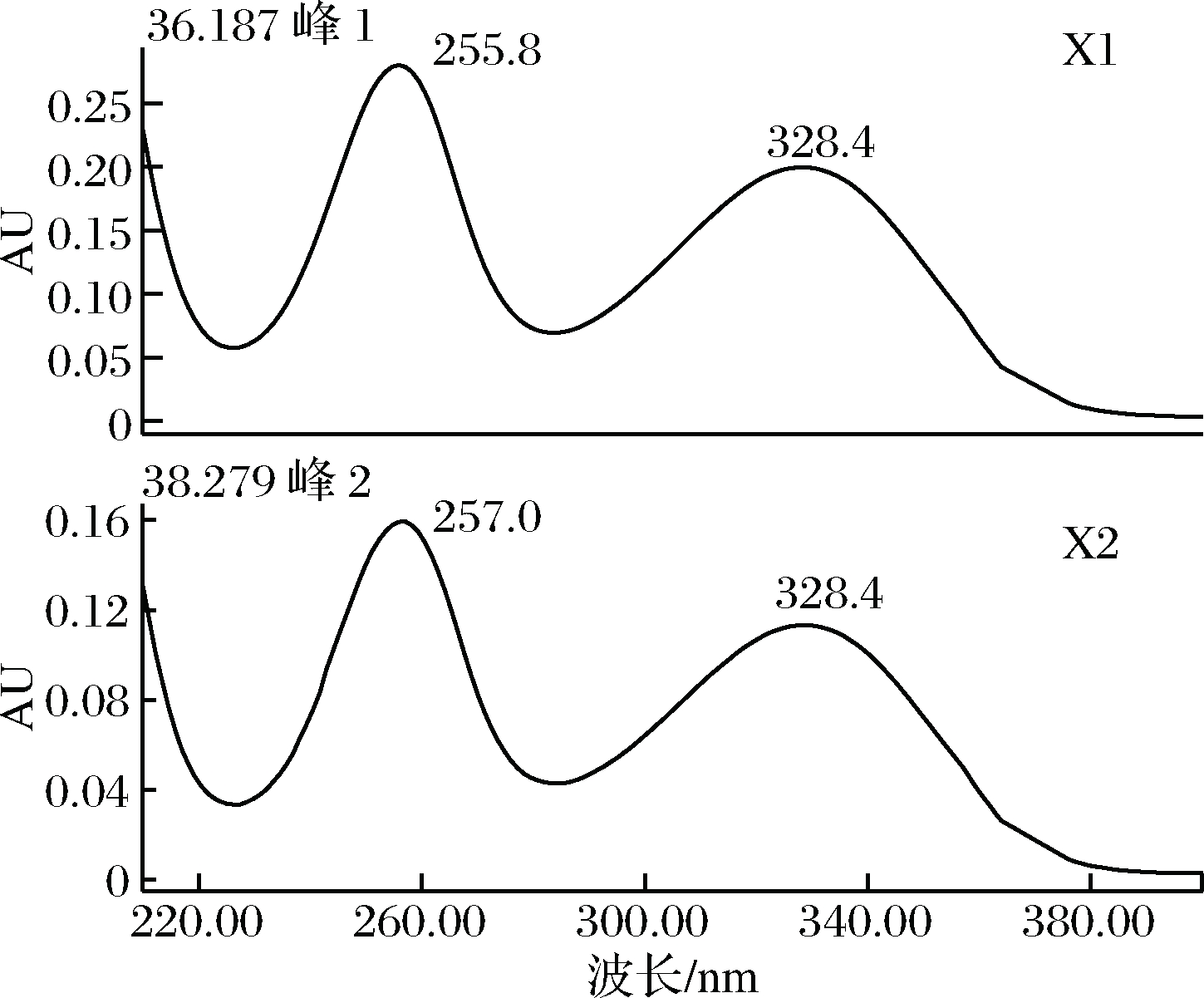
图6 希鲁酮(X1~X2)的紫外吸收光谱
Fig.6 Ultraviolet absorption spectrum of hulupones
啤酒基质复杂,其中葎草灵酮和希鲁酮的含量不高,且在仪器上的响应较低,需进行样品前处理,富集浓缩后上机分析。另外,为了加强检测方法的实用性,希望能够在1次分析中完成对啤酒中主要的苦味物质——葎草灵酮、希鲁酮和异α-酸的同时检出。
考虑到葎草灵酮和希鲁酮的极性均强于异α-酸,选择C18 柱(非极性)、PEP柱(中等极性)2种SPE柱进行样品前处理试验,选择适宜的洗脱溶剂比例(乙腈-水溶液,乙腈体积分数从0到100%递增)。实验表明,这两种SPE柱都可以完全吸附啤酒样品中的葎草灵酮、希鲁酮和异α-酸,但在洗脱时二者有所差别,待测组分在C18和PEP SPE洗脱曲线见图7。
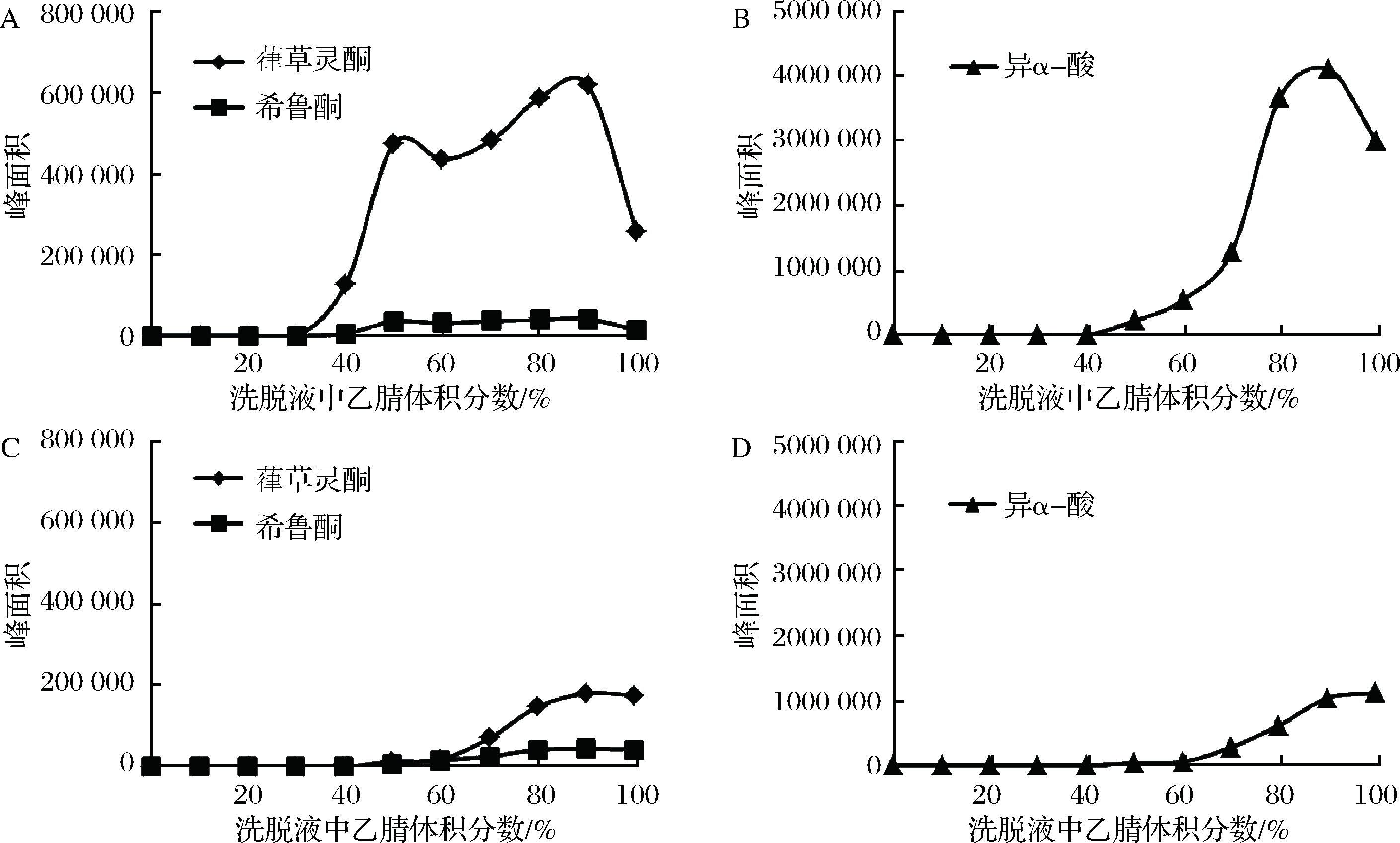
A-葎草灵酮、希鲁酮在C18柱的洗脱曲线;B-异α-酸在C18柱的洗脱曲线;C-葎草灵酮、希鲁酮在PEP柱的洗脱曲线;D-异α-酸在PEP柱的洗脱曲线
图7 待测组分在C18柱和PEP柱的洗脱曲线
Fig.7 The elution curves of components on C18 and PEP SPE cartridges
C18 SPE柱:乙腈40%(体积分数),葎草灵酮开始析出;乙腈50%,希鲁酮和异α-酸析出;乙腈90%,葎草灵酮、希鲁酮和异α-酸达到最大值。
PEP SPE柱:乙腈50%,葎草灵酮、希鲁酮和异α-酸析出;乙腈80%,希鲁酮达到最大;乙腈90%,葎草灵酮达到最大;乙腈100%,异α-酸达到最大值。
从洗脱流出液中待测组分的峰面积来看,C18柱对于葎草灵酮和异α-酸的洗脱效果明显优于PEP柱;对希鲁酮的洗脱效果二者相差不大。一方面,由于葎草灵酮和异α-酸的极性相对较弱,更适合用非极性的C18柱进行前处理;另一方面,PEP柱为官能化聚苯乙烯/二乙烯苯萃取柱,具有亲水性和憎水性基团,对各类极性、非极性化合物具有较均衡的吸附作用,但由于其吸附能力远高于C18键合硅胶(3~10倍),因此在洗脱时相比C18柱更加困难。
最终确定用C18 SPE柱进行样品前处理。具体步骤如下:
固相萃取用试剂:A液,0.5 g/L磷酸溶液;B液,V(乙腈)∶V(0.5 g/L磷酸溶液)=70∶30;C液,V(乙腈)∶V(0.5 g/L磷酸溶液)=90∶10。
C18SPE柱预先用6 mL的乙腈和纯水活化。啤酒样品充分脱气后,取9 mL脱气啤酒过SPE-C18小柱。依次用3 mL A液淋洗,3 mL B液淋洗,最后用1.5 mL C液洗脱,洗脱液经0.22 μm滤膜过滤后上机检测。图8为最终的啤酒样品中葎草灵酮、希鲁酮和异α-酸的HPLC谱图。
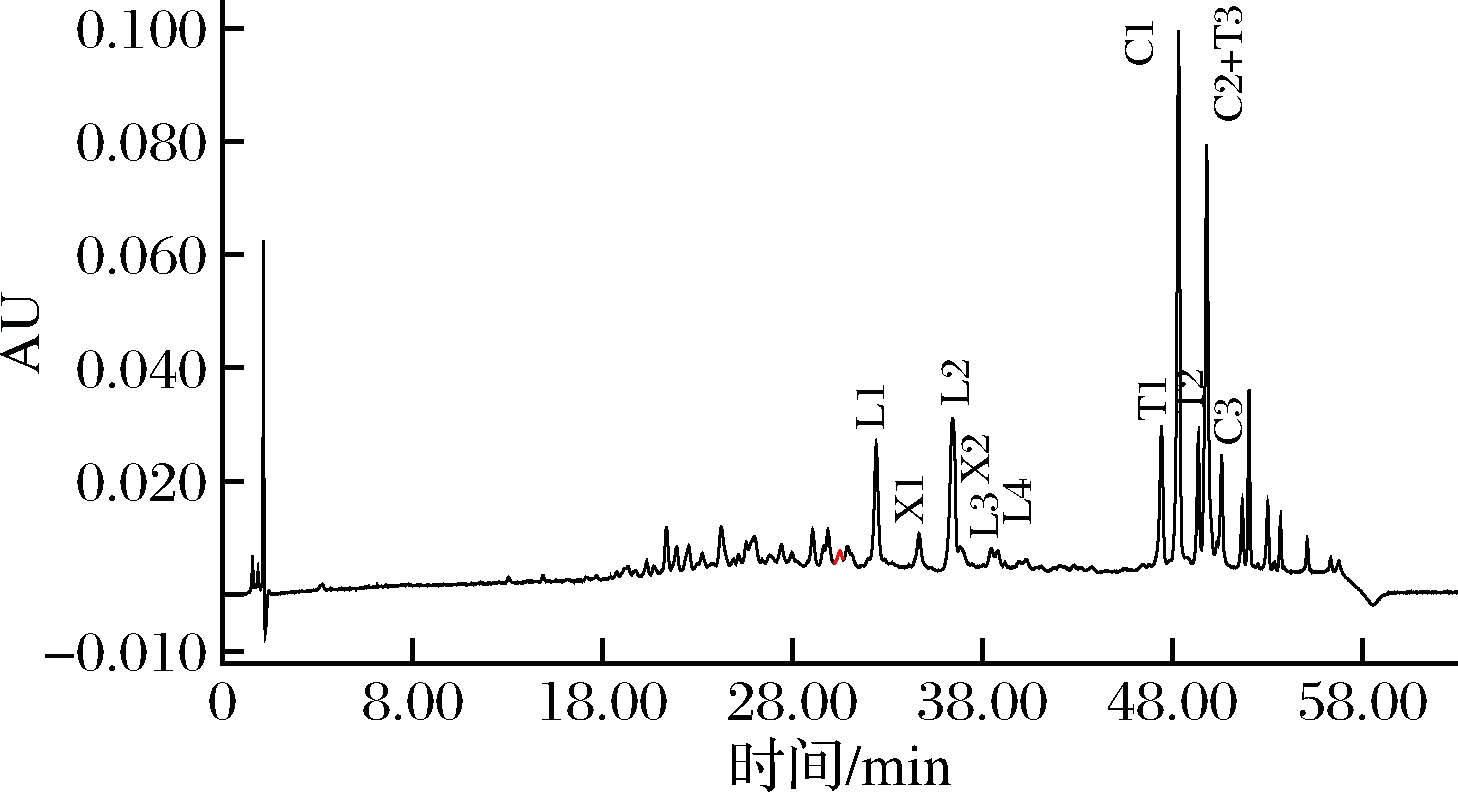
葎草灵酮= L1+L2+L3+ L4;希鲁酮= X1+X2;异α-酸= T1+C1+T2+C2+T3+C3(T为反式,C为顺式)图8 啤酒样品中葎草灵酮、希鲁酮和
异α-酸的HPLC谱图
Fig.8 HPLC chromatogram of humuliones, hulupones and iso-α-acids in beer
重现性:同一啤酒进行6次的样品前处理和仪器分析,葎草灵酮、希鲁酮和异α-酸的峰面积的相对标准偏差RSD≤4%,重现性较好,满足实际样品检测需求(表2)。
检出限:以被测组分的3倍信噪比为最小检出限,该方法中葎草灵酮、希鲁酮和异α-酸的最小检出限为0.03、0.03和0.05 mg/L。
回收率:由于本方法未分别获得葎草灵酮和希鲁酮的纯物质,故将参考标样浸提液(其中葎草灵酮和希鲁酮的含量已知),以及异α-酸标样加入啤酒样品中,分别计算待测物的回收率,见表3。
表2 葎草灵酮、希鲁酮和异α-酸的峰面积重现性
Table 2 RSD of humuliones, hulupones and iso-α-acids

表3 葎草灵酮、希鲁酮和异α-酸的回收率
Table 3 Spiked recoveries of humuliones, hulupones and iso-α-acids
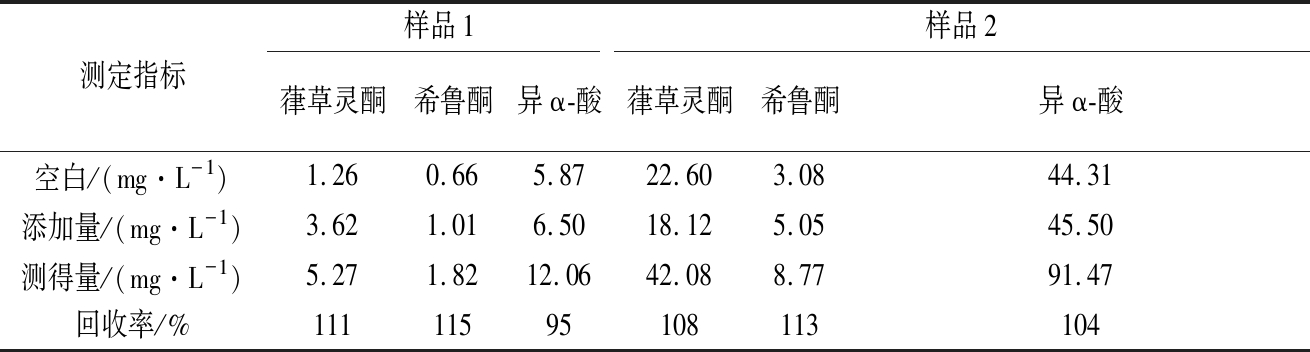
注:葎草灵酮和希鲁酮含量均以异α-酸计。表4同。
利用本方法检测市售不同品类的啤酒中葎草灵酮、希鲁酮和异α-酸含量,了解不同品类啤酒中主要的苦味物质组成。从表4中数据可以看出,Lager啤酒、皮色森啤酒、小麦啤酒和黑啤酒中,葎草灵酮和希鲁酮含量均不高(<2 mg/L);而在IPA啤酒中,含有较高的葎草灵酮、希鲁酮和异α-酸,且不同品牌的苦味物质分布差异较大,这主要是由于IPA啤酒特殊的酒花添加量和添加工艺造成的。IPA啤酒以突出的酒花风味为特点,一方面会使用大量的、不同种类的酒花进行搭配;另一方面,添加工艺也区别于其他品类啤酒,除了正常的酒花煮沸添加工艺(使酒花中的α-酸异构化成苦感较重的异α-酸)以外,还有酒花干加工艺(使酒花中α-酸、葎草灵酮、希鲁酮等溶解出来),从而使得IPA啤酒中的酒花苦味物质更加复杂,这也是近年来葎草灵酮、希鲁酮等酒花苦味酸氧化物引起酿酒师们关注的原因。本方法的建立为后续研究这些苦味物质对啤酒苦感的影响提供了技术手段。
表4 市售不同类型的啤酒样品中苦味物质组成
Table 4 The composition of bitter substances in different commercially beers

本文建立了啤酒中苦味物质——葎草灵酮、希鲁酮和异α-酸的固相萃取(SPE)-高效液相色谱(HPLC)检测技术。采用易于获得的高甲酸颗粒酒花作为原料,高温空气氧化制得酒花苦味酸氧化物,通过HPLC分离,结合文献报道的葎草灵酮和希鲁酮的紫外光谱特性确定了这2类氧化物的参考标样,克服了无商业化葎草灵酮和希鲁酮标准品带来的无法定性和定量的困难。同时,对比了不同类型SPE柱对于啤酒样品中待测组分的富集效果,确定了最佳的样品前处理条件。该方法简便易行,可操作性强,满足对不同品类啤酒中酒花苦味物质组成的分析,特别是对于高酒花添加量的IPA啤酒而言,为进一步研究不同酒花添加工艺带来的啤酒苦味物质组成差异及其对苦感质量的影响提供有力的检测手段。
参考文献
[1] DRESEL M, VOGT C, DUNKEL A, et al. The bitter chemodiversity of hops (Humulus lupulus L.) [J]. J Agric Food Chem, 2016, 64(41):7 789-7 799.
[2] INTELMANN D, HASELEU G, DUNKEL A, et al. Comprehensive sensomics analysis of hop-derived bitter compounds during storage of beer[J]. J Agric Food Chem, 2011, 59(5):1 939-1 953.
[3] HASELEU G, LAGEMANN A, STEPHAN A, et al. Quantitative sensomics profiling of hop-derived bitter compounds throughout a full-scale beer manufacturing process[J]. Journal of Agriculture and Food Chemistry, 2010, 58(13): 7 930-7 939.
[4] 郝俊光,周月南,尹花,等.啤酒中源自酒花α-酸的苦味物质研究进展[J].食品与发酵工业,2017,43(12): 232-240.
[5] 郝俊光,王云岑,岳杰,等.源自酒花β-酸和硬脂酸的苦味物质研究进展[J].食品与发酵工业,2018,44(8): 298-307.
[6] 杨朝霞,李梅,武千钧.采用高效液相色谱法鉴别啤酒中异构化α-酸的种类[J].食品与发酵工业,2006,32(6): 100-103.
[7] 武千钧,杨朝霞,李梅,等.反相高效液相色谱法同时测定啤酒中的4种异构化α-酸[J].分析化学, 2007, 35(1): 159.
[8] 杨朝霞,黄淑霞,田玉红,等.采用离子对试剂同时测定啤酒中异α-酸和还原异α-酸[J].分析实验室,2012, 31(9): 30-33.
[9] YOSHIMASA T, YASUKO M, HIROMI O, et al. Identification and quantification of the oxidation products derived from α-acids and β-acids during storage of hops (Humulus lupulus L.) [J]. Journal of Agriculture and Food Chemistry, 2013,61(12):3 121-3 130.
[10] TANIGUCHI Y, TANIGUCHI H, MATSUKURA Y, et al. Structural elucidation of humulone autoxidation products and analysis of their occurrence in stored hops[J].J Nat Prod, 2014, 77(6):1 252-1 261.
[11] TANIGUCHI Y, YAMADA M, TANIGUCHI H, et al. Chemical characterization of beer aging products derived from hard resin components in hops (Humulus lupulus L.) [J]. Journal of Agriculture and Food Chemistry, 2015, 63(46):10 181-10 191.
[12] HASELEU G, INTELMANN D, HOFMANN T. Identification and RP-HPLC-ESI-MSMS quantitation of bitter-tasting β-acid transformation products in beer[J]. Journal of Agriculture and Food Chemistry, 2009, 57(16):7 480-7 489.
[13] ALGAZZALI V, SHELLHAMMER T. Bitterness intensity of oxidized hop acids: Humulinones and hulupones[J]. Journal of the American Society of Brewing Chemists,2016,74(1):36-43.
[14] OLADOKUN O, SMART K, COOK D. An improved HPLC method for single-run analysis of the spectrum of hop bittering compounds usually encountered in beers[J]. Journal of the Institute of Brewing, 2016, 122(1):11-20.
[15] 林艳,单连菊,张沛,等.高效液相色谱法测定酒花、酒花颗粒及酒花浸膏中α-酸和β-酸[J]. 分析化学, 2000, 28(8): 1 047.
YANG Zhaoxia1,2*,LI Mei1,2,SHENG Xianbin2,DONG Jianjun1,2
1(State Key Laboratory of Biological Fermentation Engineering of Beer, Qingdao 266061, China) 2(Tsingtao Brewery Co.Ltd., Qingdao 266061, China)
ABSTRACT In order to study the composition of bitter substances in beer, high performance liquid chromatography was applied to quantitatively determine humuliones, hulupones, and iso-α-acid in beer. By oxidizing hop pellets at 60 ℃, humuliones and hulupones as major products were separated using Alltima C18 column, and 0.05% phosphoric acid and acetonitrile were used for mobile phase gradient elution. C18 solid-phase extraction (SPE) tubes were used for sample pretreatment. The relative standard deviations (RSDs) were 2.18%-3.59%. The minimum detection limits for humuliones, hulupones, and iso-α-acid were 0.03, 0.03, and 0.05 mg/L, respectively, and their recoveries were in a range of 95%-115%. It was found that most commercial beers, such as lager beer, pilsner, wheat beer and stout, contained less humuliones and hulupones (<2 mg/L), however, India Pale Ale (IPA) had higher levels and their composition varied significantly among different brands. In conclusion, this method is effective for conducting further studies on bitter senses of humuliones and hulupones, and also for regulating bitter substances in IPA.
Key words beer, bitterness, humuliones, hulupones, iso-α-acids, high performance liquid chromatography