魏瑶1,2,钟其顶1,2*,王道兵1,2,3,李国辉1,2
1(中国食品发酵工业研究院有限公司,北京,100015)2(全国食品发酵标准化中心,北京,100015) 3(山东金胜粮油集团有限公司,山东 临沂,276000)
摘 要 甘油二酯(diacylglycerols, DAGs)异构体(1,3-/1,2-DAGs)在橄榄油的品质鉴别方面具有应用价值,该异构体的比例特征可用于橄榄油新鲜程度的辨别。利用固相萃取小柱分离油脂中DAGs成分,衍生处理后经GC-FID实现了DAGs的定量测定,优化后的衍生条件为衍生温度30 ℃,衍生时间1 h。该方法最低检出限(S/N=3)为0.032 mg/mL,RSD值为1.35%~4.62%,各甘油二酯成分的回收率为73.9%~76.9%。对比分析了6种初榨橄榄油和4种精炼橄榄油,结果表明二者的DAGs异构体比例存在明显不同。该方法设备简单,操作简便,可实现对橄榄油DAGs异构体进行准确测定,为开发橄榄油的真实性检测方法和建立产品标准提供技术支持,对进口初榨橄榄油的口岸监管和市场监管均具有指导意义。
关键词 甲基硅烷化;甘油二酯;气相色谱;初榨橄榄油;真实性
第一作者:硕士研究生(钟其顶高级工程师为通讯作者,E-mail:zhong qiding@163.com)。
基金项目:科技部国家重点研发计划(2016YFE0113200);国家自然科学基金(31601553,31601580);科技部“十三五”重大科技计划(2016YFF0203903);欧盟地平线2020(635690-OLEUM-2020-SFS-2014-2015);痕迹科学与技术公安部重点实验室开放课题(2016FMKFKT06)
收稿日期:2018-09-19,改回日期:2018-12-26
DOI:10.13995/j.cnki.11-1802/ts.018832
甘油二酯(diacylglycerols, DAGs)是甘油三酯(triacylglycerols, TAGs)中1个脂肪酸酯基水解生成了羟基的脂质物质,包含1个甘油骨架和2个脂肪酸残基。DAGs是天然植物油脂的微量成分及体内脂肪代谢的内源中间产物,在食品行业、化工行业和医药行业等领域均具有很多应用[1-4]。DAGs有2种同分异构体,分为1,2-DAGs与1,3-DAGs,这2种异构体是由于脂肪酸在甘油主干链上的连接位置不同而形成的[5],其中1,2-DAGs是植物油中天然的中间体,是TAGs合成或降解过程中的中间产物,而1,3-DAGs是由1,2-DAGs经酶反应或化学异构化得到,有研究表明,温度、PH和酰基迁移酶的存在等都会影响1,2-DAGs向1,3-DAGs的转化[6-7],当二者达到稳定时,1,3-DAGs与1,2-DAGs的比例在6∶4~7∶3,由于分子的空间效应,1,3-DAGs在热力学上更加稳定[8]。经过了精炼和长期存储的植物油中1,3-DAGs的含量会有明显的增长趋势,1,3-DAGs含量的增加或者1,3-DAGs/1,2-DAGs值的增加与植物油感官质量的降低有关[9]。因此DAGs异构体的含量比例特征可用于植物油的质量鉴别[10]。
当前对DAGs的检测方法主要有薄层色谱(TLC)和高效液相色谱(HPLC)结合MALDI-TOF[11-12]或ESI-MS法[13-15],其中,TLC法成本低且操作简易,但缺点是精度不高,重复性差[16];HPLC法虽然简便快捷,但检出限受限,故常用于分析人工制备得到的甘油二酯含量,而对植物油样品中本身微量甘油二酯检测效果不佳[17]。然而该2种方法均只能检测出油脂中甘油二酯总量,且检出限通常高于1 mg/mL。 气相色谱法是常用的快速测定油脂中DAGs的方法,ISO 29822:2009规定了测定油脂中甘油二酯异构体的GC-FID方法[18],而ZHU等认为由于相关标准品的短缺难以直接引用ISO方法,故而应用EI-MS和EI-MS/MS方法定性分析了橄榄油中DAGs异构体的特征[6],PEREZ等在此基础上研究了橄榄油存储温度和时间对DAGs异构体的影响[19]。然而,我国对DAGs的分析与应用主要集中在制备方法和功能研究领域,对微量DAGs异构体的研究报道较少[20-24]。
本研究在ZHU等和ISO方法定性分析的基础上,引入定量分析的研究[25-27]。借助GC-MS对DAGs异构体进行定性分析,通过GC-FID方法进行定量测定,降低了对分析仪器的要求,以利于为实际应用中大批量的样品检测节约成本。优化了衍生条件,最后研究了初榨橄榄油和精炼橄榄油中DAGs异构体含量特征的异同,以及实现了1,3-油酸二酯的精确定量,旨在为我国橄榄油市场监管及产品标准制定提供基础数据和技术支持,这对促进我国橄榄油标准与国际接轨,保护我国食用油市场有着重要的意义。
6种新鲜初榨橄榄油和4种精炼橄榄油,来自意大利的真实样品;氮气(纯度为99.99%),北京北温气体制造厂;丙酮、甲苯和异辛烷(色谱纯),DUKSAN Pure Chemicals公司;异丙醚(分析纯),上海麦克林生物化学有限公司;乙醚(分析纯),天津市津东天正精细化学试剂厂;N-甲基-N-三甲基硅烷基七氟丁酰胺(MSHFBA),Fluorochem公司;1,2-与1,3-棕榈酸二酯混合标品、1,3-油酸二酯标品、1-甲基咪唑、1 000 mg/6 mL二氧化硅SPE小柱,Sigma公司。
Agilent6890气相色谱仪、FID检测器,安捷伦科技(中国)有限公司;GC-MS-QP2020气质联用仪,岛津企业管理(中国)有限公司;DB-5ht气相色谱柱(30 m ×0.25 mm,0.1 μm),安捷伦科技(中国)有限公司;电热恒温加热箱,北京福意联电器有限公司;MTN-2800D氮吹仪,天津奥特赛恩斯仪器有限公司;十万分之一电子天平,瑞士Mettler-Toledo公司。
1.3.1 标品衍生
称取约0.01 g的1,2-与1,3-棕榈酸二酯混标以及1,3-油酸二酯单标,精确至0.1 mg,用甲苯配成10 mg/mL 的标准溶液,分别取50 μL氮吹至干后,加入100 μL甲基硅烷化衍生剂V(1-甲基咪唑)∶V(MSHFBA)=1∶20,使衍生质量浓度为5 mg/mL(保证衍生剂过量),充分摇匀后密封,置于30 ℃恒温箱中静置衍生,衍生结束后加入900 μL丙酮,分别用GC-MS和GC-FID测定。
1.3.2 样品处理
SPE过程:二氧化硅SPE小柱先用4 mL甲苯活化。取橄榄油样品0.1 g溶于1 mL甲苯中,涡旋1 min, 移至SPE二氧化硅硅胶柱中。用2 mL甲苯淋洗后,加3.5 mL异辛烷/异丙醚混合液(体积比为85∶15) 洗脱含有TAGs的疏水化合物,重复1次后,加3.5 mL乙醚洗脱含有DAGs的极性成分,重复1次,收集含DAGs的洗脱液氮吹至干。
样品衍生:氮吹至干后称重,以5 mg/mL的衍生质量浓度加入甲基硅烷化衍生剂V(1-甲基咪唑)∶V(MSHFBA)=1∶20,进行衍生反应,充分摇匀后密封,置于30 ℃恒温箱中静置衍生,衍生结束后加入900 μL丙酮,分别用GC-MS和GC-FID仪测定。
1.3.3 GC方法
GC-FID与GC-MS气相色谱条件:DB-5ht气相色谱柱(30 m×0.25 mm,0.1 μm);升温程序:初温180 ℃ 保持2 min,以15 ℃每分钟增加到330 ℃,保持15 min;载气(N2)流速1.0 mL/min;进样量1 μL;分流比20∶1;进样口温度260 ℃。
GC-MS质谱条件:电子轰击离子源;电子能量70 eV; 传输线温度240 ℃;离子源温度200 ℃;灯丝电流80 μA;质量扫描范围m/z 200~650;扫描间隔时间1 s。
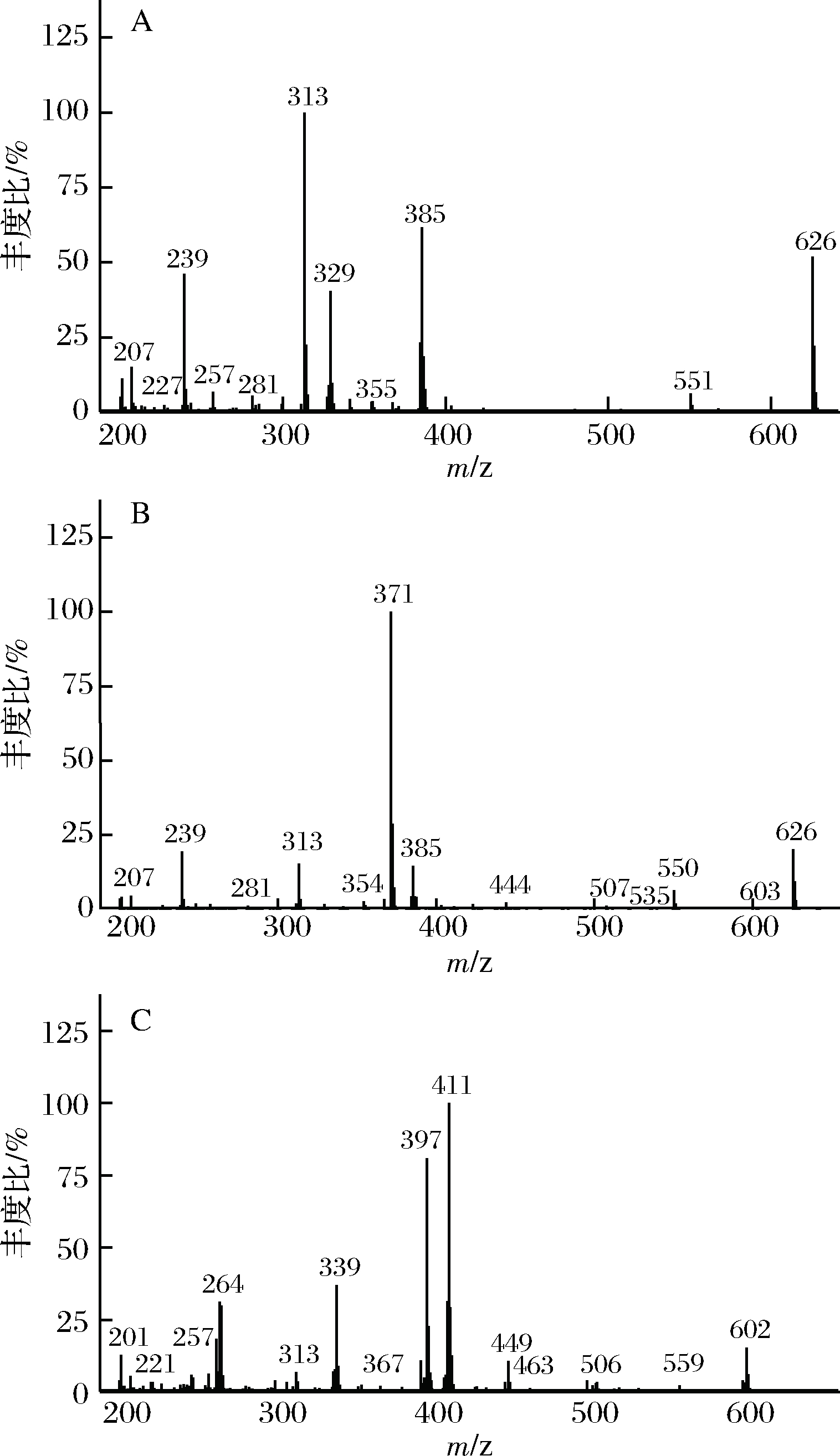
由于构成甘油二酯的脂肪酸可以多种多样,而可以购买到的DAGs异构体标准品只有4种,不足以对橄榄油中DAGs特征峰定性,因此用GC-MS进行定性分析。对1,2-与1,3-棕榈酸二酯混标以及1,3-油酸二酯单标的衍生物用GC-MS测定,得到其主要质谱特征峰的EI-MS图(图1),其中[M-15]+离子(M-表示对应甘油二酯衍生物特定基团上的分子质量或分子式)在棕榈酸二酯的626 m/z出现,在1,3-油酸二酯离子质谱检测范围(200~650 m/z)未出现,因此[M-15]+离子可作为定性棕榈酸二酯的特征离子。[M-RCO2CH2]+只在1,3-DAGs中出现,可作为1,3-DAGs的特征离子,用于区分甘油二酯异构体的构型。[RCO]+与[M-90-153]+仅在1,3-油酸二酯中出现,可作为判别1,3-油酸二酯的部分特征离子。另外,[M-RCO2]+在1,3-油酸二酯的411 m/z出现,且强度最高。[RCO2+58]+在1,2-DAGs结构中强度明显高于1,3-DAGs结构。综上,可以通过[M-RCO2CH2]+离子区分1,2-DAGs与1,3-DAGs;通过[M-15]+、[M-89]+、[M-RCO2]+、[RCO2+58]+、[RCO]+与[M-90-153]+离子判断DAGs种类。
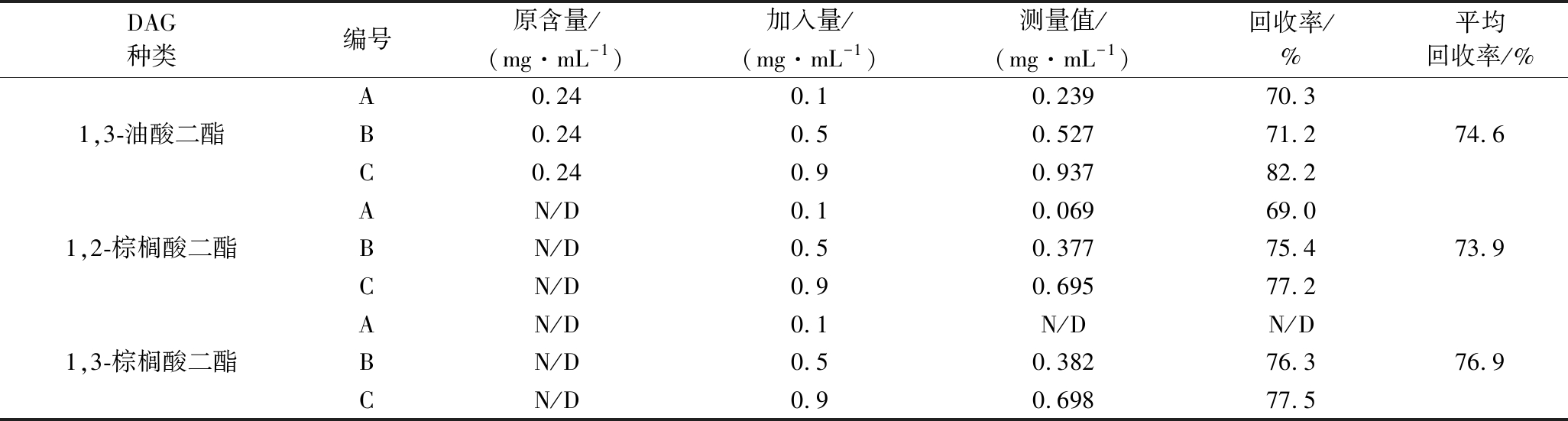
通过对橄榄油样品分析,对照表1和图2中各种甘油二酯异构体标品的特征离子种类和对应的相对丰度,确定了橄榄油中几种主要的特征DAGs异构体的种类以及在GC-MS和GC-FID色谱图中的出峰顺序,确定了1,2-油酸棕榈酸二酯、1,3-油酸棕榈酸二酯、1,2-油酸二酯和1,3-油酸二酯的保留时间分别为13.9、14.2、15.18、15.51 min,这与ZHU等的研究结果相符[6]。

A- 1,2-棕榈酸二酯衍生物;B-1,3-棕榈酸二酯衍生物;C-1,3-油酸二酯衍生物
图1 棕榈酸二酯和油酸二酯异构体甲基硅烷
衍生物的EI-MS图
Fig.1 EI-MS spectra of dipalmitin and diolein isomers
表1 不同的甘油二酯标品衍生物特征碎片离子和相对丰度
Table 1 Characteristic EI-MS fragment ions and the relative abundances observed in various DAG standards
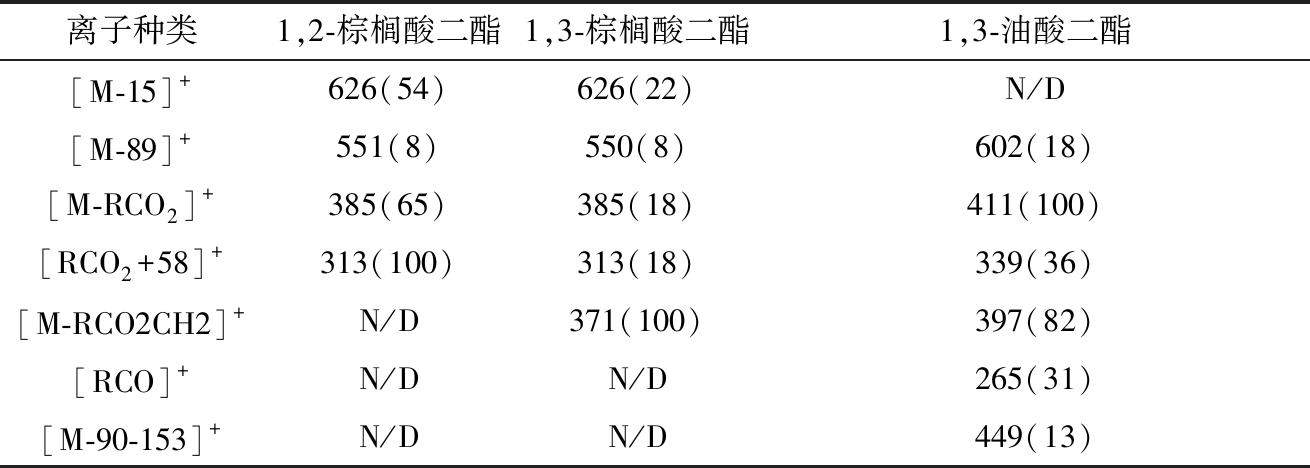
注:N/D即未检测到。
分别研究衍生时间和衍生温度对测定结果的影响。由于相关标品短缺,不能对全部相关DAGs异构体都进行定量,因此即对所需异构体总的峰面积进行分析。由图3可知,当温度一定时,衍生60 min达到稳定。
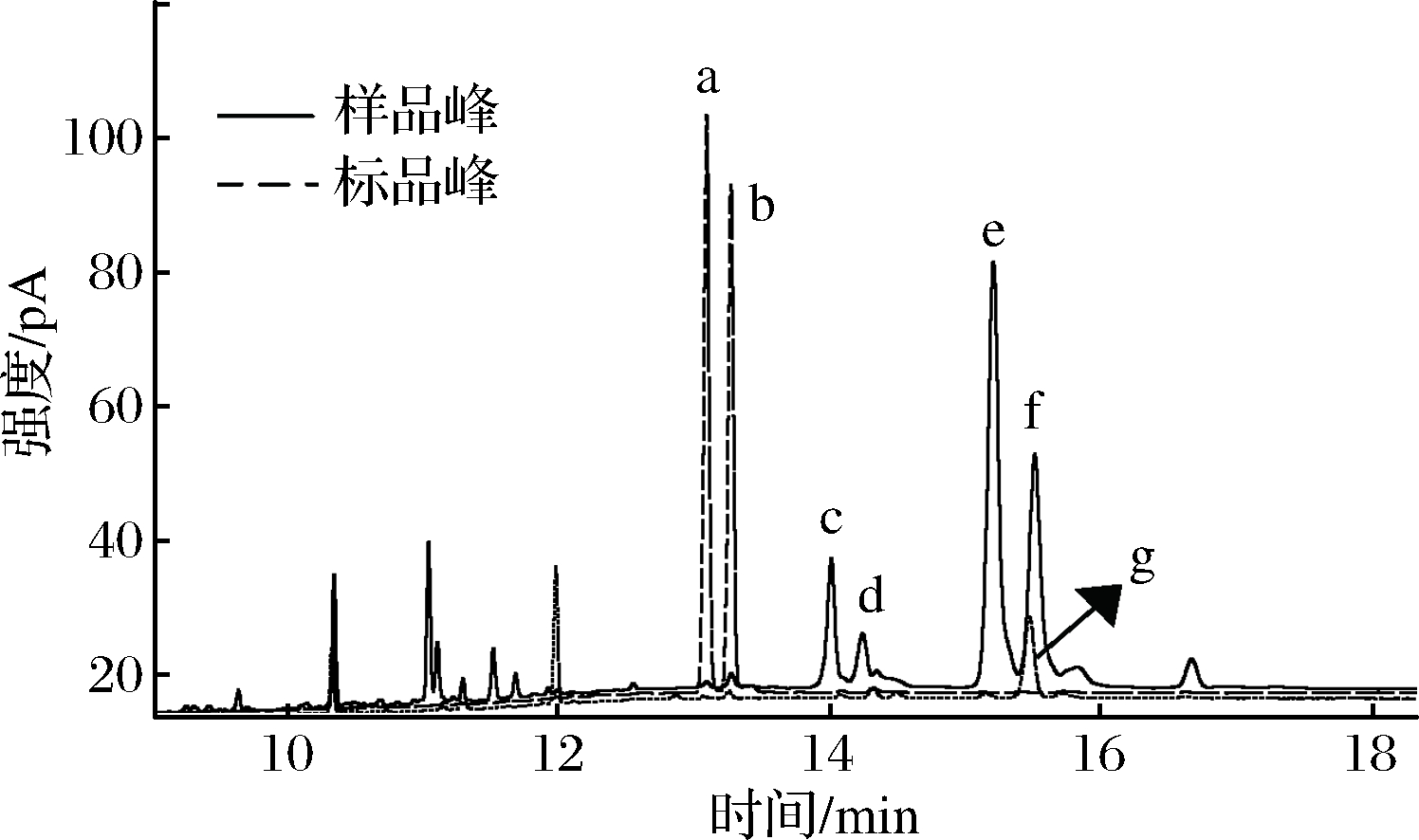
a- 1,2-棕榈酸二酯标品衍生物峰;b-1,3-棕榈酸二酯标品衍生物峰;c-1,2-油酸棕榈酸二酯样品衍生物峰; d-1,3-油酸棕榈酸二酯样品
衍生物峰;e-1,2-油酸二酯样品衍生物峰;f-1,3-油酸二酯样品衍生物峰;g-1,3-油酸二酯标品衍生物峰
图2 DAG标品及新鲜橄榄油样品的GC-FID对比图.
Fig.2 GC-FID comparison of DAG standards and fresh virgin olive oil sample
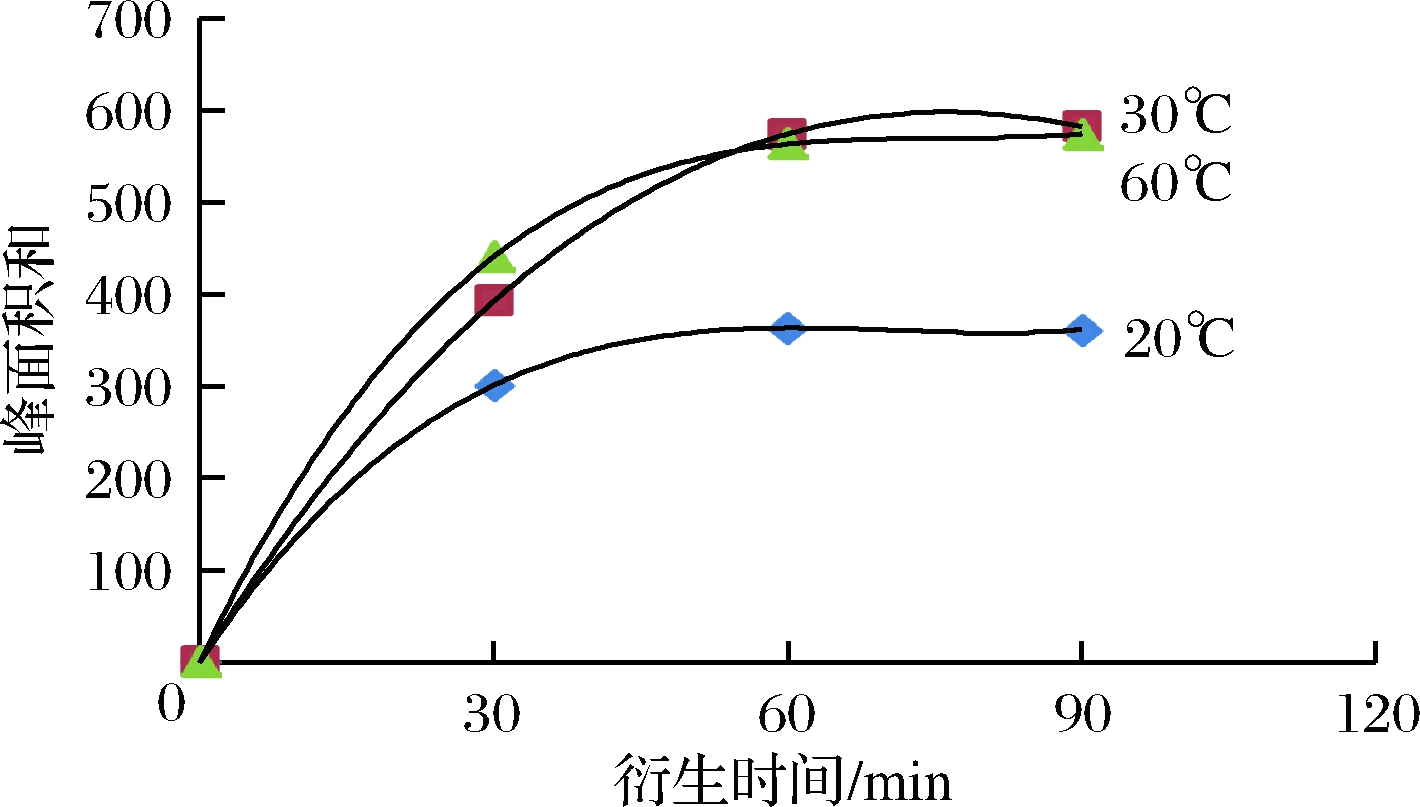
图3 新鲜初榨橄榄油在不同时间和温度衍生下的
DAGs衍生物总峰面积曲线图
Fig.3 The peak area of all DAGs derived from fresh virgin olive oil at different time and temperature
衍生时间均达到60 min时,温度为20 ℃,衍生反应不完全,温度为30 ℃与60 ℃时,稳定情况下峰面积无差异,衍生反应完全。因此,在保证衍生剂过量的情况下,橄榄油的最佳衍生条件为:衍生60 min,温度30 ℃。
2.3.1 标准曲线
称取约0.1 g的1,3-油酸二酯、1,2-和1,3-棕榈酸二酯混标标准品,精确至0.1 mg,用甲苯溶解配制成0.1、0.3、0.5、0.7、0.9 mg/mL的标准溶液,分别取1 mL标准溶液氮吹至干并进行衍生反应后,加丙酮复溶为1 mL,用分别用GC-MS与GC-FID进行检测后,以峰面积和质量浓度作标准曲线。
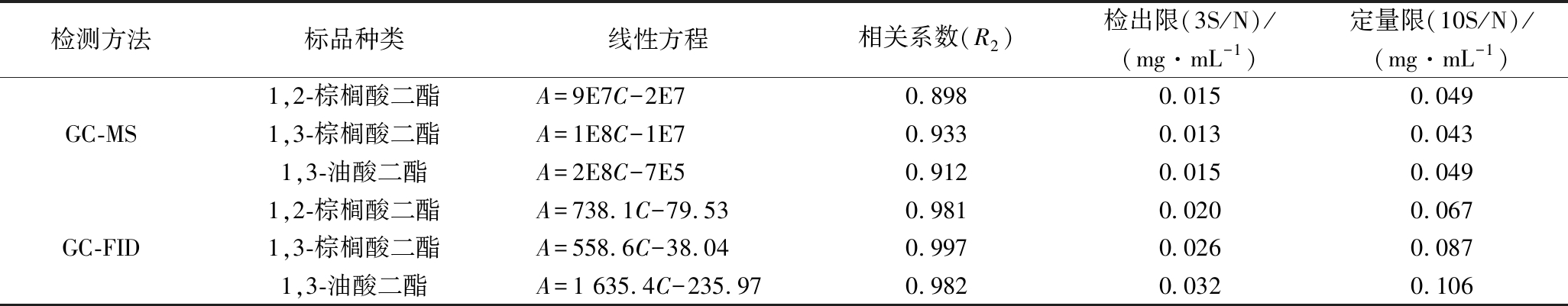
由表2可知,GC-MS方法中1,2-棕榈酸二酯、1,3-棕榈酸二酯和1,3-油酸二酯在0.1~0.9 mg/mL质量浓度范围内,线性良好,相关系数均大于0.898,按信噪比S/N=3计算,检出限分别为:0.015、0.013、 0.015 mg/mL。按信噪比S/N=10计算,定量限分别为:0.049、0.043、0.049 mg/mL。
GC-FID方法中1,2-棕榈酸二酯、1,3-棕榈酸二酯和1,3-油酸二酯的在0.1~0.9 mg/mL质量浓度范围内,线性良好,相关系数均大于0.981,按信噪比S/N=3计算,检出限分别为:0.020、0.026、0.032 mg/mL。按信噪比S/N=10计算,定量限分别为:0.067、0.087、0.106 mg/mL。
GC-MS与GC-FID均可实现对DAGs异构体的定量分析,均可满足实验要求。GC-MS方法的检出限和定量限更低,略优于GC-FID。但本研究考虑到GC-FID可以大幅降低实验仪器成本,使实验方法更加具有实际操作性和可行性,便于大批量样品的检测,因此选择利用FID进行后续的定量分析。
表2 GC-MS与GC-FID对DAGs标品的测定结果对比表
Table 2 Determination result table of DAGs between GC-MS and GC-FID
2.3.2 GC-MS与GC-FID测定结果对比分析
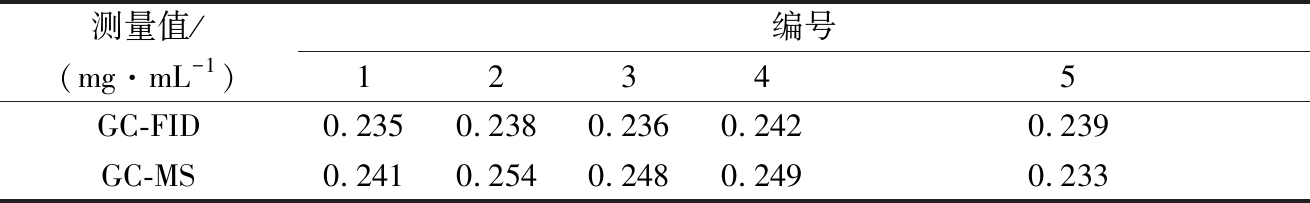
采用GC-MS与GC-FID分别对5个初榨橄榄油样品中1,3-油酸二酯含量进行分析对比(见表3),两组数据经过T检验,P<0.05,数据之间无显著性差异,两者均可用于初榨橄榄油中DAGs异构体的精确定量分析。
表3 初榨橄榄油样品中1,3-油酸二酯GC-FID与 GC-MS测定结果对比
Table 3 Determination result of 1,3-DAG in olive oil samples by GC-MS and GC-FID
2.3.3 精密度分析
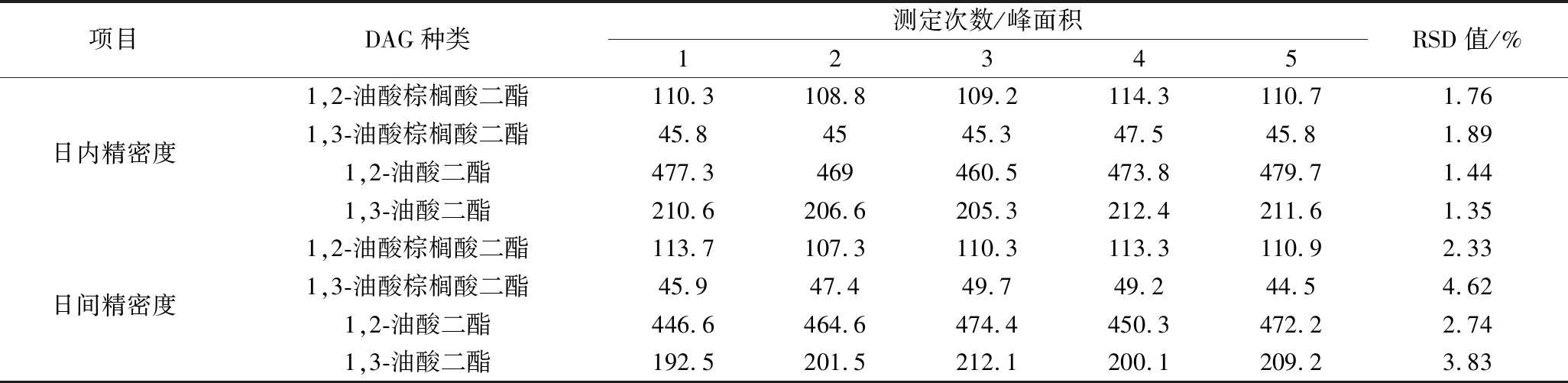
选取同一新鲜初榨橄榄油样品,依照方法处理后,GC-FID进样。在1 d内连续重复测量5次,计算日内精密度;连续5 d重复测定,每次测3次取平均值,计算日间精密度,结果见表4。由表4可知,该方法的日内精密度和日间精密度分别在1.35%~1.89%与2.33%~4.62%,并且对1,3-油酸二酯进行定量分析,得到其1,3-油酸二酯日内与日间平均值均为0.27 mg/mL(即2.7 mg/g),RSD值分别为0.02%和0.04%。表明该方法测定橄榄油中DAGs异构体含量精密度较好。
表4 方法日内和日间精密度
Table 4 The RSD for the inter- and intra-day
2.3.4 稳定性实验
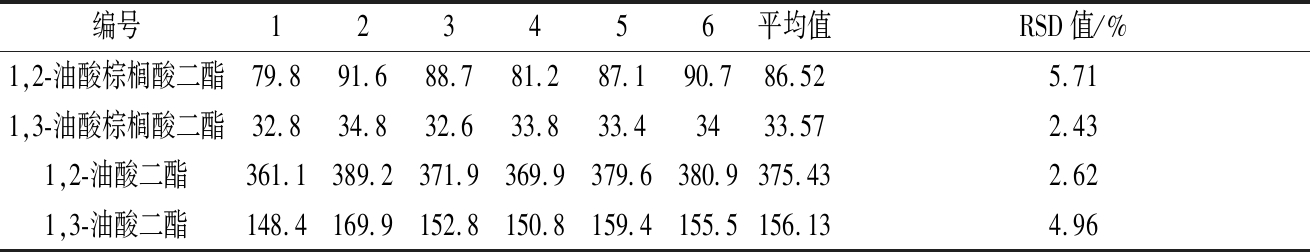
同时取6份同种新鲜初榨橄榄油样品,依照方法处理后,GC-FID进样,其出峰面积及RSD值见表5。可以看出,各种特征甘油二酯的峰面积RSD值在2.62%~5.71%,并且对1,3-油酸二酯进行定量分析,得到其1,3-油酸二酯平均值为0.24 mg/mL(即2.4 mg/g), RSD值为0.05%,前处理方法的稳定性较好。
表5 6份同种橄榄油样品的特征甘油二酯衍生物GC峰面积
Table 5 GC peak area of characteristic DAGs in 6 same olive oil samples
2.3.5 回收率实验
取已经测定1,3-油酸二酯含量的新鲜初榨橄榄油样品3份,分别加入0.1、0.5 和0.9 mg/mL的1,2-与1,3- 棕榈酸二酯混标以及1,3-油酸二酯单标标准样品各1 mL,依照方法处理后,GC-FID进样。在表6中可以看出各甘油二酯的平均回收率在73.9%~76.9%。
表6 回收率实验
Table 6 Recovery experiment
注:N/D即未检测到。
2.3.6 橄榄油样品应用初探
从意大利获得6种特级初榨橄榄油和4种精炼橄榄油。用1.3的方法进行前处理后,GC-FID进样并分析橄榄油中2种特征DAGs异构体的含量。如图4所示,新鲜初榨橄榄油中1,2-DAGs含量明显均高于1,3-DAGs,精炼橄榄油中1,2-DAGs含量明显均低于1,3-DAGs。
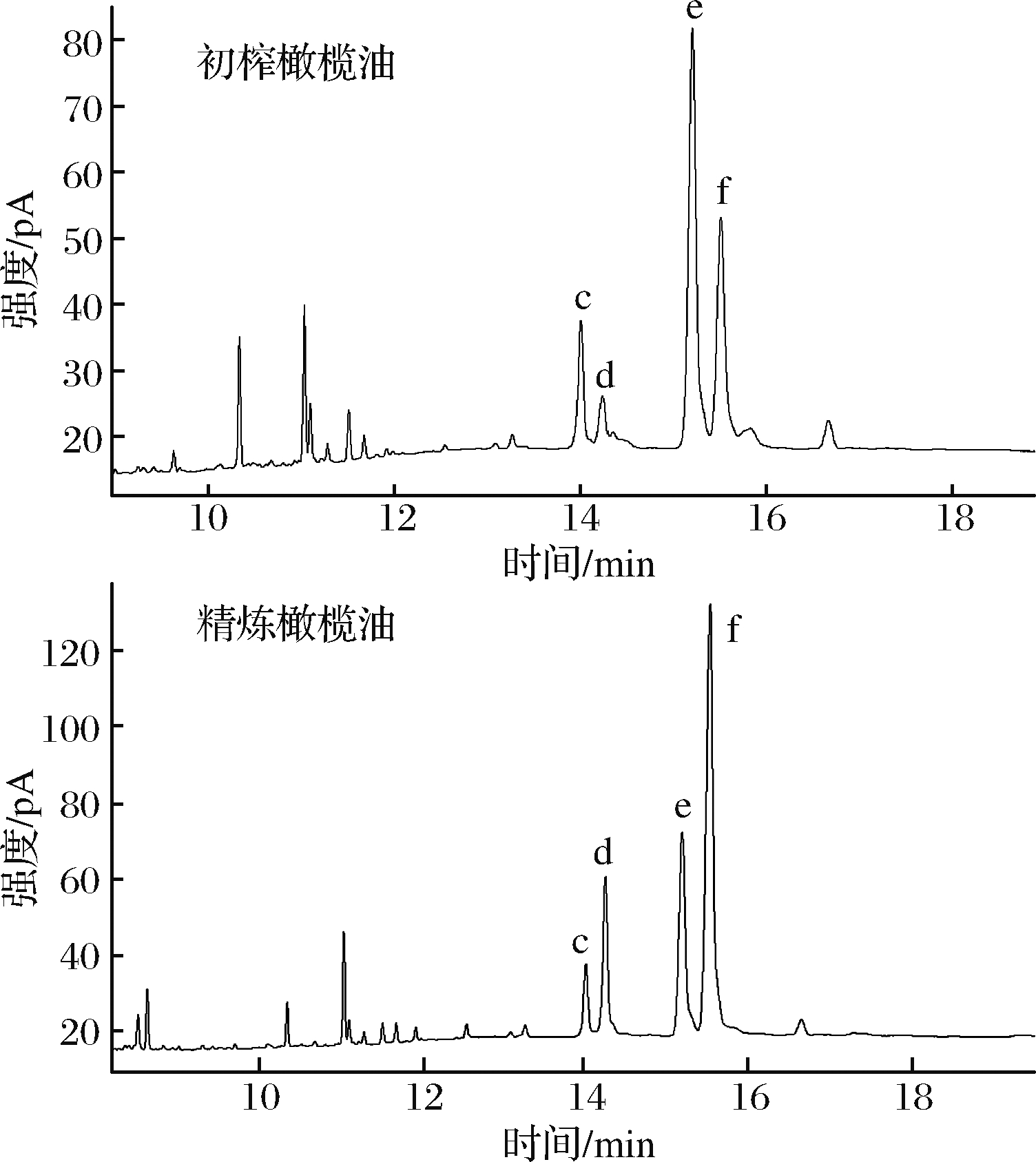
c-1,2-油酸棕榈酸二酯样品衍生物峰; d-1,3-油酸棕榈酸二酯样品衍
生物峰;e-1,2-油酸二酯样品衍生物峰;f-1,3-油酸二酯样品衍生物峰
图4 不同橄榄油样品的DAGs异构体衍生物GC-FID图
Fig.4 GC-FID of DAGs isomers in different olive oil samples
分析2种特征DAGs异构体的峰面积可知,新鲜初榨橄榄油中1,3-DAGs与1,2-DAGs的比率在0.41~0.61, 而精炼橄榄油中1,3-DAGs与1,2-DAGs的比率在2.04~2.39,这符合文献[8]中对油脂1,3-DAGs与1,2-DAGs稳定比例在6∶4~7∶3之间的描述,并且1,3-油酸二酯平均值为0.26 mg/mL(即2.6 mg/g),RSD值为0.12%,符合文献中[19]真实初榨橄榄油中1,3-油酸二酯的含量范围,可以确定样品的真实性及结果的可靠性。如图5所示。
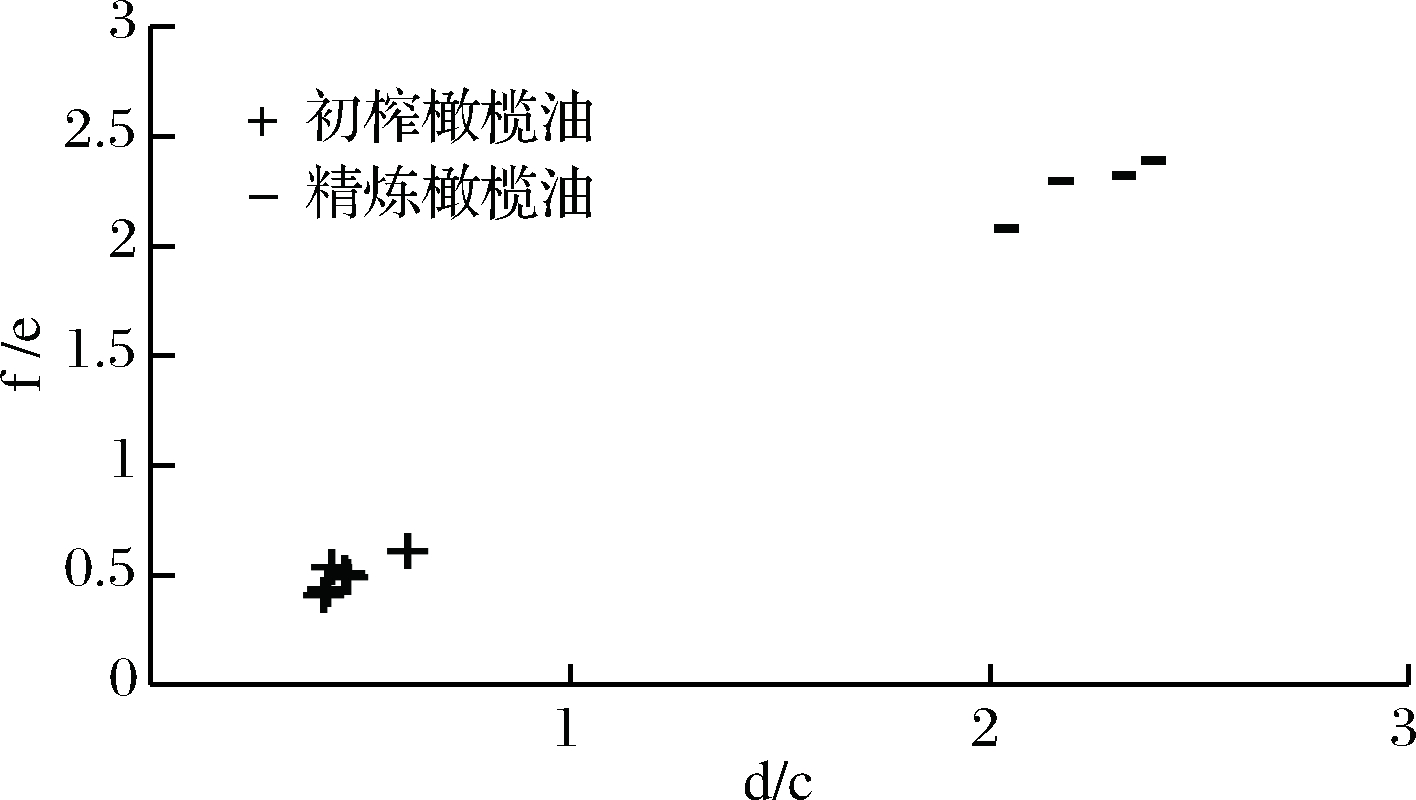
d/c-1,3-油酸棕榈酸二酯与1,2-油酸棕榈酸二酯比率;f/e-1,3-油酸二酯与1,2-油酸二酯比率
图5 橄榄油真实样品中的1,3-DAGs/1,2-DAGs值分布图
Fig.5 The distribution of 1,3-DAGs /1,2-DAGs in olive oil authentic samples (d/c)1,3-palmitoyl-oldipalmitin/1,2-palmitoyl-oldipalmitin (f/e)1,3-diolein/1,2-diolein
将橄榄油中2种主要的特征DAGs异构体的1,3-DAGs/1,2-DAGs结合来看,不同品质的橄榄油中1,3-DAGs与1,2-DAGs的比率差异明显,并且甘油二酯异构体比率的大小与橄榄油的新鲜程度呈正相关,由此可以作为区分压榨橄榄油及精炼橄榄油的鉴别参考。
本研究讨论了橄榄油经固相萃取后用甲基硅烷化试剂衍生,产生 1,2-DAGs与1,3-DAGs异构体甲基硅烷化衍生物,用GC-FID法定量分析。通过试验得出最佳衍生条件为:衍生温度30 ℃,衍生时间1 h。应用外标法定量,1,3-油酸二酯最低检出限(S/N=3)为0.032 mg/mL,RSD值在1.35%~4.62%,各特征甘油二酯的平均回收率在73.9%~76.9%。利用本试验方法,测出来自意大利的真实初榨橄榄油中1,3-DAGs与1,2-DAGs的比率在0.41~0.61,精炼橄榄油中1,3-DAGs与1,2-DAGs的比率在2.04~2.39。 实现了利用GC-FID法对橄榄油中DAGs异构体的定量分析,通过1,3-DAGs/1,2-DAGs的值来分析橄榄油品质,并精确定量了6种初榨橄榄油中1,3-油酸二酯的含量,建立了对橄榄油中特定甘油二酯异构体的定量分析方法。后续待进一步检测大量真实样品与市售样品验证方法的准确性与实用性。本研究的检测方法对鉴别初榨橄榄油新鲜程度及真伪性具有一定的参考意义,并且可以尝试应用到其他油类的品质鉴定中。
参考文献
[1] 何腊平,李兰香,周换景,等. 1,3-甘油二酯的制备研究进展[J]. 食品研究与开发, 2013, 34(15):113-116.
[2] 孟祥河, 毛忠贵,高保军,等. 甘油二酯的应用现状[J]. 中国食品添加剂, 2002(4):58-61.
[3] MORITA O, KANPP J F, TAMAKI Y, et al. Safety assessment of dietarydiacylglycerol oil: A two-generation reproductive toxicity study in rats[J]. Food and Chemical Toxicology, 2008, 46(9): 3 059-3 068.
[4] MAKI K C, DAVIDSON MH, TSUSHIMA R, et al. Consumption ofdiacylglycerol oil as part of a reduced -energy diet enhances olss of body weight and fat in compfrison with consumption of a triacylglycerol control oil[J]. Am. J. Clin. Nutr, 2002, 76(6): 1 230-1 236.
[5] 刘晓娟. 富含甘油二酯的大豆油的制备[D]. 长春:长春大学, 2017.
[6] ZHU Han-jiang, CLEGG M S, SHOEMAKER C F, et al. Characterization of diacylglycerol isomers in edible oils using gas chromatography-ion trap electron ionization mass spectrometry[J]. Journal of Chromatography A, 2013, 194-202.
[7] COSSIGNANI L, SIMONETTI M S, DAMIANI P. Structural changes of triacylglycerol and diacylglycerol fractions during olive druperipening[J]. European Journa lof Lipid Science and Technology, 2001, 212:160-164.
[8] LO S K, TAN C P, LONG K, et al. Diacylglycerol oil-properties, processes and products: A review[J]. Food Bioprocess Technol, 2008, 1:223-233.
[9] FRANKEL E N. Lipid Oxidation [M]. Cambridge UK: Woodhead Publishing Limited, 1998.
[10] 孙禧华, 王鑫,曹文明. 橄榄油质量鉴别若干内源性标记物[J]. 粮食与油脂, 2013, 26(9):8-9.
[11] BENARD S, ARNHOLD J, LEHNERT M, et al. Experiments towards quantification of saturated and polyunsaturated diacylglycerols by matrix-assisted laser desorption and ionization time-of-flight mass spectrometry[J]. Chem Phys Lipids, 1999, 100(1-2): 115-125.
[12] FUCHS B. Analysis of phospolipids and glycolipids by thin-layer chromatography-matrix-assisted laser desorption and ionization mass spectrometry[J]. Journal of Chromatography A, 2012, 1 259(19):62-73.
[13] CALLENDER H L, FORRESTER J S, IVANOVAL P, et al. Quantification of diacylglycerol species from cellular extracts by electrospray ionization mass spectrometry using a linear regression algorithm[J]. Anal Chem, 2007, 79(1): 263-272.
[14] CAMERA E, LUDOVICI M, GALANTE M, et al. Comprehensive analysis of the major lipid classes in sebum by rapid resolution high-performance liquid chromatography and electrospray mass spectrometry[J]. J Lipid Res, 2010, 51(11): 3 377-3 388.
[15] LI Y L, SU X, STAHL P D, et al. Quantification of diacylglycerol molecular species in biological samples by electrospray ionization mass spectrometry after one-step derivatization[J]. Anal Chem, 2007, 79(4): 1 569-1 574.
[16] 周君. 甘油二酯的制备与高效液相色谱的检测技术分析[J]. 当代化工研究, 2018(2):10-11.
[17] 赵欣欣, 孔保华,李龙祥,等. 甘油二酯的制备及其高效液相色谱的检测技术[J]. 食品工业, 2016, 37(11):228-231.
[18] ISO 29822:2009. Vegetable fats and oils-isomers diacylglycerols-determination of relativw amounts of 1,2- and 1,3-diacylglycerols[S]. Switzerland: DGF Standard Method, 2009.
[19] PEREZ M C, MOREDA W, CERT A. Effects of olive fruit quality and oil storage practices on the diacylglycerol content of virgin olive oils[J]. American Chemical Society, 2001, 49 (2): 699-704.
[20] 陈佳子. 甘油二酯的制备、性质表征及其在油包水型乳状液中的应用研究[D]. 广州:暨南大学, 2018.
[21] 陈岩, 潘龙. 甘油二酯研究进展[J]. 科技信息, 2012(17):19-21.
[22] 祝雨筱. 1,2-甘油二酯的酶法合成[D]. 无锡:江南大学, 2017.
[23] 高晓红, 郑毅,袁建,等. 反相高效液相色谱-蒸发光散射检测法测定大豆油中的甘油二酯[J]. 中国油脂, 2014, 39(1):65-68.
[24] 王宝维, 韩海娜,葛文华,等. 酶解法催化鹅油制备甘油二酯[J]. 中国粮油学报, 2015, 30(3):80-84.
[25] ZHU Hanjiang, TANG Shuaikun, SHOEMAKER C F, et al. Characterization of volatile compounds of virgin olive oil originating from the USA[J]. J Am Oil Chem Soc, 2015, 92(1):77-85.
[26] LI Xueqi, ZHU Hanjiang, SHOEMAKER C F, et al. The effect of different cold storage conditionson the compositions of extra virgin olive oil[J]. J Am Oil Chem Soc, 2014, 91(9):1 559-1 570.
[27] 樊巧英, 曹迪迪,张星星,等. 甘油二酯异构体高效液相色谱分析法的建立[J]. 中国油脂, 2017, 42(8):131-135.
WEI Yao1,2, ZHONG Qiding1,2*, WANG Daobing1,2,3, LI Guohui1,2
1(China National Research Institute of Food and Fermentation Industries Co. LTD, Beijing 100015, China) 2(National Standardization Center of Food and Fermentation Industry, Beijing 100015, China) 3(Shandong Jinsheng Cereals and Oils Group, Linyi 276000, China)
ABSTRACT Diacylglycerols isomers (1,3-/1,2-DAGs) play an important role in identifying olive oil quality. The ratio of DAGs isomers can indicate the freshness of olive oil. Solid phase extraction was used to extract DAGs in oil, and they were quantified by GC-FID after derivatization. Derived at 30 ℃ for 1 h was the optimal derivative condition. The lowest detection limit of this method was 0.032 mg/mL, the RSD value was 1.35%-4.62%, and the average recovery rate of each DAG was 73.9%-76.9%. It was found that the ratios of DAGs isomers in six extra-virgin olive oil and four refined olive oil were significantly different. This method was simple and easy to operate. It can be used to accurately determine DAGs isomers in olive oil. It provides technical supports for developing olive oil authenticity detection methods as well as establishing product standards. It also has guiding significance for portal and market regulations on imported extract virgin olive oil.
Key words methylsilanation; diacylglycerols; gas chromatography; extract virgin olive oil; authenticity