高霖1,朱莉2,杨泽林1,詹晓北1*,吴剑荣1
1(江南大学 生物工程学院,糖化学与生物技术教育部重点实验室,江苏 无锡,214122) 2(无锡格莱克斯生物科技有限公司,江苏 无锡,214125)
摘 要 为获得产高分子质量聚唾液酸(polysialic acid,PSA)菌株,分步采用常温常压等离子体(atmospheric and room temperature plasma,ARTP)和硫酸二乙酯(diethyl sulfate,DES)对大肠杆菌K235进行诱变。结果表明,通过ARTP诱变筛选得到1株产PSA分子质量较初始菌株提高了36.84%的E.coli K235 4B31。对E.coli K235 4B31进行DES诱变,获得1株产PSA分子质量较初始菌株提高了78.18%的突变菌株E.coli K235 6E61。通过三阶段搅拌转速控制策略最终使得突变菌株E.coli K235 6E61发酵产物PSA分子质量达到430.5 kDa,为目前已报道的最高分子质量PSA。
关键词 大肠杆菌;聚唾液酸;高分子质量;发酵
第一作者:硕士研究生(詹晓北教授为通讯作者,E-mail:xbzhan@yahoo.com)。
基金项目:863计划子课题(2012AA021505)
收稿日期: 2019-01-03, 改回日期:2019-01-23
DOI:10.13995/j.cnki.11-1802/ts.019842
唾液酸(sialic acid,SA)是一族神经氨酸的衍生物,在自然界中广泛分布,是许多糖蛋白、糖肽和糖脂的基本成分。聚唾液酸(polysialic acid,PSA)是唾液酸单体以α-2,8或α-2,9键连接而成的直链同聚物[1]。研究表明PSA参与细胞黏附、细胞迁移、神经突触生长、神经分叉、神经元导向、突触形成等功能[2]。PSA水溶性优良,黏度低,免疫原性低,生物相容性好,具有生物可降解性[3]。它可以用来作为神经再生的生物材料以及一些组织结构工程的支架材料[4];PSA在降低重金属离子对细胞毒害作用方面也有潜在的应用[5]; PSA是目前发现最好的多肽与蛋白类药物的可降解控释剂[6]。PSA的各种生物学效应使其拥有广泛的生物医学[7]和食品方面[8]的应用。
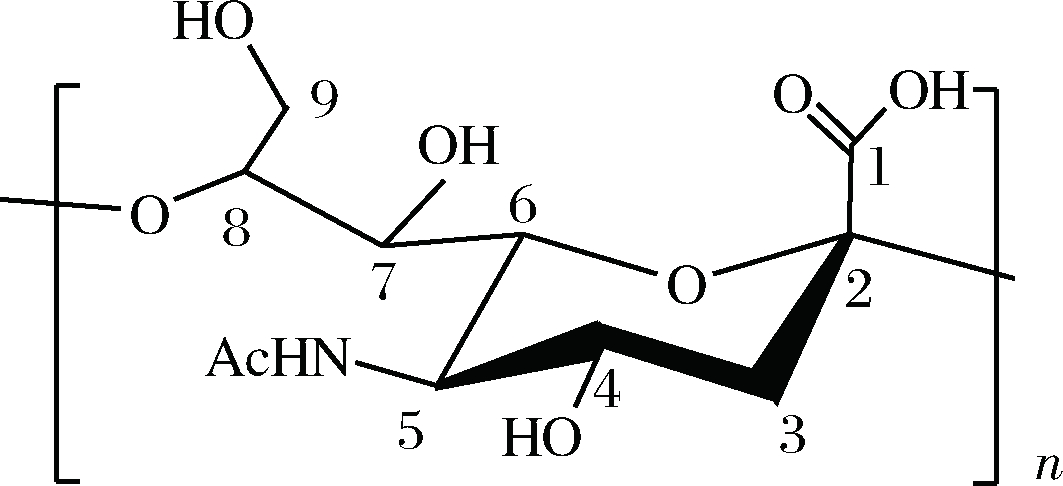
PSA是一种线性聚阴离子结构化合物,含有大量羧基,可以产生很大的水合作用,分子质量越大的PSA其水合作用越强,分子排阻体积越大,抗黏附特性越强[9]。作为药物包埋材料时,相较于低分子质量材料,高分子质量材料能包埋更多药物,具有更长的半衰期,更有利于药物在生物体内缓慢释放[10-11]。目前已报道最高分子质量PSA为260 kDa[12],与已被用于药物缓释材料[13-14]或组织材料[15-16]的透明质酸的分子质量相差较多。获得高分子质量PSA是解决这些问题的基础,而微生物发酵法是目前唯一的生产PSA的方法,因此深入挖掘探索产高分子质量PSA菌株及其发酵条件是十分有必要的。本实验主要通过对现有产PSA菌株大肠杆菌K235进行ARTP诱变和DES复合诱变,筛选获得产高分子质量PSA菌株,并在7 L发酵罐水平上对筛选得到的菌株进行发酵优化,为进一步拓宽PSA应用提供基础(图1)。

图1 α-2,8键连接构型聚唾液酸结构
Fig.1 Structure of α-2,8 linked polysialic acid
1.1.1 实验菌种
Escherichia coli K235(中国典型培养物保藏中心CCTCCM208088),保藏于江南大学糖化学与生物技术教育部重点实验室。
1.1.2 培养基
固体培养基(g/L):胰蛋白胨 10,NaCl 5,酵母粉 3,牛肉膏 2,琼脂 20,灭菌前pH 7.2。
种子培养基(g/L):胰蛋白胨 10,NaCl 5,酵母粉 3,牛肉膏 2,灭菌前pH 7.2。
摇瓶发酵培养基(g/L):山梨醇 40,(NH4)2SO44.94,K2HPO4·3H2O 26.2,胰蛋白胨1.5,MgSO4 0.9, 灭菌前pH 7.8。
上罐培养基(g/L):山梨醇 60,K2HPO4·3H2O 2.5,(NH4)2SO4 4.94,胰蛋白胨 1.5,MgSO4 0.9。
鉴别培养基(g/L):山梨醇 30,KH2PO4 1,胰蛋白胨 10,MgSO4 0.6,琼脂 20,溴百里酚蓝指示剂[17](20%溴百里酚蓝乙醇溶液)体积分数1%,灭菌前pH 7.8。
1.1.3 主要仪器
ARTP-Ⅱ诱变系统,北京思清源有限公司;3K15冷冻高速离心机,Sigma;LC-2010A液相色谱仪,岛津公司;Enspire多标记检测系统(酶标仪),珀金埃尔默有限公司;U-3900型紫外/可见分光光度计,HITACHI公司;ST210 pH仪,奥豪斯仪器有限公司;Superose-12凝胶柱,美国GE公司;7 L BioFlo115型发酵罐,Eppendorf公司。
1.1.4 主要试剂
山梨醇:医药级,阿拉丁试剂有限公司;Dextran右旋糖苷标准品:色谱纯,美国聚合物标准品(APSC)公司;其他试剂均为分析纯,购自上海国药集团。
1.2.1 ARTP诱变
甘油管保存菌株划取单菌落,挑选单菌落接至种子培养基,37 ℃、200 r/min培养12h。将活化后单菌落菌液按4%转接至种子培养基,37 ℃、200 r/min培养2~4 h。取一定量菌液4 ℃、10 000 r/min离心5 min, 用等体积无菌生理盐水(9 g/L NaCl溶液)洗涤2次,制成菌悬液。取10 μL制备好的菌悬液均匀涂在无菌载片上,置于ARTP工作台里诱变处理:距离2 mm、通气量10 slm、功率100 W,分别处理0、15、30、45、60、75、90、120 s。将处理完的载片置于1 mL无菌生理盐水中,充分振荡,稀释105倍并涂布于含鉴别培养基的平板上,每个处理样分别做个平行,37 ℃ 下培养48 h,通过平板计数计算致死率。挑选各诱变梯度菌株按方法1.3.2进行24孔板培养并测定分子质量,计算正负突变率。致死率、正突变率、负突变率分别按公式(1)、(2)、(3)计算:
致死率![]()
(1)
正突变率![]()
(2)
负突变率![]()
(3)
式中,A为未诱变处理平板上菌落数;L为诱变处理后平板上菌落数;P为分子质量高于未诱变菌株分子质量5%的菌落数;N为分子质量低于未诱变菌株分子质量5%的菌落数。
1.2.2 DES诱变
将ARTP诱变菌株制备成菌悬液。取5 mL菌悬液按体积比1%加入DES,37 ℃、150 r/min下分别处理0、10、20、30、40、50、60 min后,加入1 mL无菌250 g/L Na2S2O3溶液终止反应。按方法1.2.1进行培养并计算致死率、正负突变率。
1.3.1 初筛
从鉴别培养基平板上挑取变色光圈大且菌落也大的菌株作为初筛菌株并接种至斜面培养基保存。
1.3.2 高通量筛选
将初筛得到的菌株接种于含种子培养基的24孔板(装液量3 mL/10 mL)中,每株菌做3个平行,37 ℃、 150 r/min培养12 h。种子液按4%转接到含发酵培养基的24孔板(装液量3 mL/10 mL)中,37 ℃、150 r/min培养48 h。测定各菌株PSA分子质量。
1.3.3 摇瓶复筛
将高通量筛选得到的菌株按方法1.2.1培养成种子液。按4%转接至含发酵培养基的摇瓶中(装液量10 mL/50 mL),每株菌做4个平行,37 ℃、200 r/min培养48 h。测定各菌株的PSA分子质量,以出发菌株作为对照,筛选PSA分子质量最高菌株。
1.4.1 菌体量测定
取一定量发酵液稀释一定倍数后测定OD600,OD600=1.0相当于0.45 g/L菌体干重[12]。
1.4.2 PSA含量测定
采用间苯二酚-盐酸法[18]。
1.4.3 PSA分子质量测定
样品处理:发酵液在4 ℃、10 000 r/min下离心10 min,取一定量上清加3倍体积95%乙醇,4 ℃下放置2 h。后在4 ℃、10 000 r/min下离心5 min,取沉淀加水复溶,4 ℃、12 000 r/min下离心5 min,取上清。
高通量筛选样品分子质量测定采用端基法[19]。
摇瓶、7 L式发酵罐发酵样品分子质量测定采用高效凝胶过滤色谱(HPGFC)法:色谱柱为Superose-12(1.0 cm×30 cm)凝胶柱,流动相0.01 mol/L NaOH溶液,流速为0.5 mL/min,进样量20 μL, RID检测器。标曲绘制:已知分子质量Dextran作为标准品,以出峰时间t为横坐标,lgMw为纵坐标绘制标准曲线如公式(4)所示:
lgMW=-0.138 4t+7.703 3
(4)
对获得的突变菌株进行5次传代,经过摇瓶(装液量50 mL/500 mL)37 ℃、200 r/min下培养48 h,测定其各代的PSA产量、PSA分子质量、生物量、发酵结束pH,验证菌种的遗传稳定性。
7 L发酵罐在7 L发酵罐上对获得的诱变菌株进行发酵培养,优化最佳产高分子质量PSA搅拌转速条件。培养条件为:four-pitched blade impeller型搅拌桨(直径11.80 cm),装液量为4 L,接种量为8%,温度恒定37 ℃,通气量为1.2 vvm,采用两阶段pH控制分批补料策略[12]:0~16 h时pH控制在6.4,16 h后pH控制在7.4,以硫酸铵和山梨醇作为补料流加。测定发酵过程中菌体量、PSA产量、PSA分子质量。
2.1.1 ARTP诱变结果
E.coli K235 ARTP诱变致死曲线如图2所示。
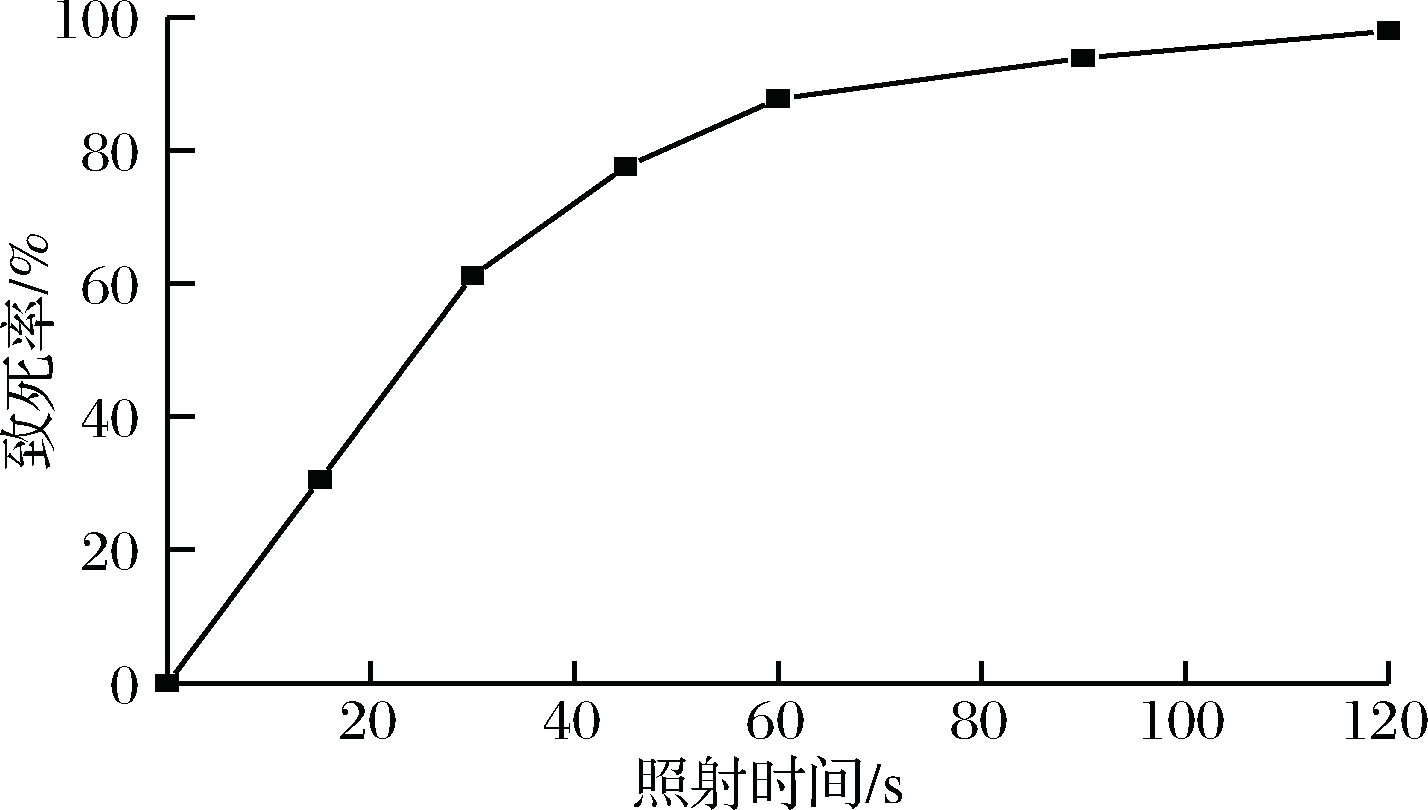
图2 E.coli K235的ARTP诱变致死曲线
Fig.2 ARTP lethal rate curve of E.coli K235
由图2可以看出,在0~30 s时,照射时间增加,致死率急剧增加;30~60 s时,照射时间增加,致死率缓慢增加;照射60 s后,致死率趋于平缓。当照射时间为45 s时,致死率达到77.55%;照射时间120 s时,致死率达到了98%。选取ARTP处理致死率在70%~90%的菌落进行培养。正负突变率结果如表1。
表1 不同ARTP诱变时间效果比较
Table 1 Evaluation of ARTP mutation

从表1可以看出,ARTP处理60 s时负突变率相比于处理45 s时大幅增加,处理 45 s菌株正突变率更高,所以ARTP诱变时间选择45 s。
ARTP诱变处理后,从初筛平板上挑取了360株光圈、菌落较大的菌株进行高通量筛选,从中选取了具有较高分子质量20株菌株进行摇瓶复筛。ARTP诱变复筛结果如图3所示。由图3可以看出,经过摇瓶复筛,16株菌株发酵产PSA的分子质量提高10%以上,2株菌株(3B21、4B31)PSA分子质量提高30%以上。其中,编号为4B31的菌株发酵产PSA分子质量最高,其PSA分子质量为21.2 kDa,较出发菌株E.coli K235提高了36.84%,其PSA产量为1.71 g/L,较出发菌株也提高了45.83%。将其命名为E.coli K235 4B31。

图3 ARTP诱变摇瓶复筛结果
Fig.3 ARTP mutagenesis screening results
2.1.2 DES诱变结果
以E.coli K235 4B31为出发菌株,进行第二轮DES诱变,致死曲线如图4。

图4 E.coli K235 4B31的DES诱变致死曲线
Fig.4 DES lethal rate curve of E.coli K235 4B31
从图4可以看出,DES诱变处理在0~10 min时,致死率缓慢增加;DES诱变处理10~30 min时,随着处理时间增加致死率急剧增加,处理30 min时致死率达到75.82%;DES诱变处理60 min时致死率达到了99.2%。
选取致死率在70%~90%的DES处理时间,统计各自的正负突变率如表2。从表2可以看出,DES处理30 min相较于处理40 min具有更高的正突变率,因此选取30 min为DES诱变的处理时间。
表2 不同DES诱变时间效果比较
Table 2 Evaluation of DES mutation
DES诱变处理后,从初筛平板上挑取了210株光圈、菌落较大的菌株进行高通量筛选,得到10株产PSA分子质量较高菌株。对这10株高通量筛选菌株进行摇瓶复筛,结果如图5所示。由图5可知,DES处理后,筛选得到8株发酵产PSA分子质量提高了10%以上菌株,3株菌株(5A23、6E61、6F41)PSA分子质量提高了20%。其中,编号为6E61的诱变菌株发酵产物PSA分子质量为27.6 kDa,较出发菌株E.coli K235 4B31提高了30.19%,较初始菌株E.coli K235提高了78.18%;产物PSA含量为1.89 g/L,较初始菌株E.coli K235提高了61.53%。将其命名为E.coli K235 6E61。

图5 DES诱变摇瓶复筛结果
Fig.5 DES mutagenesis screening results
为检测突变菌株E.coli K235 6E61 产PSA的遗传稳定性,连续培养了5代,测定各代发酵参数,实验结果如表3所示。
表3 E.coli K235 6E61 的遗传稳定性测试
Table 3 Genetic stability test of E.coli K235 6E61

从表3可以看出,各代菌株发酵结束时的pH值在6.1左右,菌体量在5.27 g/L左右,PSA产量在2.25 g/L左右,PSA分子质量在41 kDa左右,各项指标均较为稳定,具有良好的遗传稳定性。
PSA在E.coli K235中合成属于高耗能过程,因此发酵产物PSA分子质量大小很大程度上受到溶氧水平的影响,通气量一定时,高溶氧水平通常由高搅拌速率实现。PSA为胞外荚膜多糖,由胞内酶合成后,通过ABC转运(ATP-binding cassette)蛋白转移至胞外,与胞外膜上脂质受体结合[20-21]。搅拌速率过高,胞外荚膜因高剪切力作用加速脱落,不利于长链PSA的形成,因此,合适的搅拌转速对于发酵产高分子质量PSA来说至关重要。
为进一步提高诱变菌株E.coli K235 6E61发酵产物PSA,并探究搅拌转速对诱变菌株E.coli K235 6E61发酵产PSA的影响,在7 L发酵罐采用恒定单一搅拌转速对诱变菌株E.coli K235 6E61进行培养,结果如图6所示。
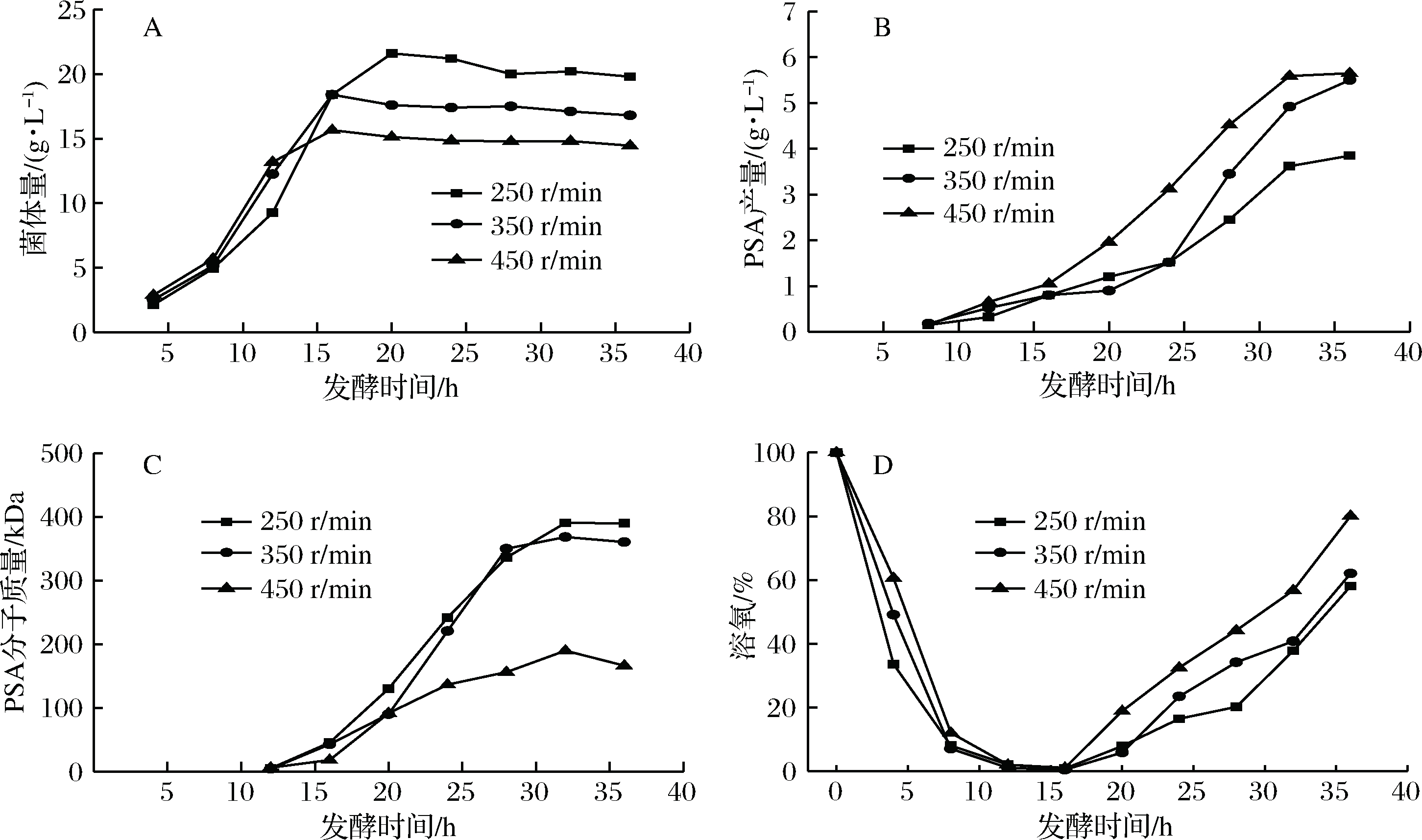
A-搅拌转速对菌体量影响;B-搅拌转速对PSA产量影响;C-搅拌转速对PSA分子质量影响;D-不同搅拌转速下溶氧水平
图6 不同搅拌转速对诱变菌株E.coli K235 6E61 发酵生产PSA影响
Fig.6 Effect of different agitation speed on PSA production by fermentation of E.coli K235 6E61
由图6-A可知,搅拌转速增加,发酵最大菌体量显著降低,低搅拌转速(250 r/min)时,菌体量最大为21.6 g/L。在发酵前期(0~12 h)时,高搅拌转速伴随着高剪切力和高溶氧,而高剪切力和高溶氧不利于菌体的生长,所以低搅拌转速下菌体量更高,与刘金龙等[22]报道相一致。由图6-B和图6-C可知,搅拌转速增加,发酵产物PSA产量增加、分子质量降低。在高搅拌转速(450 r/min)时,PSA产量最大为5.75 g/L;低搅拌转速(250 r/min)时,PSA分子质量最大为390.4 kDa。发酵8 h开始检测到低浓度SA,发酵12 h后才检测到低分子质量PSA。有研究[23-24]表明在大肠杆菌合成α-2,8结构PSA时,唾液酸转移酶不能从头开始合成PSA,需要低聚唾液酸或内源性受体,因而PSA合成具有滞后性。发酵中期(12~20 h)时,唾液酸含量较低,前体物质大量积累。BORK等[25-26]研究发现,增加底物浓度(活化后SA)后,唾液酸转移酶在细胞中的表达下调,而增加合成SA前体物质N-乙酰甘露糖胺浓度后,在细胞中的表达上调。由此推测,此时胞内唾液酸转移酶大量表达,而唾液酸转移酶是合成PSA的唯一限速酶,因而其后PSA分子质量显著增加。PSA发酵为高密度发酵,在发酵中期(12 ~20 h)时,发酵液的密度和黏度均较大,高搅拌转速带来更高效的传气传质,更有利于发酵中间产物和能量物质的积累,因而高搅拌转速下PSA产量更高。在发酵后期(20 h后),发酵产物PSA产量和分子质量快速增加,此时高搅拌转速下产生了过剩的溶氧,如图6-D所示,过剩的溶氧在发酵液作用下产生一系列的对菌体具有毒害作用的超氧化物和羟基自由基[27-28],加剧荚膜多糖的分泌,此外高剪切力加速了剥落细胞表面荚膜。所以在发酵后期,搅拌转速增加,PSA分子质量显著降低。低搅拌转速(250 r/min)时,PSA分子质量最大为390.4 kDa。
同时实现高产量和高分子质量是PSA发酵的目标,由上述结果可知,在不同发酵阶段选择不同的搅拌转速对菌株发酵十分重要。因此,提出了三阶段搅拌转速分批发酵:如图7-A所示,发酵前期(0~12 h)搅拌转速恒定为250 r/min,为防止转速变化幅度太大影响菌体生长,发酵中期(12~20 h)将搅拌转速稳定在400 r/min,发酵后期(20 h后)搅拌转速调回250 r/min,结果如图7-B所示。发酵结束后,诱变菌株E.coli K235 6E61最大菌体量为19.4 g/L,发酵产物PSA产量为5.82 g/L,PSA分子质量为430.5 kDa,PSA分子质量较恒定单一搅拌转速的最大分子质量提高了10.27%。

A-发酵过程参数;B-发酵结果
图7 三阶段搅拌转速控制诱变菌株E.coli K235 6E61发酵过程曲线
Fig.7 Time curve of PSA fermentation with E.coli K235 6E61 with three-stage agitation speed controlling strategy
通过ARTP-DES复合诱变,获得产高分子质量PSA诱变菌株E.coli K235 6E61,其在50 mL摇瓶中发酵产物PSA分子质量为27.6 kDa,较初始菌株E.coli K235提高了78.18%,PSA产量为1.89 g/L,较初始菌株提高了61.53%。诱变菌株E.coli K235 6E61通过了遗传稳定性测试,具有较好的遗传稳定性。在7 L发酵罐对诱变菌株E.coli K235 6E61进行搅拌转速优化,采用三阶段搅拌转速分批发酵,发酵产物PSA产量为5.82 g/L,最大分子质量为430.5 kDa,为目前微生物发酵产PSA的最高分子质量。
目前,通过诱变方式获得产高分子质量多糖研究相对较少,主要集中在高分子质量透明质酸研究上。汤栋等[29]通过H2O2胁迫、紫外辐射和DES对菌株进行复合诱变获得了透明质酸酶缺失菌株,使得透明质酸分子质量提高了57.8%。陈奕涵等[30]通过亚硝基甲基脲和氮离子注入对菌株复合诱变使得透明质酸分子质量提高了137.3%。本研究主要采用新型的ARTP诱变与DES诱变两种方式,这也是这两种诱变方法首次应用于产PSA菌株E.coli K235的筛选,得到一株产高分子质量PSA目的菌株,其PSA产量也有较大的提高,同时也证明了通过诱变方式获得产高分子质量多糖菌株具有可行性。
参考文献
[1] 吴剑荣,詹晓北,郑志永,等.聚唾液酸与唾液酸的研究进展[J].生物加工过程,2007,5(1):20-26.
[2] RUTISHAUSER U. Polysialic acid and the regulation of cell interactions[J].Current Opinion in Cell Biology,1996,8(5):679-684.
[3] MCGUIRE E J, BINKLEY S. The structure and chemistry of colominic acid [J].Biochemistry,1964,3(2):247-251.
[4] 付浩,冯昌雨,詹晓北,等.聚唾液酸-透明质酸接枝聚合物的合成及其在药物缓释载体中的应用[J].合成化学,2016, 24(7):570-575;581.
[5] MURTHY R V, BHARATE P, GADE M, et al. Effect of transition metals on polysialic acid structure and functions[J]. Chem Med Chem,2016, 11(7):667-673.
[6] GREGORIADIS G, JAIN S, PAPAIOANNOU I, et al. Improving the therapeutic efficacy of peptides and proteins: A role for polysialic acids[J].Int J Pharm, 2005,300(1-2):125-130.
[7] LIN B X,QIAO Y, SHI B, et al. Polysialic acid biosynthesis and production in Escherichia coli: Current state and perspectives [J].Appl Microbiol Biotechnol, 2016,100(1):1-8.
[8] 郑志永,詹晓北,朱德强,等. 聚唾液酸和唾液酸寡糖的生物合成及其在营养食品中的应用前景[J].食品科学,2013,34(15):361-368.
[9] COLLEY K J, KITAJIMA K, SATO C. Polysialic acid: Biosynthesis, novel functions and applications[J].Crit Rev Biochem Mol Biol,2014,49(6):498-532.
[10] POLA R, HEINRICH A K, MUELLER T, et al.Passive tumor targeting of polymer therapeutics: In vivo imaging of both the polymer carrier and the enzymatically cleavable drug model[J]. Macromol Biosci, 2016, 16(11):1 577-1 582.
[11] LIU Rui,WANG Yan, MA Yudan,et al. Effects of the molecular weight of PLGA on degradation and drug release in vitro from an mPEG-PLGA nanocarrier[J].Chemical Research in Chinese Universities, 2016, 32(5):848-853.
[12] ZHENG Z Y, WANG S Z, LI G S, et al. A new polysialic acid production process based on dual-stage pH control and fed-batch fermentation for higher yield and resulting high molecular weight product[J].Appl Microbiol Biotechnol, 2013, 97(6):2 405-2 412.
[13] KUFELT O, EL-TAMER A, SEHRING C, et al. Hyaluronic acid based materials for scaffolding via two-photon polymerization[J].Biomacromolecules,2014,15(2):650-659.
[14] BORKE T, NAJBERG M, ILINA P, et al. Hyaluronic acid graft copolymers with cleavable arms as potential intravitreal drug delivery vehicles[J].Macromol Biosci 2018,18(1):1-13.
[15] 杨俊龙,王艳娉,张源,等.透明质酸治疗膝骨关节炎相关机制的研究进展[J].中国疼痛医学杂志,2017,23(6):451-454.
[16] MONDAL S, HARIDAS N, LETHA S S, et al. Development of injectable high molecular weight hyaluronic acid hydrogels for cartilage regeneration[J].Journal of Macromolecular Science,2016, 53(8):507-514.
[17] 于军华.聚唾液酸生产菌种的选育及其发酵工艺的研究[D].无锡:江南大学,2002.
[18] JR O T, COOPER K M J A B. An improved automated periodate-resorcinol method for the determination of sialic acid [J].1983,133(1):233-238.
[19] 李国顺,郑志永,李丹,等. 端基法测定聚唾液酸平均聚合度[J].工业微生物,2012,42(5):19-23.
[20] WILLIS L M, STUPAK J, RICHARDS M R, et al. Conserved glycolipid termini in capsular polysaccharides synthesized by ATP-binding cassette transporter-dependent pathways in gram-negative pathogens [J].Proc Natl Acad Sci U S A,2013,110(19):7 868-7 873.
[21] DESZO E L, STEENBERGEN S M, FREEDBERG D I, et al. Escherichia coli K1 polysialic acid O-acetyltransferase gene, neuO, and the mechanism of capsule form variation involving a mobile contingency locus [J].Proc Natl Acad Sci U S A,2005,102(15):5 564-5 569.
[22] 刘金龙.微生物发酵法制备聚唾液酸的研究[D].无锡:江南大学,2011.
[23] PETERSON D C, ARAKERE G, VIONNET J,et al.Characterization and acceptor preference of a soluble meningococcal group C polysialyltransferase[J].J Bacteriol,2011,193(7):1 576-1 582.
[24] FERRERO M A, APARICIO L R. Biosynthesis and production of polysialic acids in bacteria[J].Appl Microbiol Biotechnol, 2010,86(6):1 621-1 635.
[25] BORK K,WEIDEMANN W, BERNECK B,et al. The expression of sialyltransferases is regulated by the bioavailability and biosynthesis of sialic acids[J].Gene Expr Patterns, 2017(23-24):52-58.
[26] JOSEPH D D A, JIAO W, PARKER E J. Arg314 is essential for catalysis by N-acetyl neuraminic acid synthase from Neisseria meningitidis[J].Biochemistry,2013,52(15):2 609-2 619.
[27] BARRIE F C, BLANK L M, RICHARD M, et al.Microbial hyaluronic acid production[J].2005, 66(4):341-351.
[28] RAO Y M, SURESHKUMAR G K.Improvement in bioreactor productivities using free radicals: HOCl-induced overproduction of xanthan gum from Xanthomonas campestris and its mechanism[J].Biotechnol Bioeng,2001,72(1):62-68.
[29] 汤栋,荣绍丰,管世敏,等.氧化胁迫联合UV、DES诱变选育高产、高分子质量透明质酸菌株[J]. 食品工业科技,2015,36(11):136-140.
[30] 陈奕涵,钱悦,侯永泰,等.复合诱变选育大分子质量透明质酸高产菌株[J].中国酿造,2012,31(9):98-101.
GAO Lin1,ZHU Li2,YANG Zelin1,ZHAN Xiaobei1*,WU Jianrong1
1(School of Biotechnology, Key Laboratory of Carbohydrate Chemistry and Biotechnology of Ministry of Education, Jiangnan University, Wuxi 214122, China) 2(Wuxi Glyco Biotechology Co. Ltd, Wuxi 214125, China)
ABSTRACT In order to produce polysialic acid (PSA) with high molecular weight, Escherichia coli K235 was treated by atmospheric and room temperature plasma (ARTP) and diethyl sulfate (DES). Mutant 4B31 obtained by ARTP mutagenesis produced PSA with 36.84% higher molecular weight than that of the parent strain. Mutant 6E61 obtained from mutant 4B31 by DES mutagenesis produced PSA with 78.18% higher molecular weight. By using a three-stage agitation speed fermentation, the maximal molecular weight of PSA produced by mutant 6E61 was 430.5 kDa, which was the highest value reported up to date.
Key words Escherichia coli; polysialic acid; high molecular weight; fermentation