李益烽1,2,方芳1,2*
1(工业生物技术教育部重点实验室(江南大学),江苏 无锡,214122) 2(食品科学与技术国家重点实验室(江南大学),江苏 无锡,214122)
摘 要 以1株产葡萄糖醛酸的鲁氏接合酵母ZSR2为研究对象,通过单因素优化确定了鲁氏接合酵母ZSR2发酵产葡萄糖醛酸的最佳发酵条件(发酵培养基含有80 g/L蔗糖、30 g/L大豆蛋白胨,培养基初始pH 5.0,种龄9 h,接种量为3%)。在此条件下,鲁氏接合酵母ZSR2产葡萄糖醛酸水平提高到14.68 g/L,是优化前的3.8倍。此外,通过在发酵过程中采用补料策略,使葡萄糖醛酸产量进一步提高到22.36 g/L, 是目前纯菌发酵法产葡萄糖醛酸的最高水平。研究结果可为微生物发酵法生产葡萄糖醛酸的工业化进程奠定基础。
关键词 葡萄糖醛酸(glucuronic acid,GlcUA);鲁氏接合酵母;单因素优化;补料发酵
第一作者:硕士研究生(方芳副教授为通讯作者,E-mail:ffang@jiangnan.edu.cn)
基金项目:国家轻工技术与工程一流学科自主课题(LITE2018-08)
收稿日期:2019-01-10,改回日期:2019-02-16
DOI:10.13995/j.cnki.11-1802/ts.019905
葡萄糖醛酸(glucuronic acid,GlcUA)又称葡糖醛酸、葡醛酸,分子式C6H10O7,分子质量为194.14,能溶于水,微溶于乙醇。葡萄糖醛酸存在于多种动植物中,它是葡萄糖C-6位上的羟基被氧化而形成的羧酸[1]。在人体和动物中,葡萄糖醛酸以尿苷二磷酸葡萄糖醛酸(uridine diphosphate glucuronic acid,UDP-GlcUA)的活性供体形式存在。微生物可以通过肌醇氧化途径氧化肌醇生成葡萄糖醛酸[2],有些微生物则合成细胞外结合型葡萄糖醛酸,即胞外多糖[3-5]。葡萄糖醛酸可以与人体内的多种毒素结合后排出体外,因而可以作为一种解毒剂[6]。此外,人体每天摄入适量的葡萄糖醛酸可以有效地预防多种退行性疾病[7]。D-葡萄糖醛酸也是构成肝素、软骨素,透明质酸等功能营养化学品的单体之一[8]。因此,葡萄糖醛酸被广泛应用于医药,化妆品,保健食品等领域[7,9]。
目前工业化生产葡萄糖醛酸主要是采用浓硝酸氧化淀粉的化学合成法[9]。化学合成法成本低,但是反应体系复杂,氧化选择性较差且氧化程度无法有效控制,因此存在副反应多、产物分离困难等问题[9]。根据上述缺点,研究者进行了工艺和条件的改进:林培喜等改用碱法水解减少污染[10];郭耀基等从废液中二次回收增加了产品的回收率[11];房媛通过超声波预处理,以芬顿试剂为氧化剂,并结合酶法清洁生产葡萄糖醛酸及内酯[12]。但淀粉氧化法仍存在各种限制性因素,因此必须寻找更加绿色高效的方法。利用微生物法生产葡萄糖醛酸目前处于初步研究阶段,用于合成葡萄糖醛酸的菌株有限,产量也较低。由于葡萄糖醛酸是葡萄糖二酸合成的前体,构建大肠杆菌基因工程菌合成葡萄糖二酸的过程,也实现了葡萄糖醛酸的生物合成[2,13-14]。在大肠杆菌中通过构建肌醇氧化途径以及过量表达肌醇氧化酶(myo-inositol oxidase,MIOX),使得葡萄糖醛酸产量达到3.94 g/L[13-23]。此外,也有研究者利用酶法降解微生物发酵产生的多糖或多糖醛酸获得葡萄糖醛酸。但是由于酶的特异性问题和对多糖降解的不充分性,获得的产物为不饱和葡萄糖醛酸单体、二聚体和三聚体,该方法仍处于研究阶段[4]。
本研究旨在筛选一株具有合成葡萄糖醛酸潜力的菌株,并通过单因素发酵条件优化,补料方法考察,初步提高发酵法合成葡萄糖醛酸的水平。
菌株:Aspergillus oryzae NRRL3448,购自中国微生物菌种保藏中心;其余菌株均为本研究室保藏,其中Zygosaccharomyces rouxii ZSR2,Bacillus cereus H3,Bacillus cereus H4,Bacillus cereus H7均分离自红茶菌,Candida orthopsilosis Y3分离自酱油酱醪。
葡萄糖、蔗糖、大豆蛋白胨、KH2PO4、柠檬酸铵均购自国药集团股份有限公司;蛋白胨和酵母提取物购自Oxoid公司;葡萄糖醛酸标样购自Solarbio公司。
种子培养基(g/L):酵母提取物5,蛋白胨20,葡萄糖20。固体培养基加入20琼脂。基础发酵培养基(g/L):葡萄糖20,大豆蛋白胨10,KH2PO4 1.5。
ZQZY-VAF振荡培养箱,上海知楚仪器有限公司;HH-B11·420BS恒温培养箱,上海跃进医疗器械有限公司;ICS-5000离子色谱仪,赛默飞世尔科技有限公司。
1.3.1 培养方法
种子培养:挑取单菌落接种于含 50 mL种子培养基的250 mL锥形瓶中,30 ℃、220 r/min培养10 h。摇瓶发酵培养:将种子培养液按1%的接种量接种到含50 mL发酵培养基的250 mL锥形瓶中,30 ℃、220 r/min培养20 h。单因素优化后以最佳条件培养。
1.3.2 菌株筛选方法
根据菌株肌醇氧化酶活性进行筛选,挑选酶活力较高的菌株,验证其产葡萄糖醛酸的能力,选择合适菌株进行后续研究。本方法中使用的培养基包括:真菌筛选培养基(g/L):酵母提取物5,葡萄糖20,蛋白胨20;细菌筛选培养基(g/L):蛋白胨10,牛肉膏3,NaCl 5。
1.3.3 肌醇氧化酶酶活测定
以肌醇为底物,通过酶转化肌醇生成葡萄糖醛酸的方法测定MIOX的活性[2]。酶活定义:1 min内生成1 μmol醛酸所需要的酶量为1个酶活力单位。酶催化反应:向900 μL含有50 mmol/L Tris-HCl (pH 8.0),2 mmol/L L-半胱氨酸,1 mmol/L Fe(NH4)2(SO4)2和10 g/L肌醇的反应液中添加100 μL酶液,30 ℃反应1 h,加入100 μL的 30%三氯乙酸终止反应。取1 mL反应液,加入2 mL苔黑素试剂(每10 mL 浓盐酸中加入40 mg苔黑素,10 mg FeCl3),沸水中反应15 min,冷却后测定670 nm处吸光度。酶活以每克干菌体表示,即U/ g (DCW)。菌体干重测定:取10 mL培养液离心收集菌体,用无菌水洗涤2次,烘干至恒重称重并计算菌体净重。
1.3.4 葡萄糖醛酸含量测定
葡萄糖醛酸含量的测定采用改良的离子色谱法[19,24]。发酵液用超纯水稀释100倍,用0.22 μm微孔滤膜过滤后用离子色谱测定。以质量浓度为0.1 g/L 的葡萄糖醛酸为标准品。
色谱条件:分离柱为IonPacAS11-HC (4×250 mm),保护柱使用IonPacAG11-HC (4×50 mm)。淋洗液发生器(淋洗梯度设置):0~15 min,0.8 mmol/L;15~27 min,0.8~12 mmol/L;27.1~31 min,45 mmol/L;31.1~35 min,0.8 mmol/L;流速:1.00 mL/min;柱箱温度:30 ℃;进样量为25 μL,检测使用抑制型电导,AERS 5004 mm。
1.3.5 单因素优化
培养基碳氮源优化:本研究中用于培养基组成优化的碳源包括葡萄糖、蔗糖、麦芽糖、乳糖、果糖、山梨醇和甘露醇;氮源包括蛋白胨、大豆蛋白胨、牛肉膏、酵母提取物、尿素、硫酸铵、柠檬酸铵。
碳氮源优化使用的培养基如下:碳源种类优化培养基(g/L):大豆蛋白胨10,KH2PO4 1.5,碳源含量为20 g/L(以葡萄糖计,其他碳源以相同碳摩尔数计);碳源浓度优化培养基(g/L):大豆蛋白胨10,KH2PO4 1.5,蔗糖20~120;氮源种类优化培养基(g/L):葡萄糖20,KH2PO4 1.5,氮源含量为10 g/L(以大豆蛋白胨计,其他氮源以相同氮摩尔数计);氮源浓度优化培养基(g/L):葡萄糖20,KH2PO4 1.5,大豆蛋白胨质量浓度10~40 g/L。
发酵培养基初始pH、种龄和接种量优化:本研究中的培养条件优化包括培养基初始pH、种龄和接种量,其中初始pH分别为4.0、4.5、5.0、5.5、6.0、6.5、7.0, 种龄分别为6、7、8、9、10 h,接种量分别为1%、3%、5%、7%、10%。
1.3.6 发酵液中蔗糖含量测定
蔗糖标准曲线的制作:取蔗糖标准溶液(称取1 g蔗糖,超纯水溶解,稀释到100、200、300、400、500 mg/L) 0.9 mL,加入2 mol/L NaOH 0.1 mL,100 ℃沸水浴10 min, 立即冷却。再加入间苯二酚试剂(称取0.1 g 间苯二酚,用6 mol/L HCl溶解,定容至100 mL)1 mL,10 mol/L HCl 3 mL,混匀,80 ℃水浴8 min,冷却至室温。在500 nm波长下测吸光度。
样品中蔗糖含量测定:取稀释至适当倍数发酵液0.9 mL,操作同上。以蒸馏水作为空白对照。根据标准曲线,计算出样品中蔗糖含量。
1.3.7 发酵液中氮含量检测
根据食品安全国家标准食品中蛋白质的测定中凯氏定氮法检测发酵液中氮的含量[25]。
1.3.8 补料方法考察
补料种类考察:鲁氏接合酵母ZSR2发酵至对数中后期(14 h),向培养基中补加大豆蛋白胨(10 g/L),以等量无菌水作为对照。每隔2 h取样,检测发酵液中菌体浓度和葡萄糖醛酸含量。
补料浓度考察:鲁氏接合酵母ZSR2发酵至对数中后期(14 h),向培养基中补加大豆蛋白胨(5~30 g/L),以等量无菌水作为对照。每隔2 h取样,检测发酵液中菌体浓度和葡萄糖醛酸含量。
复合氮源配比考察:鲁氏接合酵母ZSR2发酵至对数中后期(14 h),向培养基中补加不同配比复合氮源(以氮含量计,大豆蛋白胨氮含量为10%),其中有机氮源使用大豆蛋白胨,无机氮源使用柠檬酸铵,以等量无菌水作为对照。每隔2 h取样,检测发酵液中菌体浓度和葡萄糖醛酸含量。
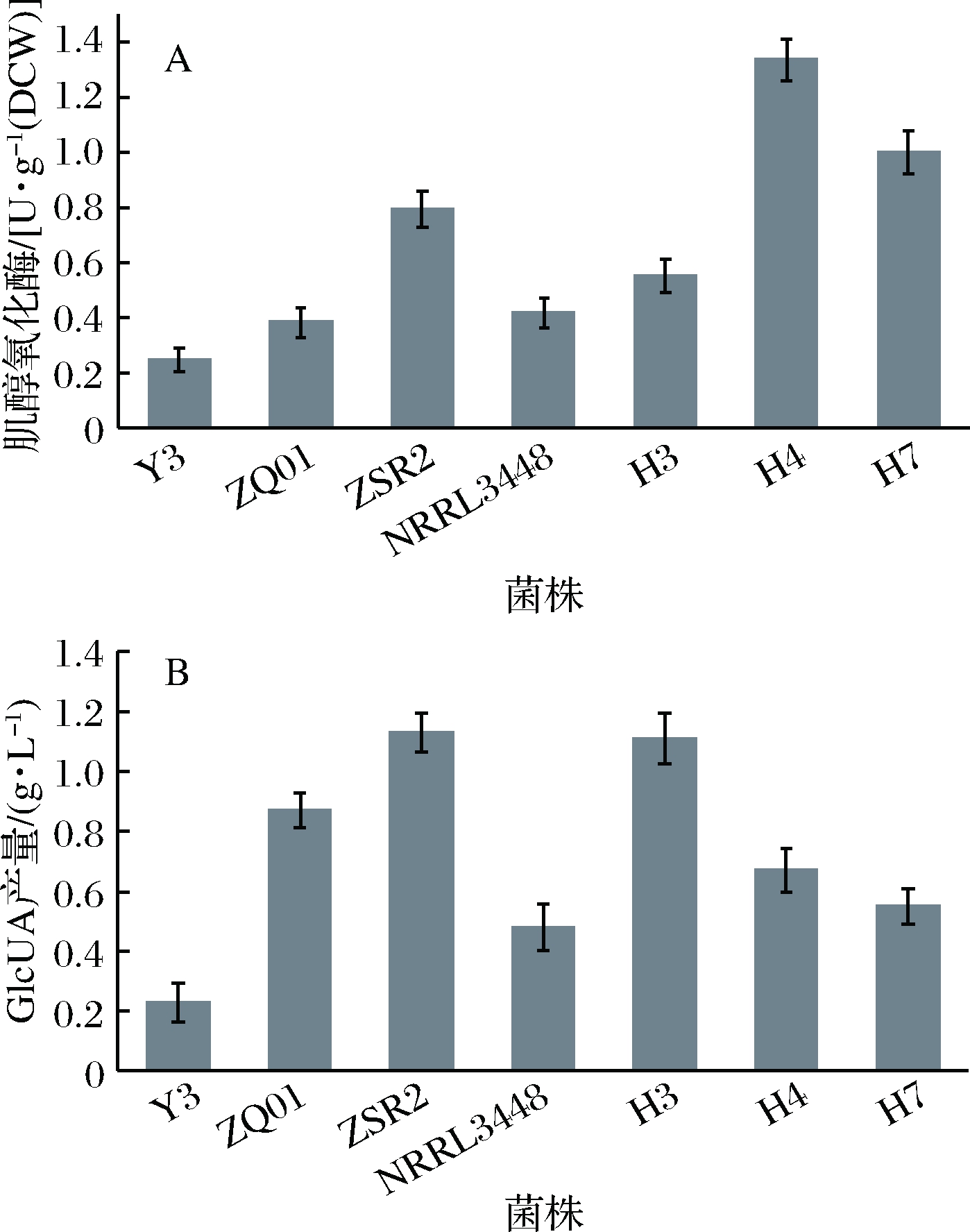
微生物合成葡萄糖醛酸途径的关键酶为肌醇氧化酶。根据菌株肌醇氧化酶活性的高低以及菌株产酸水平,可以初步选择用于发酵法生产葡萄糖醛酸的菌株。本研究比较了来源于红茶菌和酱醪及实验室保藏的菌株,发现肌醇氧化酶酶活较高的菌株有蜡样芽孢杆菌H4,蜡样芽孢杆菌H7,鲁氏接合酵母ZSR2,蜡样芽孢杆菌H3,米曲霉NRRL3448,鲁氏接合酵母ZQ01,假丝酵母Y3(图1-A)。但由于菌株肌醇氧化酶活力高低和产葡萄糖醛酸能力高低不具有绝对相关性,产葡萄糖醛酸的能力可能还与肌醇氧化途径其他酶酶活、菌株代谢利用葡萄糖醛酸能力等相关,因此还需要检测菌株产葡萄糖醛酸能力。发酵液中葡萄糖醛酸产量最高的菌株是鲁氏接合酵母ZSR2,其合成葡萄糖醛酸的水平为1.13 g/L (图1-B)。由于鲁氏接合酵母ZSR2在合成葡萄糖醛酸能力和关键合成酶水平方面具有相对优势,选择它为生产菌株进行葡萄糖醛酸发酵条件优化研究。

A-菌株肌醇氧化酶酶活比较;B-菌株产葡萄糖醛酸能力比较
图1 菌株肌醇氧化酶酶活和葡萄糖醛酸产量比较
Fig.1 The comparison of MIOX activity and glucuronic acid yield between strains
2.2.1 发酵培养基碳源优化
对发酵培养基碳源进行优化,结果见图2。在考察的7种碳源中,鲁氏接合酵母ZSR2以蔗糖和甘露醇作为碳源,可以获得较高产量的葡萄糖醛酸,分别为3.94 和4.06 g/L。但蔗糖与甘露醇相比具有价格优势,因此选择蔗糖作为发酵用碳源。对蔗糖浓度研究发现,当蔗糖质量浓度为80 g/L时,鲁氏接合酵母ZSR2产葡萄糖醛酸产量达到最高,为7.97 g/L。

A-碳源种类对鲁氏接合酵母产GlcUA影响;B-蔗糖质量浓度对鲁氏接合酵母产GlcUA影响
图2 碳源对鲁氏接合酵母ZSR2产GlcUA影响
Fig.2 Effect of carbon sources on production of GlcUA by Z. rouxii ZSR2
2.2.2 发酵培养基氮源优化
对发酵培养基的氮源种类研究显示,鲁氏接合酵母ZSR2发酵产葡萄糖醛酸的最佳氮源为大豆蛋白胨。并且,当大豆蛋白胨质量浓度为30 g/L时,产酸量最高,达到8.65 g/L (图3)。
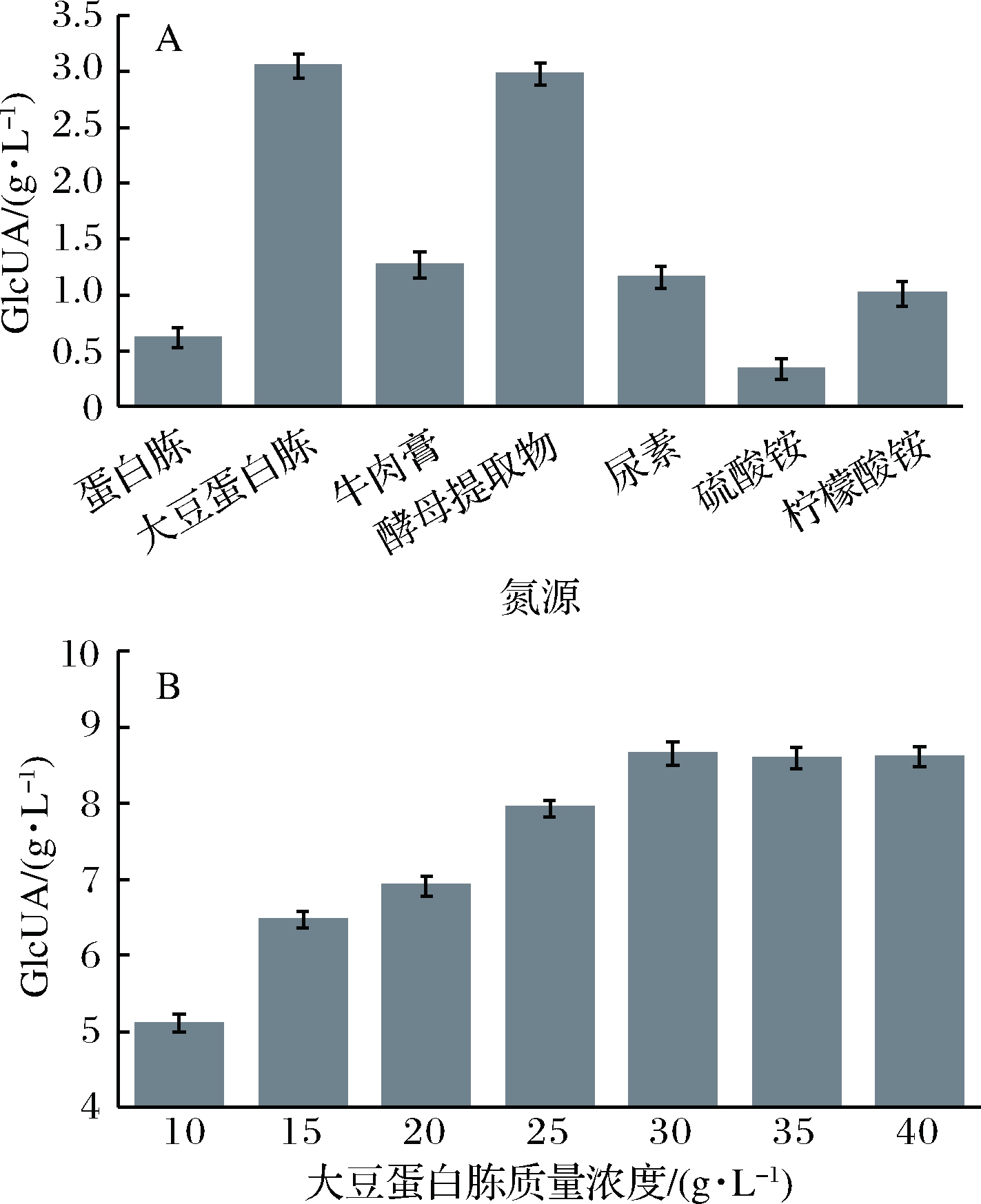
A-氮源种类对产GlcUA影响;B-大豆蛋白胨对产GlcUA影响
图3 氮源对鲁氏接合酵母ZSR2产GlcUA影响
Fig.3 Effect of nitrogen sources on production of GlcUA by Z. rouxii ZSR2
2.2.3 发酵培养基初始pH优化
鲁氏接合酵母的最适生长pH在5.0~5.5[26]。对红茶菌产葡萄糖醛酸的研究表明,弱酸环境可在一定程度上促进葡萄糖醛酸的合成[21]。为寻找有利于葡萄糖醛的发酵条件,考察了发酵培养基初始pH对鲁氏接合酵母ZSR2产葡萄糖醛酸的影响。由图4可以看出,当发酵培养基初始pH为5.0时,鲁氏接合酵母ZSR2产葡萄糖醛酸产量最高,为11.68 g/L。发酵培养基初始pH低于5.0时以及偏中性的培养条件均不利于产酸。
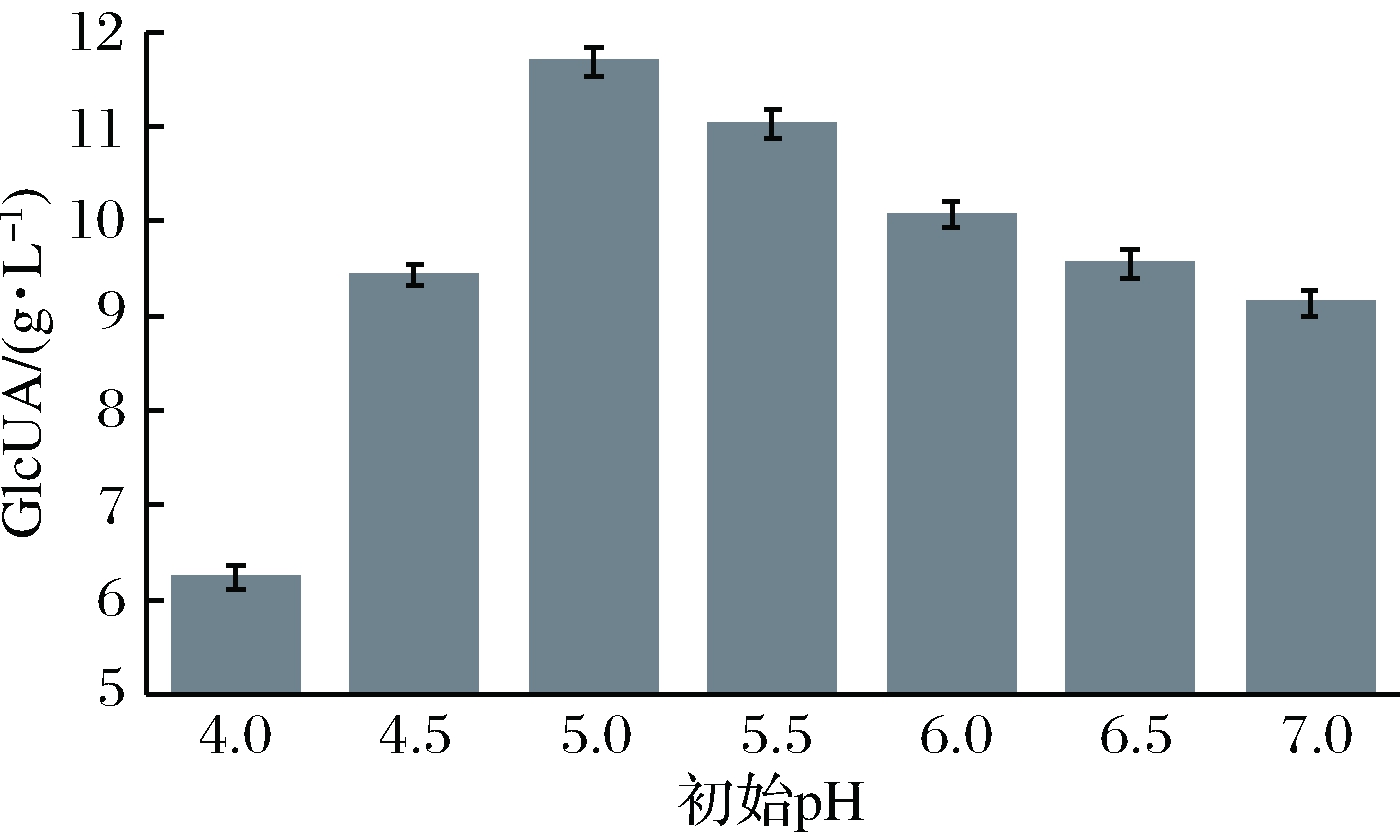
图4 初始pH对鲁氏接合酵母ZSR2产GlcUA影响
Fig.4 Effect of initial pH on production of GlcUA by Z. rouxii ZSR2
2.2.4 最适接种量和种龄的确定
对鲁氏接合酵母ZSR2产葡萄糖醛酸种龄和接种量的研究表明,接种量为3%,种龄为9 h时,ZSR2产葡萄糖醛酸产量达到最高(图5)。通过优化种龄和接种量,鲁氏接合酵母ZSR2产葡萄糖醛酸水平提高到13.02 g/L。在此基础上,通过监测鲁氏接合酵母ZSR2发酵产葡萄糖醛酸的过程发现,产酸量最高为鲁氏接合酵母ZSR2生长的稳定期。此时,菌体浓度(OD600) 达到11.6,葡萄糖醛酸产量为14.68 g/L,是优化前的3.8倍(图6)。

A-接种量对产GlcUA的影响;B-种龄对产GlcUA的影响
图5 接种量和种龄对鲁氏接合酵母ZSR2产GlcUA影响
Fig.5 Effect of inoculum size and age on production of GlcUA by Z.rouxii ZSR2
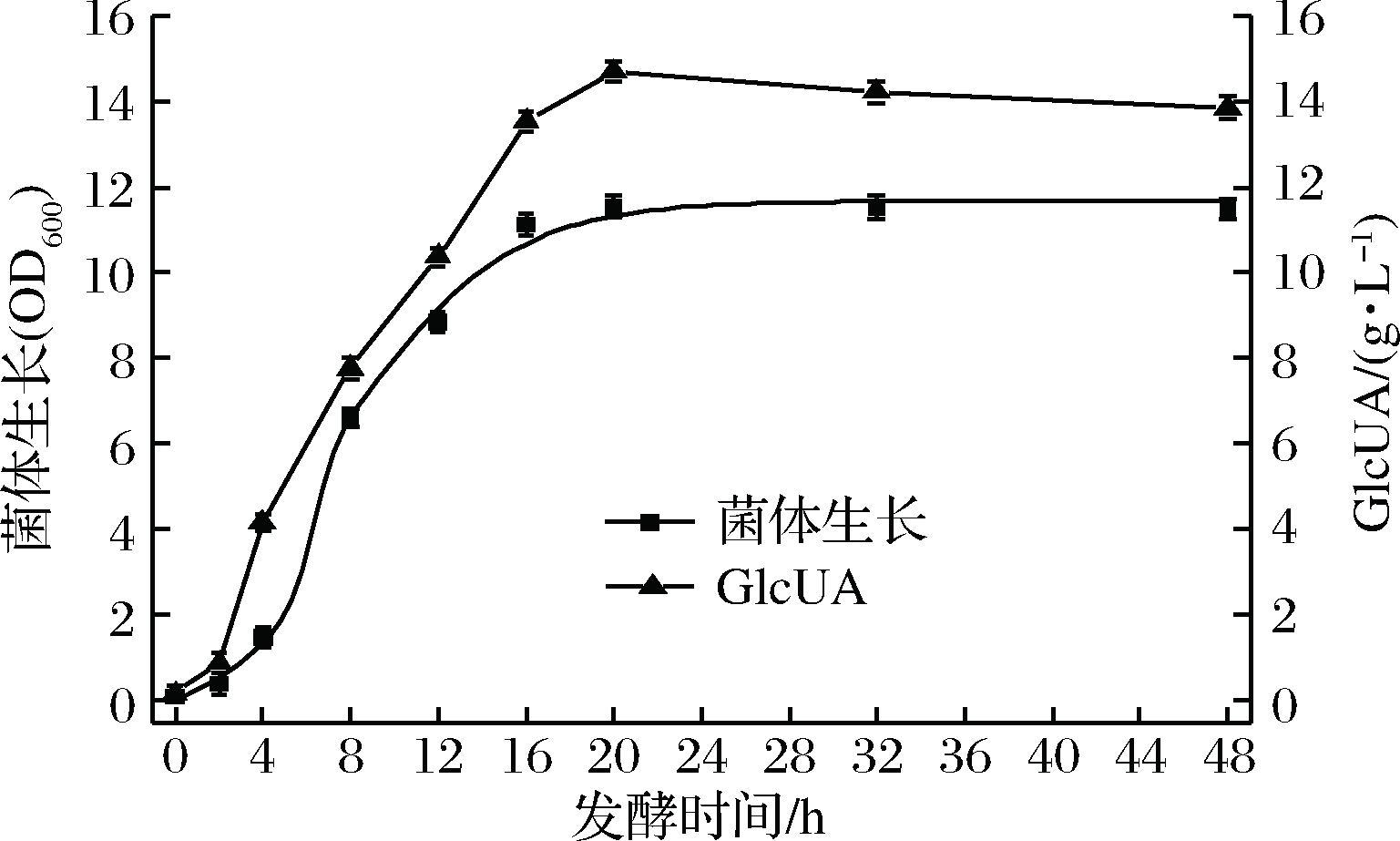
图6 鲁氏接合酵母ZSR2产GlcUA发酵过程曲线
Fig.6 The fermentation process curve of glucuronic acid by Z. rouxii ZSR2
前期研究证实,鲁氏接合酵母生长与葡萄糖醛酸的合成是偶联的。对鲁氏接合酵母产葡萄糖醛酸发酵过程培养基中碳源和氮源分析表明,发酵后期菌体生长和产酸减缓,此时培养基中碳源充足而氮源不足(图7)。因此,确定采用补加氮源的方法促进产酸。由于16 h时菌体生长已进入稳定期,此时培养基中氮源已消耗至50%以下,因此选择在发酵第14 h补加氮源。由图8可以看出,在发酵第14 h补加有机氮源大豆蛋白胨,可以同时促进菌体生长及葡萄糖醛酸的合成。在发酵过程中,向培养基中补加20 g/L大豆蛋白胨后,菌体量和葡萄糖醛酸产量均为最高;发酵24 h时菌体OD600达到14.65,葡萄糖醛酸产量提高到18.15 g/L,比对照提高22.7%。
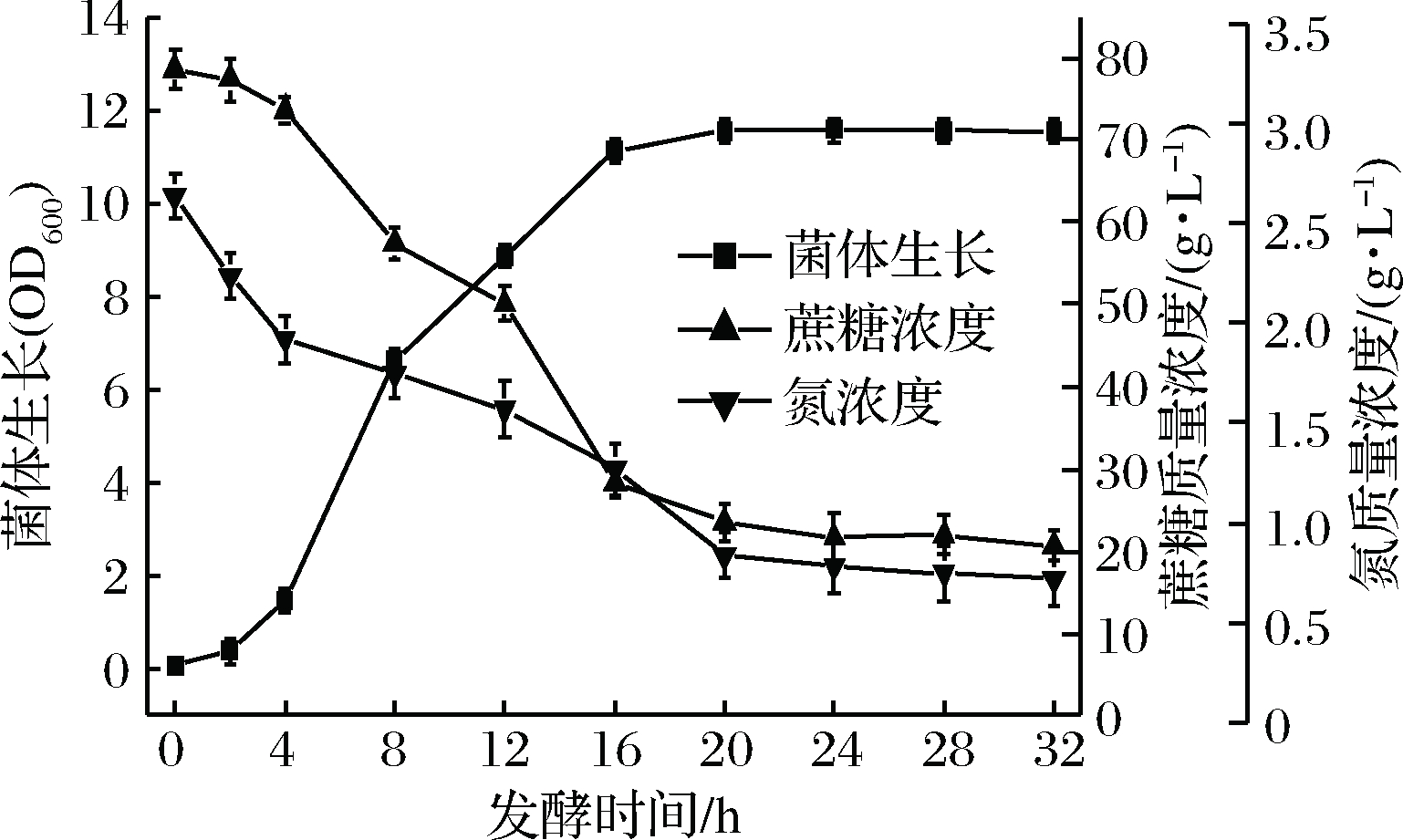
图7 鲁氏接合酵母ZSR2产GlcUA发酵过程
碳氮源含量变化
Fig.7 The change of carbon and nitrogen sources during fermentation on GlcUA production by Z.rouxii ZSR2

A-补加氮源对菌体生长的影响;B-补加氮源对产GlcUA的影响
图8 补加氮源对鲁氏接合酵母ZSR2生长及产GlcUA影响
Fig.8 The effect of nitrogen source feeding on growth of Z.rouxii ZSR2 and GlcUA synthesis
在实际工业生产中,增加培养基中有机氮源的含量会造成生产成本的增加。无机氮源成本较低,并且同有机氮源比是相对利用缓慢的氮源。因此,添加无机氮源对于降低生产成本有重要意义,也可能促进产酸。通过比较采用复合氮源或无机氮源补料对鲁氏接合酵母ZSR2产葡萄糖醛酸的影响发现,采用无机氮源柠檬酸铵不仅有利于鲁氏接合酵母ZSR2生长,也促进了其产酸。从图9可看出,随着复合氮源中柠檬酸铵的比例增加,菌体的生长加快、葡萄糖醛酸产量也不断提高。当复合氮源全为柠檬酸铵(11.56 g/L)时,菌体量在16 h达到最大,葡萄糖醛酸产量在20 h达到最高,为22.36 g/L,比对照高了49.9%。分析原因可能为鲁氏接合酵母ZSR2发酵产葡萄糖醛酸是一个产酸的过程,发酵液pH会不断下降,而过低的pH会抑制菌体的生长以及降低相关酶系的活力,而柠檬酸铵相比于大豆蛋白胨,除了为菌体提供营养物质,还可以起到中和缓冲的作用,从而维持发酵液pH的稳定,促进鲁氏接合酵母ZSR2生长和产酸。

A-不同复合氮源对菌体生长的影响;B-不同复合氮源对产GlcUA的影响
图9 补加氮源策略对鲁氏接合酵母ZSR2生长及产GlcUA影响
Fig.9 The effect of nitrogen source feeding strategies on growth of Z.rouxii ZSR2 and GlcUA synthesis
本研究以1株具有合成葡萄糖醛酸潜力的鲁氏接合酵母ZSR2为生产菌株,通过发酵条件的单因素优化,使葡萄糖醛酸产量从3.85 g/L提高到14.68 g/L,是优化前的3.8倍。然后通过在发酵中期补加氮源的方式,使鲁氏接合酵母合成葡萄糖醛酸的产量进一步提高到22.36 g/L,是目前报道的纯菌发酵产葡萄糖醛酸的最高水平。研究结果可为微生物发酵法生产葡萄糖醛酸的工业化进程奠定基础。
参考文献
[1] HOU Z, LIU Y, ZHANG X X, et al. Synthesis of glucuronic acid derivatives via the efficient and selective removal of a C6 methyl group[J]. Tetrahedron Letters, 2016, 5(5):423-426.
[2] MOON T S, YOON S H, LANZA A M, et al. Production of glucaric acid from a synthetic pathway in recombinant Escherichia coli[J]. Applied and Environmental Microbiology, 2009, 75(3): 589-595.
[3] JAYABALAN R, SUBATHRADEVI P, MARIMUTHU S, et al. Changes in free-radical scavenging ability of Kombucha tea during fermentation[J]. Food Chemistry, 2008, 109(1): 227-234.
[4] DELATTRE C, MICHAUD P, LION J M, et al. Production of glucuronan oligosaccharides using a new glucuronan lyase activity from a Trichoderma sp. strain[J]. Journal of Biotechnology, 2005, 118(4): 448-457.
[5] KOIZUMI S. Large-scale production of oligosaccharides using bacterial functions[J]. Trends in Glycoscience and Glycotechnology, 2010, 15(82): 65-74.
[6] NGUYEN N K, NGUYEN H T, LE P H. Effects of Lactobacillus casei and alterations in fermentation conditions on biosynthesis of glucuronic acid by a Dekkera bruxellensis-Gluconacetobacter intermedius Kombucha symbiosis model system[J]. Food Biotechnology, 2015, 29(4): 356-370.
[7] VINA I, SEMJONOVS P, LINDE R, et al. Glucuronic acid containing fermented functional beverages produced by natural yeasts and bacteria associations[J]. International Journal of Research and Reviews in Applied, 2013, 14(1): 17-25.
[8] CIMINI D, ROSA M D, SCHIRALDI C. Production of glucuronic acid-based polysaccharides by microbial fermentation for biomedical applications[J]. Biotechnology Journal, 2012, 7(2): 237-250.
[9] 陈辉, 和娴娴. 葡萄糖醛酸及其内酯制备方法的研究进展[J]. 山东食品发酵, 2011(1): 6-8.
[10] 周锡堂, 林培喜, 胡智华. 葡醛内酯生产工艺改进研究[J]. 桂林工学院学报,2003(1):132-135.
[11] 郭耀基,王晓峰,唐黎华. 采用二次内酯化方法从葡醛内酯生产废液中回收产品[J]. 无锡轻工大学学报,2004,23(2):67-70;75.
[12] 房媛. 葡萄糖醛酸内酯清洁生产[D]. 西安:陕西科技大学,2013.
[13] SHIUE E, PRATHER K L. Improving D-glucaric acid production from myo-inositol in E. coli by increasing MIOX stability and myo-inositol transport[J]. Metabolic Engineering, 2014, 22: 22-31.
[14] MOON T S, DUEBER J E, SHIUE E, et al. Use of modular, synthetic scaffolds for improved production of glucaric acid in engineered E. coli[J]. Metabolic Engineering, 2010, 12(3): 298-305.
[15] 和娴娴. 葡萄糖醛酸产生菌的筛选及培养条件研究[D]. 石家庄:河北科技大学, 2012.
[16] PETROVIE S E, MALBASA R V, VERAC R M. Biosynthesis of glucuronic acid by means of tea fungus[J]. Molecular Nutrition and Food Research, 2010, 44(2): 138-139.
[17] BLANC P J. Characterization of the tea fungus metabolites[J]. Biotechnology Letters, 1996, 18(2): 139-142.
[18] NGUYEN N K, DONG N T N, NGUYEN H T, et al. Lactic acid bacteria: promising supplements for enhancing the biological activities of Kombucha[J]. Springerplus, 2015, 4(1): 91.
[19] BEIGMOHAMMADI F, KARBASI A, BEIGMOHAMMADI Z. Production of high glucuronic acid level in Kombucha beverage under the influence environmental condition[J]. Journal of Food Technology and Nutrition, 2010, 2(26):30-38.
[20] YANG Z, FENG Z, JI B, et al. Symbiosis between microorganisms from Kombucha and Kefir: Potential significance to the enhancement of Kombucha function[J]. Applied Biochemistry and Biotechnology, 2010, 160(2): 446-455.
[21] NGUYEN N K, DONG N T N, LE P H, et al. Evaluation of the glucuronic acid production and other biological activities of fermented sweeten-black tea by Kombucha layer and the co-culture with different Lactobacillus sp. strains[J]. International Journal of Modern Engineering Research, 2014, 4(1): 12-17.
[22] JAYABALAN R, MARIMUTHU S, SWAMINATHAN K. Changes in content of organic acids and tea polyphenols during kombucha tea fermentation[J]. Food Chemistry, 2007, 102(1): 392-398.
[23] FILIPPIS F D, TROISE A D, VITAGLIONE P, et al. Different temperatures select distinctive acetic acid bacteria species and promotes organic acids production during Kombucha tea fermentation[J]. Food Microbiology, 2018, 73: 11-16.
[24] 范艳群,许建中,徐询,等. 离子排斥色谱法同时测定葡萄糖醛酸和内酯及葡萄糖醛酸稳定性[J]. 应用化学, 2014, 31(4): 450-454.
[25] 国家食品药品监督管理总局. GB 5009.5—2016, 食品中蛋白质的测定[S]. 北京:中国标准出版社,2016.
[26] 宋江. 酱油酿造用鲁氏接合酵母菌的生长及其产香气成分研究[D]. 长沙:湖南农业大学, 2013.
LI Yifeng1,2,FANG Fang1,2*
1(Key Laboratory of Industrial Biotechnology, Ministry of Education (Jiangnan University), Wuxi 214122, China) 2(State Key Laboratory of Food Science and Technology (Jiangnan University), Wuxi 214122, China)
ABSTRACT The fermentation condition for producing GlcUA by Zygosaccharomyces rouxii ZSR2, a GlcUA producer, was optimized by single factor experiments. It was found that the titer of GlcUA under the optimal fermentation condition (the medium contained 80 g/L sucrose, 30 g/L soy peptone, initial pH=5.0, with 3% inoculum and aged for 9 h) was 14.68 g/L, which was 3.8 times higher than that of unoptimized. Besides, the production of GlcUA enhanced to 22.36 g/L by fed-batch fermentation, which was the highest level reported regarding GlucUA production by single strain fermentation. In conclusion, this study lays a foundation for industrial production of GlcUA by microbial fermentation.
Key words glucuronic acid(GlcUA); Zygosaccharomyces rouxii;singer factor optimization; fed-batch fermentation