武雅琴1,王莉莎1,邹咪1,包海蓉1,2,3*
1(上海海洋大学 食品学院,上海,201306)2(上海水产品加工及贮藏工程技术研究中心,上海,201306) 3(农业部水产品加工贮藏保鲜质量安全风险评估实验室(上海),上海,201306)
摘 要 大豆分离蛋白(soybean protein isolate,SPI)经60、80和95 ℃热处理,分别与鱼肌原纤维蛋白(myofibrillar protein,MP)按质量比1∶3(总蛋白质量浓度45 g/L)热诱导得到混合蛋白凝胶。结果表明,从流变特性来看,与天然大豆分离蛋白复合凝胶(MP-N-SPI)相比,MP-SPI(80 ℃)的储能模量值(G′)(P<0.05)显著上升,而MP-SPI(60 ℃和95 ℃)却低于MP-N-SPI。在MP中加入SPI后,复合凝胶的持水性均高于单纯MP,适宜的热诱导温度SPI(80 ℃),可以明显改善复合凝胶的持水力(water holding capacity,WHC)(P<0.05)。从质构特性看出,MP-SPI(95 ℃)的硬度显著提升。电泳图谱显示,MP-N-SPI凝胶条带与单纯MP无明显差异,MP-SPI(80 ℃和95 ℃) 条带比MP-N-SPI和MP-SPI(60 ℃)浅,说明预热SPI(80 ℃或95 ℃)容易与MP相互作用。化学力测定显示,预热大豆蛋白与MP的凝胶网络形成主要是疏水作用的结果,而氢键和二硫键不是复合凝胶形成的主要化学力。由此可见,适宜的热诱导大豆分离蛋白,可以明显改善复合凝胶的特性。
关键词 大豆分离蛋白;鱼肌原纤维蛋白;凝胶特性;化学力
第一作者:硕士研究生(包海蓉副教授为通讯作者,E-mail:hrbao@shou.edu.cn)。
基金项目:国家高技术研究发展计划“863”计划(2012AA092302);中央级公益性科研院所业务费专项资金(东海水产研究所)资助项目(2018M04)
收稿日期:2018-09-30,改回日期:2018-11-02
DOI:10.13995/j.cnki.11-1802/ts.018951
金枪鱼中富含DHA、EPA等多不饱和脂肪酸,营养价值丰富,同时含有丰富的维生素和矿物质。目前,金枪鱼的加工主要以生鱼片和罐头为主,在金枪鱼罐头食品的加工过程中将产生大量的碎肉,约占原料的11%左右[1],除有限的用于罐头食品的净重补充外,剩余的均未能很好地利用,但其与鱼肉一样富含蛋白质和不饱和脂肪酸。目前,一部分金枪鱼碎肉凝胶化形成凝胶,生产鱼丸、鱼香肠、鱼松等鱼糜制品[2],另一部分金枪鱼碎肉组织重组化,黏结成型后制成新型鱼肉加工制品[3]。为了改善肉类和肉制品的营养和功能特性,大豆分离蛋白作为非肉蛋白添加剂已被广泛用于肉类加工业中[4]。
一些研究报道,天然大豆分离蛋白(N-SPI)对肉类蛋白质(如猪肉、牛肉、鸡肉和鱼肉)的凝胶性质有不利的影响[5-7],这是因为大豆分离蛋白和肉类蛋白之间的相互作用差。因此,改变大豆蛋白的天然结构是有必要的。加热是处理大豆蛋白常用的方法,该处理方式引起蛋白质分子结构松散,内部的疏水基团随之暴露出来并且使得展开的分子发生聚集,并引起蛋白中许多理想的物理化学变化,例如变性(展开),亚基的离解,活性基团的结合以及促进凝胶形成的聚集作用[8-9],从而影响大豆蛋白的功能性质。JIANG等[7]研究了极端pH处理大豆分离蛋白对猪肉肌原纤维蛋白凝胶中结构的影响,WANG等[15]报道了猪肉肌原纤维蛋白与热诱导大豆分离蛋白相互作用对凝胶特性的影响,但对改性大豆蛋白与鱼肉之间相互作用的研究机理研究甚少。
本实验以大豆分离蛋白为原料,经过60、80和95 ℃热处理,研究不同热处理后的大豆分离蛋白(soybean protein isolate, SPI)与金枪鱼肌原纤维蛋白(myofibrillar protein, MP)复合凝胶特性,实现动植物蛋白之间的平衡协调,从而为生产加工产品提供理论基础。
金枪鱼碎鱼肉,购于浙江大洋世家股份有限公司,分别称取5.0 g金枪鱼碎鱼肉用聚乙烯自封带密封好,冻藏于-60 ℃超低温冰箱中,实验前取出样品放置于4 ℃低温培养箱解冻至中心温度-5 ℃时取样,大豆分离蛋白,购于山东万得福生物科技有限公司;哌嗪-1,4-二乙磺酸(PIPES),购于国药集团化学试剂有限公司。
LRH-100CL型低温培养箱,上海一恒科技仪器有限公司;GL-20B高速冷冻离心机,上海安亭科学仪器厂;MCR301流变仪,奥地利安东帕公司;D-130电动匀浆机,Wiggens有限公司;UV1100型紫外分光光度计,广州罡然机电设备有限公司;SG2-ELK研究用酸度计,梅特勒-托利多公司;FA2004 型电子分析天平,南京东迈科技仪器有限公司;AL104-IC型分析天平,梅特勒-托利多国际贸易(上海)有限公司。
通过溶解10 g的SPI水溶液质量浓度为50 g/L制备蛋白质溶液,并将该溶液调节至pH=7.0。通过在60、80和95 ℃下搅拌加热溶解的蛋白质溶液30 min。 热处理后,将样品在10 000 r/min离心30 min 以除去不溶部分,然后冷冻干燥24 h[7]。
肌原纤维蛋白的提取参考KATOH等[10]并作适当的修改。准确称取5.0 g鱼肉,加40 mL 40 mmol/L Tris-Maleat缓冲液(内含0.16 mol/L KCl,20% TritonX-100,pH 7.5),均质(12 000 r/min,每次20 s,间隔10 s,重复4次),离心(4 ℃,5 000 r/min,10 min)除上清液,继续加40 mL 40 mmol/L Tris-Maleat缓冲液(内含0.16 mol/L KCl,pH 7.5)清洗沉淀。均质-离心重复2次,用4倍体积0.1 mol/L NaCl溶液清洗沉淀,离心弃上清液用8倍体积的0.1 mol/L NaCl清洗沉淀,纱布过滤,滤液离心,沉淀即为肌原纤维蛋白样品,4 ℃下冷藏备用。
双缩脲法测定肌源蛋白的浓度[11]。
将MP溶解在0.6 mol/L NaCl和50 mmol/L PIPES(pH 6.25)中,天然或热处理(60,80和95 ℃)SPI加入到MP溶液形成MP-SPI(质量比为3∶1,最终蛋白质量浓度45 g/L)复合蛋白质溶液。将蛋白质溶液在80 ℃的恒温水浴中加热30 min形成MP-SPI复合凝胶。
取一定量的MP和SPI混合蛋白溶液,置于安东帕流变仪的载物台与圆形平板(直径为4 cm)之间,用液体硅油密封样品以免水分蒸发影响测定结果。对复合蛋白进行温度扫描,测定的主要参数是:剪切频率为0.1 Hz,剪切应变0.02,狭缝为1 mm,扫描温度为20~80 ℃,升温速率为1.5 ℃/min。
在SALVADOR[12]的基础上测量了凝胶的持水能力(water holding capacity, WHC),并进行了一些修改。将凝胶在4 ℃下以5 000 r/min离心10 min。WHC按式(1)计算。
![]()
(1)
将制备的复合蛋白凝胶在4 ℃下放置12 h,采用TA-XT Plus质构仪测定凝胶样品的质构特性。实验前,将样品在室温下平衡1 h。使用的质量参数为:探针P/0.5,压缩距离:5 mm,测前速度:1.0 mm/s,测后速度:1.0 mm/s,施加力:5 g,数据采集速率:200 pps。硬度(hardness):第一次压缩所需的峰值力(N)。黏性(cohesiveness):第二次压缩曲线下完成的有效功与第一次压缩曲线下完成的有功功率效功之比(无量纲)。弹性(springiness):第一次压缩后样品恢复的距离(mm)。咀嚼性(chewiness):硬度×黏性×弹性(Hd×Ch×Sp) (N·mm)。
1.10 化学力的测定[13]
为了确定复合凝胶的化学力,取2.0 g凝胶样品与18 mL溶解溶液均质30 s。溶解液为:8 mol/L尿素,50 mmol/L磷酸钠(pH 7.0)(检测氢键);0.5% SDS,50 mmol/L磷酸钠(pH 7.0)(检测总非共价力);0.25% β-巯基乙醇,50 mmol/L磷酸钠(pH 7.0)(检测二硫键)。将混合溶液在80 ℃加热30 min,冷却至室温,然后以5 000 r/min离心15 min。用不同溶解缓冲液处理后提取蛋白质的量来表示凝胶中的主要作用力。
1.11 SDS-PAGE凝胶电泳
参照NIU[14]的不连续电泳方法,将1 mL的样品溶液与等体积的含有100 mmol/L Tris-HCl(20%甘油,4% SDS,0.2%溴酚蓝,3% DTT,pH 6.8)混合,将混合物煮沸3 min以完全溶解蛋白质,在室温下冷却,然后用4%浓缩胶,4%~15%分离胶,进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)。
1.12 数据处理
所有试验均平行重复3次,实验结果以“平均值±标准差”表示,数据统计分析采用SPSS 18.0软件对数据进行ANOVA差异显著性差异,P <0.05为显著性差异。采用Excel软件进行图表制作。
如图1所示,复合蛋白溶液的G′(弹性模量)在20 ℃至80 ℃加热过程中分成3个阶段,42.8 ℃之前,凝胶预备区(gel setting);42.8~46.3 ℃,凝胶弱化区(gel weakening);46.3~80 ℃,凝胶加强区(gel strengthening)[15-16]。G′在35.2 ℃之前缓慢增加,在约35.2 ℃后开始显著增加,此时肌球蛋白结构发生变化,导致肌球蛋白长丝的交联。G′在42.8 ℃时达到最大值。进一步加热后,G′值显著下降,这是因为轻酶解肌球蛋白轻链开始变性,部分肽链解螺旋,增加了蛋白的黏性,同时不同程度上破坏了蛋白的网络结构[17]。46.3 ℃时G′回落到最小值并迅速上升,是由于共价二硫键和疏水相互作用而形成永久的、不可逆交联的长丝和稳定的三维网络结构[18]。肌球蛋白重大的结构性转变已经发生,弹性在黏弹性体系中占主导地位。
由图1可知,MP-N-SPI的储能模量比单纯MP低,可能是N-SPI加入MP对凝胶有不好的影响,由于对肌球蛋白相互作用的干扰,具有紧密结构的天然SPI对MP凝胶化具有不利影响[19],这PETRUCCELLI等[20-21]的结果相一致。JIANG等[13]报道,高浓度的初始SPI对MP凝胶化有不利影响。SUN等[22]也推测,非肉类蛋白质在加热过程中减少了肌球蛋白重链的聚集,导致凝胶减弱效应。预热SPI与MP复合凝胶的储能模量都比MP-N-SPI高,说明加热打开SPI内部结构,与MP复合后相互作用,改善了复合蛋白的凝胶性。其中MP-SPI(80 ℃) 的储能模量有显著提升,这可能是加热可导致天然蛋白质的解折叠和掩埋的极性基团的暴露,增强了SPI与肌球蛋白重链之间的疏水相互作用,热处理SPI中反应性侧链基团促进了MP和SPI蛋白质的相互作用,导致更强和更有弹性的最终凝胶结构。
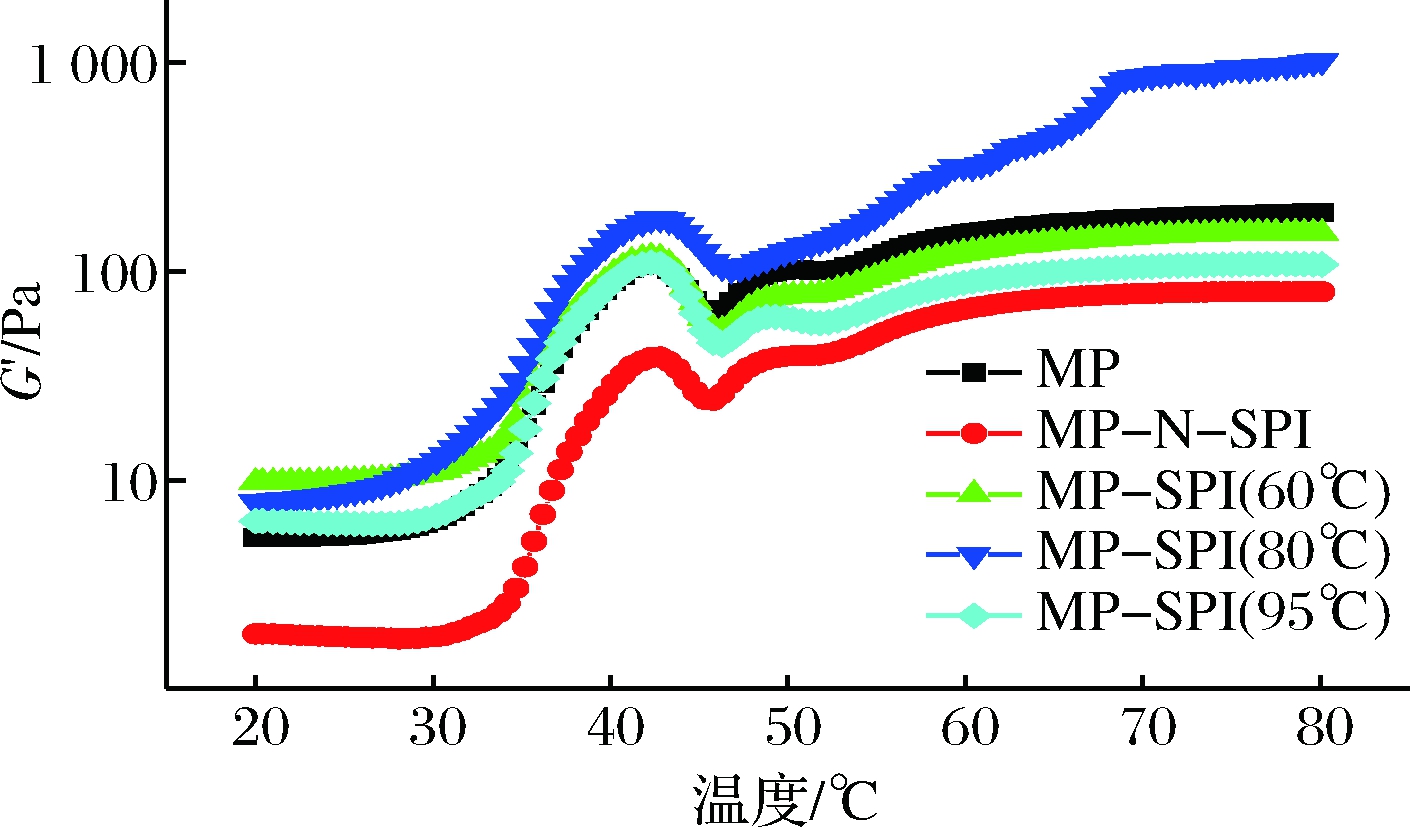
图1 复合蛋白的流变性
Fig.1 Rheological properties of complex proteins
凝胶形成过程中会形成三维网状结构,水将被捕获在网状结构中,持水力(WHC)是肉品质一项重要的性质,表明蛋白质结合水的能力,通常用于评估肉类及其产品的质量和产量。如图2所示,相对于单纯MP,复合凝胶的持水力都有显著提升,其中MP-SPI(80 ℃)混合凝胶持水力比单纯MP凝胶增加了52.79%, 这可能是由于加热可导致天然蛋白质的解折叠和掩埋的极性基团的暴露,通过疏水缔合增强蛋白质-蛋白质相互作用,适度的疏水相互作用有利于凝胶基质的形成[23],并且形成的基质具有更强的捕获水的能力。但是在MP-SPI(95 ℃)凝胶中,持水力相对于MP-SPI(80 ℃)有所降低,可能是由于温度升高,7 s和11 s两种球蛋白同时变性后,其亚基之间发生了聚集[24],聚集可以减少蛋白质的表面面积和极性氨基酸对水结合的有效性,从而持水力下降。
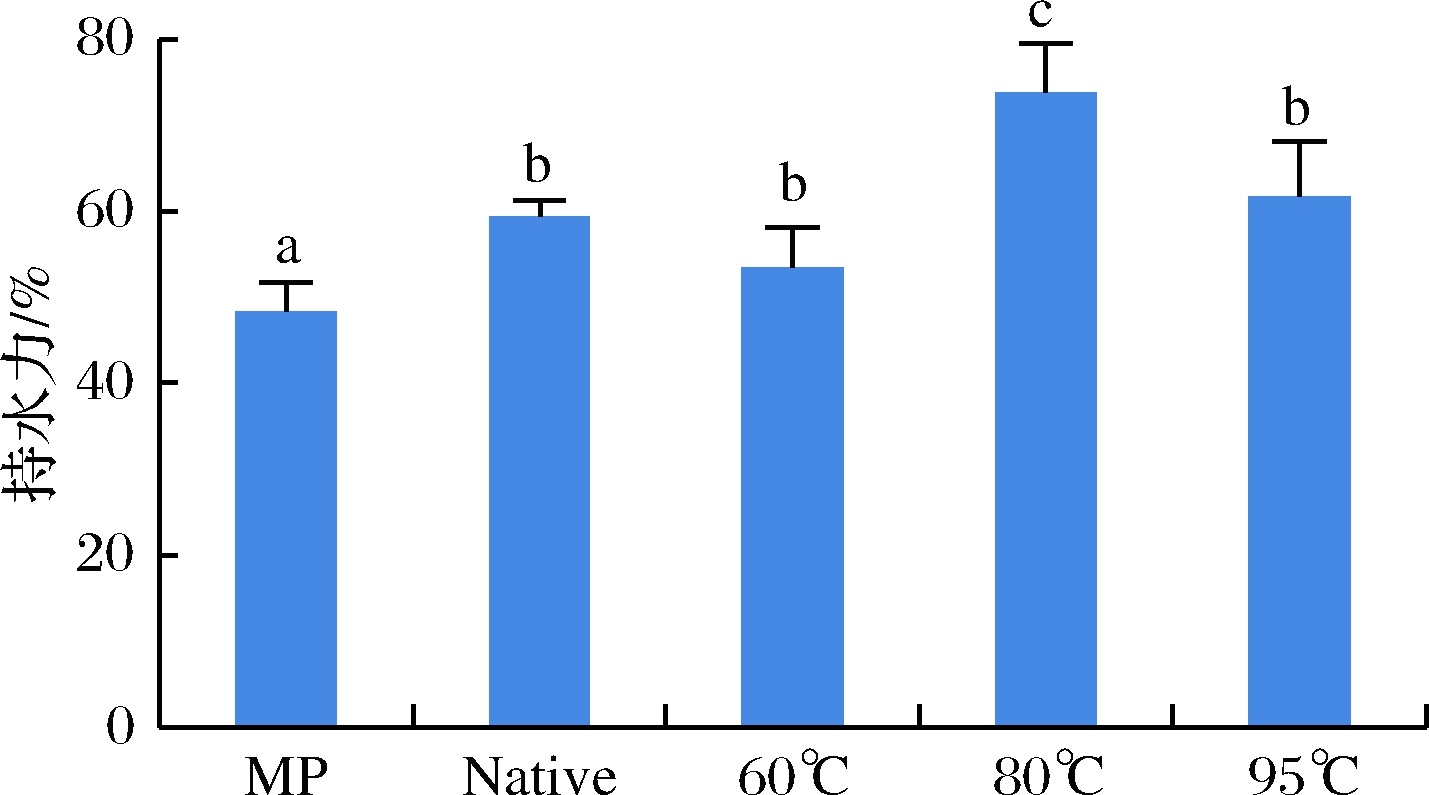
MP-单纯MP;Native-MP-N-SPI;60 ℃-MP-SPI(60 ℃); 80 ℃-MP-SPI(80 ℃);95 ℃-MP-SPI(95 ℃)图2 复合蛋白凝胶持水力的测定
Fig.2 Determination of water holding capacity of composite protein gel
注:不同小写字母表示差异显著。
质构特性是凝胶的一个重要特性,决定了凝胶的品质。通过TPA获得复合凝胶的4个参数:硬度,弹性,咀嚼性和凝聚性。表1显示了复合凝胶的TPA结果。
表1 复合蛋白凝胶的质构特性差异
Table 1 Differences in texture properties of composite protein gels
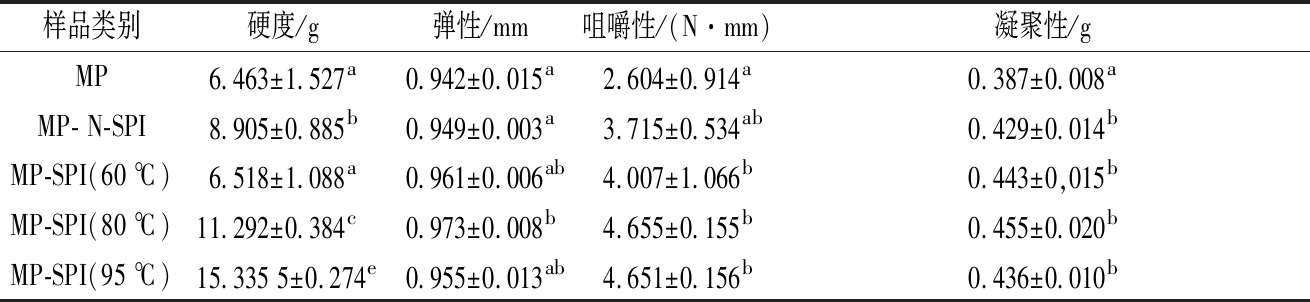
注:同列数据中右上标字母相同者,表示差异不显著(P >0.05)。
根据表1结果计算得知,相对于单纯MP,MP-N-SPI的硬度增加了37.78%,凝聚性增加了10.85%。相对于N-SPI-MP,MP-SPI(95 ℃)和MP-SPI(80 ℃)中硬度显著增加,分别是72.21%和26.80%(P <0.05)。 咀嚼性也显著改善,分别增加了25.19%和25.3%。这可能是由于热诱导引起SPI表面疏水性增加,增强了SPI与肌球蛋白重链之间的疏水相互作用,形成了刚性、弹性稳定的网络结构,从而提高了复合凝胶蛋白的硬度和弹性。然而,MP-SPI(60 ℃)样品在硬度或弹性方面没有显着改善。对于这种现象的合理解释是SPI在60 ℃下加热,由于其结构紧凑,阻碍其与肌球蛋白之间的相互作用,对MP凝胶化具有不利影响[15]。MP-SPI(95 ℃)在硬度和弹性方面显著提升,可能是因为大豆分离蛋白中球蛋白的酸性和碱性亚基在95 ℃解离,解离的碱性亚基可通过疏水相互作用与肌球蛋白相互作用,从而提高了硬度和弹性[7]。
与含有不同破坏剂的溶解溶液混合后,测定MP-SPI复合凝胶蛋白质的溶解度,鉴定凝胶之间的相互作用以及可能产生的物理化学键变化。图3显示,当凝胶与8 mol/L尿素混合时,其破坏分子之间的氢键,用尿素处理的预热SPI和MP复合凝胶的蛋白质溶解度低于MP-N-SPI,用尿素处理的预热SPI和MP复合凝胶的蛋白质溶解度随着处理温度的升高而降低,可能是蛋白质加热到其变性温度以上会导致蛋白质中的三级和氢键结构的完全破坏[25],导致蛋白质溶解度降低,结果表明,氢键不是复合凝胶结构中的主要贡献作用。

MP-单纯MP;Native-MP-N-SPI;60 ℃-MP-SPI (60 ℃), 80 ℃-MP-SPI(80 ℃);95 ℃-MP-SPI(95 ℃)图3 复合蛋白凝胶化学力的测定
Fig.3 Determination of chemical strength of complex protein gel
注:同一颜色的柱状图,字母上标相同者,表示差异不显著(P>0.05)。
当凝胶溶解在0.5% SDS溶液中,MP-SPI(80 ℃)和MP-SPI(95 ℃)的蛋白溶解性显著提高,可能是疏水残基对混合凝胶中处理的SPI有积极作用,说明疏水相互作用在稳定蛋白质的结构中起重要作用,而MP-N-SPI和MP-SPI(60 ℃)的蛋白质溶解度却低于80 ℃和95 ℃预热处理的复合蛋白凝胶,这可能是由于消耗了大部分SDS用于解开紧凑的SPI结构,而不是松散凝胶网络中的疏水缔合作用[15]。随着SPI预热温度的升高,混合凝胶蛋白的溶解性增加,说明加热导致天然蛋白质的解折叠和掩埋的极性基团的暴露,从而进一步增强SPI和MP之间的相互作用。另一方面,用β-巯基(β-ME)处理复合凝胶,用来说明二硫键的作用,结果显示,在MP-SPI(60 ℃)、MP-SPI(80 ℃)和MP-N-SPI复合凝胶的蛋白质溶解度没有实质差异,MP-SPI(95 ℃)的蛋白质溶解度降低,这表明二硫键不是负责增强复合凝胶强度的主要化学力。本实验研究表明预热大豆蛋白与MP的凝胶网络形成主要是疏水相互作用的结果,而KANE等[26]研究表明豆科蛋白的网络形成与氢键和疏水相互作用密切相关。
离心是消除MP凝胶基质中非贡献蛋白质的有效方法。通过离心可以除去凝胶中的弱结合以及非结合类的蛋白,离心后上清液中的这些弱结合蛋白可以通过SDS-PAGE容易地鉴定。由图4可以看出,所有蛋白中都含有肌钙蛋白(troponin-T)和原肌球蛋白(tropomyosin)的条带,说明它们不是主要参与复合凝胶蛋白的形成,肌球蛋白重链(myosin heavy chain,MHC)和肌动蛋白(actin)消失,表明MHC和肌动蛋白主要参与凝胶网络结构的形成。而对于MP-N-SPI混合凝胶,与单纯MP凝胶没有明显的区别,JIANG和XIONG等[15]指出,这种现象主要是由于N-SPI亚基没有参与MP-N-SPI复合凝胶的形成。相对于MP-N-SPI,MP-SPI(60 ℃)的条带变窄,可能是由于预热的大豆分离蛋白与MP之间发生交联。而MP-SPI(80 ℃)和MP-SPI(95 ℃)的肌钙蛋白和原肌球蛋白条带相对于MP-N-SPI,MP-SPI(60 ℃)变浅,可能是于部分肌钙蛋白和原肌球蛋白参与预热SPI凝胶网络结构的形成,所以离心上清液中检测出的条带比较浅。
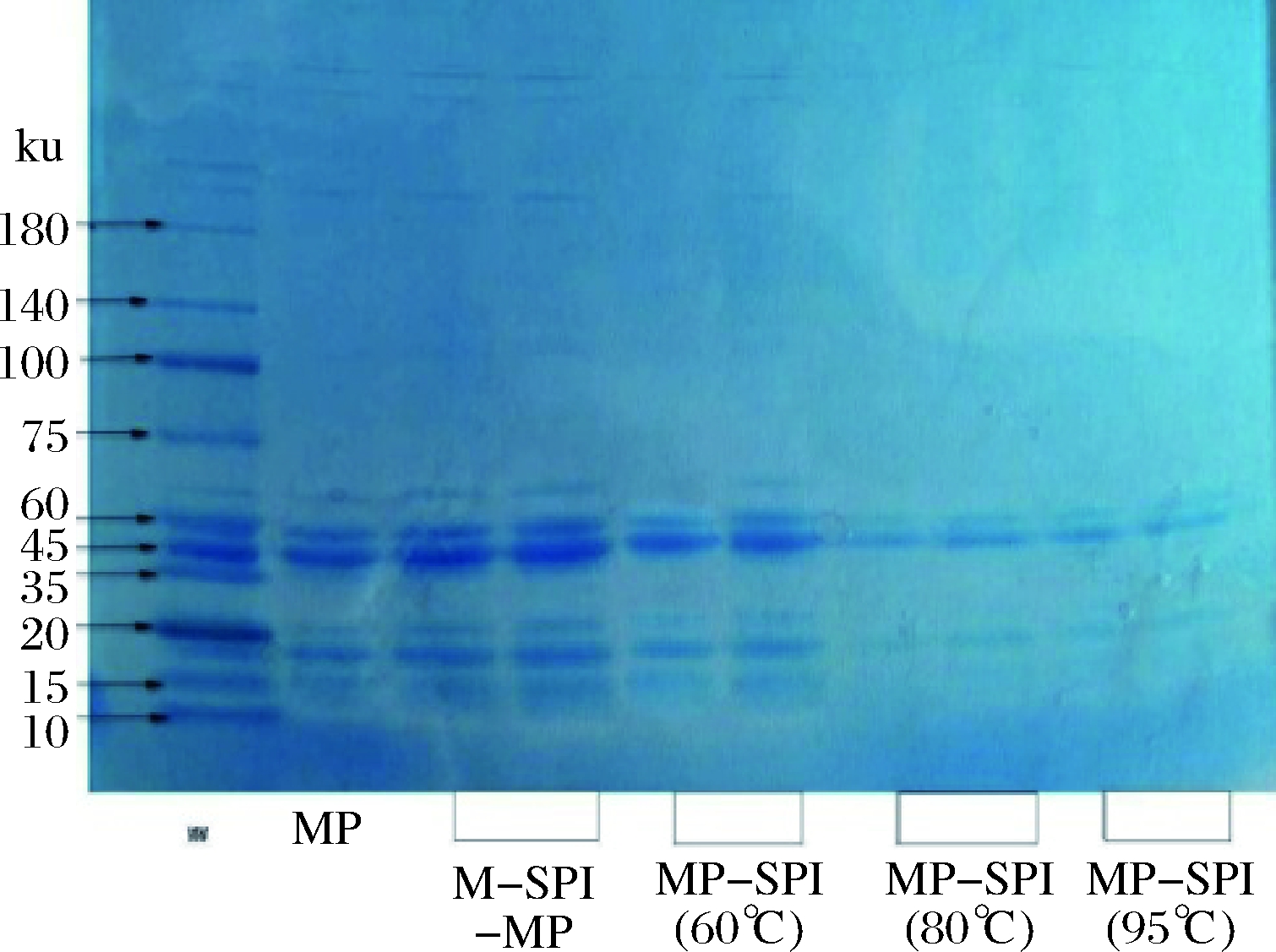
图4 复合蛋白凝胶的电泳条带图
Fig.4 Electrophoresis band diagram of composite protein gel
本实验通过预热处理SPI加入到MP中,研究了SPI-MP复合蛋白之间的流变特性、持水力、质构特性、化学力等性质。结果表明,预热SPI(80 ℃、95 ℃)可以显著增强MP和SPI之间的相互作用,改善复合凝胶的凝胶特性。由SDS-PAGE可以发现,MP-N-SPI与单纯MP条带无明显差别,同时动态流变学的结果显示,MP-N-SPI的储能模量低于单纯MP,不利于复合凝胶的形成。疏水相互作用是形成复合凝胶的主要化学力,而MP-N-SPI和MP-SPI(60 ℃)与80 ℃和95 ℃预热处理的复合蛋白凝胶有显著性差异,MP-SPI(80 ℃)显著提高了混合凝胶的持水性(P<0.05),储能模量值(G′)(P<0.05)显著提升,但是MP-SPI(95 ℃) 的硬度和咀嚼性比较好。可以根据实际生产需要,选择合适的预处理温度。实现动植物蛋白之间的优化。
参考文献
[1] 方健民,黄富雄,郑钟新等.金枪鱼的营养价值和加工利用[J]. 水产科技, 2006 (2):16-32.
[2] 李萌立,杨梦昕,李忠海,等.加工方式对鱼糜凝胶性质影响研究进展[J]. 食品工业科技, 2015, 36(8):370-373.
[3] 王新萍. 金枪鱼碎肉的酶解与产物改性利用研究[D]. 浙江工业大学, 2013.
[4] FENG J, XIONG Y L. Interaction of myofibrillar and preheated soy proteins[J]. Journal of Food Science, 2002, 67(8): 2 851-2 856.
[5] PETRUCCELLI S, A
 N M C. Relationship between the method of obtention and the structural and functional properties of soy proteins isolates. 1. Structural and hydration properties[J]. Journal of Agricultural and Food Chemistry, 1994, 42(10): 2 161-2 169.
N M C. Relationship between the method of obtention and the structural and functional properties of soy proteins isolates. 1. Structural and hydration properties[J]. Journal of Agricultural and Food Chemistry, 1994, 42(10): 2 161-2 169.
[6] SCILINGO A A, A
 N M C. Calorimetric study of soybean protein isolates: effect of calcium and thermal treatments[J]. Journal of agricultural and food chemistry, 1996, 44(Agric. Food Chem,1996,44(11):3 484-3 488.
N M C. Calorimetric study of soybean protein isolates: effect of calcium and thermal treatments[J]. Journal of agricultural and food chemistry, 1996, 44(Agric. Food Chem,1996,44(11):3 484-3 488.
[7] WANG Z, LIANG J, JIANG L, et al. Effect of the interaction between myofibrillar protein and heat-induced soy protein isolates on gel properties[J]. CyTA-Journal of Food, 2015, 13(4): 527-534.
[8] 李艳青. 鲢鱼组织蛋白酶活性及提高鱼糜凝胶特性方法的研究[D]. 哈尔滨:东北农业大学,2004.
[9] WOLF W J. Soybean proteins. Their functional, chemical, and physical properties[J]. Journal of Agricultural and Food Chemistry, 1970, 18(6): 969-976.
[10] KATOH N. A new method for evaluation of the quality of frozen surimi from Alaska pollack: Relationship between myofibrillar ATPase activity and kamaboko forming ability of frozen surimi[J]. Nippon Suisan Gakkaishi, 1979, 45: 1 027-1 032.
[11] GORNALL A G, BARDAWILL C J, DAVID M M. Determination of serum proteins by means of the biuret reaction[J]. Journal of biological chemistry, 1949, 177(2): 751-766.
[12] SALVADOR P, TOLDR M, SAGUER E, et al. Microstructure-function relationships of heat-induced gels of porcine haemoglobin[J]. Food Hydrocolloids, 2009, 23(7):1 654-1 659.
M, SAGUER E, et al. Microstructure-function relationships of heat-induced gels of porcine haemoglobin[J]. Food Hydrocolloids, 2009, 23(7):1 654-1 659.
[13] JIANG J, XIONG Y L. Extreme pH treatments enhance the structure-reinforcement role of soy protein isolate and its emulsions in pork myofibrillar protein gels in the presence of microbial transglutaminase.[J]. Meat Science, 2013, 93(3):469-476.
[14] NIU H, LI Y, HAN J, et al. Gelation and rheological properties of myofibrillar proteins influenced by the addition of soybean protein isolates subjected to an acidic pH treatment combined with a mild heating[J]. Food Hydrocolloids, 2017, 70.
[15] VISESSANGUAN W, OGAWA M, NAKAI S, et al. Physicochemical changes and mechanism of heat-induced gelation of arrowtooth flounder myosin[J]. Journal of Agricultural & Food Chemistry, 2000, 48(4):1 016-1 023.
[16] 于巍, 周坚. 鱼类肌原纤维蛋白热凝及流变特性研究进展[J]. 食品科技, 2007, 32(11):14-16.
[17] BRENNER T, JOHANNSSON R, NICOLAI T. Characterisation and thermo-reversible gelation of cod muscle protein isolates[J]. Food Chemistry, 2009, 115(1):26-31.
[18] LIU Q, BAO H, XI C, et al. Rheological characterization of tuna myofibrillar protein in linear and nonlinear viscoelastic regions[J]. Journal of Food Engineering, 2014, 121(1):58-63.
[19] RAM REZ-SU
REZ-SU REZ J C, XIONG Y L. Effect of transglutaminase-induced cross-linking on gelation of myofibrillar/soy protein mixtures[J]. Meat Science, 2003, 65(2):899-907.
REZ J C, XIONG Y L. Effect of transglutaminase-induced cross-linking on gelation of myofibrillar/soy protein mixtures[J]. Meat Science, 2003, 65(2):899-907.
[20] PETRUCCELLI S, A
 N M C. Relationship between the method of obtention and the structural and functional properties of soy proteins isolates. 1. Structural and hydration properties[J]. Journal of Agricultural and Food Chemistry, 1994, 42(10): 2 161-2 169.
N M C. Relationship between the method of obtention and the structural and functional properties of soy proteins isolates. 1. Structural and hydration properties[J]. Journal of Agricultural and Food Chemistry, 1994, 42(10): 2 161-2 169.
[21] SCILINGO A A, A
 N M C. Calorimetric study of soybean protein isolates: Effect of calcium and thermal treatments[J]. Journal of Agricultural and Food Chemistry, 1996, 44(11):3 484-3 488.
N M C. Calorimetric study of soybean protein isolates: Effect of calcium and thermal treatments[J]. Journal of Agricultural and Food Chemistry, 1996, 44(11):3 484-3 488.
[22] SUN X D, ARNTFIELD S D. Molecular forces involved in heat-induced pea protein gelation: Effects of various reagents on the rheological properties of salt-extracted pea protein gels[J]. Food Hydrocolloids, 2012, 28(2):325-332.
[23] LIU R, ZHAO S M, XIE B J, et al. Contribution of protein conformation and intermolecular bonds to fish and pork gelation properties[J]. Food Hydrocolloids, 2011, 25(5):898-906.
[24] 郭凤仙. 热处理对大豆分离蛋白结构及功能特性的影响[D]. 无锡:江南大学, 2009.
[25] HUANG X, CHEN L, FANG Y, et al. Interactions and gel strength of mixed myofibrillar with soy protein, 7S globulin and enzyme-hydrolyzed soy proteins[J]. European Food Research & Technology, 2010, 231(5):751-762.
[26] O′KANE F E, HAPPE R P, VEREIJKEN J M, et al. Heat-induced gelation of pea legumin: Comparison with soybean glycinin[J]. J Agric Food Chem, 2004, 52(16):5 071-5 078.
WU Yaqin1,WANG Lisha1,ZOU Mi1,BAO Hairong1,2,3*
1(College of Food Science and Technology,Shanghai Ocean University,Shanghai 201306,China) 2(ShanghaiEnigeering Research Center of Aguatic-Product Processing&Preservation,Shanghai 201306,China)3(Laboratory of Quality and Satefy Risk Assessment for Aguatic Products on Storage and Preservation(Shanghai),Ministry of Agricuture,Shanghai 201306,China)
ABSTRACT Soybean protein isolate (SPI) was treated at 60, 80, and 95 ℃, respectively, with fish myofibrillar protein (MP) in a ratio of 1∶3 (total protein concentration 45 g/L), to form a mixed protein gel by heat induction. The results showed that compared with natural soy protein isolate gel (MP-N-SPI), the storage modulus value (G′) of MP-SPI at 80 ℃ increased significantly (P<0.05), while the value was lower at 60 and 95 ℃. After adding SPI to MP, the water holding capacity (WHC) of the composite gel was higher than that of MP alone. A suitable heat-induced temperature of SPI (80 ℃) could significantly improve the WHC of the composite gel (P<0.05). Moreover, the hardness of MP-SPI at 95 ℃ significantly improved. The SDS-PAGE showed that there were no significant differences in bands between MP-N-SPI and MP alone. The bands of MP-SPI at 80 and 95 ℃ were lighter than MP-N-SPI and MP-SPI at 60 ℃, which indicated that pre-heated SPI at 80 or 95 ℃ was easy to interact with MP. Chemical force measurements showed that the gel network of preheated soy protein and MP mainly formed by hydrophobic interaction. In conclusion, a suitable heat-induced SPI can significantly improve the properties of the composite gel.
Key words soy protein isolate;fish myofibrillar protein;gel properties; chemical power