鲜婷婷1,2,韩小敏2,韩春卉2,李凤琴2,徐文静2,张宏元2,屠康1*
1(南京农业大学 食品科技学院,江苏 南京 210095) 2(国家食品安全风险评估中心国家卫生健康委员会食品安全风险评估重点实验室,北京 100021)
摘 要 探讨T-2毒素对人肾小管上皮细胞HK-2体外增殖和凋亡的影响。将体外培养的HK-2细胞,经不同浓度的T-2毒素作用72 h后,分别测定T-2毒素对HK-2细胞增殖抑制率、细胞形态、DNA片段化、细胞凋亡率、细胞周期分布和caspase-3活性的影响。结果表明,T-2 毒素对HK-2细胞具有增殖抑制作用,抑制率随浓度升高而增大,IC50值为49.34 nmol/L。T-2毒素在10~40 nmol/L可剂量依赖性的诱导HK-2细胞凋亡,且20 nmol/L下HK-2细胞即可出现染色质固缩等凋亡细胞的典型特征。同时,10~40 nmol/L,T-2毒素可通过引起G2/M期阻滞影响细胞的周期分布。此外,T-2毒素在10~40 nmol/L下可引起caspase-3活性剂量依赖性增强,与对照组相比,最大可提高1.93倍(P<0.05)。因此,该研究为阐明T-2毒素的肾脏毒性作用机制提供了理论依据。
关键词 T-2毒素;人肾小管上皮细胞HK-2;体外细胞增殖;细胞凋亡
第一作者:硕士研究生(屠康教授为通讯作者,E-mail:kangtu@njau.edu.cn)。
基金项目:生物安全重点研发计划(2017YFC1200901)
收稿日期:2018-12-21, 改回日期:2019-02-21
DOI:10.13995/j.cnki.11-1802/ts.019705
T-2毒素是由三线镰刀菌(Fusarium tricinctum)、拟枝饱镰刀菌(F. sporotrichioides)、梨孢镰刀菌(F. poae)和雪腐镰刀菌(F. nivale)等多种镰刀菌在特定条件下代谢产生的单端孢霉烯族化合物,具有毒性强、化学性质稳定、热及酸性条件下不易被破坏的特点[1-4]。T-2毒素广泛分布于自然界,可污染农作物和储藏的谷物等,摄入被T-2毒素污染的谷物将严重影响动物和人类的健康。研究表明,T-2毒素可对人和动物的多个组织器官包括血液、消化系统、免疫系统等产生毒性效应[5]。本实验室前期动物实验表明,T-2毒素对Wistar大鼠肾脏具有明显损伤作用,T-2毒素灌胃后有尿血症状出现,病理切片检查可见肾小管上皮细胞肿胀(该部分结果尚未发表)。王丽华等[6]也发现低剂量T-2毒素在短时间内可对肾脏造成损害,可引起肾近曲小管上皮细胞嗜酸性变和坏死、细胞核固缩,细胞器减少、基膜明显增厚和部分线粒体髓样变等。HK-2细胞是一种永生化的人肾小管上皮细胞,是研究肾毒性常用的细胞模型,目前尚未见到T-2毒素对HK-2细胞毒性作用的研究,因此,本研究以体外培养的HK-2细胞为模型,探讨不同浓度的T-2毒素对HK-2细胞增殖抑制、凋亡和周期分布等的影响,为阐明T-2毒素肾脏毒性作用机制提供理论依据。
HK-2细胞,购自中国科学院典型培养物保藏委员会昆明细胞库。
T-2毒素(纯度>98%),青岛普瑞邦生物工程有限公司;二甲基亚砜,德国Applichem公司;DMEM培养基、胎牛血清、胰酶、青霉素链霉素溶液,美国Gibco公司;CCK-8试剂盒,东仁化学科技(上海)有限公司;Hoechst 33258染色试剂盒、DNA Ladder抽提试剂盒、膜联蛋白V-异硫氰酸荧光素/碘化丙啶(Annexin V-FITC/PI)细胞凋亡检测试剂盒、碘化丙啶(PI)细胞周期检测试剂盒、Bradford蛋白浓度测定试剂盒、caspase-3活性检测试剂盒,上海碧云天生物技术有限公司。
CO2培养箱,美国Thermo Fisher Scientific公司;BD FACSVerse流式细胞仪,美国BD公司;酶标仪,美国BioTek公司;倒置显微镜,日本Olympus公司;荧光倒置显微镜,德国Zeiss公司;高速冷冻离心机,日本HITACHI公司;Gel Doc XR凝胶成像仪,美国Bio-Rad公司;万分之一天平,瑞士METTLER TOLEDO公司。
1.3.1 10 mmol/L T-2毒素储备液的制备
准确称取0.010 g T-2毒素固体粉末,加入2 143.0 μL DMSO充分溶解后,置-20 ℃避光保存,备用。
1.3.2 HK-2细胞的培养
HK-2细胞常规培养于含10%(体积分数)胎牛血清和1%(体积分数)青霉素链霉素溶液的DMEM培养基中,置于含5% CO2的37 ℃培养箱。待细胞生长至对数生长期(80%~90%汇合度)时,胰酶消化传代并进行后续实验。
1.3.3 T-2毒素对HK-2细胞增殖抑制率的影响
取对数期生长良好的HK-2细胞,用含EDTA的胰酶消化,加入培养液调整细胞悬液浓度为2×104个/mL,按4×103个/孔接种于96孔培养板,每孔200 μL。取T-2毒素储备液,用培养液分别配制终浓度为2.0、5.0、10.0、20.0、50.0、100、250和500 nmol/L的毒素溶液,备用。待细胞过夜贴壁后弃去培养液,处理组每孔加入200 μL上述毒素溶液,对照组(含细胞)和空白组(不含细胞)加入200 μL培养液,每组设3个平行孔。培养箱中培养72 h后,每孔加入20 μL CCK-8溶液,培养箱内继续孵育1.5 h后,用酶标仪测定450 nm处的吸光度值(A),用公式(1)计算细胞的增殖抑制率。
细胞增殖抑制率![]()
(1)
式中,At为处理组的吸光度;Ab为空白组的吸光度;Ac为对照组的吸光度。
以细胞增殖抑制率为纵坐标,T-2毒素浓度的对数值为横坐标,用Graphpad prism 6.0拟合曲线并获得HK-2细胞半数抑制浓度(50% concentration of inhibition,IC50)。
1.3.4 T-2毒素对HK-2细胞形态的影响
取对数期生长良好的HK-2细胞,用含EDTA的胰酶消化,加入培养液调整细胞悬液浓度为4×104个/mL,按8×104个/孔接种于6孔培养板,每孔加入1 mL培养液和2 mL细胞悬液。取T-2毒素储备液,稀释至浓度为20.0 nmol/L,备用。待细胞过夜贴壁后弃去培养液,处理组每孔加入3 mL上述毒素溶液,对照组加入3 mL培养液,每组设2个平行孔。置培养箱中培养72 h后,吸除培养液,加入0.5 mL固定液固定10 min后去除固定液,用PBS洗涤2次,加入0.5 mL Hoechst 33258染色液,避光染色5 min后置荧光倒置显微镜下观察细胞形态。
1.3.5 T-2毒素对HK-2细胞DNA片段化的影响
取对数期生长良好的HK-2细胞,处理同1.3.4。取T-2毒素储备液,用培养液分别配制终浓度为10.0、 20.0、30.0和40.0 nmol/L的毒素溶液,备用。待细胞过夜贴壁后弃去培养液,处理组每孔加入3 mL上述毒素溶液,对照组加入3 mL培养液,每组设2个平行孔。置培养箱中培养72 h后,吸除培养液至离心管,加入含EDTA的胰酶消化细胞,收集细胞,用PBS洗涤培养板,收集液体,1 000 r/min离心5 min,弃上清。PBS再次洗涤,离心弃上清,加入200 μL PBS重悬细胞。随后按照DNA Ladder试剂盒操作提取DNA,具体如下:加入4 μL RNase A,降解RNA;加入20 μL蛋白酶K,降解蛋白质;加入200 μL细胞裂解液,70 ℃水浴裂解细胞,释放DNA;加入200 μL无水乙醇,沉淀DNA。将全部液体转移至DNA纯化柱内离心,洗涤液洗涤纯化柱,除杂;加入洗脱液,溶解并洗脱DNA。将离心所得液体即纯化的DNA进行10 g/L琼脂糖凝胶电泳,DL15000+2000 marker作为对照,用凝胶成像仪拍照并观察分析。
1.3.6 T-2毒素对HK-2细胞凋亡率的影响
取对数期生长良好的HK-2细胞,用含EDTA的胰酶消化,加入培养液调整细胞悬液浓度为1×105个/mL,按2×105个/孔接种于6孔培养板,每孔加入1 mL培养液和2 mL细胞悬液。取T-2毒素储备液,用培养液分别配制终浓度为10.0、20.0、30.0和40.0 nmol /L 的毒素溶液,备用。待细胞过夜贴壁后弃去培养液,处理组每孔加入3 mL上述毒素溶液,对照组加入3 mL培养液,每组设2个平行孔。置培养箱中培养72 h后,吸除培养液至离心管,加入不含EDTA的胰酶消化细胞,收集细胞,用PBS洗涤培养板,收集液体,1 000 r/min离心5 min,弃上清。PBS再次洗涤,离心弃上清,加入195 μL Annexin V-FITC binding buffer重悬细胞,再加入5 μL Annexin V-FITC和10 μL PI染色液混匀,室温避光孵育10~20 min后用300目尼龙网过滤,1 h内用流式细胞仪上机进行检测并分析结果。
1.3.7 T-2毒素对HK-2细胞周期分布的影响
取对数期生长良好的HK-2细胞,处理同1.3.6。置培养箱中培养72 h后,吸除培养液至离心管,加入含EDTA的胰酶消化细胞,收集细胞,用PBS洗涤培养板,收集液体,1 000 r/min离心5 min,弃上清。用预冷的PBS重悬,再次离心弃上清。加入1 mL预冷的70%无水乙醇(体积分数)混匀,4 ℃固定过夜或-20 ℃固定1 h后,1 000 r/min离心5 min,弃上清,预冷的PBS重悬,再次离心弃上清。加入细胞周期检测试剂盒提供的0.5 mL染色缓冲液、25 μL PI染色液和10 μL RNase A混匀,37 ℃避光温浴30 min后用300目尼龙网过滤,流式细胞仪上机进行检测,采用ModFit LT软件分析结果。
1.3.8 T-2毒素对HK-2细胞caspase-3活性的影响
取对数期生长良好的HK-2细胞,细胞处理同1.3.6。 消化细胞后,4 ℃、600×g离心5 min,收集细胞,PBS重悬,离心弃上清。加入细胞裂解液,置于冰浴裂解15 min后,4 ℃、20 000×g离心15 min,将上清转移至冰浴预冷的干净离心管中。取5 μL加入预先加有250 μL考马斯亮蓝G250染色液的96孔板中,混匀,用酶标仪测定595 nm处吸光度值,通过标准曲线计算细胞的蛋白浓度。用裂解液调整样品蛋白质量浓度至1~3 g/L,取50 μL加入预先加有40 μL检测缓冲液的96孔板中,随后加入10 μL caspase-3反应底物,混匀,37 ℃温浴2 h,用酶标仪测定405 nm处吸光度值,通过标准曲线计算caspase-3活性。
每个实验重复3次。细胞增殖抑制率、细胞凋亡率及各细胞周期细胞比例均以(x±s)表示,数据采用SPSS 22.0软件进行统计分析。P<0.05为差异有统计学意义。
四氮唑盐比色法是目前应用较为广泛的一种检测细胞增殖活性的方法,它通过检测细胞的氧化还原活性快速检测细胞的增殖能力。CCK-8溶液中含有的水溶性四氮唑盐WST-8可被活细胞线粒体中的脱氢酶还原为具有高度水溶性的橙黄色甲瓒,在450 nm处产生较强的吸收峰,且生成的甲瓒数量和活细胞数目呈正比,而死细胞对四氮唑盐不具有此转化能力[7]。因此,测定细胞在450 nm处的吸光度值,可间接反映活细胞的数量,进而获得T-2毒素对细胞的增殖抑制率。将2.0、5.0、10.0、100、250和500 mmol/L T-2毒素浓度转移为以10为底浓度对数后,经Graphpad prism 6.0拟合后得到的HK-2细胞增殖抑制曲线如图1所示,20.0 nmol/L T-2毒素作用HK-2细胞72 h后即可抑制细胞增殖,抑制率为18.63%,与对照组相比差异显著(P<0.05),且细胞的抑制率随T-2毒素浓度的增大而上升,当浓度增大至250 nmol/L时,T-2毒素对HK-2细胞的抑制率可达84.32%。结果表明,T-2毒素在20~250 nmol/L可以明显抑制HK-2细胞的增殖,呈现剂量-效应关系。此外T-2毒素对HK-2细胞的IC50值为(49.34±1.33) nmol/L。因此,选取10.0、20.0、30.0和40.0 nmol /L作为T-2毒素作用浓度进行后续实验。
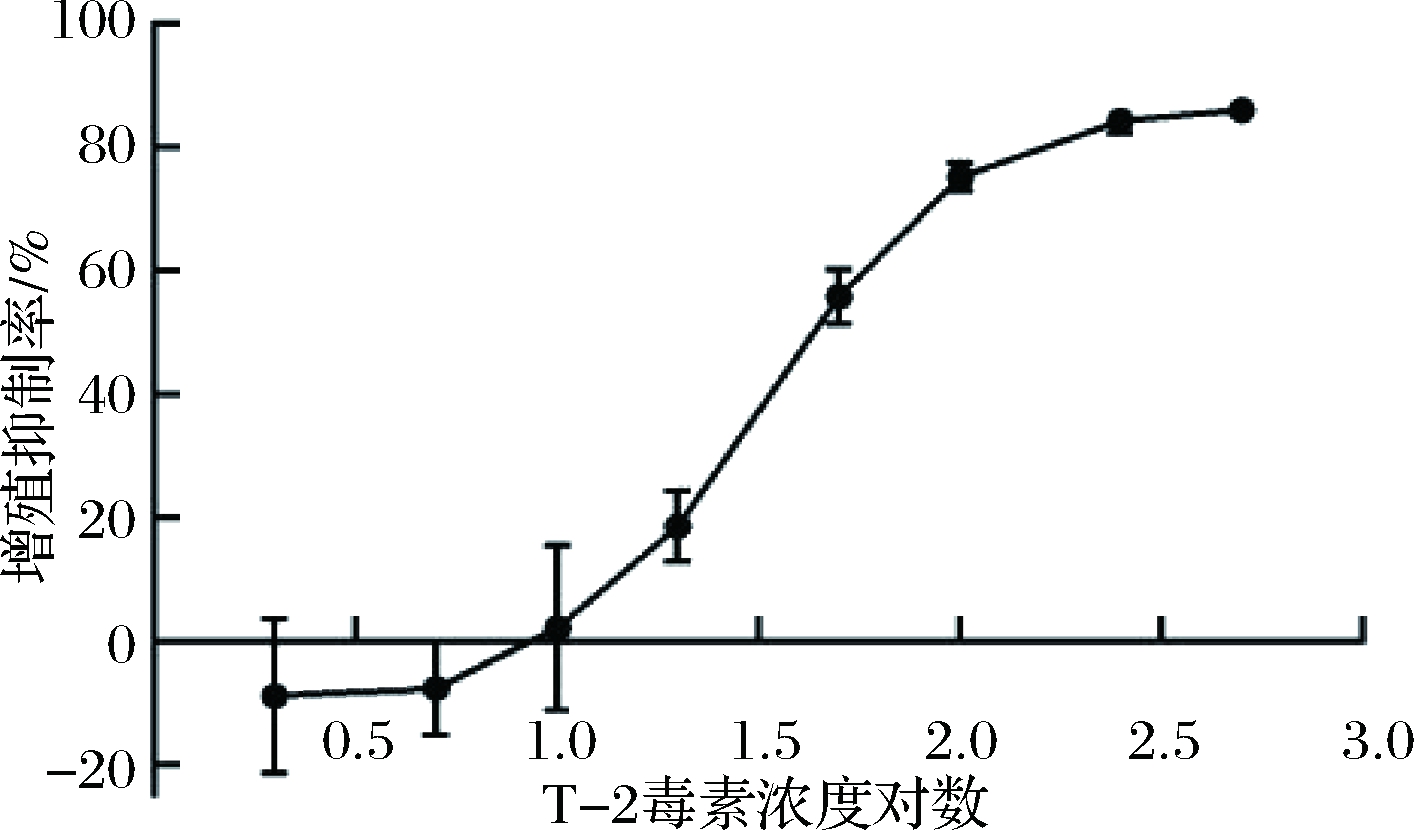
图1 HK-2细胞增殖抑制曲线
Fig.1 Proliferation inhibition curve of HK-2 cells
细胞凋亡具有典型的形态学特征,包括细胞体积缩小,结构更加紧密;染色质逐渐凝聚成新月状附于核膜周边;细胞核固缩呈均一的致密物;细胞膜出芽突起,随后形成大小不等的由胞膜包裹的凋亡小体等[8]。Hoechst 33258蓝色荧光染料可穿透细胞膜与细胞DNA双链中的小沟结合,使细胞核着色。正常细胞的细胞膜完好,通透性差,染色质分布均匀;而凋亡细胞的细胞膜通透性增强,染色质固缩。因此,经Hoechst 33258染色后,正常细胞的细胞核呈均匀淡蓝色弱荧光,凋亡细胞呈现强蓝色荧光[9]。实验发现,对照组HK-2细胞形态完整,边缘光滑,呈圆形或椭圆形,染色质分布均匀,细胞核染色颜色较浅(图2-A);20.0 nmol/L T-2毒素处理组细胞细胞核染色较深,染色质固缩,呈碎块状或新月体状的强蓝色荧光(图2-B)。

A-对照组;B-20.0 nmol/L
图2 HK-2细胞Hoechst 33258染色形态
Fig.2 The Hoechst 33258 staining morphology of HK-2 cells
细胞凋亡晚期染色质固缩,Ca2+/Mg2+依赖性的核酸内切酶的激活使得染色质DNA在核小体单位之间断裂,形成大小50~300 kb的DNA片段,进一步分解成约180~200 bp整数倍的寡核苷酸片段[10],用琼脂糖凝胶电泳检测可观察到梯形条带(DNA Ladder)出现。因此DNA片段化被认为是检测细胞晚期凋亡最直观便捷的方法[11]。实验发现,对照组和T-2毒素处理组细胞凝胶电泳均未见DNA Ladder出现,这说明10~40 nmol/L T-2毒素作用HK-2细胞72 h后未出现晚期凋亡或者晚期凋亡不明显。
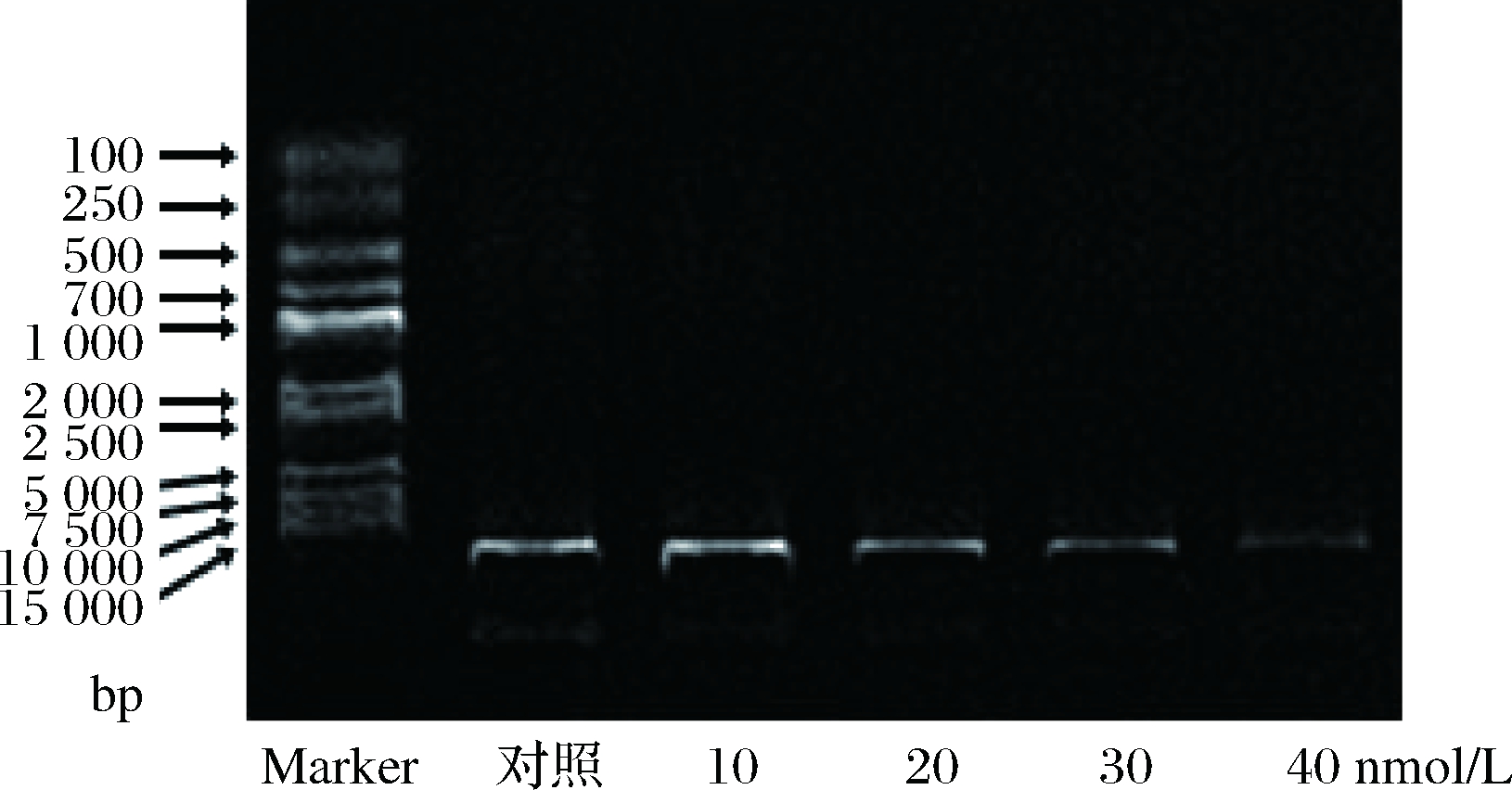
图3 T-2毒素对HK-2细胞DNA片段化的影响
Fig.3 Effect of T-2 toxin on DNA fragmentation of HK-2 cells
细胞膜内侧分布着磷脂酰丝氨酸(phosphatidylserine,PS),细胞凋亡早期,PS会从细胞膜内侧外翻,暴露于细胞膜外表面。而Annexin是一类分布于真核细胞浆内的磷脂结合蛋白,与PS具有高度亲和力,用绿色荧光探针FITC标记的Annexin V,即Annexin V-FITC就可检测凋亡细胞,结合PI可检测坏死细胞这一特征,就可区分凋亡细胞和坏死细胞。用流式细胞仪检测结果如图4所示,统计结果见表1。实验发现,与对照组相比,HK-2细胞经T-2毒素作用72 h后可使(3.84±1.61)%,(10.78±1.83)%,(17.28±7.19)%,(30.40±7.05)%的细胞出现早期凋亡,(3.85±1.46)%,(7.57±2.82)%,(4.84±1.76)%,(8.52±1.38)%的细胞出现晚期凋亡,处理组早期凋亡和晚期凋亡细胞的比例均高于对照组早期凋亡(2.17±0.12)%和晚期凋亡(3.55±0.82)%的比例。此外,不同浓度作用后总凋亡细胞的比例分别为7.69%,18.35%,22.12%和38.92%,均高于对照组总凋亡细胞比例5.72%,且总凋亡细胞比例随毒素浓度的增加而上升。由此可见,T-2毒素可诱导HK-2细胞凋亡,并呈剂量-效应关系,且主要为早期凋亡,这也与本研究发现的T-2毒素作用HK-2 细胞后未出现DNA Ladder实验结果相一致。

A-对照;B-10 nmol/L;C-20 nmol/L;D-30 nmol/L:E-40 nmol/L
UL-死细胞;UR-晚期凋亡细胞;LL-活细胞;LR-早期凋亡细胞
图4 流式细胞仪检测HK-2细胞凋亡率
Fig.4 Apoptosis rate of HK-2 cells detected by flow cytometry
表1 T-2毒素对HK-2细胞凋亡的影响
Table 1 Effect of on T-2 toxin on apoptosis of HK-2 cells

注:同列上标字母不同表示差异显著(P<0.05)。下同。
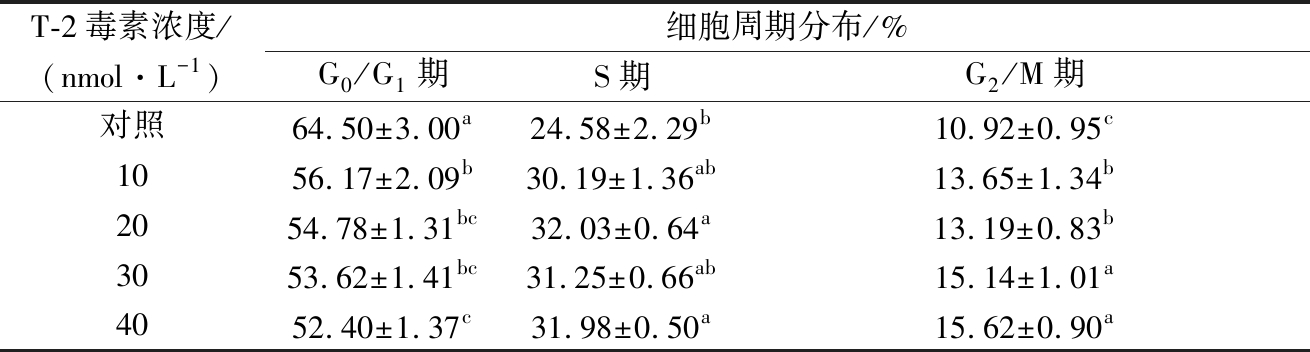
利用PI可与细胞双链DNA结合后产生荧光,并且荧光强度和双链DNA的含量成正比这一特性,可用流式细胞仪对细胞进行DNA含量测定。流式细胞仪检测统计结果见表2。实验发现,与对照组相比,HK-2细胞经T-2毒素作用72 h后,G0/G1期细胞比例分别由对照组的(64.50±3.00)%降低至(56.17±2.09)%,(54.78±1.31)%,(53.62±1.41)%和(52.40±1.37)%;S期细胞比例分别由对照组的(24.58±2.29)%增加至(30.19±1.36)%,(32.03±0.64)%,(31.25±0.66)%和(31.98±0.50)%;G2/M期细胞比例分别由对照组的(10.92±0.95)%增加至(13.65±1.34)%,(13.19±0.83)%,(15.14±1.01)%和(15.62±0.90)%。可见不同浓度T-2毒素作用细胞72 h后可影响HK-2细胞的周期分布,使G0/G1期细胞比例显著下降,而S期和G2/M期细胞比例增加,引起细胞发生G2/M期阻滞。
表2 T-2毒素对HK-2细胞周期的影响
Table 2 Effect of T-2 toxin on cell cycle of HK-2 cells
caspase-3是一种半胱氨酸蛋白酶,在细胞凋亡的过程中发挥重要作用[12]。正常细胞内caspase-3存在于胞浆中,不具活性,但在凋亡的早期阶段该蛋白可被家族中其他成员激活,裂解相应的底物,最终导致细胞凋亡[13]。
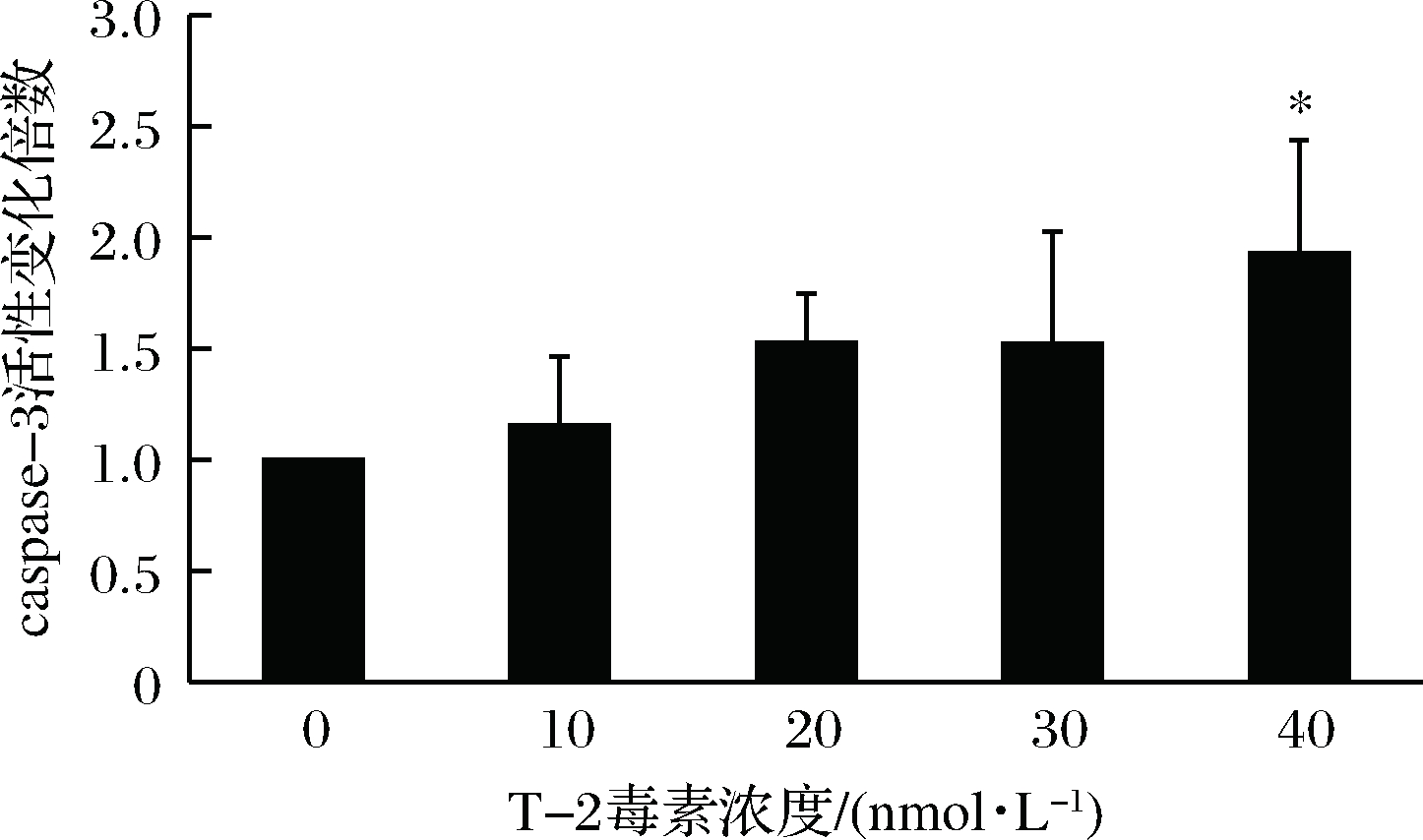
图5 T-2毒素对HK-2细胞caspase-3活性的影响
Fig.5 Effect of T-2 toxin on caspase-3 activity of HK-2 cells
注:* 表示与对照组相比差异显著(P<0.05)。
从图5可知,与对照组相比,HK-2细胞分别经10.0、20.0、30.0、40.0 nmol/L的T-2毒素作用72 h后,处理组细胞中caspase-3活性分别提高到1.15、1.53、 1.53和1.93倍,具有正的剂量依赖效应。
T-2毒素作为单端孢霉烯族化合物中毒性最强的毒素,主要污染谷物及加工饲料。李思齐等[14]对鲁北地区18家养殖场的全株玉米青贮饲料中霉菌毒素含量的调查发现,T-2毒素检出率为100%。杜妮[15]对2013~2017年全国12个省份的玉米、豆粕、小麦、麸皮和饲料中霉菌毒素污染调查发现,T-2毒素阳性检出率为66.85%~90.13%,平均值为38.9~49.9 μg/kg,污染程度较高,摄入风险较大。因此很多国家和地区制定了T-2毒素限量标准[16],如加拿大提出猪和家禽饲料中T-2毒素建议容忍限量为1 000 μg/kg,我国在《饲料卫生标准》(GB 13078—2017)中规定植物性饲料原料和猪、禽配合饲料的最大允许量为0.5 mg/kg。因此,开展T-2毒素毒性研究可以为降低T-2毒素危害提供理论依据。
本研究CCK-8实验发现,T-2毒素对HK-2细胞具有增殖抑制作用,这与很多文献报道的T-2对体外培养的人和动物细胞增殖影响的结果相一致[17-18],表明T-2毒素对HK-2细胞具有毒性作用。细胞周期和细胞凋亡是生物体内复杂而有序并受严格调控的过程,细胞周期调控紊乱在细胞损伤乃至癌变过程中起着至关重要的作用,而细胞增殖也是通过细胞周期调控来实现的。细胞周期的运行是在一系列称为检验点(checkpoint)的严格监控下进行的,当DNA发生损伤,复制不完全或纺锤体形成不正常,周期将发生阻滞,使细胞在复制前(G0/G1期阻滞)和有丝分裂前(G2/M期阻滞)有足够的时间进行有效的修复,修复成功的细胞进入细胞周期,修复失败的细胞会发生凋亡,因此细胞周期调控对于维持细胞増殖、调亡及基因组稳定性有重要作用[19-20]。本研究发现,不同浓度T-2毒素作用HK-2细胞72 h后可影响细胞的周期分布,引起细胞发生G2/M期阻滞,但AGRAWAL等[21]研究发现T-2毒素可诱导人神经母细胞瘤细胞G0/G1期细胞周期停滞,两项研究均表明T-2毒素可引起细胞周期阻滞,但其具体调控机制有待进一步研究。此外,流式细胞仪检测结果表明T-2毒素作用可引起HK-2细胞凋亡,呈明显的剂量效应关系;Hoechst 33258荧光染色也发现T-2毒素作用HK-2细胞后,细胞核染色质出现碎片和固缩现象,荧光染色增强,部分细胞可以观察到明显的凋亡小体,说明T-2毒素可诱导细胞凋亡,这与YUAN等[22]报道的T-2毒素对TM3细胞凋亡和WU等[23]报道荧光染色观察结果相一致。DNA片段化也是伴随细胞凋亡的主要生化特征,通过琼脂糖凝胶电泳可观察到特征性的梯形条带。但另有研究发现DNA凝胶电泳虽特异性高但灵敏度低,不能检测DNA轻微损伤及早期凋亡,且并不是所有细胞凋亡都有DNA Ladder出现,取决于细胞类型和一些特殊情况(如凋亡细胞DNA双链断裂时可观察到梯形条带,而单链断裂时则观察不到)[24]。本研究在HK-2细胞的对照组及处理组中均没有观察到DNA Ladder,结合流式细胞仪检测结果可知,T-2毒素确实可以诱导HK-2细胞的早期凋亡。细胞凋亡是多基因调控下的复杂的主动死亡过程,其中caspase家族在细胞凋亡过程中发挥重要作用。目前已发现的caspase家族成员有14个,根据caspase氨基酸序列的同源性及其作用性质主要分为3个亚型,分别作为细胞凋亡的活化者、执行者和炎症介质反应的调节者参与细胞凋亡的过程[13],其中caspase-3就属于细胞凋亡的执行者,作为细胞凋亡过程中最主要的终末剪切酶在细胞内存在的两条凋亡途径:外源性凋亡途径和线粒体途径中均发挥重要作用。本研究发现T-2毒素作用HK-2细胞后caspase-3活性明显升高,这也与LIU等[25]报道的T-2毒素可通过caspase-3活化引起GH3细胞凋亡的结果相一致。
综上所述,T-2毒素对HK-2细胞具有明显的增殖抑制作用,能够诱导HK-2发生G2/M期阻滞,同时通过激活caspase-3活性而诱导HK-2细胞凋亡,有关细胞凋亡和细胞周期调控的分子机制有待进一步研究。
参考文献
[1] LI Y, WANG Z, BEIER R C, et al. T-2 Toxin, a Trichothecene Mycotoxin: Review of Toxicity, Metabolism, and Analytical Methods[J]. Journal of Agricultural and Food Chemistry, 2011,59(8):3 441-3 453.
[2] KUMJO D, NORIAKI I, SHINYA S. T-2 toxin-induced toxicity in pregnant mice and rats[J]. International Journal of Molecular Sciences, 2008,9(11):2 146-2 158.
[3] 王虎军, 薛华丽,赵军,等. T-2毒素的产生、毒性及脱毒研究进展[J]. 食品安全质量检测学报, 2014,5(8):2 392-2 398.
[4] MANISH A, BHAWANA N, NEHA K, et al. T-2 mycotoxin: Toxicological effects and decontamination strategies[J]. Oncotarget, 2017,8(20):33 933-33 952.
[5] 邹广迅, 张红霞,花日茂. T-2毒素的毒性效应及致毒机制研究进展[J]. 生态毒理学报, 2011,6(2):121-128.
[6] 王丽华, 王文革,杨建伯. 低剂量T-2毒素致大鼠肝肾损伤的组织病理及超微结构观察[J]. 中国地方病防治杂志, 2007,22(1):25-28.
[7] 王瑾, 马肖容,张王刚. CCK-8法在淋巴细胞增殖检测中最佳实验条件的筛选[J]. 中国医药导报, 2018,15(23):19-22;188.
[8] ALI A G, MOHAMED M F, ABDELHAMID A O, et al. A novel adamantane thiadiazole derivative induces mitochondria-mediated apoptosis in lung carcinoma cell line[J]. Bioorganic & Medicinal Chemistry, 2017,25(1):241-253.
[9] 赵霏. 灰树花多糖联合维生素C诱导肝癌细胞SMMc-7721凋亡与自噬的研究[D]. 兰州:兰州大学,2016.
[10] 王坤. 禽流感病毒NS1A重组蛋白联合黄芩苷抗肿瘤作用研究[D]. 长春:吉林大学,2007.
[11] 谢靖. 紫薯素对~(60)coγ辐射导致的小鼠胸腺细胞损伤的抑制作用及机制[D]. 青岛:中国海洋大学,2011.
[12] GRÜTTER M G. Caspases: Key players in programmed cell death[J]. Curr Opin Struct Biol, 2000,10(6):649-655.
[13] 易铁男, 周云峰, 伍钢. Caspase家族与细胞凋亡的研究进展[J]. 国际肿瘤学杂志, 2018,28(1):39-42.
[14] 李思齐, 吕素芳,李峰,等. 鲁北地区全株玉米青贮饲料霉菌毒素检测分析[J]. 中国草食动物科学, 2018,38(5):27-29.
[15] 杜妮. 2017年我国部分地区饲料及饲用原料霉菌毒素污染调查报告[J]. 猪业科学, 2018,35(2):58-60.
[16] 祭芳, 张新明,徐学万,等. 镰刀菌毒素限量及检测方法标准现状研究[J]. 农产品质量与安全, 2018(4):59-65.
[17] MINERVINI F, FORNELLI F, LUCIVERO G, et al. T-2 toxin immunotoxicity on human B and T lymphoid cell lines[J]. Toxicology, 2005, 210(1):81-91.
[18] FATIMA Z, GUO P, HUANG D, et al. The critical role of p16/Rb pathway in the inhibition of GH3 cell cycle induced by T-2 toxin[J]. Toxicology, 2018,400-401:28-39.
[19] 王媛. ERK和p38 MAPK信号通路参与赭曲霉毒素A诱导的人胃黏膜上皮细胞(GES-1)G2期阻滞的研究[D]. 石家庄:河北医科大学,2012.
[20] 崔晋峰. 赭曲霉毒素A诱导人胃黏膜上皮细胞(GES-1)G2期阻滞及可能机制的研究[D]. 石家庄:河北医科大学,2010.
[21] AGRAWAL M, BHASKAR A S B, RAO P V L. Involvement of mitogen-activated protein kinase pathway in T-2 toxin-induced cell cycle alteration and apoptosis in human neuroblastoma cells[J]. Molecular Neurobiology,2015,51(3):1 379-1 394.
[22] YUAN Z, MATIAS F B, YI J E, et al. T-2 toxin-induced cytotoxicity and damage on TM3 Leydig cells[J]. Comparative Biochemistry and Physiology Part C: Toxicology & Pharmacology, 2016,181-182:47-54.
[23] WU J, JING L, YUAN H, et al. T-2 toxin induces apoptosis in ovarian granulosa cells of rats through reactive oxygen species-mediated mitochondrial pathway[J]. Toxicology Letters, 2011,202(3):168-177.
[24] 崔江涛. 单端孢菌素诱导人肝癌细胞Hep G2凋亡的作用机制研究[D]. 南京:南京大学,2011.
[25] LIU X, GUO P, LIU A, et al. Nitric oxide (NO)-mediated mitochondrial damage plays a critical role in T-2 toxin-induced apoptosis and growth hormone deficiency in rat anterior pituitary GH3 cells[J]. Food and Chemical Toxicology, 2017,102:11-23.
XIAN Tingting1,2,HAN Xiaomin2,HAN Chunhui2,LI Fengqin2, XU Wenjing2,ZHANG Hongyuan2,TU Kang1*
1(College of Food Science and Technology, Nanjing Agricultural University, Nanjing 210095, China) 2(NHC Key Laboratory of Food Safety Risk Assessment, China National Center for Food Safety Risk Assessment, Beijing 100021,China)
ABSTRACT This study aimed to study the effects of T-2 toxin on proliferation and apoptosis of human renal tubular epithelial cell HK-2. The HK-2 cells were treated with different concentrations of T-2 toxin for 72 h, followed by measuring their proliferation inhibition rate, cell morphology, DNA fragmentation, apoptosis rate, cell cycle distribution, and caspase-3 activity. The results showed that T-2 toxin inhibited HK-2 cell proliferation and the inhibition rate increased with increasing T-2 toxin concentration (IC50 =49.34 nmol/L). Moreover, T-2 toxin induced cell apoptosis of HK-2 cells in a positive dose-dependent manner in the range of 10-40 nmol/L. Additionally, 20 nmol/L T-2 toxin resulted in chromatin condensation and other typical characteristics of apoptotic cells. Furthermore, 10-40 nmol/L T-2 toxin affected the cell cycle distribution by arresting the G2/M phase and dose-dependently increased the caspase-3 activity with maximally 1.93-fold higher than the control (P<0.05). This paper provides a theoretical basis to elucidate the mechanisms of adverse effects of T-2 toxin on the kidneys.
Key words T-2 toxin; human renal tubular epithelial cell HK-2; in vitro cell proliferation; cell apoptosis