梁家旗1,2,陈江2,王兰英1*,赵静2*,李绍平2
1(吉林大学 珠海学院 药学与食品科学学院,广东 珠海,519041) 2(中药质量研究国家重点实验室(澳门大学),中国 澳门,999078)
摘 要 该文主要研究桦褐孔菌在液体发酵过程中主要活性成分多糖、三萜甾醇的累积与代谢变化。采用液体发酵法培养桦褐孔菌获得不同发酵时间的发酵产物,分别采用苯酚硫酸法及HPTLC分析法检测不同培养时间的菌丝体中多糖、三萜和甾醇的含量,DPPH与硫酸香草醛显色法检测抗氧化活性。结果显示,随发酵时间的延长,桦褐孔菌菌丝体生物量越来越高,经HPTLC法分析可见发酵后的菌丝体与桦褐孔菌子实体中的三萜和甾醇成分相似。且多糖、三萜甾醇的含量均呈现先增高后降低的趋势,而通过显色反应,发现菌丝体中含有子实体未发现的抗氧化三萜成分。通过研究确定了桦褐孔菌液体发酵过程中主要活性成分变化,确立最佳发酵时间,为桦褐孔菌的工业化生产提供参考。
关键词 桦褐孔菌; 多糖; 三萜;甾醇;发酵
第一作者:硕士研究生(赵静副教授和王兰英副教授为共同通讯作者,E-mail:zhaojing.cpu@163.com,wanglanying922@163.com)。
基金项目:国家自然科学基金(81603069)
收稿日期:2018-10-19,改回日期:2019-01-09
DOI:10.13995/j.cnki.11-1802/ts.019109
桦褐孔菌是一种极具开发价值的药食两用的真菌[1]。桦褐孔菌野生资源十分有限,近年来价格逐渐升高,因此,人工培养桦褐孔菌非常必要,而采用液体发酵生产桦褐孔菌菌丝体是条有效的途径,可以为研究和开发桦褐孔菌提供充足的原材料[2-3]。如何提高活性成分的产量、优化培养技术依然是人工培养过程中的研究热点。目前大部分研究着重于优化培养条件与检测活性成分[4],而对几大类活性成分在发酵过程中是如何累积变化的报道却少见。本研究以桦褐孔菌为研究对象,进行液体发酵,通过苯酚硫酸法及薄层色谱法分析桦褐孔菌中的活性成分,拟确定桦褐孔菌多糖、三萜、甾醇类等[5] 活性成分在液体发酵过程中的含量变化情况,确定发酵培养活性物质的最佳时间,通过与子实体比较,了解桦褐孔菌发酵培养物及子实体中的有效成分的差异,对进一步研究和开发桦褐孔菌具有重要意义。
桦褐孔菌CFCC6584菌株购自中国林业微生物菌种保藏管理中心;苯酚、硫酸、甲醇均采用国产分析纯;DPPH、茚三酮购自sigma公司;层析板购自德国默克;野生桦褐孔菌子实体保存于澳门大学中华医药研究院。
Bsc-A2超净工作台,美国Thermo公司;HVE-50高压灭菌锅,美国HIRAYAMA公司;C75紫外分光光度计,Chromato-Vue公司;Centrifuge 5415D离心机,Eppendorf公司;11-06-MRC恒温摇床,MRC公司;FD-02冻干机,ilShinBioBase公司;El3002电子天平,天恒科技有限公司;DENSITOMERCD60薄层扫描仪,DESAGA公司。
PDA固体培养基(g/L):马铃薯 200,葡萄糖 30,酵母粉10,MgSO4 1,KH2PO4 1,琼脂 30。具体方法参考文献[6]。取4 ℃保存的桦褐孔菌菌种,无菌操作取菌块接种到PDA培养基中。
液体发酵培养基(g/L):葡萄糖60,酵母粉1.2,蛋白胨![]() 按照液体发酵培养基配方配制培养基,用500 mL三角瓶分装液体培养基,每瓶装液量为200 mL, 121 ℃灭菌30 min。 冷却后,取活化后的菌种块转接到液体培养基中,制备液体菌种。按照配方配置液体培养基,相同条件下,灭菌冷却后按照接种量10%,接入活化后液体菌种,转入28 ℃、150 r/min摇床培养12 d, 期间每天取3瓶做各项指标检测及形态观察,共10批样品。收集的液体发酵培养物,将发酵锥形瓶内容物利用4层纱布过滤得到桦褐孔菌菌丝体,用去离子水润洗3次,10批样品分别编号为:3~12 d。将菌丝体于-80 ℃下冻干、称重。
按照液体发酵培养基配方配制培养基,用500 mL三角瓶分装液体培养基,每瓶装液量为200 mL, 121 ℃灭菌30 min。 冷却后,取活化后的菌种块转接到液体培养基中,制备液体菌种。按照配方配置液体培养基,相同条件下,灭菌冷却后按照接种量10%,接入活化后液体菌种,转入28 ℃、150 r/min摇床培养12 d, 期间每天取3瓶做各项指标检测及形态观察,共10批样品。收集的液体发酵培养物,将发酵锥形瓶内容物利用4层纱布过滤得到桦褐孔菌菌丝体,用去离子水润洗3次,10批样品分别编号为:3~12 d。将菌丝体于-80 ℃下冻干、称重。
1.5.1 样品制备
收集冻干菌丝体,用多功能粉碎机粉碎后过筛,取0.1 g菌丝体按液料比300∶1加入甲醇回流80 ℃提取2 h[1,8-9],转移到50 mL离心管中,离心取25 mL 上清液,加入甲醇洗涤再次离心。残渣再加甲醇清洗,重复3次。取甲醇脱脂后的菌丝体,按100∶1(以原来重量为准)加入去离子水,恒温水浴锅内浸提4.5 h、85 ℃, 提取液10 000 r/min离心10 min,取3 mL上清液,定容到50 mL容量瓶,用于多糖含量测定。
1.5.2 苯酚硫酸法检测多糖含量[10]
取无水葡萄糖对照品5 mg,置于50 mL容量瓶中,取0、0.5、1、2、3、4、5、6 mL定容至10 mL,倒到离心管中,分别取其中1 mL至试管中,再取出5%(质量分数)苯酚[11] 0.5 mL摇匀,迅速加入2.5 mL浓H2SO4摇匀,静置10 min后,于40 ℃水浴锅中保温15 min,冷却至室温,490 nm下检测吸光度值并记录,以浓度为横坐标,吸光度为纵坐标,根据测定结果绘制标准曲线,取1 mL待测样品按照上述方法分别加入苯酚与浓H2SO4,490 nm下检测吸光度值,代入标准曲线计算得到多糖含量。
1.6.1 样品制备
取冻干后的菌丝体与子实体,利用1.5.1中相同方法进行甲醇提取后,转移到50 mL离心管中,离心取25 mL上清液转移到合适容器中,用N2吹干后加入0.5 mL甲醇溶解。吸取复溶后的溶液,保存于2 mL 离心管中,用于HPTLC分析。
1.6.2 HPTLC法分析样品中的三萜甾醇
取薄层板,将制备好的待检测样品于40 ℃点样,设置点样条件:长度为5 mm,间距5 mm,点样量6.5 μL。按照V(二氯甲烷)∶V(乙酸乙酯)=5∶1配制层析液,预平衡20 min,层析完毕后采用硫酸香草醛显色[12]。并分别在540 nm和365 nm下观察实验结果进行拍照,同时使用薄层扫描仪进行扫描。利用扫描得到的样品总峰值计算菌丝体三萜甾醇相对含量,如公式(1)。
相对含量![]()
(1)
取薄层板分开左右2个区域,将子实体、发酵4 d、 9 d菌丝体样品于薄层板左右区域均进行点样,使用与1.6.2相同的方法进行薄层层析,左边区域利用硫酸香草醛显色,右边区域利用DPPH显色,于白光下进行拍摄并利用肉眼观察分析[13]。根据相同RF值的斑点显色结果对比桦褐孔菌子实体与菌丝体的抗氧化活性成分。
如图1所示,随着发酵时间的延长,菌丝球由小变大,逐渐增多,菌丝密度在发酵过程中明显增加,且发酵液颜色随培养时间延长逐渐加深,培养至12 d之后培养液基本浑浊,菌球消失。

A-培养3 d的菌丝体;B-培养6 d的菌丝体;C-培养9 d的菌丝体;D-培养12 d的菌丝体
图1 不同发酵时间对桦褐孔菌发酵过程的影响
Fig.1 Effects on mycelia changes of Inonotus obliquus in different fermentation times
如图2所示,菌丝体中的多糖含量在发酵的前5 d变化较小。
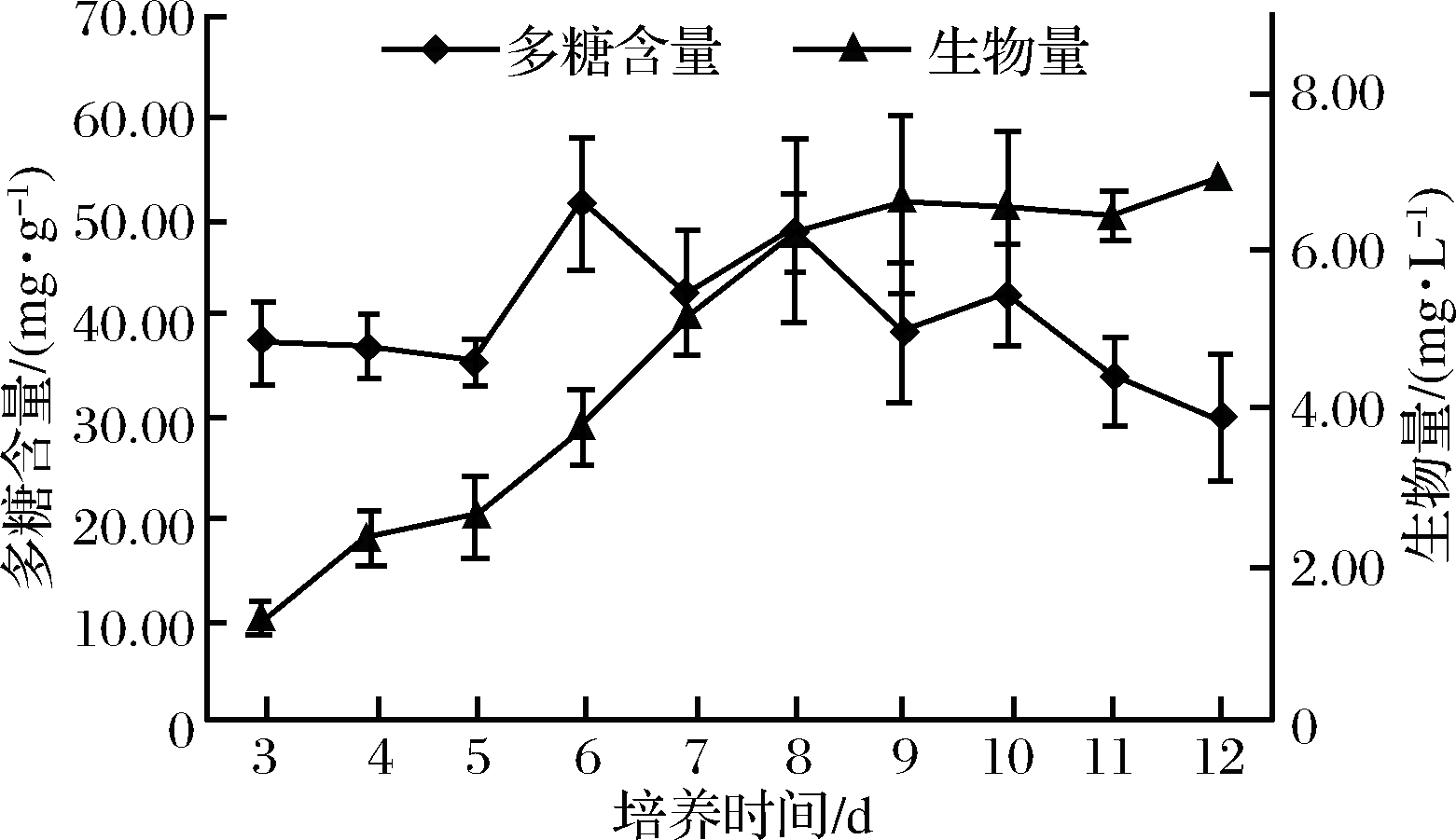
图2 不同发酵时间对桦褐孔菌的多糖含量与生物量的影响
Fig.2 Effect of polysaccharide content and biomass of Inonotus obliquus in different culture days
培养至第6天,菌丝体中的多糖含量有明显的升高,此时菌丝体处于对数生长期,其汲取营养增大生物量的同时,使得培养基中的还原糖逐步转化为多糖,在第8天多糖总产量达到最大值,为0.31 g/L。8 d之后菌丝体中多糖含量处于相对平稳下降状态,培养液中营养缺乏,菌丝体开始自溶,其中的多糖含量逐渐降低,最后达到平衡并接近于子实体中的含量(29.05 mg/g)。
如图3所示,随发酵时间的延长,桦褐孔菌次级代谢产物不断增加,并且发酵后的菌丝体与子实体的成分相似,而菌丝体提取物可观察到子实体提取物中未检测到的成分。
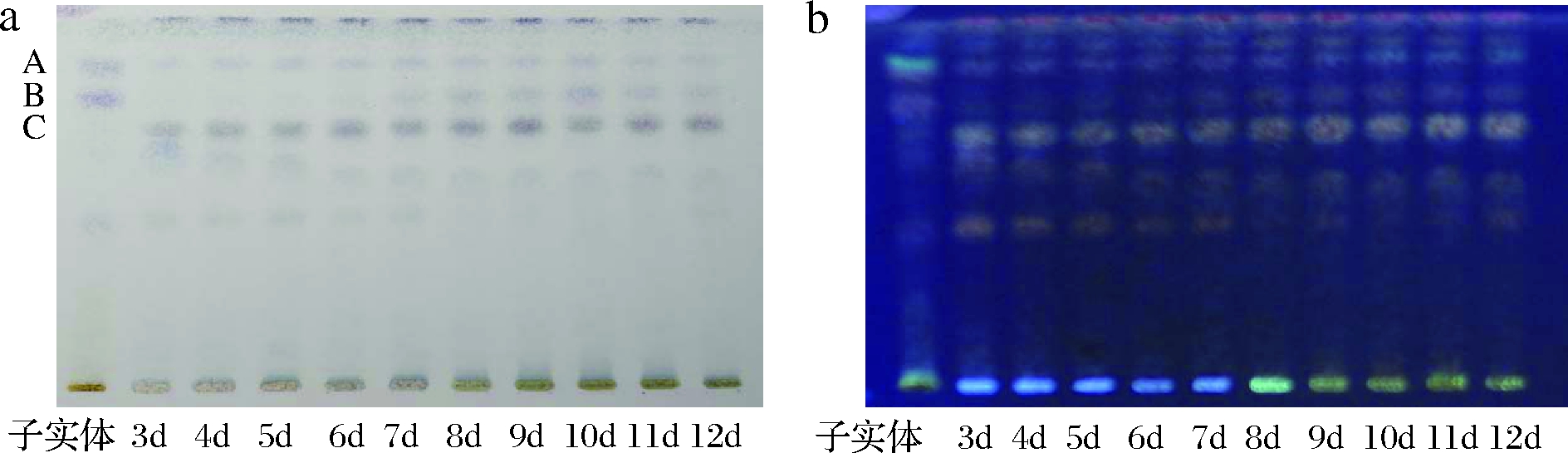
a-540 nm下拍摄,b-365 nm下拍摄
图3 桦褐孔菌培养第3~12天的薄层色谱图
Fig.3 TLC analysis results of Inonotus obliquus cultivation from 3 days to 12 days
采用ZHAO等已发表文献中方法,利用薄层扫描分析对比子实体与发酵菌丝体中三萜甾醇的相对含量(图4)[15],根据显色反应并结合现有报道,推断出桦褐孔菌主要成分A、B、C均为三萜或甾醇[16]。
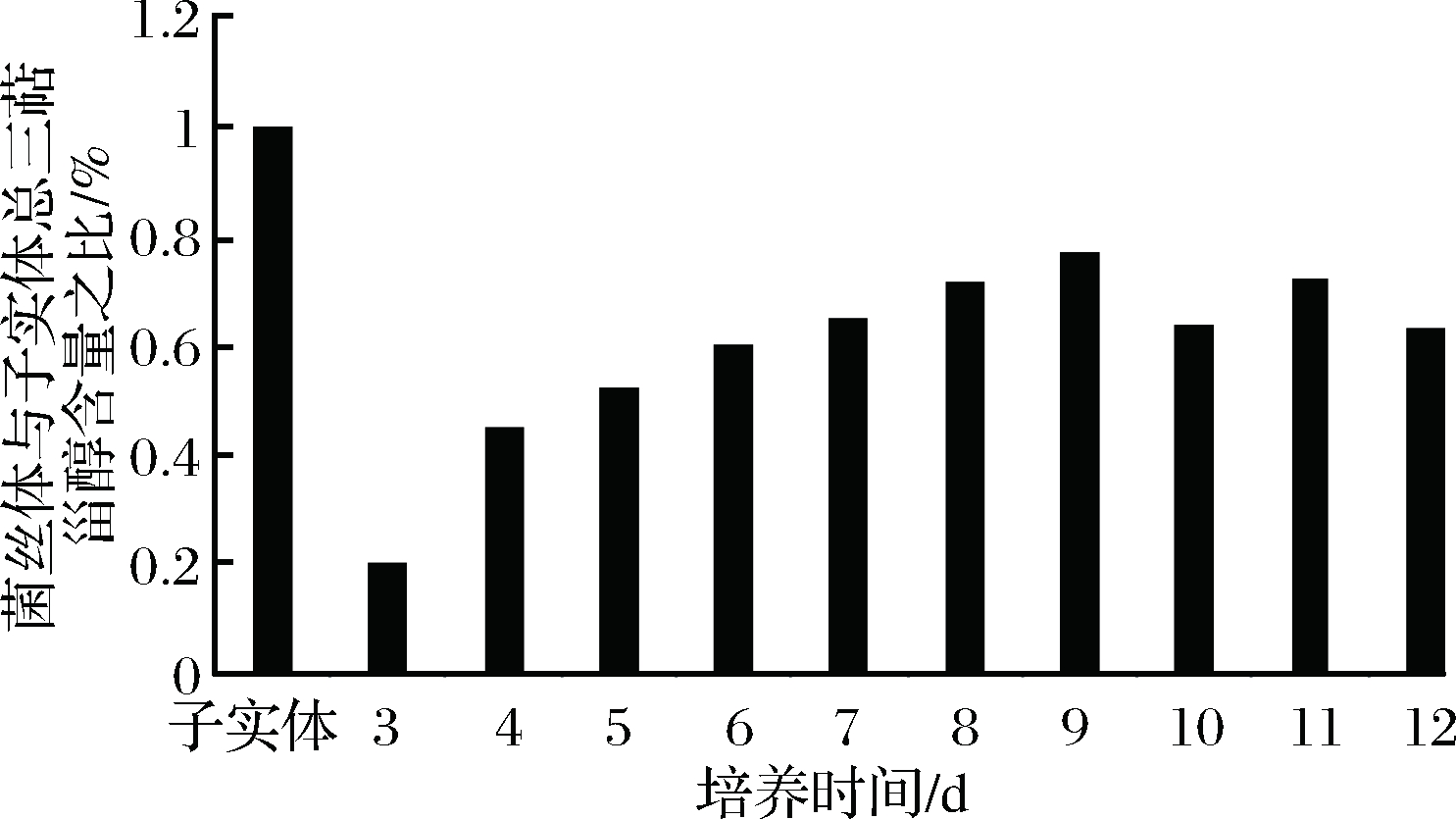
图4 培养第3~12天菌丝体三萜甾醇相对含量
Fig.4 The relative content of triterpenes and sterols in mycelia cultivation from 3 days to 12 days
可见桦褐孔菌菌丝体的总三萜甾醇含量于培养第9天左右达到最高值,约为子实体的77%。之后,总含量开始下降,究其原因,可能与营养基质消耗殆尽,菌丝生长受到抑制,菌丝自溶导致了相应产物含量降低有关。由此,判断桦褐孔菌菌丝体最佳发酵时间为9 d。
桦褐孔菌提取物的抗氧化薄层显色结果如图5所示,发酵4、9 d后的桦褐孔菌菌丝体提取物通过DPPH显色后能观察到明显的白色条带,证明经过发酵的桦褐孔菌菌丝体具有子实体不含有的抗氧化三萜成分[17]。该三萜于TLC香草醛显色下条带颜色较深,提示在其菌丝体中含量较高,原因可能是由于人工培养过程中,菌丝体得到充分的营养,从而产生较多此种代谢产物,而野生桦褐孔菌子实体由于生长环境等原因并未产出或较少产出此类成分。
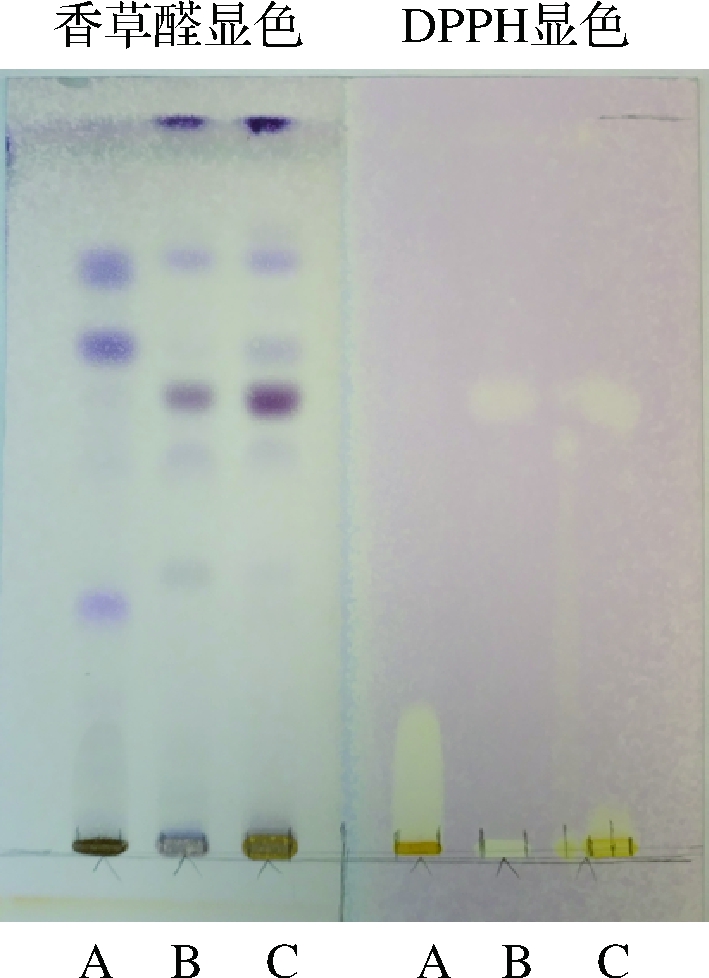
A-子实体;B-培养4 d的菌丝体;C-培养9 d的菌丝体
图5 桦褐孔菌子实体与菌丝体抗氧化活性成分对比
Fig.5 Comparison of antioxidant components between fruiting bodies and mycelia
桦褐孔菌菌丝体与天然资源一样具有调节人类免疫力的多种功能,在国外现已广泛应用于食品与保健品行列,其中桦褐孔菌多糖、三萜、甾醇类等是它的主要活性成分[18]。如何在人工培养过程中提高生物活性成分的产率,开发更多活性成分,依然是人工桦褐孔菌培养工程中的核心内容。近年来,国内对桦褐孔菌菌丝体的研究主要集中在多糖方面[19],针对桦褐孔菌菌丝体发酵条件的研究主要利用多糖含量作为发酵指标进行优化,很少将三萜甾醇的含量作为考察对象。董爱荣等分析比较了菌丝体及子实体粗多糖含量分别为7.43、2.31 g/100 g,而本文测定的菌丝体及子实体中的多糖含量分别为5.14、2.95 g/100 g,与其测定结果相近。ZHAO等对桦褐孔菌进行了研究,从中分离出了3种新的具有良好抗肿瘤活性的三萜[20],可见桦褐孔菌中的三萜甾醇具有深远的研究价值。本文采用液体深层发酵法对桦褐孔菌进行培养,每天收集菌丝体并检测其中多糖、三萜、甾醇等主要活性成分的含量,发现随着培养时间的延长,菌丝体的生物量逐渐增多,与以往报道一致[21],培养至第9天时达到最大,且发酵液颜色逐渐加深,而桦褐孔菌多糖、三萜、甾醇含量先增加后减少,在第9天左右达到最大值。结合形态学观察,可能是由于随着桦褐孔菌液体发酵时间延长,营养物质利用完后,菌丝体出现自溶,导致活性成分含量下降。据此确定,培养至第9天即进行发酵物的收集可以获得最多的活性物质。而本文首次利用HPTLC分析法,利用DPPH显色法,确定桦褐孔菌菌丝体发酵过程中可以产生子实体不具有或含量极少的抗氧化三萜成分,具体原因有待于进一步研究。本研究阐明了活性成分在发酵体系中的代谢变化,并确定了液体发酵的最佳收集时间,对人工培养桦褐孔菌菌丝体获得较高活性物质提供参考,对进一步开发桦褐孔菌功能产品具有重要的意义。
参考文献
[1] 胡涛, 刘萍,王亚亚,等. 桦褐孔菌深层发酵培养条件的优化研究[J]. 中国酿造, 2012,31(1): 26-29.
[2] 王振河, 霍云凤,王斌,等. 桦褐孔菌液体深层培养研究[J]. 菌物学报, 2006,25(3): 461-467.
[3] 徐欣, 杨承建,郑义通,等. 桦褐孔菌发酵菌粉成分分析[J]. 食用菌学报, 2011,18(4): 63-66.
[4] 沈梦薇, 全丽丽,徐向群. 有机溶剂对桦褐孔菌液体深层发酵多酚和多糖的产生与活性的影响[J]. 浙江理工大学学报(自然科学版), 2016,35(1): 93-98.
[5] 马伟平, 侯睿,陈正爱. 桦褐孔菌抗肿瘤作用的研究进展[J]. 医学研究生学报, 2017,30(4): 440-443.
[6] 张泽生, 史佳宁,张婕,等. 响应面法优化桦褐孔菌胞外多糖发酵条件[J]. 现代食品科技, 2009,25(3): 298-301.
[7] 向超, 徐向群. 响应面法优化桦褐孔菌产三萜化合物发酵培养基[J]. 浙江理工大学学报(自然科学版), 2013,30(1): 124-129.
[8] 汪莲霞, 陆震鸣,耿燕,等. UPLC法测定桦褐孔菌菌丝体中甾类化合物的质量分数[J]. 食品与生物技术学报, 2015, 34(2): 170-174.
[9] 许泓瑜, 孙军恩,陆震鸣,等. 桦褐孔菌菌粉多糖提取工艺的优化[J]. 食品与发酵工业, 2008,34(11): 175-179.
[10] 靳淑敏, 周娜,董振咏,等. 苯酚-硫酸比色法测定三黄糖敏汤中总多糖含量[J]. 河北医科大学学报, 2015,36(8): 980-982.
[11] 周振, 周能. 苯酚—硫酸法测定仁东大蒜中的总糖[J]. 食品研究与开发, 2012,33(6): 137-142.
[12] 陈程, 徐向群. 桦褐孔菌子实体三萜单体的分离及鉴定[J]. 浙江理工大学学报, 2015,33(2): 264-268.
[13] LAM S C, LUO Z, WU D T, et al. Comparison and characterization of compounds with antioxidant activity in Lycium barbarum using high-performance thin layer chromatography coupled with DPPH bioautography and tandem mass spectrometry [J]. Journal of Food Science, 2016,81(6): C1 378-C1 384.
[14] 曹灵杰, 卢雪梅,金小宝,等. 蛹虫草液体发酵过程主要活性成分的代谢变化[J]. 中药材, 2016,39(9): 1 966-1 970.
[15] ZHAO J, ZHANG J S, YANG B, et al. Free radical scavenging activity and characterization of sesquiterpenoids in four species of curcuma using a TLC bioautography assay and GC-MS analysis [J]. Molecules, 2010,15(11): 7 547-7 557.
[16] 朱春玉, 郑方亮,邵丽杰,等. 桦褐孔菌子实体与菌丝体三萜化合物提取及活性比较研究[J]. 食品科学, 2012,33(15): 161-165.
[17] 丁文欢, 文娥,张雪佳,等. 维药唇香草的薄层色谱鉴别及其抗氧化活性成分筛选[J]. 西北药学杂志, 2017,32(1): 5-9.
[18] 董爱荣, 刘雪峰,宋福强. 桦褐孔菌子实体与菌丝体营养成分比较分析[J]. 食品科学, 2015,36(14): 96-101.
[19] 钟秀宏, 孙艳美,郑楷,等. 桦褐孔菌多糖药理活性研究进展[J]. 上海中医药杂志, 2016, 50(1): 94-97.
[20] ZHAO Fenqin, MAI Qinqin, MA Jianghao, et al. Triterpenoids from Inonotus obliquus and their antitumor activities [J]. Fitoterapia, 2015,101: 34-40.
[21] 申进文, 李燕,王振河,等. 桦褐孔菌液体深层发酵条件优化研究[J]. 河南农业科学, 2007,36(8): 88-92.
LIANG Jiaqi1,2,CHEN Jiang2,WANG Lanying1*,ZHAO Jing2*,LI Shaoping2
1(School of Pharmacy and Food Science, Zhuhai College, Jilin University, Zhuhai 519041, China) 2(The State Key Laboratory for Quality Research in Chinese Medicine (University of Macau), Macao 999078, China)
ABSTRACT The accumulation and metabolism of polysaccharides, triterpene, and sterols during submerged fermentation of Inonotus obliquus were studied. Their contents were detected by phenol-sulfuric acid method and high performance thin layer chromatography (HPTLC), and their antioxidant activities were detected by DPPH and vanillin sulfate coloration method. The results showed that prolonged fermentation increased the biomass, and the components of triterpenes and sterols in mycelium were similar to that of the fruiting body. Besides, the contents of polysaccharides, triterpene, and sterols increased first and then decreased during fermentation. Additionally, antioxidative triterpenoids were found to present in the mycelium but not in fruiting bodies. This experiment provides a reference for industrial production of I. obliquus.
Key words Inonotus obliquus; polysaccharide; triterpene; sterols; fermentation