食醋能促进消化,刺激食欲,是集营养、保健、食疗功能一体的风味优良的酸味调味品[1]。我国现代食醋生产有传统酿造、纯种固态、纯种液态 3种工艺。纯种液态制醋工艺,因其具有生产技术与设备先进、便于大规模工业化生产的优点,成为提高我国食醋总产量的主要工艺[2-4]。
现代液态纯种制醋工艺以食用酒精为原料,采用液态深层发酵中的半连续分割发酵法来生产食醋。半连续分割发酵法是将处于旺盛主发酵阶段的菌种接到发酵罐中,当发酵罐总酸含量达到一定时,从发酵罐中分割出1/3~1/2的发酵液至另一发酵罐,继续发酵,并进行分割循环的过程,具有发酵速度快,周期短,原料利用率高的优点。虽然研究显示优良菌种[5]、合适的温度[6]、底物乙醇添加比例、产物乙酸量[7]等是影响关键效率的重要因素,然而循环生产过程中食用酒精原料批次的更换也常会导致发酵效率急剧下降甚至失败[8]。原料组成对于发酵过程的影响成为提高液态纯种制醋工艺关注的重点。
食用酒精主要是利用薯类、谷物类、糖类作为原料经过蒸煮、糖化、发酵等处理而得到的供食品工业使用的含水酒精,除了乙醇作为最主要的成分之外,还含有多种微量成分。事实上,即便是符合国家食用酒精标准的不同来源的食用酒精,对醋酸液态发酵也存在着明显的差异。由于目前对于食用酒精原料的分析和检测主要停留在酒精度的检测上(酒精体积分数≥95%),对于除乙醇外的微量成分对生产的影响关注较少[9],也缺乏相应的检测指标和标准。因而,深入研究食用酒精中的微量成分对醋酸菌发酵的影响迫在眉睫。
食用酒精中的微量成分是指酒精样品中待测组分含量范围在0.01%~1%的成分统称。它是由食用酒精中醛、酸、酯、醇等挥发性化合物组成,不同的挥发性化合物组成的含量和比例决定了食用酒精的风味,也影响了醋酸菌的生长和代谢。微量成分含量少且易挥发,常规的生化手段无法达到检测目的。气相色谱-质谱联用仪(gas chromatography-mass spectrometer,GC-MS)是目前检测挥发性化合物最成熟的技术之一,通过将样品中的挥发性组分导入气相色谱仪进行分离后进行质谱检测,可以同时分析数以百计的挥发性化合物,且检测灵敏度非常高[10-11]。并且,将获得的组分数据利用主成分分析(principal component analysis,PCA)等统计分析技术[12-13],通过降维简化由GC-MS检测出来的微量成分信息,进而找出与醋酸发酵相关联的微量成分。
本文首先对不同来源食用酒精的醋酸菌发酵的发酵速率进行了比较,然后利用GC-MS技术分析各种食用酒精的主要微量成分,通过PCA分析与聚类分析,显示甲酸等微量成分对于醋酸发酵产生明显影响,获得的结果为日后建立醋酸菌发酵类食用酒精原料更为精确合理的检测标准,进而提高醋酸发酵过程控制水平,提供了一种新的方法和思路。
1 材料与方法
1.1 材料
巴氏醋酸菌(Acetobacter pasteurianus),本实验室鉴定扩繁保藏。
1.2 主要试剂
甲酸、甲酸乙酯、正丙醇(色谱纯):阿拉丁试剂有限公司;营养盐:德国Fring公司;其他试剂(分析纯)均购自生工试剂有限公司。待试8种食用酒精购自不同厂家(用N1-N8表示)。
1.3 仪器和设备
78 90A-5975C气相色谱-质谱联用仪,美国Agilent公司;DB-WAX毛细管色谱柱(30 m×0.25 mm,0.25 μm);DC-0.45 μm微孔过滤膜,天津滕达过滤器件厂。
1.4 方法
1.4.1 醋酸摇瓶发酵
取总酸度为8.0、含巴氏醋酸菌的发酵种子液66 mL,加入500 mL三角瓶中,然后再加入质量比为0.15%的营养盐, 9% (体积分数)的8种不同来源的食用酒精,使酒精的终浓度为3% (体积分数),发酵起始液的体积为100 mL,在摇床中35 ℃,200 r/min培养300 h。以上试验重复3次,取平均值±SD。
1.4.2 醋酸发酵总酸度测定
以24 h为1个总酸测量时间点,测量100 mL发酵液中总酸量。用移液枪吸取5 mL发酵液,置于50 mL容量瓶中,超纯水定容,混匀。然后,吸取20 mL混合液移入250 mL的三角锥形瓶,加入60 mL的超纯水和50 μL的1%酚酞指示剂,用0.05 mol/L NaOH标准溶液标定,直到酚酞指示剂变色,记下此时消耗NaOH标准溶液的体积VNaOH。计算公式如公式(1)所示:
总酸度/[g·(100 mL)-1]=0.05×VNaOH ×3
(1)
算出总酸度后,利用Origin软件作图。
1.4.3 食用酒精样品的制备
参照周世坤等[14] GC-MS中样品干燥方法,食用酒精样品需要进行除水处理。将不同食用酒精加入无水硫酸钠吸水,在摇床中反复振荡接触。如果底部无水硫酸钠成块状,则将已进行除水处理的食用酒精转移到新的三角锥形瓶,并加入新的无水硫酸钠吸水,直到食用酒精中的无水硫酸钠为流动的固体。取无水硫酸铜验证,若食用酒精遇无水硫酸铜不变色,则证明食用酒精中的水分已经除尽,可以作为GC-MS顶空法的样品。在进入气相色谱-质谱联用仪前,用微孔过滤膜过滤,量取1 mL过滤后的食用酒精样品移入气相色谱试样瓶中。
1.4.4 GC-MS分析条件
分析食用酒精样品之前,进行进样体积为0 mL的空白分析。待测酒样连续自动进样分析,并分别对挥发性化学物质的保留时间和色谱峰相对峰面积进行统计分析。随之,使用NIST11谱库检索分析,根据匹配度筛选挥发性化合物。
色谱条件:载气(He)流速1 mL/min (>99.9%);进样口温度:220 ℃;柱温:初始柱温35 ℃,保持2 min,升温速率5 ℃ /min,升至200 ℃,保持2 min;进样量:0.2 μL;进样方式:自动进样;不分流进样。
质谱条件:电子轰击离子源;离子源温度200 ℃;连接杆温度250 ℃;电离方式EI;电子能量70 eV;电子倍增器电压1 086 V;质量分析器,单级四极杆;质量扫描范围m/z 50~500。
1.4.5 主成分分析和聚类分析
参照文献[15]和[16]的方法,通过测定得到8种不同的食用酒精的微量成分,根据与NIST11谱库检索分析匹配度高于80的特点筛选出比较典型的微量成分[15-16]。以不同食用酒精为对象,以不同微量成分为指标,对数据进行主成分(PCA)分析。对原始数据进行标准化处理,算出指标的样本均值和样本标准差。并采用重采样方法,增加食用酒精样本量,计算特征值的信息贡献率和累积贡献率,进而构建食用酒精微量成分的相关系数矩阵、特征值和特征向量。应用SPSS 24.0统计软件进行聚类分析(cluster analysis),R语言绘制出8种不同食用酒精的聚类图、主成分载荷图和得分图。
2 结果与分析
2.1 不同来源食用酒精对总酸生产的影响
为了比较不同来源的食用酒精对醋酸发酵速率的影响,购买了8个厂家的食用酒精(分别用N1~N8表示),按照醋酸摇瓶发酵培养条件培养13 d,取样测定总酸度,结果如图1所示。
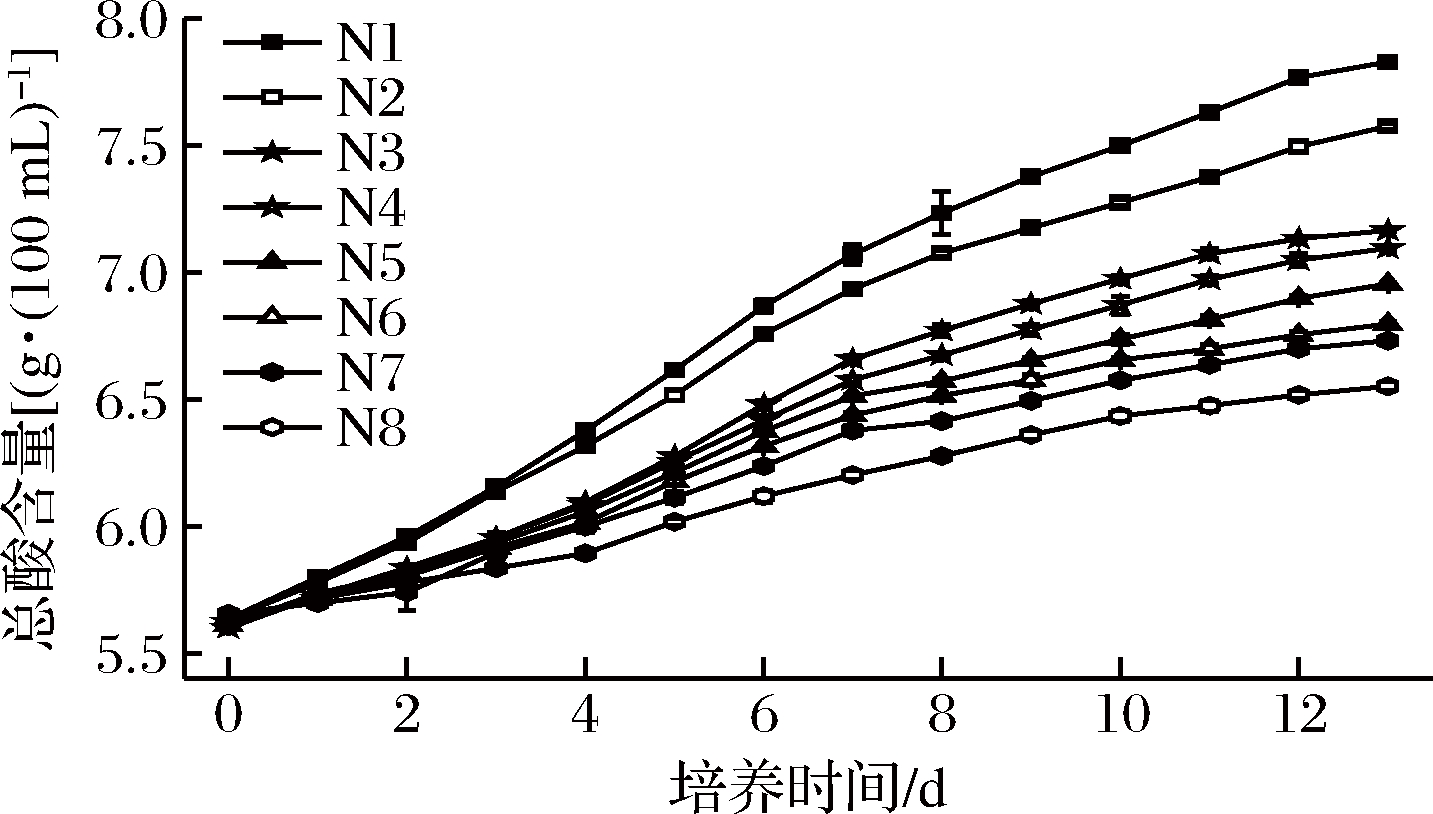
图1 8种不同食用酒精中醋酸发酵总酸度的变化
Fig.1 The change of total acidity of acetic bacteria fermentation in 8 different edible alcohol
由图1可以看出,2 d后,各发酵液总酸度快速增长,N1和N2的发酵总酸度变化相对于其他的样本差别稍大,而N3~N8的区别在48 h内不明显,显示发酵原液直接接种到摇瓶均会出现1个迟滞期。醋酸摇瓶发酵48 h后,总体发酵总酸度快速增长,不同的酒精的发酵速率出现明显差异,标记为N1的食用酒精中醋酸发酵的总酸度明显高于其他标记的食用酒精,标记为N8的食用酒精中醋酸发酵的总酸度明显低于其他标记的食用酒精,而N3和N4、N6和N7食用酒精为原料的发酵趋势则较为接近,表明不同来源的食用酒精对醋酸的生产存在明显的影响。
2.2 不同来源食用酒精微量挥发性成分的分析
为了进一步研究不同来源食用酒精的微量成分是否影响醋酸发酵产酸速率,实验采用GC-MS对8种食用酒精原料的微量成分进行了分析测定。结果显示,8种酒精中共分析出丰度较高的24种微量挥发性成分,分别为酚、呋喃、酯、烷烃、醛、醇和酸7类。其中酯类有11种,丰富度最高。不同的酒精微量成分组成类群各异,其中发酵速率较为接近的N3和N4存在着明显类似的微量成分组成,而发酵速度差异最大的N1与N8则体现出微量成分组成和含量具有明显差异,暗示不同的微量挥发性成分与醋酸发酵存在关联作用。由于食用酒精含有大量的乙醇,甲酸的选择离子与乙醇的选择离子相近,且游离的甲酸容易和大量的乙醇生成甲酸乙酯而容易被忽略[17]。因此采用在食用酒精样品中添加标样的方法,对甲酸的含量进一步检测并用于后续分析(表1)。
表1 食用酒精微量成分GC/MS分析结果
Table 1 GC/MS analysis of trace elements in edible alcohol
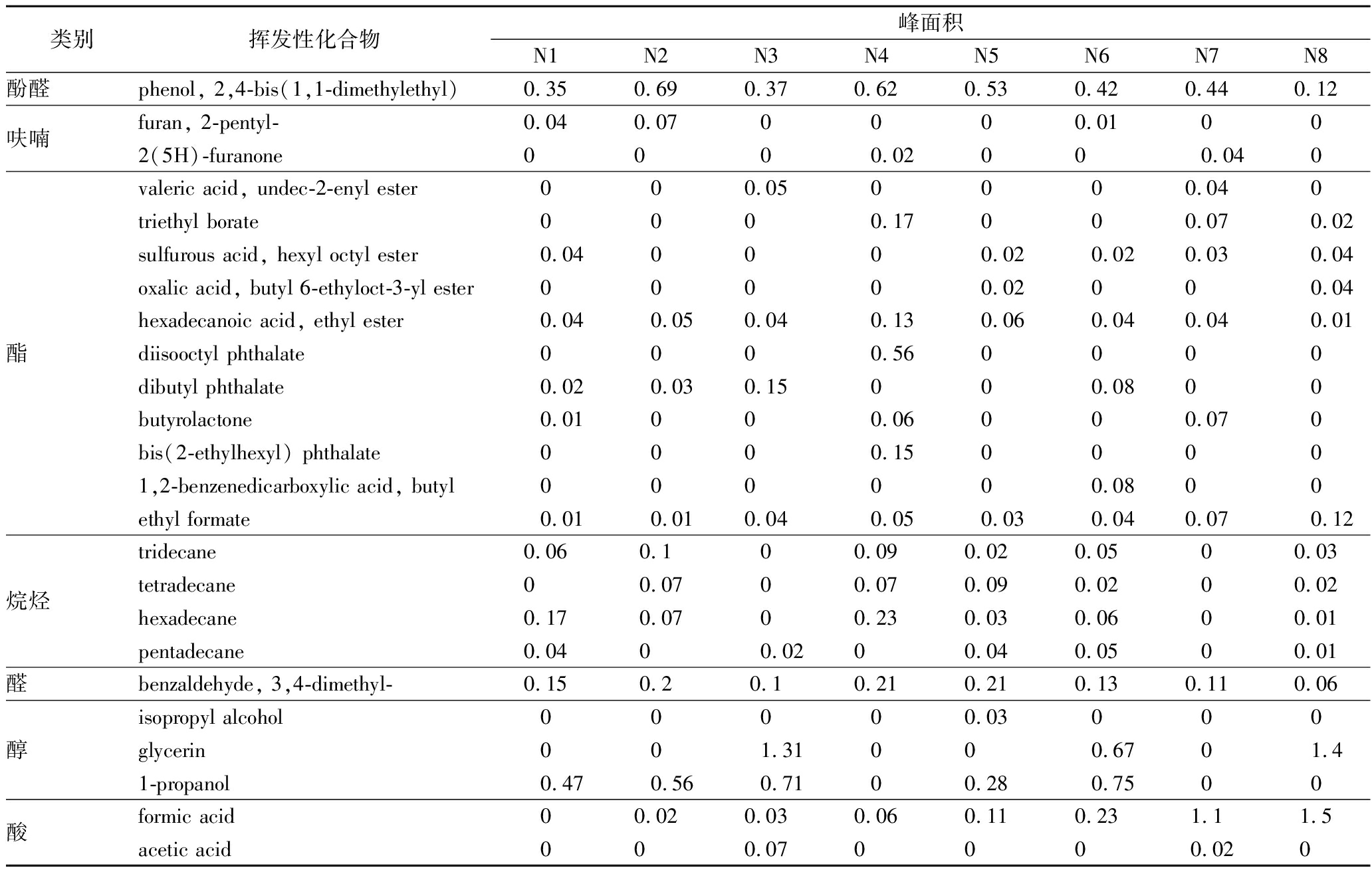
类别挥发性化合物峰面积N1N2N3N4N5N6N7N8酚醛phenol, 2,4-bis(1,1-dimethylethyl)0.350.690.370.620.530.420.440.12呋喃furan, 2-pentyl-0.040.070000.01002(5H)-furanone0000.02000.040酯valeric acid, undec-2-enyl ester000.050000.040triethyl borate0000.17000.070.02sulfurous acid, hexyl octyl ester0.040000.020.020.030.04oxalic acid, butyl 6-ethyloct-3-yl ester00000.02000.04hexadecanoic acid, ethyl ester0.040.050.040.130.060.040.040.01diisooctyl phthalate0000.560000dibutyl phthalate0.020.030.15000.0800butyrolactone0.01000.06000.070bis(2-ethylhexyl) phthalate0000.1500001,2-benzenedicarboxylic acid, butyl 000000.0800ethyl formate0.010.010.040.050.030.040.070.12烷烃tridecane0.060.100.090.020.0500.03tetradecane00.0700.070.090.0200.02hexadecane0.170.0700.230.030.0600.01pentadecane0.0400.0200.040.0500.01醛benzaldehyde, 3,4-dimethyl-0.150.20.10.210.210.130.110.06醇isopropyl alcohol00000.03000glycerin001.31000.6701.41-propanol0.470.560.7100.280.7500酸formic acid00.020.030.060.110.231.11.5acetic acid000.070000.020
2.3 PCA分析食用酒精微量成分
为了进一步挖掘食用酒精的微量成分与醋酸发酵之间的关系,找出原料食用酒精中可能抑制醋酸发酵的微量成分,对8种食用酒精和24种微量成分数据进行主成分(PCA)分析。从图2可以看出,第一主成分与第二主成分贡献度之和为54.8%,表明能够较好地反映食用酒精组分的构成对醋酸发酵的影响。随着发酵速度的增加,数据点横向坐标增大,说明不同样本间的成分差异与发酵速度有明显的相关性。依据李莹等[18]的研究,以SPSS软件按照24种微量成分数据为指标对食用酒精样品做聚类分析,结果显示,在主成分分析因子图(图2)和聚类分析图(图3)中,N1和N8相聚较远,而N6与N7聚为一类。这与发酵结果(图1)一致,说明该分析模式能够反映出实验酒精微量成分与发酵速度之间的关系。

图2 8种不同食用酒精的主成分分析图
Fig.2 Principal component analysis of 8 different edible alcohols
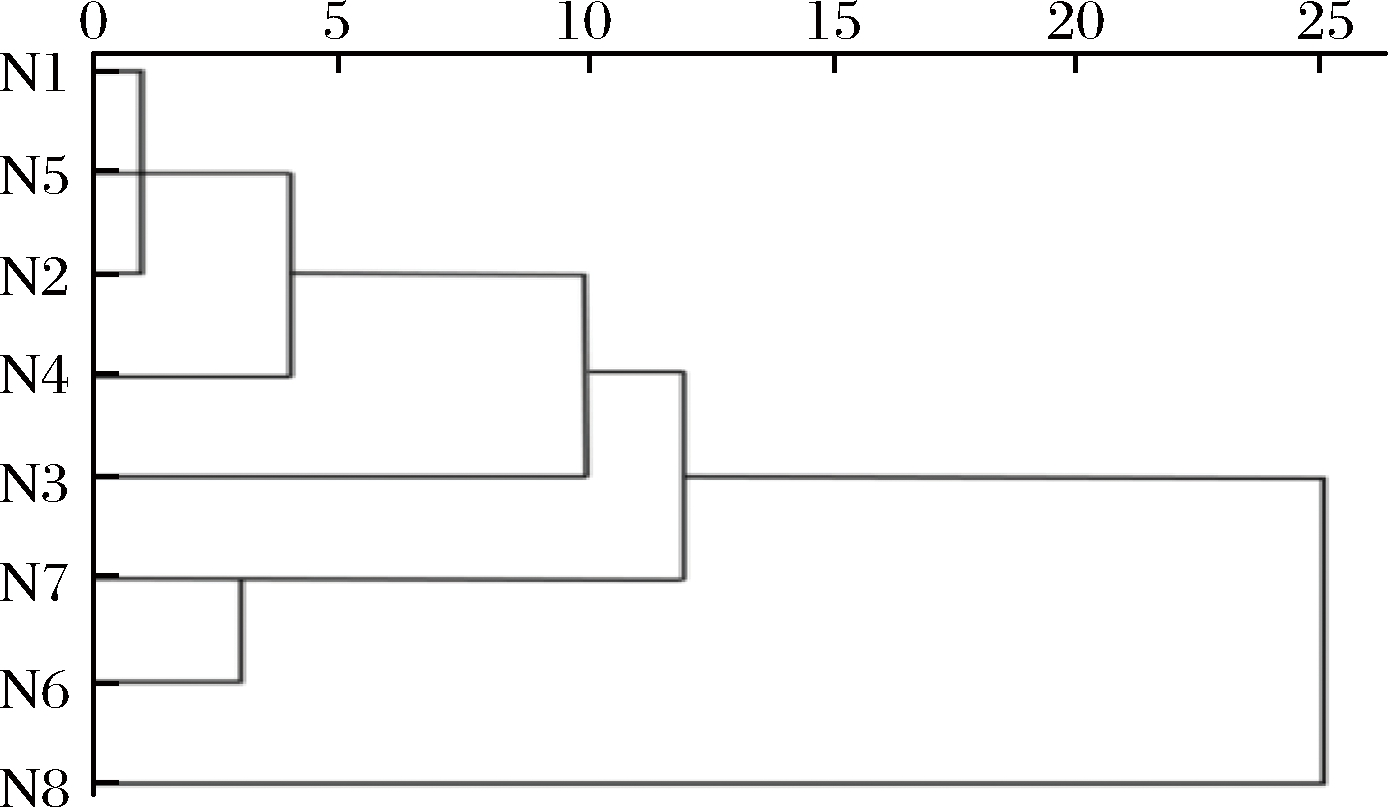
图3 不同食用酒精中的聚类分析图
Fig.3 Cluster analysis of different edible alcohols
图4是24种微量挥发性成份的主成分分析载荷图,食用酒精“样品点”在各自主成分中所处位置越近,则相关性越高,图4中有2个“样品点”落在一个位置,故只呈现23个“样品点”[19]。从图4中可以看出,位于第2、3象限的甲酸、甲酸乙酯、戊酸-1,2-烯丙基酯、亚硫酸己基辛酯、草酸、丁基-6-乙基-3-酯、乙酸、甘油等微量成分与发酵速率慢的N8等比较接近,表明这些组分可能与抑制醋酸发酵密切相关。

图4 24个指标在不同食用酒精中的主成分分析图
Fig.4 Principal component analysis of 24 indicators in different edible alcohols
2.4 微量挥发性成分对醋酸菌发酵影响
为了验证PCA降维分析第二象限的预测结果,挑选可能抑制醋酸发酵成分的甲酸、甲酸乙酯,以及第三象限的正丙醇进行进一步实验[20]。以产酸速度最快的食用酒精编号N1对照,在N1中通过梯度分别添加甲酸乙酯、甲酸、正丙醇,来分析这些组分对发酵的影响。结果显示(图5和图6),甲酸及其衍生物甲酸乙酯对醋酸发酵有明显影响,分别添加100 μg/mL和500 μg/mL就能显著降低发酵速度,而且当甲酸的浓度达到200 μg/mL就会使醋酸菌发酵停止(图5)。而正丙醇影响相对较小,添加量达1 500 μg/mL才对醋酸发酵速度产生明显的抑制作用(图7)。结果显示酒精原料中甲酸、甲酸乙酯含量将严重影响醋酸发酵的生产。
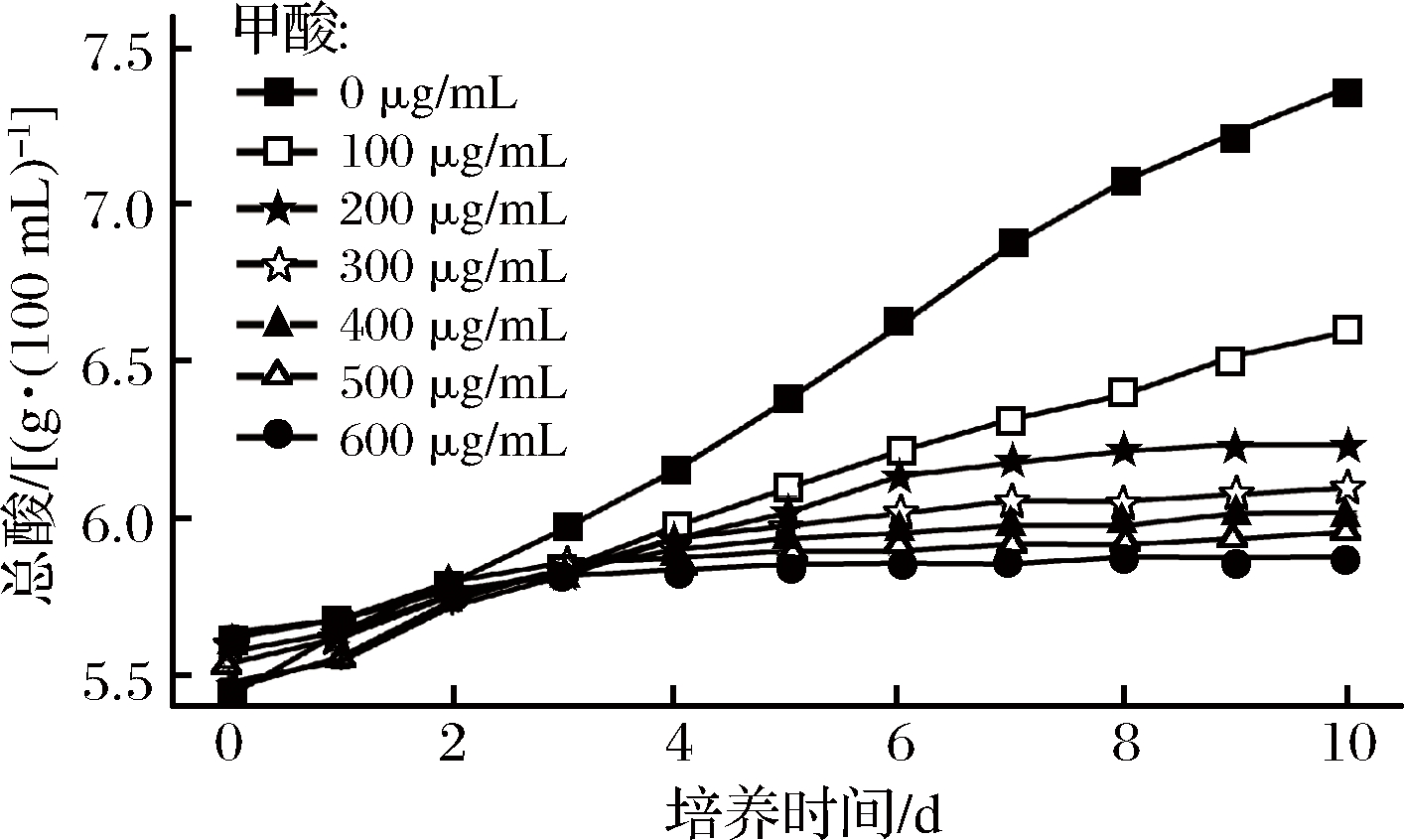
图5 甲酸对醋酸发酵的影响
Fig.5 Influence of formic acid on acetic bacteria fermentation

图6 甲酸乙酯对醋酸发酵的影响
Fig.6 Influence of ethyl formate on acetic bacteria fermentation
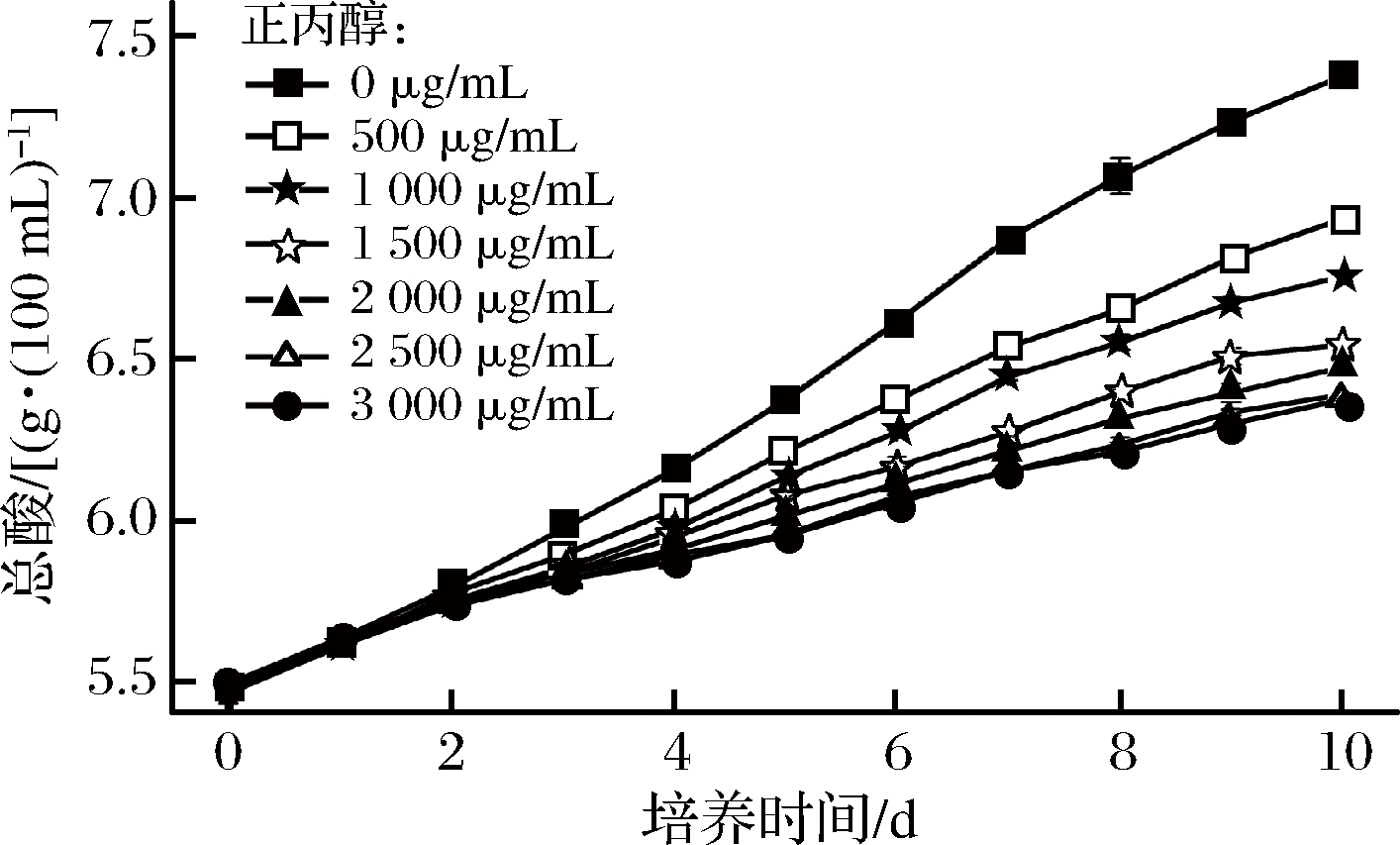
图7 正丙醇对醋酸发酵的影响
Fig.7 Influence of 1-propanol on acetic bacteria fermentation
3 讨论
液态纯种制醋是利用好氧型的醋酸菌,将乙醇氧化成乙醛,通过吸水形成水化乙醛,进而氧化成乙酸的过程[21]。该工艺菌种明确,醇酸转化率高,周期短,生产效率高,已成为最主要的制醋方式[22]。醋酸菌可培养性低、对周围环境敏感。比如通气量严重影响醋酸菌发酵过程,而溶氧不足很快会使发酵中的醋酸菌转变为存活或不可培养状态[23]。同时,醋酸菌对于除酒精外的其他营养物质要求也比较高,报道显示氨基酸、柠檬酸、纤维素等均显著影响发酵过程[24]。
食用酒精原料的微量成分对于醋酸液态发酵存在着严重的影响,通过GC-MS检测、PCA降维分析,预测出甲酸、甲酸乙酯、戊酸-1,2-烯丙基酯、亚硫酸己基辛酯、草酸、丁基-6-乙基-3-酯、乙酸、甘油等成分可能影响醋酸发酵,进一步验证实验表明甲酸和甲酸乙酯对于醋酸发酵有明显的抑制作用,此结果对醋酸生产厂家对于原料来源的选择和验收、制定相应的企业标准具有重要的意义。
虽然有研究显示,部分有机酸对于醋酸菌生长有明显影响,比如过多乙酸(15 mol/L,pH=1.8)会限制醋酸菌的生长,适量的丙酸对醋酸菌生长具有促进作用[24]。但是目前依然缺乏酒精中微量成分对醋酸菌发酵的研究报告。本研究结果显示,微量的甲酸是影响醋酸菌发酵速率重要因素,仅100 μg/mL就显著降低醋酸菌的产酸速度。而在动物细胞中,甲酸也被发现对人淋巴细胞具有显著的遗传毒性和细胞毒作用[25]。因此,进一步深入研究甲酸抑制原核生物醋酸菌的分子机制,解释甲酸在细菌生长、代谢中的调控作用将会成为日后醋酸发酵机制研究的一个重要方向。同时,甲酸耐受性也将为选育高性能醋酸菌提供一个重要的参考标准。
4 结论
本研究对不同来源的食用酒精对于醋酸发酵速率的影响进行了比较,结果显示酒精来源对于醋酸发酵有明显影响,通过GC-MS分析了各种酒精的挥发性微量成分,PCA降维、聚类分析预测甲酸、甲酸乙酯、戊酸-1,2-烯丙基酯、亚硫酸己基辛酯、草酸、丁基-6-乙基-3-酯、乙酸、甘油等微量成分可能影响醋酸发酵,发酵实验表明添加100 μg/mL甲酸和500 μg/mL甲酸乙酯能显著影响醋酸菌发酵速度,本研究结果为醋酸生产厂家相应的行业标准的制定提供参考。
[1] HO C W, LAZIM A M, FAZRY S, et al. Varieties, production, composition and health benefits of vinegars: A review[J]. Food Chemistry,2016,221(2 017):1 621-1 630.
[2] 赵良启, 李丽. 我国食醋生产技术的历史、现状与发展趋势(下)[J]. 中国调味品, 2005(1):3-6.
[3] 秦兴, 卢红梅,陈莉. 醋酸菌的分子分类学研究和在食醋生产中的应用[J]. 中国酿造, 2017(6):1-8.
[4] 白雪峰. 老陈醋成分分析及液态发酵工艺探讨[J]. 食品安全导刊, 2 016(12):129-130.
[5] 姚洪礼, 李兴江,郑志,等. 基于16SrDNA的醋酸菌筛选及其发酵特性[J]. 食品科学, 2017, 38(4):6-12.
[6] 管彬彬, 赵杰文,金鸿娟,等. 醋醅种子温度对食醋品质的影响[J]. 食品与发酵工业, 2015, 41(9):74-78.
[7] ZHENG Y, ZHANG K, WANG C, et al. Improving acetic acid production of Acetobacter pasteurianus AC2005 in hawthorn vinegar fermentation by using beer for seed culture[J]. International Journal of Food Science & Technology, 2010, 45(11):2 394-2 399.
[8] 陈蔚青, 程长平. 30M~3标准型通风发酵罐进行液态深层米醋发酵的应用研究[J]. 中国调味品, 2001(10):30-32.
[9] 江源.《食品安全国家标准食用酒精》今年6月23日起实施[J]. 酿酒科技, 2017(2):36.
[10] GAVAMUKULYA Y, ABOU-ELLELA F, WAMUNYOKOLI F, et al. GC-MS Analysis of bioactive phytochemicals present in ethanolic extracts of leaves of annona muricata: A further evidence for its medicinal diversity[J]. Pharmacognosy Journal, 2015, 7(5):300-304.
[11] 马凯, 武会娟,刘悦,等.一种传统发酵酵子细菌多样性及挥发性发酵产物分析[J]. 食品与发酵工业, 2018,44(2):202-208.
[12] 韩基明. 红枣醋发酵工艺响应面优化及其化学成分分析[J]. 北方园艺, 2018(11):132-137.
[13] 熊岑, 苏志义,郑彦婕,等. 基于多化学组分的模式识别法在地理标志食醋真伪鉴别中的应用[J]. 食品与发酵工业, 2016, 42(10):156-162.
[14] 周世坤, 许大年,赵冲林,等. 气相色谱-质谱法检测土壤中微量芥子气[J]. 现代仪器与医疗, 2007, 13(1):60-61.
[15] NEI D, ENOMOTO K, NAKAMURA N,et al. A gaseous acetic acid treatment to disinfect fenugreek seeds and black pepper inoculated with pathogenic and spoilage bacteria [J]. Food Microbiology, 2015(49):226-230.
[16] 张义杰, 谷云,祁勇刚,等. 不同发酵方法酿造西瓜醋的挥发性成分分析[J]. 中国酿造, 2016, 35(1):156-160.
[17] PINU F R, SAMUEL C S, PAULA T U A, et al. Vinegar metabolomics: An explorative study of commercial balsamic vinegars using gas chromatography-mass spectrometry [J]. Metabolites, 2016, 6(3):2-15.
[18] 李莹, 刘敏,崔春,等. 酱油抗氧化能力评价及聚类分析[J]. 食品与发酵工业, 2008, 34(1):14-19.
[19] YU Z, ZHANG R, YIN H, et al. Acetobacter pasteurianus, metabolic change induced by initial acetic acid to adapt to acetic acid fermentation conditions[J]. Applied Microbiology & Biotechnology, 2017, 101(18):7 007-7 016.
[20] JEONG D W, HEO S, LEE B, et al. Effects of the predominant bacteria from meju and doenjang on the production of volatile compounds during soybean fermentation[J]. International Journal of Food Microbiology, 2017(262):8-13.
[21] 周永治. 食醋的生产原理[J]. 江苏调味副食品,2 007(4):21-24.
[22] MILLET V,LONVAUD‐FUNEL A. The viable but non-culturable state of wine micro-organisms during storage[J]. Letters in Applied Microbiology,2000,30(2):136-141.
[23] 李欣,黄芳,常旭,等.醋酸菌的营养特性分析及研究进展[J].食品研究与开发,2018,39(15): 219-224.
[24] 谭霄, 曾林,赵婷婷,等. 产γ-氨基丁酸酿酒酵母JM037酿造桑葚酒风味物质分析[J]. 食品与发酵工业, 2017, 43(12): 191-198.
[25] AKSU P, NUR G, GULKAN S, et al. Genotoxic and cytotoxic effects of formic acid on human lymphocytes in vitro[J]. Türk Hijiyen Ve Deneysel Biyoloji Dergisi Turkish Bulletin of Hygiene & Experimental Biology, 2016, 73(2):111-120.