虎斑乌贼(Sepia pharaonis Ehrenberg, 1831),别称花旗、花西、墨姆,隶属于软体动物门(Mollusca)、头足纲(Cephalopoda)、乌贼目(Sepiida)、乌贼科(Sepiidae)、乌贼属(Sepia),主要分布于印度洋至西太平洋海域,在我国南海分布广泛[1-2]。作为重要的经济头足类物种,虎斑乌贼具有肉质鲜美、营养丰富、养殖潜力大、抗病力强、生长迅速等特点,受到国内外研究学者的广泛关注[3]。目前,对虎斑乌贼的研究主要集中在生物学特性[4-6]、养殖技术[7-8]及天然活性物质的提取和应用[9-11]等方面,而对于虎斑乌贼蛋白质来源的抗氧化活性肽的研究还鲜见报道。生殖腺是虎斑乌贼副产物的重要组成部分,占体质量的4%~7%,具有高蛋白、低脂肪的特点,是一种非常理想的蛋白质来源[12],极具开发前景。
目前,国内外关于抗氧化活性肽的制备主要集中于商业蛋白酶酶解法,而对于发酵法制备抗氧化活性肽的研究相对较少[13]。与酶解法相比,微生物蛋白酶来源广泛,种类繁多,且微生物代谢产生的胞外酶不用分离,降低了生产成本[14]。枯草芽孢杆菌(Bacillus subtilis)具有产酶能力强、发酵周期短、相对耐高温、生产难度小等特点,在各行各业中应用广泛[15]。目前,利用枯草芽孢杆菌及其蛋白酶水解蛋白质制备抗氧化活性肽的研究,已取得了一定的成效[16-17]。本文以虎斑乌贼生殖腺作为枯草芽孢杆菌(Bacillus subtilis)的唯一发酵基质,以发酵液的蛋白酶活力和非蛋白氮含量为评价指标,研究底物浓度、培养基的初始pH值、发酵温度和发酵时间对发酵过程的影响。
1 材料与方法
1.1 材料与试剂
虎斑乌贼:购于广东省湛江市霞山水产品批发市场,解剖取生殖腺,经冻干、粉碎后,于-18 ℃贮藏备用;枯草芽孢杆菌CICC 20030:购于中国工业微生物菌种保藏管理中心;其他试剂:国产分析纯。
1.2 仪器与设备
紫外可见分光光度计(UV-3000型),上海美谱达仪器有限公司;冷冻干燥机(LGJ-18型),北京四环科学仪器厂;中草药粉碎机(FW135型),天津市泰斯特仪器有限公司;高速组织捣碎机(DS-1型),上海标本模型厂;恒温培养振荡器(HNY-200B型),天津欧诺仪器股份有限公司;生化培养箱(SPL-250型),天津市莱玻特瑞仪器设备有限公司;超净工作台(CJ-2S型),天津市泰斯特仪器有限公司;立式压力蒸汽灭菌锅(YXQ-LS-75SⅡ型),上海博讯实业有限公司;多参数分析仪(DZB-718-B型),上海仪电科学仪器股份有限公司;索氏提取器(SXT-06型),上海洪纪仪器设备有限公司;全自动氨基酸分析仪(S-433D型),德国塞卡姆公司;全自动凯氏定氮仪(K9860型),济南海能仪器股份有限公司。
1.3 培养基
营养琼脂培养基:牛肉膏3 g/L,蛋白胨10 g/L,NaCl 5 g/L,琼脂18 g/L,pH 7.0;种子培养基:牛肉膏3 g/L,蛋白胨10 g/L,NaCl 5 g/L,pH 7.0;液体发酵培养基:以虎斑乌贼生殖腺为底物的培养基。
1.4 方法
1.4.1 菌种的活化与种子液的制备
将枯草芽孢杆菌在营养琼脂培养基中活化,于37 ℃恒温培养箱中培养24 h后,挑选形态正常、生长良好的单菌落接种至种子培养基中,于37 ℃、180 r/min摇床培养24 h,即得枯草芽孢杆菌种子液。
1.4.2 乌贼生殖腺发酵工艺的优化
在固定发酵总量50 mL、菌种接种量10%(V/V)、摇床转速180 r/min的条件下,以蛋白酶活力和非蛋白氮含量作为评价指标,分别研究发酵底物质量浓度(10、20、30、40、50 mg/mL)、培养基的初始pH值(5、6、7、8、9)、发酵温度(30、34、37、40 ℃)和发酵时间(12、24、36、48、60 h)对发酵过程的影响。在上述单因素实验的基础上,对发酵底物质量浓度、初始pH值、发酵温度和发酵时间进行L9(34)正交实验,优化枯草芽孢杆菌发酵虎斑乌贼生殖腺的工艺流程。
1.4.3 乌贼生殖腺多肽的制备工艺
乌贼生殖腺原料粉→加水匀浆并调节pH值→高温灭菌(121 ℃,20 min)→接种→发酵→沸水浴(100 ℃,15 min)→冷却→离心(6 000 r/min,30 min)→上清液→冷冻干燥→虎斑乌贼生殖腺粗肽样品(SPGPs)
1.4.4 理化指标的检测
蛋白质含量的测定参照GB 5009.5—2016《食品中蛋白质的测定》,采用凯氏定氮法;脂肪含量的测定参照GB 5009.6—2016《食品中脂肪的测定》,采用索氏提取法;水分含量的测定参照GB 5009.3—2016《食品中水分的测定》,采用直接干燥法;灰分的测定参照GB 5009.4—2016《食品中灰分的测定》,采用高温灼烧法。
1.4.5 发酵液蛋白酶活力的测定
蛋白酶活力的测定参照GBT 23527—2009《蛋白酶制剂》中的福林法进行测定。酶活力单位定义为:1 mL酶液在40 ℃、pH值为7.5的条件下,每分钟水解酪蛋白产生1 μg酪氨酸,即为1个酶活力单位,以U/mL表示。
酶活力标准曲线的绘制:取质量浓度为0、10、20、30、40、50、60 mg/mL的L-酪氨酸标准溶液各1 mL,分别加入5 mL Na2CO3溶液(42.4 g/L)、1 mL福林试剂,混匀后,于40 ℃水浴显色20 min,以不含酪氨酸的0管为空白,测定其在680 nm处的吸光值。以吸光度A为纵坐标,酪氨酸浓度为横坐标,绘制标准曲线y=0.010 6x-0.002(R2=0.999 9)。
1.4.6 发酵液中非蛋白氮含量的测定
取发酵后的上清液,加入等体积三氯乙酸(trichloroacetic acid, TCA)溶液(150 g/L),混匀后,室温静置30 min,于6 000 r/min离心20 min,用凯氏定氮法测定上清液中非蛋白(包括多肽和氨基酸)氮的含量。
1.4.7 氨基酸组分分析
氨基酸含量的测定参照GB 5009.124—2016《食品中氨基酸的测定》,采用氨基酸分析仪测定样品中酸水解氨基酸的组成和含量。
1.4.8 羟自由基清除能力的测定
参照文献[18]的方法并作适当修改。向试管中依次加入0.5 mL FeSO4溶液(6 mmol/L)、0.5 mL水杨酸-乙醇溶液(6 mmol/L)及0.5 mL样液,最后加入0.5 mL H2O2溶液(6 mmol/L)启动反应,并用蒸馏水补至总体积为5 mL。其中,对照管不加样液,底管不加H2O2,混匀后于37 ℃水浴中保温30 min,测定其在波长510 nm处的吸光值。以抗坏血酸作为阳性对照,按式(1)计算清除率:
清除率![]()
(1)
式中:A0,对照管的吸光值;A,样品管的吸光值;AD,底管的吸光值。
1.4.9 超氧阴离子自由基清除能力的测定
参照文献[19]的方法并作适当修改。向试管中依次加入1 mL样液、5 mL Tris-HCl缓冲液(0.1 mol/L, pH 8.2),混匀后,于25 ℃水浴中保温10 min,取出后立即加入0.3 mL邻苯三酚溶液(3 mmol/L),迅速摇匀后倒入比色皿,每隔30 s测定其在波长320 nm处的吸光值,持续4 min。以蒸馏水代替样液作为空白对照,以抗坏血酸作为阳性对照,计算线性范围内每分钟吸光度的增加量。按式(2)计算清除率:
清除率![]()
(2)
式中:A0,空白对照的吸光值;A,样品组的吸光值。
1.4.10 亚铁离子螯合能力的测定
参照文献[20]的方法并作适当修改。向试管中依次加入1 mL样液、3.7 mL蒸馏水及0.1 mL FeSO4溶液(2 mmol/L),混匀后室温静置5 min,加入0.2 mL菲洛嗪溶液(5 mmol/L),混匀后室温静置10 min。以蒸馏水代替样液作为空白对照,以乙二胺四乙酸(EDTA)作为阳性对照,测定其在波长562 nm处的吸光值。按式(3)计算螯合率:
螯合率![]()
(3)
式中:A0,空白对照的吸光值;A,样品组的吸光值。
2 结果与分析
2.1 乌贼生殖腺原料粉的基本成分分析
由表1可知,虎斑乌贼生殖腺原料粉中粗蛋白质和粗脂肪含量分别为62.71 g/100g和0.52 g/100g,是一种高蛋白、低脂肪的优质蛋白质来源。其灰分含量相对较高,达6.64 g/100g,这可能与海洋环境有关。戴宏杰等[12]的研究也表明,雌性虎斑乌贼缠卵腺的粗蛋白质和粗脂肪含量分别为18.40 g/100g和0.16 g/100g(以鲜重计),且其氨基酸种类丰富,组成和比例合理,具有很高的营养价值和开发潜力。
表1 虎斑乌贼生殖腺原料粉的基本成分 单位:g/100g
Table 1 Elementary composition in cuttlefish(Sepia pharaonis) gonads power
水分粗蛋白质粗脂肪灰分2.32±0.0662.71±0.200.52±0.026.64±0.03
2.2 乌贼生殖腺发酵工艺的优化
2.2.1 发酵底物浓度对蛋白酶活力和非蛋白氮含量的影响
由图1可知,在一定的范围内,随着底物浓度的增加,发酵液的蛋白酶活力不断增加,当底物质量浓度达到30 mg/mL时,发酵液的蛋白酶活力达到最大值,而后逐渐下降。这可能是因为底物浓度过低时,培养基营养不足,导致菌株的生长或产酶受到限制;而底物浓度过高时,培养基的黏度过高影响通气,从而导致菌株的蛋白酶活力降低。而底物质量浓度在10~50 mg/mL,发酵液中的非蛋白氮含量与底物浓度始终呈正相关。结合成本和节约等因素,选择30 mg/mL作为最适的底物浓度。
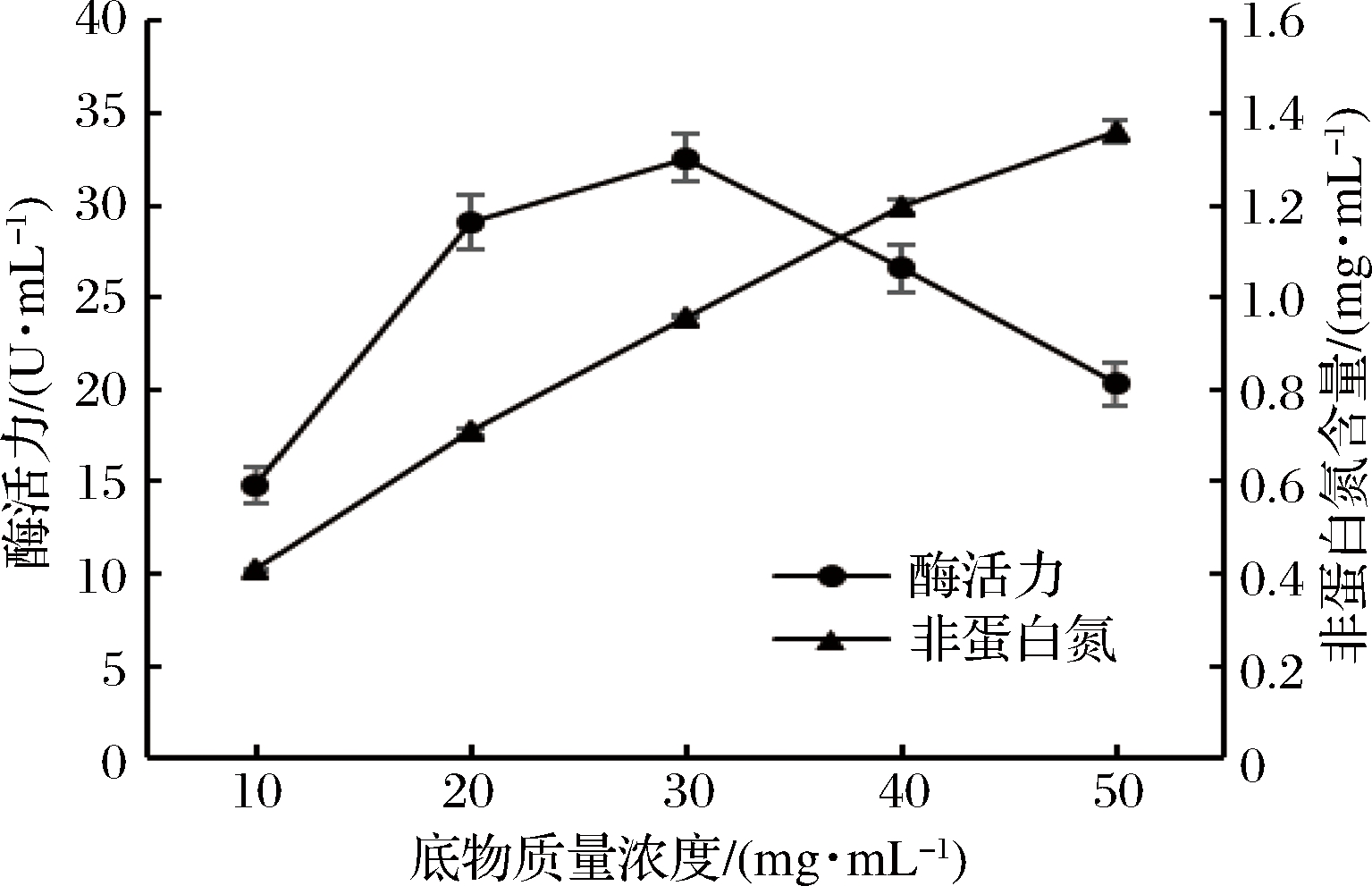
图1 底物浓度对酶活力和非蛋白氮含量的影响
Fig.1 Effect of substrate concentration on enzyme activity and non-protein nitrogen contents
2.2.2 初始pH值对蛋白酶活力和非蛋白氮含量的影响
由图2可知,随着培养基初始pH值的升高,发酵液的蛋白酶活力和非蛋白氮含量均有所增加。当初始pH值为6.0时,蛋白酶活力和非蛋白氮含量均达到最大值,继续升高pH值,蛋白酶活力迅速下降,非蛋白氮含量也开始缓慢降低。这主要是因为培养基的初始pH值会影响菌株的生长繁殖及相关代谢产物的生物合成途径,初始pH值过高或者过低,都会影响蛋白酶的合成和积累,并进一步影响非蛋白氮含量的增加。因此,选择初始pH 6.0作为培养基的最适pH值。
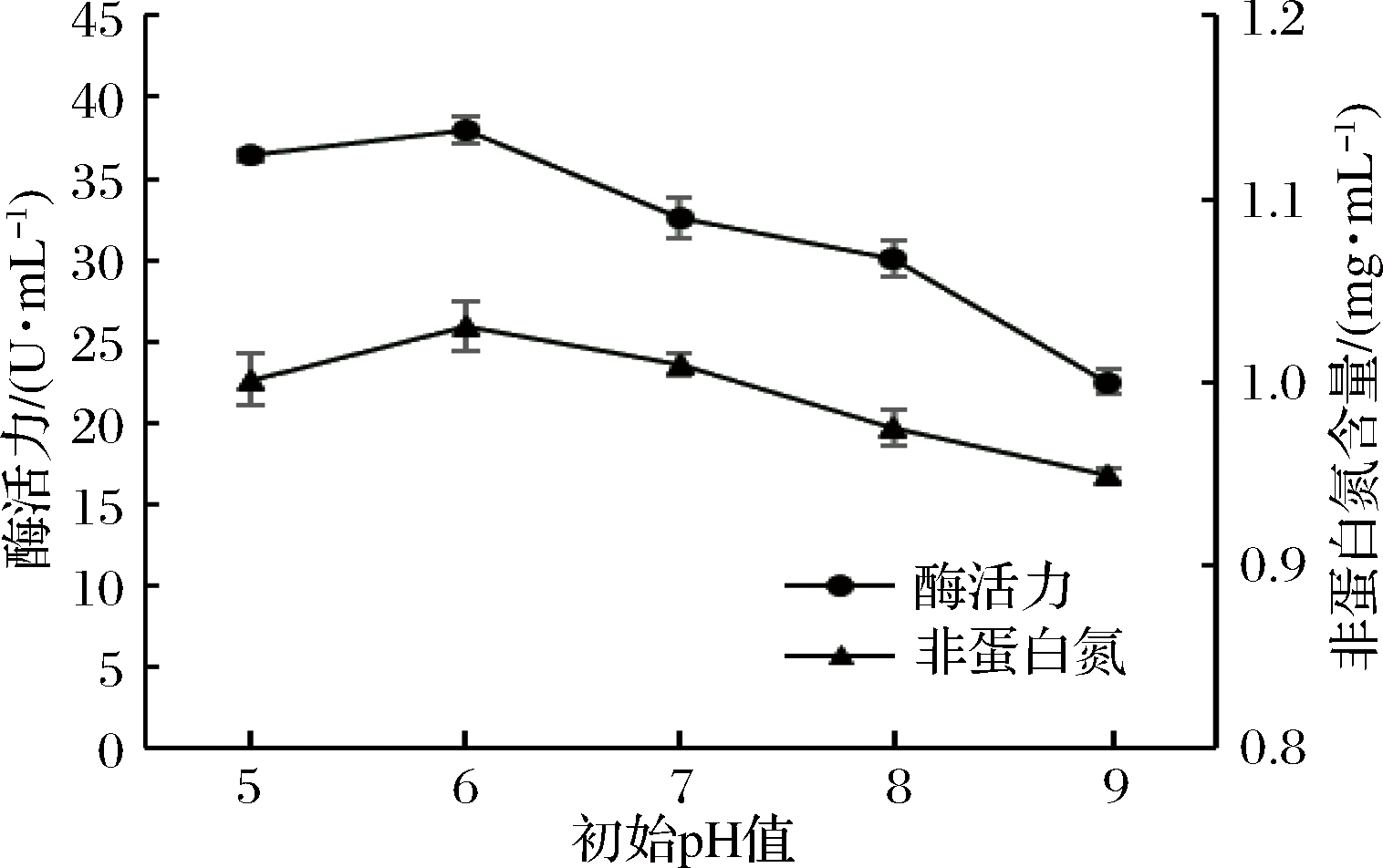
图2 初始pH值对酶活力和非蛋白氮含量的影响
Fig.2 Effect of initial pH on enzyme activity and non- proteinlnitrogen contents
2.2.3 发酵温度对蛋白酶活力和非蛋白氮含量的影响
发酵温度是影响微生物生长及代谢产物积累的重要因素。由图3可知,随着发酵温度的升高,发酵液的蛋白酶活力增加,34 ℃时,蛋白酶活力达到最大,此后迅速下降。而在30~40 ℃,发酵液的非蛋白氮含量与发酵温度始终呈正相关。主要原因可能是该菌株的最适产酶温度(34 ℃)与酶解反应的最适温度不一致。随着温度的升高,酶解反应的速率逐渐增加,使发酵液的非蛋白氮含量不断增加。在本次实验中,超过34 ℃后,发酵液的蛋白酶活力迅速下降,而非蛋白氮含量的增加相对缓慢。因此,选择34 ℃作为最适的发酵温度。
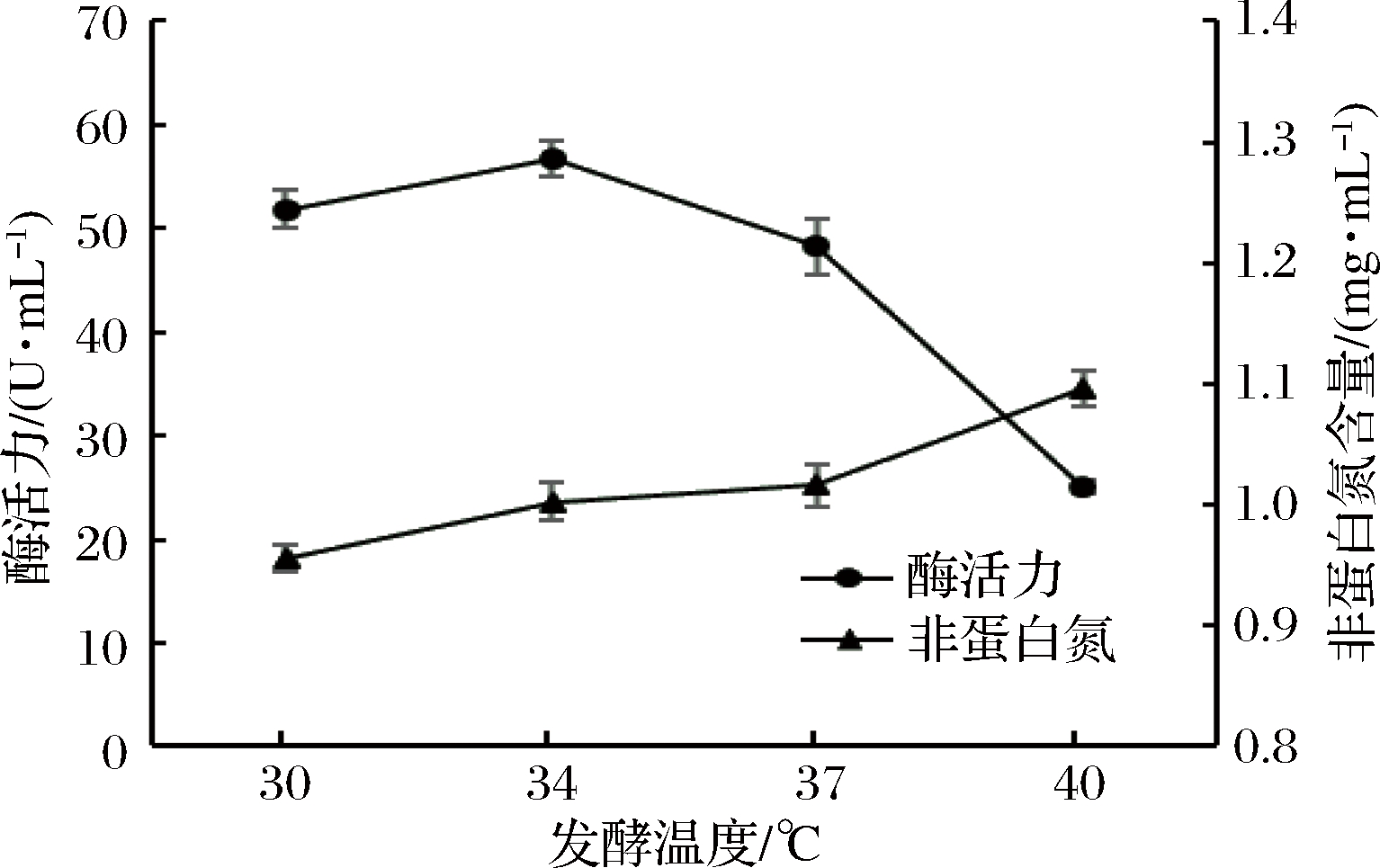
图3 发酵温度对酶活力和非蛋白氮含量的影响
Fig.3 Effect of incubation temperature on enzyme activity and non-protein nitrogen contents
2.2.4 发酵时间对蛋白酶活力和非蛋白氮含量的影响
由图4可知,随着发酵时间的增加,发酵液的蛋白酶活力和非蛋白氮含量均有所增加,在发酵时间达到48 h时,发酵液的蛋白酶活力达到最大值,之后又迅速下降。发酵液的非蛋白氮含量在60 h时达到最大,此后缓慢下降。原因可能是随着发酵时间的增加,有害产物的不断积累,菌种逐步进入衰退期,使发酵液的酶活力降低,并进一步导致发酵液的非蛋白氮含量降低。考虑到发酵效率等因素,选择48 h作为最适的发酵时间。
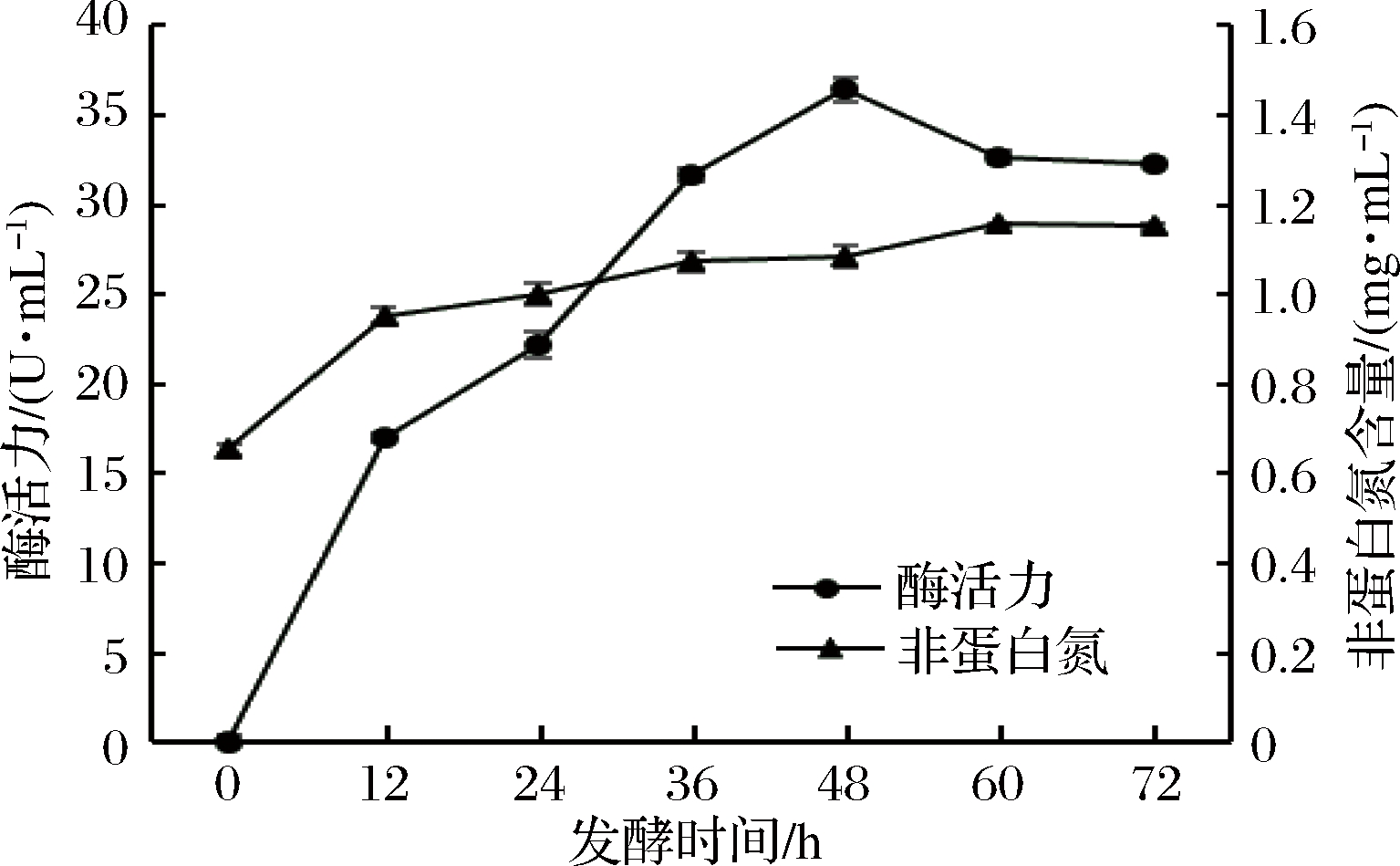
图4 发酵时间对酶活力和非蛋白氮含量的影响
Fig.4 Effect of fermentation time on enzyme activity and non-protein nitrogen contents
2.2.5 正交试验
在上述单因素实验的基础上,以蛋白酶活力和非蛋白氮含量为评价指标,选取发酵底物浓度(A)、培养基的初始pH值(B)、发酵温度(C)和发酵时间(D)进行L9(34)正交试验,结果见表2。
表2 正交试验结果
Table 2 Results of orthogonal experiment
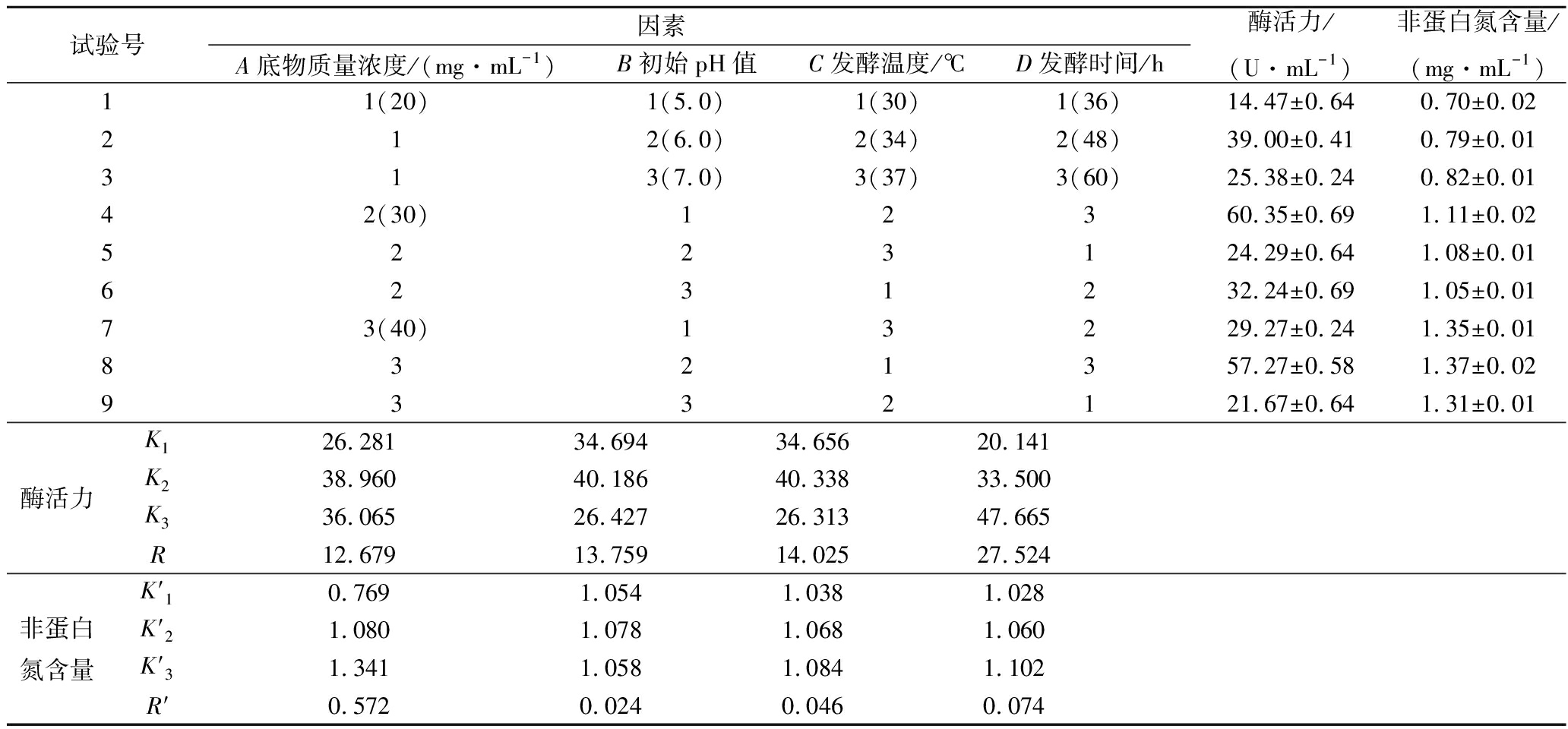
试验号因素A底物质量浓度/(mg·mL-1)B初始pH值C发酵温度/℃D发酵时间/h酶活力/(U·mL-1)非蛋白氮含量/(mg·mL-1)11(20)1(5.0)1(30)1(36)14.47±0.640.70±0.02212(6.0)2(34)2(48)39.00±0.410.79±0.01313(7.0)3(37)3(60)25.38±0.240.82±0.0142(30)12360.35±0.691.11±0.025223124.29±0.641.08±0.016231232.24±0.691.05±0.0173(40)13229.27±0.241.35±0.018321357.27±0.581.37±0.029332121.67±0.641.31±0.01酶活力K126.28134.69434.65620.141K238.96040.18640.33833.500K336.06526.42726.31347.665R12.67913.75914.02527.524非蛋白氮含量K′10.7691.0541.0381.028K′21.0801.0781.0681.060K′31.3411.0581.0841.102R′0.5720.0240.0460.074
由表2可知,发酵过程中,各因素对蛋白酶活力影响的主次顺序为D>C>B>A,最优组合为A2B2C2D3。各因素对非蛋白氮含量影响的主次顺序为A>D>C>B,最优组合为A3B2C3D3。由于上述2个指标独立分析后得出的最佳发酵条件不同,因此,需要对2个指标进行综合分析以确定最终的发酵工艺。在本次实验中,蛋白酶活力作为主要的评价指标,能够更加直观而准确地反映菌种的生长及产酶情况,并进一步影响多肽的产量。而非蛋白氮含量侧面反映了发酵过程中大分子蛋白质降解为小分子肽和氨基酸的动态变化,可作为辅助性指标监视蛋白质的水解程度。底物浓度对非蛋白氮含量影响较大,对酶活力影响较小,但考虑到发酵成本以及底物浓度过高时,底物粘壁严重等问题,选择A2作为最适的底物浓度水平。发酵温度对蛋白酶活力的影响大于非蛋白氮含量,因此,选择C2作为最适的发酵温度。初始pH值和发酵时间均为B2和D3最佳。
根据正交试验结果进行综合分析,选择A2B2C2D3作为发酵的最佳组合条件,即发酵底物浓度30 mg/mL,培养基的初始pH值6.0,发酵温度34 ℃,发酵时间60 h。在此条件下,发酵液的蛋白酶活力为(66.66±0.64) U/mL,非蛋白氮含量为(1.10±0.02) mg/mL。
2.3 乌贼生殖腺发酵物的抗氧化活性
2.3.1 羟自由基清除能力
羟自由基(·OH)是体内最活泼、进攻性最强的活性氧自由基,能够杀死红细胞,降解DNA、细胞膜和多糖化合物,具有很高的危害性[24]。
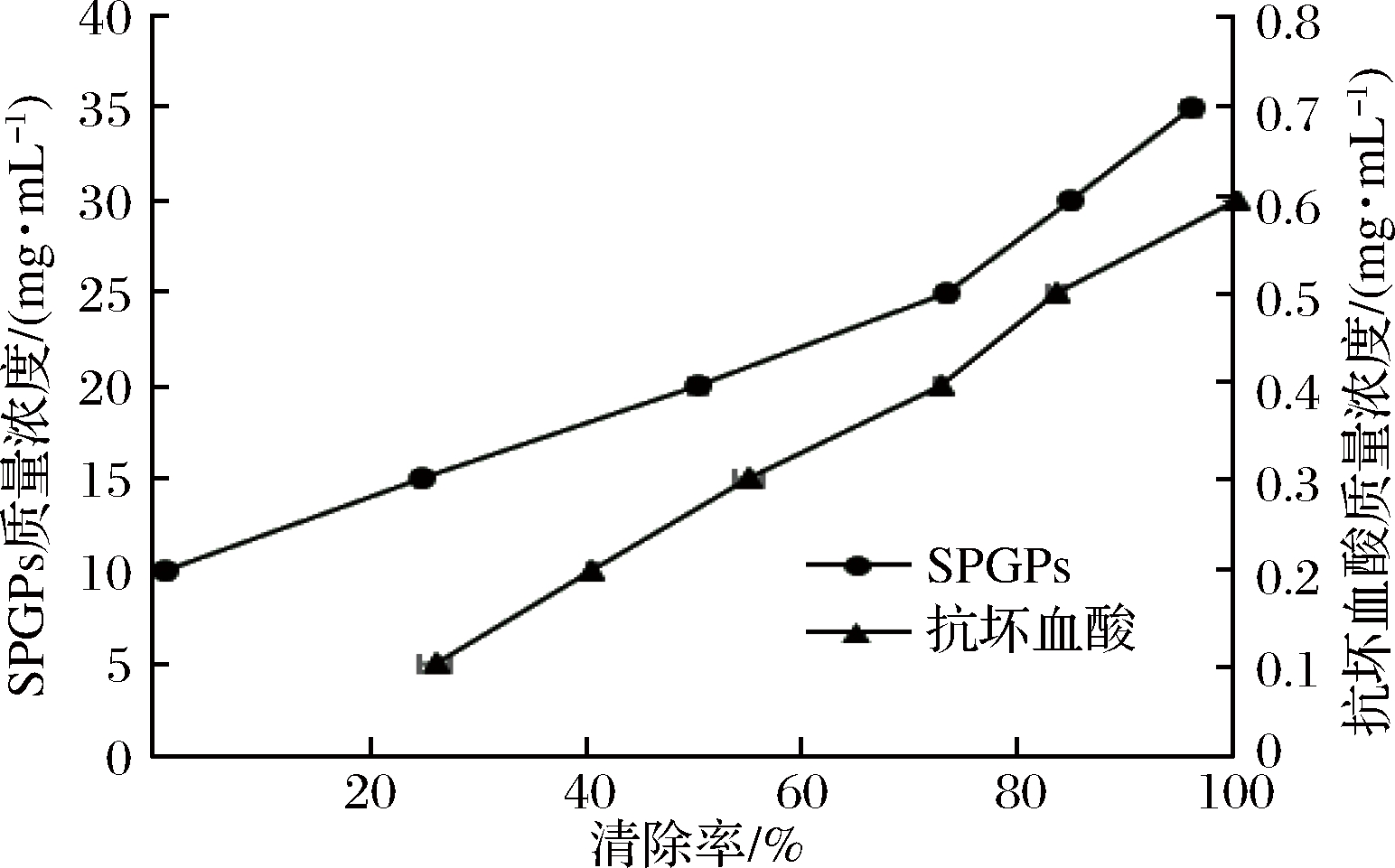
图5 SPGPs和抗坏血酸的羟自由基清除能力
Fig.5 Hydroxyl free radical scavenging abilities of SPGPs and ascorbic acid
由图5可知,抗坏血酸具有很强的·OH清除能力,SPGPs的清除能力相对较弱。随着SPGPs浓度的增加,其·OH清除能力逐渐增加,当SPGPs的浓度达到35 mg/mL时,其·OH清除率可达92.02%。对浓度和清除率之间作回归方程并计算半抑制浓度(IC50),得到SPGPs清除·OH的IC50值为19.40 mg/mL,高于金枪鱼多肽(IC50=28.81 mg/mL)[25]。总的来说,SPGPs具有一定的·OH清除能力。
2.3.2 超氧阴离子自由基清除能力
超氧阴离子自由基是人体内产生的活性氧自由基,过高会导致机体损伤和疾病发生[23]。由图6可知,与抗坏血酸相比,SPGPs的清除能力相对较弱,其清除率随SPGPs浓度的增加而增加。当SPGPs浓度为15 mg/mL时,其清除率为61.10%,随后清除率变化减慢。对浓度和清除率之间作回归方程,计算得到SPGPs清除的IC50值为8.90 mg/mL。杨涛等[24]用碱性蛋白酶水解海参内脏制备了海参多肽,其清除的IC50值为21.6 mg/mL。胡小军等[25]用复合蛋白酶酶解鱿鱼蛋白制备抗氧化肽,其酶解产物清除的IC50值为10.3 mg/mL,均低于SPGPs。综上分析表明,SPGPs具有良好的清除能力。
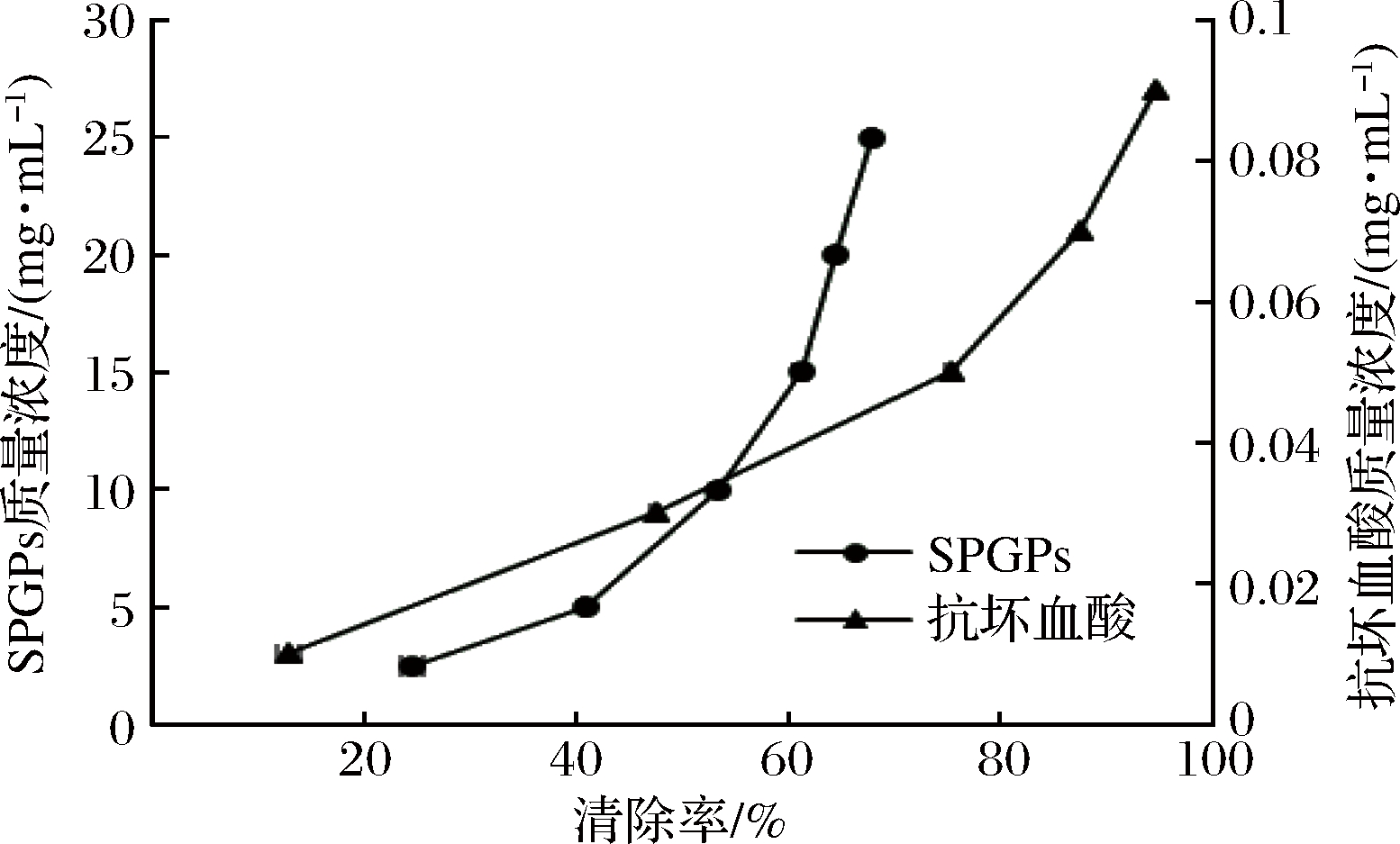
图6 SPGPs和抗坏血酸的超氧阴离子自由基清除能力
Fig.6 Superoxide anion radical scavenging abilities of SPGPs and ascorbic acid
2.3.3 亚铁离子螯合能力
过渡金属离子,如Fe2+和Cu2+,能够参与体内的许多氧化反应,催化·OH等自由基的产生并介导脂质过氧化[26]。由图7可知,SPGPs具有一定的Fe2+螯合能力,且螯合能力随SPGPs浓度的增加而增加,具有很好的量效关系。
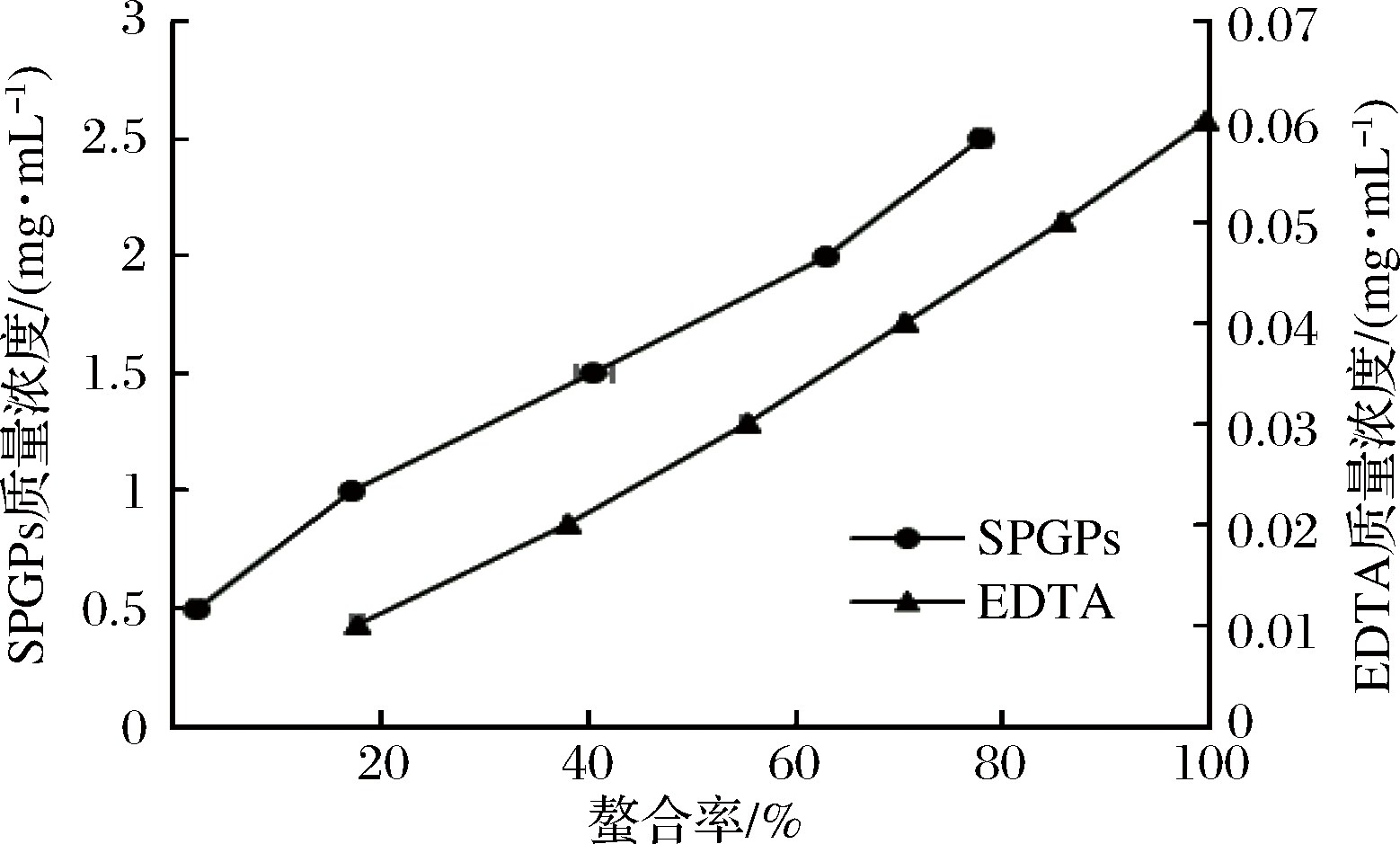
图7 SPGPs和EDTA的亚铁离子螯合能力
Fig.7 Ferrous ion chelating power of SPGPs and EDTA
当SPGPs质量浓度达到2.5 mg/mL时,其Fe2+螯合率达到78.00%。对浓度和螯合率之间作回归方程,计算得到SPGPs螯合Fe2+的IC50值为1.75 mg/mL。但与阳性对照EDTA相比,SPGPs螯合Fe2+的能力相对较弱,这可能与SPGPs的纯度有关。ZHOU等[27]利用木瓜蛋白酶水解光棘球海胆(Strongylocentrotus nudus)生殖腺,酶解产物经10 kDa超滤膜过滤后,其螯合Fe2+的IC50值为7.26 mg/mL。郑杰等[28]用木瓜蛋白酶酶解海蜇生殖腺,得到酶解产物Fe2+螯合能力的IC50值为1.73 mg/mL,这与本次实验结果相近。综上所述,SPGPs具有良好的Fe2+螯合能力。
2.4 SPGPs的氨基酸组成分析
由表3可知,SPGPs的氨基酸组成中Lys的含量最高,占总氨基酸含量的11.1%,其次分别是Asp(10.7%)、His(9.3%)、Glu(8.8%)、Thr(8.7%)和Phe(7.3%)。其必需氨基酸(essential amino acid,EAA)含量丰富,组成合理,占总氨基酸(total amino acid,TAA)含量的42.1%,具有较高的营养价值。
表3 SPGPs的氨基酸组成分析
Table 3 Amino acid composition of SPGPs

氨基酸名称含量/(mg·g-1)占比/%氨基酸名称含量/(mg·g-1)占比/%天冬氨酸Asp29.310.7酪氨酸Tyr17.76.5苏氨酸Thr★23.78.7苯丙氨Phe★20.07.3丝氨酸Ser9.83.6组氨酸His25.69.3谷氨酸Glu24.08.8赖氨酸Lys★30.411.1甘氨酸Gly15.85.8精氨酸Arg8.33.0丙氨酸Ala8.53.1脯氨酸Pro17.16.2缬氨酸Val★11.84.3EAA115.342.1蛋氨酸Met★9.33.4AAA173.463.3异亮氨酸Ile★13.04.7HAA107.239.1亮氨酸Leu★9.83.6TAA274.1100.0
注:★表示必需氨基酸;抗氧化氨基酸(antioxidant amino acid,AAA)包括:Asp、Glu、Pro、Met、Tyr、Phe、His、Lys;疏水性氨基酸(Hydrophobic amino acids,HAA)包括:Pro、Ala、Val、Met、Ile、Leu、Tyr、Phe。
相关研究表明,多肽的抗氧化活性与氨基酸的组成和序列密切相关,疏水性氨基酸及His、Lys等氨基酸含量较高的多肽往往具有更高的抗氧化活性[29]。在SPGPs中,疏水性氨基酸的含量为107.2 mg/g,占总氨基酸含量的39.1%。其抗氧化氨基酸的含量为173.4 mg/mL,占总氨基酸含量的63.3%,这也侧面印证了SPGPs具有较好的抗氧化潜力。另外,研究表明,His和酸性氨基酸(Asp、Glu)是参与金属螯合作用的重要氨基酸[30]。在SPGPs中Asp、His和Glu的含量都很高,分别为29.3、25.6和24.0 mg/g,这可能是SPGPs具有良好的Fe2+螯合能力的原因。
3 结论
以虎斑乌贼生殖腺作为枯草芽孢杆菌的唯一发酵基质,以发酵液的蛋白酶活力和非蛋白氮含量为评价指标,研究发酵的底物浓度、培养基初始pH值、发酵温度和发酵时间对发酵结果的影响。枯草芽孢杆菌发酵虎斑乌贼生殖腺的最佳条件为:底物质量浓度30 mg/mL,初始pH值6.0,发酵温度34 ℃,发酵时间60 h。在此条件下,发酵液的蛋白酶活力及非蛋白氮含量分别为(66.66±0.64) U/mL和(1.10±0.02) mg/mL。SPGPs具有一定的体外抗氧化活性,其羟自由基清除能力、超氧阴离子自由基清除能力及亚铁离子螯合能力的IC50值分别为19.40、8.90和1.75 mg/mL。氨基酸组成分析表明,SPGPs中Lys含量最高,其抗氧化氨基酸和疏水性氨基酸的含量分别占总氨基酸含量的63.3%和39.1%,具有很高的抗氧化潜力。采用枯草芽孢杆菌发酵虎斑乌贼生殖腺,制备得到的多肽具有良好的体外抗氧化活性,可以作为天然抗氧化剂或功能性食品添加剂应用于食品加工中。
[1] 董正之. 世界大洋经济头足类生物学[M]. 济南:山东科学技术出版社, 1991: 214-216.
[2] 陈新军, 刘必林,王尧耕. 世界头足类[M]. 北京:海洋出版社, 2009: 450-451.
[3] 陈道海, 郑亚龙. 虎斑乌贼(Sepia pharaonis)繁殖行为谱分析[J]. 海洋与湖沼, 2013, 44(4): 931-936.
[4] YIN Shangjun, ZHANG Linmeng, ZHANG Lili, et al. Metabolic responses and arginine kinase expression of juvenile cuttlefish (Sepia pharaonis) under salinity stress[J]. International Journal of Biological Macromolecules, 2018, 113: 881-888.
[5] 周爽男, 吕腾腾,陈奇成,等. 光照强度与光周期对虎斑乌贼胚胎发育的影响[J]. 应用生态学报, 2018, 29(6): 2 059-2 067.
[6] 陈道海, 王雁,梁汉青,等. 虎斑乌贼(Sepia pharaonis)胚胎发育及孵化历期观察[J]. 海洋与湖沼, 2012, 43(2): 394-400.
[7] 蒋霞敏, 罗江,彭瑞冰,等. 水泥池养殖条件下虎斑乌贼的生长特性[J]. 宁波大学学报(理工版), 2014, 27(2): 1-6.
[8] 阮鹏, 蒋霞敏,韩庆喜,等. 社会等级因素对虎斑乌贼生长、存活及相关酶活的影响[J]. 水产学报, 2016, 40(12):1 897-1 905.
[9] 孙玉林, 罗琴琴,冯梓欣,等. 响应面法优化虎斑乌贼内脏多糖提取工艺及抗氧化活性、吸湿保湿性能研究[J]. 食品工业科技, 2018, 39(10): 182-189.
[10] SHUSHIZADEH M R, POUR E M, ZARE A, et al. Persian gulf β-chitin extraction from Sepia pharaonis sp. cuttlebone and preparation of its derivatives[J]. Bioactive Carbohydrates and Dietary Fibre, 2015, 6(2): 133-142.
[11] KRISHNAMOORTHI J, RAMASAMY P, SHANMUGAM V, et al. Isolation and partial characterization of collagen from outer skin of Sepia pharaonis (Ehrenberg, 1831) from Puducherry coast[J]. Biochemistry and Biophysics Reports, 2017, 10: 39-45.
[12] 戴宏杰, 孙玉林,冯梓欣,等. 雌性虎斑乌贼缠卵腺营养成分分析与评价[J]. 食品科学, 2016, 37(14): 97-103.
[13] CHAI T T, LAW Y C, WONG F C, et al. Enzyme-assisted discovery of antioxidant peptides from edible marine invertebrates: a review[J]. Marine Drugs, 2017, 15(2): 42.
[14] 刘金龙. 鱼蛋白多肽的制备及其在农业生产中的应用[D]. 泰安:山东农业大学, 2017: 20-44.
[15] 马明, 杜金华. 枯草芽孢杆菌酶在工业生产中的应用[J]. 山东科学, 2006, 19(3):35-38.
[16] LASSOUED I, MORA L, BARKIA A, et al. Bioactive peptides identified in thornback ray skin's gelatin hydrolysates by proteases from Bacillus subtilis and Bacillus amyloliquefaciens[J]. Journal of Proteomics, 2015, 128: 8-17.
[17] 江敏, 胡小军,王标诗,等. 发酵法制备马氏珠母贝抗氧化多肽工艺及清除自由基的研究[J]. 食品与发酵科技, 2017, 53(4): 32-38.
[18] 钟群. 雪峰乌骨鸡活性肽制备及抗氧化功能测定[D]. 广州:华南农业大学, 2016: 23-24.
[19] 吴燕燕, 田倩,尚军,等. 合浦珠母贝抗氧化肽的性质及应用研究[J]. 食品工业科技, 2011, 32(11): 123-126.
[20] SILA A, SAYARI N, BALTI R, et al. Biochemical and antioxidant properties of peptidic fraction of carotenoproteins generated from shrimp by-products by enzymatic hydrolysis[J]. Food Chemistry, 2014, 148: 445-452.
[21] ARUOMA O I. Free radicals, oxidative stress, and antioxidants in human health and disease[J]. Journal of the American Oil Chemists Society, 1998, 75(2): 199-212.
[22] 龚志强, 王朋,赵玉谨,等. 金枪鱼碎肉水解液喷雾干燥工艺优化及抗氧化活性研究[J]. 安徽农业科学, 2015, 43(4): 297-299.
[23] FRIDOVICH I. Superoxide anion radical ![]() superoxide dismutases, and related matters[J]. Journal of Biological Chemistry, 1997, 272(30): 18 515-18 517.
superoxide dismutases, and related matters[J]. Journal of Biological Chemistry, 1997, 272(30): 18 515-18 517.
[24] 杨涛, 万端极,吴正奇,等. 海参内脏制备海参多肽工艺优化及其抗氧化测定[J]. 食品科技, 2014, 39(3): 218-222.
[25] 胡小军, 江敏,莫秋远,等. 鱿鱼肌肉蛋白肽的制备工艺优化及其抗氧化活性[J]. 食品工业科技, 2017, 38(5):191-195.
[26] STOHS S J, BAGCHI D. Oxidative mechanisms in the toxicity of metal ions[J]. Free Radical Biology and Medicine, 1995, 18(2): 321-336.
[27] ZHOU Dayong, QIN Lei, ZHU Beiwei, et al. Optimisation of hydrolysis of purple sea urchin (Strongylocentrotus nudus) gonad by response surface methodology and evaluation of in vitro antioxidant activity of the hydrolysate[J]. Journal of the Science of Food and Agriculture, 2012, 92(8): 1 694-1 701.
[28] 郑杰, 于笛,陈冲,等. 海蜇生殖腺酶解物抗氧化活性的研究[J]. 水产科学, 2014, 33(2): 81-86.
[29] JE J Y, PARK S Y, HWANG J Y, et al. Amino acid composition and in vitro antioxidant and cytoprotective activity of abalone viscera hydrolysate[J]. Journal of Functional Foods, 2015, 16: 94-103.
[30] UDENIGWE C C, ALUKO R E. Chemometric analysis of the amino acid requirements of antioxidant food protein hydrolysates[J]. International Journal of Molecular Sciences, 2011, 12(5): 3 148-3 161.