醋酸菌是一种革兰氏阴性专性好氧菌,属于α-变形杆菌的Acetobacteraceae[1]。醋酸菌具有“氧化发酵”的特殊能力,在发酵过程中会将乙醇逐渐氧化为乙酸。醋酸发酵是底物和产物抑制发酵进行的典型例子。随着发酵过程的进行,乙酸逐渐积累,在质量浓度5 g/L下产生较强的细胞毒性[2-3],对菌体细胞施加严重的酸胁迫压力,这极大地降低了醋酸发酵生产效率,因此改善醋酸杆菌的耐酸特性具有重要的意义。
前期研究工作已有较多的关于醋酸菌属的耐酸性及其改进的相关报道![]() 等[4]比较了醋酸菌中不同属之间adhA的序列和活性,发现具有较高产酸活性的菌株在乙酸条件下表现出更稳定的吡咯喹啉依赖性醇脱氢酶(pyrroloquinolinequinone alcohol dehydrogenase, PQQ-ADH)活性。基因簇aarABC,首先被鉴定与AAB(acetic acid bacteria)中的乙酸耐受性相关[5]。此外,ABC转运蛋白和膜组成的改变参与乙酸耐受性机理[6-9]。人们普遍认为,耐酸性机制主要是由质子泵、代谢改变、细胞密度和细胞膜改变组成[10]。对于醋酸菌而言,质子泵对其耐酸能力至关重要,其由F1F0-ATPase,阳离子转运ATP酶和ABC转运蛋白形成,在维持内部pH值接近中性时发挥关键作用,都与ATP密切相关[6, 11]。当大多数微生物暴露于不利环境时,改变其形态学特性可能是对逆境最显著和可视化的表型反应,乙酸浓度增加时,菌体细胞通过增加主要不饱和脂肪酸的浓度来改变细胞总脂肪酸组成。例如乙酸通过增加顺十八碳烯酸的含量来改变Ga.europaeus V3的总脂肪酸和磷脂酰甘油组成[7]。氨基酸对A. pasteurianus的生长和发酵具有影响,并参与酸胁迫下的耐受性[12-15]。尽管目前已经报道了几种醋酸菌中乙酸耐受性的分子机制,但尚未完全了解微环境水平的乙酸胁迫协作应答机制,这制约了进一步解析基因型-表型之间的关系,从而阻碍了改进和提高醋酸杆菌的耐酸性。
等[4]比较了醋酸菌中不同属之间adhA的序列和活性,发现具有较高产酸活性的菌株在乙酸条件下表现出更稳定的吡咯喹啉依赖性醇脱氢酶(pyrroloquinolinequinone alcohol dehydrogenase, PQQ-ADH)活性。基因簇aarABC,首先被鉴定与AAB(acetic acid bacteria)中的乙酸耐受性相关[5]。此外,ABC转运蛋白和膜组成的改变参与乙酸耐受性机理[6-9]。人们普遍认为,耐酸性机制主要是由质子泵、代谢改变、细胞密度和细胞膜改变组成[10]。对于醋酸菌而言,质子泵对其耐酸能力至关重要,其由F1F0-ATPase,阳离子转运ATP酶和ABC转运蛋白形成,在维持内部pH值接近中性时发挥关键作用,都与ATP密切相关[6, 11]。当大多数微生物暴露于不利环境时,改变其形态学特性可能是对逆境最显著和可视化的表型反应,乙酸浓度增加时,菌体细胞通过增加主要不饱和脂肪酸的浓度来改变细胞总脂肪酸组成。例如乙酸通过增加顺十八碳烯酸的含量来改变Ga.europaeus V3的总脂肪酸和磷脂酰甘油组成[7]。氨基酸对A. pasteurianus的生长和发酵具有影响,并参与酸胁迫下的耐受性[12-15]。尽管目前已经报道了几种醋酸菌中乙酸耐受性的分子机制,但尚未完全了解微环境水平的乙酸胁迫协作应答机制,这制约了进一步解析基因型-表型之间的关系,从而阻碍了改进和提高醋酸杆菌的耐酸性。
本研究曾通过酸激复合紫外线诱变组合获得1株名为A. pasteurianus CICIM B7003-02,具有较高乙酸耐受性的突变菌株,在不同胁迫条件下突变株超过了亲本株的发酵速率和乙酸产量[16]。巴氏醋酸杆菌是严格的好氧菌,利用7.5 L发酵罐保证其溶氧,采用不同的发酵方式,研究突变菌株和亲本菌株的发酵特性,以及不同发酵阶段酸胁迫下菌体细胞膜脂肪酸、胞内氨基酸含量、胞内ATP含量和乙醇呼吸链活性,以更好地了解巴氏醋酸杆菌耐受酸胁迫的机理,解析其适应特定发酵环境的优势。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株
巴氏醋酸杆菌亲本菌株A. pasteurianus CICIM B7003,一种典型的工业用醋酸发酵菌株,分离自酿造工厂,保存于本实验室,巴氏醋酸杆菌突变菌株A. pasteurianus CICIM B7003-02保存于本实验室。
1.1.2 培养基与试剂
种子培养基(g/L):葡萄糖10,酵母粉10,121 ℃灭菌20 min,接种前加无水乙醇至24。
发酵培养基(g/L):葡萄糖10,酵母粉10,KH2PO4 0.6,无水MgSO4 0.4,121 ℃灭菌20 min,接种前加入过滤除菌的初始乙酸10,无水乙醇至40。
葡萄糖、无水乙醇、冰醋酸、三氯乙酸:分析纯;甲醇、正己烷:色谱纯,国药集团;有机酸标准品:TCI公司;辅酶Q9标准品:Sigma公司;ATP测定试剂盒:碧云天生物技术有限公司。
1.2 仪器与设备
台式高速离心机,德国Sigma公司;超声细胞破碎机,宁波新芝生物科技股份有限公司;BioFlo115 发酵罐,美国NBS公司;Enspire多标记检测系统(酶标仪),美国珀金埃尔默有限公司;Agilent1260高效液相色谱仪,美国安捷伦公司;GC-MS TSQ8000三重四极杆气质联用仪、LC-MS TSQ quantum Ultra EMR,美国赛默飞世尔科技公司。
1.3 实验方法
1.3.1 发酵培养方法
摇瓶活化和种子培养参照文献[17]。
分批发酵:将培养24 h的种子接种到发酵罐,总发酵体积为4 L,初始乙醇质量浓度为40 g/L,初始乙酸为10 g/L,接种量10%,培养温度30 ℃,通气速率设定为1 L/min (0.25 vvm),转速400 r/min,溶氧下降到20%时,调节通气速率为1.6 L/min (0.4 vvm)。
半连续发酵:(1)发酵启动阶段。3 L新鲜发酵培养基,初始醋酸和乙醇质量浓度分别为10 g/L和30 g/L,接种量10%,培养24 h的种子接种到发酵罐,培养温度为30 ℃,转速400 r/min,通气速率设定为0.865 L/min (0.25 vvm),当发酵罐中残余乙醇质量浓度降到5 g/L时,泵入260 g/L乙醇的新鲜培养基0.54 L,共计4 L培养液。培养温度为30 ℃,通气速率上调至1.2 L/min (0.3 vvm)继续培养。(2)重复补料发酵阶段:当发酵罐中残余乙醇质量浓度降到5 g/L时,排出总发酵体积(4 L)43% (1.72 L)的发酵液,缓慢补入81.4 g/L乙醇的新鲜培养基1.72 L,培养温度为30 ℃,通气速率1.2 L/min(0.3 vvm)。
1.3.2 发酵过程参数的测定
乙醇、乙酸、细胞干重的测定参照文献[18]。
1.3.3 发酵过程ATP含量的测定
利用ATP检测试剂盒(ATP Assay Kit)检测发酵过程菌体内部的ATP,向 96 孔板中加入100 μL ATP检测工作液,放置3~5 min,加50 μL样品或者标准品,检测时间设置10 s,测Lum值,图1为ATP测定的标准曲线。
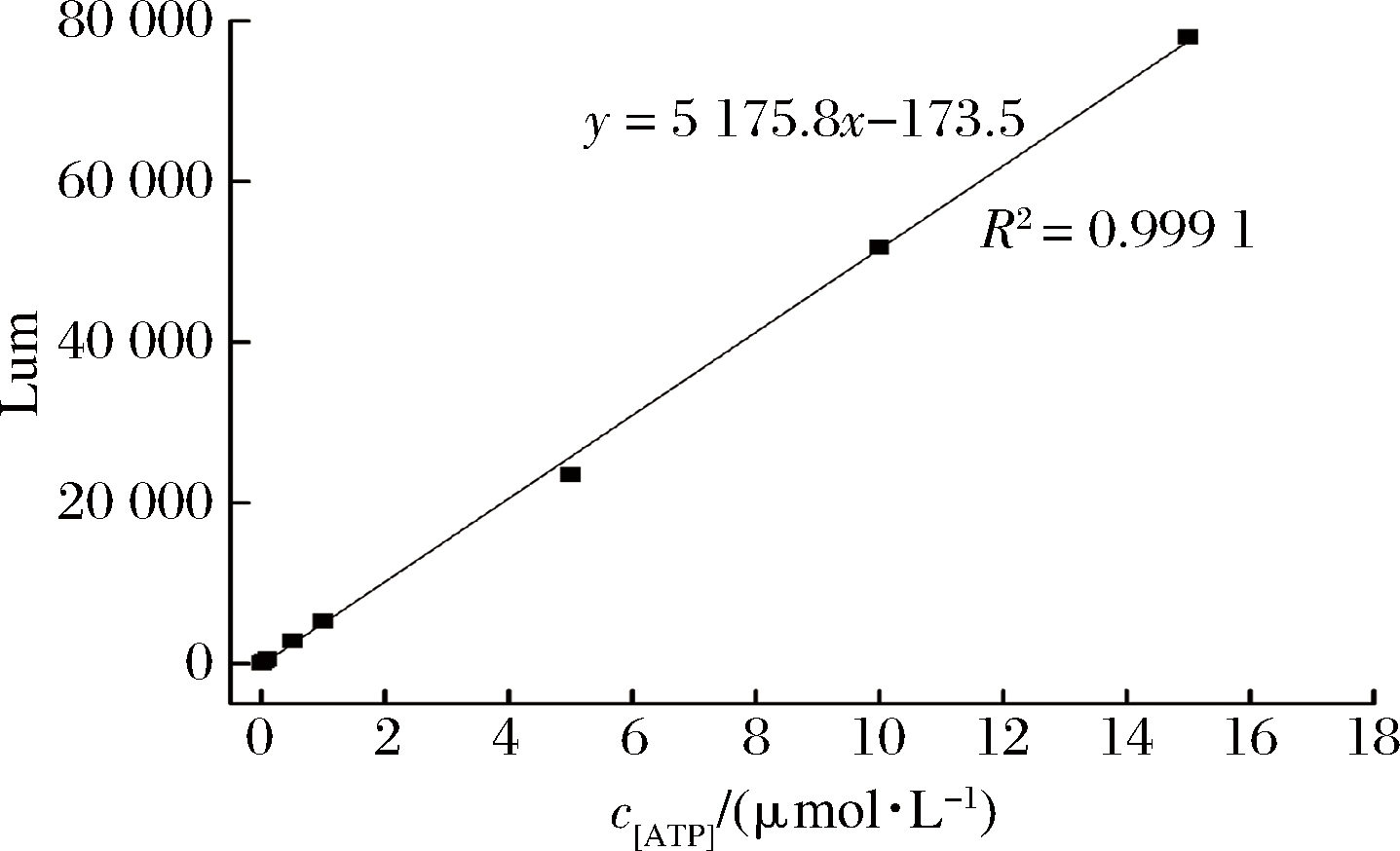
图1 Lum值与ATP浓度的线性关系
Fig.1 Linear relationship between Lum value and ATP concentration
1.3.4 ADH和ALDH酶活的测定
采用比色法,具体操作参考文献[19]。
1.3.5 辅酶Q9的测定
辅酶Q9的提取:取适量发酵液,离心得菌体,加入10 mL丙酮重悬,冰浴条件下超声波破碎20 min (240 W, 3 s/3 s),破碎完全后,5 000×g、4 ℃下离心15 min;取上清液,在45 ℃的旋转蒸发仪中浓缩,上清液不再减少时再加入50 mL石油醚萃取;充分混匀,分层后将含有辅酶的萃取液用旋转蒸发仪45 ℃条件下浓缩至干,最后加入无水乙醇10 mL溶解,放入冰箱冷冻,析出胆固醇等杂质,过滤后用无水乙醇定容到50 mL,待测。
辅酶Q9含量的测定条件:纯甲醇为洗脱液,流速设置为0.3 mL/min,柱温45 ℃,色谱柱为BEH chemistry C18柱,进样量2 μL,图2为辅酶Q9含量的标准曲线。

图2 峰面积与辅酶Q9浓度的线性关系
Fig.2 Linear relationship between peak area and Q9 concentration
1.3.6 细胞膜脂肪酸含量的测定
收集发酵一定时间的菌体,经过皂化、甲基化、萃取、碱洗等前处理步骤得到脂肪酸[19],用于气质联用分析。GC-MS分析条件参考文献[19]。
1.3.7 胞内氨基酸的测定
取适量发酵液,8 000×g,离心10 min收集菌体,用PBS缓冲液(pH 7.0)洗涤2次。重悬于1 mL 10 g/L的三氯乙酸中,37 ℃放置10 min,煮沸15 min,8 000×g离心10 min,除去细胞碎片,上清液经0.22 μm水膜过滤,取400 μL上清液用于氨基酸分析[20]。
2 结果与分析
2.1 两株菌分批发酵过程比较
在7.5 L发酵罐中进行A. pasteurianus CICIM B7003和CICIM B7003-02的分批发酵。图3-A为A.pasteurianus CICIM B7003的发酵过程曲线,亲本菌株接入发酵罐后存在20 h左右的延滞期,随后进入快速产酸阶段,20~70 h左右进入快速产酸期,发酵80 h停止产酸,34 h之后溶氧需求达到最大,发酵期间因底物乙醇和产物乙酸的双重抑制作用,菌株进入对数生长期中期,最大比生长速率μmax仅为0.106 h-1,发酵结束,生物量为0.62 g/L,比突变株高37.8%,最终酸产量达51.6 g/L,发酵过程平均产酸速率为0.645 g/(L·h),发酵结束乙醇残留5.69 g/L,乙醇对乙酸的转化率为87.7%。相比于亲本菌株,如图3-C所示,突变株种子液接入发酵罐后迅速开始菌体生长和乙酸发酵过程,无延滞期,8 h左右溶氧下降到4%左右,随后保持不变,58 h左右溶氧逐渐上升,最终发酵66 h结束,生物量为0.45 g/L,乙酸产量达55.2 g/L,发酵过程产酸速率较平稳,平均产酸速率为0.836 g/(L·h),发酵期间最大比生长速率μmax为0.121 h-1,发酵结束几乎无乙醇残留,乙醇对乙酸的转化率达86.3%。

A-CICIM B7003发酵过程曲线;B-CICIM B7003能量代谢曲线;C-CICIM B7003-02发酵过程曲线;D-CICIM B7003-02能量代谢曲线
图3 A. pasteurianus CICIM B7003和CICIM B7003-02的分批发酵过程比较
Fig.3 Comparison of batch fermentation process of A. pasteurianus CICIM B7003 and CICIM B7003-02
进一步对其胞内能量代谢分析可知,如图3-B所示,亲本株胞内ATP含量10 h后快速上升,29 h达到最大值16.25 μmol/g (菌体干重),如图3-A所示,此时比生长速率在10 h达到最大值0.106 h-1,产酸速率为0.9 g/(L·h),发酵结束前ATP含量为0.055 μmol/g (菌体干重),如图3-D所示,突变株胞内ATP在8 h左右达到最大值18 μmol/g(菌体干重),此时的比生长速率为最大值0.121 h-1,产酸速率为1.215 g/(L·h),随后ATP水平迅速下降,在20 h后出现短暂的上升后又迅速下降,发酵结束前ATP含量为0.08 μmol/g(菌体干重),发酵初期乙酸浓度较低,主要利用三羧酸循环来供能,能量以ATP的形式储存,乙醇快速氧化阶段,主要利用乙醇呼吸链产能[18],产生的能量不仅需要供给菌体生长,还需供给蛋白抵抗酸胁迫下的不利环境。当乙酸扩散到细胞中时,ATP依赖性ABC转运蛋白泵出乙酸,维持胞内的pH稳态,与GrpE和DnaJ类似,DnaK等分子伴侣蛋白消耗ATP以确保蛋白质在酸性压力下正确折叠,ATP被大量消耗[21-23]。
2.2 发酵过程中细胞膜脂肪酸的变化
细胞膜与菌体能量传导与维持细胞内微环境的稳定性密切相关,细胞膜脂肪酸组成的变化通常被认为是微生物细胞对外界毒性化合物的适应性反应[24]。实验测定了24,48和72 h的细胞膜脂肪酸组成,如图4所示。

图4 发酵过程中细胞膜脂肪酸组成变化
Fig.4 Membrane fatty acids change of A. pasteurianus
CICIM B7003 and CICIM B7003-02 during fermentation process
A. pasteurianus CICIM B7003和CICIM B7003-02发酵过程中的饱和脂肪酸主要由C12∶0 (月桂酸),C14∶0 (肉豆蔻酸),C16∶0 (棕榈酸),C18∶0 (硬脂酸)组成,不饱和脂肪酸主要是C16∶1 (棕榈油酸),C18∶1 (十八碳烯酸),C18∶2 (十八碳二烯酸)。棕榈酸,硬脂酸和十八碳烯酸占据了A. pasteurianus CICIM B7003和CICIM B7003-02细胞膜脂肪酸大部分的比例。随着发酵过程的进行,醋酸不断积累,饱和脂肪酸,主要是棕榈酸和硬脂酸的含量逐渐降低,不饱和脂肪酸,主要是十八碳一烯酸的比例不断升高。发酵72 h棕榈酸含量由24 h的31.92%(29.28%)降低到最终的20.86%(21.86%),硬脂酸的含量由发酵24 h的27.45% (21.91%)降低到发酵72 h的15.59%(11.88%)。十八碳一烯酸的含量由24 h的21.59% (28.4%)上升到发酵结束前的43.58% (48.7%),此外,发酵过程中A. pasteurianus CICIM B7003-02的棕榈酸和硬脂酸等饱和脂肪酸比A. pasteurianus CICIM B7003低25.2%~33.8%,突变株中十八碳烯酸等不饱和脂肪酸比亲本株高10.4%~31.5%,除此之外的其他脂肪酸几乎无明显变化。乙酸存在下,不饱和脂肪酸(顺式异油酸)的增加形成更加流动的细胞膜,因为异油酸积聚会导致细胞膜流化[7]。
2.3 菌体胞内氨基酸含量变化
在高酸度的恶劣环境下,谷氨酸、天冬氨酸、脯氨酸、丙氨酸等氨基酸在醋酸菌细胞生长代谢和细胞存活中起重要作用,其增强酸胁迫损伤引起的DNA合成和DNA修复,促进细胞膜不饱和脂肪酸合成稳定性和完整性,改善细胞膜的流动性,稳定性和完整性[13-14],氨基酸脱羧形成氨降低胞内pH[25]。本实验考察了突变菌株和亲本菌株在发酵过程中的胞内氨基酸含量的变化,如图5所示。

图5 发酵过程中胞内氨基酸含量变化
Fig.5 Changes in intracellular pools of amino acids changes in intracellular pools of amino acids during fermentation
发酵初期,胞内氨基酸含量普遍较高,随着酸度的提升,胞内氨基酸含量不断下降,在17种氨基酸中,天冬氨酸、谷氨酸、丙氨酸占据了大部分。在发酵的初始阶段,24 h时突变株的胞内氨基酸大部分含量都比亲本株高,例如突变株中谷氨酸和天冬氨酸的含量分别为2.58和1.03 μg/mg (蛋白),相比于亲本株的2.33和0.87 μg/mg(蛋白)高10.7%和18.3%;但在72 h时,亲本株中含量为0.56和1.02 μg/mg(蛋白),突变株中为0.37和0.80 μg/mg(蛋白)。因此在低酸度下氨基酸可能主要用于供给生长代谢,到发酵中后期,细胞活性相对较弱,发酵液中酸度较高,突变株细胞利用胞内氨基酸增强脱氨作用,增加细胞内氨浓度,从而维持细胞内pH的稳定性[14]。
2.4 ADH、ALDH酶活以及辅酶Q9含量变化
醋酸菌利用吡咯喹啉依赖性醇脱氢酶(PQQ-ADH)和乙醛脱氢酶(ALDH)将乙醇转化为乙酸,它们是乙醇呼吸链中的关键酶,同时,PQQ-ADH的活性与乙酸耐受性有关[4]。如图6-A所示,ADH酶活性和ALDH酶活性在发酵过程中都呈现先上升后下降的趋势,其活性与产酸速率正相关。在亲本株中,由于延滞期的存在,发酵初始酶活水平较低,随着发酵的进行,最高酶活出现在45 h,ADH活性为7.21 U/mg,ALDH活性为5.84 U/mg,突变株的最高酶活出现在36 h,ADH活性为9.16 U/mg,ALDH活性为6.73 U/mg。
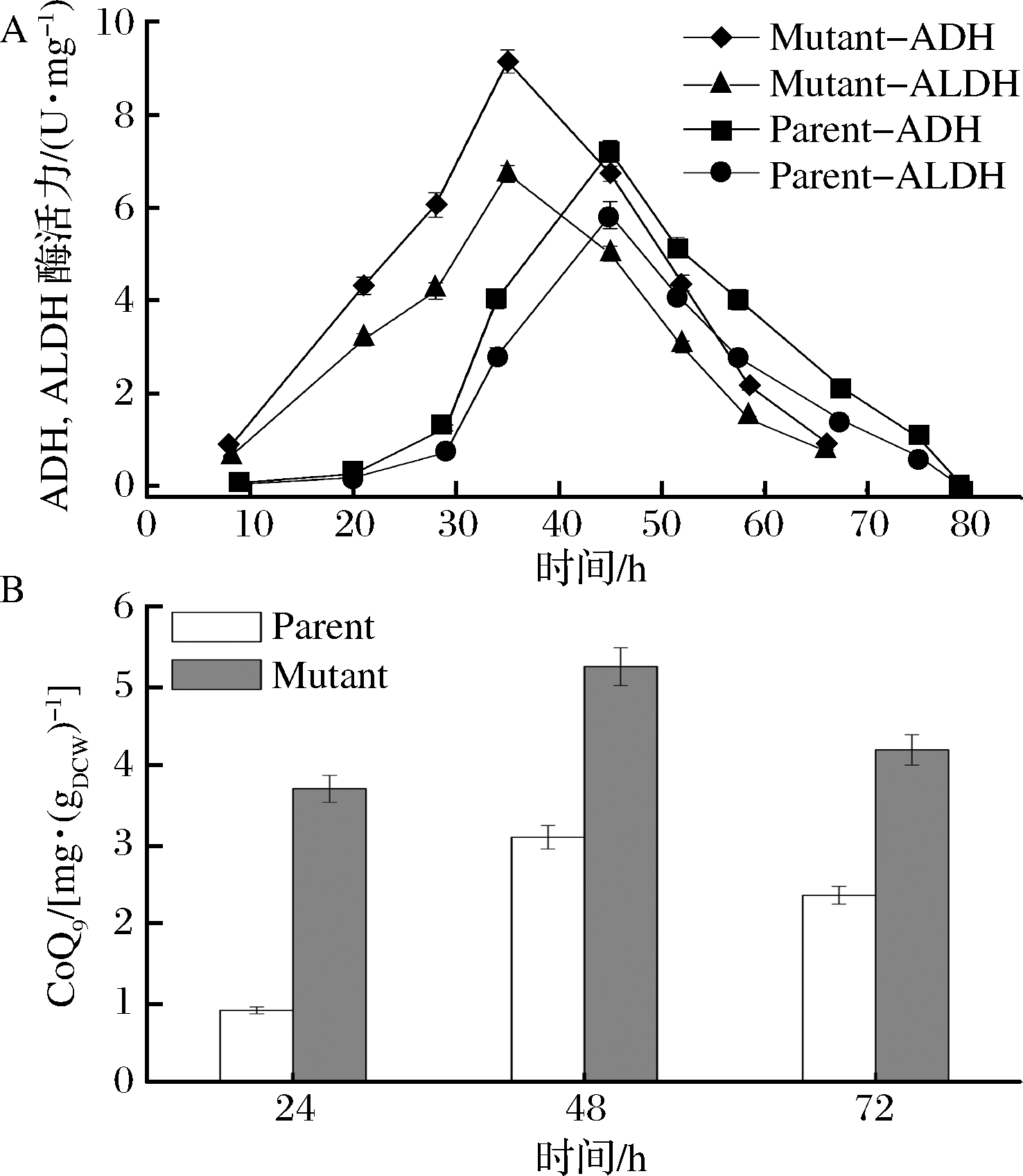
图6 发酵过程中ADH和ALDH酶活以及辅酶Q9含量的变化
Fig.6 Changes of ADH and ALDH activity and coenzyme Q9 content during fermentation process
辅酶Q9是乙醇呼吸链中可自由穿梭的电子传递载体,其接受ADH的辅酶PQQ的电子被还原成Q9H2,随后被末端氧化酶Cyto氧化,其含量与乙醇呼吸链的强度有直接关系,如图6-B所示,整个发酵过程中突变株的辅酶Q9含量一直高于亲本株,发酵24 h时由于刚进入生长期,亲本株的辅酶Q9含量只有0.91 mg/g菌体干重,突变株处于对数生长期,辅酶Q9含量为3.71 mg/g (菌体干重),发酵48 h,辅酶Q9含量在2株菌中含量都达到了最大值,分别为3.09和5.24 mg/g(菌体干重),发酵72 h时,此时处于发酵后期,发酵液中酸积累较多,乙醇呼吸链活性减弱,辅酶Q9含量相比48 h降低,分别为2.36和4.19 mg/g (菌体干重)。由此可见,ADH,ALDH酶活以及辅酶Q9含量的高低直接反映了乙醇呼吸链在发酵过程中的动态调控过程。
2.5 半连续发酵特性比较
底物乙醇初始浓度过高时,会对菌体产生抑制作用,所以工业中一般采用半连续发酵工艺来进行醋酸发酵。主要分为发酵启动,半连续发酵适应阶段,半连续发酵生产阶段。如图7所示,图7-A为突变株的半连续发酵,发酵启动时间为46 h,经过1次乙醇和新鲜培养基补料,达到最终酸度70.6 g/L,启动后的第1次补料延滞期较长,为15 h左右,随后进入快速产酸阶段,经过一两个不稳定的批次后进行稳定发酵,发酵周期33 h,平均产酸速率1.01 g/(L·h),乙醇对醋酸的转化率为81.4%。
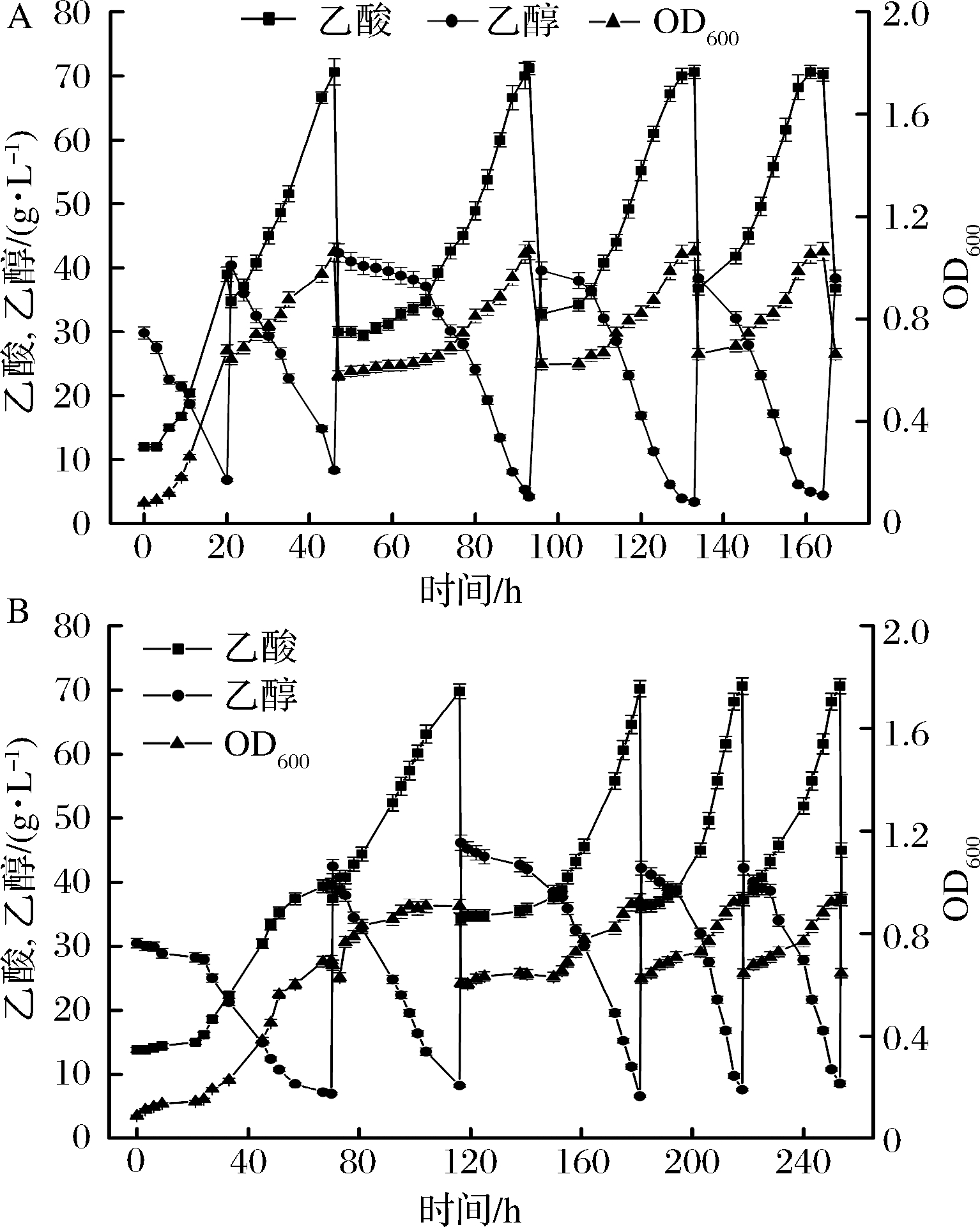
A-突变株的半连续发酵;B-亲本株的半连续发酵
图7 两株菌半连续发酵特性比较
Fig.7 Fermentation characteriatics of A. pasteurianusCICIM B7003-02 and CICIM B7003 in repeated batch method
图7-B中,种子液接入发酵罐后延滞期很长,116 h才结束了发酵启动过程,经过一两次适应阶段后,发酵周期为35 h,平均产酸速率为0.87 g/(L·h),乙醇对醋酸的转化率为76.7%,转化率较低可能是由于半连续发酵中底物乙醇的不断积累胁迫菌体导致利用乙醇不充分,另外发酵时间过长,乙醇的挥发降低了利用效率,诱变菌种充分缩短了发酵周期,特别是半连续发酵启动阶段。后续可以利用营养盐进一步缩短发酵启动时间。
3 讨论
醋酸发酵是产物抑制底物转化的典型模型,醋酸菌的一个突出和必要的生理特征是它们能够在醋酸发酵的高醋酸条件下存活,本文从2个方面解析醋酸菌发酵耐酸特性,一方面通过亲本菌株和突变菌株的发酵特性对比,包括分批发酵和重复补料分批发酵,亲本株的延滞期较长,但后期产酸速率较快,并且分批发酵中亲本株最终生物量高出突变株37.8%;醋酸发酵中,菌体生长状态直接影响产酸速率,突变株中的生长代谢的基因突变可能限制了菌株的过度生长。突变株在发酵初始就拥有较高胞内ATP水平,初始乙酸可能诱导了其发酵启动过程,导致大量ATP积累[22],保证了其快速发酵启动过程,亲本株依靠生物量的积累完成胞内ATP积累,达到最高ATP水平进入对数生长期和高产酸速率阶段。
另一方面,亲本株对发酵环境适应度差,考虑到可能是胞内微环境的影响,因此又对发酵过程中菌体细胞膜脂肪酸组成,胞内ATP含量,胞内氨基酸含量,乙醇脱氢酶(ADH),乙醛脱氢酶(ALDH)酶活以及辅酶Q9含量进行了分析,乙醇呼吸链ADH、ALDH酶活以及辅酶Q9含量,与发酵过程中产酸速率呈正相关,ATP含量与比生长速率呈正相关,突变株处于最高活性时的生理指标都明显优于亲本菌株。不饱和脂肪酸,特别是十八碳烯酸在发酵过程中不断上升,饱和脂肪酸包括棕榈酸和硬脂酸含量不断下降,不饱和度的升高增强了细胞膜的流动性[26]。谷氨酸和天冬氨酸也被报道参与耐酸性,突变株胞内谷氨酸和天冬氨酸多10.7%和18.3%,其在发酵过程中不断减少,主要参与增强磷酸戊糖和NADPH的生成,维持细胞内氧化还原平衡和细胞活力,增强氨基酸的脱氨作用,增加细胞内氨浓度,维持细胞内pH的稳定性[14],这不仅为食品工业选择耐酸菌株提供了有效途径,而且提供新的策略来提高该巴氏醋酸杆菌的工业实用性。
[1] SAICHANA N, MATSUSHITA K, ADACHI O, et al. Acetic acid bacteria: A group of bacteria with versatile biotechnological applications[J]. Biotechnology Advances, 2015, 33(6): 1 260-1 271.
[2] TRCEK J, MIRA N P, JARBOE L R. Adaptation and tolerance of bacteria against acetic acid[J]. Applied Microbiology and Biotechnology, 2015, 99(15): 6 215-6 229.
[3] XIA K, ZANG N, ZHANG J, et al. New insights into the mechanisms of acetic acid resistance in Acetobacter pasteurianus using iTRAQ-dependent quantitative proteomic analysis[J]. International Journal of Food Microbiology, 2016, 238: 241-251.
[4] TRCEK J, TOYAMA H, CZUBA J, et al. Correlation between acetic acid resistance and characteristics of PQQ-dependent ADH in acetic acid bacteria[J]. Applied Microbiology and Biotechnology, 2006, 70(3): 366-373.
[5] FUKAYA M, TAKEMURA H, TAYAMA K, et al. The aarC gene responsible for acetic acid assimilation confers acetic acid resistance on acetobacter aceti[J]. Journal of Fermentation and Bioengineering, 1993, 76(4): 270-275.
[6] NAKANO S, FUKAYA M, HORINOUCHI S. Putative ABC transporter responsible for acetic acid resistance in Acetobacter aceti[J]. Applied and Environmental Microbiology, 2006, 72(1): 497-505.
[7] TRCEK J, JERNEJC K, MATSUSHITA K. The highly tolerant acetic acid bacterium Gluconacetobacter europaeus adapts to the presence of acetic acid by changes in lipid composition, morphological properties and PQQ-dependent ADH expression[J]. Extremophiles, 2007, 11(4): 627-635.
[8] HANADA T, KASHIMA Y, KOSUGI A, et al. A gene encoding phosphatidylethanolamine N-methyltransferase from Acetobacter aceti and some properties of its disruptant[J]. Bioscience Biotechnology and Biochemistry, 2001, 65(12): 2 741-2 748.
[9] LIU Y, TANG H, LIN Z, et al. Mechanisms of acid tolerance in bacteria and prospects in biotechnology and bioremediation[J]. Biotechnology Advances, 2015, 33(7): 1 484-1 492.
[10] COTTER P D, COLIN H. Surviving the acid test: responses of gram-positive bacteria to low pH[J]. Microbiology and Molecular Biology Reviews: MMBR, 2003, 67(3): 429-453.
[11] MATSUSHITA K, INOUE T, ADACHI O, et al. Acetobacter aceti possesses a proton motive force-dependent efflux system for acetic acid[J]. Journal of Bacteriology, 2005, 187(13): 4 346-4 352.
[12] SAINZ F, MAS A, TORIJA M J. Effect of ammonium and amino acids on the growth of selected strains of Gluconobacter and Acetobacter[J]. International Journal of Food Microbiology, 2017, 242: 45-52.
[13] QI Z, DONG D, YANG H, et al. Improving fermented quality of cider vinegar via rational nutrient feeding strategy[J]. Food Chemistry, 2017, 224: 312-319.
[14] YIN H, ZHANG R, XIA M, et al. Effect of aspartic acid and glutamate on metabolism and acid stress resistance of Acetobacter pasteurianus[J]. Microbial Cell Factories, 2017, 16(1): 109.
[15] ZHENG Y, CHANG Y, XIE S, et al. Impacts of bioprocess engineering on product formation by Acetobacter pasteurianus[J]. Applied Microbiology and Biotechnology, 2018, 102(6): 2 535-2 541.
[16] QI Z, WANG W, YANG H, et al. Mutation of Acetobacter pasteurianus by UV irradiation under acidic stress for high-acidity vinegar fermentation[J]. International Journal of Food Science and Technology, 2014, 49(2): 468-476.
[17] 朱小明, 夏小乐,杨海麟,等. 巴氏醋酸杆菌沪酿1.01乙醇氧化产醋酸关键酶的研究[J]. 食品工业科技, 2013, 34(2): 167-170.
[18] 亓正良, 杨海麟,夏小乐,等. 巴氏醋杆菌高酸度醋发酵过程的能量代谢分析[J]. 微生物学通报, 2013, 40(12): 2 171-2 181.
[19] 亓正良, 杨海麟,夏小乐,等. 巴氏醋酸杆菌对发酵中醋酸胁迫的生理应答[J]. 微生物学报, 2014, 54(3): 299-308.
[20] FOUNTOULAKIS M, LAHM H W. Hydrolysis and amino acid composition of proteins[J]. Journal of Chromatography A, 1998, 826(2): 109-134.
[21] HARRISON C J, HAYER-HARTL M, LIBERTO M Di, et al. Crystal structure of the nucleotide exchange factor GrpE bound to the ATPase domain of the molecular chaperone DnaK[J]. Science, 1997, 276(5 311): 431-435.
[22] ZHENG Y, ZHANG R, YIN H, et al. Acetobacter pasteurianus metabolic change induced by initial acetic acid to adapt to acetic acid fermentation conditions[J]. Applied Microbiology and Biotechnology, 2017, 101(18): 7 007-7 016.
[23] ISHIKAWA M, OKAMOTO-KAINUMA A, MATSUI K, et al. Cloning and characterization of clpB in Acetobacter pasteurianus NBRC 3283[J]. Journal of Bioscience and Bioengineering, 2010, 110(1): 69-71.
[24] DENICH T J, BEAUDETTE L A, LEE H, et al. Effect of selected environmental and physico-chemical factors on bacterial cytoplasmic membranes[J]. Journal of Microbiological Methods, 2003, 52(2): 149-182.
[25] WANG B, SHAO Y, CHENG F. Overview on mechanisms of acetic acid resistance in acetic acid bacteria[J]. World Journal of Microbiology and Biotechnology, 2015, 31(2): 255-263.
[26] 马新凤, 陈义伦,周波,等. 巴氏醋酸杆菌沪酿1.01对液体保藏中醋酸胁迫的生理应答[J]. 食品与发酵工业, 2016, 42(1): 42-47.