辣木(Moringa oleifera Lam.)为辣木科辣木属植物,原产于印度北部喜马拉雅山南麓[1]。辣木具有良好的保健功能和生理活性,其根、茎、叶、种子、花朵等均可食用[2]。辣木籽中含有丰富的油脂、蛋白质及矿物元素。其中,辣木籽油中富含不饱和脂肪酸,油酸含量高达75.39%[3-4],且含有饱和烃、醛及植物甾醇[5-6],具有较高的营养价值。因此,研究一种高效提取辣木籽中油脂等营养成分的方法,为功能食品、医药和化妆品等领域的产品开发及应用奠定理论和技术基础。
目前,植物油脂提取多采用有机溶剂浸提法,这种方法油脂提取率较高,但此过程涉及易燃、易爆化学试剂,易导致有机溶剂残留且存在一定的安全问题[7]。水酶法是利用酶解作用破坏油料细胞壁结构,从而将油脂释放出来,该方法条件温和,提取工艺简单,无溶剂残留。刘华勇[8]研究了蛋白酶种类、酶解时间、酶添加量等条件对辣木籽油提取率的影响,酶解24 h后辣木籽油提取率为70.09%。已报道的水酶法提取辣木籽油提取率较低且酶解时间大都较长(通常为24 h)[8-9]。而预处理(高温高压、微波、超声等)方法与水酶法相结合可以有效地提高油脂提取效率。YUSOFF等[10]采用高压(50 MPa,60 ℃,35 min)预处理方法辅助水酶法提取辣木籽油,油脂提取率可达73%,并且与传统水酶法相比乳化层更薄,但酶解时间较长(12.5 h)。近年来,预处理方法与水酶法结合的研究多集中在茶叶籽油[11]、西瓜籽油[12]、橄榄油[13]等植物油的提取,但在提取辣木籽油中应用较少,且不同预处理方法对辣木籽油提取率及微观表面形貌和结构的影响尚未见报道。
本文以辣木籽为原料,在传统水酶法的基础上,结合微波、高压和超声3种不同的预处理方法,考察3种预处理对辣木籽油提取率的影响,并与传统水酶法的提取效果进行对比。进一步借助扫描电镜分析辣木籽在预处理前后微观表面形貌及结构的变化,初步探究不同预处理方法提取辣木籽油的机理,以期提高辣木籽油的提取效率以及为辣木籽的开发与利用提供理论依据与技术支持。
1 材料与方法
1.1 材料与试剂
辣木籽,云滇养生堂;中性蛋白酶Neutrase 0.8 L,丹麦诺维信公司;其他试剂均属于分析纯;超纯水,由YSL-RO-T10L/H超纯水系统(Ashland公司)制备。
1.2 仪器与设备
BJ-300型高速多功能粉碎机,上海拜杰实业有限公司;EG823LA6-NR型微波炉,美的公司;手提式高压蒸汽灭菌锅,上海申安医疗器械厂;Scientz-800CQ型超声波提取震荡反应器,宁波新芝生物科技股份有限公司;SHZ-88水浴恒温振荡器,常州朗越仪器制造有限公司;RW20数显型混合顶置式机械搅拌器,德国IKA公司;FD-1A-50型冷冻干燥机,北京博医康实验仪器有限公司;PB-10 pH计,赛多利斯科学仪器(北京)有限公司。
1.3 方法
1.3.1 提取方法
辣木籽→脱壳→粉碎→过筛→与水混合→水浴加热→冷却→预处理(微波、高压、超声)→调pH 6.0→酶解→灭酶→离心
操作要点:辣木籽脱壳粉碎,过60~80目筛。辣木籽粉与超纯水以1∶6质量比混匀,96 ℃水浴9 min,冷却至室温。分别经微波、高压、超声预处理后,用1 mol/L NaOH和1 mol/L HCl调其pH为6.0。样品中添加中性蛋白酶(1.5×105 U/100g辣木籽粉)于水浴恒温振荡器(45 ℃,120 r/min)进行酶解反应。酶解后于95 ℃水浴灭酶30 min。离心(8 000 r/min,20 min)后得到游离油、乳状液、水解液及残渣。微波预处理时采用微波间歇加热方法,即微波加热1 min后冰水浴冷却1 min,再微波1 min,反复进行,以防止提取液暴沸。未进行预处理的为对照组。
1.3.2 单因素试验
在提取过程中,考察微波(功率、时间、酶解时间)、高压(温度、时间、酶解时间)、超声(功率、时间、酶解时间)预处理条件对辣木籽油提取率的影响。
1.4 辣木籽油和蛋白质的提取率的计算
辣木籽油和蛋白提取率的计算分别如式(1)和(2)。
辣木籽油提取率![]()
(1)
辣木蛋白提取率![]()
(2)
式中:m1,游离油的质量,g;m2,辣木籽粉中粗脂肪的质量,g;m3,辣木籽粉中粗蛋白质量,g;m4,残渣中蛋白质量,g。其中,粗脂肪含量和蛋白质含量测定分别根据GB 5009.6—2016《食品中脂肪的测定》和GB 5009.5—2016《食品中蛋白质的测定》进行测定。
1.5 数据处理
各实验重复3次,各样品的指标平行测定至少3次,以平均值±标准偏差表示结果。采用SPSS 18.0软件对数据进行单因素方差分析(P<0.05时判断组间存在显著差异)。
2 结果与分析
2.1 微波预处理对辣木籽油提取率的影响
2.1.1 微波功率对辣木籽油提取率的影响
在微波时间3 min,酶解时间3 h的条件下,微波功率(100~800 W)对辣木籽油提取率的影响如图1-A所示。当微波功率从100 W增大到300 W时,辣木籽油的提取率由52.54%显著升高至58.75%(P<0.05),这可能是因为辣木籽粉吸收微波热能后,温度快速升高,辣木籽细胞在微波电磁场作用下粒子之间相互碰撞,使得细胞壁破裂,油脂流动性增加,其内部的油脂得以释放[14-15]。当微波功率在300~800 W时,油脂提取率趋于平缓,这可能是因为随着微波功率的增大,酶对蛋白的水解作用达到饱和,蛋白质的提取率不再显著性上升(P>0.05),油脂提取接近平衡状态,这与仵缘等[15]用微波辅助溶剂法提取橡胶籽所得结果类似。胡滨等[16]在微波功率300~800 W也得出相似的结论。因此,选择提取辣木籽油的微波功率为300 W。
2.1.2 微波时间对辣木籽油提取率的影响
在微波功率300 W,酶解时间3 h的条件下,微波时间(0~9 min)对辣木籽油提取率的影响如图1-B所示。

图1 微波功率(A)和时间(B)对辣木籽油提取率的影响
Fig.1 Effect of microwave power (A) and time (B) on oil recovery from the Moringa oleifera seed powder
当微波时间从0增加到5 min时,油脂提取率增加了5.57%。一方面,可能是随着微波时间的增加,微波辐射对细胞壁的破坏作用增大,增加了细胞的通透性[17];另一方面随着提取时间的进行,更多的蛋白被酶水解,蛋白提取率显著增加(4.81%),说明蛋白质在酶解液中溶解度增大,这使被蛋白质包围的油脂得以释放。当微波处理时间超过5 min后,油脂释放较少,提取率(60.87%)不再显著增加(P>0.05)。提取过程中,蛋白提取率和油脂提取率呈相似趋势,可能说明油脂释放与蛋白水解在一定程度上呈正相关。
2.1.3 微波预处理酶解时间对辣木籽油提取率的影响
在微波功率300 W,微波时间5 min的条件下,酶解时间(0.5~5 h)对辣木籽油提取率的影响如图2所示。酶解时间从0.5 h延长至1 h时,油脂提取率从50.26%迅速增大至62.09%,这可能是由于随着酶解时间的延长,蛋白酶充分水解细胞内部的蛋白质(蛋白提取率从26.56%提高至44.63%),使油脂大量溶出。当酶解时间从1 h延长至3 h,油脂提取率提高不显著(P>0.05);酶解时间继续至5 h时,虽然蛋白提取率增加了5.77%,但是油脂提取率下降了3.70%,这可能是长时间的酶解和振荡使大量蛋白质及蛋白质酶解物与辣木籽油发生乳化。为了提高油的提取率,选择提取辣木籽油的酶解时间为1 h。

图2 酶解时间对辣木籽油提取率的影响
Fig.2 Effect of reaction time on oil recovery from theMoringa oleifera seed powder
注:不同字母表示差异显著。下同。
2.2 高压预处理对辣木籽油提取率的影响
2.2.1 高压温度对辣木籽油提取率的影响
在高压时间10 min,酶解时间3 h的条件下,高压温度(100~120 ℃)对辣木籽油提取率的影响如图3-A所示。当高压温度达到110 ℃时,油脂提取率由60.43%提高至65.71%,这可能是因为高压有效地使细胞壁膨松、淀粉糊化,增加其渗透性[18-19],因而有利于酶的作用使蛋白质提取率增加了20.73%,促进油脂释放。继续升高温度至120 ℃时,油脂提取率下降了3.97%。这可能是因为高温使蛋白质变性,蛋白质提取率提高不显著(P>0.05);且部分油脂在此条件下易被乳化。因此,选择提取辣木籽油的高压温度为110 ℃。
2.2.2 高压时间对辣木籽油提取率的影响
在高压温度110 ℃,酶解时间3 h的条件下,高压时间(0~20 min)对辣木籽油提取率的影响如图3-B所示。随着高压时间从0升高到10 min,辣木籽油提取率增加了8.96%,辣木蛋白提取率增加了14.96%,这可能是由于较长时间的高温高压作用使细胞壁变得更加松弛,酶更易进入细胞内部与蛋白质发生作用[19],从而提高了出油率。当继续增加高压时间至20 min,辣木籽油的释放接近平衡状态,提取率呈平缓趋势。因此,选择提取辣木籽油的高压时间为10 min。
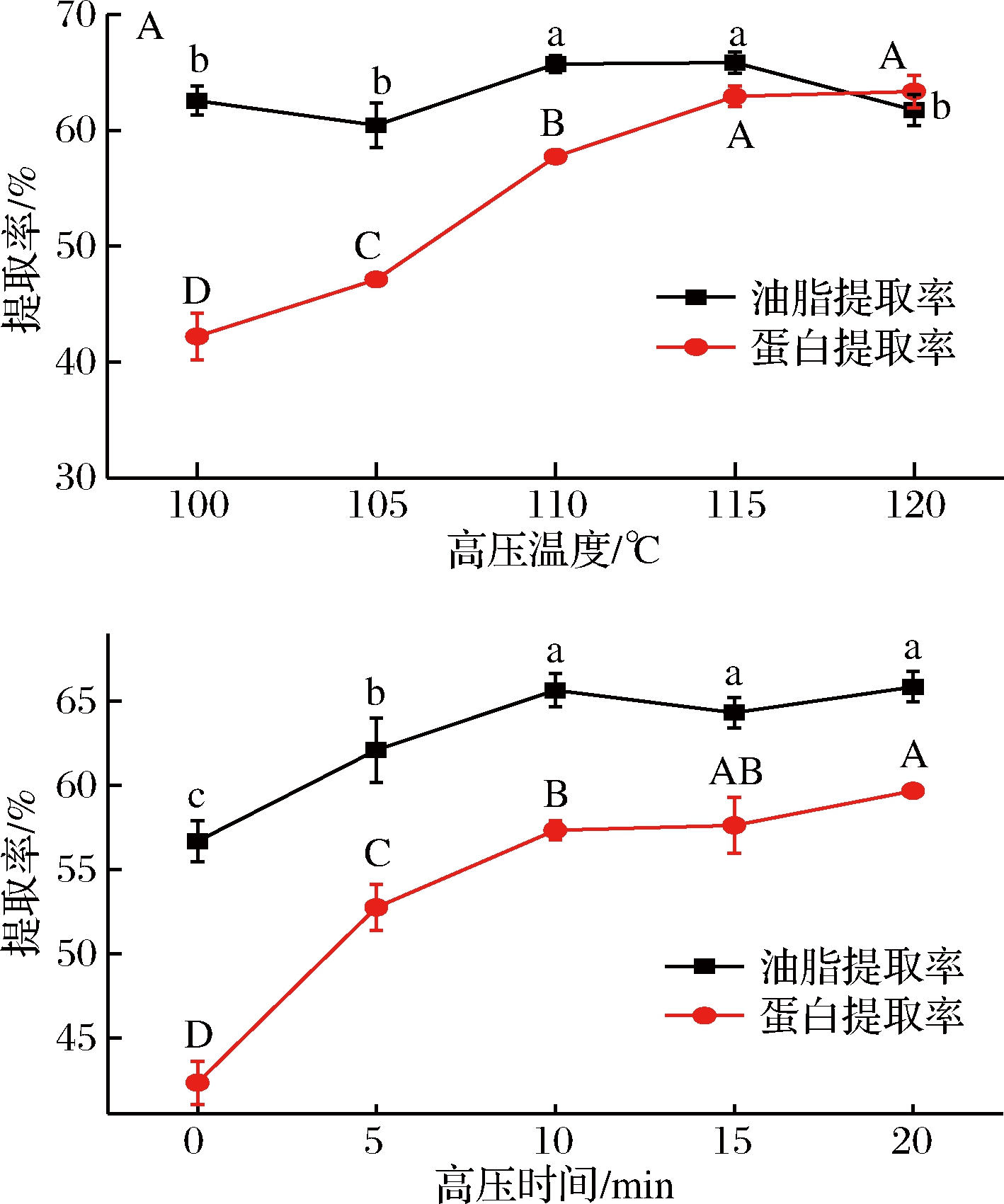
图3 高压温度(A)和时间(B)对辣木籽油提取率的影响
Fig.3 Effect of highpress temperature (A) and time (B) on oil recovery from the Moringa oleifera seed powder
2.2.3 高压预处理酶解时间对辣木籽油提取率的影响
在高压温度110 ℃,高压时间10 min的条件下,高压预处理酶解时间(0.5~5 h)对辣木籽油提取率的影响如图4-A所示。酶解时间从0.5 h延长至2 h时,油脂提取率从56.17%提高至65.48%,这可能是由于随着酶解时间的延长,更多的蛋白被水解(蛋白提取率增加了10.07%),促进了油脂的释放。当酶解时间延长至5 h,油脂提取率显著下降(油脂提取率从65.71%降低至57.14%),这可能是因为高温高压作用以及长时间酶解作用,使大量的蛋白质及蛋白酶解物与油脂发生乳化(图4-B)。YUSOFF等[10]研究了辣木籽粉在高压预处理(50 MPa,60 ℃,35 min)后酶解12.5 h,辣木籽油提取率为73.02%,而本试验在高压预处理(110 ℃,10 min)后酶解2 h即可达到相近的提取率(65.48%),有效地缩短了提取时间,因此,高压预处理可显著提高油脂提取效率。
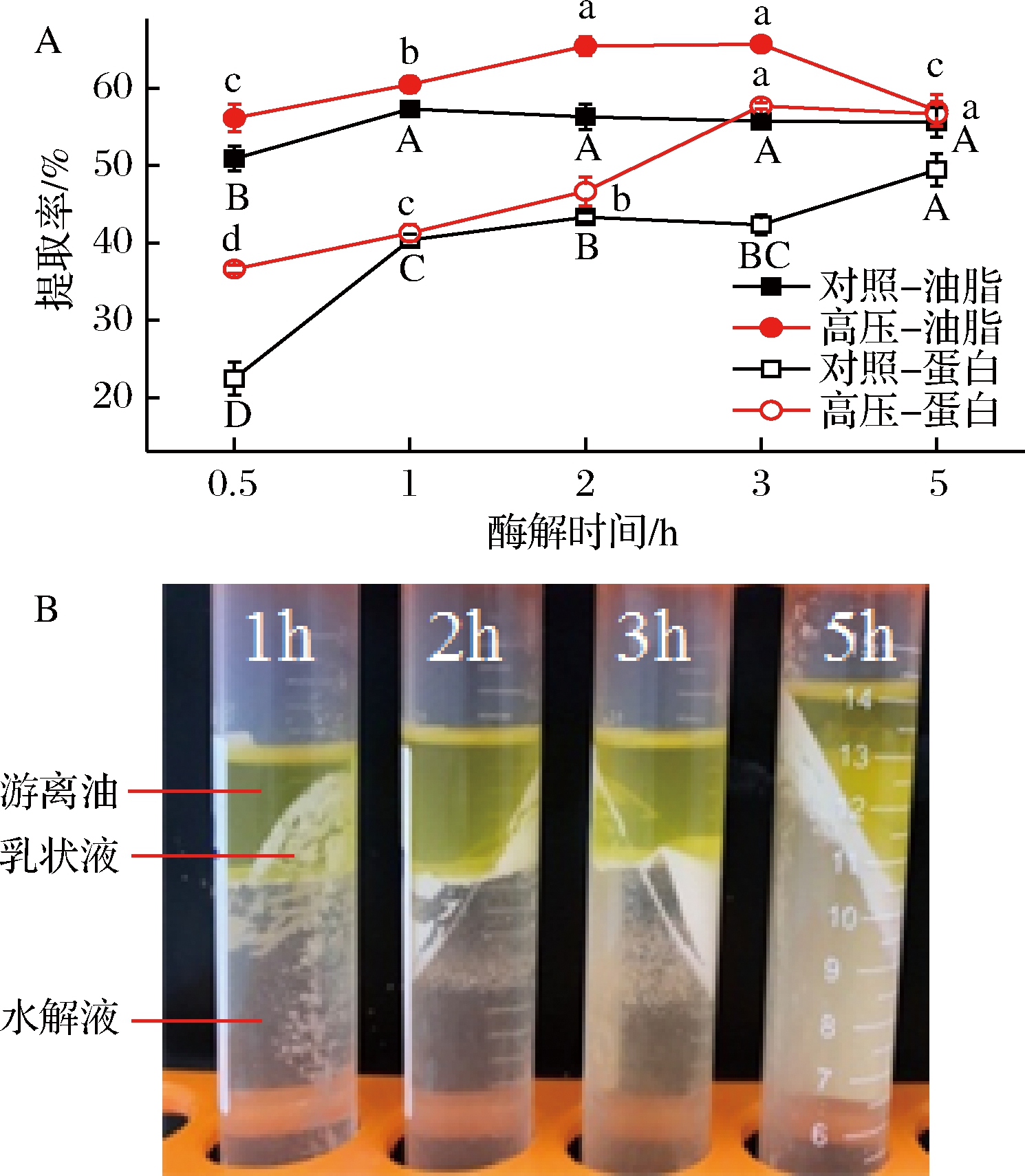
图4 酶解时间对辣木籽油提取率(A)和乳状液形成(B)的影响
Fig. 4 Effect of reaction time on oil recovery (A) and cream emulsion formed (B) from the Moringa oleiferaseed powder
2.3 超声预处理对辣木籽油提取率的影响
2.3.1 超声功率对辣木籽油提取率的影响
在超声时间10 min,酶解时间3 h的条件下,超声功率(40~720 W)对辣木籽油提取率的影响如图5-A所示。当超声功率从40 W升高到720 W,油脂提取率降低了6.96%,这可能是因为较强的超声功率使蛋白质分子聚集,溶解度下降(蛋白提取率下降了6.16%),不利于油脂释放[20-22]。因此,选择提取辣木籽油的超声功率为40 W。
2.3.2 超声时间对辣木籽油提取率的影响
在超声功率40 W,酶解时间3 h的条件下,超声时间(10~50 min)对辣木籽油提取率的影响如图5-B所示。当超声时间从10 min升高到20 min,油脂提取率从58.96%显著提高至66.29%(P<0.05),这可能是因为随着超声时间的延长,超声波的空化作用及机械振荡作用对原料组织的细胞破碎程度增大,使其内部的油脂得以释放[23-24]。超声时间20~40 min,油脂提取率变化不明显。超声时间继续至50 min,油脂提取率降低了2.32%,这可能是因为随着提取时间的延长,蛋白分子发生聚集,不利于酶的作用使蛋白提取率降低了3.13%,抑制了油脂的释放。因此,选择提取辣木籽油的超声时间为20 min。
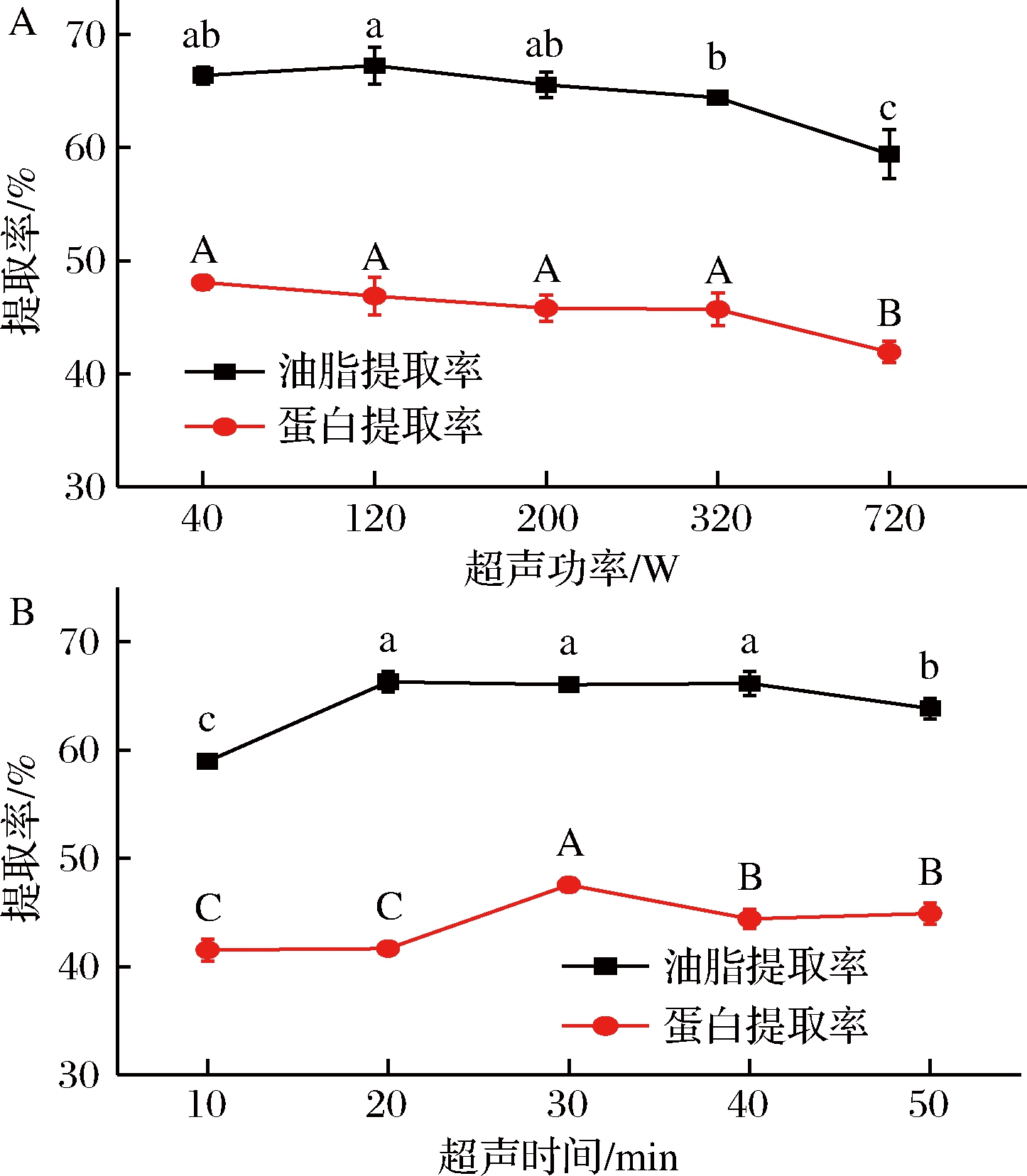
图5 超声功率(A)和时间(B)对辣木籽油提取率的影响
Fig.5 Effect of ultrasonic power (A) and time (B) on oil recovery from the Moringa oleifera seed powder
2.3.3 酶解时间对辣木籽油提取率的影响
在超声功率40 W,超声时间20 min的条件下,酶解时间(0.5~5 h)对辣木籽油提取率的影响如图6-A所示。随着酶解时间从0.5 h升高到1 h,油脂提取率显著提高了4.86%(P<0.05),这可能是因为随着酶解时间的延长,蛋白溶解度增大(蛋白提取率提高了4.54%),使被蛋白包围的油脂得以释放。酶解时间1 h到3 h油脂提取率变化不明显。酶解时间继续至5 h时,油脂提取率下降了3.15%,而蛋白提取率(42.05%)不再显著增加(P>0.05),这可能是因为蛋白及蛋白酶解物与油脂发生乳化。超声酶解1 h(图6-A)和高压酶解2 h(图4-A)油脂提取率显著高于微波酶解1 h(图2)和对照酶解1 h(P<0.05);另外,超声预处理5 h乳化程度(图6-B)小于其他预处理(图4-B),且蛋白提取率低于其他处理组。这说明超声在提高油脂提取率的基础上还可以在一定程度上缓解油脂严重乳化现象。ABDULKARIM等[25]研究表明,不经预处理辅助水酶法提取辣木籽油,酶解24 h后提取率为73.38%。也有研究通过碱提的方法水解蛋白质促进油脂的释放,添加复合酶酶解24 h后,也可得到相近的提取率(70.09%)[8]。而本试验分别经高压和超声预处理后酶解1~2 h,均可达到相近的提取率,大大缩短了提取时间,有效提高了油脂提取效率。

图6 酶解时间对辣木籽油提取率(A) 和乳状液形成(B)的影响
Fig. 6 Effect of reaction time on oil recovery (A) and cream emulsion formed (B) from the Moringa oleiferaseed powder
2.4 不同预处理对辣木籽表观结构分析
与传统水酶法相比,3种预处理方法均能显著提高油脂提取率,其中超声和高压处理效果最好,为了进一步解释这一结果,通过扫描电镜对预处理提取前后辣木籽粉的微观表面形貌进行观察,分析不同预处理提取辣木籽油的机理,结果如图7所示。

A-提取前;B-水酶法提取后;C-微波+水酶法提取后;D-高压+水酶法提取后;E-超声+水酶法提取后
图7 辣木籽扫描电镜图(×1 500)
Fig.7 The images of scanning electron microscope
提取前辣木籽粉呈不规则圆形,表面较为粗糙(图7-A)。不经预处理的水酶法提取使辣木籽结构明显膨胀、体积增大(图7-B)。微波处理是利用微波的热效应在短时间内升高其内部温度,使结构变得膨胀,经酶解后辣木籽粉表面出现小的凹陷、卷曲和破碎(图7-C);高压处理是利用高温高压的膨胀挤压作用使辣木籽细胞组织松散、破碎,经酶解后辣木籽粉呈不均匀的片状结构(图7-D);而超声的机械振荡作用能更彻底地破坏其表观结构,使辣木籽颗粒变得更加细小,有明显的孔洞,更有利于油脂的释放(图7-E)。这说明,微波、高压、超声3种预处理辅助水酶法均有利于破坏辣木籽表观结构,促进酶解作用,使得更多油脂被释放,从而提高辣木籽油的提取率。其中超声和高压预处理对其结构破坏程度最大,更有助于油脂的释放,油脂提取率提高,这与单因素试验中超声和高压预处理油脂提取率较高的结果一致。
3 结论
(1)微波酶解1 h油脂提取率为62.09%;高压酶解2 h油脂提取率为65.48%;超声酶解1 h油脂提取率为66.35%,而对照组油脂提取率仅为56.45%。说明3种处理方法均可以高效地提高油脂提取效率,其中超声和高压预处理效果更好。
(2)扫描电镜结果表明,微波处理使辣木籽粉表面出现小的凹陷、卷曲和破碎;高压处理使辣木籽粉呈不均匀的片状结构;而超声使辣木籽颗粒变得更加细小,有明显的孔洞。3种预处理辅助水酶法均不同程度地破坏了辣木籽的表观结构,其中超声的空化和机械振荡作用以及高压的膨胀挤压作用对其结构的破坏效果更为明显,更有利于蛋白酶水解细胞内部的蛋白质,促进油脂释放,这与单因素试验中超声和高压预处理油脂提取率较高的结果一致。因此,超声和高压预处理能够有效地提取辣木籽油。
[1] 许敏, 赵三军,宋晖,等. 辣木的研究进展[J].食品科学,2016,37(23):291-301.
[2] UPADHYAY P, YADAV M K, MISHRA S, et al. Moringa oleifera: A review of the medical evidence for its nutritional and pharmacological properties[J].International Journal of Research in Pharmacy and Science,2015,5(2):12-16.
[3] TSAKNIS J, LALAS S, GERGIS V, et al. Characterization of Moringa oleifera variety Mbololo seed oil of Kenya[J].Journal of Agricultural and Food Chemistry,1999,47(11):4 495-4 499.
[4] SALAHELDEEN M, AROUA M K, MARIOD A A, et al. An evaluation of Moringa peregrina seeds as a source for bio-fuel [J].Industrial Crops and Products,2014,61:49-61.
[5] 段琼芬, 刘飞,罗金岳,等. 辣木籽油的超临界CO2萃取及其化学成分分析[J].中国油脂,2010(2):76-79.
[6] 虎虓真, 陶宁萍,许长华. 基于食药价值的辣木籽研究进展[J].食品科学,2018,39(15):302-309.
[7] BHUTADA P R, JADHAY A J B, PINJARI D V, et al. Solvent assisted extraction of oil from Moringa oleifera Lam. seeds[J]. Industrial Crops and Products,2016,82:74-80.
[8] 刘华勇. 水酶法同时提取辣木籽油和抗氧化肽的研究[D].广州:华南理工大学,2016.
[9] ANWAR F, LATIF S. Quality assessment of Moringa concanensis seed oil extracted through solvent and aqueous-enzymatic techniques[J].Grasas Y Aceites,2008,59(1):69-75.
[10] YUSOFF M M, NIRANJAN K, GORDON M H, et al. High pressure pre-treatment of Moringa oleifera seed kernels prior to aqueous enzymatic oil extraction[J].Innovative Food Science and Emerging Technologies,2017,39:129-136.
[11] 陈德经. 微波预处理水酶法提取茶叶籽油工艺优化[J].食品科学,2012,33(6):87-91.
[12] LIU S, JIANG L Z, LI Y. Research of aqueous enzymatic extraction of watermelon seed oil of ultrasonic pretreatment assisted[J]. Procedia Engineering,2011,15(1):4 949-4 955.
[13] 原姣姣, 王成章,张红玉,等. 超声辅助酶法提取橄榄油的研究[J].中国油脂,2016,41(7):10-14.
[14] JIAO J, LI Z G, GAI Q Y, et al. Microwave-assisted aqueous enzymatic extraction of oil from pumpkin seeds and evaluation of its physicochemical properties, fatty acid compositions and antioxidant activities[J].Food Chemistry,2014,147(6):17-24.
[15] 仵缘, 蒋丹,包瑛,等. 微波辅助溶剂法提取橡胶籽油工艺[J].食品与发酵工业,2015,41(7):244-250.
[16] 胡滨, 陈一资,苏赵. 超声波和微波辅助水酶法提取葡萄籽油的工艺研究[J].中国油脂,2015,40(12):12-17.
[17] VINATORU M, CHEMAT F, MASON T J. The extraction of natural products using ultrasound or microwaves[J].Current Organic Chemistry,2011,15(2):237-247.
[18] 杨慧萍, 宋伟,王素雅,等. 高压蒸煮、超声波辅助水酶法处理米糠技术研究[J].粮食与饲料工业,2005,12:20-21.
[19] JUNG S, MAHFUZA A. Low temperature dry extrusion and high-pressure processing prior to enzyme-assisted aqueous extraction of full fat soybean flakes[J].Food Chemistry,2009,114(3):947-954.
[20] ATHANASIOS C, NIKOLAS G S, DIMITRA J D, et al. Comparison of distillation and ultrasound-assisted extraction methods for the isolation of sensitive aroma compounds from garlic (Allium sativum)[J].Ultrasonics Sonochemistry,2006,13(1):54-60.
[21] PINGRET D, FABIANO-TIXIER A S, CHEMAT F. Degradation during application of ultrasound in food processing: A review[J].Food Control,2013,31(2):593-606.
[22] 洪晴悦, 张玉. 超声波辅助提取牡丹籽毛油的工艺优化及脂肪酸组成分析[J].食品与发酵工业,2018,44(3): 159-164.
[23] SHARMA A, GUPTA M N. Ultrasonic pre-irradiation effect upon aqueous enzymatic oil extraction from almond and apricot seeds[J].Ultrasonics Sonochemistry,2006,13(6):529-534.
[24] TOMA M, VINATORU M, PANIWNYK L, et al. Investigation of the effects of ultrasound on vegetal tissues during solvent extraction[J].Ultrasonics Sonochemistry,2001,8(2):137-142.
[25] ABDULKARIM S M, LONG K, LAI O M, et al. Some physico-chemical properties of Moringa oleifera seed oil extracted using solvent and aqueous enzymatic methods[J].Food Chemistry,2005,93(2):253-263.