姜黄素又称姜黄色素,是常用的天然黄色色素,有特殊芳香味道。大量文献记载,姜黄素具有多种药理作用,尤其在抗动脉硬化、抗炎、抗氧化、抗肿瘤等方面具有广阔的应用前景[1]。但姜黄素水溶性低,稳定性差,经胃肠吸收率较低,代谢快[2],所以限制了其在体内的应用。因此,合适的姜黄素载体是提高其生物利用率的重要手段,新型姜黄素缓释载体的研究逐渐受到重视,所涉及领域也日益广泛[3]。
水凝胶作为药物载体应用已经趋于广泛,且具有良好缓释效果。近年来,有关对姜黄素复合水凝胶的研究越来越受到重视[4]。水凝胶是高度溶胀、亲水、三维聚合物网络结构,由于存在交联,纠缠或结晶区[1],能吸收大量水而不溶于水。通过天然材料聚合形成的水凝胶具有生物相容性和可生物降解,是用于药物生物材料传递系统非常重要的性质,越来越受到研究人员的关注。水凝胶网络之间存在大量空隙,姜黄素分子可以连接在网络里,使释放能力持续而高效。利用水凝胶对温度、pH敏感的特性,可以将姜黄素运载到癌细胞等靶位点,起到定向治疗疾病的作用。NAMDARI等[5]制备了姜黄素负载水凝胶复合物用于心力衰竭大鼠模型2周,结果显示效果良好,且此载体未发现明显毒副作用。还有学者通过简单混合和原味聚合制作出一种改良蜂蜜-姜黄素水凝胶复合海绵载体,具有良好的液体吸收能力和缓释作用,且对糖尿病、足溃疡有明显适用性[6]。
木薯淀粉是一种高度可溶胀的、pH响应和生物相容性聚合物,可用于将药物输送到体内。木薯淀粉是丰富的天然聚合物,由于其来源丰富、成本低廉、无毒无害、生物降解等天然的特性,在各领域得到一定应用[7]。由木薯淀粉制备的水凝胶亲水性大,水溶胀度高,且三维网状结构利于药物输送,所以本实验采用木薯淀粉接枝丙烯酰胺制备水凝胶用于负载姜黄素,且具有良好的药物缓释效果。木薯淀粉水凝胶已成为较被重视的药物载体,也能提高木薯淀粉及水凝胶的应用价值。
1 材料与方法
1.1 材料与试剂
木薯淀粉,工业级,广西武鸣安宁淀粉有限公司;丙烯酰胺(AM),化学纯,国药集团化学试剂有限公司;N,N-亚甲基双丙烯酰胺(NMBA),分析纯,阿达玛斯;过硫酸钾(KPS),分析纯,广东市金华大化学试剂有限公司;无水乙醇,分析纯,成都市科隆化学品有限公司;姜黄素,分析纯,麦克林;氘代试剂,分析纯,上海玉博生物科技有限公司。
1.2 仪器与设备
JHS恒速数显控制器,杭州仪表电机有限公司;DF-101S集热式恒温加热磁力搅拌器,巩义市予华仪器有限责任公司;DGG-9070AD电热恒温鼓风干燥箱,上海齐欣科学仪器有限公司;FD-1000冷冻干燥机,埃朗科技国际贸易有限公司;分析天平(BSA224S/0.000 1g),赛多利斯科学仪器(北京)有限公司;MAGNA-1R550傅里叶变换红外光谱仪,美国Thermo公司;TG-DSC同步热分析仪(STA449F3),德国耐驰仪器制造有限公司;TQ2-312台式全温振荡器,上海精宏实验设备有限公司;Cary100紫外-可见分光光度计,Agilent Technologies。
1.3 方法
1.3.1 木薯淀粉水凝胶的制备
称取1 g木薯淀粉于100 mL蒸馏水中,温度为75 ℃水浴糊化30 min至糊化完全,加入5 g丙烯酰胺于混合物中,用磁力搅拌器以75 ℃的温度继续搅拌20 min,再加入0.06 g N,N-亚甲基双丙烯酰胺,加5 mL蒸馏水稀释,最后将0.03 g过硫酸铵溶于5 mL蒸馏水中,加入后继续以75 ℃温度磁力搅拌10 min。搅拌结束后,75 ℃水浴中静置10 min成均匀胶状,将胶状物倒入100 mL乙醇中,保持2 min,倾倒出乙醇,再加入100 mL新鲜乙醇,保持24 h以完成脱水,将脱水后的凝胶在50 ℃烘箱中干燥24 h,烘干后用蒸馏水浸泡24 h,再次烘干,备用[8]。
1.3.2 木薯淀粉水凝胶红外性能表征
取1~2 mg已完全干燥的水凝胶样品,与50~100 mg干燥的KBr粉末混合,置于玛瑙研钵中充分研磨,将研磨好的混合物粉末放入压模中,在10 kPa的压力下压制成透明薄片,放入红外光谱仪进行测试,在4 000~500 cm-1波长范围内,扫描。
1.3.3 木薯淀粉水凝胶核磁共振性能表征
取6~10 mg溶胀后的水凝胶样品,溶于氘代试剂中,放入核磁共振仪中进行测试。
1.3.4 木薯淀粉水凝胶X射线衍射性能表征
将完全冷冻干燥的水凝胶研磨成粉末,压片后置于XRD中扫描得到XRD图。
1.3.5 木薯淀粉水凝胶机械性能测试
取小块定型的水凝胶,在蒸馏水中浸泡达到溶胀平衡后,进行拉伸、压缩、打结实验。
1.3.6 姜黄素载药性能的测定
1.3.6.1 姜黄素及PBS缓冲液最大吸收波长的测定
将姜黄素在无水乙醇中配制成一定浓度溶液,在波长200~800 nm范围内,用紫外-可见分光光度计进行全波长扫描,由紫外吸收光谱图选择乙醇溶液中姜黄素的检测波长。
配制pH值为7.4的PBS磷酸盐缓冲液,即为人体组织液及血液的模拟系统。将姜黄素在上述缓冲液(含0.5% 吐温-80)中配制成一定浓度溶液,在波长200~800 nm,进行全波长扫描,以选择PBS磷酸盐缓冲液中姜黄素的检测波长。
1.3.6.2 姜黄素标准曲线的测定
准确称取25 mg姜黄素,用无水乙醇溶解后,将姜黄素的乙醇溶液移到250 mL容量瓶中,再用无水乙醇进行定容,得到100 μg/mL的储备液。精密移取2、3、4、5、6 mL 100 μg/mL的储备液,将其分别移到100 mL的容量瓶中,用无水乙醇进行定容,即制成2~6 μg/mL系列标准溶液。用无水己醇做空白对照液,分别在427 nm处测定其吸光度。以浓度(C,μg/mL)为横坐标,吸光度(A)为纵坐标,绘制标准曲线。
1.3.6.3 PBS缓冲液标准曲线的测定
精密称取25 mg姜黄素,用乙醇溶解,转移到250 mL容量瓶中,用1.3.6.1 PBS缓冲液定容,得到100 μg/mL的药物溶液,精密移取2、3、4、5、6 mL的药物溶液到100 mL容量瓶,以PBS缓冲液(pH=7.4,含0.5 %吐温-80)定容,即制得浓度为2~6 μg/mL系列标准溶液。用PBS缓冲液做空白对照,分别在427 nm处测定其吸光度。以浓度(C,μg/mL)为横坐标,吸光度(A)为纵坐标,绘制标准曲线。
1.3.6.4 载药性能的影响因素考察
采用吸附法测定姜黄素溶液吸附前后在427 nm处的吸光度。木薯淀粉水凝胶对姜黄素药液的载药量按式(1)、(2)计算,对其进行各因素载药性能影响研究。
![]()
(1)
![]()
(2)
式中: C0表示姜黄素初始药液浓度,mg/L;Ct表示姜黄素t时刻的药液浓度,mg/L;Ce表示姜黄素平衡药液浓度,mg/L;Qt表示t时刻的载药量,mg/g;Qe表示平衡载药量,mg/g;V表示姜黄素药液体积,L;m表示加入木薯淀粉水凝胶的量,g。
1.3.6.5 姜黄素释药性能的考察
将纯姜黄素与最佳条件下负载于水凝胶中的姜黄素作为对照,分别置于含有10 mL PBS缓冲液的洗净的透析袋中,透析外液为500 mL PBS缓冲液,37℃恒温振荡,设定振荡时间分别为0.5、1、2、3、5、8、10、12、24、36、48、72 h后,分别取10 mL样品液于比色皿中,随后补充10 mL新PBS缓冲液,保持缓冲体系稳定[9]。在最大吸收波长处测吸光度,带入标准曲线方程计算药物浓度,计算累积释药百分率并作累积释药曲线。
2 结果与讨论
2.1 红外图谱分析
木薯淀粉水凝胶红外图谱如图1所示。
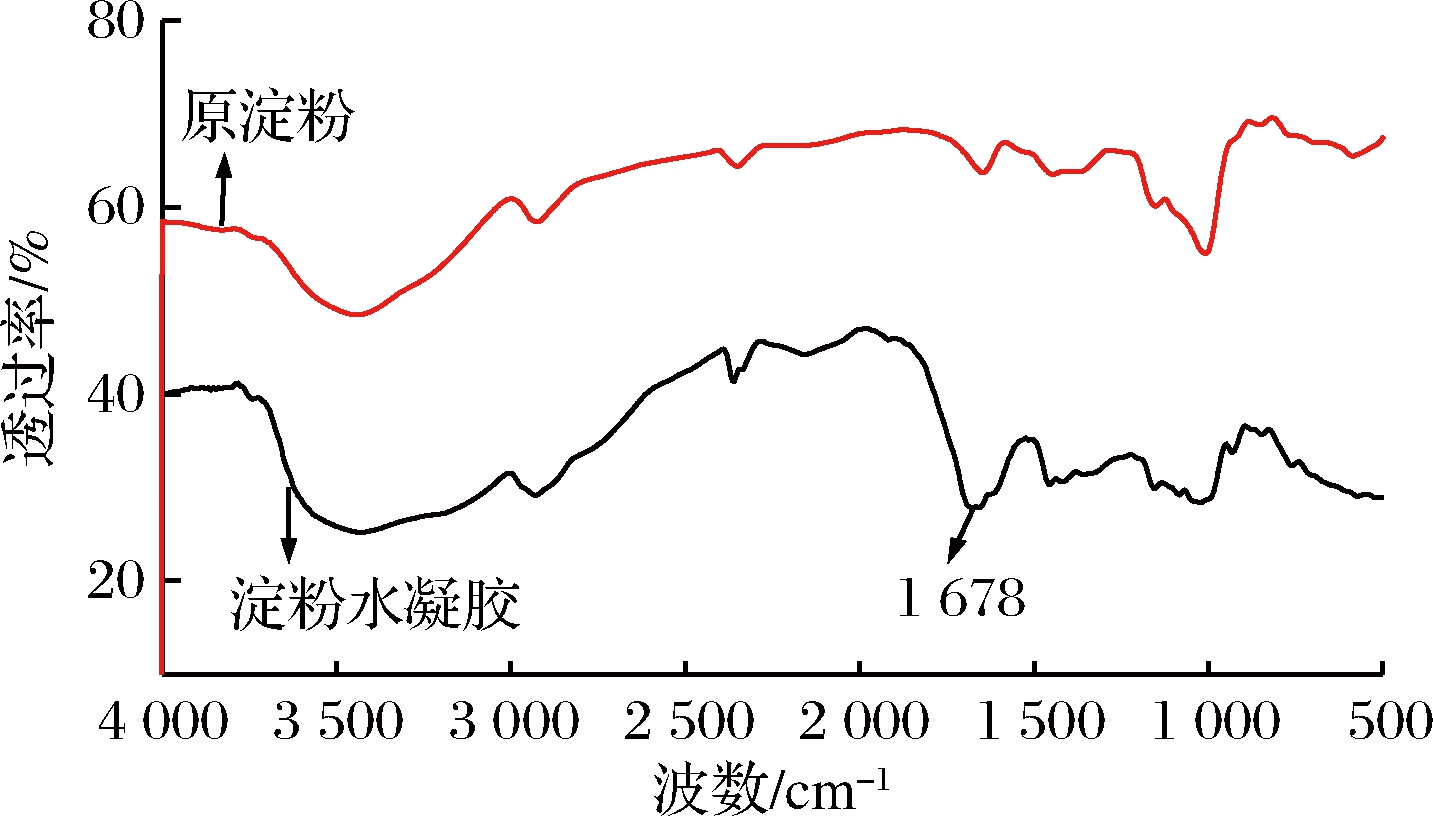
图1 木薯淀粉水凝胶红外图谱
Fig.1 Infrared map of tapioca starch hydrogel
由图1可知,原淀粉在3 432 cm-1,1 640 cm-1,1 380 cm-1,1 157 cm-1,1 006 cm-1处有强吸收峰,其中3 432 cm-1处为葡萄糖单元中-OH的伸缩振动吸收峰[10],1 640 cm-1处为羰基C=O吸收峰,1 380 cm-1处为C—C的弯曲振动吸收峰,1 157 cm-1处为淀粉中糖苷键C—O—C的特征吸收峰[11],1 006 cm-1为骨架振动峰。水凝胶除了有原淀粉本身的吸收峰外, 3 429 cm-1附近峰变宽是存在N—H对称和不对称宽峰,1 678 cm-1附近出现C—N链的伸缩振动峰,是酰胺特征峰[12],说明丙烯酰胺成功嫁接到淀粉骨架上。
2.2 核磁共振图谱分析
木薯淀粉水凝胶核磁图谱如图2所示。
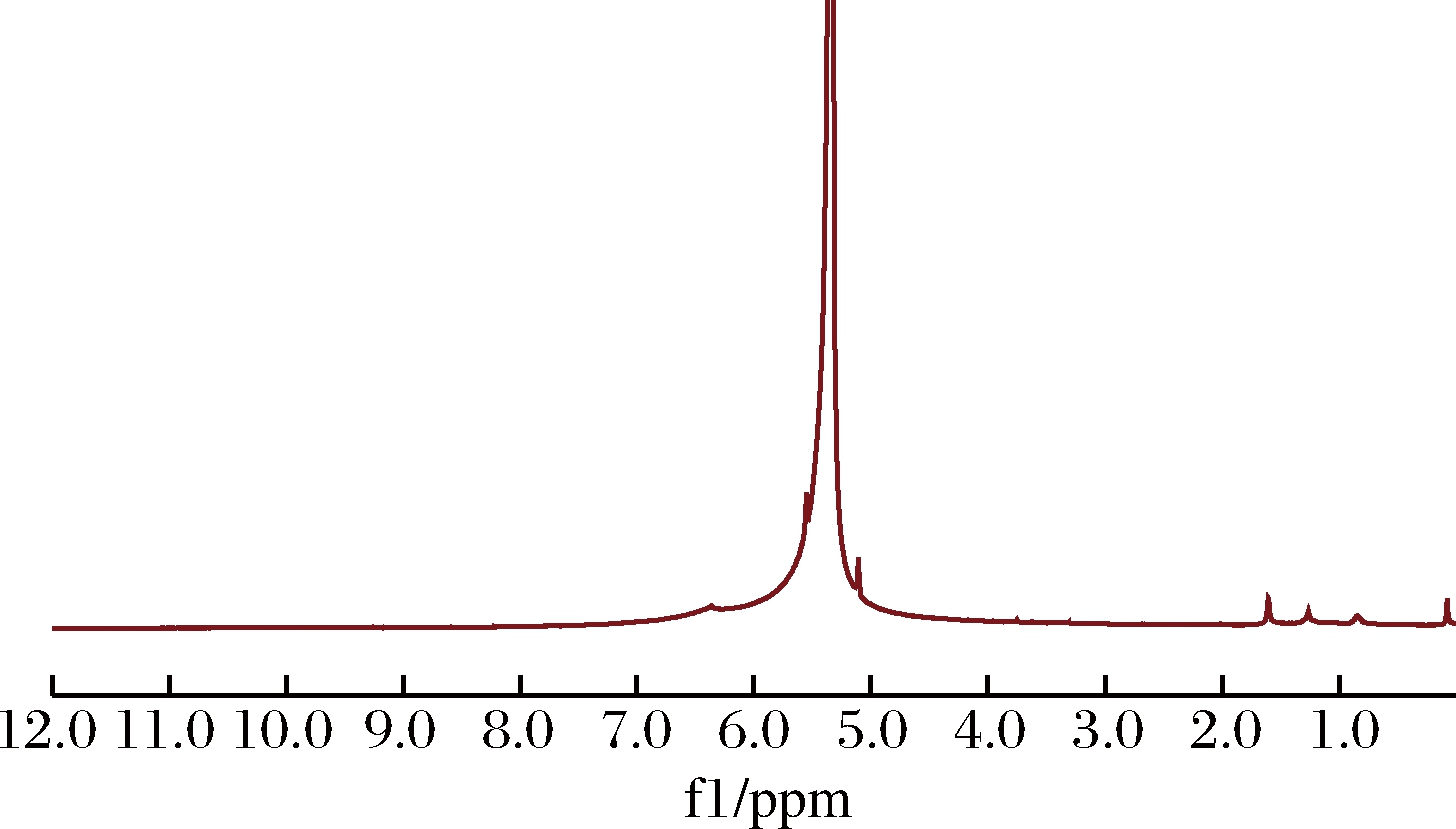
图2 木薯淀粉水凝胶核磁共振图谱
Fig.2 Nuclear magnetic resonance spectroscopy of tapioca starch hydrogel
由图2可知,δ=1.27~1.80 ppm是丙烯酰胺中亚甲基上氢的位移[13],δ=5.00~6.50 ppm是丙烯酰胺特征基团酰胺基团上氢的位移。核磁谱图证明丙烯酰胺已经成功接枝。
2.3 X射线衍射图谱分析
木薯淀粉水凝胶X射线衍射图谱如图3所示。

图3 木薯淀粉和水凝胶XRD图
Fig.3 XRD pattern of cassava starch and hydrogel
原淀粉XRD衍射图约在15°、17°、18°、23°附近有衍射峰,这是多结晶区域,水凝胶的XRD衍射图在20°左右,结晶进一步减少,分子间氢键被破坏,说明木薯淀粉发生反应成水凝胶后改变了原有的结晶。淀粉分子链上具有很多羟基,亲水性很强,但是淀粉颗粒不溶于水,这是因为羟基之间通过氢键结合,颗粒中水分也参与形成氢键的缘故。淀粉颗粒内部有结晶和无定形区域,后者具有较高的渗透性,化学反应主要是发生在这个区域,反应后的水凝胶主要为无定形,渗透性升高,溶胀性能良好[7]。
2.4 木薯淀粉水凝胶机械性能分析
水凝胶作为药物输送系统需要足够的机械强度,这样才可以承受器官收缩期间的压力并延长药物在人体内滞留时间,具有较小机械强度的水凝胶可能经过器官收缩导致碎裂[14]。传统有机交联的水凝胶力学性质差,在较小外力或形变作用下易碎,本实验使用丙烯酰胺接枝木薯淀粉制备的水凝胶,由图4可知,木薯淀粉水凝胶能够拉伸至原来的5倍甚至更长长度都不断裂,用手指充分压缩后能够迅速回弹,恢复原有形状并且还能够保持凝胶体完整,能够在进行打结时凝胶样品不发生破坏,表现出优异的机械性质[15]。

图4 水凝胶机械性能测定
Fig.4 Determination of mechanical properties of hydrogel
2.5 木薯淀粉水凝胶载药性能分析
2.5.1 姜黄素及姜黄素-PBS缓冲液最大吸收波长测定
由图5、图6可知,姜黄素溶液以及姜黄素-PBS缓冲液在λ=427 nm处有最大吸收,由此可以确定姜黄素及PBS缓冲液的最大吸收波长为427 nm。

图5 姜黄素最大吸收波长图
Fig.5 Maximum absorption wavelength of curcumin
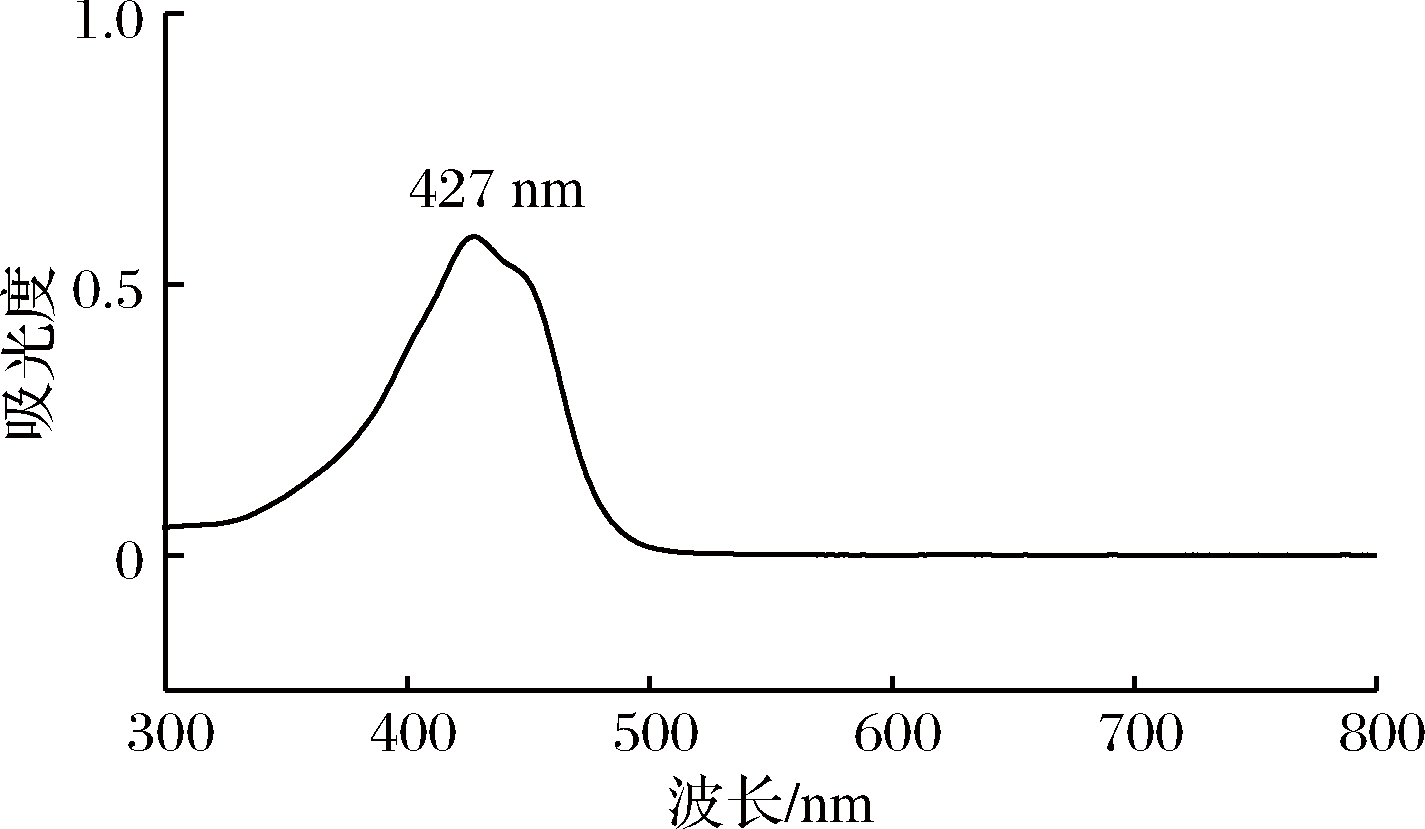
图6 姜黄素-PBS缓冲液最大吸收波长图
Fig.6 Maximum absorption wavelength of curcumin-PBS buffer
2.5.2 姜黄素标准曲线测定
将配制的2~6 μg/mL的姜黄素溶液,在427 nm处分别测定其吸光度,结果如图7所示。
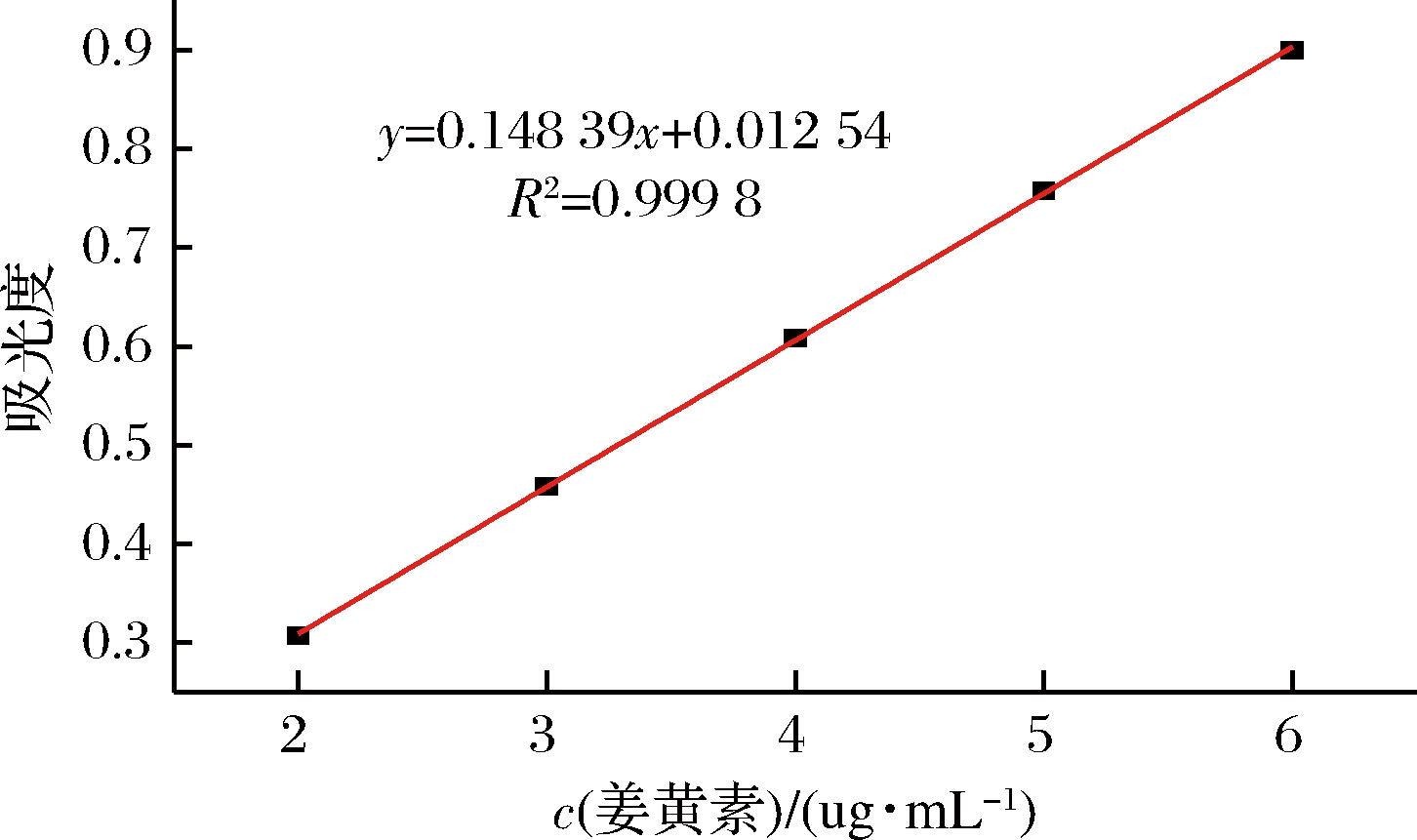
图7 姜黄素标准曲线图
Fig.7 Curcumin standard curve
姜黄素溶液在427 nm处的回归方程为A=0.148 39C+0.012 54(R2=0.999 8),由标准曲线可知,姜黄素浓度在2~6 μg/mL线性关系良好。
2.5.3 姜黄素-PBS缓冲液标准曲线测定
将配制的2~6 μg/mL的姜黄素PBS缓冲液溶液,在427 nm处分别测定其吸光度,结果如图8所示,在427 nm处的回归方程为A=0.141 32C+0.018 55(R2=0.999 85),由标准曲线可知,姜黄素PBS缓冲液的浓度在2~6 μg/mL线性关系良好(图8)。
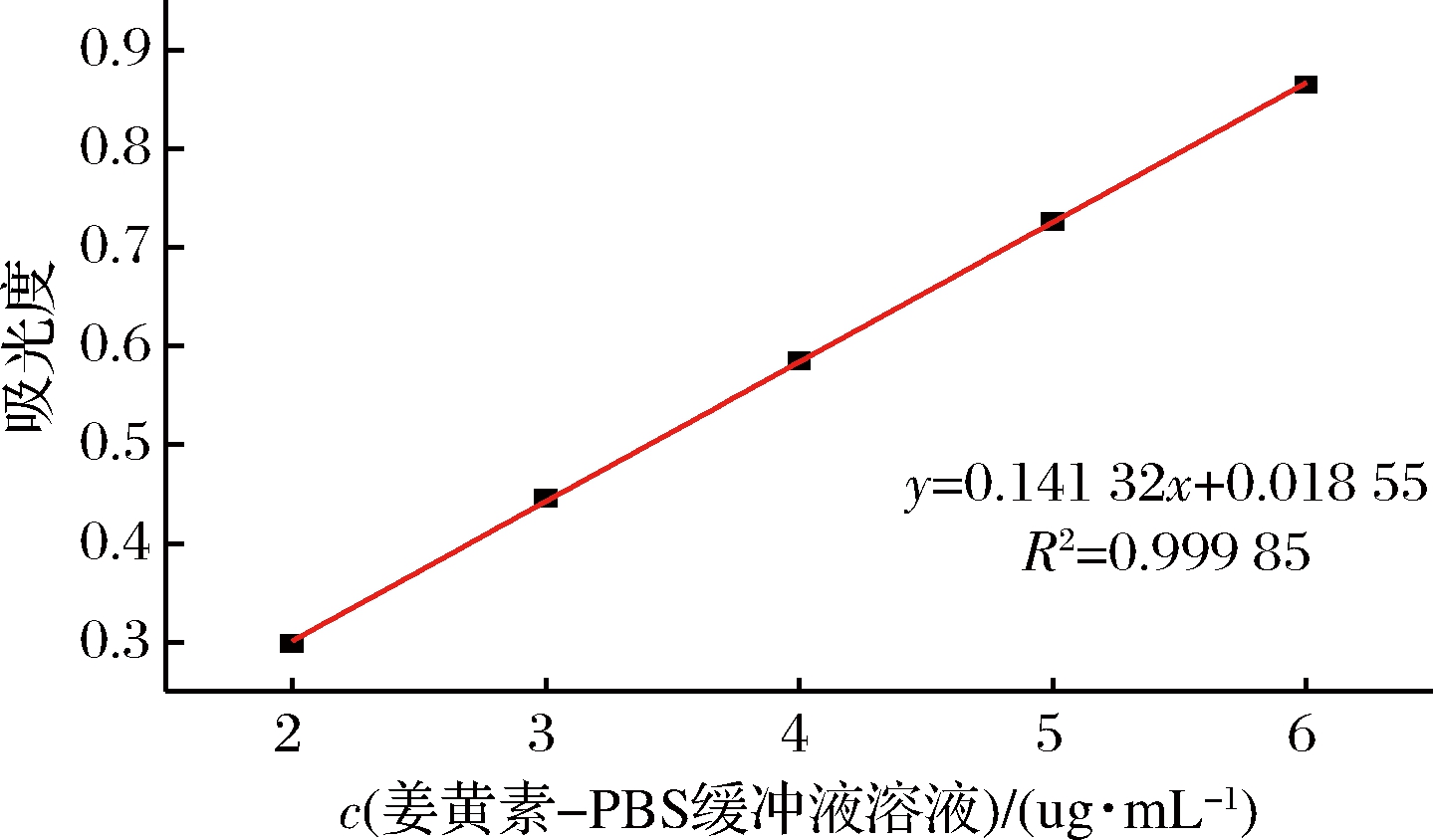
图8 姜黄素-PBS缓冲液标准曲线图
Fig.8 Curcumin-PBS buffer standard curve
2.5.4 各因素对木薯淀粉水凝胶载药性能的影响
2.5.4.1 时间对水凝胶载药性能的影响
称取0.1 g水凝胶,加入到500 mL 100 μg/mL的姜黄素药液中,置于转速120 r/min,35℃恒温摇床中振荡,吸附时间分别为0.25、0.5、1、2、4、6、8、10、12 h,每次取1 mL吸附后药液在25 mL容量瓶中用20%乙醇溶液定容,在紫外分光光度计中测其吸光度,计算其浓度及载药量。实验结果如图9所示。
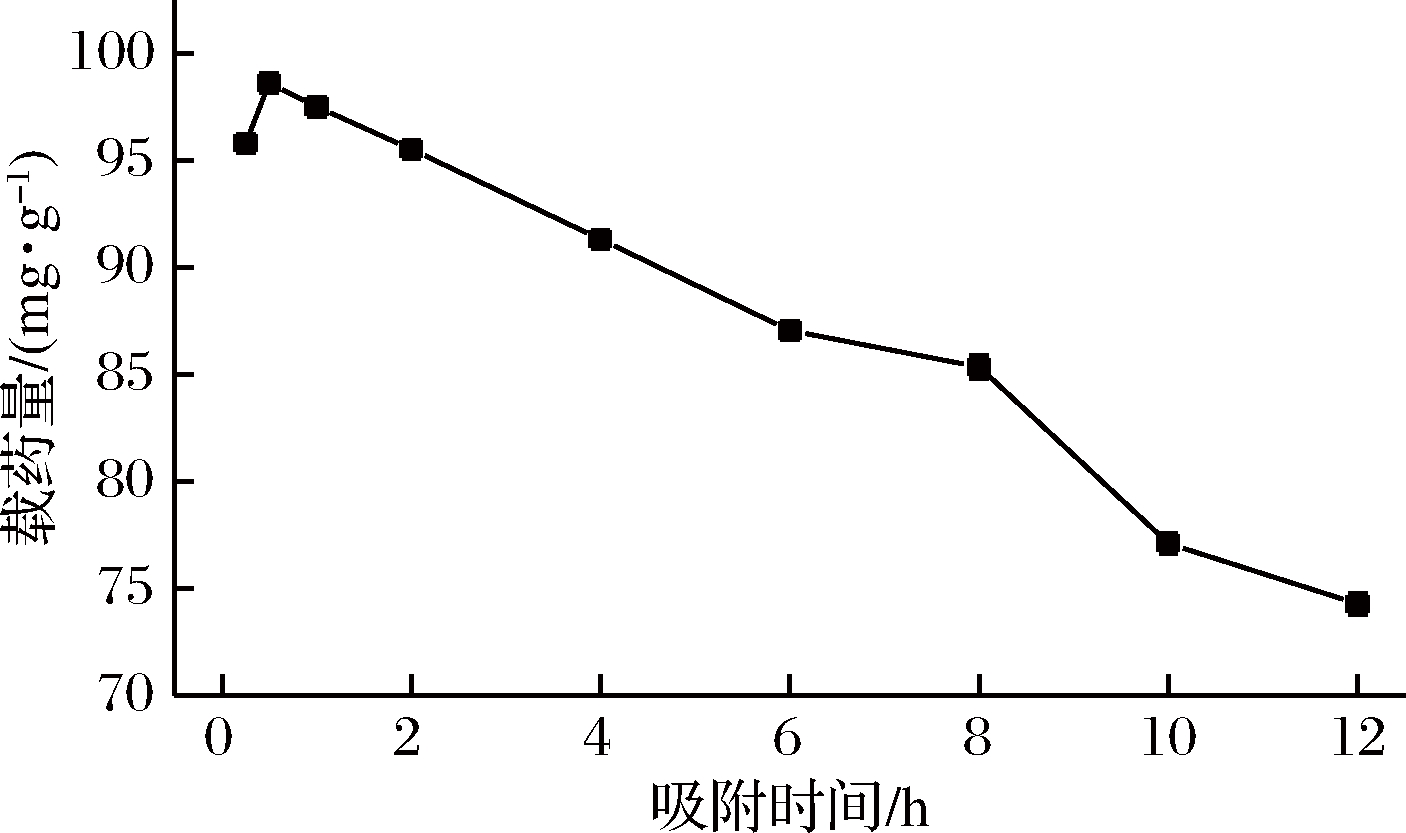
图9 吸附时间对水凝胶载药量的影响
Fig.9 Effect of time on hydrogel loading
由图9可知,初期水凝胶对药物快速吸附,0.5 h达到最大载药量,随后载药量开始降低,因为时间越长药液中的水分进入到水凝胶中,使得水凝胶溶胀,药液中乙醇浓度变大会使水凝胶脱水,姜黄素脱附,载药量降低[16]。
2.5.4.2 乙醇浓度对水凝胶载药性能的影响
称取0.1 g水凝胶,加入到500 mL 100 μg/mL的姜黄素药液中,置于转速120 r/min,35 ℃恒温摇床中振荡吸附0.5 h,每次取1 mL吸附后药液在25 mL容量瓶中分别用体积分数为15%、20%、30%、40%、50%的乙醇溶液定容,在紫外分光光度计中测其吸光度,计算其浓度及载药量。实验结果如图10所示。
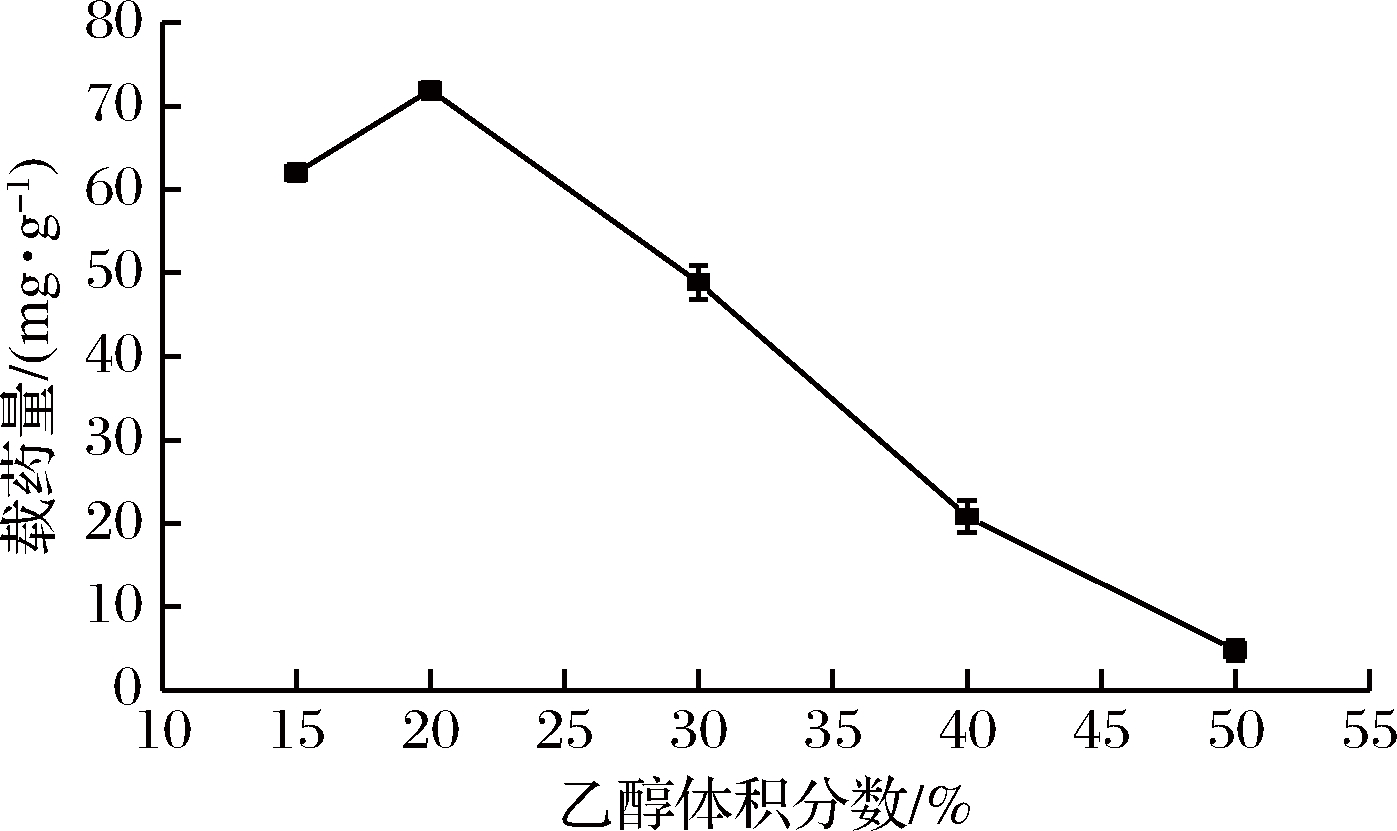
图10 乙醇浓度对水凝胶载药量的影响
Fig.10 Effect of ethanol concentration on hydrogel drμg loading
由图10可知,溶液中乙醇的体积分数对水凝胶负载姜黄素有较大的影响[17]。载药量随着乙醇体积分数呈现先增大后减小的趋势,当乙醇体积分数为20%时,达到最大载药量。乙醇体积分数较低时,姜黄素不能完全溶解,载药量较低;当乙醇体积分数超过20%后,载药量逐渐下降,这是由于溶液中乙醇浓度过高,会使溶胀的水凝胶失水缩小,吸附的药液流出,使载药量降低,所以以体积分数20%的乙醇水溶液配制姜黄素溶液效果最佳[18-19]。
2.5.4.3 温度对水凝胶载药性能的影响
称取0.1 g水凝胶,加入到500 mL 100 μg/mL的姜黄素药液中,置于转速120 r/min,温度分别为25、30、35、40、45 ℃恒温摇床中振荡吸附0.5 h,每次取1 mL吸附后药液在25 mL容量瓶中用20 %乙醇溶液定容,在紫外分光光度计中测其吸光度,计算其浓度及载药量。实验结果如图11所示。

图11 温度对水凝胶载药量的影响
Fig.11 Effect of temperature on hydrogel loading
由图11可知,由于吸附时间较短,温度较低时,凝胶未能完全溶胀,不利于姜黄素的吸附,所以载药量较低,在35 ℃时,达到最大载药量,随着温度升高,姜黄素不稳定,降解速度加快,而且水凝胶的温度敏感特性使得高温时水凝胶急剧收缩[20],药物脱附,所以水凝胶载药量变低。
2.5.4.4 药液初始浓度对水凝胶载药性能的影响
分别称取0.1 g水凝胶,加入到500 mL初始浓度为60、70、80、90、100、110 μg/mL的姜黄素药液,用20%乙醇溶解,置于转速120 r/min,35 ℃恒温摇床中振荡吸附0.5 h,每次取1 mL吸附后药液在25 mL容量瓶中分别用20%乙醇溶液定容,在紫外分光光度计中测其吸光度,计算其浓度及载药量。实验结果如图12所示。
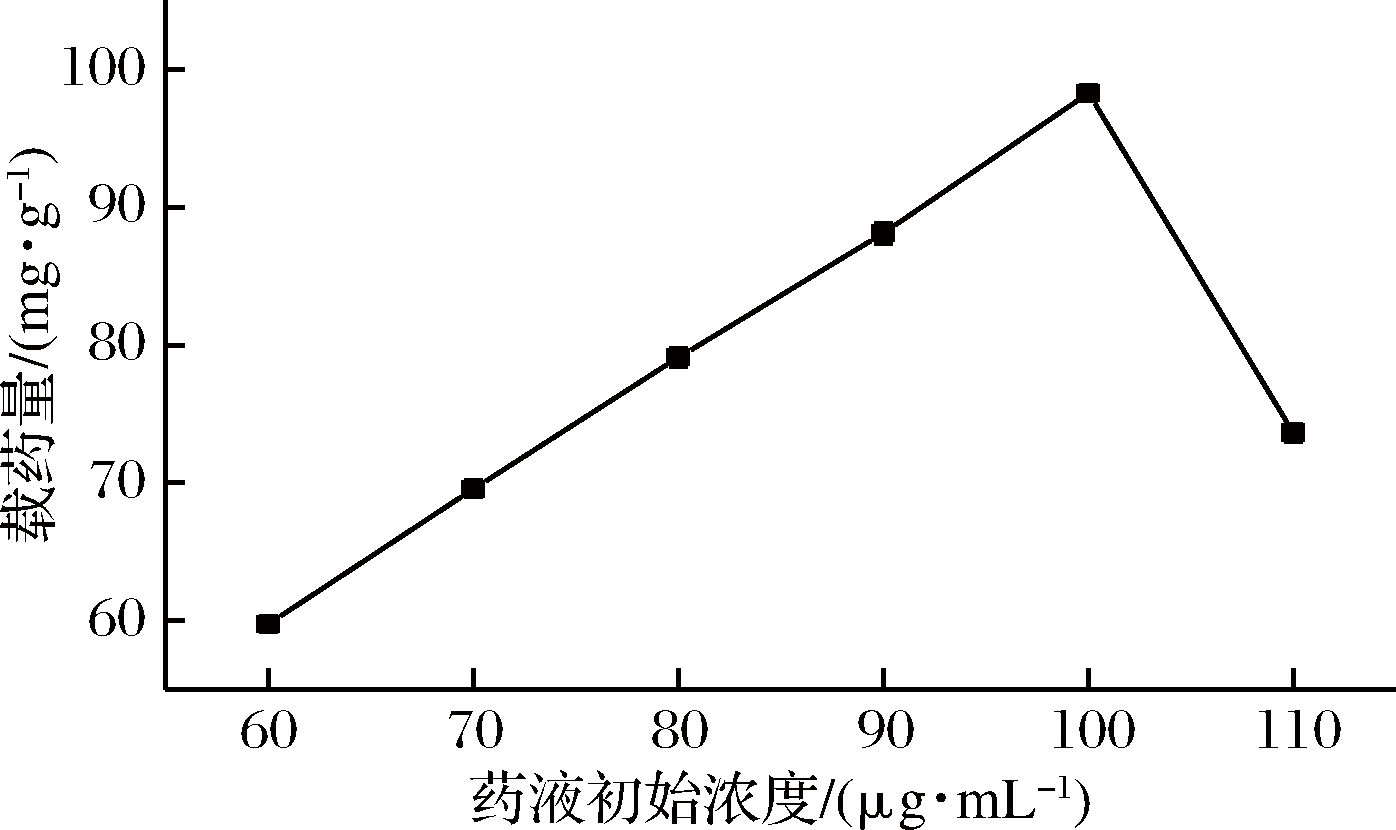
图12 药液初始浓度对水凝胶载药量的影响
Fig.12 Effect of initial concentration of drμg solution on drμg loading of hydrogel
由图12可知,随着姜黄素投药量的增加,水凝胶的载药量不断增加,药液初始浓度达到100 μg/mL时达到最大载药量,此时药液初始浓度达到饱和载药量,浓度继续增加,溶液过饱和,姜黄素溶解不完全使得载药量反而又呈下降趋势。所以水凝胶对姜黄素的有效吸附需要一个最佳的料药比,药液初始浓度过高会使其载药量降低[21]。
2.6 释药性能分析
由图13可知,纯姜黄素释药迅速,5 h时发生突释,释药率达到60%以上,8 h几乎释放完全,释药率达到99%以上。而负载于水凝胶中的姜黄素在介质中的释药过程分为3个阶段:(1)突释阶段。0~2 h药物释放非常迅速,这一阶段释放的主要是吸附在水凝胶表面的药物[22]。(2)缓慢释放阶段。2~48 h,释药曲线逐渐平稳,药物缓慢而均匀的释放入介质中,释药量逐渐增加。(3)平衡缓释阶段。48~72 h这一阶段水凝胶内的药物与水凝胶附近介质内的药物达到吸附-解吸平衡,随着介质内的药物向介质本体的扩散,以及水凝胶在介质中的溶胀、解体,有少量药物向外释放[23-24],释放速率开始变缓。最终,水凝胶内仍保留一部分药物,直到72 h时累计释药量达到80%。与纯姜黄素对比,负载于水凝胶中的姜黄素释药呈规律性变化,所以采用水凝胶作为载体以达到药物缓释的效果[25]。
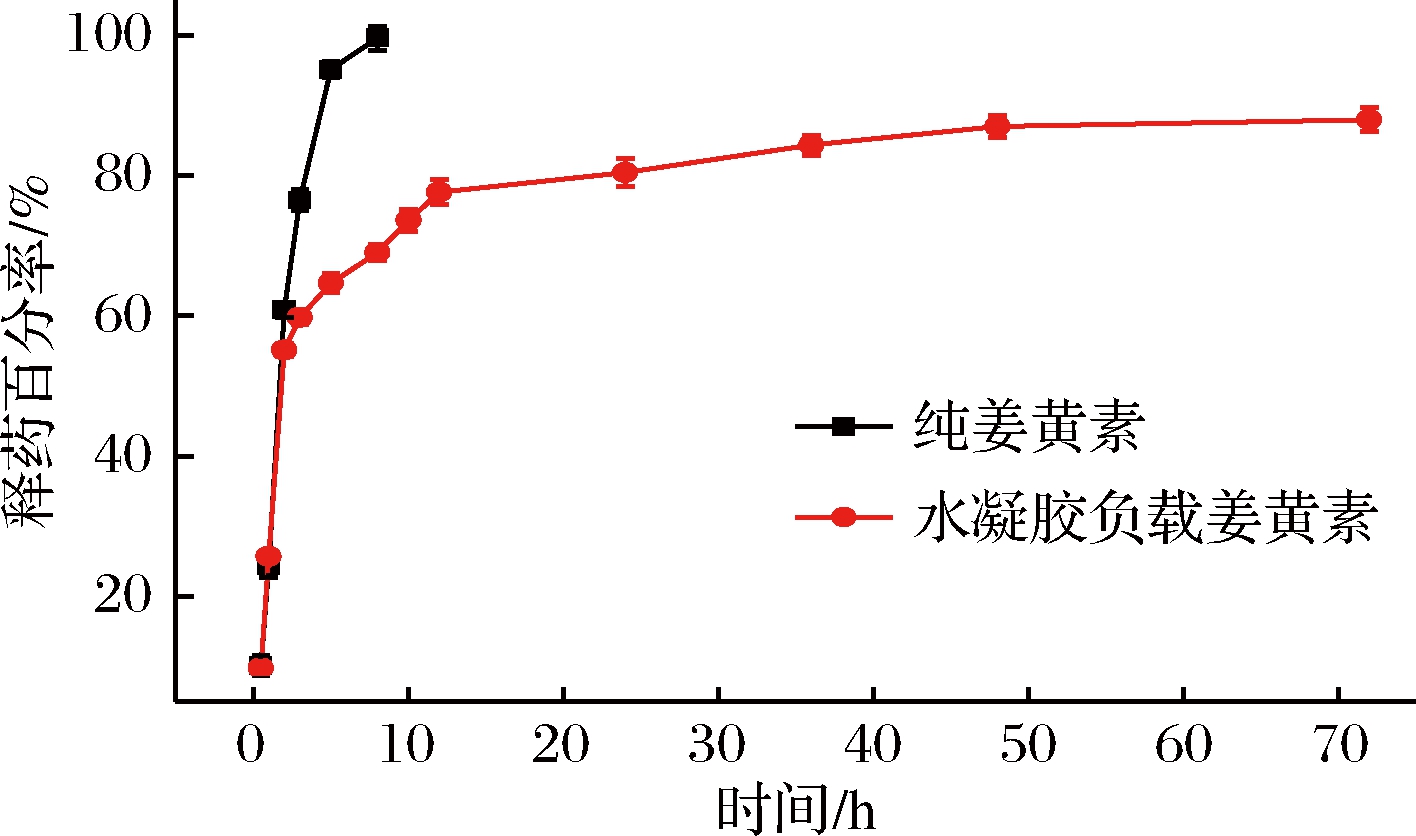
图13 水凝胶药物缓释效果图
Fig.13 Hydrogel drμg sustained release effect diagram
3 结论
对水凝胶进行性能研究结果表明,木薯淀粉水凝胶具有良好的力学性能,机械强度良好,适合作为药物缓释的载体材料。通过对木薯淀粉水凝胶载药因素的考察,木薯淀粉水凝胶的载药性能良好,最佳载药条件为载药时间0.5 h,乙醇浓度为20%,温度为35 ℃,药液初始浓度100 μg/mL,载药量可达到100 mg/g。通过对比纯姜黄素发现,负载于水凝胶中的姜黄素具有药物缓释效果,且效果良好。该研究为淀粉水凝胶载药性能的研究提供一定的实验依据,提高了木薯淀粉的附加值。
[1] 王彬辉,高晓宇,章文红,等.姜黄素抗肿瘤作用新剂型及其衍生物研究新进展[J].中国中医药科技,2015,22(2):232-235.
[2] SZYMUSIAK M, HU X, LEON P P A, et al. Bioavailability of curcumin and curcumin glucuronide in the central nervous system of mice after oral delivery of nano-curcumin[J].International Journal of Pharmaceutics, 2016, 511(1):415-423.
[3] 李帅,宋少婷,张振显,等.姜黄素缓释载体研究进展[J].上海中医药杂志,2018,52(7):102-104.
[4] 薛博,李新华,王虹玲.阴离子淀粉微球吸附姜黄素工艺的研究[J].安徽农业科学,2015,43(12):230-232;255.
[5] NAMDARIM,EATEMADIA.Cardioprotective effects of curcumin-loaded magnetic hydrogel nanocomposite(nanocur-cumin) against doxorubicin-induced cardiac toxicity in rat cardiomyocyte cell lines[J]. Artifi Cel Nanomed Biotech, 2016,45(4):731-739.
[6] MOMINM,KURHADE S,KHANEKAR P, et al. Novel biodegradable hydrogel sponge containing curcumin and honey for wound healing[J].J Wound Care,2016,25(6):364-372.
[7] 蓝平,何日梅,封余贤,等.木薯淀粉磁性微球的结构表征及其对溶菌酶的吸附性能[J].化工进展,2016,35(1):189-196.
[8] 高凤苑,韦东来,张鑫,等.木薯淀粉水凝胶的制备及表征[J].食品工业科技,2019,40(6):49-53;61.
[9] YANG C, WANG Z, OU C, et al. A supramolecular hydrogelator of curcumin[J]. Chemistry Commun. 2014, 50(66):9 413-9 415.
[10] NAMAZI H, DADKHAH A. Convenient method for preparation of hydrophobically modified starch nanocrystals with using fatty acids[J]. Carbohydrate Polymers, 2010, 79(3):731-737.
[11] BAI C, ZHANG S, HUANG L, et al. Starch-based hydrogel loading with carbendazim for controlled-release and water absorption[J]. Carbohydrate Polymers, 2015, 125(12):376-383.
[12] SOLEYMAN R, POURJAVADI A, MONFARED A, et al. Novel salep-based chelating hydrogel for heavy metal removal from aqueous solutions[J]. Polymers for Advanced Technologies, 2016, 27(8):999-1 005.
[13] 薛丹,杨倩,解桥娟,等.基于丙烯酰胺的三元疏水缔合聚合物的合成[J].应用化工,2018,47(2):312-314;318.
[14] WANG N, HAN Y, LIU Y, et al. High-strength hydrogel as a reusable adsorbent of copper ions[J]. Journal of Hazardous Materials, 2012, 213 (7):258-264.
[15] 王现功. 高强度多重交联网络水凝胶的制备与性能[D].济南,山东大学,2018.
[16] 胡艳红,陈胜,黄秀榕,等.羧甲基壳聚糖载姜黄素缓释药膜的制备及其体外缓释动力学研究[J].齐齐哈尔医学院学报,2016,37(28):3 512-3 514.
[17] SAIKIA C, DAS M K, RAMTEKE A, et al. Controlled release of curcumin from thiolated starch-coated iron oxide magnetic nanoparticles: An in vitro evaluation[J]. International Journal of Polymeric Materials & Polymeric Biomaterials, 2016, 66(7):349-358.
[18] 刘敏. 载带姜黄素的果胶复合凝胶球性能研究[D].天津,天津科技大学,2014.
[19] 秦静雯,傅佳佳,万玉芹,等.CA担载姜黄素缓释体系的制备及其缓释动力学[J].材料科学与工程学报,2013,31(6):881-885.
[20] LIU J, CHEN Z, WANG J, et al. Encapsulation of curcumin nanoparticles with MMP9-responsive and thermos-sensitive hydrogel improves diabetic wound healing[J]. Acs Applied Materials & Interfaces, 2018, 10(19):25-36.
[21] 林媚,林晨,刘洋.姜黄素微球的制备及缓释性能研究[J].福建医科大学学报,2010,44(3):178-181.
[22] AYTAC Z, UYAR T. Core-shell nanofibers of curcumin/cyclodextrin inclusion complex and polylactic acid: Enhanced water solubility and slow release of curcumin[J]. International Journal of Pharmaceutics,2017, 518(1-2):177-184.
[23] 刘亚,王雨,陈莹莹,等.MOF-5吸附姜黄素及在胃肠中的消化研究[J].食品科学技术学报,2017,35(5):46-52.
[24] 吴丽莎,喻红英,曾庆冰.姜黄素mPEG_(114)-PCL_(36)纳米胶束的制备及体外释药考察[J].中国实验方剂学杂志,2013,19(12):53-58.
[25] AMIN S, RAJABNEZHAD S, KOHLI K. Hydrogels as potential drμg delivery systems[J]. Sci Res Essays,2009, 4(2):1 175-1 183.