普洱茶是一类后发酵茶,通常被压缩成饼状,根据加工工艺和质量特点分为2种:生普洱茶(生普)和成熟的普洱茶(熟普)。20世纪70年代,人们为了在短时间内(几个月)将普洱茶做成成熟的普洱(几年)的味道,利用人工发酵加工工艺做成了熟普。这2种品种都适合老化,因此市场上普洱茶既有陈年生普洱茶又有熟普[1-2]。普洱茶是6大茶类当中的黑茶,是一种被广泛认可和食用的饮料,可根据不同的加工条件、特殊的感官特点及其化学成分分为两类:生普和熟普。陈年生普(以下简称APT)价格高昂,和熟普(以下简称YPT)的价格大相径庭,因此对于陈年生普和熟普鉴别是非常重要的。APT经历了自然发酵过程,在室温和正常的湿度条件下,进行微生物后发酵,其在消费前有很长的存储时间(长达几十年)[3-4]。YPT是由人工加速发酵的过程被称为“渥堆”,茶叶在较大的湿度,较高的温度(40~60 ℃),进行为期1~2个月发酵即可[5-6]。在这种情况下,氧化的速度和程度比APT高,因此,与APT相比,YPT中的所有儿茶素类物质都显著减少[7-8]。
由于其感官品质和社会文化因素,普洱茶的知名度越来越高,由于其具有较强的抗氧化活性[9-11]和降脂效果[10,12-13],被国外认为是奢侈品和有助于健康的“超级食物”。研究表明,普洱茶对胆固醇的合成具有抑制作用,能增加高密度脂蛋白胆固醇含量,降低低密度脂蛋白胆固醇含量,而其他茶类对2种胆固醇含量都会降低[14-15]。同时有研究表明,六大茶类中,普洱茶的减肥效果仅次于乌龙茶[16]。
茶叶总多酚(TPC)是茶叶中所含的一类多羟基类化合物,主要化学成分为儿茶素类(黄烷醇类)、黄酮及黄酮醇类、花青素类、酚酸及缩酚酸类、聚合酚类等化合物的复合体[17-18]。研究表明,茶多酚活性物质具解毒和抗辐射作用,能有效地阻止放射性物质侵入骨髓,并可使锶90和钴60迅速排出体外,被健康及医学界誉为“辐射克星”[19]。儿茶素类具有明显的酚的特性,占茶叶干重的 12%~24%,约占茶多酚含量的75%~80%,也是茶的苦涩味的来源之一[20]。其中主要成分有表儿茶素(EC)、表没食子儿茶素(EGC)、表没食子儿茶素没食子酸酯(EGCG)和表儿茶素没食子酸酯(ECG),其中EGCG含量最为丰富,占儿茶素总量的60%~80%[20]。研究表明,儿茶素类化合物具有抗菌、抗氧化、抗肿瘤、抗突变、预防心血管疾病等多种作用[21]。
目前,对于绿茶和红茶的总多酚和黄烷醇类物质进行了大量的研究[22],但普洱茶尤其是APT和YPT的TPC和黄烷醇类化合物及其转化还没有得到全面的描述。为了了解主要化合物的差异,本文对APT和YPT的TPC和黄烷醇类物质活性成分进行分析,以达到对市场上普洱茶商品的鉴别。
1 材料与方法
1.1 材料与仪器
儿茶素(C)、表儿茶素(EC)、表儿茶素没食子酸酯(ECG)、表没食子儿茶素(EGC)、表没食子儿茶素没食子酸酯(EGCG)、没食子儿茶素(GC)、没食子儿茶素没食子酸酯(GCG),德国PhytoLab GmbHKG公司;乙腈、水、甲酸(LC-MS级)、福林酚试剂和无水碳酸钠,美国sigma公司。所有标准品纯度≥98%,用甲醇配制成1 mg/mL的标准母液,在-20 ℃下储存。分别吸取各标准母液混合,用甲醇稀释至0.01~0.4 mg/L系列混合标准溶液。
MM301型球磨机,德国Retsh公司;BT125D型精密电子分析天平,赛多利斯生产公司;2100 型可见光分光光度计,上海精密科学仪器有限公司;DK-98-1型双列四孔电热恒温水浴锅;LC-MS6120系列G6100液质联用仪,安捷伦科技股份有限公司。
在云南的不同生产企业中抽取茶叶样品:陈年生普:7个(5个2006年产样、1个1981年产样和1个1993年产样);熟普:12个(5个2017年产样、5个2016年产样、1个1981年产样和1个1995年产样)。所有样品均储存在密闭、干燥和黑暗的条件下,具体见表1。
表1 普洱茶品种、产地和生产年份
Table 1 Variety, year of production and region of origin of the puer samples

样品产地生产年份/年熟1勐海2017熟2临沧2017熟3勐海2017熟4大理2017熟5大理2017熟6临沧2018熟7勐海2018熟8勐海2018熟9临沧2018熟10普洱2018熟1981西双版纳1981熟1995西双版纳1995生1大理2006生2勐海2006生3临沧2006生4勐海2006生5勐海2006生1981西双版纳1981生1993西双版纳1993
1.2 实验方法
1.2.1 样品制备方法
进行测定前,用球磨机对茶叶样品进行粉碎处理。称取1 g粉碎样品加入4 mL体积分数50%的乙醇溶液在60 ℃水浴中振荡提取10 min,提取3次,经 0.45 μm滤膜过滤,将此茶多酚浸提液定容至25 mL,待用[23]。
1.2.2 LC-DAD-ESI-MS分析方法
质谱条件:本实验采用电喷雾电离质谱正离子扫描模式,设置参数如下:毛细管电压3 kV,样品锥电压20 V,萃取锥电压3 V,射频透镜电压0.3 V,脱溶剂气流量650 L/h,去溶剂温度275 ℃,源温度为100 ℃。
色谱条件:色谱柱,Eclipse XDB-C18柱(3.0 mm×150 mm,3.5 μm)。流动相A为含0.1%甲酸的水溶液,流动相B为含0.1%甲酸的94.9%乙腈溶液。采用梯度洗脱,0~5 min 3%流动相B,5~8 min 3%~6%流动相B,8~20 min 6%~11%流动相B,20~25 min 11%~12% 流动相B,25~32 min 12%~17%流动相B,32~38 min 17%~20%流动相B,38~44 min 20%~28%流动相B,44~47 min 28%~31%流动相B,47~51 min 31%~38%流动相B,51~54 min 38%~45%流动相B,54~58 min 45%~50%流动相B,58~61 min 50%~90%流动相B,61~63 min 90%流动相B,63~64 min 90%~1%流动相B。流速为0.25 mL/min,柱温为38 ℃, 进样器温度为10 ℃,进样量5 μL。
1.2.3 总多酚(TPC)测定方法
取茶多酚浸提液0.2 mL,置于10 mL容量瓶中,加入 0.2 mL 25%福林酚试剂摇匀,反应 3 min后,加入 0.4 mL 20% Na2CO3溶液,加0.4 mL水摇匀。室温下放置 120 min。用 10 mm比色皿,在 750 nm波长条件下,以水作空白对照,测定吸光度。
标准曲线制备:利用质量浓度分别 10、20、30、40、50 mg/L 的没食子酸(GA)标准溶液按上述测定方法制定标准曲线,进行线性拟合,得茶多酚浓度x与吸光度y的回归方程:y=19.41x-0.046 7,R2 =0.999 6。
1.2.4 数据统计分析
采用单因素方差分析和最小显著性差异(least significant difference, LSD)多重比较、t 检验等比较TPC和黄烷醇类化合物含量在APT和YPT中的差异。采用主成分分析法(PCA)和层次聚类分析(HCA)对APT和YPT进行判别。上述统计分析采用SPSS 23.0软件。所有实验数据均重复3次。
2 结果与分析
2.1 黄烷醇类活性成分识别结果
试验对APT和YPT茶叶提取液总多酚和黄烷醇类活性成分进行测定,使其多酚类物质得到定性和定量分析。由表2得知,利用LC-DAD-ESI-MS分析方法确定了8种黄烷醇类化合物成分,分别是儿茶素(C)、表儿茶素(EC)、表儿茶素没食子酸酯(ECG)、表没食子儿茶素(EGC)、表没食子儿茶素没食子酸酯(EGCG)、没食子儿茶素(GC)、没食子儿茶素没食子酸酯(GCG)和儿茶素没食子酸酯(CG)。表2详述8种物质的保留时间、吸光度光谱和质量分裂模式(图1)。
表2 质谱分析结果
Table 2 Mass spectrometric identification results
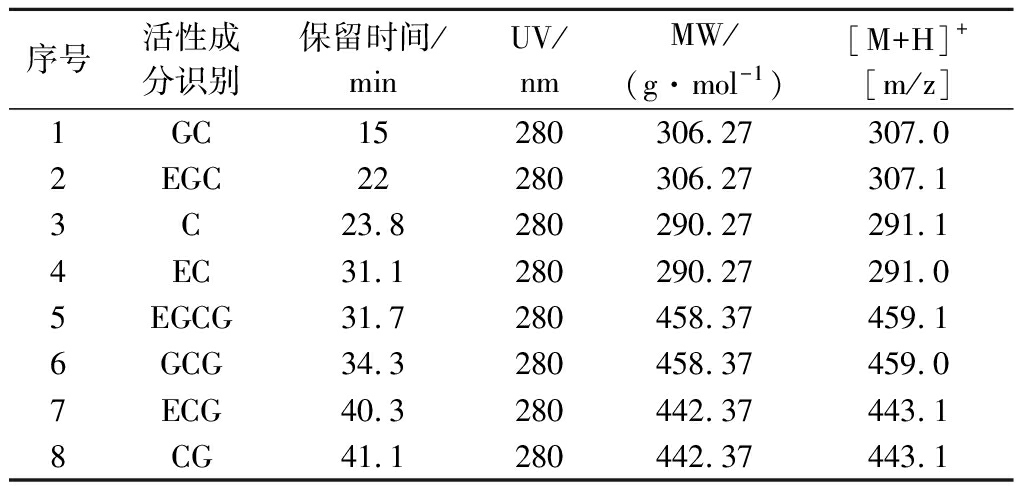
序号活性成分识别保留时间/minUV/nmMW/(g·mol-1)[M+H]+[m/z]1GC15280306.27307.02EGC22280306.27307.13C23.8280290.27291.14EC31.1280290.27291.05EGCG31.7280458.37459.16GCG34.3280458.37459.07ECG40.3280442.37443.18CG41.1280442.37443.1
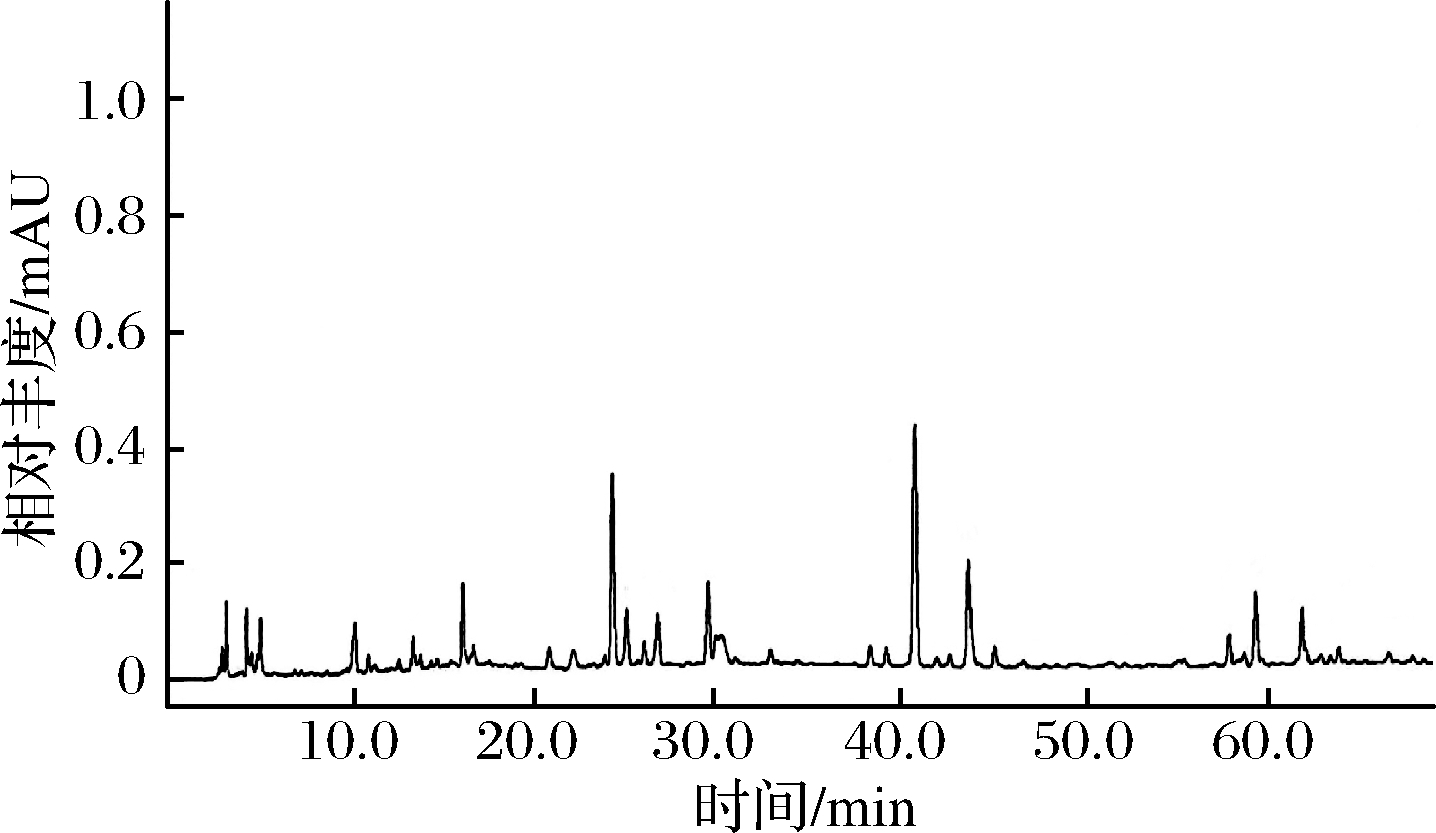
图1 普洱茶的LC色谱图(峰对应表2中的化合物)
Fig.1 LC chromatograms of Pu’er Tea
由表3可知,2种茶的TPC和黄烷醇类化合物含量具有显著差异(P<0.01)。同时可以看出,不同年份的普洱茶中TPC含量差异性显著,且年份相差越大,差异越显著。不同产地的普洱茶中TPC含量差异不显著,这可能是由于加工条件、环境控制(温度、湿度和氧气浓度等)等不同造成的。APT中TPC含量均显著高于YPT中,其中YPT中TPC含量为(90±1)~(118±1) mg/g,APT中TPC含量为(184±3)~(231±7) mg/g。
茶叶活性成分中含量最高的物质为黄烷醇类化合物,在APT中含量依次为ECG>EGCG>EC>EGC>GCG>GC>C>CG,YPT中含量依次为ECG>GC>EC>EGCG>EGC>C>GCG>CG,具体见表3。
表3 APT和YPT的黄烷醇类化合物成分含量 单位:mg/g
Table 3 Flavan-3-ols contents of APT and YPT
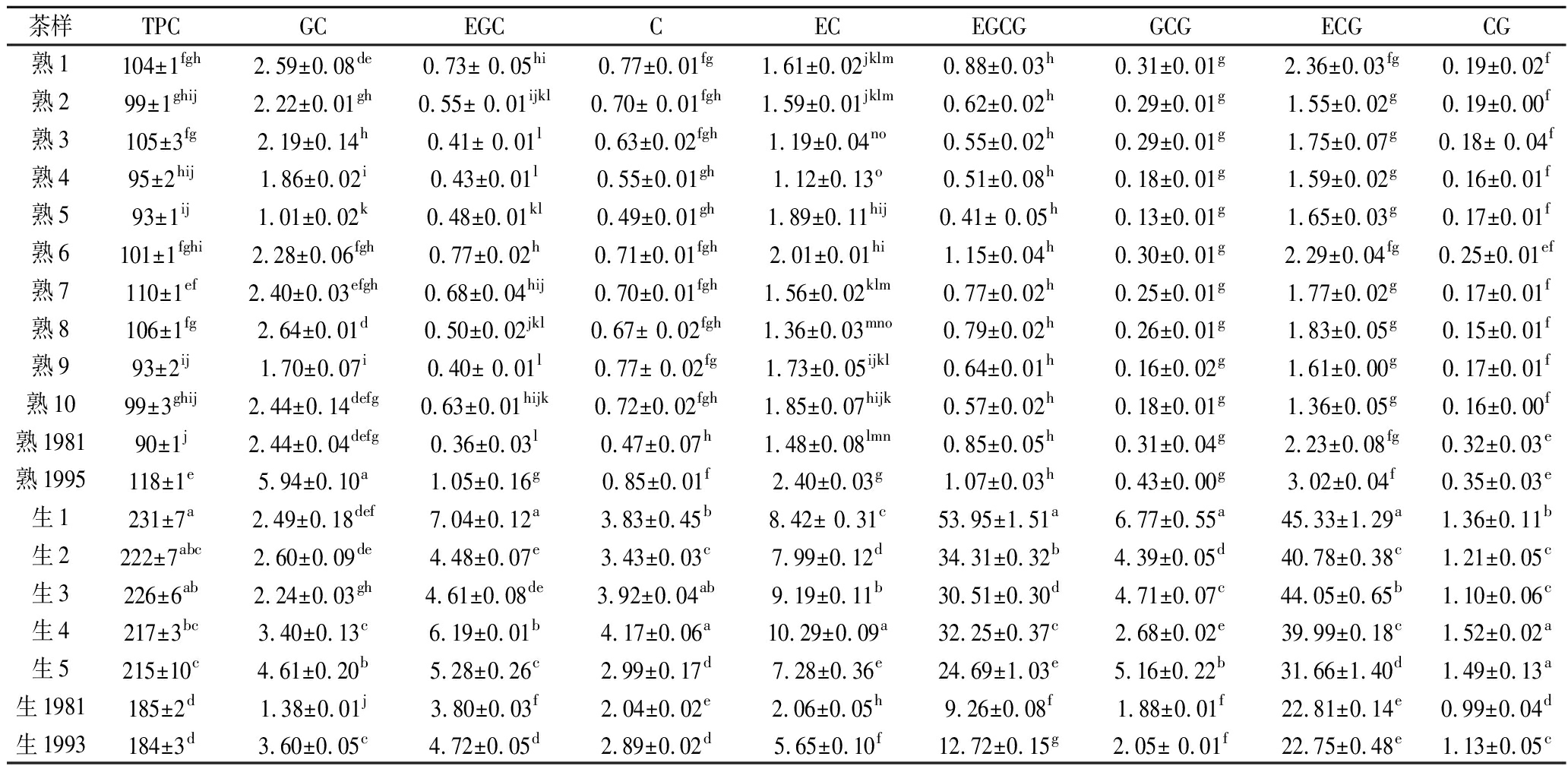
茶样TPCGCEGCCECEGCGGCGECGCG熟1104±1fgh2.59±0.08de0.73± 0.05hi0.77±0.01fg1.61±0.02jklm0.88±0.03h0.31±0.01g2.36±0.03fg0.19±0.02f熟299±1ghij2.22±0.01gh0.55± 0.01ijkl0.70± 0.01fgh1.59±0.01jklm0.62±0.02h0.29±0.01g1.55±0.02g0.19±0.00f熟3105±3fg2.19±0.14h0.41± 0.01l0.63±0.02fgh1.19±0.04no0.55±0.02h0.29±0.01g1.75±0.07g0.18± 0.04f熟495±2hij1.86±0.02i0.43±0.01l0.55±0.01gh1.12±0.13o0.51±0.08h0.18±0.01g1.59±0.02g0.16±0.01f熟593±1ij1.01±0.02k0.48±0.01kl0.49±0.01gh1.89±0.11hij0.41± 0.05h0.13±0.01g1.65±0.03g0.17±0.01f熟6101±1fghi2.28±0.06fgh0.77±0.02h0.71±0.01fgh2.01±0.01hi1.15±0.04h0.30±0.01g2.29±0.04fg0.25±0.01ef熟7110±1ef2.40±0.03efgh0.68±0.04hij0.70±0.01fgh1.56±0.02klm0.77±0.02h0.25±0.01g1.77±0.02g0.17±0.01f熟8106±1fg2.64±0.01d0.50±0.02jkl0.67± 0.02fgh1.36±0.03mno0.79±0.02h0.26±0.01g1.83±0.05g0.15±0.01f熟993±2ij1.70±0.07i0.40± 0.01l0.77± 0.02fg1.73±0.05ijkl0.64±0.01h0.16±0.02g1.61±0.00g0.17±0.01f熟1099±3ghij2.44±0.14defg0.63±0.01hijk0.72±0.02fgh1.85±0.07hijk0.57±0.02h0.18±0.01g1.36±0.05g0.16±0.00f熟198190±1j2.44±0.04defg0.36±0.03l0.47±0.07h1.48±0.08lmn0.85±0.05h0.31±0.04g2.23±0.08fg0.32±0.03e熟1995118±1e5.94±0.10a1.05±0.16g0.85±0.01f2.40±0.03g1.07±0.03h0.43±0.00g3.02±0.04f0.35±0.03e生1231±7a2.49±0.18def7.04±0.12a3.83±0.45b8.42± 0.31c53.95±1.51a6.77±0.55a45.33±1.29a1.36±0.11b生2222±7abc2.60±0.09de4.48±0.07e3.43±0.03c7.99±0.12d34.31±0.32b4.39±0.05d40.78±0.38c1.21±0.05c生3226±6ab2.24±0.03gh4.61±0.08de3.92±0.04ab9.19±0.11b30.51±0.30d4.71±0.07c44.05±0.65b1.10±0.06c生4217±3bc3.40±0.13c6.19±0.01b4.17±0.06a10.29±0.09a32.25±0.37c2.68±0.02e39.99±0.18c1.52±0.02a生5215±10c4.61±0.20b5.28±0.26c2.99±0.17d7.28±0.36e24.69±1.03e5.16±0.22b31.66±1.40d1.49±0.13a生1981185±2d1.38±0.01j3.80±0.03f2.04±0.02e2.06±0.05h9.26±0.08f1.88±0.01f22.81±0.14e0.99±0.04d生1993184±3d3.60±0.05c4.72±0.05d2.89±0.02d5.65±0.10f12.72±0.15g2.05± 0.01f22.75±0.48e1.13±0.05c
注:均值差的显著性水平为0.01。
可以看出,APT样品中的GC含量与YPT样品中相比较,差异显著性不明显(部分样品间差异显著,部分不显著)。APT中其余黄烷醇类化合物含量均显著高于YPT中,ECG和EGCG的含量差异最显著。同时可以看出,不同产地的普洱茶的黄烷醇类化合物含量的差异不显著,不同年份差异显著。有研究表明,普洱茶在发酵过程中,其黄烷醇类化合物会被氧化并凝聚成如茶黄素、茶红素等酚类化合物,导致茶叶的颜色变暗,且发酵时间越长,涩味越低[24]。ZHANG等对APT和YPT的化学成分研究表明,在APT中EGCG、C、EC、EGC、GCG和ECG的含量均显著高于YPT(P<0.01);同时APT中含量为:ECG(9.86 mg/g)>EGCG(9.43 mg/g)>EC(6.01 mg/g)>EGC(5.00 mg/g)>GC(3.64 mg/g)> C(3.16 mg/g)> GCG (1.37 mg/g)[25]。这与本试验研究结果一致。
ECG是茶叶中主要的儿茶素,约占总量的1/3[26]。本试验中2种茶中含量最高的黄烷醇类化合物均为ECG,从表中得知,APT中ECG含量为(22.75±0.48)~(45.33±1.29) mg/g,YPT中含量(1.36±0.05)~(3.02±0.04) mg/g,APT中ECG含量显著高于YPT中。有研究表明,APT中ECG含量也显著高于其他茶类;APT中的ECG含量高达(30.60±4.18) mg/g,绿茶中含量为(17.10±3.34) mg/g,黄茶中含量为(16.23±7.01) mg/g,白茶中含量为(8.12±3.05) mg/g,乌龙茶中含量为(5.09±1.64) mg/g,红茶中含量为(2.65±2.25) mg/g和YPT中含量为(1.57±2.46) mg/g[8]。另外,YPT中较高的GC含量可以通过EGCG转化为EGC再进一步转化为GC来解释[27]。
从表3可知,1981年和1993年生产的APT以及1981年和1995年生产的YPT活性成分TPC和黄烷醇类化合物含量,分别与近几年生产的生普和YPT成分含量有差异。随老化时间的延长能否提高普洱茶的质量需再做研究。不过,滋味的爽口度随老化时间延长而增加,是由于典型的苦涩和收敛性化学成分的持续减少所致。总而言之,不同的加工方法导致了APT和YTP中TPC和黄烷醇类化合物活性成分含量不同,APT中含量较高。APT是比较传统的加工工艺,不经过人工发酵,靠时间和岁月的流逝,自然发酵,一般5~10年的茶才好喝。YPT在温暖潮湿的环境下经过渥堆发酵[25]。
2.2 PCA和HCA分析结果
主成分得分图反应样品与品质成分之间的关系[28],因PC1解释了总方差的85.10%, PC2解释了总方差的10.60%,第1主成分和第2主成分可解释APT和YPT总多酚和黄烷醇类成分总方差的95.70%,可解释很大部分变异。故根据PC 1和PC 2分别绘制载荷样品分布图,结果如图2所示。

图2 主成分分析结果
Fig.2 pca results
APT和YPT样品在PC1、PC2的分值图上有很好的聚类趋势,其中APT样品分布于第Ⅰ和Ⅳ象限;YPT样品分布于第Ⅱ和第Ⅲ象限。因此,经过检验的19个茶叶样品可以清楚地分成2组:YPT和APT。同时可以看出,YPT和APT的区分主要是在第1个主成分PC1。APT样本的特征是除了GC,其余所有化合物的含量均高于YPT。GC在第2个主成分PC2上贡献更大,这并没有导致这2种类型茶的分类。PCA结果表明,不同生产年份和产地的茶叶样品,没有影响APT和YPT茶叶类型的分类。根据主成分分析的结果,对2个主成分的成分采用组间联接(between-groups linkage)的聚类方法和平方欧式距离(squared euclidean distance)区间测量法进行聚类分析如图3。

图3 HCA树状图
Fig.3 Heat map of hierarchical clustering dendrogram
结果显示:聚类结果与主成分得分图结果基本一致,可以看出样品可聚为2大类:第一类即APT(13~19号茶样),其特征在于TPC和8种黄烷醇类化合物含量较高。第二类YPT(1~12号茶样),TPC和8种黄烷醇类化合物含量比较低。其原因在于,TPC和黄烷醇类化合物在普洱茶的发酵过程中会发生一系列的氧化、聚和、缩合反应,产生大量的水溶性氧化产物,致使含量会逐渐降低。研究表明,YPT中多酚类物质更易被氧化降解,含量更低[6]。
3 结论
本文对APT和YPT茶叶提取液TPC和黄烷醇类化合物活性成分进行了测定和分析。利用LC-DAD-ESI-MS分析方法对其确定了8种黄烷醇类化合物成分,2种茶的GC含量差异不显著,APT中TPC和其余7种(GC除外)黄烷醇类化合物含量显著高于YPT中。APT中含量依次为ECG>EGCG>EC>EGC>GCG>GC>C>CG,YPT中含量依次为ECG>GC>EC>EGCG>EGC>C>GCG>CG,其中2种茶中ECG和EGCG的含量差异最显著。同时可以看出,不同产地普洱茶的TPC和8种黄烷醇类化合物含量的差异不显著,不同年份差异显著。
主成分分析(PCA)和聚类分析(HCA)的方法在茶树资源筛选中应用越来越普遍[4,6,22-26],对19个供试样的TPC和8种黄烷醇类化合物进行主成分分析和聚类分析,由主成分分析结果可知,19个茶样主成分分析主要得到2个主成分,累积贡献率达95.70%。通过聚类分析结果表明,19个茶样依据成分分为2大类。第Ⅰ类包括1~12号,即YPT样品;第Ⅱ类为13~19号,即APT样品。可见PCA和HCA依据TPC和8种黄烷醇类化合物能将APT和YPT很好的聚类,成功区分出APT和YPT样品;TPC和7种(GC除外)黄烷醇类化合物均是很好的聚类化学标记。PCA和HCA的统计组合可被用作区分APT和YPT品种和确定特征化合物的适当方法。
普洱茶有较高的药用价值和营养价值,发酵作为一种古老的技术,有助于改善生物活性化合物的生物可及性,并改善它们与健康相关的功能。总的来说,本研究为APT和YPT中黄烷醇类活性成分提供了确切信息,可以作为消费者购买普洱茶的参考,对其质量监督起重要作用。未来的研究可以专注于开发快速跟踪分析各种普洱茶特定生物活性化合物与质量之间的相关性。此外,这种研究方法也可用于类似的多元因素代表的产品的质量鉴定。目前,不同茶叶品种的认证和表征方法是热点,依据活性化合物的含量区分不同品种的茶叶越来越重要。
[1] 马燕,陈立佼,吕才有, 等.普洱茶安全性毒理学评价研究概述[J].茶叶科学,2018,38(3):221-226.
[2] ZHOU ZX, DUAN WH, WU HY, et al. Investigation and analysis of consumptive request for Chinese premium teas[J].Journal of Zhejiang University-SCIENCE B,2013,30:412-416.
[3] 覃健军.普洱茶生茶抗运动疲劳作用研究[J].福建茶叶,2018,40(1):302-303.
[4] LV HP, ZHANG YJ, LIN Z, et al. Processing and chemical constituents of Pu-erh tea: A. review[J].Food Research International, 2013,53(2):608-618.
[5] WANG Q, BEL CAK-CVITANOVI′ C A, DURGO K, et al. Physicochemical properties and biological activities of a high-theabrownins instant Pu-erh tea produced using Aspergillus tubingensis[J]. LWT-Food Science and Technology, 2018,90:598-605.
CAK-CVITANOVI′ C A, DURGO K, et al. Physicochemical properties and biological activities of a high-theabrownins instant Pu-erh tea produced using Aspergillus tubingensis[J]. LWT-Food Science and Technology, 2018,90:598-605.
[6] 郝彬秀,李颂,田海霞, 等.普洱熟茶的发酵微生物研究进展[J].食品研究与开发,2018,39(8):203-206.
[7] 蒋睿,罗理勇,常睿,等.普洱生茶和熟茶的品质化学成分分析比较[J].西南大学学报(自然科学版),2018,40(6):38-47.
[8] YI T, ZHU L,PENG WL, et al.Comparison of ten major constituents in seven types of processed tea using HPLC-DAD-MS followed by principal component and hierarchical cluster analysis[J]. LWT-Food Science and Technology,2015,62(1):194-201.
[9] 陈亚蓝,王雪青,王怡雯, 等.基于HepG2细胞模型研究普洱茶茶色素的抗氧化作用[J].食品科学,2017,38(1):226-231.
[10] 顾小盼,潘勃,吴臻,等.普洱茶药理作用研究进展[J].中国中药杂志,2017,42(11):2 038-2 041.
[11] ZHANG HM, WANG CF,SHEN SM,et al.Antioxidant phenolic compounds from Pu-erh tea[J]. Molecules,2012,17(12):14 037-14 045.
[12] 熊昌云,杨彬,彭远菊, 等.普洱茶抑肥降脂作用比较研究[J].西南农业学报,2018,31(5):1 058-1 062.
[13] QIONG S,XISHUANG Y. History of Pu'er Tea and comparative study for the effect of its various extracts on lipid-lowering diet[J]. Pakistan Journal of Pharmaceutical Sciences. 2014,27(4):1 015-1 022.
[14] 陈亚蓝,王雪青,王怡雯, 等.普洱茶茶色素对HepG2细胞脂质代谢的影响及作用机理[J].食品科学,2017,38(17):203-209.
[15] LU CH, HWANG LS. Polyphenol contents of Pu-Erh teas and their abilities to inhibit cholesterol biosynthesis in Hep G2 cell line[J]. Food Chemistry, 2008,111(1):67-71.
[16] KUO KL, WENG MS, CHIANG CT, et al. Comparative studies on the hypolipidemic and growth suppressive effects of Oolong, Black, Pu-erh, and Green Tea leaves in rats[J].Journal of Agricultural and Food Chemistry, 2005,53(2):480-489.
[17] 包蓉,谷欣莹,陈佳.茶多酚提取纯化及其功能特性研究进展[J].安徽农学通报,2018,24(10):109-110;156.
[18] 章辰琛,杜婷婷.茶多酚医药价值的研究进展[J].医学食疗与健康,2018(4):174-175.
[19] 郑科勤.茶多酚的药理作用探讨[J].福建茶叶,2018,40(1):33-34.
[20] 李媛,苏美冬,刘佩.茶叶中儿茶素的高效液相色谱法研究[J].农产品加工(上半月),2017(8):29-30;34.
[21] 周露露,高原,牛知慧, 等.茶叶中儿茶素的药理作用及其研究进展[J].辽宁化工,2018,47(4):316-318;363.
[22] 张慧.不同产地普洱茶主要成分含量分析[J].云南农业,2017(11):49-51.
[23] ZUO Y, CHEN H, DENG Y. Simultaneous determination of catechins, caffeine and gallic acids in green, Oolong, black and pu-erh teas using HPLC with a photodiode array detector[J]. Talanta,2002,57(2):307-316.
[24] 王兴华,念波,段双梅, 等.数控与传统发酵普洱茶抗氧化活性与化学成分的比较[J].食品与发酵工业,2017,43(5):138-143.
[25] ZHANG L, LI N, MA ZZ, et al. Comparison of the chemical constituents of aged Pu-erh tea, ripened Pu-erh tea, and other teas using HPLC-DAD-ESI-MSn[J].Journal of Agricultural and Food Chemistry,2011,59(16):8 754-8 760.
[26] 陈星卉.表儿茶素没食子酸酯抑菌活性的研究[J].黑龙江医药科学,2017,40(6):129-130;132.
[27] TANAKA T, UMEKI H, NAGAI S, et al. Transformation of tea catechins and flavonoid glycosides by treatment with Japanese post-fermented tea acetone powder[J]. Food Chemistry,2012,134(1):276-281.
[28] 曾亮,田小军,罗理勇, 等.不同贮藏时间普洱生茶水提物的特征性成分分析[J].食品科学,2017,38(2):198-205.