葡萄糖氧化酶(glucose oxidase, GOD)的系统名称为β-D-葡萄糖氧化还原酶(E.C.1.1.3.4)[1],最先于1904年在黑曲霉和灰绿青霉中发现[2-4]。它能够催化β-D-葡萄糖被氧化成葡萄糖酸-δ-内酯,进而被水解成葡萄糖酸,并生成过氧化氢[5]。因此,GOD因其具有脱氧和防腐的功能,而应用在食品保鲜方面。GOD还具有消除肠道病原菌、解除肠道霉菌毒素中毒、改善肠道酸性消化环境、保护肠道上皮完整的功能[6-7],被广泛应用在畜牧业和养殖业[8-9]。由于GOD的专一氧化葡萄糖的特性,在生物传感器、医学检验等领域是重要分析用酶[10-13]。
野生菌株中GOD活力较低,利用基因工程进行改造成为一种有效的手段。20世纪KOVACEVIC等[14]与GUO等[15]在毕赤酵母中成功表达黑曲霉GOD。PULCI等[16]也将青霉GOD的基因成功克隆到酵母中并实现表达。随着GOD需求的增加,我国相关研究也逐渐增多。周亚凤等[17]将黑曲霉GOD基因克隆到酵母中并高效表达。高庆华等[18]也将青霉GOD基因克隆到酵母中并表达。大肠杆菌一直作为外源蛋白表达的首选系统[19],但很少应用在GOD外源表达方面。现有报道仅WITT等[20]及顾磊等[21]尝试在大肠杆菌中表达黑曲霉GOD。细菌与大肠杆菌的同源性更高,可能更适合在大肠杆菌中表达,但此类的研究此前未见报道。
本研究以海洋细菌Citrobacters sp. 8-III为出发菌株,采用E. coli BL21(DE3)为表达宿主,构建GOD高产大肠杆菌工程菌株,实现GOD在大肠杆菌中的高效表达,并对重组GOD酶学性质进行分析。
1 材料与方法
1.1 实验材料
1.1.1 菌株与质粒
Citrobacters sp. 8-III:辽宁省海洋微生物工程中心提供(分离自大连渤海海域,深度约30 m的海泥中。);E. coli DH5ɑ:构建和克隆目的基因;E. coli BL21(DE3):表达宿主;质粒pMD9-T:克隆载体;质粒pET-28a(+):表达载体。
1.1.2 试剂与仪器
PCR相关试剂、克隆相关试剂和限制性内切酶:Takara公司;PCR产物纯化试剂盒等:上海生工生物有限公司;琼脂糖、辣根过氧化物酶和邻联茴香胺等试剂:Sigma公司。
PCR仪和电转化仪,Eppendorf公司;Multiskan1510酶标仪,Thermo Fisher Scientific;LDZX-40BI立式压力蒸汽灭菌锅,上海申安医疗器械厂;LTI-700恒温培养箱,上海爱郎仪器有限公司;HZP-250全温振荡培养箱,上海精宏实验设备有限公司;HD-1360 超净工作台,北京东联哈尔仪器制造有限公司;AL-204电子天平,梅特勒-托利多仪器有限公司;RDY-SP1Z型核酸电泳仪,北京荣阳静电科技有限公司
1.1.3 培养基
LB培养基:10 g/L NaCl、5 g/L酵母提取物、10 g/L蛋白胨;种子培养基:10 g/L蛋白胨、5 g/L牛肉膏、10 g/L NaCl;发酵培养基:60 g/L葡萄糖、3 g/L蛋白胨、2 g/L K2HPO4、0.7 g/L MgSO4、0.5 g/L KCl、4 g/L NaNO3,pH 6.5。
1.2 实验方法
1.2.1 菌株8-III GOD基因的获取
挑取菌株8-III的单菌落于8 mL种子培养基,于25 ℃下160 r/min振荡培养48 h,以2%的接种量接种到含有100 mL种子培养基的250 mL摇瓶中,160 r/min,25 ℃摇床中培养48 h。取2 mL的菌液于8 000 r/min离心,去掉上清液,用PBS洗涤2次,再次离心收集菌体。利用基因组大量提取试剂盒(powermax TMSoil DNA isolation kit)提取基因组DNA。所提DNA送到北京百迈克生物科技有限公司进行DNA质量检测,并使用Illumina Hiseq X10高通量测序平台进行双端测序(PE150),得基因组草图。对测序数据过滤低质量后,利用Velvet软件[18]进行初步组装,得到最终基因组框架图(draft genome)。根据GenBank公布GOD基因序列通过BLAST比对确定目的基因。交由Synbio Technologies公司对8-III菌株的GOD基因进行基因全长合成,并构建于克隆载体pMD-9-T,命名pMD-9-T-GOD。
1.2.2 目的基因的克隆
5′端引物序列P1为:5′-ATGAAGTCCACTATTATCACCTCCA-3′,其3′端引物序列P2为:5′-CTAGGCACTTTTGGCA-TAGTCTTCA-3′,用这对引物以pMD-9-T-GOD为模板进行PCR扩增。反应体系为50 μL:基因组DNA 100 ng,引物各0.2 μmol/L,dNTPs 250 μmol/L,5×Q5高保真DNA聚合酶缓冲液10 μL,Q5高保真DNA聚合酶0.5 μL。PCR反应条件:98 ℃、5 min;98 ℃、 30 s,65 ℃、30 s,72 ℃、60 s,共30个循环;72 ℃、10 min。PCR产物于1%琼脂糖凝胶上电泳鉴定纯度和分子量的大小。PCR产物经DNA回收试剂盒回收。
1.2.3 原核表达载体的构建
将pET-28a(+)用NcoⅠ和XhoⅠ进行双酶切,与目的基因连接,重组质粒命名为pET-28a(+)-GOD。该表达质粒的构建方式删除了pET-28a(+)质粒载体上的全部标签,可用来构建无标签的基因表达工程菌。将该表达质粒转化至E. coli BL21(DE3)感受态细胞,阳性的转化菌命名为E. coli BL21(DE3)/pET-28a(+)-GOD。送至Synbio Technologies公司测序验证,保存测序正确的菌株。
1.2.4 目的蛋白的诱导表达与纯化
将E. coli BL21/pET-28a(+)-GOD接种于10 mL含卡那霉素的LB液体培养基中,160 r/min,25 ℃,过夜培养。取上述菌液按2%接种量接种于100 mL含卡那霉素的LB液体培养基中,160 r/min,25 ℃培养4 h,加入IPTG诱导表达。收集菌体发酵液于10 000 r/min,4 ℃,离心20 min,弃上清。菌体沉淀以pH 7.4的PBS洗涤,重复洗涤3次。洗涤后用10 mL的PBS重悬。将重悬液超声裂解15 min(开3 s,间隔5 s,功率200 W)。将裂解液以10 000 r/min,4 ℃,离心20 min,上清液为粗酶液。粗蛋白用Ni2+-NTA柱(Novagen)进行亲和层析纯化,洗脱的蛋白液4 ℃保存,蛋白样品经变性聚丙烯酰胺凝胶电泳(SDS-PAGE)检测,同时以空载体和未诱导作对照,记录并分析结果。
1.2.5 酶活力测定[22]
于96孔板中依次加入5%葡萄糖溶液150 μL,邻联茴香胺溶液150 μL,辣根过氧化物酶溶液10 μL,25 ℃反应10 min,加入待测液10 μL。酶标仪波长460 nm,每间隔1 min测定1次,共测定5次。以在25 ℃,pH 6.5的磷酸缓冲溶液的反应条件下,每分钟将1 μmol的葡萄糖催化氧化为葡萄糖酸和过氧化氢所需要的GOD的量定义为1个GOD的活力单位。根据公式计算酶活[19]。
1.2.6 酶学性质研究
温度对重组GOD影响:将适当稀释的酶液分别在15、20、25、30、35、40、45、50、55、60和65 ℃下进行反应,以酶活最高者为100%计算相对酶活,从而确定该酶的最适作用温度。将适当稀释的酶液分别放到0、10、20、30、40、50和60 ℃下保温1 h,每隔30 min取样,在冰上放置5 min后进行酶活测定。以未进行热处理的酶液的酶活为100%计算相对酶活,确定重组GOD的热稳定性。
pH值对重组GOD影响:配制pH值分别为4.0、4.5、5.0、5.5、6.0、6.5、7.0、7.5、8.0、8.5、9.0的PBS缓冲体系,将酶液分别用这些缓冲液稀释后进行反应,以酶活最高者为100%计算相对酶活,从而确定GOD酶的最适pH值。分别将酶液在pH值为4.0、4.5、5.0、5.5、6.0、6.5、7.0、7.5、8.0、8.5、9.0、9.5和10.0的PBS缓冲液中保温30 min(温度为25 ℃),以未经保温处理的酶活为100%计算残余酶活力,从而确定GOD酶的pH稳定性。
金属离子对酶活影响:在GOD酶与其底物进行反应的体系中,加入Na+、K+、Ca2+、Mg2+、Fe2+、Cu2+、Mn2+、Fe3+、Zn2+、Ba2+及乙二胺四乙酸(ethylenediaminetetraacetic acid,EDTA),使其终浓度为0.35 mmol/L,然后按照1.2.5的方法进行酶活测定。以不加金属离子的反应体系的酶活定义为100%,表示不同金属离子或化合物下的相对酶活。
1.2.7 鸡饲料的应用
将重组GOD纯化后与SiO2以4∶1比例复配后,以0.05%加入鸡饲料中,喂养A组雏鸡;只加入GOD未与SiO2复配的鸡饲料喂养B组雏鸡;以未加入GOD的鸡饲料喂养C组雏鸡。每组12只,喂养14 d,记录平均每日增重、平均每日摄取量、饲料利用率和腹泻率。
1.2.8 幼犬饲料保鲜
将重组GOD纯化后与SiO2以4∶1比例复配后,以0.05%加入幼犬饲料中,为实验组A;以陆生霉菌GOD与SiO2以4∶1比例复配后,以0.05%加入幼犬饲料中,为实验组B;以未加入GOD的幼犬饲料为实验组C。每组50份0.5 kg饲料,4 ℃储藏14 d,记录饲料霉变情况。
2 结果与分析
2.1 目的基因PCR扩增
以pMD-9-T-GOD为模板PCR扩增GOD基因,见图1。

M-DNA Marker;1~4-PCR扩增产物
图1 目的基因克隆PCR电泳检测结果
Fig.1 PCR assay of the targetgene
目的基因条带单一、浓度较高。经测序其全长为1 292 bp,提交至Genbank所获序列登录号是MK054202,与Genbank中其他GOD基因序列的相似度在92%~98%,预期能够编码含有428个氨基酸残基的蛋白质。对序列进行分析,发现序列中不含有内含子和基因原有的信号肽序列,不含有SacⅠ、NotⅠ和SnabⅠ酶切位点,含有NcoⅠ和XhoⅠ酶切位点,符合之前的预测。
2.2 重组表达载体的构建
分别用NcoⅠ和XhoⅠ对pET-28a-GOD做分步酶切,预期得到大小分别为5.4 kb的载体片段和1.3 kb的目的基因片段。通过1%琼脂糖凝胶电泳对双酶切产物进行检验,结果见图2。泳道1为重组质粒的酶切鉴定结果,大小与预期结果一致,将鉴定正确的质粒进行测序,最终确定重组表达质粒pET28a-GOD。
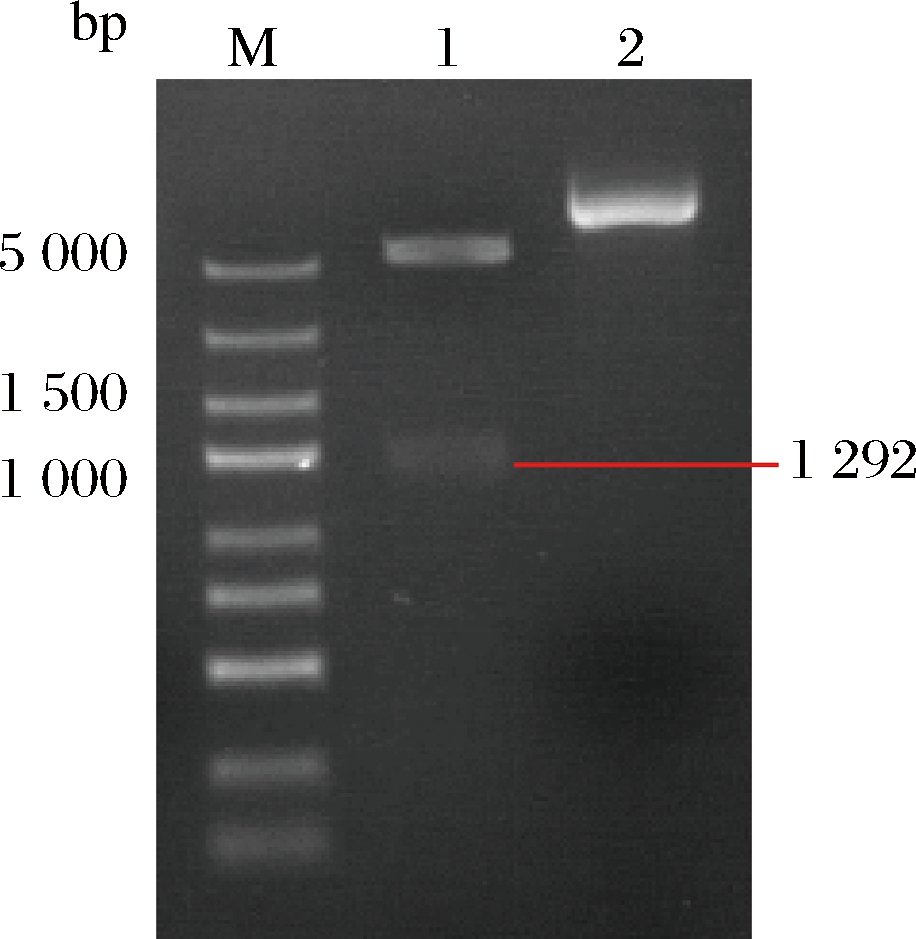
M-DNA Marker;1-酶切处理的质粒;2-质粒DNA
图2 重组质粒pET-28a-GOD的酶切鉴定
Fig.2 Restriction pattern of recombinant pET-28a-GOD
2.3 诱导表达与纯化
将经鉴定正确的原核重组表达质粒载体pET28a-GOD转化至表达宿主菌E. coli BL21(DE3)中诱导表达。通过SDS-PAGE分析目标蛋白表达情况。加入IPTG后成功诱导外源蛋白的表达。以没有装载GOD的E. coli BL21/pET28a菌体作为对照,在E. coli BL21/pET28a-GOD菌体裂解液全菌、上清液和沉淀的约46 kDa位置出现一条蛋白带(图3),该蛋白带分子质量与重组GOD的理论分子质量(46 kDa)相一致,由此推测该蛋白带为诱导表达的GOD。此外,由图(图3泳道2)可见菌体裂解后的可溶部分也检测到GOD蛋白条带,说明克隆菌株不仅能有效表达GOD,而且重组GOD为可溶性表达。
2.4 NI+-NTA柱亲和纯化
通过Ni+-NTA亲和层析柱进行GOD纯化,SDS-PAGE检测洗脱收集液,如图4所示。目标蛋白被150 mmol/L和200 mmol/L咪唑溶液洗脱下来,大小在46 kDa左右,且洗脱液中杂蛋白较少。

M-标准蛋白;1-E. coli BL21/pET28a-GOD菌体裂解液沉淀;2-E. coli BL21/pET28a-GOD菌体裂解液上清液;3-E. coli BL21/pET28a-GOD菌体裂解液全液;4-E. coli BL21/pET28a(+)菌体裂解液上清液
图3 目的蛋白GOD的SDS-PAGE检测结果
Fig.3 SDS-PAGE analysis of GOD protein

M-蛋白质分子量标准;1-150 mmol/L咪唑溶液洗脱目标蛋白;2-200 mmol/L咪唑溶液洗脱目标蛋白
图4 纯化后E. coli BL21/pET28a-GOD的SDS-PAGE
Fig.4 SDS-PAGE of E. coli BL21/pET28a-GOD after purification
2.5 酶学性质分析
2.5.1 酶最适作用温度
将重组GOD在10~60 ℃处理5 min,结果如图5-a所示。酶的最适反应温度为25 ℃,20~35 ℃相对酶活可以保持在80%以上,40 ℃后相对酶活快速降低。此外该酶在0 ℃时可保持50%相对酶活,符合海洋细菌低温酶特性,在较短的时间产生大量GOD。如图5-b所示,10~35 ℃时,相对酶活可保持80%以上,表明在该温度范围内酶的温度稳定性良好,其中25 ℃酶活最稳定,相对酶活保持在90%以上,40 ℃后稳定性迅速下降。该酶在0 ℃时可保持60%以上酶活力且稳定性快速提升,10 ℃后可达到60%以上酶活力,说明该酶具有低温酶特性,且温度稳定性良好。
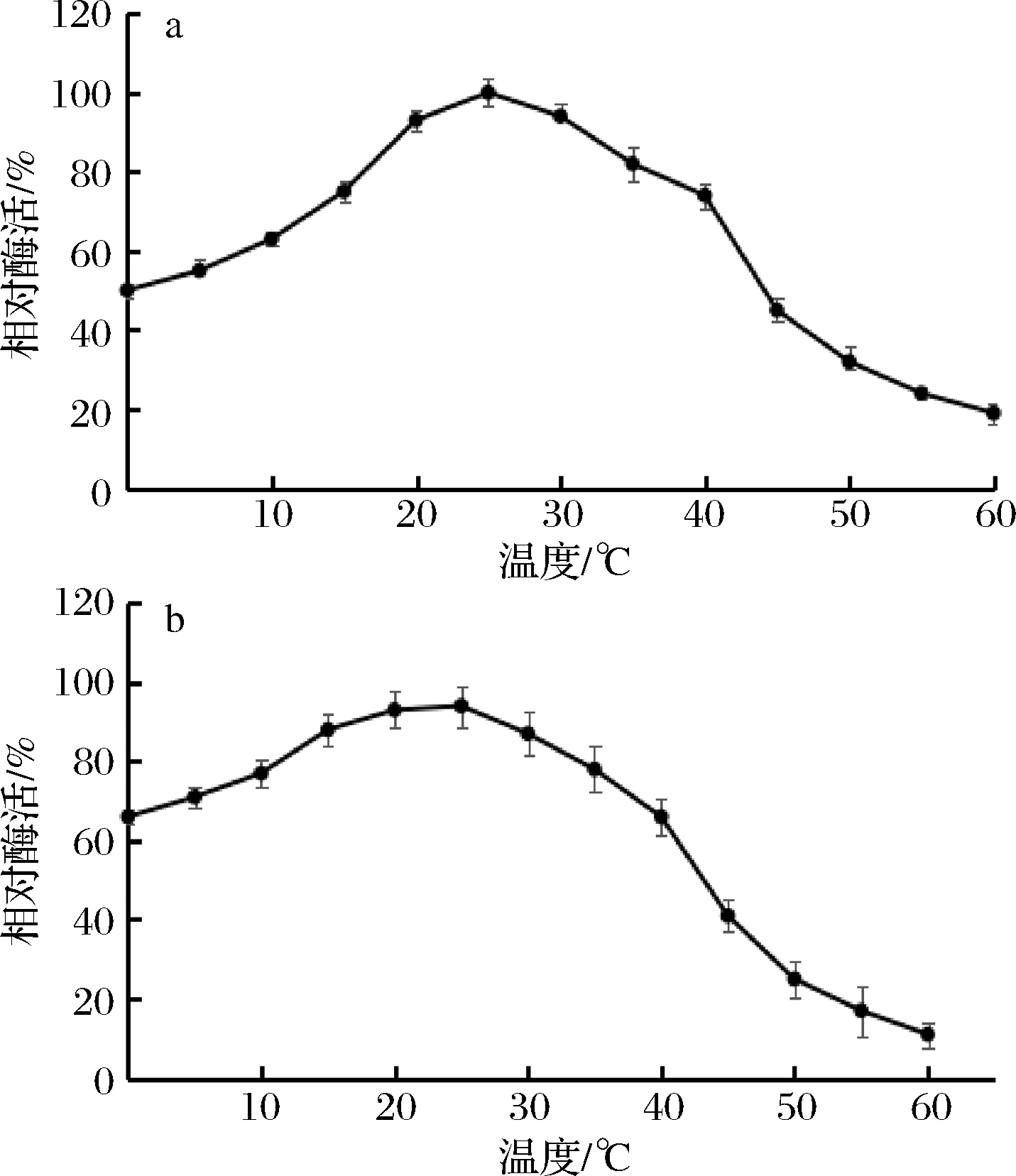
a-酶最适作用温度;b-酶的温度稳定性
图5 温度对酶活影响
Fig.5 Effect of temperature on enzyme activity
2.5.2 酶最适作用pH
如图6-a所示,重组GOD的最适pH值为6.0,在pH值为5.5~6.5时,保持85%以上的相对酶活,表明该酶属于偏酸性GOD。如图6-b所示,该酶在pH 6.5时稳定性最好,在pH 6.0~7.0时相对酶活可保持80%以上,pH 7.5以后稳定性快速降低。推测GOD中可能存在酸性基团,碱性条件下不能稳定存在。在pH 7.5以上会产生结构变化,影响酶活。
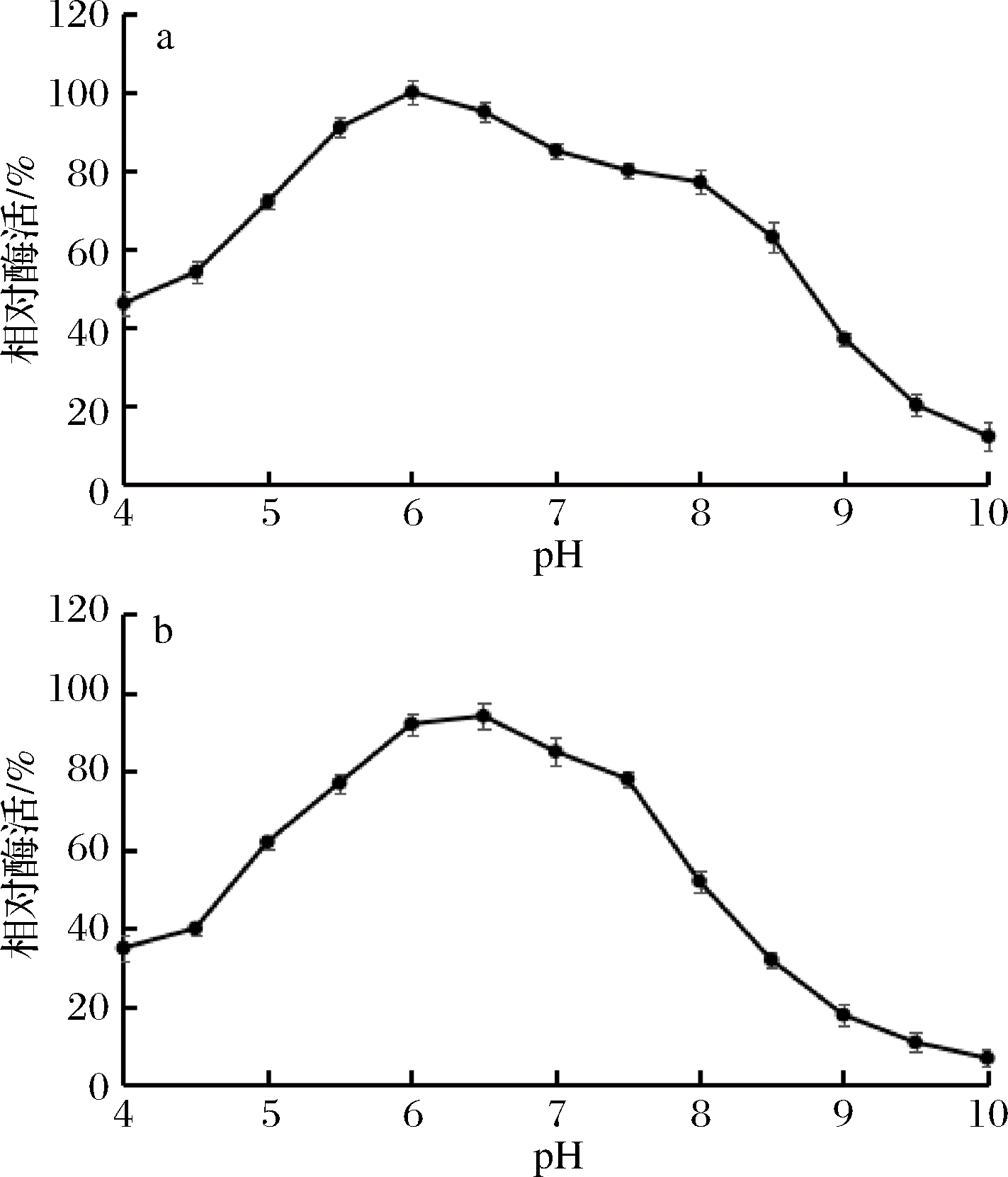
a-最适pH值; b-pH稳定性
图6 pH对酶活影响
Fig.6 Effect of pH on enzyme activity
2.5.3 金属离子及螯合剂对酶活的影响
由图7可知,K+、Ni2+对重组GOD的活性有明显促进作用;Na+、Zn2+、Fe3+、Cu2+、Ag+、Ca2+、Fe2+、Mg2+和EDTA对GOD活性有抑制作用,其中Cu2+、Ag+、Ca2+、Fe2+和Mg2+严重抑制重组GOD酶活性。推测这可能是由于这些离子与酶中心的功能基团结合,进而引起酶失活。
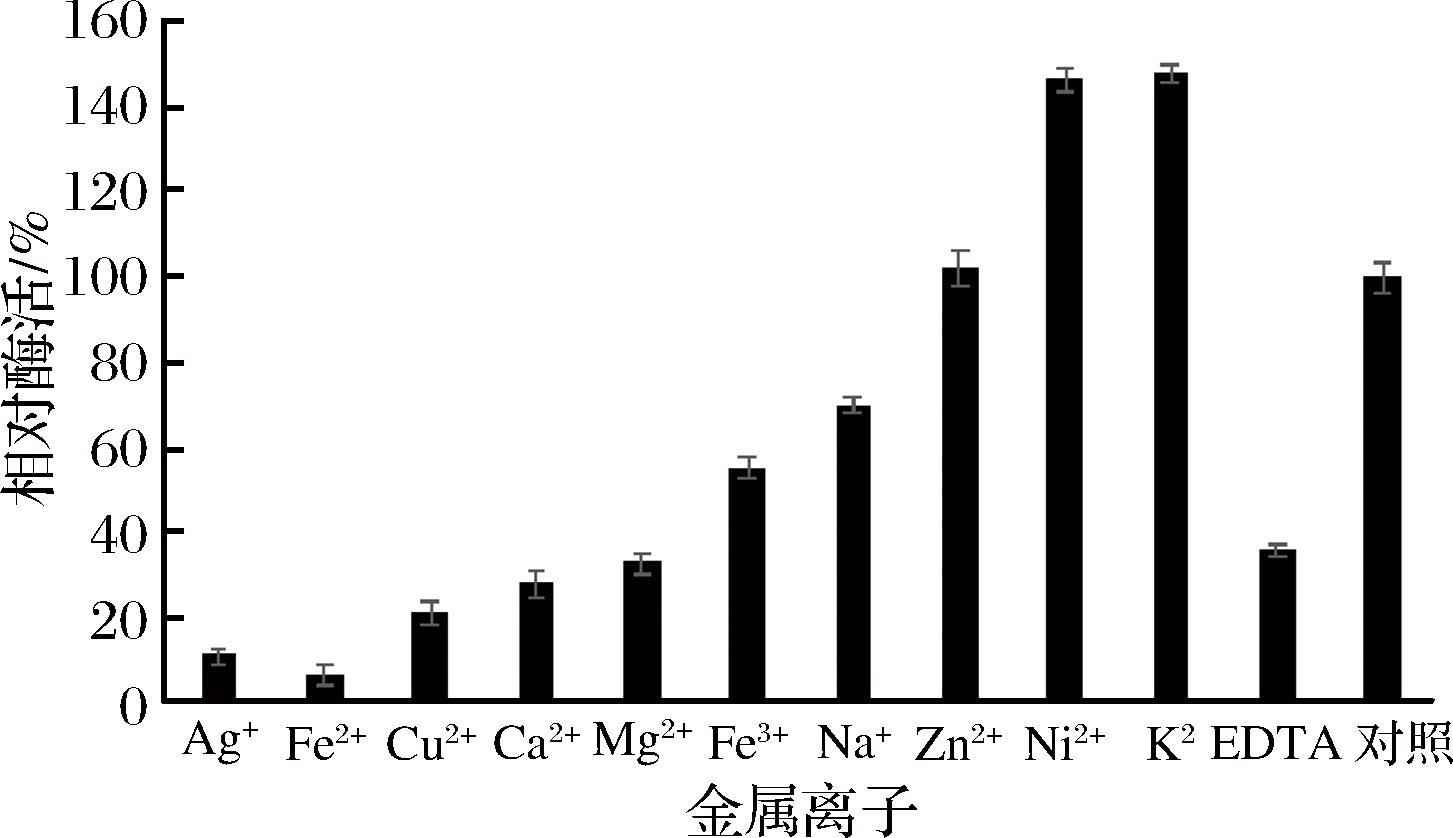
图7 金属离子及螯合剂对酶活力的影响
Fig.7 Effects of metalions and chelating agents on enzyme activity
2.6 鸡饲料中应用
将重组GOD添加到鸡饲料中,饲养结果如表1所示。A组雏鸡的平均日增和饲料利用率重要大大高于B、C两组,其中B组又比C组要高。腹泻率C组最高,A组最低。结果表明,重组GOD可以通过改善肠道菌群提升对饲料的有效吸收,从而提升鸡体重。此外,重组GOD需要与相应载体联合使用,单独使用重组GOD效果并不理想。
表1 重组GOD在鸡饲料中应用
Table 1 Application of recombinant GOD in chicken feed
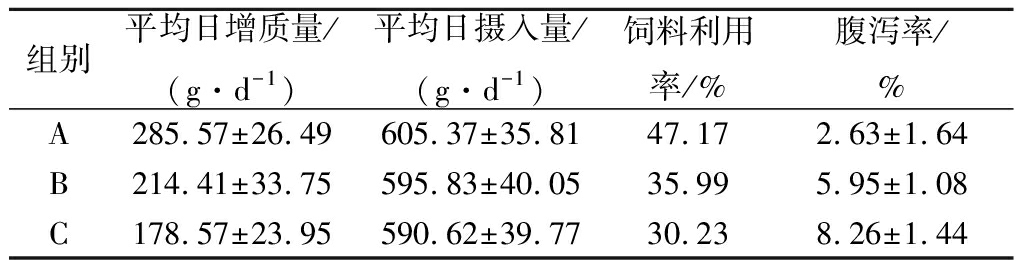
组别平均日增质量/(g·d-1)平均日摄入量/(g·d-1)饲料利用率/%腹泻率/%A285.57±26.49605.37±35.8147.172.63±1.64B214.41±33.75595.83±40.0535.995.95±1.08C178.57±23.95590.62±39.7730.238.26±1.44
2.7 幼犬饲料中应用
重组GOD添加到幼犬饲料中,结果如图8所示。A组的霉变情况最好,C组最差,B组稍好于C组。说明重组GOD确实具备防腐的作用,并且在低温环境也能有很好的作用,这是陆地来源GOD所不具备的。
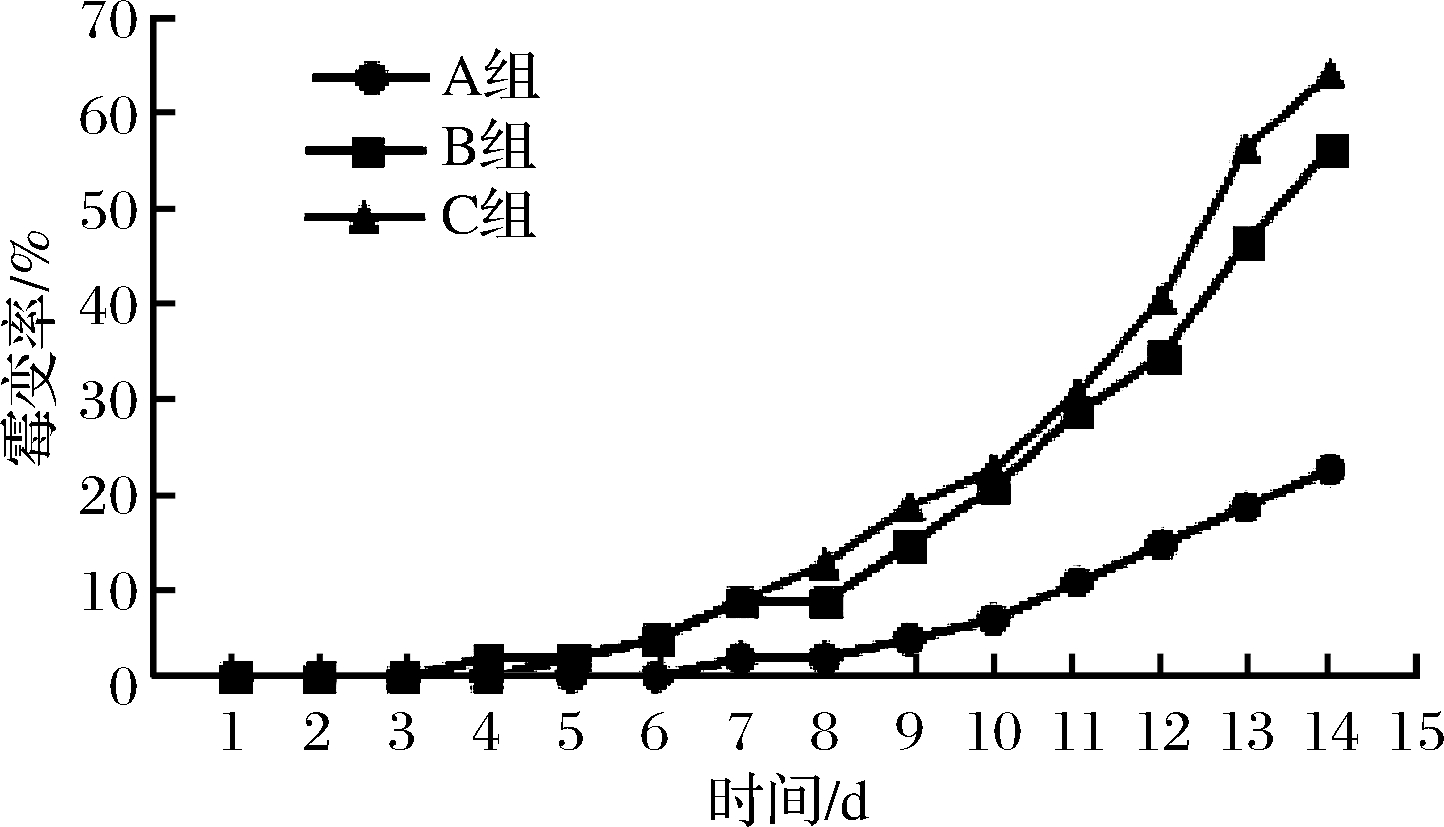
图8 幼犬饲料霉变情况
Fig.8 Mildew of puppy feed
3 结论
GOD是一种重要的应用酶,国内外学者在其外源表达方面已进行大量研究[22-26]。葡萄糖氧化酶最适作用温度为40~45 ℃,在35~50 ℃酶活稳定,属于中高温酶。本文首次尝试将海洋细菌GOD基因在大肠杆菌中表达,并将酶活提升2.72倍。重组GOD分子质量为46 kDa,在25 ℃,pH 6.5的环境下酶活最高,10~20 ℃酶活保持稳定。结果表明,重组GOD具备低温酶特性,可以填补传统陆地来源GOD在饲料保鲜等方面的不足。此外大肠杆菌可用于细菌GOD外源表达。同时,克隆菌株自身具有培养条件简单经济、生长繁殖快速、蛋白表达水平高等优势、遗传背景清晰、基因改造工具多样等特点[15],与工业生产相契合。
将重组GOD添加到动物饲料中,可起到防腐作用,并提升饲料利用率。重组GOD通过杀灭或抑制病原微生物的生长繁殖维持动物肠道菌群平衡,自身及代谢产物对动物和环境均无毒副作用,且不易诱发耐药菌产生,也不易诱发交叉耐药菌的产生,具备加工为饲料添加剂的潜力。此外,已报到的GOD饲料添加剂绝大多数自身不具备防腐功效[27-28],重组GOD的低温酶特性,可填补传统GOD在低温领域的空白。在食品保鲜与以低温检测方面有良好的应用前景。
[1] WOHLFAHRT G. The chemical mechanism of action of glucose oxidase from Aspergillus niger[J].Mol Cell Biochem,2004, 260(1-2):69-83.
[2] FERNANDES P. Enzymes in food processing: a condensed overview on strategies for better biocatalysts[J].Enzyme Res, 2010,2010:862537.DOI:10.4061/2010/862537.
[3] COULTHARD C E, MICHAELS R, SHORT W F, et al. Notatin:an anti-bacterial glucose-aerodehydrogenase from Penicillium notatum Westling[J].Nature, 1942, 39(2):459-460.
[4] MÜLLER D.Oxidation von glukose mit extrakten aus Aspegillus niger[J].Biochemische Zeitschrift, 1928,199:136-170.
[5] WITTEVEEN F B. Induction of glucose oxidase, catalase, and lactonase in Aspergillus niger[J].Curr Genet,1993,24(5):408-416.
[6] 刘志国,张志东,冯定远.日粮中添加过氧化氢酶对断奶仔猪生长性能、肠道形态及抗氧化性能的影响[J].中国饲料, 2017(1): 23-27.
[7] 王政,张大伟.抗生素替代技术在畜牧业中的应用[J].中国饲料,2017(24):30-34.
[8] 熊云霞.葡萄糖氧化酶在畜牧业中的应用及检测方法研究进展[J].饲料工业,2016,37(4):15-20.
[9] 张同燕.葡萄糖氧化酶在养殖业中的应用研究进展[J].当代畜牧,2018(1):16-17.
[10] FOULDS N C,LOWE C R.Immobilization of glucose oxidase in ferrocene-modified pyrrole polymers[J].Analytical Chemistry,1988,60(22):2 473.
[11] KANG X,WANG J,WU H,et al.Glucose oxidase-graphene-chitosan modified electrode for direct electrochemistry and glucose sensing[J].Biosensors & Bioelectronics,2009,25(4):901-905.
[12] 毕春元,杜祎,张金玲,等.生物传感器法检测葡萄汁中葡萄糖含量[J].中国酿造,2018,37(10):172-175.
[13] 马艳. 血糖仪和葡萄糖氧化酶法测定血糖的结果比较[J].世界最新医学信息文摘,2018,18(93):131.
[14] BLAZIC M,KOVACEVIC G,PRODANOVIC O,et al.Yeast surface display for the expression, purification and characterization of wild-type and B11 mutant glucose oxidases[J].Protein Expression & Purification,2013,89(2):175-180.
[15] GUO Y,LU F,ZHAO H,et al.Cloning and heterologous expression of glucose oxidase gene from Aspergillus niger Z-25 in Pichia pastoris[J].Applied Biochemistry & Biotechnology,2010,162(2):498.
[16] PULCI V, D’OVIDIO R, PETRUCCIOLI M, et al. The glucose oxidase of Penicillium variabile, P16: Gene cloning, sequencing and expression[J]. Letters in Applied Microbiology, 2010, 38(3): 233-238.
[17] 周亚凤,张先恩,刘虹,等.黑曲霉GOD基因的克隆及其在酵母中的高效表达[J].生物工程学报,2001,17(4):400-405.
[18] 高庆华,胡美荣,吴芳彤,等.点青霉葡萄糖氧化酶基因的克隆及其酶学性质研究[J].生物技术通报,2016,32(7):152-159.
[19] 王钢,陈尘,李强.大肠杆菌体系外源蛋白表达速度的调控策略[J].过程工程学报,2013,13(6):1 075-1 080.
[20] WITT S,SINGH M,KALISZ H M.Structural and kinetic properties of nonglycosylated recombinant Penicillium amagasakiense GOD expressed in Escherichia coli[J].Applied & Environmental Microbiology,1998,64(4):1 405.
[21] 顾磊,张娟,堵国成,等.黑曲霉葡萄糖氧化酶产生菌的筛选及其基因在大肠杆菌中的克隆表达[C].第八届中国酶工程学术研讨会论文集,2011,10:136.
[22] 肖志明,樊霞,马东霞,等.葡萄糖氧化酶的应用和检测方法研究进展[J].中国畜牧杂志,2014,50(18):76-81.
[23] 聂金梅,李阳源,刘金山.黑曲霉葡萄糖氧化酶基因改造及其在毕赤酵母中的表达[J].江苏农业科学,2018,46(20):17-21.
[24] 郝杰清,王帅坤,师慧,等.重组毕赤酵母葡萄糖氧化酶的纯化和性质[J].食品科学,2013,34(9):159-163.
[25] KIM B C,JEONG E,KIM E,et al.Bio-organic-inorganic hybrid photocatalyst,TiO2 and glucose oxidase composite for enhancing antibacterial performance in aqueous environments[J].Applied Catalysis B: Environmental,2018,11(3):205-211.
[26] FAKHRY B, ALI ASGHAR K, JAMSHID R. Expression, characterization and one step purification of heterologous glucose oxidase gene from Aspergillus niger ATCC 9029 in Pichia pastoris[J].EuPA Open Proteomics,2018, 9:1-5.
[27] 胡亚奇.葡萄糖氧化酶在鸡生产上的应用[J].中兽医学杂志, 2018(1):4.
[28] 王冰.葡萄糖氧化酶在猪饲料中的研究进展[J].饲料博览,2018(1):21-24.