2-酮基-D-葡萄糖酸(2-keto-D-gluconicacid,2-KGA)是一种重要的有机酸,用途广泛[1],能够作为食品添加剂、水泥增塑剂、洗涤剂和照片显影剂,最主要的用途是作为食品添加剂D-异抗坏血酸及其钠盐的前体[2]。此外,2-KGA还可以在2-酮基-D-葡萄糖酸脱氢酶的作用下转化成2,5-二酮基-D-葡萄糖酸(2,5-KDG),2,5-KDG通过2,5-KDG还原酶可以生成用于维生素C合成的前体2-酮基-L-古龙酸(2-KLG)[3]。2-KGA主要以化学法、酶催化法以及发酵法生产。化学合成法以Pt/Pb为催化剂,催化D-葡萄糖与分子氧反应形成2-KGA;酶法是指在相关氧化酶的催化作用下,将溶液中的D-葡萄糖经多步氧化形成2-KGA;发酵法是通过细菌发酵直接将D-葡萄糖转化为2-KGA,当前,普遍应用于工业生产2-KGA的方法为细菌发酵法。主要的细菌有荧光假单胞菌、恶臭假单胞菌、铜绿假单胞菌、球状节杆菌、产酮产碱菌、巴氏醋酸杆菌、氧化葡萄糖酸杆菌、粘质沙雷氏菌等[4-7]。我国的工业生产以荧光假单胞菌为主,在以18%的葡萄糖溶液为底物时,最终的转化率可达90.0%。但是荧光假单胞菌作为生产菌株,存在生产过程噬菌体污染、高浓度底物对发酵过程中菌体生长的抑制和发酵液中成分过多,分离困难等问题。
本研究中采用的菌株为氧化葡萄糖酸杆菌[8],具有耐高渗、耐酸等特点,同时对葡萄糖的利用率较高,因此可以用作生产2-KGA的菌株。本实验主要对5株野生菌进行初步筛选,针对具有较强2-KGA积累能力的菌株进行发酵优化,包括摇瓶培养的温度、培养基的组成以提高2-KGA的产量。
1 材料与方法
1.1 实验材料
1.1.1 菌株与质粒
Gluconobacter cerinus CGMCC 1.110[9]、Glucono-bacter japonicus CGMCC 1.49[10]:中国普通微生物菌株保藏中心;Gluconobacter oxydans 621H [11]:美国模式培养物集存库(ATCC);Gluconobacter oxydans WSH-003[12]:江苏江山制药有限公司;Gluconobacter oxydans T-100:日本NBRC菌株保藏中心。
1.1.2 主要试剂
头孢西丁钠盐、卡纳霉素抗生素,阿拉丁生物;蛋白胨、酵母粉,Oxoid生物。其他常规试剂购自国药试剂。
1.1.3 培养基
种子培养基(g/L):酵母抽提物10,山梨醇50,相应的固体培养基加入2%琼脂条,115 ℃灭菌20 min。
摇瓶发酵培养基(g/L):葡萄糖100,玉米浆粉20,CaCO3 20,MgSO4 0.2,(NH4)2SO4 2,KH2PO4 0.5,115 ℃灭菌20 min。
3 L发酵罐发酵培养基(g/L):葡萄糖100,玉米浆粉20,CaCO3 0.1,MgSO4 0.2,(NH4)2SO4 2,KH2PO4 0.5,115 ℃灭菌20 min。
1.1.4 仪器与设备
高效液相色谱仪,美国安捷伦公司;高压蒸汽灭菌锅,上海博讯实业有限公司;恒温摇床,上海知楚仪器有限公司。
1.2 实验方法
1.2.1 种子活化
从冰箱中取出保存的菌株甘油管解冻后,用接种针蘸取菌液划线于平板上,放置于30 ℃恒温培养箱中培养24 h后,挑取平板上的单菌落于装有种子培养基的摇瓶中,放置于30 ℃恒温摇床中,220 r/min培养24 h。
1.2.2 细胞培养
摇瓶培养:将活化后的种子液以10%接种量转接至装液量为50 mL的500 mL摇瓶中,30 ℃下220 r/min培养24 h。
发酵罐培养:以10%接种量将培养好的种子液转接到3 L发酵罐中,装液量为1 L,搅拌转速600 r/min,通气量4 vvm,30 ℃下培养。
1.2.3 检测方法
采用高效液相色谱法(HPLC)测定发酵液中的2-KGA含量。利用AMINEX HPX-87H有机酸柱进行检测,检测条件为:流动相0.5 mmol/L稀H2SO4溶液,流速0.5 mL/min,柱温35 ℃,进样量10 μL。
标准曲线的绘制:将购买的标准品溶于纯水中,按照一定比例稀释成不同质量分数的溶液后,以液相检测的峰面积为Y轴,标准品浓度为X轴,绘制标准曲线,得到液相检测的峰面积与产物浓度的关系。
1.2.4 最终转化率计算
转化率![]()
(1)
2 结果与分析
2.1 高产2-KGA菌株筛选
本实验室保藏的菌株共5株:G. cerinus CGMCC 1.110、G. japonicus CGMCC 1.49、G. oxydans 621H、G. oxydans WSH-003 和G. oxydans T-100。分别以这5株野生菌作为出发菌株进行摇瓶发酵,以葡萄糖质量浓度为50 g/L的培养基为底物发酵,催化生产2-KGA。通过液相色谱检测产量进行对比,筛选出1株高产菌株作为后续发酵优化的出发菌株。从图1可以看出,在这5株野生菌中,G. japonicus CGMCC 1.49的产量最高,为19.9 g/L,转化率为36.9%,将其作为后续研究的出发菌株。
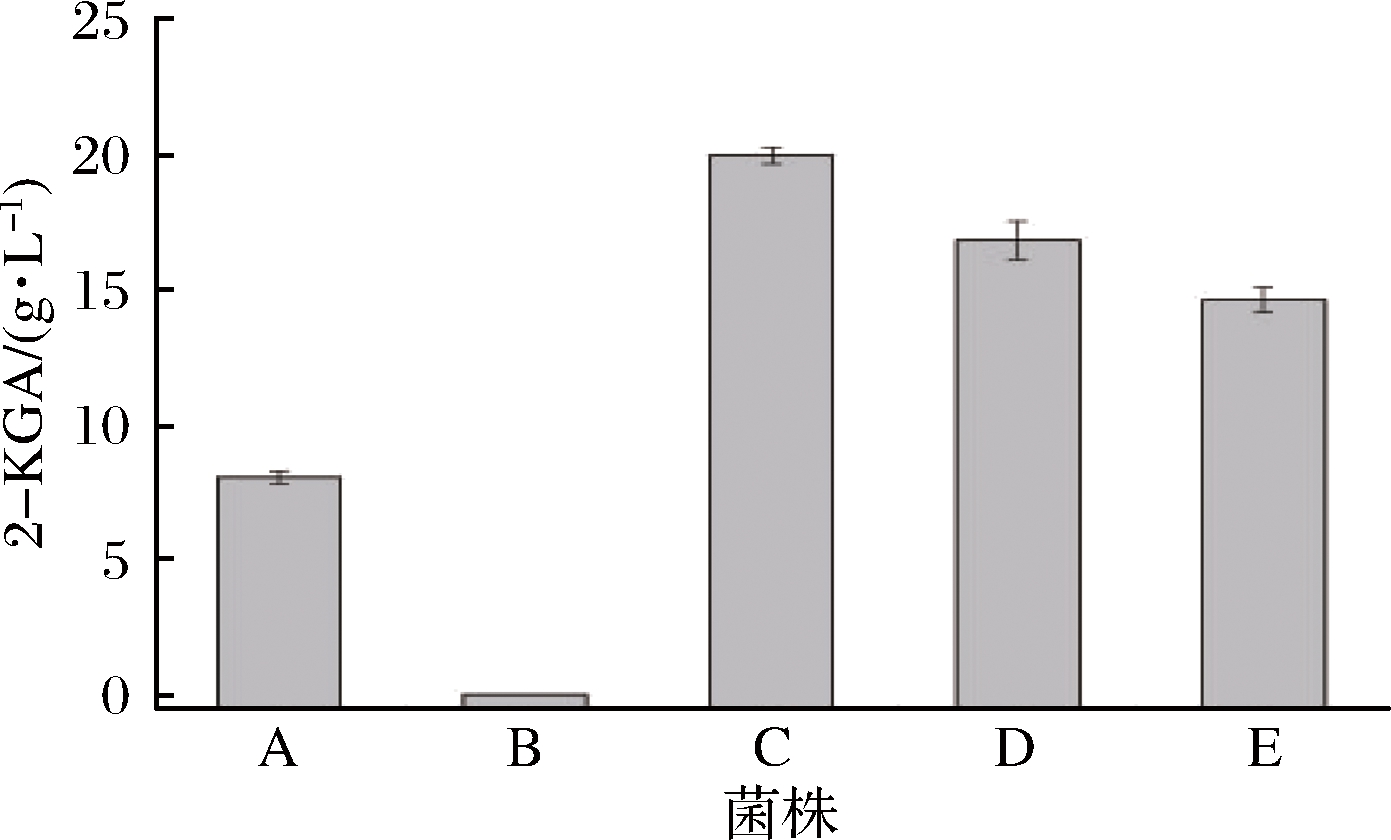
A-G. oxydans WSH-003;B- G. oxydans 621H;C-G. japonicus
CGMCC 1.49;D-G. cerinus CGMCC 1.110;E-G. oxydans T-100
图1 五株出发菌株发酵产量对比
Fig.1 Comparison of 2-KGA titer of 5 starting strains
2.2 摇瓶发酵条件优化
2.2.1 葡萄糖质量浓度对发酵的影响
氧化葡萄糖酸杆菌中含有较多的脱氢酶,不同的底物可以被特异性催化生成不同的代谢产物[13]。以葡萄糖为底物时,产物为酮基葡萄糖酸,包括2-KGA和5-酮基葡萄糖酸(5-KGA)以及2,5-二酮基-D-葡萄糖酸(2,5-KDG)[14]。本实验中,确定以葡萄糖作为底物,探究不同浓度的底物对发酵以及产率的影响。
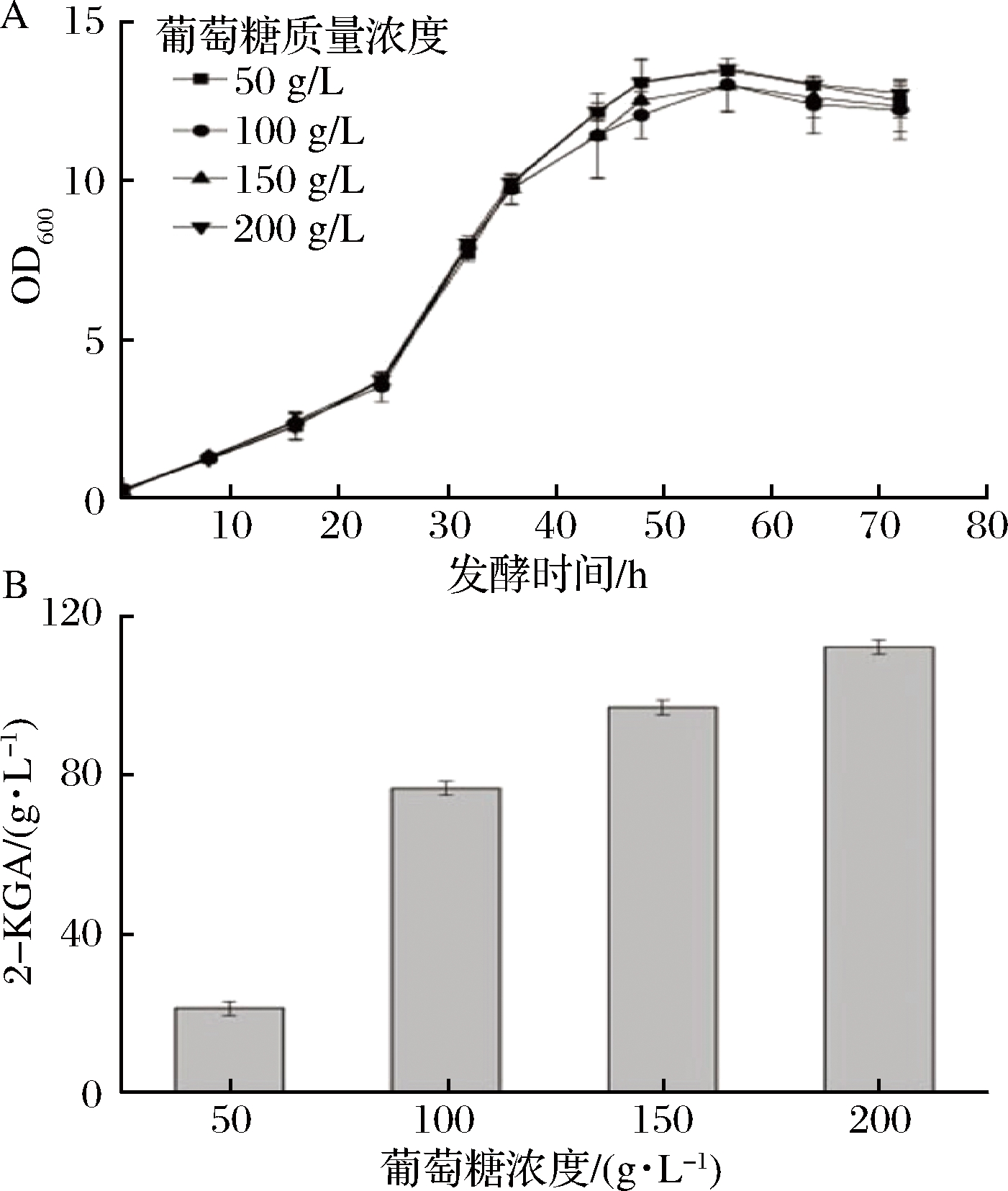
A-不同底物浓度对应的生长曲线;B-不同底物浓度条件下的2-KGA产量
图2 葡萄糖浓度对发酵过程的影响
Fig.2 Effects of glucose concentrations on fermentation process
从图2和表1中可以看出,培养基中的葡萄糖浓度不同,对于发酵过程中菌体的生长量、生长速率和2-KGA的产量有一定影响。当培养基中的葡萄糖质量浓度为50 g/L和100 g/L时,菌体的生长速度较快,最大的OD600值分别为12.5和13.7,可以看出当葡萄糖初始浓度较小时,有利于菌体的生长,生长速率较快;浓度较高时,对菌体的生长有较大的抑制作用,导致最终的菌体量较小。综合考虑菌体的生长速率、产量以及转化率,选取底物质量浓度为100 g/L作为发酵的初始浓度。
表1 初始葡萄糖浓度对发酵的影响
Table 1 Effect of initial glucose concentration onfermentation process
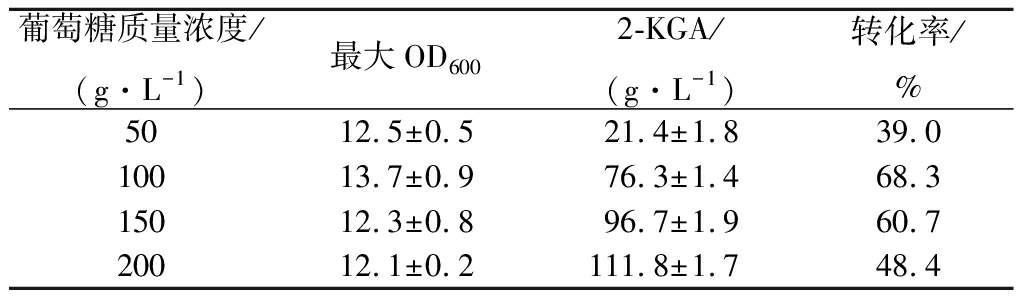
葡萄糖质量浓度/(g·L-1)最大OD6002-KGA/(g·L-1)转化率/%5012.5±0.521.4±1.839.010013.7±0.976.3±1.468.315012.3±0.896.7±1.960.720012.1±0.2111.8±1.748.4
2.2.2 氮源种类以及最优氮源浓度对发酵的影响
本实验选取的氮源有硝酸钠、硫酸铵、氯化铵、尿素、玉米浆粉、酵母粉和牛肉浸膏,添加量均为10 g/L,发酵72 h后,对比2-KGA的产量,确定最佳氮源[15]。从图2-A中得出,以玉米浆粉作为氮源时,对比生长情况在各个氮源种类中最佳,发酵72 h后,2-KGA产量为23.8 g/L,转化率为44.2%。在所选氮源中,最终的产率最高。
在确定最佳的氮源为玉米浆粉后,对玉米浆粉添加量进行优化。选取5个浓度梯度进行发酵验证。不同玉米浆粉质量浓度对菌体的生长和产物的合成都有一定的影响,通过图3-B中比较可以得出玉米浆粉的最优添加量为20 g/L。
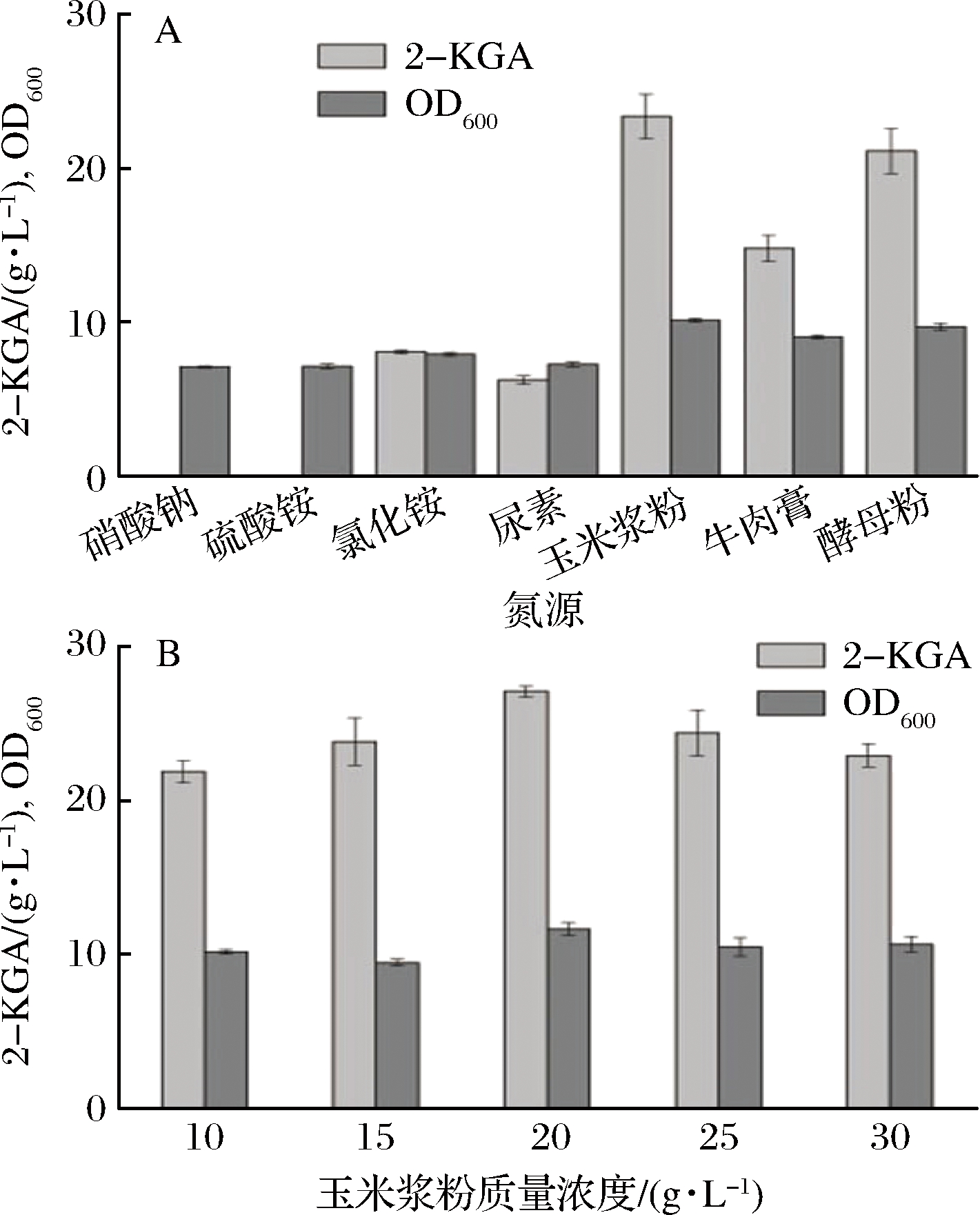
A-不同氮源对2-KGA产量及菌体生长的影响;
B-玉米浆粉添加量对2-KGA产量及菌体生长的影响
图3 氮源及最佳氮源添加量对2-KGA的产量以及菌体生长的影响
Fig.3 Effects of different nitrogen sources and optimum nitrogen sources on titer of 2-KGA and growth of strain
2.2.3 温度对发酵的影响
氧化葡萄糖酸杆菌中已知的相关酶类的性质,主要涉及的葡萄糖脱氢酶和葡萄糖酸-2-脱氢酶最适温度与菌体生长的最适温度有差别,所以本实验对不同温度条件下的发酵情况进行比较[13,16-17]。主要控制发酵温度在28~32 ℃范围内,以50 g/L底物质量浓度发酵,控制其他条件相同,比较菌体的生长和最终产率情况。从图4可以得出,同一批次中,当控制发酵温度在30 ℃时,菌体的生长速度较快,发酵至终点的菌体量及最终的产率最高,产量达到23.7 g/L,转化率为49.6%。
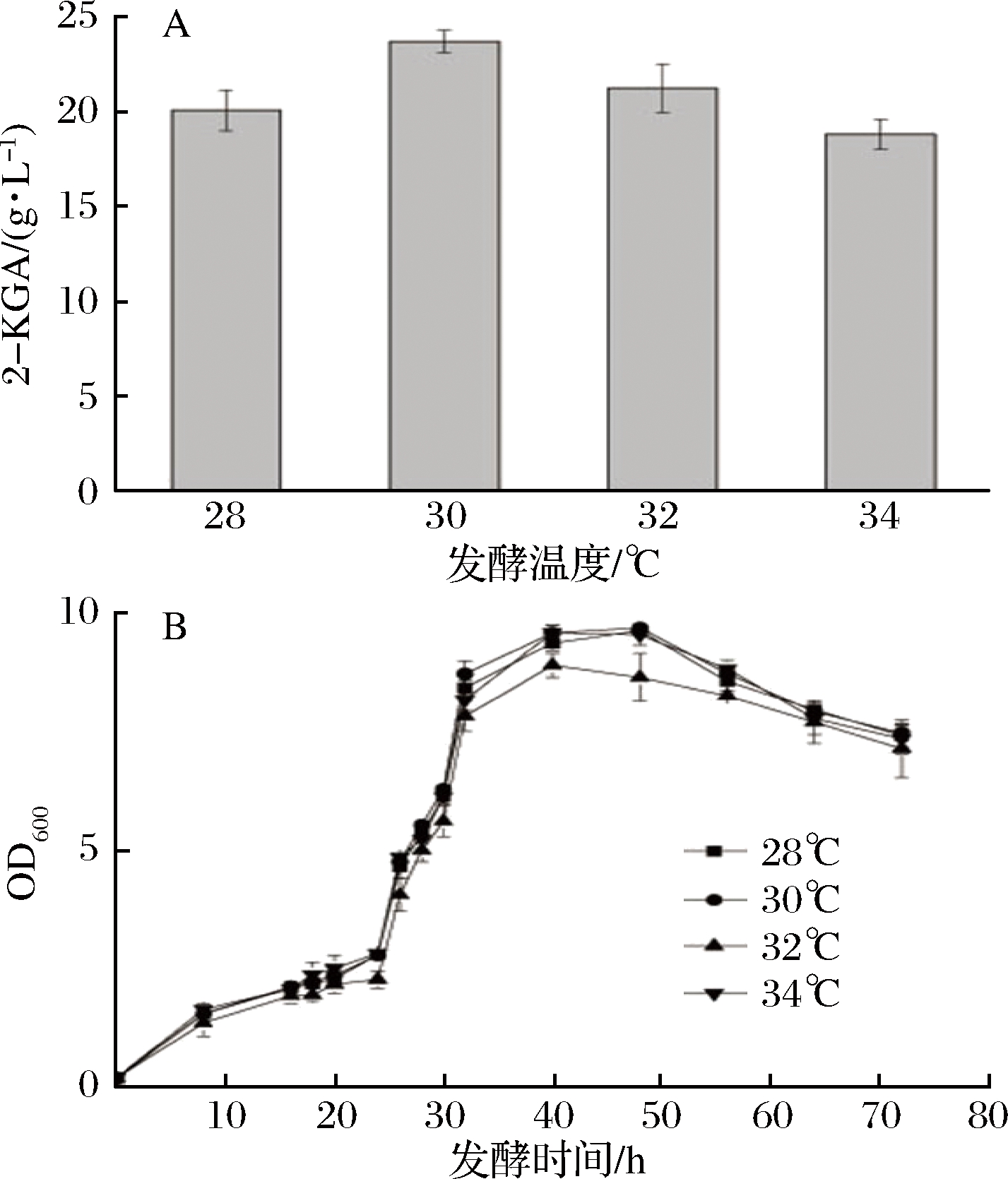
A-温度对2-KGA产量的影响;B-不同温条件下的生长曲线
图4 温度对发酵过程的影响
Fig.4 Effects of temperature on fermentation process
2.3 3 L发酵罐实验
2.3.1 初始pH值对发酵的影响
通过在摇瓶上对发酵条件的摸索,确定培养基的基本组成,在发酵罐中对摇瓶实验进行放大[1,18]。在摸索摇瓶发酵条件时,对pH值条件的摸索受到限制,主要通过碳酸钙的添加来维持摇瓶中的pH值,在发酵罐上主要采用50%的氨水溶液进行pH值的调节。在摇瓶上进行发酵时,对比不添加碳酸钙进行发酵,最终的发酵液的pH值仅为2.8左右,且检测不到产物。所以猜想,在发酵过程中如果pH值一直维持较低水平,不利于产物的产生。当初始pH值为4.0或更低时,菌体的生长受到了很大抑制,所以需要在发酵罐上对发酵过程中的pH值进行调控。本实验主要选取了pH值为5.0、6.0、7.0进行对比。
对比图5不同pH条件下的发酵情况发现,当控制发酵过程中的pH值为6.0,发酵时间达到60 h时,产量最高达到93.4 g/L,转化率为87.2%。在该条件下,菌体的生长状况最好,所以在后续的发酵实验中,控制pH值为6.0。从葡萄糖消耗速率与中间产物葡萄糖酸的产生速率来看,前24 h内,底物被快速消耗,大部分转化为中间产物葡萄糖酸,菌体持续快速生长。经历了前24 h后,菌体量保持增加,底物逐渐消耗尽,中间产物开始转化为终产物2-KGA。另外检测发酵过程中溶氧发现,在0~36 h内变化剧烈且出现最低值,说明此阶段菌体生长旺盛,耗氧量增加。36 h后,溶氧开始慢慢上升,发酵持续到42 h后,溶氧水平保持平衡,菌体生长开始放缓。后续发酵罐上的溶氧水平优化可以此作为参考。
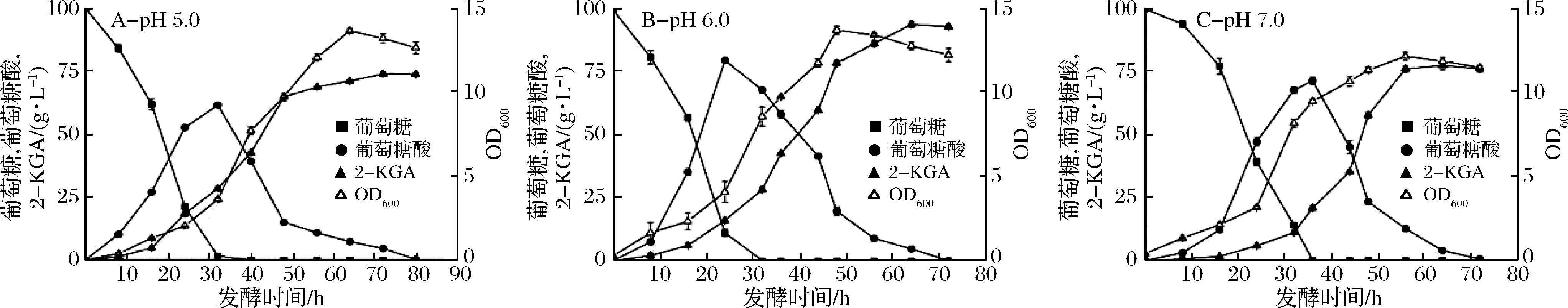
图5 pH对发酵过程的影响
Fig.5 Effects of pH on fermentation process
2.3.2 溶氧对发酵的影响
溶氧(DO)是好氧微生物生长所必须的条件,更是对产物生成和能量代谢产生影响的关键环境因素之一。溶氧作为发酵过程中的重要参数,对发酵生产的稳定性和生产成本具有重大影响。在研究确定了最佳的pH值后,继续对溶氧进行探究。通过前期对罐上发酵过程的溶氧水平进行监测可知,在接种后的0~24 h内,溶氧量剧烈波动不断下降,最低降为0且维持一段时间;在36 h后,溶氧水平慢慢回升至最高值后维持恒定。所以本实验中对发酵前36 h内控制溶氧条件分别为20%、30%、40%和50%由图6可知,随着DO的升高,菌体生物量逐渐升高,至DO为40%时达到最大。当DO上升至50%时,菌体的生长量反而减小,同时当控制DO为30%时,2-KGA产量达到最大,且此条件下的产率也达到最高,分别为97.3 g/L和90.3%。虽然氧化葡萄糖酸杆菌是好氧菌,但是过多的氧气容易引起超氧化物和羟基自由基等物质形成,破坏细胞的组成,从而对菌体自身的代谢产生影响。
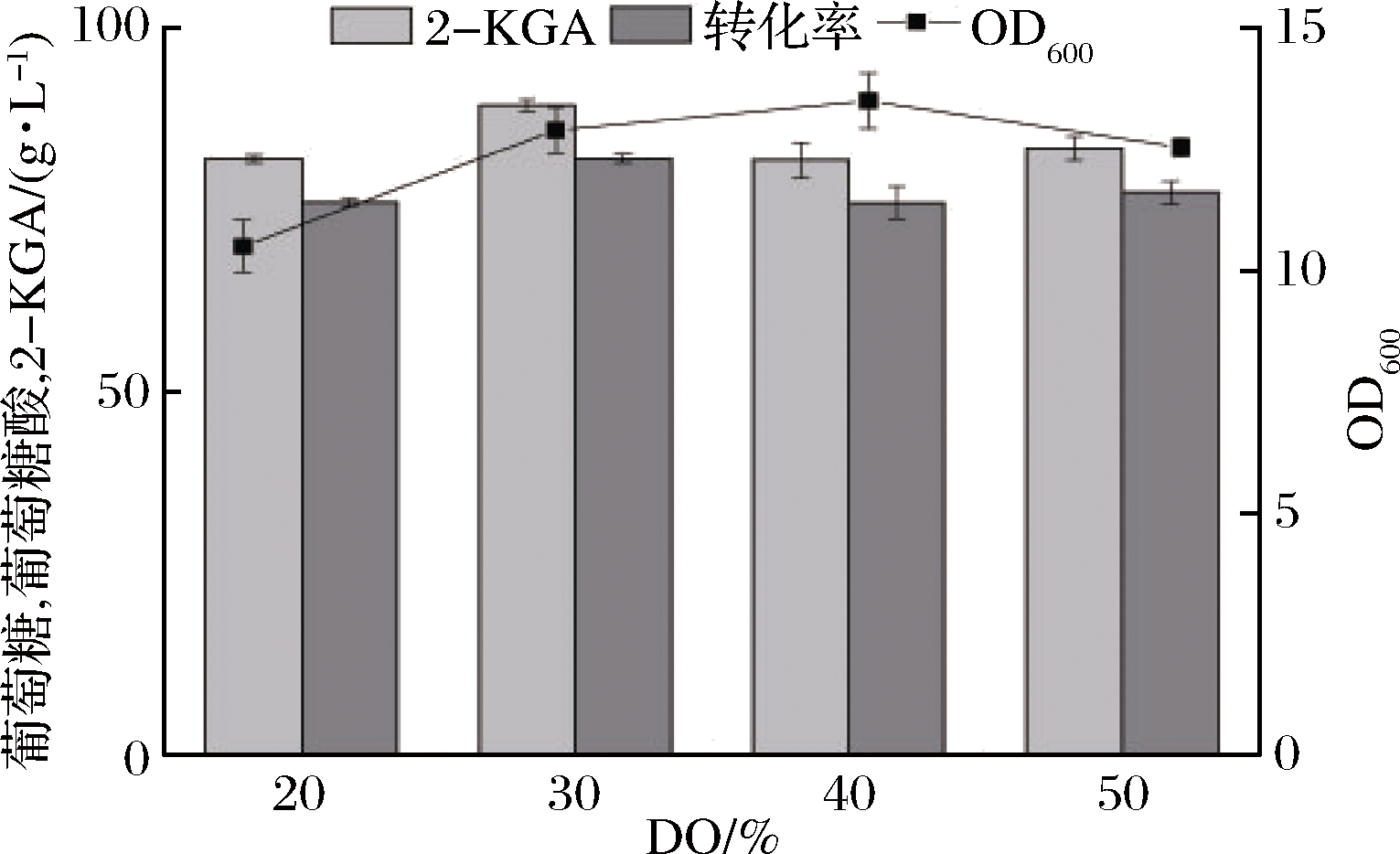
图6 不同DO水平对发酵过程的影响
Fig.6 Effects of different DO levels on fermentation process
2.3.3 一次性补料时残糖质量浓度对发酵的影响
本实验采用3 L自动发酵罐进行2-KGA的分批补料发酵实验,初始的葡萄糖质量浓度均为100 g/L,装液量为1 L。发酵过程中以发酵液中的残糖质量浓度为指标,分别选取残糖质量浓度降低至15、25、35和45 g/L四个水平,一次性补加葡萄糖250 g/L,补糖量为200 mL,再以同样的条件发酵至终点。在发酵开始后10~18 h内,每1 h取样1次,监测残糖质量浓度,确定补料时机,补料之后每6 h取样1次。
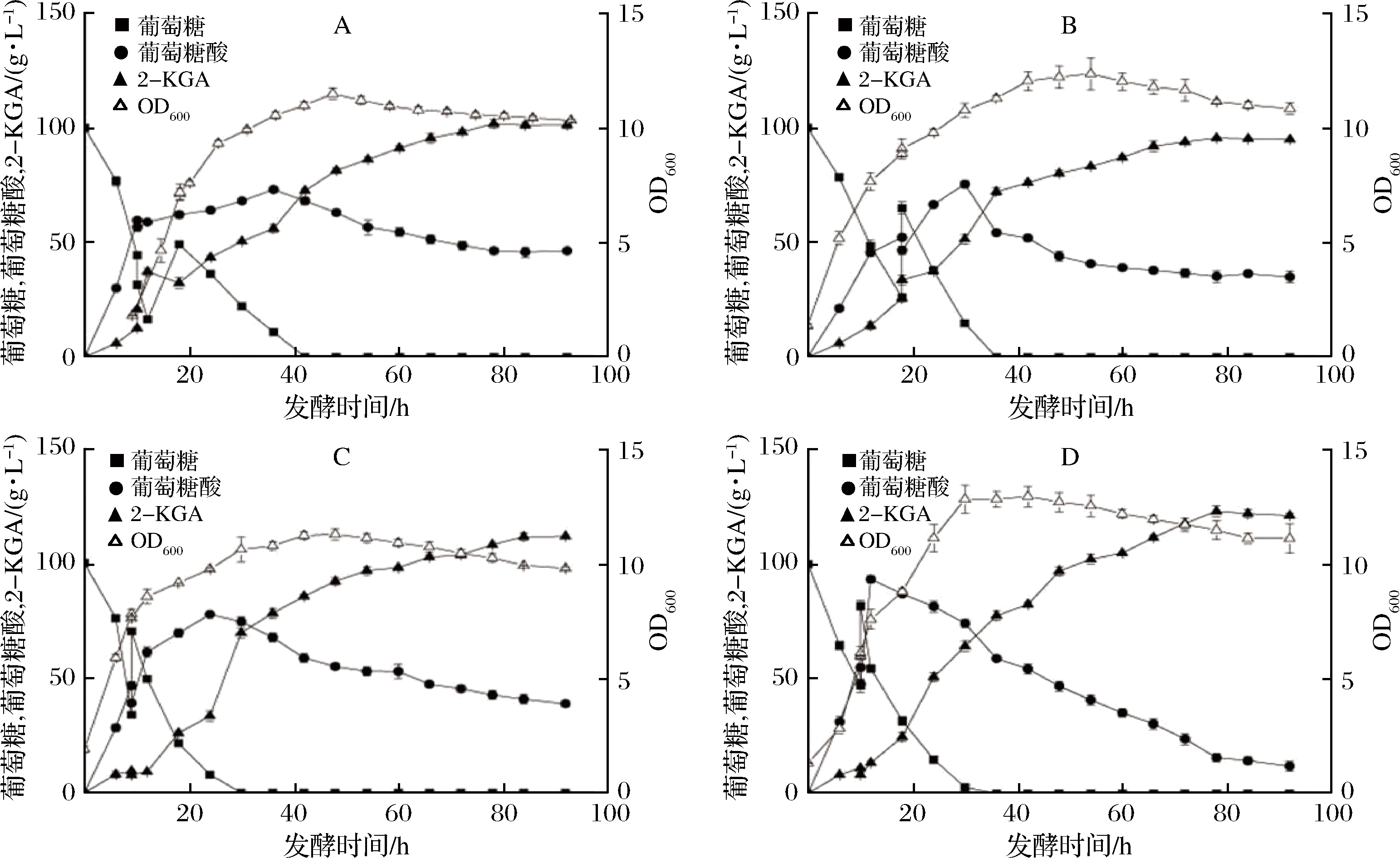
残糖质量浓度分别为:A-15 g/L;B-25 g/L;C-35 g/L;D-45 g/L
图7 残糖质量浓度对生长的影响
Fig.7 Effect of residual sugar concentration on growth
由图7可知,在不同的残糖质量浓度下,一次性添加50 g葡萄糖补料发酵,有利于减弱底物抑制,避免快速利用碳源的阻遏效应;补料发酵还可以控制最佳的生长和产物合成条件,稳定生产工艺。在25 g/L和45 g/L时一次性补料,菌体生长较旺盛,在对数生长期比生长速率较快,且能获得较高的菌体浓度。结合在发酵过程中的葡萄糖消耗、中间产物以及2-KGA生成的速率分析,在残糖质量浓度为35 g/L和45 g/L时一次性补料后底物的消耗以及产物的形成速率较快。残糖质量浓度为35 g/L时一次性补料,最大的生产强度为4.33 g/(L·h),发酵92 h后产量最终达到112.1 g/L;而残糖质量浓度为45 g/L时,最大的生产强度为6.16 g/(L·h),发酵92 h后产量最终达到122.1 g/L。同时,当选择残糖质量浓度为45 g/L时进行补料,最终发酵液中残留的葡萄糖酸最少,给后期产物提纯带来的影响较小。在15 g/L和25 g/L时进行补料,菌体生长较慢,2-KGA产量较低,生产强度和底物利用率不高。综合产物得率以及转换率对比得出,在残糖质量浓度为45 g/L时一次性补料后,菌体生长较好,产物转化率和生产强度最高,分别为75.5%和6.16 g/(L·h),产量较分批发酵提高了43.5%。
3 讨论
本文从5株菌中筛选出最适菌株G. japonicus CGMCC 1.49,并对其产2-KGA的发酵工艺进行了优化,在此最适条件下,2-KGA摇瓶发酵最高产量为76.3 g/L,较优化前提高了120.0%。对3 L罐中生产2-KGA的最优pH值和溶氧条件进行探究,得到在pH值为6,DO为30%条件下,2-KGA的产量为97.3 g/L,较摇瓶最高水平提高了26.7%。通过一次性补料优化后,产量达到122.1 g/L,转化率达75.5%。在后期的研究中,可以通过对补料方式和补料时机进一步探究,完善氧化葡萄糖酸杆菌产2-KGA过程中的各项参数,实现高产2-KGA的目标。本文筛选最适菌株后主要通过发酵优化手段实现2-KGA的高产,没有对其进行分子改造。最终结果表明,潜在副产物5-KGA和2,5-DKG的含量极低,对后期的分离提纯影响较小。近年来,对氧化葡萄糖酸杆菌的基因操作手段日趋完善[13,19-21]。在后续工作中,通过代谢工程策略强化2-KGA合成的关键酶、优化补料发酵条件,将有望进一步提升2-KGA产量[22-23]。本研究为后续利用氧化葡萄糖酸杆菌发酵生产2-KGA,及利用代谢工程改造实现维生素C前体2-KLG的直接发酵提供理论与技术参考[24-25]。
[1] 张炜.2-酮基-D-葡萄糖酸产生菌的筛选、发酵工艺优化及其动力学研究[D].杭州:浙江大学, 2011.
[2] 周强,魏转,孙文敬.等.D-异抗坏血酸生产技术研究进展[J].食品科学, 2008,29(8): 647-651.
[3] 石岗,颜方贵.维生素C重要前体2,5-二酮基-D-葡萄糖酸发酵研究. [J].食品与发酵工业, 2002,38(5): 18-23.
[4] 陈萍,苗晓燕,张筱梅.等.利用荧光假单胞菌固定化细胞生产2-酮基-D-葡萄糖酸[J].食品科学, 2010, 31(21): 258-261.
[5] 王贝贝,李昊聪,孙文敬,等.粘质沙雷氏菌膜结合葡萄糖酸脱氢酶的分离纯化及其酶学特性[J/OL].食品科学, 1-14[2019-05-16].
[6] 余泗莲, 汪美生,孙文敬,等. 荧光假单胞菌JD1202利用大米淀粉水解糖连续发酵生产2-酮基-D-葡萄糖酸[J].中国食品添加剂, 2012(6): 191-197.
[7] 张炜,谢志鹏,罗玮,等.沙雷氏菌Serratia sp.BK-98发酵生产2-酮基-D-葡萄糖酸的工艺优化及动力学研究[J].化工学报, 2011, 62(5): 1 371-1 376.
[8] 姚瑞苗.氧化葡萄糖酸杆菌的抑制物耐受性及全糖转化探究[D].上海:华东理工大学, 2017.
[9] PHILIPPE C, KRUPOVIC M, JAOMANJAKA F,et al. Bacteriophage GC1, a novel tectivirus infecting Gluconobacter cerinus, an acetic acid bacterium associated with wine-making[J].Viruses-Basel, 2018, 10(1):39.
[10] LI L, CLEENWERCK I, DE VUYST L,et al. Identification of acetic acid bacteria through matrix-assisted laser desorption/ionization time-of-flight mass spectrometry and report of Gluconobacter nephelii Kommanee et al. 2011 and Gluconobacter uchimurae Tanasupawat et al. 2012 as later heterotypic synonyms of Gluconobacter japonicus Malimas et al. 2009 and Gluconobacter oxydans (HENNEBERG 1897) De Ley 1961 (Approved Lists 1980) emend Gossele et al. 1983, respectively[J].Systematic and Applied Microbiology, 2017, 40(3): 123-134.
[11] SIEMEN A, KOSCIOW K, SCHWEIGER P,et al. Production of 5-ketofructose from fructose or sucrose using genetically modified Gluconobacter oxydans strains[J].Applied Microbiology and Biotechnology, 2018, 102(4): 1 699-1 710.
[12] WAN Hui,KANG Zhen, LI Jianghua,et al. Effect of high 2-KLG concentration on expression of pivotal genes involved in 2-KLG synthesis in Gluconobacter oxydans WSH-003[J]. Acta microbiologica Sinica, 2016, 56(10): 1 656-1 663.
[13] 薛庆.2-酮基-D-葡萄糖酸产生菌膜结合葡萄糖脱氢酶的分离纯化及性质[D].石家庄:河北师范大学, 2015.
[14] 李博义,潘海峰,孙伟荣,等. 5-酮基-D-葡萄糖酸发酵生产的工艺条件优化[J].生物工程学报, 2014, 30(9): 1 486-1 490.
[15] 李文婧,徐慧,刘建军,等.玉米浆粉预处理对粘质沙雷氏菌发酵产2-酮基-D-葡萄糖酸的影响[J].食品工业科技, 2018, 39(5): 130-133.
[16] 陈吉铭.氧化葡萄糖酸杆菌中2-酮基-L-古龙酸合成途径的整合表达与强化[D].无锡:江南大学, 2015.
[17] 陈吉铭,堵国成,陈坚,等.普通生酮基古龙酸菌2-酮基-L-古龙酸合成途径在氧化葡萄糖酸杆菌中的整合表达与强化[J].食品与生物技术学报, 2016, 35(6): 611-616.
[18] 王雪娇,程晓志,冯晨龙,等.一株2-酮基-D-葡萄糖酸(2KGA)产生菌的发酵研究[J].中国食品添加剂, 2014(3): 109-114.
[19] 陈鸿胜,李克非,舒行宙,等.基于Gluconobacter oxydans膜结合脱氢酶的静息细胞催化合成2-酮基-D-葡萄糖酸[J].食品工业科技, 2012, 33(19): 177-181.
[20] 袁翠娟.氧化葡萄糖酸杆菌621H中双组分蛋白组氨酸激酶应答调节子杂合蛋白质与细胞内其他蛋白质相互作用的研究[D].上海:华东理工大学, 2017.
[21] 胡于东.氧化葡萄糖酸杆菌梯度强度组成型启动子的筛选与应用[D].无锡:江南大学, 2015.
[22] 张欢.氧化葡萄糖酸杆菌膜结合乙醇脱氢酶亚基Ⅲ的功能鉴定及提高菌株羟基酸合成能力的研究[D].上海:华东理工大学, 2016.
[23] 李翎,许琳,魏淼,等.氧化葡萄糖酸杆菌中5-葡萄糖酸脱氢酶基因的克隆、表达及酶学性质分析[J].生物技术通报, 2014(9): 157-163.
[24] 杨燕花,吕永坤,陈吉铭,等.2-酮基-L-古龙酸一步发酵生产菌株发酵过程优化[J].食品与发酵工业, 2016, 42(7): 60-64.
[25] 翟兵兵,董秀涛,丁明珠,等.VC三菌种一步发酵方法的构建与研究[J].中国生物工程杂志, 2016, 36(12): 72-78.