姜黄素类化合物主要包括姜黄素、单脱甲氧基姜黄素和双脱甲氧基姜黄素,其中以姜黄素为主要成分[1],主要存在于植物姜黄、莪术和郁金的根或茎中,长期以来就作为一种常用的天然色素被广泛地应用在食品工业中[2]。研究表明姜黄素可抑制众多肿瘤细胞系的生长,能影响肿瘤发生和发展的多个环节和步骤,近两年研究表明,姜黄素具有提高记忆力、抗老年痴呆活性,对急性、亚急性和慢性炎症均具有抗炎作用[3-6],对肝脏有保护功能[7],因此它亦具有广泛的医用价值。
然而,姜黄素的应用受限于它的结构不稳定性、低的生物利用度和差的水溶性[8-11],姜黄素有烯醇式(图1-A)和酮式(图1-B)两种结构。姜黄素在水中几乎不溶解,能溶于碱性溶液和乙醇、丙酮、二甲基亚砜等有机溶剂[12]。因此,提高姜黄素的水溶性和生物利用度十分必要。目前提高姜黄素的水溶性的一般方法有环糊精包被、添加乳化剂、连接亲水基团、形成缀合物、糖苷化等[13-18]。其中,糖苷化是提高天然产物水溶性的一种有效途径[19]。CHOUDHURY等通过化学法制备了姜黄素葡萄糖苷和姜黄素双葡萄糖苷[20];ZHANG等[21]利用华根霉合成了姜黄素葡萄糖苷;PRASAD等[22]利用苦杏仁中的β-葡萄糖苷酶合成了姜黄素双葡萄糖苷,有效提高了姜黄素的水溶性和生物利用度,其抗氧化活性、抑菌活性均有所提高。
本文成功筛选到1株乳酸菌能够有效地将葡萄糖苷连接到姜黄素分子的羟基集团上。研究通过LC-MS确认了糖苷化产物。
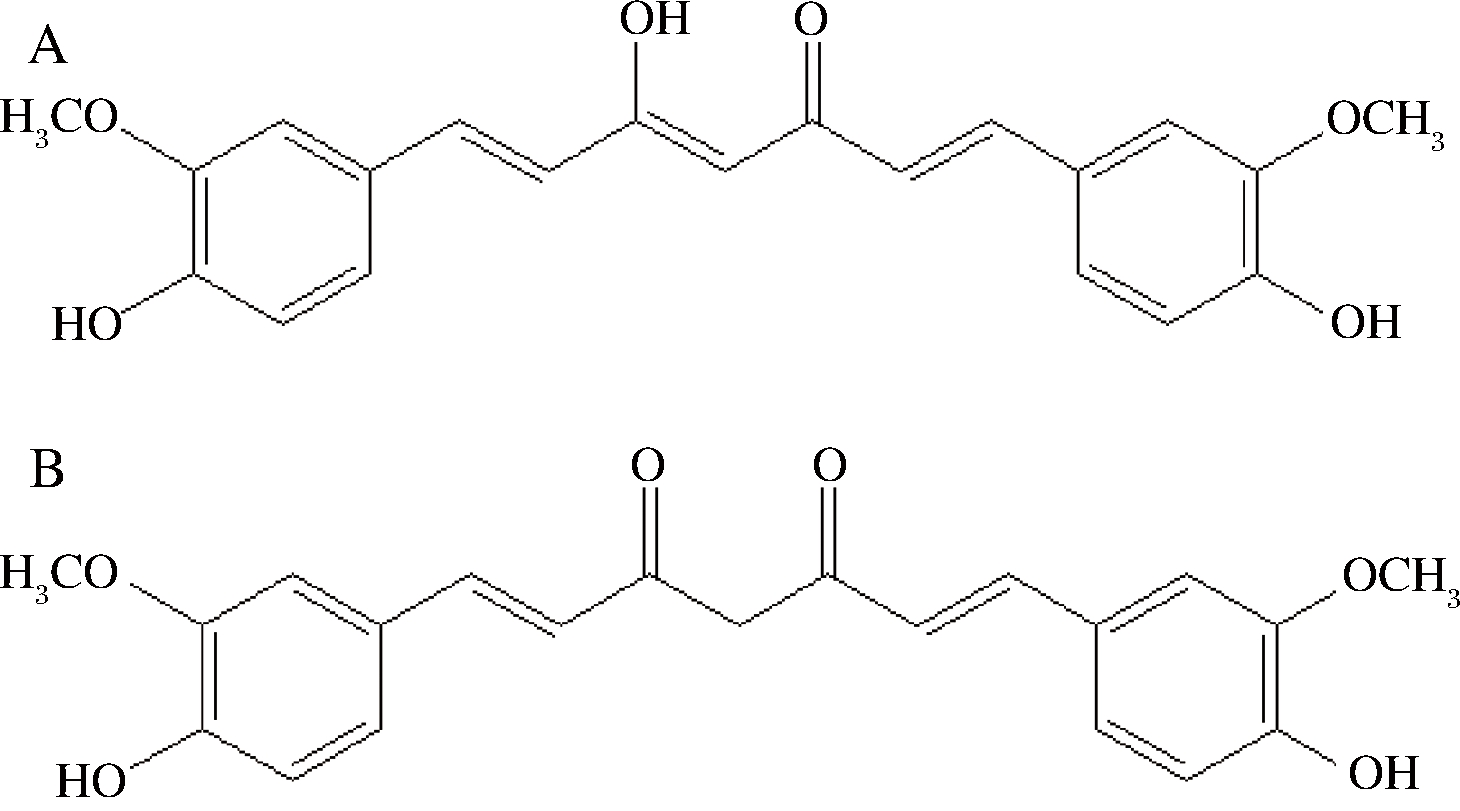
A-烯醇式姜黄素;B-酮式姜黄素
图1 姜黄素分子结构示意图
Fig.1 Chemical structure of curcumin
1 材料与方法
1.1 材料与仪器
实验菌株来源于实验室菌株保藏库。
蛋白胨、牛肉膏、酵母粉、K2HPO4、乙酸钠、MgSO4·7H2O、MnSO4·4H2O、葡萄糖、柠檬酸二铵、吐温80、琼脂、无水乙醇(AR)、乙酸乙酯(AR)上海国药集团;甲醇(HPLC)、乙腈(HPLC),阿拉丁试剂有限(中国)公司。
G180T灭菌锅,美国致微仪器有限公司;安捷伦1260高效液相色谱仪,美国安捷伦科技公司;cence H180型离心机,湖南湘仪实验室仪器开发有限公司;超高效液相色谱串联四极杆飞行时间质谱联用仪,美国沃特世公司。
1.2 菌种筛选
通过颜色圈法筛选出能够产β-葡萄糖苷酶酵母菌和乳酸菌,筛选方法如下:在YPD和MRS培养基中加入质量分数为0.1%的栀子苷和0.25%的谷氨酸钠。如筛选平板变蓝,则说明其是产β-葡萄糖苷酶的菌株[23]。
1.3 实验方法
1.3.1 微生物转化实验
种子培养基:每100 mL种子液加入蛋白胨 1 g、牛肉膏 1 g、酵母粉0.5 g、K2HPO4 0.2 g、乙酸钠 0.5 g、MgSO4·7H2O 0.08 g、MnSO4·4H2O 0.02 g、葡萄糖 2 g、柠檬酸二铵 0.2 g、吐温 80 0.5 mL、琼脂 2 g(固体培养基)。
发酵培养基:每100 mL发酵液加入蛋白胨 0.5 g、酵母粉 0.25 g、K2HPO4 0.2 g、乙酸钠 0.5 g、MgSO4·7H2O 0.08 g、MnSO4·4H2O 0.02 g、葡萄糖 4 g、柠檬酸二铵 0.2 g。
以上培养基分装封口后于灭菌锅115 ℃下灭菌30 min。
种子液培养:将乳酸菌接种于250 mL三角瓶中,每瓶装100 mL上述MRS液体培养基,37 ℃下静置培养24 h。
发酵液培养:配制80 mL上述MRS发酵培养基于250 mL三角瓶中,于灭菌锅115 ℃下灭菌30 min,接种量为10 mL,再加入10 mL质量浓度为1 mg/mL的乙醇姜黄素溶液,于37 ℃ 60 r/min摇床培养4 d。
1.3.2 姜黄素及其衍生物的提取
将发酵4 d的发酵液按10 000 r/min离心10 min,取上清液。上清液用乙酸乙酯萃取3次,V(上清液)∶V(乙酸乙酯)=2∶1,合并乙酸乙酯层于旋转蒸发仪旋蒸至干,加入10 mL甲醇(HPLC)复溶,过0.22 μm微孔滤膜备用。
1.3.3 姜黄素及其衍生物的检测方法
使用高效液相色谱仪对样品进行检测,液相条件为:ZORBOX SB-C18色谱柱(150 mm×4.6 mm,5 μm);VWD检测器检测,检测波长425 nm;柱温30 ℃;进样量5 μL;流速为1 mL/min;流动相纯水(A)-乙腈(B),洗脱梯度如表1。
表1 HPLC流动相梯度
Table 1 The gradient elution program of HPLC

时间/min流动相A/%流动相B/%0901057030104060153070202080250100
2 结果与分析
2.1 菌种选择
通过选择颜色圈变蓝的能够产β-葡萄糖苷酶的菌株进行转化实验。在姜黄素的特征吸收波长下有新的产物产生,说明该菌株具有转化能力,结合质谱结果分析,最终确定实验菌株。

图2 颜色圈筛选平板
Fig.2 Color circle screening plate
在MRS平板上37 ℃培养24 h,菌落形态:大小中等,凸起,微白色,湿润,边缘整齐,呈圆形。
菌株经上海生物工程股份有限公司测序,利用BLAST程序对所测菌种16S rDNA测序结果比对,并用MEGA7.0软件绘制系统进化树。用邻接法(Neighbor-joining)进行发育树分析。由图3可知,该菌株为Lactobacillus zeae strain OZK17。

图3 Lactobacillus zeae strain OZK17 菌株进化树图
Fig.3 Lactobacillus zeae strain OZK17 strain evolution tree
2.2 HPLC检测分析
样品经HPLC在姜黄素特征吸收波长425 nm下检测如图4所示,图4-A为姜黄素标准品HPLC检测图谱,图4-B中保留时间为9.696 min和7.402 min的未知产物1和2出峰比姜黄素早,其在高水相时洗脱出来,说明其具有比姜黄素更大的极性,初步推测其为比姜黄素水溶性更好的衍生物。
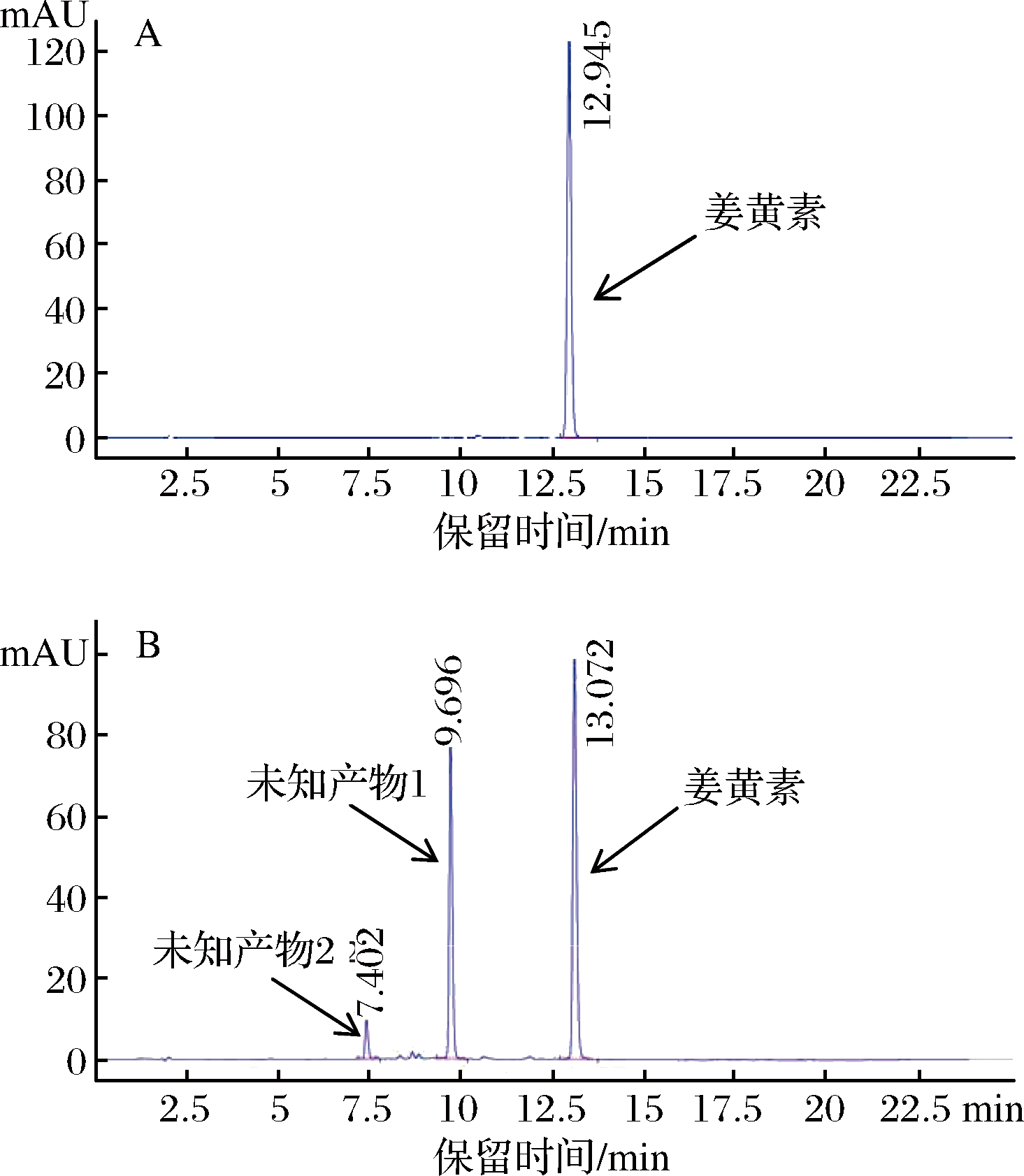
A-姜黄素标准品HPLC图谱;B-转化后产物HPLC图谱
图4 HPLC分析图谱
Fig.4 HPLC analysis chromatograms
2.3 转化产物的HPLC-MS定性分析
对未知产物1进行ESIMS分析,由图5-A可知,其MS1出现m/z 529的[M-H]-和m/z 565的[M+Cl]-的分子离子峰,也出现m/z 367的[M-H]-的姜黄素分子离子峰,初步判断为连上162 Da(六碳糖)产生的姜黄素葡萄糖苷。
由图5-B和图5-C可知,未知峰MS2图出现的离子碎片m/z 134、149、173、175和217均为姜黄素MS2离子碎片特征离子峰,其断裂方式如图6所示。此外,由图9可知,未知产物的最大紫外吸收波长和姜黄素分子的最大紫外吸收波长基本一致。综合以上检测结果,转化产物为姜黄素葡萄糖苷。
对未知产物2进行ESIMS分析,由图7-A可知,其MS1出现m/z 691的[M-H]-,初步判断为连上2个162 Da(六碳糖)产生的姜黄素葡萄糖苷。
由图7-B和图5-C可知,未知峰MS2图出现的离子碎片m/z 175、217、367、均为姜黄素MS2离子碎片特征离子峰,碎片m/z 409、541为姜黄素葡萄糖苷MS2离子碎片特征离子峰,其断裂方式如图8所示。

A-姜黄素葡萄糖苷分子的MS图;B-姜黄素葡糖糖苷对应峰的MS2图;C-姜黄素对应峰的MS2图
图5 质谱分析图谱
Fig.5 Mass spectrometry analysis
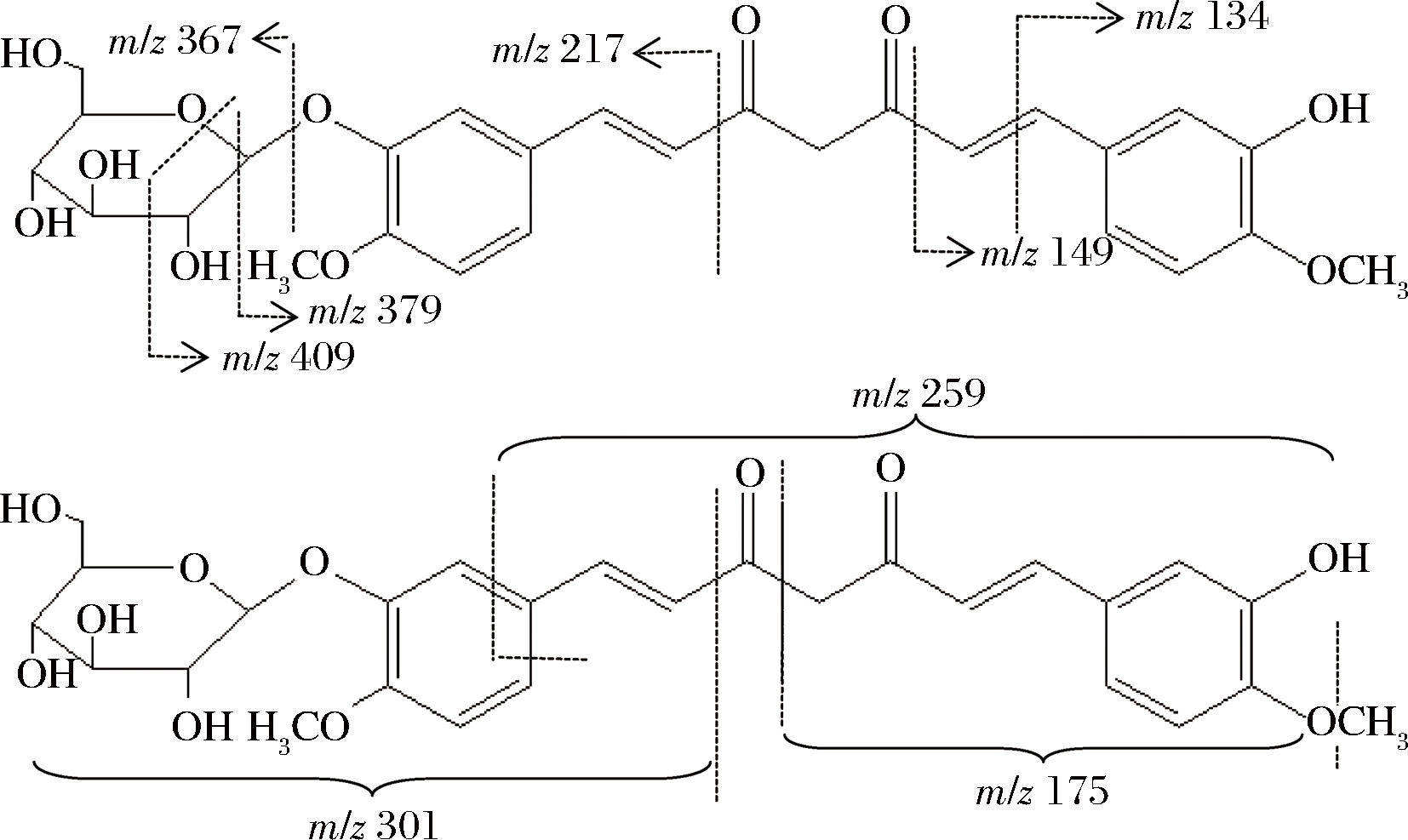
图6 姜黄素葡萄糖苷断裂方式
Fig.6 Curcumin glucoside breaks

A-姜黄素双葡萄糖苷分子的MS1图;
B-姜黄素双葡萄糖苷分子的MS2图
图7 质谱分析图谱
Fig.7 Mass spectrometry analysis

图8 姜黄素双葡萄糖苷断裂方式
Fig.8 Curcumin-bis-glucoside breaks
此外,由图9可知,未知产物的最大紫外吸收波长和姜黄素分子的最大紫外吸收波长基本一致。综合以上检测结果推测,转化产物为姜黄素双葡萄糖苷。
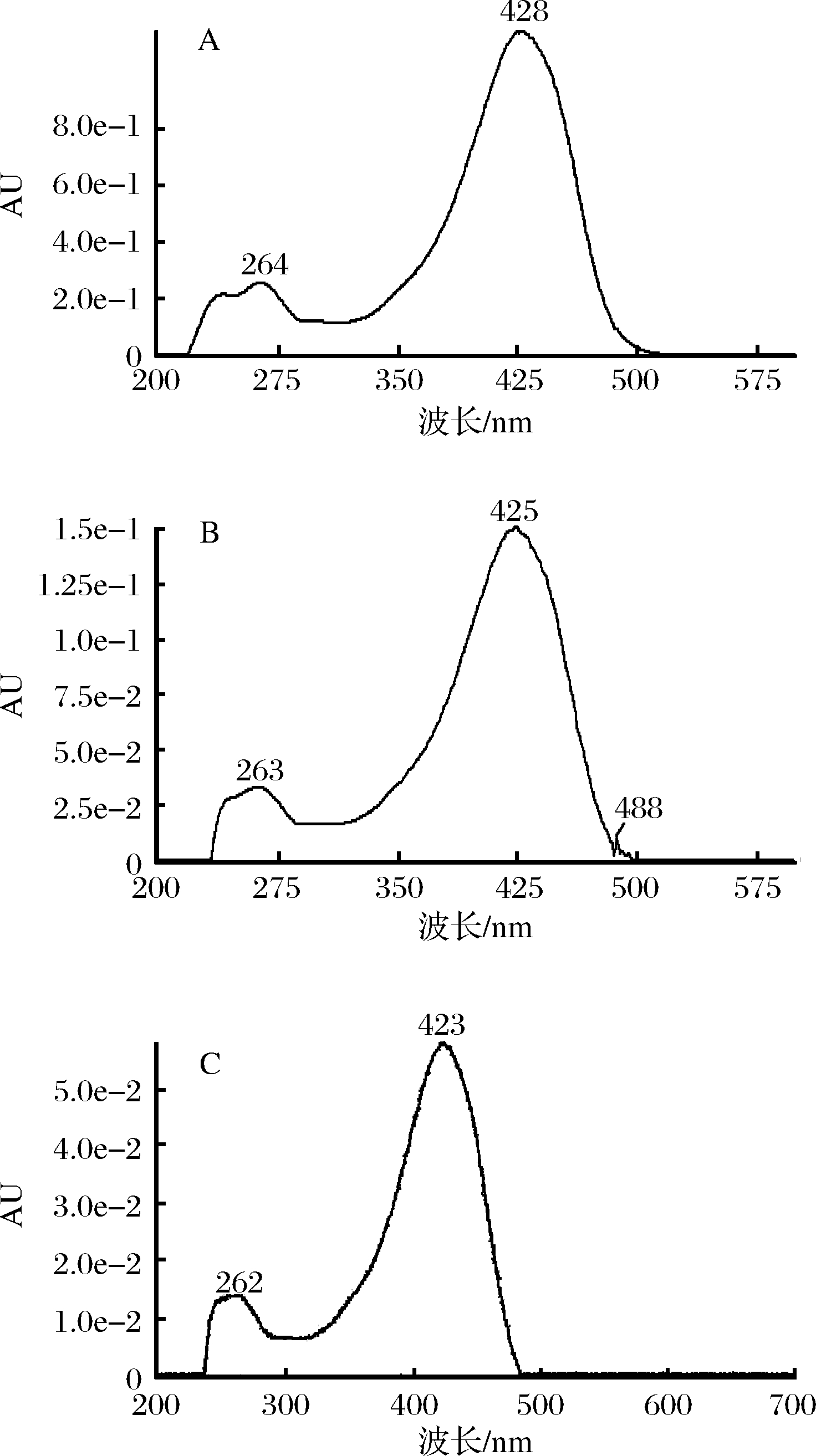
A-姜黄素UV-Max图谱;B-姜黄素葡萄糖苷UV-Max图谱;C-姜黄素双葡萄糖苷UV-Max图谱
图9 UV-Max图谱
Fig.9 UV-Max map
2.4 转化产物水溶性验证
上述样品经半制备液相分离出单个峰,旋干,加超纯水复溶,过0.45 μm微孔滤膜,按上述方法进行HPLC检测,检测结果如图10所示,在保留时间为9.631和7.333 min处检测出吸收峰,为姜黄素葡萄糖苷和姜黄素双葡萄糖苷,而姜黄素溶解于水中其色谱无响应,由此证明转化产物水溶性远高于姜黄素。
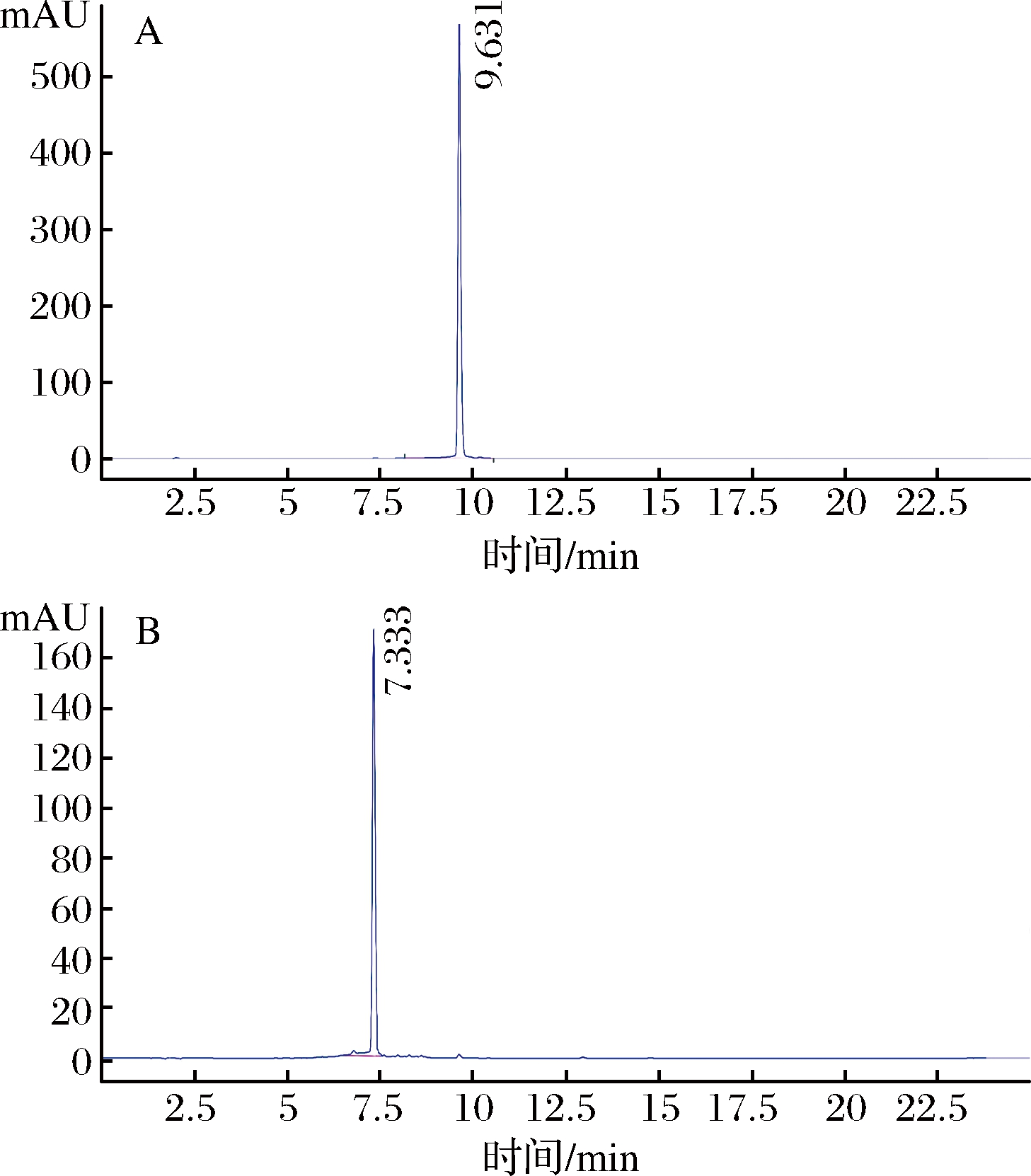
A-姜黄素葡萄糖苷HPLC图谱;B-姜黄素双葡萄糖苷HPLC图谱
图10 HPLC检测图谱
Fig.10 HPLC detection chromatograms
3 结论
本实验旨在提高姜黄素的水溶性。糖苷化已经成为增加天然产物水溶性的有效途径[24],HOLDER等报道,姜黄素在大鼠体内主要代谢物为四氢姜黄素和六氢姜黄素的葡萄糖苷酸[25],ZENG等利用真菌菌株Beauveria bassiana ATCC 7159的生物转化成功合成了1种新的姜黄素衍生物——姜黄素-8′-O-4″-O-甲基-β-D-吡喃葡萄糖苷,新化合物水溶性比姜黄素高39 000倍[26]。本实验通过颜色圈法筛选出具有转化作用的产β-葡萄糖苷酶的乳酸菌L. zeae strain OZK17,利用糖苷水解酶的逆反应将葡萄糖分子连接到姜黄素分子上形成姜黄素葡萄糖苷,通过HPLC初步确认了未知新物质,经LC-MS确定了转化产物为姜黄素葡萄糖苷和姜黄素双葡萄糖苷。ZHANG等利用华根霉合成的姜黄素葡萄糖苷转化率达到57%[8],本研究中姜黄素葡萄糖苷转化率为40%左右(以峰面积计算),而姜黄素双葡萄糖苷未见其报道,本研究中姜黄素双葡萄糖苷转化率为4%,整体转化率有待进一步提高。
本实验中还发现乳酸菌L. zeae strain OZK17在无氧环境下对姜黄素不转化、对于无乙醇和加吐温80溶解姜黄素的情况均不转化,推测其为好氧反应,乙醇为其反应的催化剂。
微生物发酵法制备水溶性姜黄素有着化学法所不具备的成本低、污染小和反应温和的优势,尤其是益生菌发酵,更是为姜黄素在今后食品、药品上更充分和有效的利用提供了一种新的参考。
[1] 李锐,刘芳,李芸香,等. 微生物转化法制备双脱甲氧基姜黄素糖苷化产物及其对HepG2肿瘤细胞的抑制作用[J]. 食品与发酵工业,2016,42(6): 20-25.
[2] 袁鹏,陈莹,肖发,等. 姜黄素的生物活性及在食品中的应用[J]. 食品工业科技,2012,33(14):371-375.
[3] 柯秀梅,杨荣平,梁旭明. 姜黄素增溶方法的研究进展[J]. 天然产物研究与开发,2013,25(8):1 154-1 159.
[4] HASSANINASAB A,HASHIMOTO Y,TOMITA-YOKKTANI K,et al. Discovery of the curcumin metabolic pathway involving a unique enzyme in an intestinal microorganism[J]. Proceedings of the National Academy of Sciences,2011,108(16):6 615-6 620.
[5] PIANPUMEPONG P,ANAL A K,DOUNGCHAWEE G,et al. Study on enhanced absorption of phenolic compounds of Lactobacillus-fermented turmeric (Curcuma longa Linn.) beverages in rats[J]. International Journal of Food Science & Technology,2012,47(11):2 380-2 387.
[6] WANG Sujuan,PENG Xixi,CUI Liangliang,et al. Synthesis of water-soluble curcumin derivatives and their inhibition on lysozyme amyloid fibrillation[J]. Spectrochimica Acta Part A: Molecular and Biomolecular Spectroscopy,2018,190:89-95.
[7] KIMS W,HA K C,CHOI E K,et al. The effectiveness of fermented turmeric powder in subjects with elevated alanine transaminase levels: a randomised controlled study[J]. BMC Complementary and Alternative Medicine,2013,13(1):58-58.
[8] SLAVOMIRA D,SOUTO E B,SILVA A M. Hansen solubility parameters (HSP) for pre-screening formulation of solid lipid nanoparticles (SLN): in vitro testing of curcumin-loaded SLN in MCF-7 and BT-474 cell lines[J]. Pharmaceutical Development and Technology,2018,23(1):96-105.
[9] PURPURA M,LOWERY R P,WILSON J M,et al. Analysis of different innovative formulations of curcumin for improved relative oral bioavailability in human subjects [J]. European Journal of Nutrition,2017,57(3): 1-10.
[10] ANAND P,KUNNUMAKKARAA A B,NEWMAN R A,et al. Bioavailability of curcumin:problems and promises [J]. Mol Pharm,2007,4(6): 807-818.
[11] PURPURA M,LOWERY R P,WILSON J M,et al. Analysis of different innovative formulations of curcumin for improved relative oral bioavailability in human subjects[J]. European Journal of Nutrition,2017,57(3):1-10.
[12] 刘彬,赵莹,于思礼,等. 微生物代谢工程发酵姜黄素研究进展[J]. 食品与发酵工业,2016,42(7): 254-260.
[13] 魏妍婷,马三梅. 姜黄素衍生物及复合物抗肿瘤的研究[J]. 生命科学,2017,29(4):386-392.
[14] 伍敏晖,王磊,何梅. 高压微射流均质对姜黄素纳米乳液稳定性的影响[J]. 中国食品学报,2018,18(5):56-62.
[15] 黄淑芳,应华洲,胡永洲. 含氮姜黄素衍生物的合成及抗肿瘤活性研究[J]. 中国药物化学杂志,2011,21(2):88-95.
[16] 陈建平,彭莞仪,秦小明,等. 姜黄素超分子包合物的结构鉴定及其抗氧化活性[J]. 食品工业科技,2017(21):28-32.
[17] SAFAVY A,RAISCH P,MANTENA S,et al. Design and development of water-soluble curcumin conjugates as potential anticancer agents[J]. Journal of Medicinal Chemistry,2007,50(24):6 284-6 288.
[18] KAMINAGA Y,NAGATSU A,AKIYAMA T,et al. Production of unnatural glucosides of curcumin with drastically enhanced water solubility by cell suspension cultures of Catharanthus roseus[J]. FEBS Letters,2003,555(2):311-316.
[19] 孟岚,吴旭日,陈依军. 糖苷合成酶及应用的研究进展[J]. 广西科学,2017,24(1):7-14.
[20] CHOUDHURY A K,RAJA S,MAHAPATRA S,et al. Synthesis and evaluation of the anti-oxidant capacity of curcumin glucuronides,the major curcumin metabolites [J]. Antioxidants,2015,4(4): 750-767.
[21] ZHANG Xing,LI Min,LI Rui,et al. Microbial transformation of curcumin by Rhizopus chinensis [J]. Biocatalysis,2015,28(5-6): 380-386.
[22] PRASAD E,HAMEEDA B,RAO A B,et al. Biotransformation of curcumin for improved biological activity and antiproliferative activity on acute HT-29 human cell lines [J]. Indian Journal of Biotechnology,2014,13(3): 324-329.
[23] 姚瑶,霍元鹏,周伟,等. 高产β-葡萄糖苷酶菌株的筛选及产酶条件优化[J]. 江西农业学报,2018,30(3):97-101.
[24] PATIDAR P,PILLAI S A,SHETH U,et al. Glucose triggered enhanced solubilisation,release and cytotoxicity of poorly water soluble anti-cancer drugs fromT1307 micelles[J]. Journal of Biotechnology,2017,254:43-50.
[25] HOLDER G M,PLUMMER J L,RYAN A J. The metabolism and excretion of curcumin (1,7-Bis-(4-hydroxy-3-methoxyphenyl)-1,6-heptadiene-3,5-dione) in the rat [J]. Xenobiotica,1978,8(12): 761-768.
[26] ZENG Jia,YANG Nan,LI Xiumin,et al. 4′-O-methylglycosylation of curcumin by Beauveria bassiana [J]. Natural Product Communications,2010,5(1): 77-80.