β-丙氨酸是自然界中存在的唯一一种β型氨基酸,广泛应用于医药、食品及化工等领域[1]。医药领域用于合成肌肽、巴柳氮、帕米磷酸钠等[1];在食品领域作为食品和饲料添加剂[1];在化工领域用作电镀缓蚀剂等[1]。β-丙氨酸的合成方法有化学合成法和生物合成法,化学合成法是目前生产β-丙氨酸的主要方法[1-2],但是存在工艺条件苛刻、耗能高及环境不友好等缺点[3];生物合成法是以L-天冬氨酸为底物,利用细胞内L-天冬氨酸α-脱羧酶(L-aspartate α-decarboxylase,EC4.1.1.11 panD),催化生成β-丙氨酸[4],生物合成法由于反应条件温和、操作简便受到广泛的关注。高丽娟等扩增了E.coli DH5a的panD基因,在E.coli BL21(DE3)中进行表达和诱导条件优化,经0.4 mmol/L IPTG和10 g/L的乳糖诱导后,最终发酵液中β-丙氨酸的质量浓度为2.5 g/L和4.7 g/L[5];SHEN等对谷氨酸棒杆菌来源的L-天冬氨酸α-脱羧酶进行研究,采用纯酶催化,36 h可产生12.85 g/L的β-丙氨酸[4];SONG等利用E.coli W3110异源扩增谷氨酸棒杆菌的panD基因,构建从葡萄糖开始到β-丙氨酸合成途径,发酵39 h β-丙氨酸产量达到32.3 g/L[6]。这些研究在生物合成法生产β-丙氨酸方面取得了一定进展,但是依然存在酶活低、产物浓度不高、转化时间长等缺点,距工业应用尚有一段距离。
目前研究较多的L-天冬氨酸α-脱羧酶主要来源于原核生物,例如大肠杆菌[7](Escherichia coli)、幽门螺杆菌[8](Helicobacter pylori)、结核分歧杆菌[9](Mycobacterium tuberculosis)、谷氨酸棒杆菌[10](Corynebacterium glutamicum)、枯草芽孢杆菌[11](Bacillus subtilis)等。1979年,JONAAE等对大肠杆菌来源的L-天冬氨酸α-脱羧酶进行研究,测得其最适反应温度为55 ℃,温度稳定性较好,在26~78 ℃维持50%以上酶活[7];2010 年,石增秀等克隆并表达了谷氨酸棒杆菌来源的panD基因,测得其最适反应温度为55 ℃,80 ℃下的半衰期为40 min[12];2015年,邓思颖等克隆表达了枯草芽孢杆菌来源的panD基因,测得其最适反应温度为60 ℃,65 ℃温育12 h,残余酶活为73%[11];2017年,陈夏林等克隆并表达了杰氏棒杆菌来源的panD基因,研究其酶学性质发现该酶在30~50 ℃下较稳定,在60 ℃温育12 h,残余酶活约为60%[13]。原核来源的L-天冬氨酸α-脱羧酶是一类丙酮酰基依赖型酶[14],需要在体内经过剪切形成有活性的酶[10,15],其稳定性较好但酶活普遍偏低[16],因此生物催化法生产β-丙氨酸的产量也处于较低水平。有研究表明,在昆虫体内也存在L-天冬氨酸α-脱羧酶[17-20],其催化产生的β-丙氨酸对昆虫幼虫色素沉淀等有重要影响[21],与原核来源的L-天冬氨酸α-脱羧酶相比,真核来源的L-天冬氨酸α-脱羧酶是磷酸吡哆醛(PLP)依赖型的酶[22]。2010年,GRAHAM克隆并表达了蚊子来源的panD基因,并对其底物特异性进行研究[23];2015年IRINA等将鞘翅目昆虫赤拟谷盗、原核生物大肠杆菌和谷氨酸棒杆菌3种来源的panD基因分别整合到酿酒酵母基因组中,进行代谢研究,发现真核生物来源的L-天冬氨酸α-脱羧酶对终产物产量的提高起到了重要作用[24]。因此,我们推测赤拟谷盗来源L-天冬氨酸α-脱羧酶酶活较高,具有一定的应用前景。
前期研究中,在大肠杆菌中重组表达了来源于真核生物赤拟谷盗的L-天冬氨酸α-脱羧酶(TcADC)[16],酶学性质表征结果显示,其比酶活为谷氨酸棒杆菌来源的L-天冬氨酸α-脱羧酶的2倍,但其热稳定性较差[16]。本研究针对其稳定性差的问题,通过定点突变进行分子改造,提高其热稳定性,同时建立全细胞催化生产β-丙氨酸工艺,为β-丙氨酸工业生产奠定基础。
1 材料与方法
1.1 材料
重组大肠杆菌BL21/pET28a-TcADC为实验室前期构建,重组菌株种子培养基为LB培养基,诱导培养基为2YT培养基。
L-天冬氨酸钠、β-丙氨酸、IPTG、卡那霉素:上海生工生物工程有限公司;引物由苏州金维智公司合成;酵母提取物、蛋白胨:Oxford公司;PITC:Sigma公司。
1.2 方法
1.2.1 突变体位点的选择及引物设计
以人类来源半胱氨酸亚磺酸脱羧酶(HuCSADC,PDB ID:2jis)为模板,利用SWISS MODLE在线软件对TcADC同源建模,并上传至GETAREA网站,进行表面氨基酸预测,选取TcADC分子表面所有Lys和Gly分别突变成Arg和Ala,以重组质粒pET28a-TcADC为模板,使用Primer 5.0 软件设计引物(表1)。
1.2.2 突变体构建、表达与纯化
以重组质粒pET28a-TcADC为模板,利用全质粒PCR方法引入定点突变,构建突变体,DpnⅠ消化PCR模板后,将构建的质粒转化进E.coli JM109,抗性平板筛选阳性克隆,将DNA测序正确质粒转化E.coli BL21(DE3),以备表达。
表1 本文所用引物及序列
Table 1 Primers used in this study

引物名称引物序列(5′-3′)长度/bpK49R upCTCTCCGGTTTCTAGGCCAGTTAGCTTCGAATC33K49R downGATTCGAAGCTAACTGGCCTAGAAACCGGAGAG33K85R upGAAGGCACCAACCGTAGGAACCGTGTTCTGCAG33K85R downCTGCAGAACACGGTTCCTACGGTTGGTGCCTTC33K190R upGGTTTCGAAGGTGGTAGGGGTGACGGTATCTTC33K190R downGAAGATACCGTCACCCCTACCACCTTCGAAACC33K220R upCATGCCGGACATCAAAAGAAAAGGTCTGCACTC33K220R downGAGTGCAGACCTTTTCTTTTGATGTCCGGCATG33K221R upCCGGACATCAAAAAAAGAGGTCTGCACTCTCTG33K221R downCAGAGAGTGCAGACCTCTTTTTTTGATGTCCGG33K305R upCGACCCGATCGAGAGGATCGCTGACGTTTGCC32K305R downGGCAAACGTCAGCGATCCTCTCGATCGGGTCG32K312R upGCTGACGTTTGCCAGAGATACAAACTGTGGCTG33K312R downCAGCCACAGTTTGTATCTCTGGCAAACGTCAGC33K314R upCTGACGTTTGCCAGAAATACAGACTGTGGCTGC33K314R downCTGACGTTTGCCAGAAATACAGACTGTGGCTGC33K338R upCCGTCACCTGCTGAGGGGTATCGAACGTGCTG32K338R downAGCACGTTCGATACCCCTCAGCAGGTGACGG32K385R upGCTTACCTGTTCCAGAGAGACAAATTCTACGAC33K385R downGTCGTAGAATTTGTCTCTCTGGAACAGGTAAGC33K392R upAGACAAATTCTACGACACCAGATACGACACCGG33K392R downTTGTCACCGGTGTCGTATCTGGTGTCGTAGAAT33K425R upCACCGACTGCATCAGGAACCGTGAAGGTTTCG33K425R downCTTTGTCAACGTGTTCCTCCAGACCAGAGGTAC33K442R upCACCGACTGCATCAGGAACCGTGAAGGTTTCG32K442R downCGAAACCTTCACGGTTCCTGATGCAGTCGGTG32K466R upCTTCTGGTACGTTCCGAGGTCTCTGCGTGGTCG33K466R downCGACCACGCAGAGACCTCGGAACGTACCAGAAG33K472R upCTCTGCGTGGTCGTAGAGACGAAGCTGACTAC32K472R downGTAGTCAGCTTCGTCTCTACGACCACGCAGAG32K480R upGCTGACTACAAAGACAGACTGCACAAAGTTGCTC34K480R downGAGCAACTTTGTGCAGTCTGTCTTTGTAGTCAGC34G188A upCGTTGGTTTCGAAGCTGGTAAAGGTGACGGTATC34G188A downGATACCGTCACCTTTACCAGCTTCGAAACCAACG34G189A upGTTGGTTTCGAAGGTGCTAAAGGTGACGGTATC33G189A downGATACCGTCACCTTTAGCACCTTCGAAACCAAC33G282A upGTTCTCTGCGTGAAGCGGCTGCTCCGTTCATGG33G282A downCCATGAACGGAGCAGCCGCTTCACGCAGAGAAC33G369A upGCTGCGTCACGAAGCTGTTCTGGCTGAAGCTC32G369A downGAGCTTCAGCCAGAACAGCTTCGTGACGCAGC32G507A upCTACCAGGCTCAGAAAGCTCACCCGAACTTCTTC34G507A downGAAGAAGTTCGGGTGAGCTTTCTGAGCCTGGTAG34
注:下划线表示突变位点处替换的密码子。
将重组大肠杆菌BL21/pET28a-TcADC接种于5 mL卡那霉素质量浓度为50 μg/mL的LB培养基,37 ℃、200 r/min振荡培养8~12 h,将上述培养物按1%接种量接种于卡那霉素质量浓度为50 μg/mL的2YT培养基,37 ℃、200 r/min振荡培养至OD600 为0.6~0.8,加入终浓度0.2 mmol/L IPTG,20 ℃培养20 h,收集菌体进行超声破碎,通过SDS-PAGE方法鉴定蛋白表达水平。收集菌体溶于结合缓冲液(20 mmol/L Na2HPO4、20 mmol/L NaH2PO4、500 mmol/L NaCl、20 mmol/L咪唑),超声破碎,4 ℃ 12 000 r/min离心,上清用0.22 μm滤膜过滤,用5倍柱体积结合缓冲液平衡His Trap HF柱,取10 mL的破碎上清上样,用5倍柱体积结合缓冲液洗去非特异性结合的蛋白,用15倍柱体积洗脱缓冲液(20 mmol/L Na2HPO4、20 mmol/L NaH2PO4、500 mmol/L NaCl、500 mmol/L咪唑)线性洗脱蛋白。收集样品,用透析袋密封,置于50 mmol/L Tris-HCl缓冲液(pH 7.0)中,4 ℃过夜透析,除去残余的咪唑,SDS-PAGE分析鉴定。蛋白质定量采用Bradford法[25]。
1.2.3 L-天冬氨酸和β-丙氨酸测定
反应液采用异硫氰酸苯酯(PITC)衍生,具体步骤:取500 μL反应溶液于2 mL离心管,加入250 μL 1 mol/L三乙胺乙腈溶液和250 μL 0.1 mol/L PITC乙腈溶液,充分混合均匀,避光室温衍生1 h后,加入750 μL己烷,涡旋振荡器振荡20 s,静置分层,吸取下层850 μL溶液,0.22 μm有机滤膜过滤。
衍生产物采用HPLC测定,色谱柱为La Chrom C18(5 μm,4.6 mm×250 mm);流动相A:体积分数80%的乙腈水溶液,B溶液:体积比97∶3(pH 6.5)的0.1 mol/L乙酸钠-乙腈溶液;梯度洗脱:0~20 min,B溶液由95%下降至65%;20~30 min,B溶液由65%上升至95%;30~43 min,B溶液梯度保持不变,检测波长254 nm,柱温40 ℃。
1.2.4 酶学性质测定
取适量酶液于1.5 mL离心管中,加入终浓度为100 mmol/L的L-天冬氨酸钠,PLP终浓度1 mmol/L,于37 ℃,pH 6.5条件下反应30 min,检测酶活。
酶活定义:在37 ℃,pH 6.5的条件下,每小时转化L-天冬氨酸钠生成1 mmol β-丙氨酸所需酶量为1个酶活力单位U。
比酶活定义:每克蛋白所含的酶活单位数。
最适反应温度测定:取适量纯酶液于1.5 mL离心管中,加入终浓度100 mmol/L L-天冬氨酸钠,PLP终浓度1 mmol/L,分别于30、37、40、42、50、55 ℃ pH 6.5条件下反应30 min测定酶活,将最高的酶活定义为100%。
最适反应pH测定:取适量纯酶液于1.5 mL离心管中,分别加入相同体积的pH 4.0、5.0、6.0、6.5、7.0、8.0、9.0的缓冲溶液,然后分别于37 ℃反应30 min测定酶活性,将最高的酶活定义为100%,分析酶活随pH的变化情况。
热稳定性测定:取适量纯酶液置于0、20、30、40、50、60 ℃金属浴中处理30 min后,于冰上冷却5 min,在37 ℃,pH 6.5条件下反应30 min测定酶活性,将所测得最高酶活定义为100%,分析酶的热稳定性。
pH稳定性测定:取适量纯酶液,加入相同体积的pH 4.0、5.0、6.0、6.5、7.0、8.0、9.0 的缓冲溶液调整酶液pH,于冰上放置8 h,然后在37 ℃ pH 6.5条件下反应30 min测定酶活性,将所测最高的酶活定义为100%,分析酶的pH稳定性。
1.2.5 全细胞催化生成β-丙氨酸
将0.4 mol/L的固体底物L-天冬氨酸钠分批添加到10 mL,OD600为200的菌液中并不断搅拌,反应温度维持在37 ℃左右,每隔4 h加入0.4 mol/L固体底物,检测产物的生成量和底物积累量。
2 结果与分析
2.1 突变体筛选
早在1980年,ARGOS等对嗜热蛋白的氨基酸组成进行了分析,发现嗜热蛋白氨基酸序列中有Gly替换为Ala以及Lys替换为Arg的趋势[26];ZHANG等在T4溶菌酶中插入了单个或多个Ala突变,有效提高了该酶的热稳定性[27];MRABET等利用将Lys突变成Arg的策略提高了木聚糖异构酶的热稳定性[28];叶双双等采用Lys突变成Arg,Gly突变成Ala的策略提高苯丙氨酸羟化酶的热稳定性[29]。然而,Gly-Ala及Lys-Arg的突变策略尚未应用到天冬氨酸α-脱羧酶的热稳定性改造中,本研究根据嗜热蛋白对Ala和Arg的偏好性,对TcADC分子中Gly和Lys进行突变。
同源建模与分子表面氨基酸预测结果显示,TcADC表面有16个Lys和5个Gly。将Lys和Gly分别突变为Arg和Ala,共构建突变体21个。重组大肠杆菌野生型及突变型菌株经IPTG诱导后,用粗酶液对突变体的酶活和热稳定性进行初步筛选,检测结果如图1所示。
酶活变化检测结果显示,在K→R系列突变体中,大部分突变体均保留80%以上的酶活,其中K190R,K220R,K221R,K305R,K480R酶活较野生型有不同程度提升(图1-A),在G→A系列突变体中,G282A酶活仅剩40%,G369A酶活有所提高,其余突变体与野生型酶活相差不大(图1-B)。

A-K→R系列突变体相对酶活;B-G→A系列突变体相对酶活
图1 突变体相对酶活
Fig.1 Relative activity of mutants
突变体热稳定性初步筛选结果如图2所示,在50 ℃处理30 min后,突变体K221R,G369A 残余酶活在40%以上,较野生酶有较大提高,其余突变体较野生型残余酶活变化不大或有所下降。由于G282A酶活力明显下降,所以未对它进行热稳定性检测。
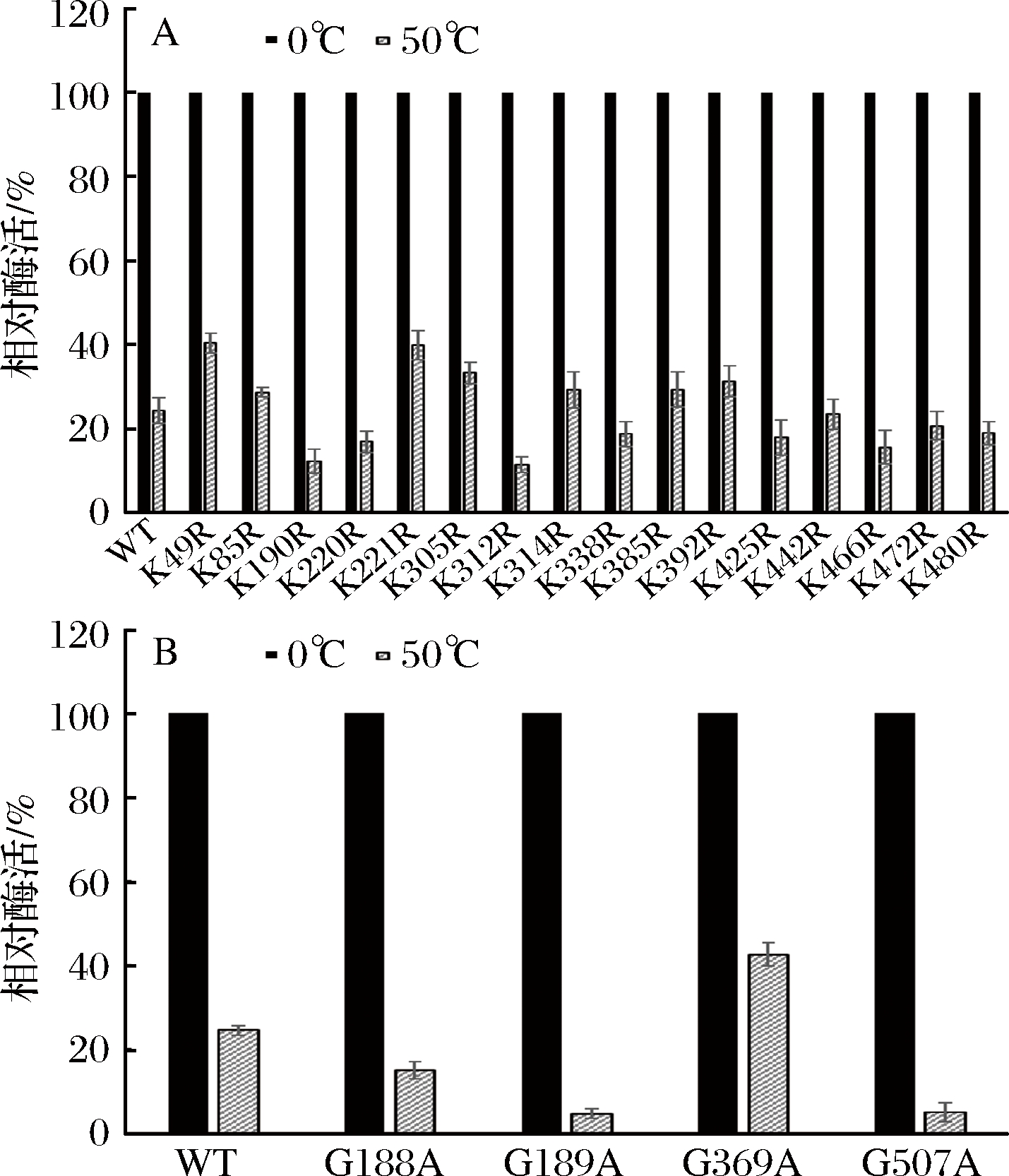
A-Lys突变为Arg稳定性检测;B-Gly突变为Ala稳定性检测
图2 突变酶热稳定性
Fig.2 Thermal stability of mutants
2.2 突变酶的表达与纯化
酶活与稳定性的初筛结果显示突变体K221R、G369A可能具有较好催化性能。将2个突变体进行分离纯化,并进行酶学性质表征。
将野生型及突变型重组菌株经IPTG诱导表达、超声破碎,细胞破碎上清液经亲和柱纯化后,得到电泳纯的重组蛋白,结果如图3所示,突变酶的单体分子量与野生酶保持一致,均在64 kDa左右。

M-标准蛋白; 1-野生型;2-K221R; 3-G369A
图3 野生酶及突变酶纯化结果
Fig.3 Wild and mutant enzyme purified enzymes
对纯化后的突变体进行酶活测定,结果表明K221R,G369A比酶活分别为(349.0±8.5)U/g,(288.0±9.0) U/g,与野生酶(290.0±9.5)U/g相比,突变体K221R酶活提高约20%,因此选择K221R作为下一步研究对象。
2.3 突变酶K221R的酶学性质
突变体K221R酶学性质研究结果如图4所示,该突变体最适温度为40 ℃;最适pH为6.5;pH 6.0~7.0酶活维持在90%以上,在pH 5.5~8.0,残余酶活在70%以上;在40 ℃处理30 min,残余酶活为86%,在50 ℃处理30 min,残余酶活为43%。
据高宇研究[16],野生型酶最适反应温度为37℃;最适pH为6.5;在pH 5.5~7.5稳定性较好,残余酶活为75%以上;温度稳定性较差,在40℃处理30 min,残余酶活不足50%,在50 ℃处理30 min,酶活几乎为0。
酶的最适反应pH及pH稳定性受表面氨基酸所形成的静电作用网络的影响[30],改变表面氨基酸的带电性质可能对酶的pH稳定性产生影响[31]。由于K221R突变没有改变酶分子表面电荷分布,因此突变体K221R的最适pH与pH稳定性与野生型相差无几,但是温度稳定性较野生酶有较大的提高。
2.4 全细胞催化生成β-丙氨酸
有报道显示,全细胞催化过程中,底物多次添加工艺优于一次性添加工艺[32],因此我们选择底物分批补料工艺进行基因工程菌株全细胞催化天冬氨酸生成β-丙氨酸的研究。利用K221R突变体菌株,进行全细胞催化反应。全细胞催化反应条件为pH 6.5、37 ℃,因为K221R突变体此条件下酶活及稳定性较好,适合长时间转化。在补料次数摸索实验中,野生型菌株全细胞催化反应补料3次(每次0.4 mol/L天冬氨酸)可以完全转化生成β-丙氨酸,补料4次、5次均不能完全转化,有底物残留(数据未显示)。K221R突变株酶活和稳定性较野生型提高,因此选择补料4次、5次进行全细胞催化效率研究。向体积为10 mL,细胞OD600为200的反应体系中每隔4 h加入0.4 mol/L固体底物,添加4次底物,突变体K221R菌株转化23 h生成β-丙氨酸达到1 512.24 mmol/L,约134.72 g/L,摩尔转化率达到94.52%(图5-A)。加入5次底物后,转化48 h生成1 729.71 mmol/L β-丙氨酸,约154.05 g/L,摩尔转化率86.49%(图5-B)。补料次数增加,虽然β-丙氨酸产量有所提高,但是转化率有所下降,有底物残留,不利于后期产品的提纯,确定最佳补料次数为4次。

A-最适反应温度;B-热稳定性;C-最适反应pH;D-pH稳定性
图4 K221R酶学性质
Fig.4 Characterization of K221R
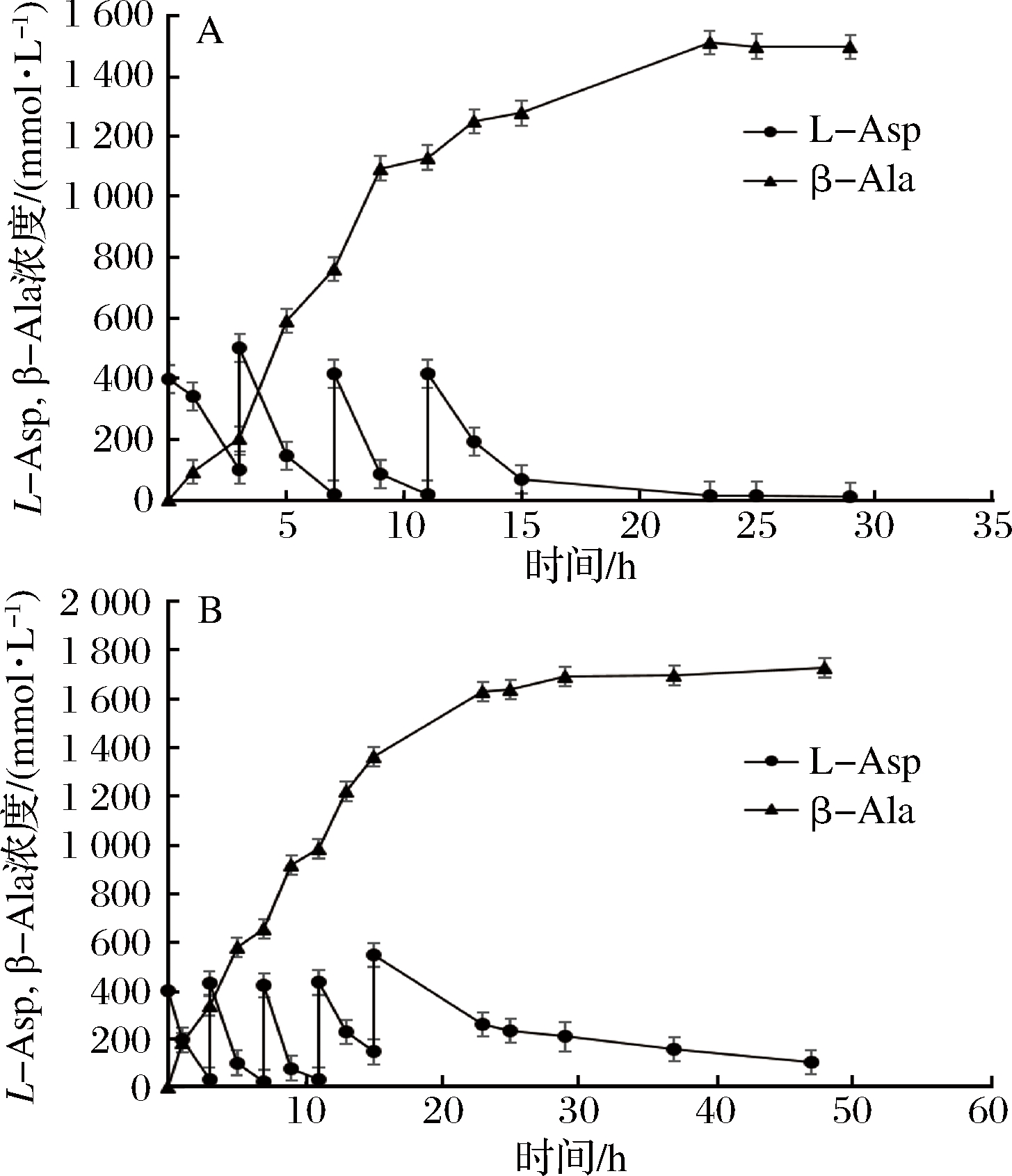
A-添加4次固体底物;B-添加5次固体底物
图5 K221R菌株底物分批补料催化工艺
Fig.5 Fed-batch catalysis using recombinant cells expressing the K221R variant
3 结论
本文通过对鞘翅目昆虫赤拟谷盗来源的L-天冬氨酸α-脱羧酶进行分子改造,在21个突变体中得到突变体K221R,其比酶活比野生型提高20.3%,在50 ℃处理30 min的残余酶活仍能保持43%,而相同处理条件下,野生型酶活接近于0,得到了酶活及稳定性均提高的突变体。确定全细胞催化生产β-丙氨酸的最佳工艺为:底物分批补料,反应温度37 ℃,pH 6.5,底物添加次数4次。利用K221R菌株转化23 h后可生成134.72 g/L β-丙氨酸,产量达到了工业生产基本要求,摩尔转化率达到94.52%。相较于之前研究产物浓度有显著提高,对生物法替代化学法生产β-丙氨酸具有一定促进作用。
[1] 罗积杏,薛建萍,沈寅初.β-氨基丙酸的合成与应用[J].氨基酸和生物资源,2005,27(1):52-55.
[2] 任怡,王彦青,舒宏,等.β-氨基丙酸的合成工艺研究[J].辽宁化工,2006,35(4):187-188.
[3] 楼坚.生物转化法生产β-丙氨酸的研究[D].杭州:浙江工业大学,2006.
[4] SHEN Yan, ZHAO Lianzhen, LI Youran,el al. Synthesis of β-alanine from L-aspartate using L-aspartate-α-decarboxylase from Corynebacterium glutamicum[J].Biotechnology Letters,2014,36(8):1 681-1 686.
[5] 高丽娟,裘娟萍.L-天冬氨酸脱羧酶研究进展[J].工业微生物,2007, 37(5):54-59.
[6] SONG C W, LEE J, KO Y S, et al.Metabolic engineering of Escherichia coli for the production of 3-aminopropionic acid[J].Metabolic Engineering,2015,30(3):121-129.
[7] WILLIAMSON J M,BROWN G M.Purification and properties of L-aspartate α-decarboxylase,an enzyme that catalyzes the formation of β-alanine in Escherichia coli[J].Journal of Biological Chemistry,1979,254(16):8 074-8 082.
[8] LEE B I,SUH S W. Crystal structure of the schiff base intermediate prior to decarboxylation in the catalytic cycle of aspartate α-decarboxylase[J].Journal of Molecular Biology,2004,340(1):1-7.
[9] GOPALAN G, CHOPRA S, RANGANATHAN A, et al. Crystal structure of uncleaved L-aspartate-α-decarboxylase from Mycobacterium tuberculosis[J].Proteins-structure Function & Bioinformatics,2010,65(4):796-802.
[10] CUI W, SHI Z, FANG Y, et al. Significance of Arg3,Arg54,and Tyr58 of L-aspartate α-decarboxylase from Corynebacterium glutamicum,in the process of self-cleavage[J].Biotechnology Letters,2014,36(1):121-126.
[11] 邓思颖,张君丽,蔡真,等.枯草芽胞杆菌L-天冬氨酸α-脱羧酶的酶学性质[J].生物工程学报,2015,31(8):1 184-1 193.
[12] 石增秀,崔文璟,周丽,等.谷氨酸棒杆菌L-天冬氨酸α-脱羧酶基因的克隆及重组酶性质研究[J].生物技术通报,2013(4):110-115.
[13] 陈夏林,李由然,顾正华,等.两种L-天冬氨酸α-脱羧酶的表达与酶学性质分析[J].微生物学通报,2017(10):2 337-2 344.
[14] KWON A R, LEE B I, HAN B W, et al.Crystallization and preliminary X-ray crystallographic analysis of aspartate L-decarboxylase from Helicobacter pylori[J].Acta Crystallographica,2002,58(5):861-863.
[15] SCHMITZBERGER F, KILKENNY M L, LOBLEY C M C, et al. Structural constraints on protein self-processing in L-aspartate-α-decarboxylase[J].Embo Journal,2014,22(23):6 193-6 204.
[16] 高宇.一釜双酶法转化富马酸制备β-丙氨酸催化体系的构建及工艺优化[D].无锡:江南大学,2017.
[17] LIU P,TORRENS-SPENCE M P, DING H, et al.Mechanism of cysteine-dependent inactivation of aspartate/glutamate/cysteine sulfinic acid α-decarboxylases[J].Amino Acids,2013,44(2):391-404.
[18] ARAKANE Y, LOMAKIN J, BEEMAN R W, et al.Molecular and functional analyses of amino acid decarboxylases involved in cuticle tanning in Tribolium castaneum[J].Journal of Biological Chemistry,2009,284(24):16 584.
[19] MOUSSIAN B.Recent advances in understanding mechanisms of insect cuticle differentiation[J].Insect Biochemistry & Molecular Biology,2010,40(5):363-375.
[20] KRAMER K J,MORGAN T D,HOPKINS T L,et al.Catecholamines and β-alanine in the red flour beetle,Tribolium castaneum:roles in cuticle sclerotization and melanization[J].Insect Biochemistry,1984,14(3):293.
[21] DAI F,LIANG Q,CAO C,et al.Aspartate decarboxylase is required for a normal pupa pigmentation pattern in the silkworm,bombyx mori[J].Scientific Reports,2015,5:10 885.
[22] LIU P,DING H,CHRISTENSEN B M,et al.Cysteine sulfinic acid decarboxylase activity of Aedes aegypti aspartate L-decarboxylase: the structural basis of its substrate selectivity[J].Insect Biochemistry & Molecular Biology,2012,42(6):396-403.
[23] RICHARDSON G,DING H,ROCHELEAU T, et al. An examination of aspartate decarboxylase and glutamate decarboxylase activity in mosquitoes[J].Molecular Biology Reports,2010,37(7):3 199-3 205.
[24] BORODINA I, KILDEGAARD K R, JENSEN N B, et al. Establishing a synthetic pathway for high-level production of 3-hydroxypropionic acid in Saccharomyces cerevisiae via β-alanine[J].Metabolic Engineering,2015,27:57-64.
[25] BRADFORD M M. A rapid method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding[J].Analytical Biochemistry,1976,72(S1-2):248-254.
[26] ARGOS P, ROSSMANN M G, GRAU U M, et al.Thermal stability and protein structure[J].Evolution of Protein Structure & Function,1980,18(25):159-169.
[27] ZHANG X J, BAASE W A, MATTHEWS B W. Multiple alanine replacements within alpha-helix 126-134 of T4 lysozyme have independent,additive effects on both structure and stability[J].Protein Science,2010,1(6):761-776.
[28] MRABET N T, BROECK A V D, BRANDE I V D, et al. Arginine residues as stabilizing elements in proteins[J].Biochemistry,1992,31(8):2 239.
[29] 叶双双,周丽,周哲敏.定点突变提高苯丙氨酸羟化酶的热稳定性[J].生物工程学报,2016,32(9):1 243-1 254.
[30] JAKOB F, MARTINEZ R, MANDAWE J, et al. Surface charge engineering of a Bacillus gibsonii subtilisin protease[J].Applied Microbiology & Biotechnology,2013,97(15):6 793-6 802.
[31] 黄楠,朱龙宝,周丽,等.鱼腥藻苯丙氨酸脱氨酶的基因克隆、表达及最适反应pH改造[J].微生物学通报,2015,42(7):1 208-1 215.
[32] 王哲.重组大肠杆菌产腈水合酶发酵优化及烟酰胺生产工艺的建立[D].无锡:江南大学,2017.