多糖是由多个相同或不同的单糖之间脱水形成糖苷键,并以糖苷键线性或分支连接而成的一类结构复杂的大分子聚合物[1],作为细胞膜和细胞壁结构组成成分而广泛存在于植物、动物、微生物(包括细菌、真菌)及藻类等生命体中。与真菌或植物中提取的细胞壁多糖相比,细菌分泌到周围环境中的胞外多糖(exopoly saccharides, EPS)主要是由规则的重复单元构成的均质多糖[2],分子质量一般较大,其重复单位通常在1 000个以上。由于微生物多糖具有独特的理化性质和生物性质,越来越多的微生物多糖在各行业都得到了广泛的应用。例如,由假黄单胞菌属产生的黄原胶可作为乳化剂、悬浮剂、稳定剂和凝胶增稠剂等运用于工业生产的各个领域[3];由芽短梗霉发酵产生的普鲁兰多糖,是一种胞外水溶性黏质多糖,可作为食品品质的被膜剂、改良剂和增稠剂等[4],又因其在自然界可被微生物降解利用,不会引起环境污染,还被誉为无公害塑料[5]。2006年我国批准了由微生物产生的可得然胶作为食品添加剂,它可以改善食品的黏弹性、稳定性和持水性等[6-7]。此外,微生物多糖还可作为生物吸附剂和乳化剂[8-9],具有生态环境修复的潜力。
研究表明,根瘤菌胞外多糖不仅能够增强机体免疫力[10-11],还具有抗氧化和抗肿瘤[10,12-14]等活性。2017年URAI等[15]研究了根瘤菌M2产生的胞外多糖,发现其具有先天免疫刺激活性。虽然上述文献从不同角度对根瘤菌胞外多糖的功能与活性关系进行了研究,但大多数研究中使用的胞外多糖均是混合多糖,而没有对单组分多糖结构与其生物活性的关系进行研究。此外,不同微生物细胞,即使是来源同一种的不同株之间,其个体之间代谢产物的结构也可能具有巨大差异,尤其是一些次级代谢产物和大分子物质,例如维生素、色素、蛋白质和多糖等。因此,分离并分析根瘤菌胞外多糖组分,可为该种属微生物的胞外多糖组成和活性功能研究提供重要的理论参考。为此,本文对研究中所分离得到的1株根瘤菌的胞外多糖进行了单组分分离、纯化和糖组分分析等工作,为进一步深入地研究各组分的结构和功能关系奠定了良好的基础。
1 材料与方法
1.1 材料
1.1.1 菌种
本研究中所使用的根瘤菌(Rhizobium sp. TY-03)由本实验室筛选、鉴定并保藏。
1.1.2 试剂
无水乙醇、蒽酮、H2SO4、葡萄糖、三氯甲烷、正丁醇、考马斯亮蓝G 250、NaCl等,国药集团化学试剂有限公司;牛血清白蛋白和木瓜蛋白酶(≥2 000 units/mg),上海阿拉丁生化科技股份有限公司;Sephadex G-200葡聚糖凝胶和DEAE-52纤维素,北京瑞达恒辉科技发展有限公司。
1.1.3 培养基
PDA液体培养基:称取去皮马铃薯200 g切成小块,加水煮沸20~30 min,8层纱布过滤,滤液中加入20 g葡萄糖,定容至1 L,115 ℃灭菌20 min。
马铃薯浸出汁酶解液:称取去皮马铃薯300 g切成小块,加蒸馏水煮沸20~30 min,8层纱布过滤弃渣,向滤液加入0.2 g淀粉酶,65 ℃恒温水浴至水解液遇碘液无色为止,定容至1 L。
发酵培养基:葡萄糖35 g、酵母粉25 g、K2HPO4 0.8 g、MgSO4·7H2O 0.2 g、NaCl 0.10 g、硼酸0.002 g,溶于马铃薯浸出汁酶解液并使用蒸馏水定容至1 L,用KH2PO4调节pH 6.8,115 ℃灭菌20 min。
1.2 仪器与设备
玻璃层析柱(2.6 cm×60 cm和1.5 cm×75 cm),北京瑞达恒辉科技发展有限公司;紫外分光光度计;傅立叶变换红外光谱FTIR-650,天津港东科技发展股份有限公司;Waters 1525高效液相色谱仪,美国Waters公司;ICS-5000离子色谱仪,美国戴安公司。
1.3 方法
1.3.1 根瘤菌胞外多糖的发酵与提取
种子液制备:以PDA培养基为种子培养基,将活化的菌种按1%(体积分数)接入装液量为100 mL的250 mL摇瓶中,于30 ℃ 200 r/min摇床培养12 h。
将发酵培养基加入10 L发酵罐中,装液量为6 L,115 ℃灭菌20 min,冷却至30 ℃时,接入5%(体积分数)的种子液,通入无菌空气,搅拌速度为300~500 r/min,罐内压力为0.05 MPa,发酵温度为30 ℃,发酵40 h。发酵结束后,发酵液使用蒸馏水(1∶1)稀释后离心(8 000 r/min,20 min)去除菌体,上清液经过减压浓缩4倍后用3倍体积95%乙醇进行沉淀。将所得沉淀使用95%乙醇洗涤2次后,进行真空冷冻干燥得到粗多糖。
1.3.2 根瘤菌粗多糖的脱蛋白
将上述粗多糖配制成2 mg/mL的水溶液,使用木瓜蛋白酶与Sevage法进行脱蛋白[16],加酶反应完全后,加入Sevage试剂[V(氯仿)∶V(正丁醇)=4∶1)]∶多糖溶液=4∶1(体积比),进行脱蛋白处理。利用Bradford法[17]与蒽酮-硫酸法[18]分别测定多糖溶液中蛋白质含量和多糖含量。将处理后的多糖溶液通过减压浓缩、醇沉处理后进行真空冷冻干燥,得到根瘤菌粗多糖。
1.3.3 根瘤菌粗多糖的分离纯化
1.3.3.1 DEAE-52纤维素阴离子交换柱纯化
将DEAE-52纤维素进行预处理[19],湿法装柱。称取100.0 mg根瘤菌粗多糖,用去离子水配制成10 mg/mL多糖溶液。使用DEAE-52纤维素柱进行纯化,上样量为10 mL,分别用蒸馏水、0.1、0.3、0.5 mol/L NaCl溶液进行梯度洗脱,收集各个不同组分,采用蒽酮-硫酸法检测各管多糖含量,绘制多糖洗脱曲线。合并相同组分,50 ℃减压浓缩后,分别用去离子水透析48 h后进行真空冷冻干燥。
1.3.3.2 Sephadex G-200葡聚糖凝胶柱纯化
分别准确称取10 mg上述真空冷冻干燥样品并溶于2 mL蒸馏水中,使用Sephadex G-200柱(1.5 cm×75 cm)进一步分离纯化(上样量为2 mL,以蒸馏水洗脱,流速为0.2 mL/min)。以蒽酮-硫酸法进行逐一检测,绘制多糖洗脱曲线,收集多糖浓度较高的洗脱液,经真空冷冻干燥备用。
1.3.3.3 根瘤菌胞外多糖纯度鉴定
将经过DEAE-52纤维素阴离子交换柱和Sephadex G-200葡聚糖凝胶柱纯化后的多糖组分分别配制成质量浓度为0.5 mg/mL的溶液,在190~400 nm进行扫描,检测在260~280 nm有无吸收峰,鉴定多糖的纯度。
1.3.4 根瘤菌胞外多糖组分的结构初步分析
1.3.4.1 根瘤菌胞外多糖分子量测定
采用高效液相色谱仪进行胞外多糖的分子量测定。色谱条件:色谱柱为UltrahydrogelTM Linear(300 mm×7.8 mm id×2),配2414示差折光检测器和Empower 3工作站。流动相为0.1 mol/L NaNO3,流速0.9 mL/min,柱温45 ℃,进样量20 μL。将收集的不同多糖组分分别溶解于流动相中,用0.45 μm微孔滤膜过滤后依次进样分析,采用GPC软件计算其分子量。
1.3.4.2 根瘤菌胞外多糖的单糖组成分析
采用离子色谱仪进行多糖单糖组成分析。色谱条件:色谱柱为CarboPac PA20,检测器为脉冲安培检测器。流动相为250 mmol/L NaOH和1 mol/L CH3COONa进行梯度洗脱,流速0.5 mL/min,柱温25 ℃。称取5 mg多糖样品于5 mL的具塞刻度试管中,加入1 mL 2 mol/L三氟乙酸,121 ℃烘箱水解2 h,水解液除尽过量三氟乙酸后,用水定容至50 mL,用0.45 μm微孔滤膜过滤后供进样分析。
1.3.4.3 根瘤菌多糖的红外光谱分析
分别称取1.0 mg多糖样品与100.0 mg干燥KBr混合均匀后,充分研磨压片后置于傅立叶红外光谱仪中,在4 000~400 cm-1波段内进行扫描。
2 结果与分析
2.1 胞外多糖的发酵与提取
利用10 L发酵罐控制发酵条件对根瘤菌进行放大培养,发酵液经醇沉后,真空冷冻干燥得到粗多糖。根瘤菌胞外多糖的合成与细胞生长紧密相关,发酵至10 h时,细胞生长进入对数生长期,此时,胞外多糖开始大量积累;发酵至20 h时,菌体生长进入稳定期,而胞外多糖的合成也趋于稳定(图1)。通过控制发酵条件,根瘤菌胞外多糖产量最高可达到28.2 g/L。
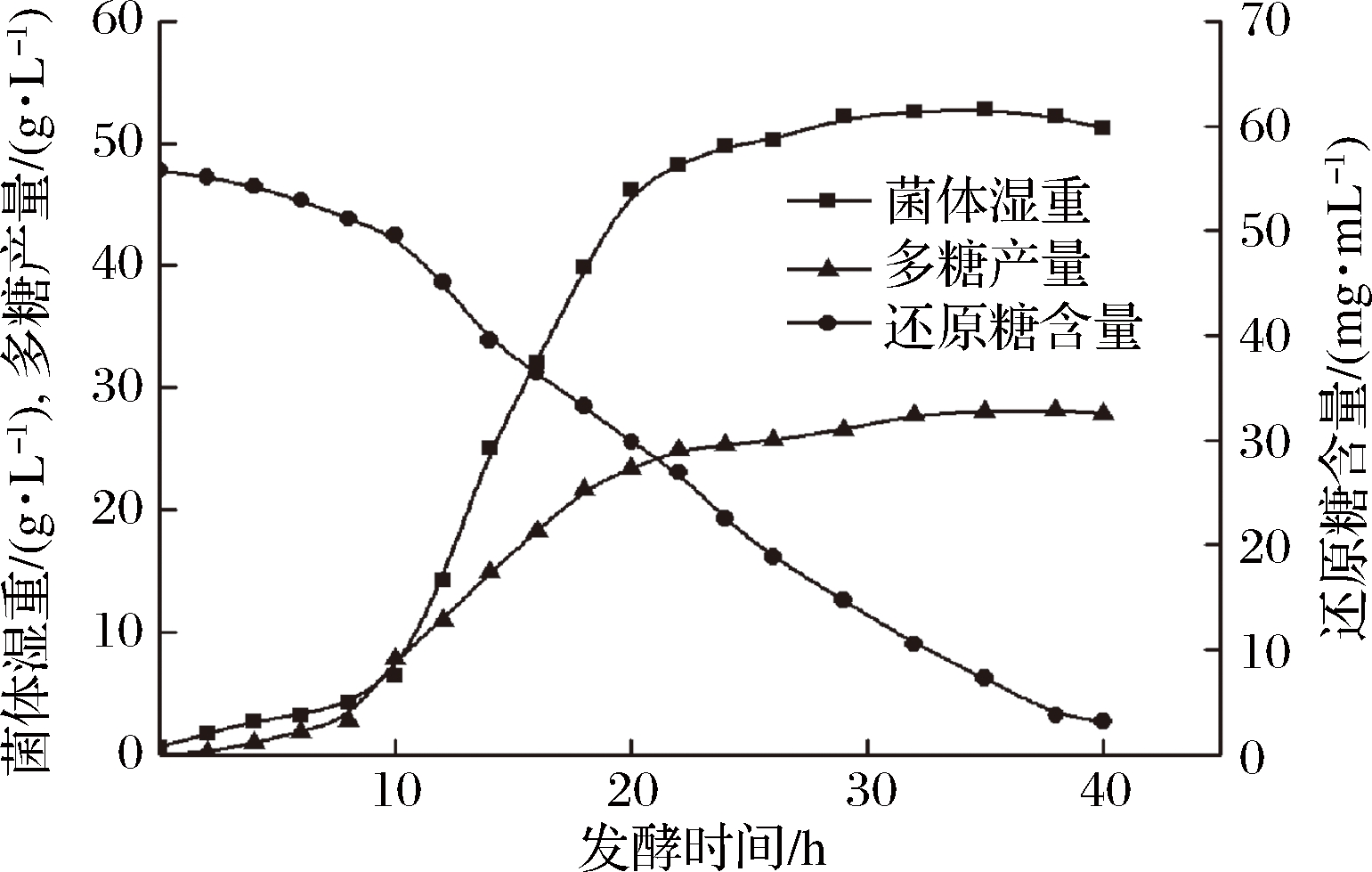
图1 根瘤菌产胞外多糖过程变化曲线
Fig.1 The process curve of extracellular polysaccharide production from Rhizobium
2.2 胞外多糖的脱蛋白处理
使用木瓜蛋白酶与Sevage试剂相结合的方法对根瘤菌胞外粗多糖进行脱蛋白处理,如图2所示。随着Sevage试剂脱蛋白次数的增加,蛋白去除率明显增强,经过6次脱蛋白处理后,蛋白去除率达到94.61%,可以进行下一步分离纯化。
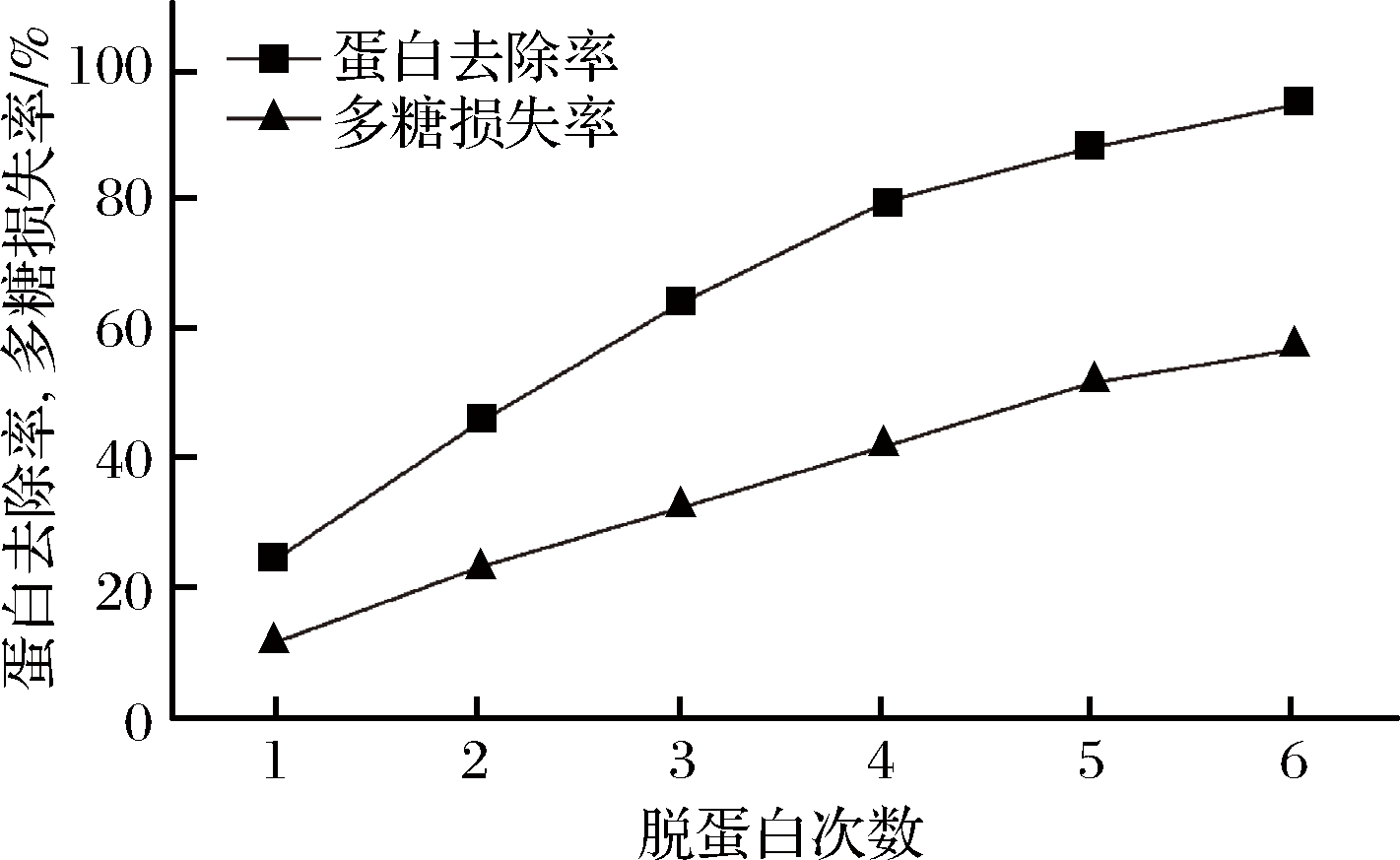
图2 酶与Sevage法结合对蛋白脱除率的影响
Fig.2 Effect of enzyme combined with Sevage method on protein removal rate
2.3 胞外多糖的分离纯化
2.3.1 DEAE-52纤维素柱纯化
通过DEAE-52纤维素阴离子交换柱对根瘤菌胞外粗多糖进行初步分离纯化。由于根瘤菌混合胞外多糖中存在不同极性的离子基团,所以随着不同浓度洗脱液洗脱下来的多糖,极性也有所差异。本研究中,利用阴离子交换柱进行纯化时,当使用蒸馏水进行洗脱时,得到的EPS 1和EPS 2两种组分应为中性多糖[20],而分别用0.1、0.3和0.5 mol/L NaCl溶液洗脱得到的EPS 3、EPS 4和EPS 5应为酸性多糖(图3)。收集各个组分洗脱液,减压浓缩,透析后冷冻干燥,得到的多糖组分供下一步分离纯化。
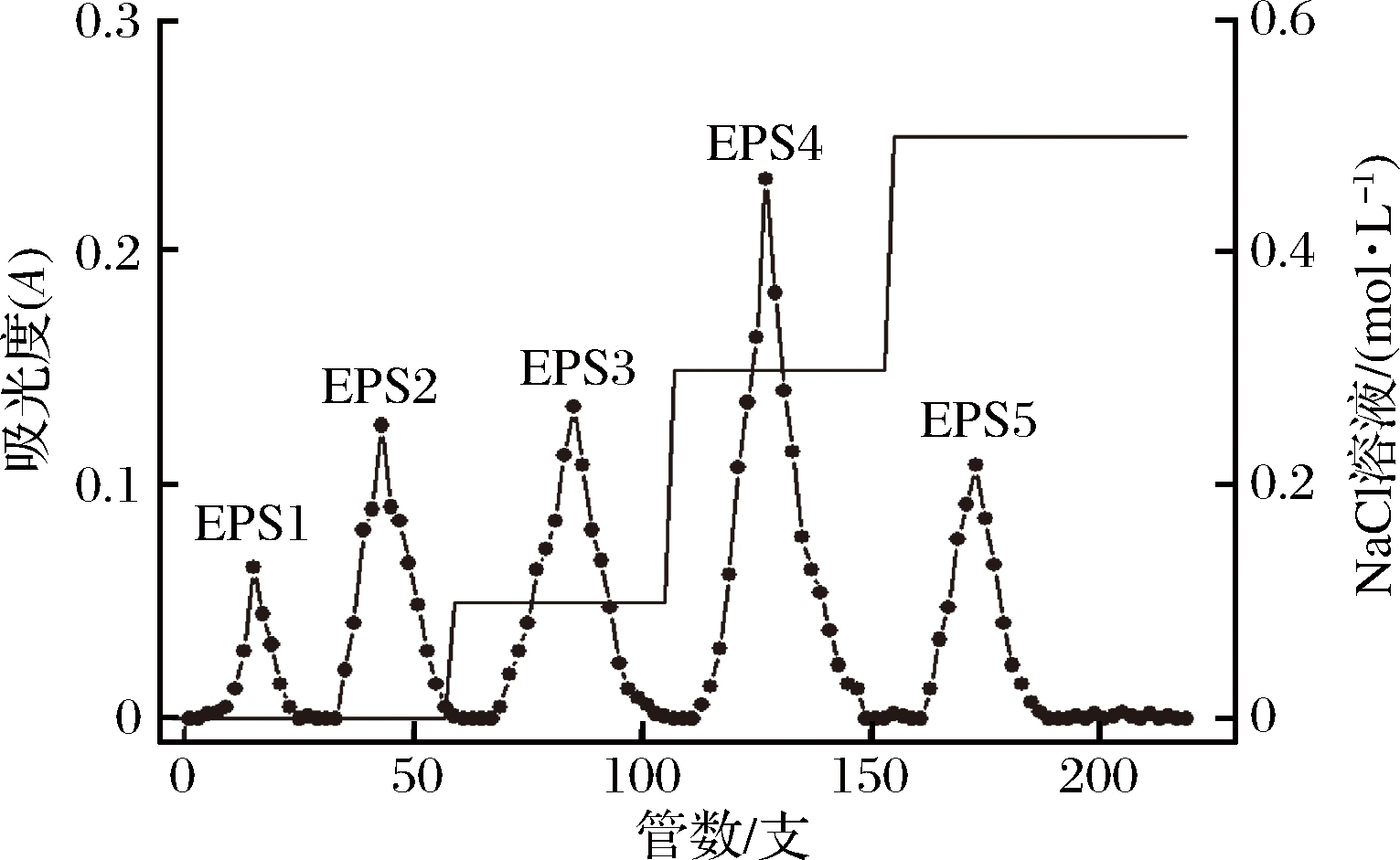
图3 DEAE-52纤维素阴离子交换柱多糖梯度洗脱曲线
Fig.3 The chromatography curve of polysaccharides by DEAE-52 cellulose column
2.3.2 Sephadex G-200葡聚糖凝胶柱纯化
经DEAE-52纤维素阴离子交换柱分离得到的5种多糖组分,分别进一步使用Sephadex G-200葡聚糖凝胶柱进行分离纯化。经蒸馏水洗脱后,5种多糖组分均为对称单一的峰,如图4所示,所得5种组分为较高纯度的多糖组分。收集每个对应峰洗脱液,经真空冷冻干燥后,得到5种白色絮状胞外单一多糖组分,分别命名为:EPS 1-1、EPS 2-1、EPS 3-1、EPS 4-1和EPS 5-1。
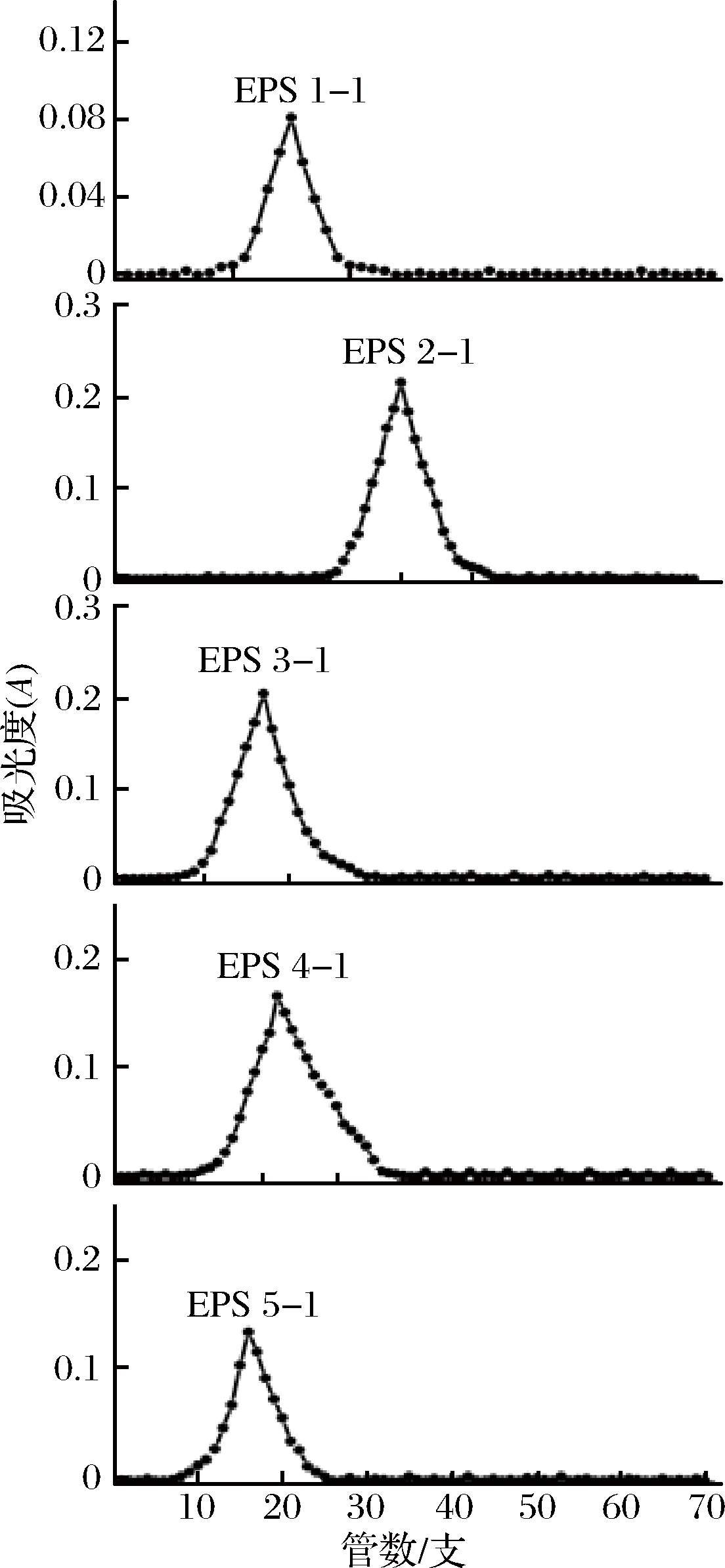
图4 Sephadex G-200葡聚糖凝胶柱多糖洗脱曲线
Fig.4 The elution curve of polysaccharides by Sephadex G-200 column
2.3.3 胞外多糖组分的纯度测定
经过分离纯化后的5种根瘤菌胞外多糖组分经紫外光谱扫描(图5),在260~280 nm没有明显吸收峰,说明经纯化后所得多糖相对较纯,无明显的核酸和游离蛋白质等杂质存在,可进一步分析。
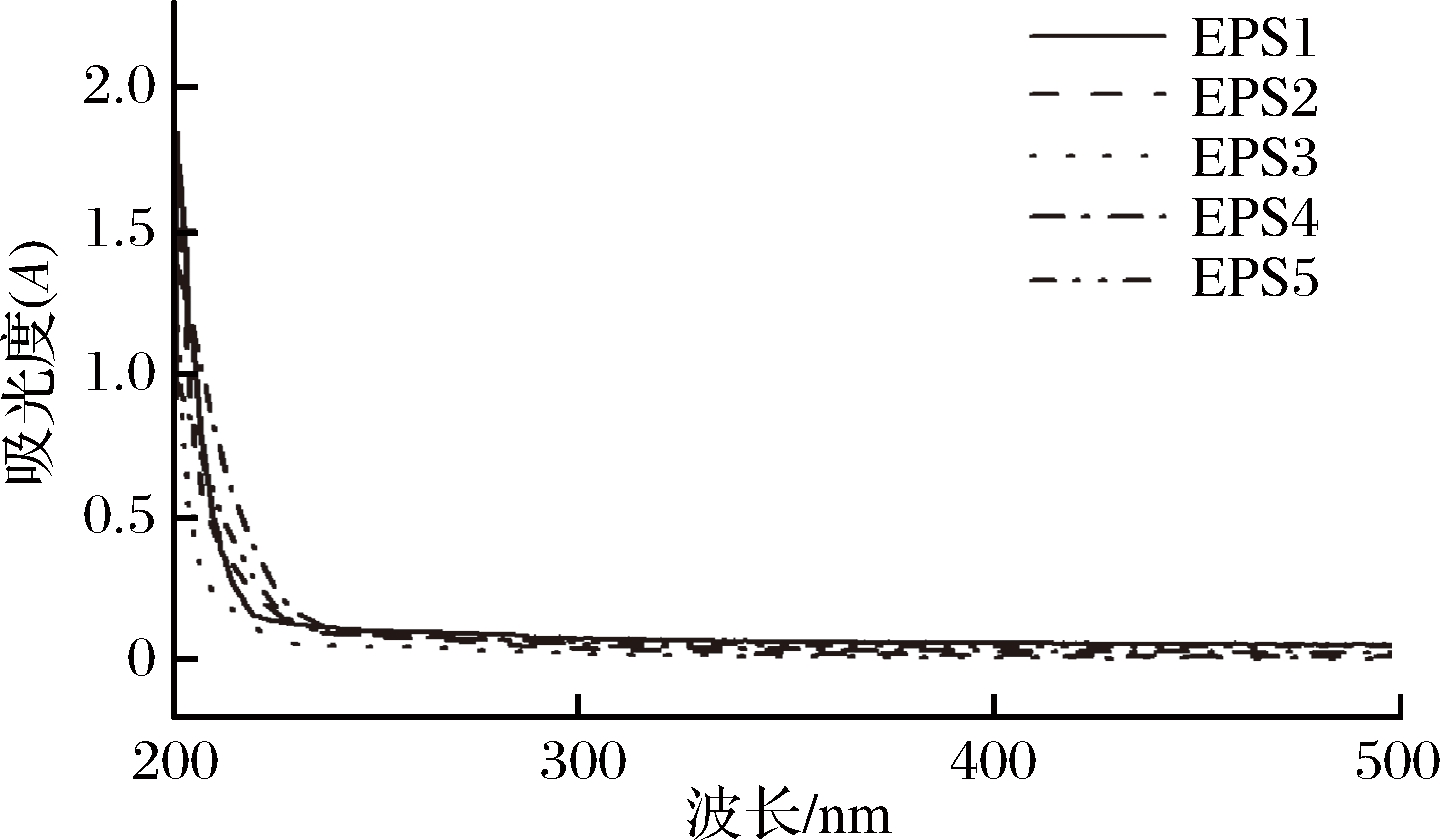
图5 根瘤菌胞外多糖的紫外光谱图
Fig.5 UV spectrum of extracellular polysaccharides ofRhizobium
2.4 胞外多糖组分结构的初步分析
2.4.1 分子质量测定
分离纯化后所得5种根瘤菌胞外多糖组分经高效凝胶过滤色谱分析,EPS 1-1的均重分子质量最大为1.905×107 Da;其次是EPS 2-1,为1.053×107 Da; EPS 3-1、EPS 4-1和EPS 5-1三种胞外多糖组分的均重分子质量较接近,分别为6.370×106、7.187×106和6.155×106 Da(图6)。

图6 根瘤菌胞外多糖的高效凝胶过滤色谱图
Fig.6 High-efficiency gel filtration chromatogram oflextr- acellular polysaccharides from Rhizobium
2.4.2 单糖组成分析
经离子色谱分析,混合单糖标准样品对应的出峰时间:(1)岩藻糖(Fuc)(t保留=2.217 min),(2)鼠李糖(Rha)(t保留=4.25 min),(3)阿拉伯糖(Ara)(t保留=4.467 min),(4)半乳糖(Gal)(t保留=5.6 min),(5)葡萄糖(Glu)(t保留=6.434 min),(6)木糖(Xyl)(t保留=7.55 min),(7)甘露糖(Man)(t保留=7.85 min),(8)果糖(Fru)(t保留=9.05 min),如图7所示。纯化得到的5种根瘤菌多糖组分水解后经离子色谱分析,与标准单糖样品色谱图进行比对,5种多糖组分中单糖组成含量及种类是有所差异的。如表1所示,EPS 1-1、EPS 2-1和EPS 5-1均主要由半乳糖、葡萄糖和甘露糖组成,其摩尔比分别为1∶4.67∶2.35、1∶4.69∶4.33和1∶7.72∶1.69。此外,3种组分中还含有少量的岩藻糖、鼠李糖和阿拉伯糖等。EPS 3-1是由4种单糖组成,其主要单糖摩尔比为半乳糖∶葡萄糖∶甘露糖=1∶3.42∶4.77;EPS 4-1由3种单糖组成,摩尔比为半乳糖∶葡萄糖∶甘露糖=1∶5.54∶1.9;根瘤菌胞外多糖的5个多糖组分主要都由半乳糖、葡萄糖和甘露糖组成,但其摩尔比各不相同。每种单糖含量有差异,从而影响了其连接方式和结构,结构与生物活性又紧密相关,因此,研究根瘤菌单一胞外多糖组成成分分析,可以为后期根瘤菌单一胞外多糖的活性研究提供理论依据。
2.4.3 根瘤菌胞外多糖的红外光谱分析
红外光谱是检测多糖结构特征最常用的检测方法。1 000~1 200、2 800~3 200和3 200~3 600 cm-1的吸收峰是多糖的曲型特征吸收峰。分离纯化后的5种根瘤菌多糖组分的红外光谱图,如图8所示。

a-单糖标准品的离子色谱图;b-EPS 1-1的离子色谱图;c-EPS 2-1的离子色谱图;
d-EPS 3-1的离子色谱图;e-EPS 4-1的离子色谱图;f-EPS 5-1的离子色谱图
图7 单糖标准品和根瘤菌胞外多糖离子色谱图
Fig.7 Ion chromatogram of monosaccharide standards and exopolysaccharide from Rhizobium
表1 根瘤菌单一胞外多糖的单糖组成及含量
Table 1 Monosaccharide composition and content of a single exopolysaccharide from Rhizobium

单糖浓度/(mg·L-1)EPS 1-1EPS 2-1EPS 3-1EPS 4-1EPS 5-1岩藻糖(Fuc)0.1400.32000.104鼠李糖(Rha)0.4880.650.49300.474阿拉伯糖(Ara)0.2390.148000.094半乳糖(Gal)4.7824.885.9175.7312.392葡萄糖(Glu)22.33322.81220.23531.74518.455木糖(Xyl)00000甘露糖(Man)11.23321.04828.62510.8844.047果糖(Fru)00000Gal∶Glu∶Man∗1∶4.67∶2.351∶4.69∶4.331∶3.42∶4.771∶5.54∶1.91∶7.72∶1.69
注:*指单糖组成摩尔比
在3 220~3 350 cm-1出现的宽而强的吸收峰为—OH基的伸缩振动峰;在2 920 cm-1附近出现的较弱的吸收峰为C—H伸缩振动峰;在1 628 cm-1处为C—O—C伸缩振动峰;在1 408 cm-1左右为C![]() O的伸缩振动峰;在896 cm-1左右为β-型糖苷键特征峰;在1 080 cm-1处为吡喃糖环的特征吸收峰。EPS 1-1和EPS 3-1在808 cm-1左右有吸收峰,可能是因为有半乳吡喃糖存在[21],这与离子色谱分析EPS 1-1和EPS 3-1中具有半乳糖相一致。经分析红外图谱可知,根瘤菌胞外多糖的5种单一组分均具有β-吡喃糖。
O的伸缩振动峰;在896 cm-1左右为β-型糖苷键特征峰;在1 080 cm-1处为吡喃糖环的特征吸收峰。EPS 1-1和EPS 3-1在808 cm-1左右有吸收峰,可能是因为有半乳吡喃糖存在[21],这与离子色谱分析EPS 1-1和EPS 3-1中具有半乳糖相一致。经分析红外图谱可知,根瘤菌胞外多糖的5种单一组分均具有β-吡喃糖。
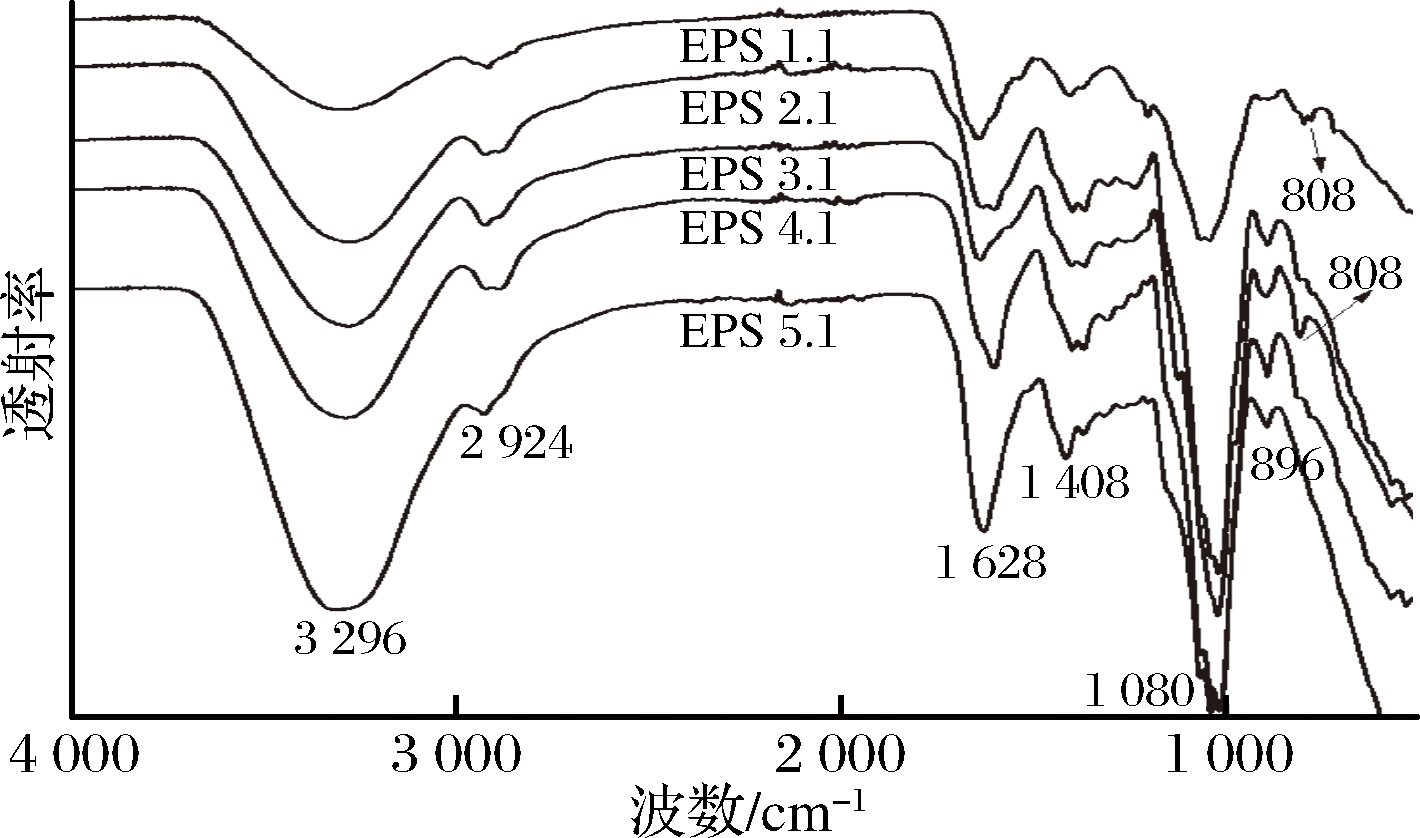
图8 根瘤菌单一胞外多糖的红外光谱图
Fig.8 IR spectra of a single exopolysaccharide fromRhizobium
3 讨论
通过对根瘤菌胞外粗多糖进行分离纯化,得到EPS 1-1、EPS 2-1、EPS 3-1、EPS 4-1和EPS 5-1五种组分,并初步分析了5种多糖组分之间的差异性。结果表明,5种多糖组分均为β-型糖苷键连接的吡喃糖,其中EPS 1-1和EPS 3-1是β构型的半乳吡喃糖;根瘤菌胞外多糖的5种组分主要由半乳糖、葡萄糖和甘露糖3种单糖组成,但它们的分子量和摩尔比却不尽相同,从而可能会影响它们的生物活性。多糖的生物活性与其结构和分子量有着密切关系[22-23]。不同分子量的多糖其结构和生物活性大不相同,即使相同分子量的多糖,其内部结构也可能不相同,这也是大分子物质的复杂性和生物特性。不同的单糖组成影响多糖的结构和性质,从而改变其生物生化特性[24]。例如,多糖组分中含有岩藻糖时能显著促进RAW 264.7巨噬细胞释放TNF-α细胞因子[25]。本文主要对根瘤菌胞外多糖的组分、分子量及单糖组成进行了研究。为进一步研究根瘤菌胞外多糖组分的糖重复单元、生物活性及其构-效关系奠定基础。
[1] ZONG A, CAO H, WANG F. Anticancer polysaccharides from natural resources: A review of recent research [J]. Carbohydrate Polymers, 2012, 90(4):1 395-1 410.
[2] NWODO U U, EZEKIEL G, OKOH A I. Bacterial exopolysaccharides: functionality and prospects [J]. International Journal of Molecular Sciences, 2012, 13(11):14 002-14 015.
[3] HABIBI H, KHOSRAVIDARANI K. Effective variables on production and structure of xanthan gum and its food applications: A review [J]. Biocatalysis & Agricultural Biotechnology, 2017, 10:130-140.
[4] SILVA N H C S, VILELA C, ALMEIDA A, et al. Pullulan-based nanocomposite films for functional food packaging: Exploiting lysozyme nanofibers as antibacterial and antioxidant reinforcing additives [J]. Food Hydrocolloids, 2018, 77:921-930.
[5] 杨西江,徐田华,徐玲,等.普鲁兰多糖的应用及研究生产现状[J]. 发酵科技通讯, 2010,39(4):25-28.
[6] 肖素荣,高清山,李京东. 新型食品添加剂可得然胶的性质及应用[J]. 中国食物与营养, 2008(1):25-26.
[7] MANGOLIM C S, DA SILVA T T, FENELON V C, et al. Use of FT-IR, FT-Raman and thermal analysis to evaluate the gel formation of curdlan produced by Agrobacterium sp. IFO 13140 and determination of its rheological properties with food applicability [J]. Food Chemistry, 2017, 232:369.
[8] OZTURK S, ASLIM B, SULUDERE Z, et al. Metal removal of cyanobacterial exopolysaccharides by uronic acid content and monosaccharide composition [J]. Carbohydr Polym, 2014, 101(2):265-271.
[9] CASTELLANE T C L. Production of exopolysaccharide from Rhizobia with potential biotechnological and bioremediation applications [J]. International Journal of Biological Macromolecules, 2015, 74:515-522.
[10] 陈艳丽, 任盛,魏国琴,等. Rhizobium sp.N613胞外多糖的抗氧化活性[J]. 微生物学通报, 2010, 37(2):234-238.
[11] KIM J W, LEE J, YOO A Y, et al. Immune-stimulating activity of water-soluble extracellular polysaccharide isolated from Rhizobium massiliae [J]. Process Biochemistry, 2017, 63:236-243.
[12] PRIYANKA P, ARUN A B, ASHWINI P, et al. Versatile properties of an exopolysaccharide R-PS18 produced by Rhizobium sp. PRIM-18 [J]. Carbohydrate Polymers, 2015, 126:215-221.
[13] LIANGQI Z, YANLI C, SHENG R, et al. Studies on the chemical structure and antitumor activity of an exopolysaccharide from Rhizobium sp. N613 [J]. Carbohydrate Research, 2010, 345(5):637-643.
[14] 程红兵, 韩勇,任盛,等. Rhizobium sp.N613胞外多糖分离纯化及抗S180肉瘤的研究[J]. 中国药学杂志, 2008, 43(4):268-272.
[15] URAI M, AIZAWA T, IMAMURA K, et al. Characterization of the chemical structure and innate immune-stimulating activity of an extracellular polysaccharide from Rhizobium sp. strain M2 screened using a silkworm muscle contraction assay [J]. Drug Discoveries & Therapeutics, 2017, 11(5):238-245.
[16] 魏杰,吕磊,金莉莉,等.茄枝多糖的分离纯化及成分分析[J]. 食品科学, 2015,36(4):168-171.
[17] 王卫国,吴强,胡宝坤,等.几种测定灰树花多糖中蛋白质含量方法的比较研究[J]. 中国食用菌, 2003(1):27-30.
[18] 刘景煜, 李晨,肖林刚,等.双水相萃取法分离纯化金针菇子实体多糖[J]. 食品与发酵工业, 2017,43(5):255-260.
[19] 刘璐, 乔宇,汪兰,等.山药多糖的抗氧化作用研究[J]. 食品科技, 2014,39(12):212-216.
[20] 雷思敏,肖榕,章莹,等.铁皮石斛中性多糖分离纯化及其体内免疫调节作用研究[J]. 中药新药与临床药理, 2018(6):748-753.
[21] LI N, MAO W, YAN M, et al. Structural characterization and anticoagulant activity of a sulfated polysaccharide from the green alga Codium divaricatum[J]. Carbohydrate Polymers, 2015, 121:175-182.
[22] ZHOU G, SUN Y P, XIN H, et al. In vivo antitumor and immunomodulation activities of different molecular weight λ-carrageenans from Chondrus ocellatus[J]. Pharmacological Research, 2004, 50(1):47-53.
[23] SUN L, WANG C, SHI Q, et al. Preparation of different molecular weight polysaccharides from Porphyridium cruentum and their antioxidant activities [J]. International Journal of Biological Macromolecules, 2009, 45(1):1-47.
[24] YI Y, LAMIKANRA O, SUN J, et al. Activity diversity structure-activity relationship of polysaccharides from lotus root varieties [J]. Carbohydr Polym, 2017, 190:67-76.
[25] WANG H T, YANG L C, YU H C, et al. Characteristics of fucose-containing polysaccharides from submerged fermentation of Agaricus blazei Murill [J]. Journal of Food & Drug Analysis, 2018,26(2):678-687.