豌豆是一种以蛋白质和淀粉为主的豆科植物,在世界各地广泛种植,其产量在豆科类农作物中排名第四,仅低于黄豆、花生和大豆。豌豆淀粉是豌豆提取蛋白质后的副产物,价格便宜,与玉米、小麦和马铃薯淀粉相比,其直链淀粉含量较高,形成的凝胶强度大,糊化温度高[1-2]。豌豆淀粉主要用于纺织、轻化和医药工业中,除大多用于替代绿豆淀粉制作粉丝外,在食品中由于其功能性较差而应用较少[3-4]。改性淀粉的加工处理方法较多,例如:微波辐射处理[5-6]、高压处理及高压循环处理[7-8]、超声处理[9]、酸解处理[10]、脱支酶酶解处理[11-12]、湿热处理[13]和多种方法联合使用等。有关消化过程中改性淀粉结构转变及机理的研究很少。鉴于个体小肠转运时间存在明显差异,研究人员已建立了几种模拟淀粉体内消化过程模型。有报道称,对酶消化的抗性是酶水解动力学与直链淀粉还原动力学竞争的结果,加工过的高直链淀粉在消化过程中可能形成抗性淀粉。因此,研究改性淀粉在消化过程中结构转变具有重要意义。
前期研究发现,超声高压联合处理对豌豆淀粉结构及理化性质影响较大,可在一定程度上提高样品中抗性淀粉的含量,降低食品的血糖生成指数,同时提高改性淀粉的热加工稳定性。超声波振动的能量在传播过程中会被聚合物吸收,从而使分子中所含的能量提高,这对直链淀粉的重结晶具有积极作用。压热处理法能将淀粉充分糊化,且制备工艺简单,是最通用、经济的制备方法;超声波安全无污染,也逐步被应用于淀粉改性中。在超声波预处理作用下,虽然淀粉颗粒中有部分直链淀粉溢出,但支链淀粉中的α - (1, 6) 糖苷键的存在会阻碍直链淀粉相互接近[14-15]。经过压热处理后,支链淀粉溶解膨胀,直链淀粉完全溶出[16]。超声和高压复合处理的最终目的是破坏原豌豆淀粉的结构,使豌豆淀粉分子更大程度地降解为分子链较小的,分子量分布较均一的淀粉分子,便于在后期的老化过程中形成双螺旋结构。本研究将豌豆淀粉进行超声-高压处理,分析模拟体内消化过程中不同消化阶段淀粉残余物,利用环境扫描电子显微镜、X射线衍射、傅里叶红外光谱观察改性豌豆淀粉在消化过程中形貌和结晶区的变化,同时分析消化过程中改性淀粉理化性质的改变,包括冻融稳定性等与结构变化之间的关系,阐述消化时间与结构、物理性质变化之间的关系,结构的变化与物理性质之间的关系,为扩大豌豆淀粉应用范围提供依据。
1 材料与方法
1.1 材料与试剂
豌豆淀粉,四川成都城东王食品有限公司;α-淀粉酶(10 080-25G,50 U/mg)、胰酶(P7545)和葡萄糖苷酶(10115-5G-F,70 U/mg),Sigma试剂公司;人总胆汁酸检测试剂盒,上海Elisa生物试剂有限公司;其余的试剂均为分析纯,西安晶博试剂有限公司。
1.2 仪器与设备
LD2X-30KBS立式压力蒸汽灭菌锅,上海申安医疗器械厂;DK-S26型电热恒温水浴锅,上海申贤恒温设备厂;BSA124S型电子分析天平,德国赛多利斯公司;PHSJ-3F型pH计,上海雷磁仪器厂;L6/L6S型紫外可见分光光度计,上海仪电分析仪器有限公司;Multiskan Go全波长酶标仪,美国热电公司;真空冷冻干燥机,北京四环科学仪器厂;D8 advance粉末X-射线衍射仪,德国BRUKER公司;Tensor 27红外光谱仪,德国BRUKER公司;Quanta 200环境扫描电子显微镜,美国FEI公司;Q600 SDT型热分析系统,美国TA公司;SB-500DTY超声波多频清洗机,宁波生物科技股份有限公司。
1.3 方法
1.3.1 超声-高压处理豌豆淀粉
称取豌豆淀粉180 g,加入蒸馏水400 mL [m(淀粉)∶V(蒸馏水)=9∶20]混合成淀粉乳,置于超声仪器中(25 ℃)处理60 min,功率为600 W,然后将其放入高压灭菌锅中(121 ℃)压热处理30 min,冷却至室温后放入冰箱中(4 ℃)老化处理24 h。回生老化结束后,于45 ℃烘干24 h,烘干后的样品粉碎过100目筛,待用。
1.3.2 体外模拟消化
参照张娟等[17]的方法。将1.5 g淀粉样品加入到30 mL磷酸缓冲溶液(0.2 mol/L, pH 5.8)中混匀,加入2 mL质量浓度为100 g/L的胃蛋白酶(由0.2 mol/L, pH 5.8磷酸缓冲液配制),摇匀,置于恒温水浴振荡器中37 ℃酶解30 min,离心弃上清液,加入30 mL磷酸缓冲液(0.2 mol/L, pH 6.9)和2 mL质量浓度为1 g/L的α-淀粉酶(由0.2 mol/L, pH 6.9磷酸缓冲液配制),37 ℃下水浴10 min,离心后弃上清,于沉淀中加入由200 mg胰酶、100 μL葡萄糖苷酶和30 mL醋酸缓冲液(0.2 mol/L, pH 5.2)混合的溶液,37 ℃下振荡水浴。样品于不同时间(0 min、10 min、30 min、1 h、2 h、4 h、8 h、18 h)取出加入等量的95%乙醇终止反应,离心弃上清液,用蒸馏水和醋酸缓冲液各洗涤1遍,冷冻干燥后研磨过100目筛,待测。
1.3.3 环境扫描电子显微镜(ESEM)
取少量淀粉样品粉末,用导电胶固定在金属台后,用离子迸射仪进行喷金处理,然后用环境扫描电子显微镜观察其形态特征,取一定的倍数拍摄适当区域的样品(×1 000倍)。
1.3.4 X-射线衍射分析(XRD)
取一定量的淀粉样品于样品凹槽中,利用X射线衍射仪在40 kV电压和40 mA电流条件下观察超声-高压抗性淀粉经不同消化时间后的结晶特性, X衍射源特征线是Cu-Kα辐射,衍射角2θ的扫描范围是4~40°,扫描速度为2°/min。
1.3.5 傅里叶红外变换光谱(FT-IR)
取一定量的淀粉样品与溴化钾于玛瑙研钵中研磨[m(样品)∶m(溴化钾)=1∶100],采用溴化钾压片法制成薄片,置于样品架上,利用傅里叶红外变换光谱仪观察超声-高压抗性淀粉经不同消化时间后的短链结构。红外光谱仪波长范围为400~4 000 cm-1,速度为4 cm-1/s。
1.3.6 热特性分析(DSC)
称取约10 mg淀粉样品放入铝钳锅中,用进样器向坩埚中加入蒸馏水[m(淀粉)∶m(水)=1∶5],对样品进行压盖密封处理,室温条件下静置平衡24 h,测试条件:温度范围20~160 ℃,升温速率10°/min。
1.3.7 胆酸结合能力
参照KIM等[18]的方法。用35%的胆酸钠、35%的脱氧胆酸钠、15%的甘氨胆酸钠和15%的牛磺胆酸钠制备胆酸混合物。将混合物溶解于50 mmol磷酸盐缓冲液(pH 6.9)中,配制成 1.4 mmol/L的胆酸混合溶液。取一定量胰酶溶解于磷酸盐缓冲液中,配制为6.25 mg/mL的溶液。将5 mg的淀粉样品放入试管中,分别用0.1 mL的0.01 mol/L HCl于37 ℃水浴中振荡1 h。然后用0.1 mol/L NaOH溶液调pH至7。继而加入0.4 mL的胆酸混合物溶液和0.5 mL的胰酶溶液,37 ℃水浴振荡1 h。每个试管中加入5 mL磷酸盐缓冲液, 3 000 r/min离心10 min,上清液转移到新管。沉淀物中加入5 mL磷酸盐缓冲液,重复离心,混合上清液。游离的胆酸含量由人总胆汁酸酶联免疫分析(TBA ELISA)试剂盒检测。将混合物稀释到测试试剂盒和标准曲线的范围内。最后,用标准曲线计算每个样品溶液的浓度。每个样本重复3次。
1.3.8 冻融稳定性
取一定量的样品配制60 g/L的淀粉乳(绝干淀粉加水)置于沸水浴中加热20 min,冷却至室温后置于冰箱(4 ℃)中16 h,继而放于-20 ℃下冷冻24 h后,取出自然解冻,3 000 r/min离心20 min,弃去上清液,称沉淀物的质量并计算。
1.3.9 透光率
取一定量的样品配制为60 g/L的淀粉乳(绝干淀粉加水)于沸水浴中加热搅拌30 min,在30 ℃下冷却1 h后,以蒸馏水为空白对照,测定淀粉乳在620 nm下的透光率。
1.3.10 统计与分析
所有数据分析采用ANOVA, TUKEY, DUNCAN和Data Processing Station (DPS) 检测标准差(P<0.05),数据3次平行重复,用Origin 8.0作图。
2 结果与讨论
2.1 超声-高压处理后的抗性淀粉经不同时间消化后的结晶结构
由文献[3]可知,豌豆淀粉晶体为典型的C型结构,即淀粉晶体结构中既有A-型结构又有B-型结构。经过超声-高压处理后,抗性淀粉样品在17°(图1)左右有一个较强的衍射峰,为典型的B-型结构。这说明超声-高压处理破坏了豌豆淀粉的A-型结构。

图1 豌豆淀粉和超声高压处理后抗性淀粉的X射线衍射分析图
Fig.1 X-ray diffraction spectrums of pea starch of native and treated starch by ultrasonic-autoclaving
淀粉经不同时间的体外消化处理后,与超声-高压抗性淀粉相似,所有样品在17°左右均有较强的衍射峰,表现为B-型结晶。这说明,体外消化处理不会改变超声-高压抗性淀粉的结晶类型。也有文献指出[19-20],B-型结晶对淀粉酶的耐受性更强,且有报道指出结晶类型仅与其回生方式有关[21]。超声-高压抗性淀粉在19.86°处有弱小衍射峰,代表抗性淀粉颗粒中有V型结构,这种结构的出现可能是因为豌豆淀粉中的直链淀粉与少量的脂质形成了直链淀粉-脂质复合物[24],也可能是因为豌豆淀粉在超声-高压处理之后受4 ℃回生重结晶的影响[26]。超声-高压抗性淀粉未被消化时不显示V型结晶(图2),这可能是由于在消化处理过程中,胰酶的作用去除了淀粉中少量的脂类物质,直链淀粉与脂类的交联消失,从而导致了V型结构的消失。

图2 不同消化时间的超声-高压抗性淀粉的X射线衍射分析图
Fig.2 X-ray diffraction spectrums of treated pea starch at different digestion stages
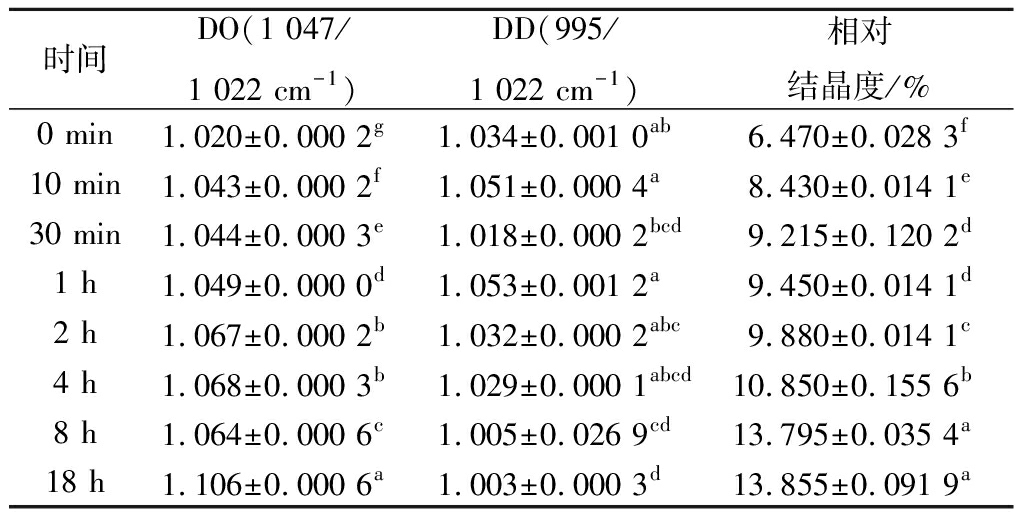
淀粉样品的相对结晶度如表1所示。从表1可以看出,随着消化时间延长,超声-高压抗性淀粉的相对结晶度也逐渐变大,这可能是因为酶的消化作用降解了超声-高压抗性淀粉颗粒里面较为薄弱的无定形部分,从而使具有较好结晶结构的抗酶解淀粉的相对比例增加,结晶度有所提高。但之后随着消化时间(8 h)的延长,结晶度没有显著增加(P<0.05),说明酶对底物的酶促作用变弱,结晶区域稳定。结论与傅里叶的DO值趋势一致,也进一步说明相对结晶度的增加与淀粉分子的链有序度有关[23]。
表1 不同消化时间样品的FTIR的DD、DO值和XRD的相对结晶度
Table 1 Molecular order and relative crystallinity oftreated pea starch at different digestion times by Fouriertransform infrared spectroscopy and X-raydiffraction (p<0.05)
时间DO(1 047/1 022 cm-1)DD(995/1 022 cm-1)相对结晶度/%0 min1.020±0.000 2g1.034±0.001 0ab6.470±0.028 3f10 min1.043±0.000 2f1.051±0.000 4a8.430±0.014 1e30 min1.044±0.000 3e1.018±0.000 2bcd9.215±0.120 2d1 h1.049±0.000 0d1.053±0.001 2a9.450±0.014 1d2 h1.067±0.000 2b1.032±0.000 2abc9.880±0.014 1c4 h1.068±0.000 3b1.029±0.000 1abcd10.850±0.155 6b8 h1.064±0.000 6c1.005±0.026 9cd13.795±0.035 4a18 h1.106±0.000 6a1.003±0.000 3d13.855±0.091 9a
2.2 傅里叶红外变换分析
不同消化时间后的超声-高压豌豆抗性淀粉的傅里叶红外变换光谱如图3所示。从图中可以很明显地看出,体外消化处理没有形成新的吸收峰,说明超声-高压抗性淀粉在体外消化处理过程中不会形成新的键型[25]。波长800~1 200 cm-1的吸收峰对应C—O、C—C、C—H键的伸缩振动,该峰强度随着消化时间的增加而降低,说明超声-高压抗性淀粉经酶消化处理后其聚合结构在水合作用下发生了改变[26]。3 000~3 700 cm-1处的峰是O—H的振动吸收峰,超声-高压抗性淀粉在此处的峰随消化过程的延长降低甚至消失,这表明抗性淀粉经酶消化处理后羟基的含量减少。这是因为随着消化时间的增加,淀粉颗粒中的O—H被逐渐解离或淀粉直链分子与直链分子之间相互结合而导致O—H的强度没有被检出[27]。1 646 cm-1是C![]() O的吸收峰,随着消化的进行,该化学键的强度降低,说明羰基遭到了破坏。2 930 cm-1处的峰随着消化时间的增加而逐渐降低,即C—H2的反对称伸缩振动强度降低,18 h后消失。吸收键1 047、995和1 022 cm-1与淀粉颗粒的分子有序结构和非结晶区有关[28]。其中波长为1 047 cm-1处的吸收峰面积反映的是淀粉结晶层的结构特征,代表聚集态分子结构内的短程有序结构;波长为1 022 cm-1处的吸收峰面积则反映淀粉无定形片层结构,代表了分子结构中无规则线团结构,1 047/1 022 cm-1峰强度的比值为淀粉中结晶结构和无定形结构的比例,代表淀粉颗粒内分子的有序度(degree of order, DO),比值越大说明有序度越高,淀粉颗粒在短程范围内的结晶度越高。(995/1 022)cm-1的比值变化说明了淀粉颗粒内部双螺旋结构发生了改变(degree of double helix, DD)[29]。
O的吸收峰,随着消化的进行,该化学键的强度降低,说明羰基遭到了破坏。2 930 cm-1处的峰随着消化时间的增加而逐渐降低,即C—H2的反对称伸缩振动强度降低,18 h后消失。吸收键1 047、995和1 022 cm-1与淀粉颗粒的分子有序结构和非结晶区有关[28]。其中波长为1 047 cm-1处的吸收峰面积反映的是淀粉结晶层的结构特征,代表聚集态分子结构内的短程有序结构;波长为1 022 cm-1处的吸收峰面积则反映淀粉无定形片层结构,代表了分子结构中无规则线团结构,1 047/1 022 cm-1峰强度的比值为淀粉中结晶结构和无定形结构的比例,代表淀粉颗粒内分子的有序度(degree of order, DO),比值越大说明有序度越高,淀粉颗粒在短程范围内的结晶度越高。(995/1 022)cm-1的比值变化说明了淀粉颗粒内部双螺旋结构发生了改变(degree of double helix, DD)[29]。
超声-高压抗性淀粉在不同时间消化后的分子有序度(DO)和双螺旋程度(DD)如表1所示,可以明显看出DO值随着消化时间的增加逐渐变大,可能是因为淀粉经过消化后颗粒中不稳定结构被酶解,淀粉直链双螺旋结构遭到酶的破坏,形成更多的直链淀粉或短链分子链,直链淀粉与直链淀粉、或者直链淀粉与酶解后支链淀粉所产生的短链分子链通过氢键相连,形成新的有序结构[23,29]。且DO值缓慢从1.020增长到1.106,可能是因为消化时间控制的间隔较短且超声-高压处理得到的抗性淀粉结构相对原豌豆淀粉更加紧密,从而导致了消化过程中DO值变化缓慢。结果与XRD中相对结晶度的变化一致,分子有序度越高,相对结晶度越大,说明消化过程中无定形区被缓慢酶解,结晶区结构因为相对稳定而没有被破坏。
2.3 体外消化过程中超声-高压抗性淀粉的形貌结构分析
图4表示超声-高压抗性淀粉经不同消化时间后淀粉形貌结构的变化。如图4所示,消化未开始时淀粉的形状都是比较小且不规则的,这可能是由于淀粉经超声-高压处理后受热膨胀,直链淀粉逐渐浸出,颗粒形态遭到破坏,老化过程中淀粉分子链通过氢键和范德华力作用相互靠近并重排重组成坚硬的不规则晶体结构碎片[30]。超声-高压抗性淀粉经消化2 h后,淀粉颗粒表面开始出现一些凹槽和脊状条形同时伴随着细小的孔状,这可能是因为淀粉表面的层状结构随着消化的进行逐渐被酶解。而消化4 h以后到18 h,所有淀粉的表面都有孔状和漩涡状并且都变成了大包裹型。

图3 不同消化时间的超声-高压抗性淀粉的FTIR光谱图
Fig.3 FTIR of treated pea starch at different digestion stages

图4 不同消化时间淀粉的电镜扫描图
Fig.4 Scanning electron microscope images of treated pea starch at different digestion times
2.4 体外消化过程中超声-高压抗性淀粉的热特性分析
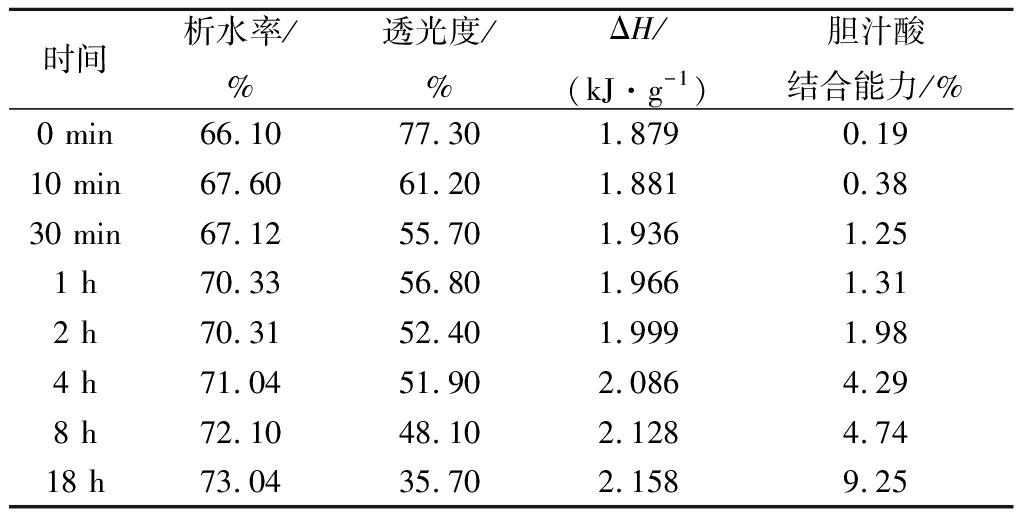
表2为超声-高压抗性淀粉经不同消化时间后淀粉的热特性变化。从表2中可以看出,随着消化时间的增加,淀粉样品的热焓值(ΔH,kJ/g)随体外消化时间的增长也呈缓慢增加的趋势,这可能是因为在消化过程中淀粉颗粒结构中的直链淀粉增加,并聚集形成结晶区,而其较支链淀粉晶体较难被破坏,故需要更高的能量。淀粉经过超声-高压联用处理后具有一定的酶抗性,故增加较缓慢[24,31]。
2.5 胆酸结合能力
胆酸是一种类胆固醇羧酸,由胆固醇在肝脏中合成,膳食纤维等聚合物与胆酸结合后,游离的胆酸含量降低,促进肝脏中的胆固醇转变成胆酸,也可以在小肠中通过结合胆酸来降低胆固醇水平,因此会增加粪便中的胆酸排泄,起到降低血浆总和及低密度脂蛋白水平的作用,从而降低心血管疾病的患病率[32]。表2中呈现出超声-高压抗性淀粉的胆汁酸结合能力随着消化时间的延长而增强,说明淀粉经过消化后形成的孔状和漩涡状可以很好地与胆酸结合。从淀粉的形貌结构中也可以看出,随着消化时间的增加,淀粉表面出现的孔状和漩涡状数增多。
表2 不同消化时间样品的冻融稳定性、透光度、糊化吸热焓和胆汁酸结合力(n=3)
Table 2 Freeze thaw stability,light transmittance,ΔHand bile acid binding of treated pea starch at differentdigestion times
时间析水率/%透光度/%ΔH/(kJ·g-1)胆汁酸结合能力/%0 min66.10 77.301.8790.1910 min67.60 61.201.8810.38 30 min67.12 55.701.9361.25 1 h70.33 56.801.9661.31 2 h70.31 52.401.9991.98 4 h71.04 51.902.0864.29 8 h72.10 48.102.1284.74 18 h73.04 35.702.1589.25
2.6 透光率与冻融稳定性
透光率即淀粉糊透明度,它反映了淀粉分子吸水膨胀及分子间的缔合程度,也可以反映淀粉分子与水分子之间的结合能力。透光率与直链淀粉含量有关,直链淀粉含量越低,透明度越高;一般来说,当淀粉分子吸水充分膨胀后,分子间不发生相互缔合或者缔合程度很低时,淀粉糊的透明度会很高,反之,透明度会很低[19,33]。从表2可以看到,透光率随着消化时间的延长而逐渐降低,这可能是由于淀粉颗粒经消化后直链淀粉含量增加,分子间的缔合作用引起了光反射,这与样品的热焓值的变化的规律一致。
淀粉的冻融稳定性是指淀粉乳液经冻结和融化交替变化时的稳定性,可由析水率反映,析水率是淀粉制品品质的重要指标之一,析水率越高冻融稳定性越差,反之冻融稳定性越好。随着消化时间的增加,淀粉的冻融稳定性越差,这可能与直链淀粉与支链淀粉的比值有关。
3 结论
豌豆淀粉经过超声-高压处理后,淀粉的晶型由原来的C型变为B+V型。体外消化后结晶型由B+V型转变为B型,说明B型晶体的耐酶解能力更强。超声-高压抗性淀粉在体外消化过程中,抗性淀粉的无定形区被破坏,所以相对结晶度随着消化时间的延长而增加。超声-高压抗性淀粉体外消化后,豌豆抗性淀粉的分子有序度随着消化时间的增加而增加;抗性淀粉平整的表面出现孔状和旋涡状,且随消化时间的增长,孔状和旋涡状结构逐渐增多;超声-高压抗性淀粉的胆汁酸结合能力的提高随消化时间的增长呈缓慢升高趋势,且与其形貌有关。超声-高压抗性淀粉的冻融稳定性和热焓值均随消化时间的增长而增加,而透光率则刚好相反,这可能与消化后淀粉被酶解形成了更多的直链淀粉有关。改性淀粉中直/支链淀粉的含量,分子量变化情况及其与改性淀粉的体外消化率的关系还需在后续研究中继续探究。
[1] 李薇,郑炯,陈映衡,张甫生.超声波处理对豌豆淀粉糊化、流变及质构特性的影响[J].食品与机械,2018,34(5):32-37.
[2] RATNAYAKE W S, HOOVER R, WARKENTIN T. Pea starch: composition, structure and properties—a review[J]. Starch-Stärke, 2015, 54(6):217-234.
[3] 李兆丰,顾正彪,洪雁.豌豆淀粉的研究进展[J].食品与发酵工业,2003,29(10):70-74.
[4] 武俊超.豌豆抗性淀粉的制备及其性质研究[D].广州:华南理工大学,2012.
[5] 兰冬梅,林晓岚,颜谊颖,等.微波联合干燥制备锥栗抗性淀粉[J].食品与发酵工业,2015,41(5):144-149.
[6] 原沙沙,谢岩黎,王金水.微波对淀粉特性影响的研究进展[J].食品科技,2011,36(7):242-243;247.
[7] 郭泽镔.超高压处理对莲子淀粉结构及理化特性影响的研究[D].福州:福建农林大学,2014.
[8] 郑琳,张元元,齐明.压热法制备白扁豆抗性淀粉的研究[J].现代食品科技,2011,27(6):647-650;657
[9] 冯铄涵,阚建全.压热酸解法制备玉米抗性淀粉的工艺优化[J].粮食科技与经济,2011,36(6):38-42.
[10] 牛春艳,刘阳阳.超声波法制备玉米抗性淀粉的工艺条件[J].江苏农业科学,2017,45(1):181-183.
[11] 任海斌,肖志刚,赵妍等.挤压-酶解联用抗性淀粉制备工艺的优化研究[J].中国粮油学报,2017,32(2):30-36;56.
[12] REDDY C K, SURIYA M, HARIPRIYA S. Physico-chemical and functional properties of resistant starch prepared from red kidney beans (Phaseolus vulgaris L.) starch by enzymatic method[J]. Carbohydrate Polymeis, 2013, 95(1):220-226.
[13] 谢岩黎,南永远,郝振宇.微波湿热-循环冷冻对小麦淀粉结晶特性的影响[J].中国粮油学报,2017,32(10):49-53.
[14] 何小维,罗发兴,罗志刚.物理场改性淀粉的研究[J].食品工业科技,2005,30(9):172-174
[15] ZHANG Huanxin, JIN Zhengyu. Preparation of products rich in resistant starch from maize starch by an enzymatic method[J]. Carbohydrate Polymers, 2011, 86(4):1 610-1 614.
[16] 付陈梅,赵国华,阚健全,等.超声波对淀粉降解及其性质影响[J].粮食与油脂,2002(12):31-32.
[17] ZHANG Juan, CHEN Feng, LIU Feng, et al. Study on structural changes of microwave heat-moisture treated resistant Canna edulis Ker starch during digestion in vitro[J]. Food Hydrocolloids, 2010, 24(1):27-34.
[18] LOPEZ-RUBIO A, FLANAGAN B M, SHRESTHA A K, et al. Molecular rearrangement of starch during in vitro digestion: toward a better understanding of enzyme resistant starch formation in processed starches[J]. Biomacromolecules, 2018,9:1 951-1 958.
[19] 王娟,刘泽翰,张凯,等.小麦抗性淀粉的理化性质研究[J].现代食品科技, 2012, 28(4): 374-377;472.
[20] EVANGÉLICA F-Z, ELENA S-Z, SENDRA E, et al. Resistant starch as prebiotic: A review[J]. Starch-Stärke, 2011, 63(7):10.
[21] 熊玮彦. 蒸煮和湿热处理对杂豆细胞内淀粉结构及体外消化性的影响机制研究[D].广州:华南理工大学,2018.
[22] MA Zhen, BOYE J I. Research advances on structural characterization of Resistant starch and its structure-physiological function relationship: A review[J]. Critical Reviews in Food Science & Nutrition, 2018, 58(7):1 059-1 083.
[23] MA Zhen, YIN Xiuxiu, HU Xinzhong, et al. Structural characterization of Resistant starch isolated from laird lentils (Lens Culinaris) seeds subjected to different processing treatments[J]. Food Chemistry, 2018, 263:163-170.
[24] 高群玉,叶营,王琳.湿热处理对不同晶型淀粉理化性质及消化性的影响[J].现代食品科技,2015, 31(3):60-65.
[25] 付蕾,田纪春,汪浩.抗性淀粉理化特性研究[J]. 中国粮油学报, 2009, 24(5):58-62.
[26] ZHENG Baodong, ZHANG Yi, ZENG Hongliang. Structural characteristics and prebiotic effects of Lotus seed Resistant starch[M].Probiotics, Prebiotics, and Synbiotics. Elsevier Inc,2016:195-211.
[27] HUANG Kehao, DU Bin, XU Baojun. Alterations in physicochemical properties and bile acid binding capacities of dietary fibers upon ultrafine grinding[J]. Powder Technology, 2018, 326:146-150.
[28] 李翠翠,张彩芳,栗亚琼.蚕豆、豌豆淀粉特性研究[J].粮食与食品工业, 2016, 23(4):62-65.
[29] 王雪毓. 淀粉基水分散体薄膜包衣材料及其释放行为的研究[D].广州:华南理工大学, 2011.
[30] 杨小玲,赵维,陈佑宁等.超声波辅助酸法制备红薯抗性淀粉及其结构表征[J].中国粮油学报, 2018, 33(1):107-110;117.
[31] 李素玲,邓晓聪,高群玉.颗粒型抗性淀粉的制备及性质[J].农业工程学报, 2011, 27(5):385-391.
[32] ASHWAR B A, GANI A, WANI I A, et al. Production of resistant starch from rice by dual autoclaving-retrogradation treatment: Invitro digestibility, thermal and structural characterization[J]. Food Hydrocolloids, 2016, 56:108-117.
[33] 谭晓凤.马铃薯成分及其淀粉的功能特性探究[J].食品安全导刊, 2018(9): 138-139.