发酵香肠是指将碎肉和丁状脂肪同盐、糖、香辛料等混合灌入肠衣内,经微生物发酵及干燥成熟而制成的肉制品[1]。传统香肠的自然发酵完全依靠本身少量的微生物,存在发酵周期长,产品质量难以保障等缺点,因此逐渐被人工接种发酵剂所取代。目前常用的肉制品发酵剂有葡萄球菌、微球菌和乳酸菌[2-3]。葡萄球菌可释放脂肪酶和蛋白酶,增强肉制品风味,产生亚硝酸盐还原酶,改善产品色泽[4-6]。JEONG等从豆制发酵食品中筛选出33株葡萄球菌,大多数可在4% NaCl的条件下显示脂肪酶活性[7]。高继庆等发现添加了木糖葡萄球菌的鱼类,脂肪氧化产物含量增多[8]。乳酸菌具有产酸速度快、耐盐、抑菌等特点[9-10],可缩短发酵周期,提高食品安全性。为满足发酵香肠品质、成本、安全性等要求,葡萄球菌和乳酸菌复合发酵剂的使用越来越多。FIEIRA等将葡萄球菌与乳酸菌作为发酵剂用于意大利香肠,研究NaCl替代物对发酵剂的影响[11],可见葡萄球菌和乳酸菌作为混合发酵剂的实用性很强。SUN等将葡萄球菌与乳酸杆菌混合用于哈尔滨香肠,发现混合发酵剂改善了肉制品品质[12]。
脂肪氧化是发酵香肠成熟过程中主要的生化反应之一,可将脂肪分解产生的脂肪酸进一步氧化为醛酮等风味物质,经研究发现,发酵肉制品60%的风味来源于脂肪分解、氧化[13]。本实验将从内蒙古传统肉制品中分离筛选出具有脂肪分解能力的木糖葡萄球菌X21-2m与植物乳杆菌19-2D复配应用于羊肉发酵香肠,以自然发酵和汉森发酵剂作为对照,研究其对羊肉发酵香肠脂肪氧化和脂肪酸组成的影响。
1 材料与方法
1.1 材料与试剂
原辅料:精选内蒙古市售苏尼特羊后腿肉和羊尾肥膘。食盐、蔗糖、葡萄糖、孜然粉、黑胡椒粉、硝酸钠、亚硝酸钠、天然猪肠衣。
发酵剂:木糖葡萄球菌(Staphylococcus xylosus)X21-2m及植物乳杆菌(Lactobacilles plantarum)X19-2D均为内蒙古农业大学肉品实验室保藏。汉森发酵剂:木糖葡萄球菌和戊糖片球菌(Pediococcus pentosaceus)。
试剂:异丙醇、乙醚,天津市富宇精细化工公司;冰乙酸,天津市永晟精细化工公司;氯仿、甲醇,国药集团化学试剂公司;正己烷(色谱纯),天津市光复精细化工研究所;所有分离用有机溶剂均为分析纯。
1.2 仪器与设备
HN200氮吹仪,海能仪器;AM204电子天平,梅特勒-托利多仪器公司;FSH-2可调高速匀浆机,常州国华电器公司;通风橱、SC-3612低速离心机、Clarns680气相色谱仪、JC-HW-2旋涡振荡器,济南精诚试验仪器公司;TCP全自动测色色差计,北京奥依克光电仪器有限公司;T6紫外可见分光光度计,北京普析通用仪器有限公司。
1.3 方法
1.3.1 发酵香肠的制备
1.3.1.1 工艺配方
精选羊后腿肉(占量80%),去筋;羊尾肥膘(占量20%)。辅料主要为葡萄糖0.5%、食盐2.5%、蔗糖0.5%、孜然粉0.5%、黑胡椒粉0.5%、亚硝酸钠70 mg/kg、硝酸钠100 mg/kg。
1.3.1.2 发酵香肠的制备
辅料、发酵剂
↓
原料肉→瘦肉绞碎、肥肉切丁→搅拌制馅→低温腌制(4 ℃,12 h)→灌肠→发酵(24 ~25 ℃,RH 98%~95%,3 d)→干燥成熟(14~15 ℃,RH 90%~65%,11d)→真空包装→成品
分组:自然组(未添加发酵剂);汉森组(添加科·汉森发酵剂,0.125 g/kg);复配组(添加木糖葡萄球菌X21-2m与植物乳杆菌X19-2D 2∶1的混合菌株,107 CFU/g)。
1.3.1.3 样品的采集
分别于香肠加工过程中发酵结束(3 d)、加工结束(11 d)、贮藏(4 ℃真空)1周(18 d)、2周(25 d)、贮藏第1个月(41 d)、2个月(71 d)、5个月(161 d)各时间点随机抽取样品,用于香肠各指标的测定。
1.3.2 脂肪氧化指标的测定
1.3.2.1 酸价(acid value,AV)的测定
参照GB 5009.229—2016《食品中酸价的测定》进行测定[14]。
1.3.2.2 过氧化值(peroxide value,POV)的测定
参照GB 5009.227—2016《食品中过氧化值的测定》进行测定[15]。
1.3.2.3 硫代巴比妥酸值(thiobarbituric acid reactive substances,TBARS)的测定
参照GB 5009.181—2016《食品中丙二醛的测定》进行测定[16]。
1.3.3 游离脂肪酸的测定
1.3.3.1 脂肪的提取
参照FOLCH等[17]的方法提取脂质,取发酵香肠1.0 g,加入氯仿-甲醇(2∶1,V∶V)20 mL后低速匀浆,静置1 h,过滤后加入0.2倍体积的生理盐水(7.3 g/L NaCl,0.5 g/L CaCl2),3 600 r/min离心15 min,吸净上层液体,剩余液体用氮吹仪吹干溶剂。
1.3.3.2 脂肪酸的甲酯化
称取挥干溶剂后的脂质0.15 g,加入2 mL 14%三氯化硼-甲醇进行甲酯化(60 ℃水浴30 min),冷却后加入2 mL水和2 mL正己烷振荡混匀,静置分层后吸取上层液体,挥干溶剂,加入100 μg/mL十七酸甲酯做内标,用正己烷定容,以备气相测定。
1.3.3.3 气相条件
色谱柱:SP2560(100 m×0.25 mm×0.2 μm);检测器温度:260 ℃;升温程序:120 ℃保持5 min,以3 ℃/min升至230 ℃,保持3min,以1.5 ℃/min升至240 ℃,保持13 min;气体流速:H2 45.0 mL/min,空气450.0 mL/min,氮气1.0 mL/min,进样量1.0 μL;分流比1∶10。
1.3.3.4 定性定量分析
根据37 种脂肪酸甲酯混标来确定各脂肪酸的保留时间进行定性分析;以十七酸甲酯为内标物质进行定量分析。
1.3.4 数据处理
每个试验重复3次,结果表示为平均数±SD,图表采用Excel进行绘制,数据统计分析采用SPSS Statistics 18 统计分析软件中的比较均值中的独立样品T检验进行显著性分析,差异显著水平为0.05。
2 结果与分析
2.1 酸价(AV)
AV表示脂肪中游离脂肪酸含量,可作为衡量脂肪分解程度的指标[18]。图1所示,AV总体呈现上升趋势,表明发酵香肠的脂肪不断分解为脂肪酸,且脂肪酸的生成速度大于分解速度,与许美娜等的研究成果一致[19]。
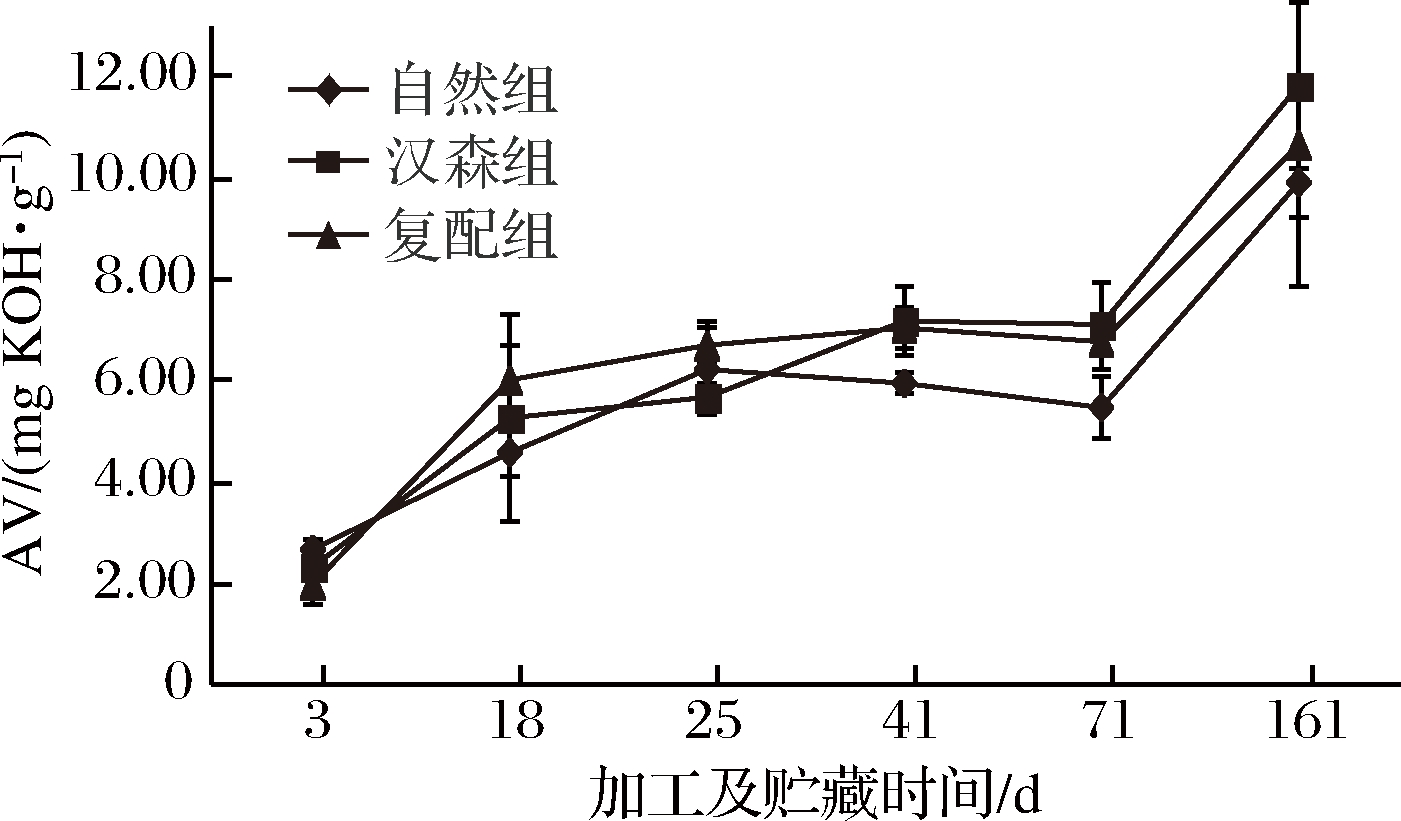
图1 各组发酵香肠AV随加工贮藏时间的变化
Fig.1 Changes of AV of fermented sausages in each group with processing and storage time
发酵香肠在3~18 d,自然组、汉森组、复配组AV分别提高了1.95、2.92和4.03 mg/g,复配组提高最多。在18、41、71d,复配组和汉森组AV显著高于(P<0.05)自然组。由此可以证明,复配发酵剂有利于发酵香肠脂肪的分解。
2.2 过氧化值(POV)
POV表示脂质氧化初级产物过氧化物的积累量[20]。由图2可知,各发酵组POV均呈现先上升后下降的趋势,各发酵组变化显著(P<0.05),与李钰[21]、SOHN等[22]实验结果一致,可能因为过氧化物不稳定可继续氧化分解为其他物质。在11~18 d,复配组的POV增长率为156%,高于其他2组。在41d,复配组POV显著高于(P<0.05)其他2组。在71 d,各组香肠的POV达到最大值,自然组、汉森组、复配组分别为2.54 mmol/kg、2.96 mmol/kg和3.31 mmol/kg,复配组最高,但差异不显著(P>0.05)。说明复配发酵剂的添加,对脂肪氧化初级产物的产生有一定的作用。

图2 各组发酵香肠POV随加工贮藏时间的变化
Fig.2 Changes of POV of fermented sausages in each group with processing and storage time
2.3 硫代巴比妥酸值(TBARS)
TBARS值表示组织中丙二醛的累积量。丙二醛是由不饱和脂肪酸分解所产生的[23],代表着脂质二级氧化产物。由图3可知,各发酵组的TBARS值先显著上升(P<0.05)后下降,可能因为贮藏前期不饱和脂肪酸分解较快,醛类物质积累,贮藏后期醛类与肉中的蛋白质、氨基酸或其他含有氨基侧链基团的物质发生羰氨反应[24]。在3~11 d,TBARS持续増加,说明脂肪酸在低温条件下也可以发生氧化[25]。在41 d,复配组TBARS达到最大值0.35 mg/kg。在41~161 d,汉森组和复配组的TBARS显著高于(P<0.05)自然组,继而证明复配发酵剂可提高发酵香肠脂肪氧化能力。

图3 各组发酵香肠TBARS随发酵香肠加工贮藏时间的变化
Fig.3 Changes of TBARS of fermented sausages in each group with processing and storage time
2.4 游离脂肪酸的变化
脂质在脂肪酶和磷脂酶的作用下被分解为甘油酯和磷脂释放游离脂肪酸,释放的游离脂肪酸直接影响发酵香肠的风味[26]。由表1可知,共检测出15种脂肪酸,主要脂肪酸是C16∶0、C18∶0和C18∶1n9c,与王柏辉[27]、CHEN等[28]研究一致。
表1 各组发酵香肠游离脂肪酸随加工贮藏时间的变化 单位:mg/g(脂肪)
Table 1 Changes of FFA of fermented sausages in each group with processing and storage time
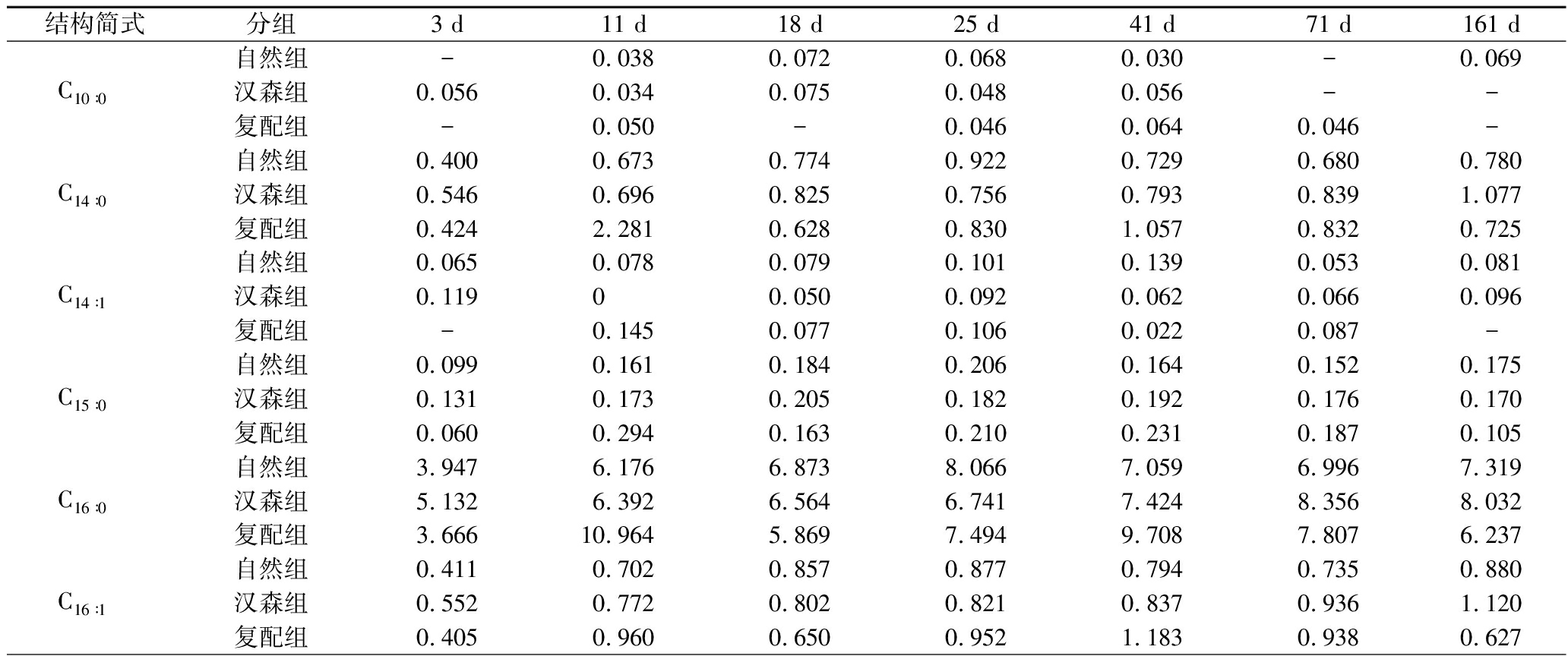
结构简式分组3 d11 d18 d25 d41 d71 d161 d自然组-0.0380.0720.0680.030-0.069C10∶0汉森组0.0560.0340.0750.0480.056--复配组-0.050-0.0460.0640.046-自然组0.4000.6730.7740.9220.7290.6800.780C14∶0汉森组0.5460.6960.8250.7560.7930.8391.077复配组0.4242.2810.6280.8301.0570.8320.725自然组0.0650.0780.0790.1010.1390.0530.081C14∶1汉森组0.11900.0500.0920.0620.0660.096复配组-0.1450.0770.1060.0220.087-自然组0.0990.1610.1840.2060.1640.1520.175C15∶0汉森组0.1310.1730.2050.1820.1920.1760.170复配组0.0600.2940.1630.2100.2310.1870.105自然组3.9476.1766.8738.0667.0596.9967.319C16∶0汉森组5.1326.3926.5646.7417.4248.3568.032复配组3.66610.9645.8697.4949.7087.8076.237自然组0.4110.7020.8570.8770.7940.7350.880C16∶1汉森组0.5520.7720.8020.8210.8370.9361.120复配组0.4050.9600.6500.9521.1830.9380.627
续表1

结构简式分组3 d11 d18 d25 d41 d71 d161 d自然组0.1650.3180.3550.3070.3090.2760.298C17∶1汉森组0.2650.2800.2890.3020.3070.3300.292复配组0.1450.2960.2560.3410.4470.3180.225自然组3.3404.3095.1826.2035.7505.4705.434C18∶0汉森组3.7805.3345.2825.1456.0156.3245.453复配组2.8776.3795.2865.6867.0105.7964.045自然组0.4280.7261.2280.8420.7610.7261.066C18∶1n9t汉森组0.4571.0350.9041.1540.8780.8160.827复配组0.3541.3350.7321.4071.6271.1370.650自然组7.42312.67315.11215.30713.61715.26412.846C18∶1n9c汉森组9.28513.07812.64414.18413.71718.08517.079复配组6.35515.97410.85415.47121.36316.32613.702自然组-0.1040.1490.1500.1360.1160.129C18∶2n6t汉森组0.0670.1360.1460.1470.0880.1300.123复配组-0.1590.1050.1080.1970.138-自然组0.6241.4021.2061.2401.7371.3510.886C18∶2n6c汉森组1.2251.0431.2341.2291.4131.3421.121复配组0.6241.4021.2061.2291.7371.3510.886自然组0.2860.3870.5250.5780.6700.5350.558C18∶3n3汉森组0.3830.4530.6130.5560.6930.6310.524复配组0.2770.5030.4460.6250.8370.5960.510自然组0.0740.1270.1820.1910.1770.1620.175C21∶0汉森组0.0830.1600.2100.1900.1930.1990.179复配组0.0620.2140.1370.2460.2990.1870.138自然组-0.0460.0510.0550.080-0.054C22∶0汉森组0.056-0.0470.0490.058--复配组-0.0490.0460.0570.1000.058-
注:-为未检测出。
各组香肠中的C16∶0、C18∶0和C18∶1n9c,呈现先增高后下降的趋势,与黄金枝等[29]实验结果相同,后期下降可能是因为水分逐渐降低,酶活力减弱,脂肪分解能力下降。在3~11 d,各脂肪酸的生成量明显增加,且复配组增长最快。在11、25、41 d,复配组的C16∶0含量明显高于其他2组。在11、18、41 d,复配组的C18∶0含量明显高于其他2组。C18∶1n9c是发酵香肠中含量最高的脂肪酸,是重要的风味前体物质[20]。在41 d,复配组的C18∶1n9c含量达到最大值21.363 mg/g,明显高于其他两组。可以看出,复配发酵剂的使用有利于游离脂肪酸的产生,对发酵香肠风味的改善有促进作用。
2.5 饱和脂肪酸(saturated fatty acid,SFA)、单不饱和脂肪酸(monounsaturated fatty acid,MUFA)和多不饱和脂肪酸(polyunsaturated fatty acid,PUFA)的变化
脂肪酸一般可分为SFA、MUFA、PUFA三类。SFA主要为人体提供能量,可增加人体胆固醇和中性脂肪。不饱和脂肪酸(unsaturated fatty acid,UFA)是人体不能合成必须从膳食中获取的脂肪酸,有调节血脂、清理血栓、提高人体的免疫力等功能,对人体有重要的意义[30]。
由表1可知,共检测出7种饱和脂肪酸,其中C16∶0,C18∶0的含量相对较高,其余SFA含量在1 mg/g以下。各组SFA在加工及贮藏时间均呈先增长后下降趋势。在3~11 d,各组香肠的SFA含量增长较大,自然组、汉森组和复配组分别增长了3.67 mg/g、3.005 mg/g和13.142 mg/g,其中复配组增长幅度最大,可能是添加具有脂肪分解作用的木糖葡萄球菌加速了脂肪酸的产生。在贮藏后期,各组SFA逐渐下降,在161 d,复配组SFA含量为11.25 mg/g,明显低于其他2组。
由表1可示,共检测出5种单不饱和脂肪酸,其中C18∶1n9c的含量相对较高,在41 d,复配组的C18∶1n9c的含量达到最大值21.363 mg/g。由表2可知,在3~11 d,各组香肠的MUFA含量骤增,这可能是PUFA转化为MUFA的速率大于MUFA转化为SFA的速率[31],且复配组最为明显,增长了11.451 mg/g。在11、18、41d,复配组的MUFA明显高于其他2组。在41 d以后,MUFA处于下降趋势,可能是因为其氧化速度大于产生速度。可以说明,在贮藏初期,复配组的MUFA相对较高。
表2 各组发酵香肠SFA、MUFA、PUFA随加工贮藏时间的变化 单位:mg/g(脂肪)
Table 2 Changes of SFA、MUFA、PUFA of fermented sausages in each group with processing and storage time
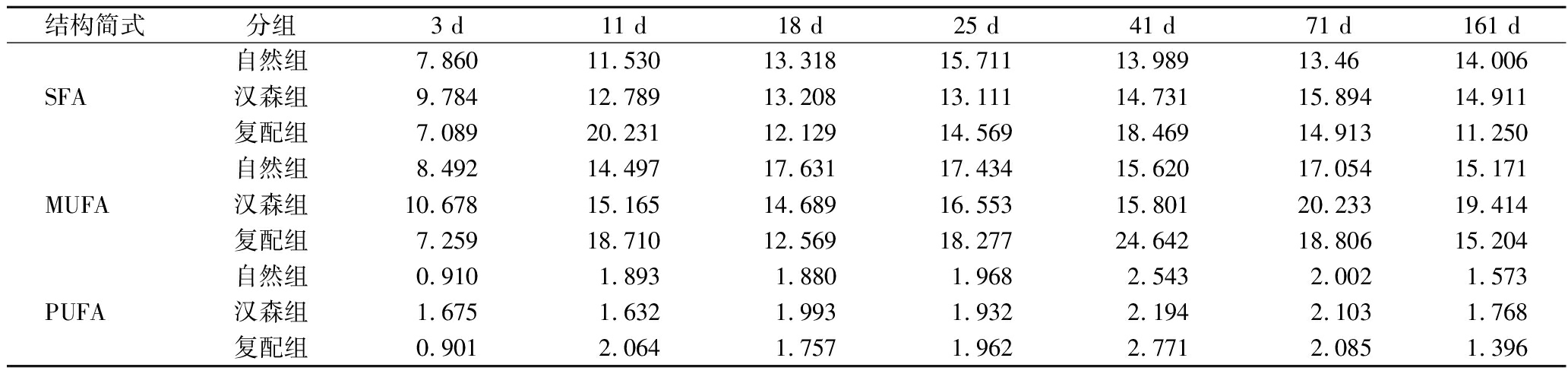
结构简式分组3 d11 d18 d25 d41 d71 d161 d自然组7.86011.53013.31815.71113.98913.4614.006SFA汉森组9.78412.78913.20813.11114.73115.89414.911复配组7.08920.23112.12914.56918.46914.91311.250自然组8.49214.49717.63117.43415.62017.05415.171MUFA汉森组10.67815.16514.68916.55315.80120.23319.414复配组7.25918.71012.56918.27724.64218.80615.204自然组0.9101.8931.8801.9682.5432.0021.573PUFA汉森组1.6751.6321.9931.9322.1942.1031.768复配组0.9012.0641.7571.9622.7712.0851.396
由表1所示,共检测出3种PUFA,分别为C18∶2n6t,C18∶2n6c和C18∶3n3,其中C18∶3n3是人体必需脂肪酸,是维持生命的重要物质,能在体内经脱氢和碳链延长合成C20∶5、C22∶6等代谢产物[31],C20∶5、C22∶6对脑功能、智力和视力发育有重要意义,在41 d,复配组的C18∶3n3含量明显大于其他2组。PUFA最易被氧化[32-33],所以含量明显少于SFA和MUFA。各组PUFA的均呈先上升后下降趋势,在3~11 d,各组PUFA增长较快。复配组在41d达到最大值2.771 mg/g,高于其他2组,随后不断下降,说明贮藏时间越长,转化为其他物质的PUFA越多。
2.6 脂肪酸比例的变化
随着对脂肪营养的深入研究,脂肪酸的营养及预防疾病的作用、摄入量等日益受到关注。n-6 PUFA/n-3 PUFA是一个评价肉制品品质的重要标准,经研究表明,过高的n-6 PUFA和n-6 PUFA/n-3 PUFA可促进多种疾病的爆发,如心血管疾病、癌症和炎症和自身免疫性疾病。n-6 PUFA/n-3 PUFA的值应控制在4以下为宜[34]。
表3 各组发酵香肠n-6PUFA/n-3PUFA随加工贮藏时间的变化
Table 3 Changes of n-6PUFA/n-3PUFA of fermentedsausage in each group with processing and storage time
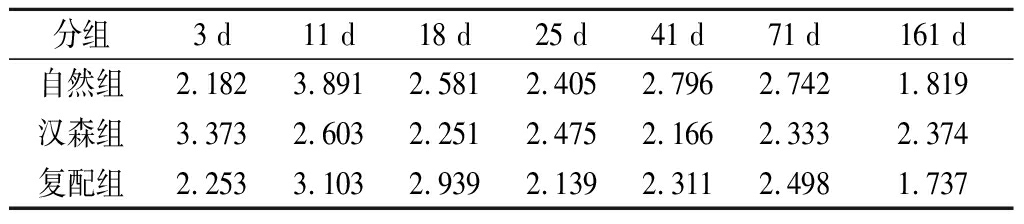
分组3 d11 d18 d25 d41 d71 d161 d自然组2.182 3.891 2.581 2.405 2.796 2.742 1.819 汉森组3.373 2.603 2.251 2.475 2.166 2.333 2.374 复配组2.253 3.103 2.939 2.139 2.311 2.498 1.737
由表3可知,各组发酵香肠各个时间段的n-6PUFA/n-3PUFA值皆在4.0以下,只是自然组在11 d时接近4。在25~161 d,复配组的n-6PUFA/n-3PUFA的值略低于自然组。
PUFA/SFA是评价肉制品营养质量的重要指标之一,减少SFA的含量,增加PUFA的含量更有利于人的身体健康[35]。由表4所示,复配组和汉森组PUFA/SFA的变化趋势一致,自然组变化波动较大。在18~161 d,汉森组和复配组PUFA/SFA的比值变化不明显,相比于自然组更稳定。
表4 各组发酵香肠PUFA/SFA随加工及贮藏时间的变化
Table 4 Changes of PUFA/SFA of fermented sausage ineach group with processing and storage time
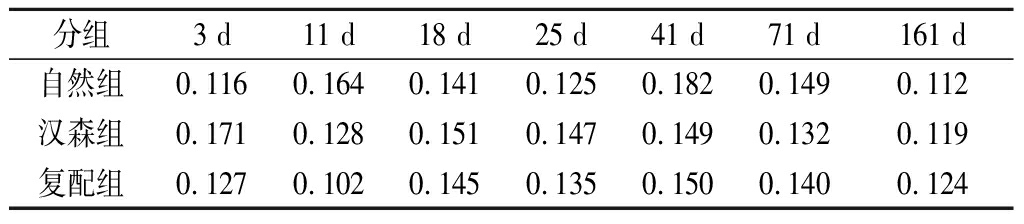
分组3 d11 d18 d25 d41 d71 d161 d自然组0.116 0.164 0.141 0.125 0.182 0.149 0.112 汉森组0.171 0.128 0.151 0.147 0.149 0.132 0.119 复配组0.127 0.102 0.145 0.135 0.150 0.140 0.124
3 结论
本研究发现,在18、41、71 d,复配组和汉森组的AV显著高于(P<0.05)自然组;复配组的POV高于其他2组,但差异不显著(P>0.05);在41~161 d,复配发酵组和汉森发酵组的TBARS显著高于(P<0.05)自然组;在11和41 d,复配组主要脂肪酸C16:0、C18:0和C18:1n9c含量皆高于其他2组,在18~161 d,n-6PUFA/n-3PUFA值略低于自然组,PUFA/SFA的值相对稳定。研究证明,复配发酵剂的使用加速了香肠的脂肪氧化程度,并未出现不良现象,各指标都在安全范围之内,对改善发酵肉制品风味有重要意义,其脂肪酸比例更有益于人体健康。
[1] 龙强,聂乾忠,刘成国,等.发酵香肠研究进展及展望[J]. 食品科学, 2017, 38(13): 291-298.
[2] WANG X, REN H, WANG W, et al. Effects of a starter culture on histamine reduction, nitrite depletion and oxidative stability of fermented sausages[J]. Journal of Food Safety, 2016, 36(2):195-202.
[3] KAROLINA M. WóJCIAK J L, DARIUSZ M S. Technological aspect of Lactobacillus acidophilus Bauer, Bifidobacterium animalis BB‐12 and Lactobacillus rhamnosus LOCK900 USE in dry‐fermented pork neck and sausage[J]. Journal of Food Processing and Preservation, 2017, 41(3):1-9.
[4] NGUYEN M T, LUQMAN A, BITSCHAR K, et al. Staphylococcal (phospho)lipases promote biofilm formation and host cell invasion [J]. International Journal of Medical Microbiology, 2017,308:653-663.
[5] 贾娜,马宏慧,刘登勇,等.直投式发酵剂对发酵牛肉干品质的影响[J]. 中国食品学报, 2014, 14(12): 106-112.
[6] 夏秀芳,张金铎,孔保华,等.木糖葡萄球菌添加量对发酵牛肉串品质特性的影响[J]. 食品科学, 2013, 37(7): 47-50.
[7] DO-WON Jeong, BITNARA L, JAE-YOUNG H,et al.Safety and technological characterization of coagulase-negative Staphylococci isolates from traditional Korean fermented soybean foods for starter development[J]. International Journal of Food Microbiology, 2016,236:9-16.
[8] 高继庆, 赵云平,秦华伟,等. 木糖葡萄球菌发酵对海鲈鱼鱼肉理化性质的影响[J]. 农产品加工, 2018(6):1-5.
[9] KABAN G, KAYA M. Effect of starter culture on growth of Stathylococcus aureus in sucuk[J]. Food Control, 2006, 17: 797-801.
[10] HASHEMI S M B, RAEISI S, ZANARDI E, et al. Antimicrobial and antioxidant activities of fermented meat patty with Lactobacillus strains[J] Food Science,2018,30:268-279.
[11] SUN Qinxiu, CHEN Qian, LI Fangfei,et al. Biogenic amine inhibition and quality protection of Harbin dry sausages by inoculation with Staphylococcus xylosus and Lactobacillus Plantarum [J]. Food Control,2016,68:358-366.
[12] FIEIRA C, MARCHI J F, MARAF O D,et al.The impact of the partial replacement of sodium chloride in the development of starter cultures during Italian salami production [J]. Braz J Food Technol Campinas, 2018, 21: e2015036.
O D,et al.The impact of the partial replacement of sodium chloride in the development of starter cultures during Italian salami production [J]. Braz J Food Technol Campinas, 2018, 21: e2015036.
[13] 巩洋,孙霞,杨勇,等. 低酸度川味香肠加工过程中脂肪降解和氧化[J]. 食品工业科技, 2015, 36(12): 152-161.
[14] 中华人民共和国国家卫生和计划生育委员会,食品安全国家标准食品中酸价的测定:GB 5009.229—2016[S].2016.
[15] 中华人民共和国国家卫生和计划生育委员会,食品安全国家标准食品中过氧化值的测定:GB 5009.227—2016[S].2016.
[16] 中华人民共和国国家卫生和计划生育委员会,食品安全国家标准食品中丙二醛的测定:GB 5009.181—2016[S].2016.
[17] FOLCH J, LEES M, STANLEY G H S. A simple method for the isolation and purification of total lipids from animal tissue[J]. Journal of Biological Chemistry, 1957, 226(1):497-509.
[18] 周慧敏,张顺亮,赵冰,等. 木糖葡萄球菌和肉葡萄球菌混合发酵剂对腊肉品质的影响[J].食品科学,2018,39(2):39-45.
[19] 许美娜,陈乃阳,牟柏德. 洋葱皮提取物对西式香肠抗氧化及品质的影响[J].食品与机械, 2017, 33(8):155-158.
[20] 王静云,卢士玲,王庆玲,等. 发酵剂对熏马肠脂肪氧化的影响[J].食品与发酵工业, 2015, 41(2): 123-128.
[21] 李钰,刘成江,李应彪,等. 温度对阿勒泰羊尾脂氧化初期脂肪酸变化的影响[J].食品工业科技, 2016, 38(4): 311-316
[22] SOHN J H,OHSHIMA T. Control of lipid oxidation and meat color deterioration in skipjack tuna muscle during ice storage[J].Fisheries Science,2010,76(1): 703-710.
[23] 侯新月,卢士玲,郭新,等. 羊肉火腿在加工过程中脂肪变化的研究[J]. 食品工业, 2017(10): 34-37.
[24] HUANG Y, HUA Y, QIU A. Soybean protein aggregation induced by lipoxygenase catalyzed linoleic acid oxidation[J]. Food Research International, 2006, 39(2):240-249.
[25] 马丹.不同发酵剂对羊肉发酵香肠理化品质及脂肪分解的影响[D]. 呼和浩特:内蒙古农业大学, 2016.
[26] 李想, 邓锋,秦春君,等. 腐生葡萄球菌CGMCC3475对发酵里脊猪肉脂质分解氧化及风味特性的影响[J]. 食品与发酵工业, 2011, 37(1): 152-157.
[27] 王柏辉, 靳志敏,刘夏炜,等. 羊肉半干发酵香肠在发酵和成熟过程中游离脂肪酸变化研究[J]. 食品工业科技, 2015, 36(7): 64-68.
[28] CHEN Q, KONG B, HAN Q, et al. The role of bacterial fermentation in lipolysis and lipid oxidation in Harbin dry sausages and its flavour development[J]. LWT-Food Science and Technology, 2017, 77:389-396.
[29] 黄金枝,杨荣玲,唐道邦,等. 发酵广式腊肠加工过程中脂质氧化特性及其指标间的相关性分析[J]. 食品科学, 2015, 36(16): 197-202.
[30] 杜智慧.不同发酵剂对发酵香肠品质影响的研究[D]. 泰安:山东农业大学, 2014.
[31] 周慧敏, 赵燕,任双,等. 杀菌温度对乳化肠中脂肪酸组成和脂肪氧化的影响[J]. 食品科学, 2018, 39(11):26-31.
[32] FERNANDES R P P, TRINDADE M A, LORENZO J M, et al. Assessment of the stability of sheep sausages with the addition of different concentrations of Origanum vulgare extract during storage[J]. Meat Science, 2017, 137:244-257.
[33] ERDMANN M E, LAUTENSCHLAEGER R, ZEEB B, et al. Effect of differently sized O/W emulsions loaded with rosemary extract on lipid oxidation in cooked emulsion-type sausages rich in n-3 fatty acids[J]. LWT - Food Science and Technology, 2017, 79:496-502.
[34] BIROL K, CEM O. Effects of replacement of beef fat with interesterified palm kernel oil on the quality characteristics of Turkish dry-fermented sausage[J]. Meat Science, 2017, 131:18-24.
[35] WOOD J D, ENSER M. Chapter 20 - Manipulating the fatty acid composition of meat to improve nutritional value and meat quality[J]. New Aspects of Meat Quality, 2017:501-535.