研究报告
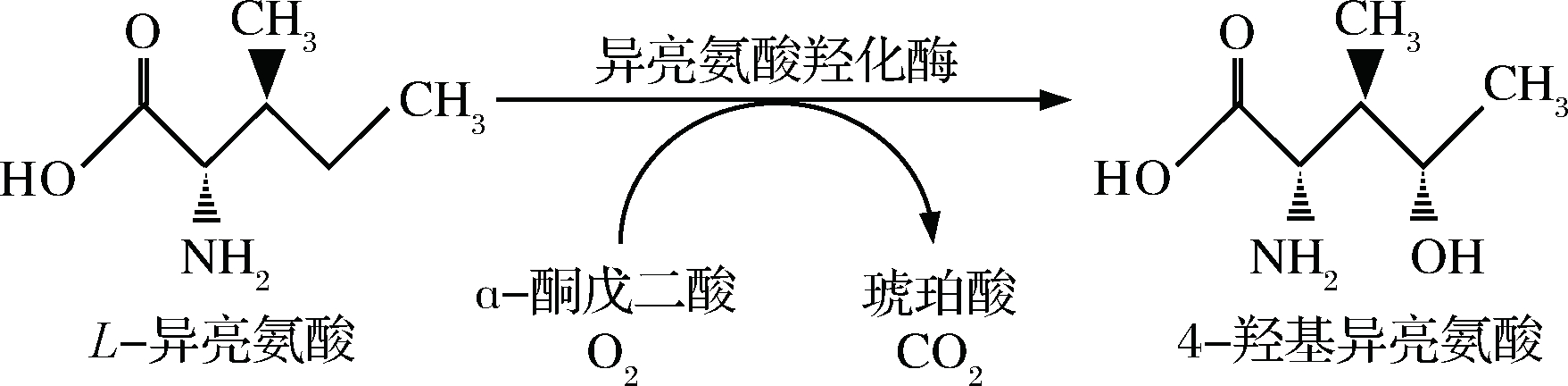
4-羟基异亮氨酸是L-异亮氨酸羟化物,具有血糖水平依赖的促进胰岛素分泌的特性,同时还有保护肝功能、促进脂肪代谢等功能,对糖尿病、高血脂、肥胖等疾病具有良好的预防和治疗效果,应用前景广阔[1-6]。目前4-羟基异亮氨酸的工业化生产主要采用胡芦巴种子提取法,但该方法存在原材料需求量大、分离纯化困难、提取率低(0.091%~0.6%)、成本高等不足[7]。而化学法反应条件苛刻、步骤多、分离困难、收率低(21%~31%)而且容易引起环境污染,因此仍停留在研究阶段[8-14]。KODERA等首次在苏云金芽孢杆菌(Bacillus thuringiensis) 中发现能够以L-异亮氨酸和α-酮戊二酸为底物、特异性催化生成4-羟基异亮氨酸的异亮氨酸羟化酶(isoleucine dioxygenase,IDO,由ido基因编码)[9] (图1)。

图1 异亮氨酸羟化酶催化生成4-羟异亮氨酸的反应示意图[8]
Fig.1 Diagram of reaction for 4-hydroxyisoleucine synthesis catalized by IDO
在前期研究中,我们利用ido基因构建了4-羟异亮氨酸生产菌株Corynebacterium glutamicum HIL18,实现其发酵法合成[14]。在获得优良性状菌株的基础上,对其发酵过程进行控制和条件优化可进一步挖掘其发酵性能。4-羟基异亮氨酸的合成不但需要L-异亮氨酸,同时还需要α-酮戊二酸、Fe2+及![]() 其合成过程需要同时兼顾天冬族氨基酸合成途径、丙酮酸代谢以及TCA循环。
其合成过程需要同时兼顾天冬族氨基酸合成途径、丙酮酸代谢以及TCA循环。
溶氧是微生物发酵过程中的重要环境因素之一,在菌体生长、产物形成和维持细胞的代谢中起着重要的作用[17-20]。溶氧均对上述代谢途径有一定影响。此外,Fe2+容易被氧化为Fe3+,在摇瓶发酵或者酶法合成4-羟基异亮氨酸时,通常添加还原性物质(如Vc)防止其氧化[21-22],然而在大规模发酵过程中不易操作,故可通过控制溶氧或补充Fe2+来保持IDO活性。本文针对上述问题,在明晰了4-羟基异亮氨酸发酵过程中溶氧水平变化规律的基础上优化了溶氧控制水平和Fe2+的添加浓度,从而实现了4-羟基异亮氨酸的高效合成。
1.1.1 菌株
4-羟基异亮氨酸生产菌株C.glutamicum HIL18,由本实验室保藏[14]。
1.1.2 培养基
种子培养基(g/L):葡萄糖 25,酵母粉 5,(NH4)2SO4 5,KH2PO4·3H2O 2,MnSO4·7H2O 0.06,玉米浆 40 mL,pH 7.0~7.5,115 ℃高压蒸汽灭菌15 min。
发酵培养基(g/L):葡萄糖100,(NH4)2SO43,KH2PO4·3H2O 0.5,MgSO4·7H2O 0.6,MnSO4·7H2O 0.015,FeSO4·7H2O 0.017,VB1 0.001,谷氨酸 3,酵母粉 0.5,玉米浆 34 mL,pH 7.0~7.5,115 ℃高压蒸汽灭菌15 min。
1.1.3 仪器与设备
BIOTECH-5JG 5L发酵罐,上海保兴生物设备工程有限公司;SBA-40D生物传感分析仪,山东省科学院生物研究所;Thermo U3000高效液相色谱仪,美国赛默飞世尔科技公司。
1.2.1 发酵试验
将活化后的C.glutamicum HIL18培养物以1%的接种量接种至含30 mL种子培养基,于32 ℃、220 r/min 振荡培养10~12 h。将上述种子培养物以10%的接种量接种至含有3 L发酵培养基的5 L自动控制发酵罐中。发酵过程中控制温度34 ℃、用氨水控制pH=7.0,通过控制通风量和搅拌转速根据实验要求调节溶氧水平,流加消泡剂消除泡沫。考察4-羟基异亮氨酸发酵过程中溶氧水平的动态变化时,通气量为3.5 L/min,搅拌转速为400 r/min。分阶段溶氧控制策略如表1所示。
表1 4-羟基异亮氨酸发酵过程中的两阶段溶氧控制策略
Table 1 The two-stage DO control strategy during fermentation process of 4-hydroxyisoleucine

溶氧控制策略溶氧水平/%0~20 h20~64 hⅠ2020Ⅱ2025Ⅲ2030Ⅳ2035
1.2.2 IDO酶活性测定
发酵过程中收集不同时间点发酵液,于4 ℃、8 000×g 离心1 min后弃上清液。细胞重悬于10 mL Tris-HCl缓冲液(100 mmol/L,pH 7.0),然后利用超声破碎仪破碎。将上述破碎物于4 ℃、13 000×g离心30 min后取上清,然后利用滤柱(PD-10 除盐柱,英国GE Healthcare公司)过滤除盐。取滤液100 μL加入900 μL含10 mmol/L α-酮戊二酸和L-异亮氨酸、5 mmol/L FeSO4和 10 mmol/L抗坏血酸的Tris-HCl缓冲液(100 mmol/L,pH 7.0),反应30 min后利用高效液相色谱仪测定4-羟基异亮氨酸浓度[14],以每毫克总蛋白每分钟催化生成的4-羟基异亮氨酸[nmol/(min·mg蛋白)]表示IDO的比活力。
1.2.3 氨基酸、葡萄糖及生物量检测
发酵过程中收集不同时间点发酵液1 mL,于4 ℃、 8 000×g离心5 min后取上清液。经2, 4-二硝基氟苯衍生后利用高效液相色谱仪测定4-羟基异亮氨酸、L-异亮氨酸(Ile)、L-丙氨酸(Ala)、L-天冬氨酸(Asp)、L-亮氨酸(Leu)、L-缬氨酸(Val)和L-赖氨酸(Lys),质量浓度。检测条件为:ZORBAX Eclipse AAA氨基酸柱(美国Agilent公司),乙腈(体积分数50%)/醋酸铵(50 mmol/L)二元梯度洗脱。采用SBA-40D生物传感分析仪(山东省科学院生物研究所)多功能谷氨酸-葡萄糖分析仪测定残糖量。发酵液经离心后,用生理盐水洗涤菌体沉淀3次,然后用适量生理盐水重悬。利用分光光度计测定其发酵液OD600,根据公式(1)计算菌体生物量:
细胞干重/(g·L-1)=0.242×OD600-0.016
(1)
4-羟基异亮氨酸的合成需要L-异亮氨酸和α-酮戊二酸,溶氧对这两种前体物均有较大影响[23-24],因此溶氧水平的控制对4-羟基异亮氨酸发酵具有至关重要的作用。考察了溶氧水平对4-羟基异亮氨酸发酵的影响,结果如图2和表2所示。
在不同溶氧水平条件下,菌株C.glutamicum HIL18的生长和产酸趋势一致:发酵初期(0~20 h)生长速率较快,20 h后逐渐下降,但4-羟基异亮氨酸的合成速率和产量逐渐提升。当溶氧水平为20%时,生物量、4-羟基异亮氨酸产量及转化率最高,分别为18.3 g/L、34.1 g/L和15.0%。当溶氧水平为30%时,发酵初期的生物量高于其余溶氧水平,但随后生长速率迅速下降,其原因可能是尽管溶氧水平的升高提高了生长速率,但使得菌体细胞过早衰老,发酵终止时其生物量、4-羟基异亮氨酸产量分别为13.5 g/L和24.5 g/L,高于溶氧水平为10%;但其转化率低于后者,其原因可能是由于葡萄糖的消耗除用于合成4-羟 基异亮氨酸外,更多用于菌体细胞生长和呼吸作用。溶氧水平为20%时,主要副产物L-天冬氨酸、L-丙氨酸、L-缬氨酸、L-亮氨酸、L-赖氨酸和L-异亮氨酸均高于溶氧水平为10%;而溶氧水平为30%时,上述副产物最低。由此推测,适当的溶氧水平(20%)提高了TCA循环代谢流,从而为4-羟基异亮氨酸的合成提供更多的α-酮戊二酸;但当溶氧水平过高(30%)时,TCA循环代谢流进一步增强,使得L-异亮氨酸和α-酮戊二酸代谢不平衡,不利于4-羟基异亮氨酸的合成。
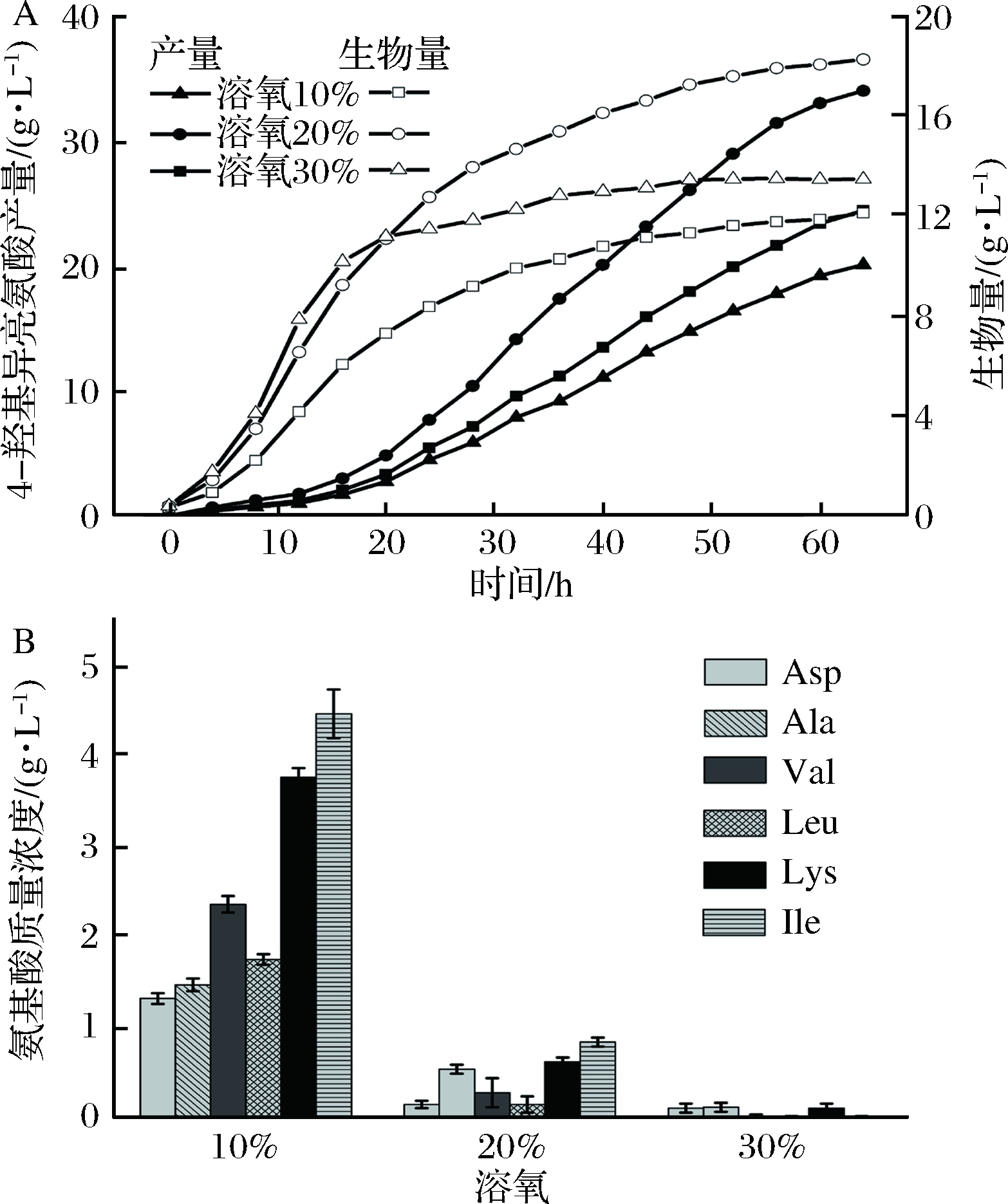
A-4-羟基异亮氨酸产量及生物量;B-氨基酸质量浓度
图2 溶氧水平对4-羟基异亮氨酸发酵的影响
Fig.2 Effects of DO levels on 4-hydroxyisoleucine fermentation
表2 溶氧对4-羟基异亮氨酸发酵参数的影响
Table 2 Effect of DO levels on parameters of 4-hydroxyisoleucine fermentation

发酵参数溶氧/%1020304-羟基异亮氨酸产量/(g·L-1)20.134.124.5生物量/(g·L-1)12.118.313.5耗糖量/(g·L-1)162.1226.8218.8转化率/%12.415.011.2单位菌体产量/(g· g-1)1.71.91.8发酵强度/[g·(L·h)-1]0.30.50.4
IDO属于Fe2+和α-酮戊二酸依赖型双加氧酶家族,故催化4-羟基异亮氨酸合成时需要O2[9, 25]。由图2-A可知,C.glutamicum HIL18的最高生长速率和4-羟基异亮氨酸的最高合成速率分别于发酵初期和中期,可见4-羟基异亮氨酸的合成为非生长依赖型。综上,推测在发酵过程中C.glutamicum HIL18对溶氧的需求会有所变化。因此考察了4-羟基异亮氨酸发酵过程中溶氧水平的动态变化,结果如图3所示。溶氧水平于0~10 h迅速下降,于10~20 h缓慢下降,该阶段以菌体生长为主,4-羟基异亮氨酸合成速率逐渐提高。溶氧于20~40 h再次快速下降,该阶段菌体生长速率显著下降,但4-羟基异亮氨酸合成速率和产量迅速提升。40 h后溶氧水平趋于稳定,菌体生长达到稳定期,4-羟基异亮氨酸合成量持续增加,但其合成速率显著降低,其原因可能是过低的溶氧难以满足4-羟基异亮氨酸合成的需求。由此可见,发酵中期及后期时,C.glutamicum HIL18对氧需求量进一步升高。发酵结束时,4-羟基异亮氨酸产量和菌体生物量分别达到15.7 g/L和15.4 g/L。
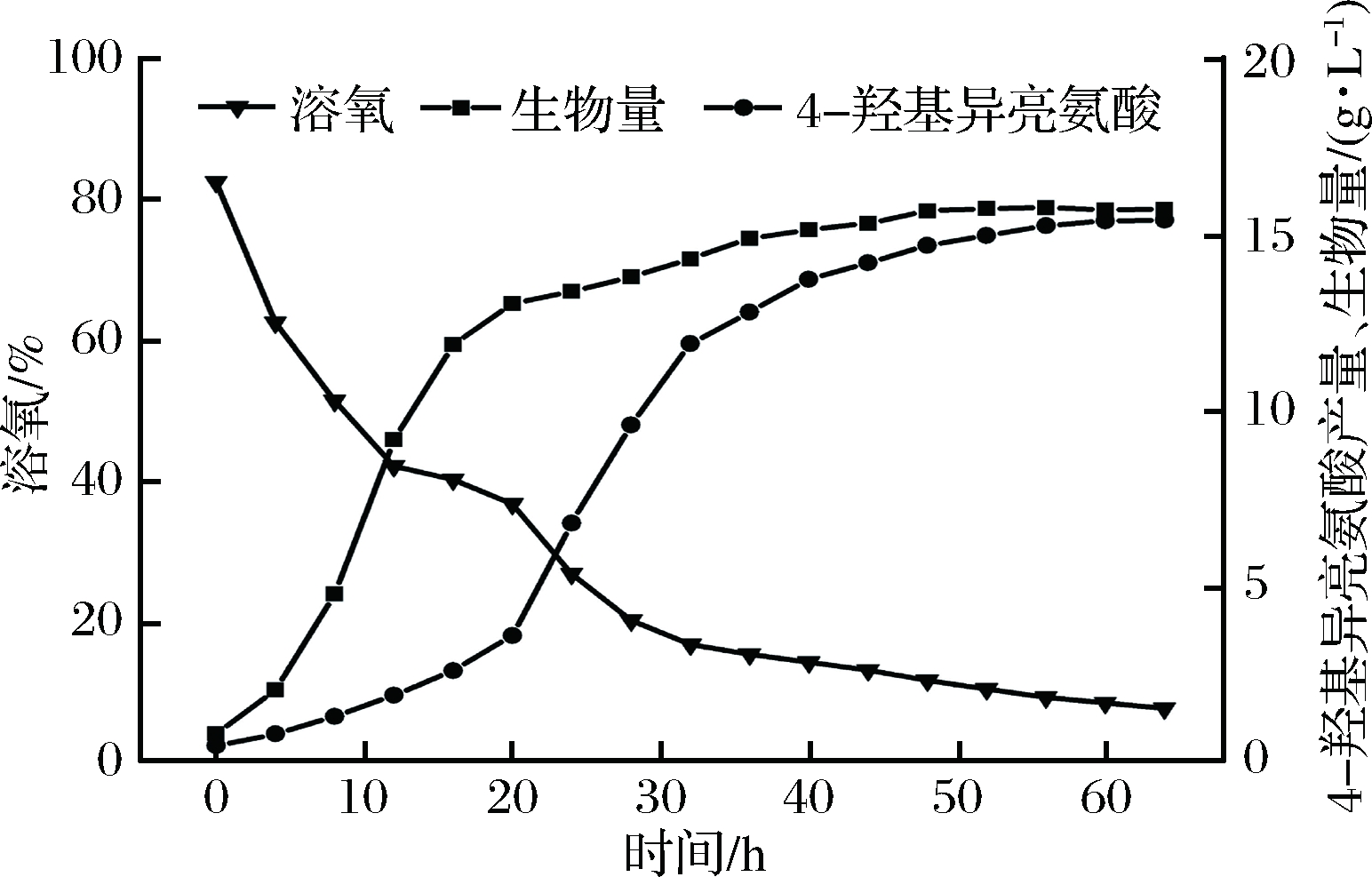
图3 4-羟基异亮氨酸发酵过程中溶氧水平动态变化
Fig.3 Dynamics of DO levels during 4-hydroxyisoleucine fermentation
2.3.1 两阶段溶氧水平优化
由图3可知,4-羟基异亮氨酸发酵过程中对氧的需求不同,即发酵中期和后期(20~64 h)较发酵初期(0~20 h)需氧量高。因此,控制发酵过程中各阶段的溶氧水平,可满足C.glutamicum HIL18对氧的需求,并有望进一步提高4-羟基异亮氨酸的产量。结合结果2.1和2.2,提出4种分阶段溶氧控制策略(表1),并考察其对4-羟基异亮氨酸发酵的影响。结果如图4和表3所示。
控制策略Ⅲ时,于发酵中期和后期4-羟基异亮氨酸的产酸速率高于其他策略,其终产量达到最高值38.7 g/L,其次依次为策略Ⅱ、Ⅰ和Ⅳ;然而控制策略Ⅳ条件下,生物量最高,为22.1 g/L,其次依次为策略Ⅲ、Ⅱ和Ⅰ。此外,还可知溶氧控制策略Ⅲ条件下,葡萄糖消耗量(255.9 g/L)最大。由此可见,不同的溶氧控制策略导致菌体生物量和4-羟基异亮氨酸产量差异较大。发酵前期溶氧控制在20%、后期控制在30%时效果最佳。这可能与细胞实际需氧量吻合,即发酵初始阶段,细胞生长所需溶氧相对少,4-羟基异亮
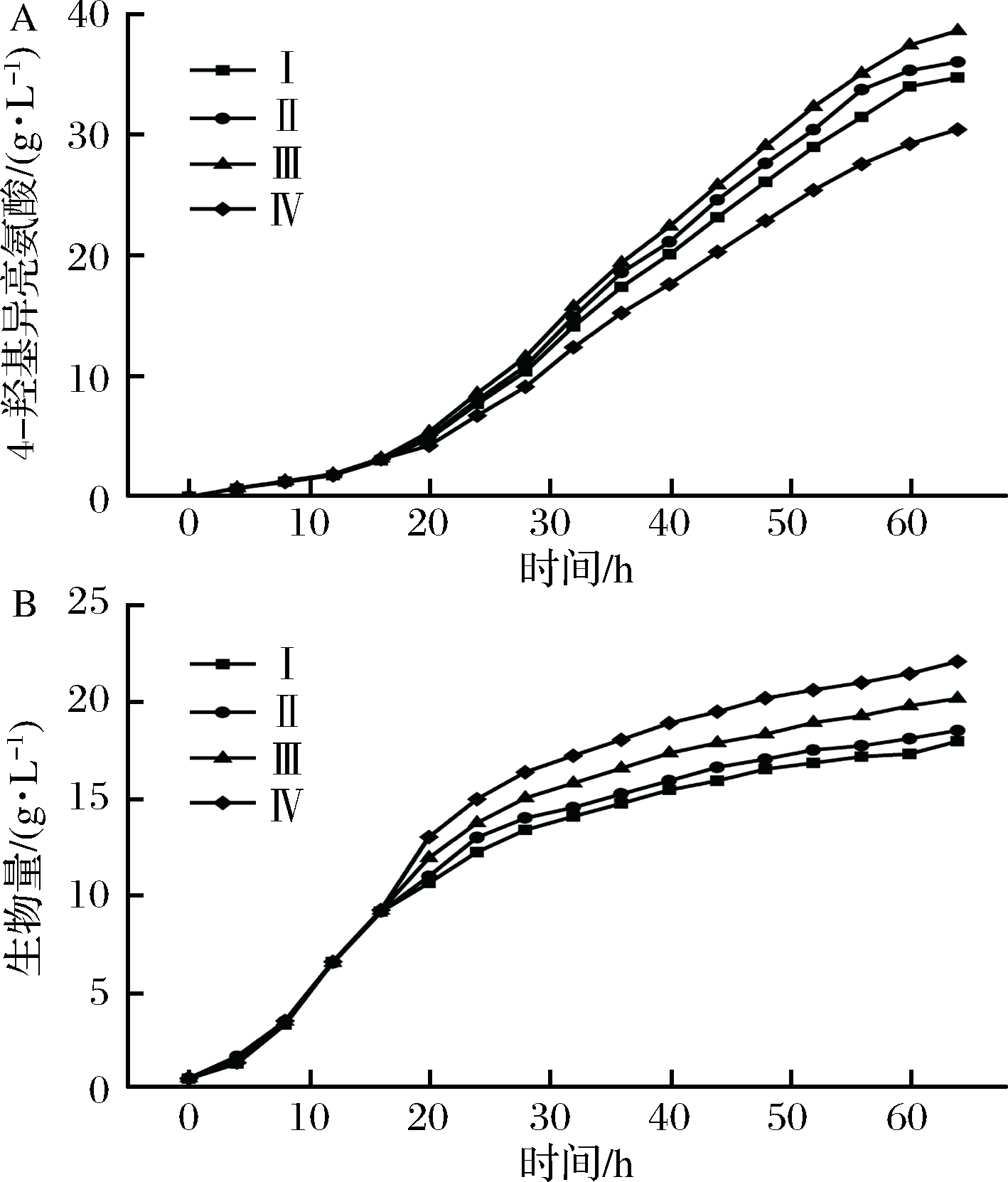
A-4-羟基异亮氨酸产量; B-生长曲线
图4 溶氧控制策略对4-羟基异亮氨酸发酵的影响
Fig.4 Effects of DO control strategies on 4-hydroxyisoleucine fermentation
表3 溶氧控制策略对4-羟基异亮氨酸发酵参数的影响
Table 3 Effects of DO control strategies on parameters of 4-hydroxyisoleucine fermentation
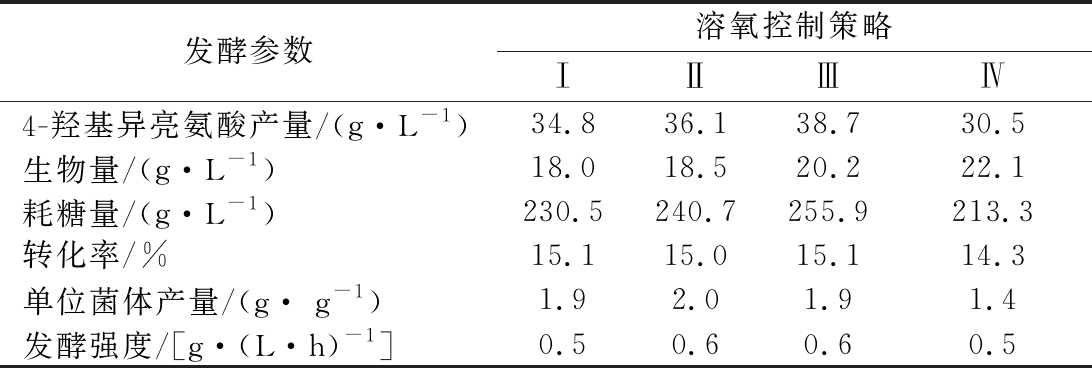
发酵参数溶氧控制策略ⅠⅡⅢⅣ4-羟基异亮氨酸产量/(g·L-1)34.836.138.730.5生物量/(g·L-1)18.018.520.222.1耗糖量/(g·L-1)230.5240.7255.9213.3转化率/%15.115.015.114.3单位菌体产量/(g· g-1)1.92.01.91.4发酵强度/[g·(L·h)-1]0.50.60.60.5
氨酸合成代谢速率低,从而需要较低的氧气供应;发酵中期和后期4-羟基异亮氨酸合成速率增加,故氧气需求量提高。
2.3.2 溶氧转变时间对4-羟基异亮氨酸发酵的影响
分别于16、18、20、22和24 h提高溶氧水平至30%,考察其对4-羟基异亮氨酸发酵的影响。结果如表4所示。
表4 溶氧转变时间对4-羟基异亮氨酸发酵参数的影响
Table 4 Effects of DO shift time on parameters of 4-hydroxyisoleucine fermentation
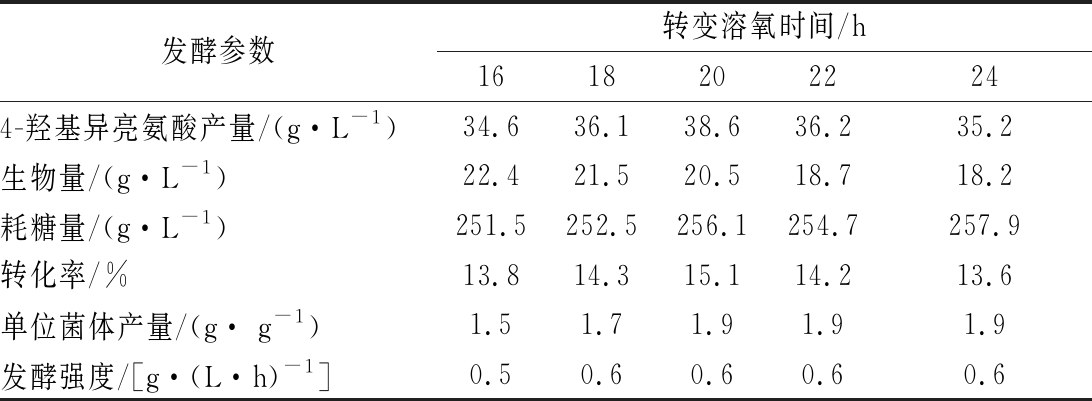
发酵参数转变溶氧时间/h16182022244-羟基异亮氨酸产量/(g·L-1)34.636.138.636.235.2生物量/(g·L-1)22.421.520.518.718.2耗糖量/(g·L-1)251.5252.5256.1254.7257.9转化率/%13.814.315.114.213.6单位菌体产量/(g· g-1)1.51.71.91.91.9发酵强度/[g·(L·h)-1]0.50.60.60.60.6
溶氧转变时间为16、18和20 h时,4-羟基异亮氨酸产量依次升高, 20 h时其产量最高。溶氧转变时间为22和24 h时,4-羟基异亮氨酸产量降低。可见,20 h时提高溶氧至30%最有利于4-羟基异亮氨酸的合成。
2.4.1 FeSO4初始浓度对4-羟基异亮氨酸发酵的影响
如前所述,IDO在催化4-羟基异亮氨酸合成过程需要Fe2+,研究表明Fe2+浓度对其活性影响显著[9,25-26]。Fe2+在发酵过程中容易被O2氧化,不利于IDO催化L-异亮氨酸合成4-羟基异亮氨酸。考察了FeSO4初始浓度对4-羟基异亮氨酸发酵的影响,结果如表5所示。随着FeSO4浓度的增加,4-羟基异亮氨酸的合成量提高,当其浓度为65 μmol/L时,4-羟基异亮氨酸的产量达到41.5 g/L,表明该条件下有利于IDO活性的保持。当FeSO4浓度高于65 μmol/L时,4-羟基异亮氨酸的产量不再提高。而FeSO4浓度对生物量无明显影响。
表5 FeSO4初始浓度对4-羟基异亮氨酸发酵参数的影响
Table 5 Effects of primary FeSO4 concentration on parameters of 4-hydroxyisoleucine fermentation
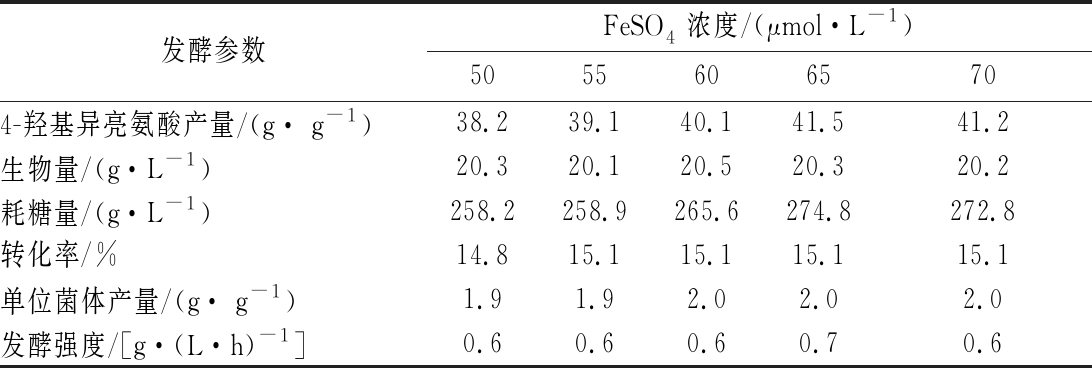
发酵参数FeSO4浓度/(μmol·L-1)50556065704-羟基异亮氨酸产量/(g· g-1)38.239.140.141.541.2生物量/(g·L-1)20.320.120.520.320.2耗糖量/(g·L-1)258.2258.9265.6274.8272.8转化率/%14.815.115.115.115.1单位菌体产量/(g· g-1)1.91.92.02.02.0发酵强度/[g·(L·h)-1]0.60.60.60.70.6
2.4.2 发酵过程中添加FeSO4对4-羟基异亮氨酸发酵的影响
由于在发酵20 h后溶氧水平提升,Fe2+可能易被O2氧化为Fe3+,不利于IDO活性的保持。检测了发酵过程中IDO的活性,结果如图5所示。
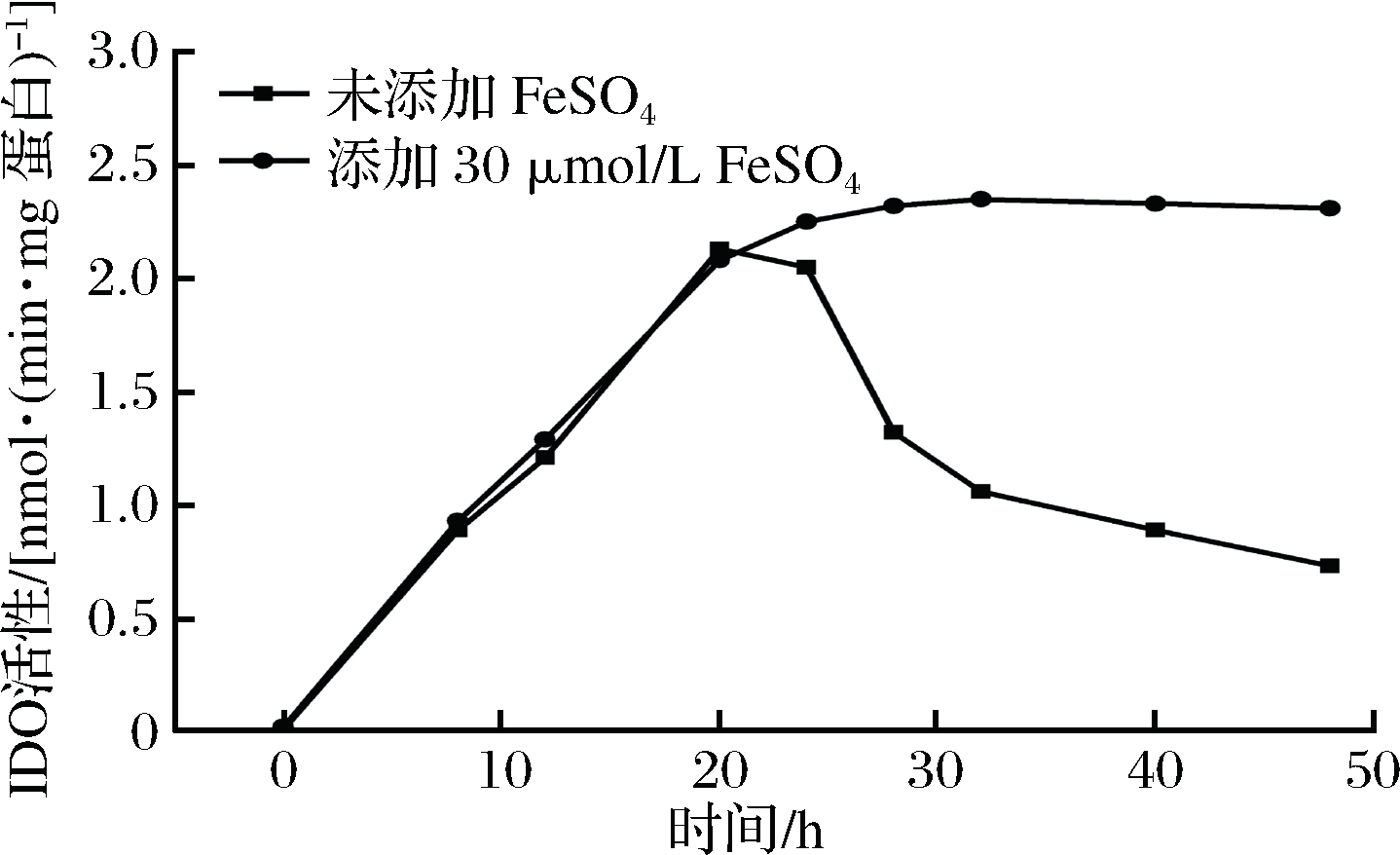
图5 发酵过程中添加FeSO4对IDO活性的影响
Fig.5 Effects of FeSO4 addition during fermentation process on IDO activity
随着发酵时间的延长,IDO活性持续提高,但24 h 时IDO的活性降低,随后剧烈降低,由此推测发酵20 h后,随着溶氧水平的提升,部分Fe2+被氧化,致使IDO活性下降,影响4-羟基异亮氨酸的合成。因此考察了20 h添加不同浓度FeSO4对4-羟基异亮氨酸的影响。结果如表6所示,FeSO4添加量为10 μmol/L 对4-羟基异亮氨酸产量无明显影响;FeSO4 添加量为30 μmol/L时,4-羟基异亮氨酸产量为43.4 g/L, 提高5.6%;但其高于30 μmol/L时,4-羟基异亮氨酸产量不再提高。检测了该条件下IDO活性变化,结果如图5所示,于20 h添加FeSO4后,IDO活性缓慢提升,40 h后达到稳定状态。综上,FeSO4添加工艺优化后,4-羟基异亮氨酸产量提高13.6%。
表6 发酵过程添加FeSO4对4-羟基异亮 氨酸发酵参数的影响
Table 6 Effects of FeSO4 addition during fermentation process on parameters of 4-hydroxyisoleucine fermentation
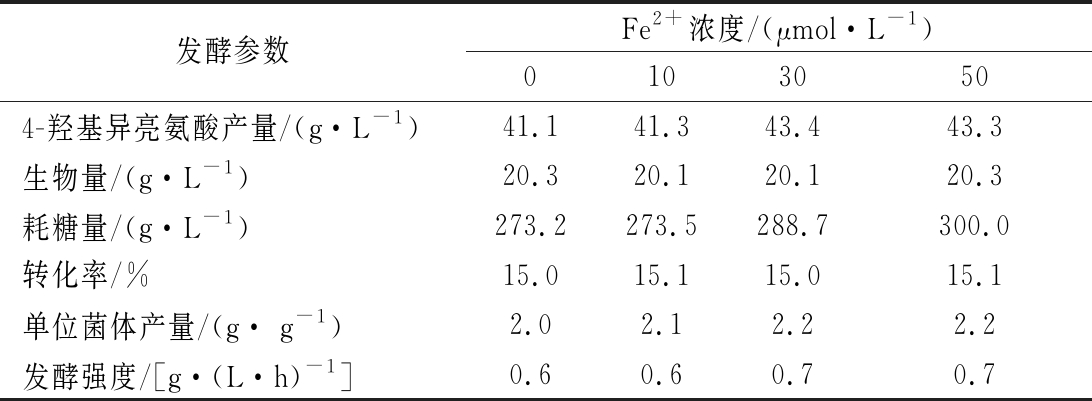
发酵参数Fe2+浓度/(μmol·L-1)01030504-羟基异亮氨酸产量/(g·L-1)41.141.343.443.3生物量/(g·L-1)20.320.120.120.3耗糖量/(g·L-1)273.2273.5288.7300.0转化率/%15.015.115.015.1单位菌体产量/(g· g-1)2.02.12.22.2发酵强度/[g·(L·h)-1]0.60.60.70.7
结合菌株C.glutamicum HIL18特性优化了溶氧水平,20%的溶氧有利于4-羟基异亮氨酸的合成。根据C.glutamicum HIL18发酵过程中对溶氧需求的变化,提出两阶段溶氧控制工艺,0~20 h、20%溶氧,20~64 h、30%溶氧,在此条件下,4-羟基异亮氨酸的产量为38.7 g/L,提高11.2%。为避免Fe2+被氧化,在两阶段溶氧控制策略的基础上采用两阶段FeSO4添加策略,初始浓度为65 mmol/L、20 h添加30 mmol/L, 4-羟基异亮氨酸的产量为43.4 g/L。采用优化后的工艺使得4-羟基异亮氨酸产量较优化前提高27.3%。本文优化了4-羟基异亮氨酸发酵过程中的溶氧水平,但其机制尚不明确。今后工作拟从基因转录及代谢流等角度开展溶氧水平影响C.glutamicum HIL18合成4-羟基异亮氨酸的机制研究,以期为进一步优化其发酵工艺提供依据。
[1] ZAFAR M I, GAO F. 4-Hydroxyisoleucine: A potential new treatment for type 2 diabetes mellitus[J]. BioDrugs, 2016, 30(4):255-262.
[2] AHMAD A, ALGHAMDI S S, MAHMOOD K, et al. Fenugreek a multipurpose crop: Potentialities and improvements[J]. Saudi Journal of Biological Sciences, 2016, 23(2): 300-310.
[3] HAERI M R, LIMAKI H K, WHITE C J B, et al. Non-insulin dependent anti-diabetic activity of (2S, 3R, 4S)-4-hydroxyisoleucine of fenugreek (Trigonella foenum-graecum) in streptozotocin-induced type I diabetic rats[J]. Phytomedicine, 2012, 19(7): 571-574.
[4] JAISWAL N, MAURYA C K, VENKATESWARLU K, et al. 4-Hydroxyisoleucine stimulates glucose uptake by increasing surface GLUT4 level in skeletal muscle cells via phosphatidylinositol-3-kinase-dependent pathway[J]. European Journal of Nutrition, 2012, 51(7): 893-898.
[5] MAURYA C K, SINGH R, JAISWAL N, et al. 4-Hydroxyisoleucine ameliorates fatty acid-induced insulin resistance and inflammatory response in skeletal muscle cells[J]. Molecular and Cellular Endocrinology, 2014, 395(1-2): 51-60.
[6] FULLER S, STEPHENS J M. Diosgenin, 4-hydroxyisoleucine, and fiber fromFenugreek: Mechanisms of actions and potential effects on metabolic syndrome[J]. Advances in Nutrition, 2015, 6(2): 189-197.
[7] FOWDEN L, PRATT H M, SMITH A. 4-Hydroxyisoleucine from seed ofTrigonella foenum-graecum[J]. Phytochemistry, 1973, 12(7): 1 707-1 711.
[8] AOUADI K, JEANNEAU E, MSADDEK M, et al. 1, 3-dipolar cycloaddition of a chiral nitrone to (E)-1, 4-dichloro-2-butene: A new efficient synthesis of (2S, 3S, 4R)-4-hydroxyisoleucine[J]. Tetrahedron Letters, 2012, 53 (23): 2 817-2 821.
[9] KODERA T, SMIRNOV S V, SAMSONOVA N N, et al. A novelL-isoleucine hydroxylating enzyme,L-isoleucine dioxygenase fromBacillus thuringiensis, produces (2S, 3R, 4S)-4-hydroxyisoleucine[J]. Biochemical and Biophysical Research Communication, 2009, 390(3): 506-510.
[10] SHI X, MIYAKAWA T, NAKAMURA A, et al. Engineering a short-chain dehydrogenase/reductase for the stereoselective production of (2S, 3R, 4S)-4-hydroxyisoleucine with three asymmetric centers[J]. Scientific Reports, 2017, 7(1): 1-13.
[11] SMIRNOV S V, KODERA T, SAMSONOVA N N, et al. Metabolic engineering ofEscherichia coli to produce (2S, 3R, 4S)-4-hydroxyisoleucine[J]. Applied Microbiology and Biotechnology, 2010, 88(3): 719-726.
[12] OGAWA J, KODERA T, SMIRNOV S V. A novelL-isoleucine metabolism inBacillus thuringiensis generating (2S, 3R, 4S)-4-hydroxyisoleucine, a potential insulinotropic and anti-obesity amino acid[J]. Applied Microbiology and Biotechnology, 2011, 89(6): 1 929-1 938.
[13] KIVERO A D, NOVIKOVA A E, SMIRNOV S V. Modification ofE.coli central metabolism to optimize the biotransformation ofL-isoleucine into 4-hydroxyisoleucine by enzymatic hydroxylation[J]. Applied Biochemistry and Microbiology, 2012, 48(7): 639-644.
[14] ZHANG C, LI Y, MA J, et al. High production of 4-hydroxyisoleucine inCorynebacterium glutamicum by multistep metabolic engineering[J]. Metabolic Engineering, 2018, 49: 287-298.
[15] SHI F, FANG H, NIU T, et al. Overexpression ofppc andlysC to improve the production of 4-hydroxyisoleucine and its precursorL-isoleucine in recombinantCorynebacterium glutamicum ssp.lactofermentum[J]. Enzyme and Microbial Technology, 2016, 87: 79-85.
[16] SHI F, ZHANG M, LI Y, et al. Sufficient NADPH supply andpknG deletion improve 4-hydroxyisoleucine production in recombinantCorynebacterium glutamicum[J]. Enzyme and Microbial Technology, 2018, 115: 1-8.
[17] DIAO J J, LI X R, PEI G S, et al. Comparative metabolomic analysis ofCrypthecodinium cohnii in response to different dissolved oxygen levels during docosahexaenoic acid fermentation[J]. Biochemical and Biophysical Research Communications, 2018, 499(4): 941-947.
[18] WEI Z H, CHEN N, LI Y J, et al. Glucose fed-batch integrated dissolved oxygen control strategy enhanced polysaccharide, total triterpenoids and inotodiol production in fermentation of a newly isolatedInonotus obliquus strain[J]. Process Biochemistry, 2018, 66: 1-6.
[19] ZHANG X L, CHEN J X, WU D, et al. Economical lipid production fromTrichosporon oleaginosus via dissolved oxygen adjustment and crude glycerol addition[J]. Bioresource Technology, 2019, 273: 288-296.
[20] 白亚磊,徐庆阳,谢希贤,等. 溶氧控制对黄色短杆菌YILW合成L-异亮氨酸的影响[J]. 天津科技大学学报,2011,26 (1): 5-9;30.
[21] 张成林,刘远,薛宁,等. 苏云金芽孢杆菌重组L-异亮氨酸羟化酶的酶学性质及其在4-羟基异亮氨酸合成中的应用[J]. 微生物学报,2014,54(8): 889-896.
[22] ZHANG C, MA J, LI Z, et al. A strategy forL-isoleucine dioxygenase screening and 4-hydroxyisoleucine production by resting cells[J]. Bioengineered, 2017, 9 (1): 72-79.
[23] 张成林,龙辉,温冰,等. 双底物指数流加和双阶段溶氧控制对谷氨酸棒状杆菌生产L-异亮氨酸的影响[J]. 食品与发酵工业,2014,40(4): 1-6.
[24] LI Y, SUN L, FENG J, et al. Efficient production of α-ketoglutarate in thegdh deletedCorynebacterium glutamicum by novel double-phase pH and biotin control strategy[J]. Bioprocess and Biosystems Engineering, 2016, 39(6):967-976.
[25] HAUSINGER R P. Fe II/alpha-ketoglutarate-dependent hydroxylases and related enzymes[J]. Critical Reviews in Biochemistry and Molecular Biology, 2004, 39(1): 21-68.
[26] SHI F, NIU T, FANG H. 4-Hydroxyisoleucine production of recombinantCorynebacterium glutamicum ssp.lactofermentum under optimal corn steep liquor limitation[J]. Applied Microbiology and Biotechnology, 2015, 99(9):3 851-3 863.