生产与科研应用
目前市场上益生菌的产品日益丰富,但是益生菌发酵饮品依然以发酵乳品为主。近年来,果蔬汁因含有丰富的维生素、膳食纤维、甾醇等营养物质,及更清爽的口感备受消费者喜爱。将益生菌与果蔬汁结合,研究开发益生菌发酵果蔬汁成为新的研究热点,并具有广泛的前景。高寅等[1]利用干酪乳杆菌发酵柑橘汁,并优化工艺,得到了富含乳酸菌的发酵柑橘汁饮品。张玉慧[2]利用植物乳杆菌和干酪乳杆菌混合发酵蓝莓汁,开发得到具有抗氧化、营养价值高、风味浓郁的新型乳酸菌饮料。但是,目前的乳酸菌发酵果蔬汁研究依然存在以下问题:(1)发酵时间长;(2)短时间发酵乳酸菌的增殖浓度低;(3)发酵用乳酸菌菌种为普通乳酸菌,不具有明确的益生功能;(4)得到的活性乳酸菌饮品,菌体在储藏期内的活性保持较差。上述几个因素均限制了益生菌发酵果蔬汁的产业化转化,目前市场上含活性益生菌的发酵果蔬汁饮品依然是空白。
植物乳杆菌作为重要的益生菌,其来源于果蔬及自然发酵果蔬食品,利用其发酵果蔬汁更具有可行性。但是,不是所有的植物乳杆菌均具有益生功能,研究证明具有特定功效的植物乳杆菌发酵果蔬汁更具有研究和开发价值。植物乳杆菌CCFM8661被证明具有抗氧化、缓解铅中毒等功能[3-6],将其应用至果蔬汁发酵开发含活性菌饮品将赋予果蔬汁新的功效。苹果汁富含单宁、膳食纤维和VA、VC、铁和磷等多种营养成分,具有增加胃肠道蠕动、润肺化痰、补充益气等功效,且制备成本低。在益生菌发酵乳产品同质化的大环境下,植物乳杆菌CCFM8661与苹果汁的结合不仅创造新的口味饮品,而且活性益生菌发酵苹果汁亦会是一种具有排铅健康功能的发酵饮品。
但是,苹果汁酸度高,pH低,且缺少益生菌发酵所需的生长因子,使得植物乳杆菌发酵时间长、增殖的益生菌活菌数低,植物乳杆菌在苹果汁中的快速增殖依然是个难题。另外发酵后苹果汁的酸度很高,pH值更低,有机酸通过酸化细胞质,损害乳酸菌的生存能力,增加维持细胞内pH和抑制酶促反应所需能量的消耗[7]。因此,在发酵果汁的低酸环境中,大多数益生菌会迅速丧失活力。而益生菌产品需拥有足够的活菌数(1×107 CFU/mL)才可发挥保健作用,保证产品在货架期内达到一定的活菌数是极其必要的。
目前有多种方式可以提高益生菌在酸性等不利环境下的耐受性,包括菌株选择、加工过程中适当的压力处理、添加蛋白或纤维素等保护剂,及制备微胶囊保护性载体等[8-11]。
本文的目的是在不明显改变苹果汁风味的前提下通过优化苹果汁营养组成,使植物乳杆菌能够在苹果汁中快速增殖,并研究不同保护剂及微胶囊化对发酵苹果汁中的植物乳杆菌在贮藏期内的活性保持。
1.1.1 菌株
植物乳杆菌CCFM 8661,江南大学食品生物技术中心保藏。
1.1.2 试剂
苹果汁,无锡橙宝食品有限公司;分离乳清蛋白(WPI90),美国Hilmar公司;抗性糊精,罗盖特(中国)精细化工有限公司;酵母提取物,安琪酵母股份有限公司;MRS培养基,青岛海博生物技术有限公司;海藻酸钠、柠檬酸钠、K2HPO4、CaCl2等,国药集团化学试剂有限公司。
GRP-9160型隔水式恒温培养箱,上海森信实验仪器有限公司;MLS-3750型高温高压灭菌锅,日本SANYO公司;K1100型全自动凯氏定氮仪,济南海能仪器股份有限公司;löser-om806m型冰点渗透压测定仪,德国löser公司;FE-20型pH计,梅特勒-托利多集团;UV-2450紫外分光光度计,日本岛津公司。
1.3.1 植物乳杆菌种子液的制备
从保菌管内吸取100 μL植物乳杆菌CCFM8661菌液,接种到5 mL MRS液体培养基中,在37 ℃条件下进行活化培养12 h,连续活化2次,将所得菌液离心,并用生理盐水洗涤1次后离心,得植物乳杆菌菌泥,将其重悬于离心前等体积生理盐水作为后续发酵种子液。
1.3.2 苹果汁理化性质的测定
(1)pH值的测定:FE-20型酸度计直接测定;
(2)总糖含量的测定:取苹果汁25 mL,采用斐林试剂法测定;
(3)蛋白质含量的测定:取苹果汁20 mL,按照K1100型全自动凯氏定氮仪说明进行测定;
(4)渗透压的测定:取澄清苹果汁100 μL,采用渗透压测定仪直接测定。
1.3.3 植物乳杆菌在添加无机盐苹果汁中生长的测定
向苹果汁中添加5 g/L K2HPO4及适量的柠檬酸钠以调节苹果汁pH至5.5,以不添加无机盐苹果汁为对照组。采用80 ℃灭菌15 min,冷却后以体积分数1%接入植物乳杆菌活化种子液,置于37 ℃下恒温培养16 h。从发酵10 h开始,每隔2 h取样通过平板菌落计数法测定发酵苹果汁中植物乳杆菌活菌数量。
1.3.4 植物乳杆菌在添加营养因子苹果汁中生长的测定
向苹果汁中添加5 g/L K2HPO4、5 g/L酵母粉及适量的柠檬酸钠以调节苹果汁pH至5.5,以添加无机盐但不添加营养因子的苹果汁为对照组。采用80 ℃ 灭菌15 min,冷却后以体积分数1%接入植物乳杆菌活化种子液,置于37 ℃下恒温培养16 h。从发酵10 h开始,每隔2 h取样通过平板菌落计数法测定发酵苹果汁中植物乳杆菌活菌数量。
1.3.5 植物乳杆菌在添加微量元素苹果汁生长的测定
向苹果汁中添加5 g/L K2HPO4、5 g/L酵母粉、0.05 g/L硫酸锰及适量的柠檬酸钠以调节苹果汁pH至5.5,以添加无机盐、营养因子但不添加硫酸锰的的苹果汁为对照组。采用80 ℃灭菌15 min,冷却后以体积分数1%接入植物乳杆菌活化种子液,置于37 ℃下恒温培养16 h。从发酵10 h开始,每隔2 h取样通过平板菌落计数法测定发酵苹果汁中植物乳杆菌活菌数量。
1.3.6 植物乳杆菌在添加不同保护剂发酵苹果汁活性保持的分析
植物乳杆菌发酵苹果汁结束后,无菌条件下分别加入灭菌的分离乳清蛋白(whey protein isolation,WPI)溶液和抗性糊精溶液,终质量浓度为10 g/L,以不添加保护剂发酵苹果汁为对照,然后置于4 ℃贮藏。分别在0、3、7、1、21 d取样通过平板菌落计数法测定植物乳杆菌在不同发酵苹果汁贮藏期间的活菌变化。
1.3.7 植物乳杆菌微胶囊的制备
配制1.0%(质量分数)的海藻酸钠溶液与5%的CaCl2溶液,在60 ℃条件下灭菌30 min,冷却至室温备用。
植物乳杆菌发酵苹果汁结束后,在无菌环境下以8 000×g离心20 min,收集苹果汁中植物乳杆菌菌泥,将上清发酵苹果汁置于4 ℃冷藏待用。
将植物乳杆菌菌泥在无菌环境下按1∶1(质量比)分别添加至无菌的100 g/L抗性糊精溶液和WPI溶液,混合均匀。混合菌悬液与无菌的1%海藻酸钠溶液按1∶5(体积比)混合均匀,用1 mL注射器将上述混合液滴入无菌的CaCl2溶液中,制备成直径2 mm的微胶囊。
1.3.8 植物乳杆菌微胶囊在发酵苹果汁贮藏期菌体活性测定
将1.3.7制备的微胶囊,无菌条件下用纱布过滤,将微胶囊重新投回发酵的苹果汁中,4 ℃低温贮藏。分别在0、3、7、14、21 d取样,用消毒后的高剪切均质机剪切微胶囊至果汁内无肉眼可见颗粒,对未做微胶囊化处理的WPI组、抗性糊精组、空白对照组进行同样转速、时间的高剪切处理,然后通过平板菌落计数法测定植物乳杆菌活菌数。
1.3.9 植物乳杆菌在不同浓度保护剂制备的微胶囊内活性保持的测定
配制100、200、300 g/L的抗性糊精溶液,按照1.3.7 的方法制备不同浓度保护剂的植物乳杆菌微胶囊,按照1.3.8的方法测定其在发酵苹果汁贮藏期菌体活性保持。
1.3.10 植物乳杆菌在不同粒径大小的微胶囊内活性保持的测定
以最适保护剂浓度和海藻酸钠浓度按照1.3.7的方法制备2和4 mm粒径的植物乳杆菌微胶囊,按照1.3.8的方法测定其在发酵苹果汁贮藏期菌体活性保持。
1.3.11 苹果汁风味物质的测定
室温下取5 g发酵苹果汁样品装入20 mL的萃取小瓶中,同时加入1 g NaCl,采用固相微萃取(solid phase microextraction,SPME)方法提取发酵苹果汁中的风味成分,萃取头是涂抹厚度为85 μm的CAR/PDMS纤维,自动进样器将萃取头插入密封的萃取瓶后,于50 ℃条件下,振荡平衡30 min;将萃取头暴露在顶部空间5 min。
气谱条件为:Rtx-WAX毛细管柱;柱子规格:30 m×0.25 mm×0.25 mm,进口温度为240 ℃,不分流,柱流速15.0 mL/min,载气为氦气;程序升温:初始温度30 ℃,保持3 min;15 ℃/min升温至225 ℃,保持5 min。
质谱条件为:离子化方式EI,发射能量为70 eV,发射电流为200 μA,检测器电压为1.4 kV,离子源温度240 ℃,质荷比30~500。化合物检索结果与NIST和Varian两个标准谱库进行匹配,相似度达到80%以上确认为目的化合物。以4 μL的0.025 g/L癸酸乙酯为内标,计算各风味物质的含量。
1.3.12 数据统计与分析
试验中总糖的测定、总氮的测定、渗透压的测定、pH的测定及生物量的测定均为3次生物学重复的平均值。实验数据平均值与标准差均采用Excel计算并作图。
植物乳杆菌的增殖需要碳源、氮源、无机盐、生长因子和微量元素。因此研究植物乳杆菌CCFM8661能否发酵苹果汁并进行富集,首先需要综合分析苹果汁的营养组成及与菌体增殖相关的理化性质。通过利用斐林试剂法、凯氏定氮法、冰点渗透压仪、pH计分别测定了苹果汁的总糖含量(115.52±0.5)g/L、总氮含量(0.02±0.0)g/L、渗透压(849±12)g/L和pH值(4.01±0.1)。
苹果汁内含有丰富的碳源,总糖含量达到(115.52±0.5) g/L,高于培养乳酸菌的MRS培养基含糖量(20 g/L), 故苹果汁中总糖含量不会成为抑制植物乳杆菌发酵的因素。而苹果汁中总氮含量为(0.02±0.0)g/L, 较低的氮含量会影响菌体的增殖,同时苹果汁中是否含有菌体增殖的生长因子亦是未知。
渗透压是影响植物乳杆菌生长的重要因素,前期的研究表明植物乳杆菌CCFM8661可耐受的最高渗透压达(2 414±25) mOsm/kg[12]。苹果汁渗透压为(849±12) mOsm/kg,故苹果汁渗透压不会限制菌体发酵增殖。
众所周知,pH值是抑制乳酸菌生长的最重要的因素。而苹果汁的pH值仅为(4.01±0.1),远低于植物乳杆菌生长最适pH值。因此,为提高植物乳杆菌在苹果汁中的增殖,首先需要适当提高发酵体系的pH值。缓冲盐和偏碱性的无机盐的添加可能利于发酵苹果中植物乳杆菌的增殖,且添加的无机盐的种类和含量应符合添加剂国家标准。
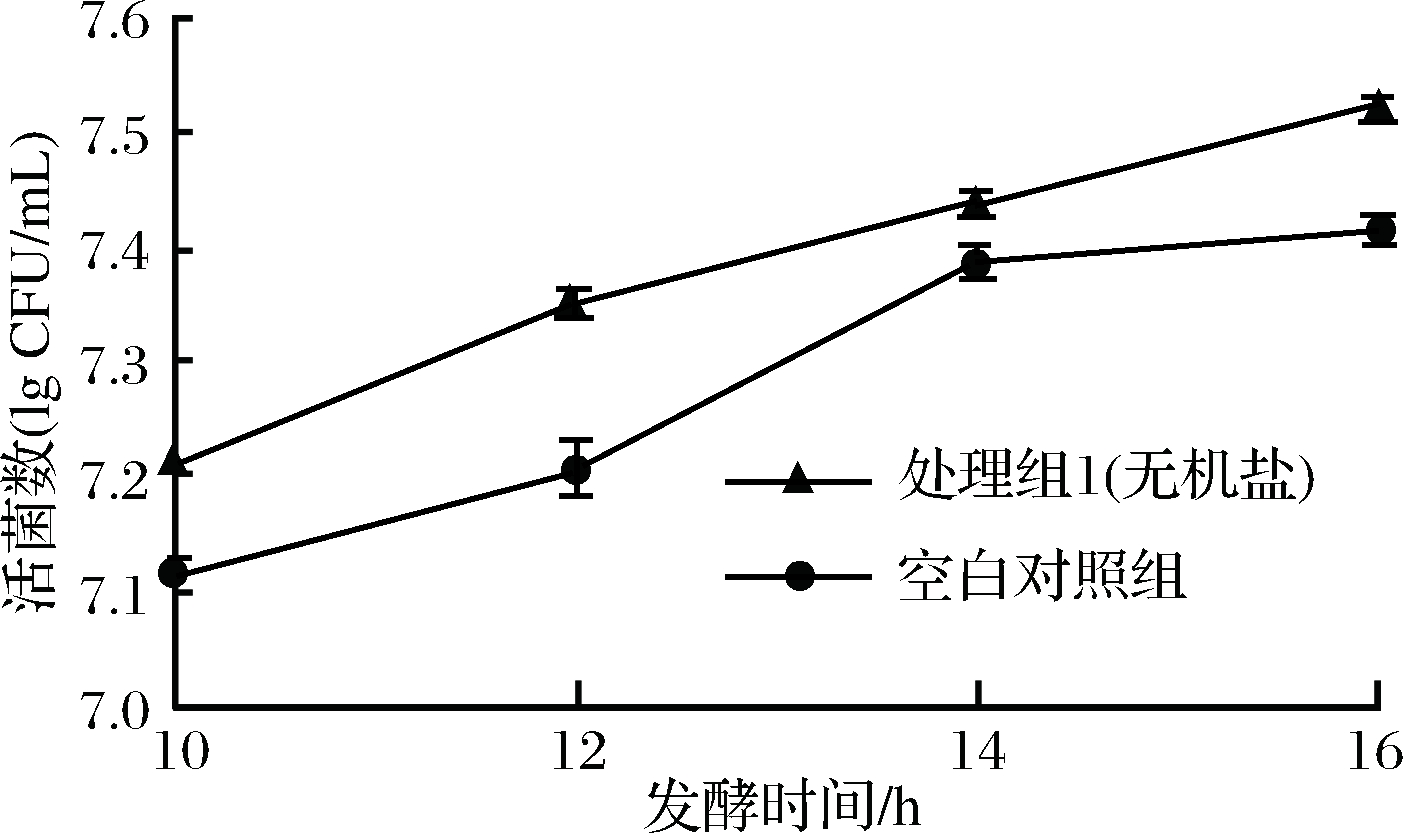
K2HPO4和柠檬酸钠被确认是可加入果汁的添加剂,二者的添加可提高苹果汁的pH和缓冲能力。实验表明,添加5 g/L K2HPO4和7 g/L柠檬酸钠的苹果汁pH值达5.5。在该条件下接菌发酵苹果汁,结果见图1。添加无机盐调整苹果汁的pH值,提高了植物乳杆菌CCFM8661的增殖,16 h时活菌数达到(3.2±0.0)×107 CFU/mL,是未处理的对照苹果汁的1.3倍。虽然无机盐的添加对植物乳杆菌CCFM8661在果汁内的增殖起到了促进作用,但效果不显著。可能氮源和生长因子的缺乏是主要的限制因素。

图1 无机盐对苹果汁中植物乳杆菌CCFM8661增殖的影响
Fig.1 Effect of inorganic salts on the growth ofLctobacillus plantarum CCFM8661 in apple juice
酵母粉不仅含有适宜植物乳杆菌增殖的氮源,且含有核苷酸、维生素等促进乳酸菌生长的重要的生长因子[13]。由图2可知,添加酵母粉后显著促进了植物乳杆菌CCFM8661在苹果汁中的增殖,在发酵12 h活菌数即达到(2.5±0.0)×109 CFU/mL,是空白对照组的100倍。酵母粉的添加是植物乳杆菌CCFM8661在苹果汁中快速增殖的显著因素,且添加量仅为5 g/L,不会对苹果汁的口感产生显著影响,是植物乳杆菌发酵苹果汁的理想助剂。

图2 酵母粉对苹果汁中植物乳杆菌CCFM8661增殖的影响
Fig.2 Effect of yeast extract on the growth ofLctobacillus plantarum CCFM8661 in apple juice
微量元素也是乳酸菌生长的关键因子,有研究表明Mn2+是乳杆菌菌体内关键酶的辅基[14],可积极促进菌体细胞的生长。苹果汁中添加适宜的微量元素Mn2+,显著提高了植物乳杆菌CCFM8661在苹果汁中的增殖(图3),在发酵12 h活菌数达到(3.4±0.2)×109 CFU/mL。
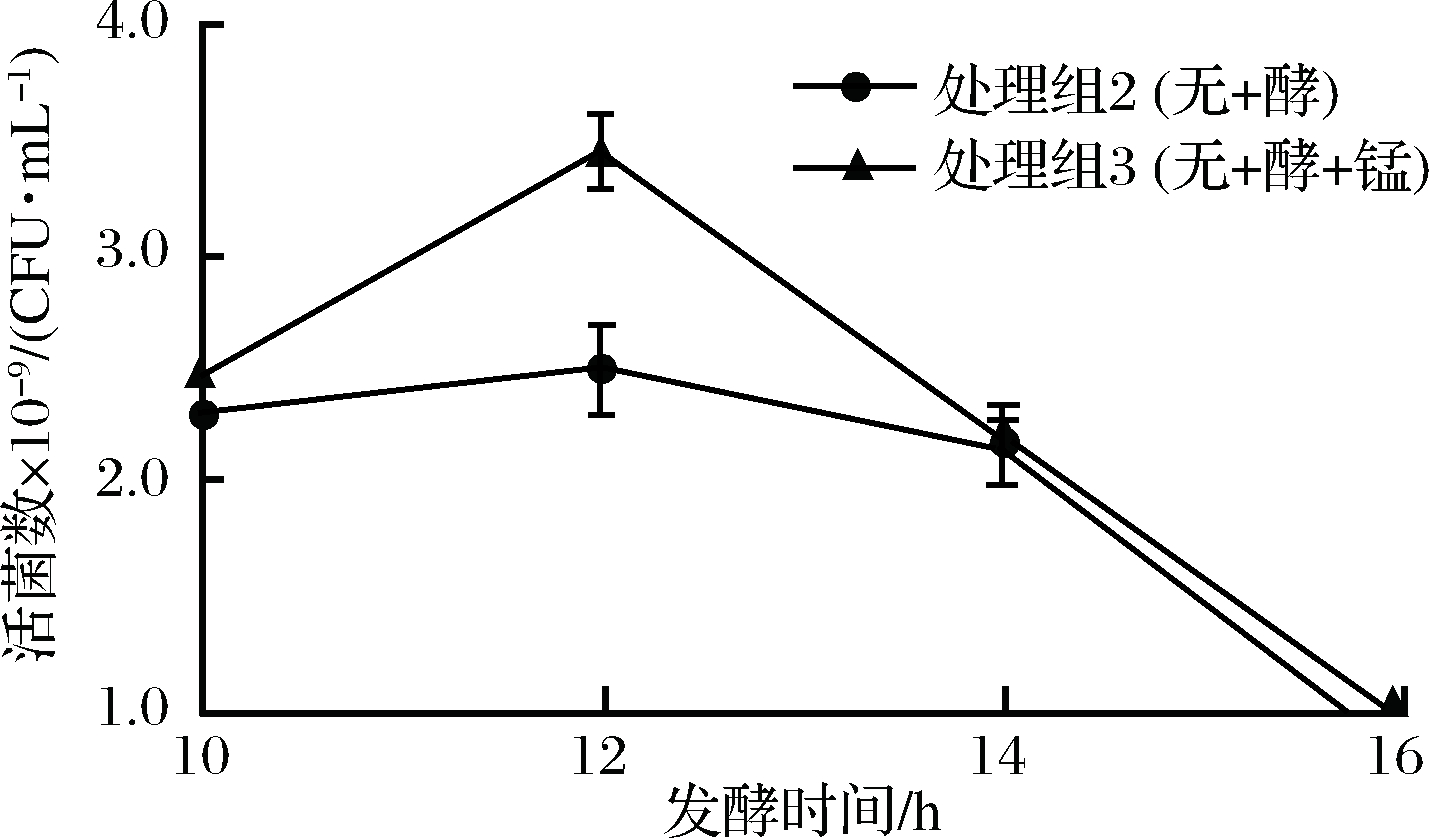
图3 锰元素对苹果汁中植物乳杆菌CCFM8661增殖的影响
Fig.3 Effect of Mn on the growth ofLctobacillus plantarum CCFM8661 in apple juice
综上,在苹果汁中添加5 g/L K2HPO4和7 g/L柠檬酸钠可调节苹果汁的初始pH值至5.5,再辅以5 g/L酵母粉和0.05 g/L MnSO4可以显著促进植物乳杆菌CCFM8661的增殖。在发酵12 h,发酵苹果汁中植物乳杆菌CCFM8661的活菌数达到(3.4±0.2)×109 CFU/mL,是空白对照组的100多倍。
苹果汁发酵结束后,有机酸积累,pH降低,条件非常不利于植物乳杆菌的存活。即使4 ℃贮藏,在发酵苹果汁中植物乳杆菌CCFM8661的活性快速损失,在贮藏期的第7天存活率迅速下降至(14±0.3)%,贮藏第21天存活率下降至(5±1.1)%。添加保护剂的发酵苹果汁中植物乳杆菌CCFM8661的存活率整体高于空白对照组,在贮藏期前7天,两者的存活率达60%左右,显著高于未加保护剂的对照组别,表明抗性糊精和分离乳清蛋白对苹果汁中的植物乳杆菌CCFM8661均有保护效果。可能因为二者所携带的氨基、羧基以及羟基可以与菌体细胞膜表面的磷脂基团或蛋白质极性基团形成氢键,降低氢离子对菌体细胞的损伤。但在贮藏期第21天,发酵苹果汁添加分离乳清蛋白组植物乳杆菌CCFM8661的存活率降至(15±2.8)%,抗性糊精组降至(20±2.0)%(图4)。 虽然相较于空白对照组均有提高,但是植物乳杆菌的活性损失超过了80%,还需要进一步提高其活性保持。
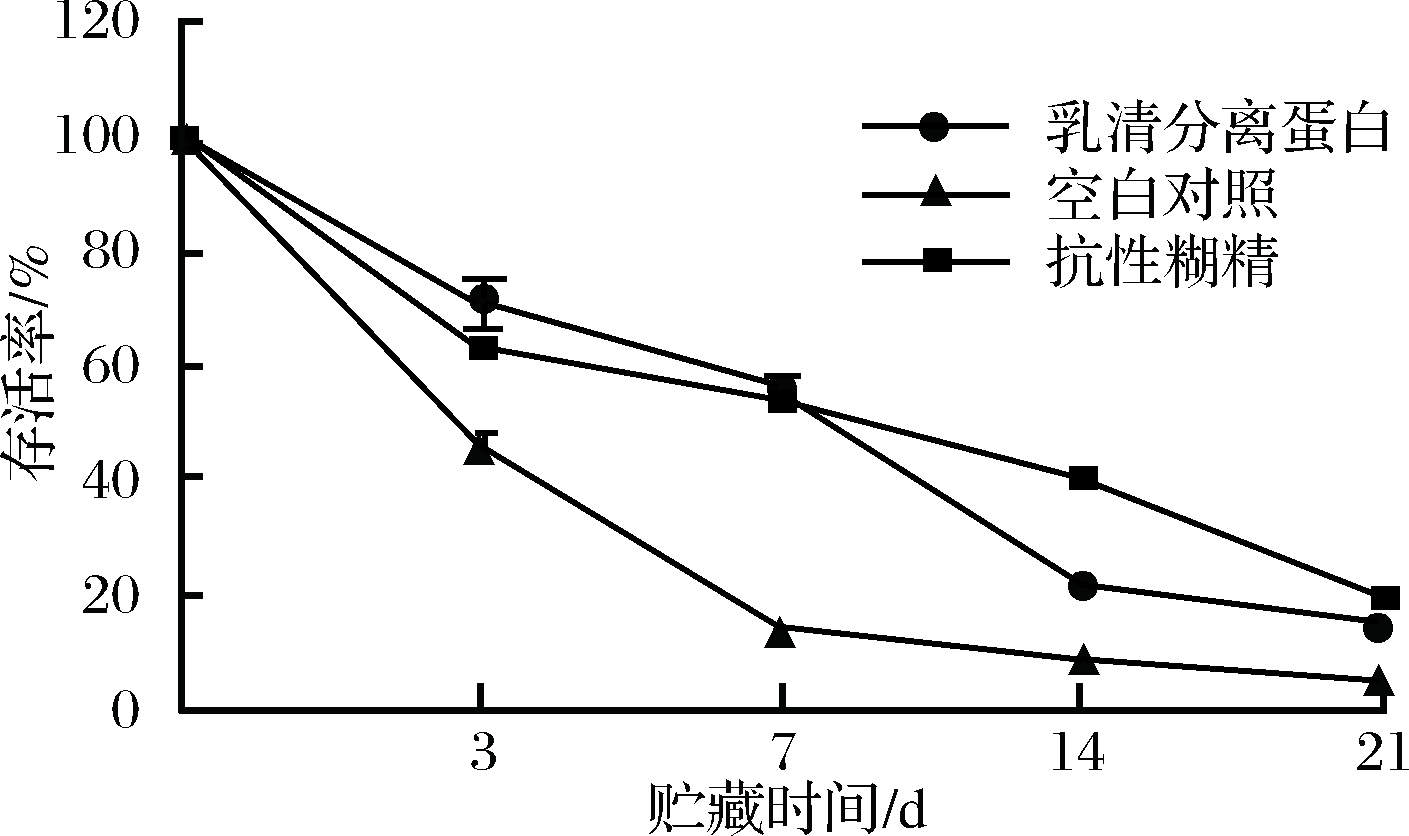
图4 保护剂对发酵苹果汁中植物乳杆菌CCFM8661贮藏期存活率的影响
Fig.4 Effect of protectant on survival rate of ofLctobacillus plantarum CCFM8661 in fermented apple juice during storage
将植物乳杆菌CCFM8661与保护剂混合后以1%海藻酸钠制备微胶囊进行包埋,将其至于发酵苹果汁。结果表明,经微胶囊化后可显著提高植物乳杆菌CCFM8661在发酵苹果汁贮藏期间的存活率(图5)。
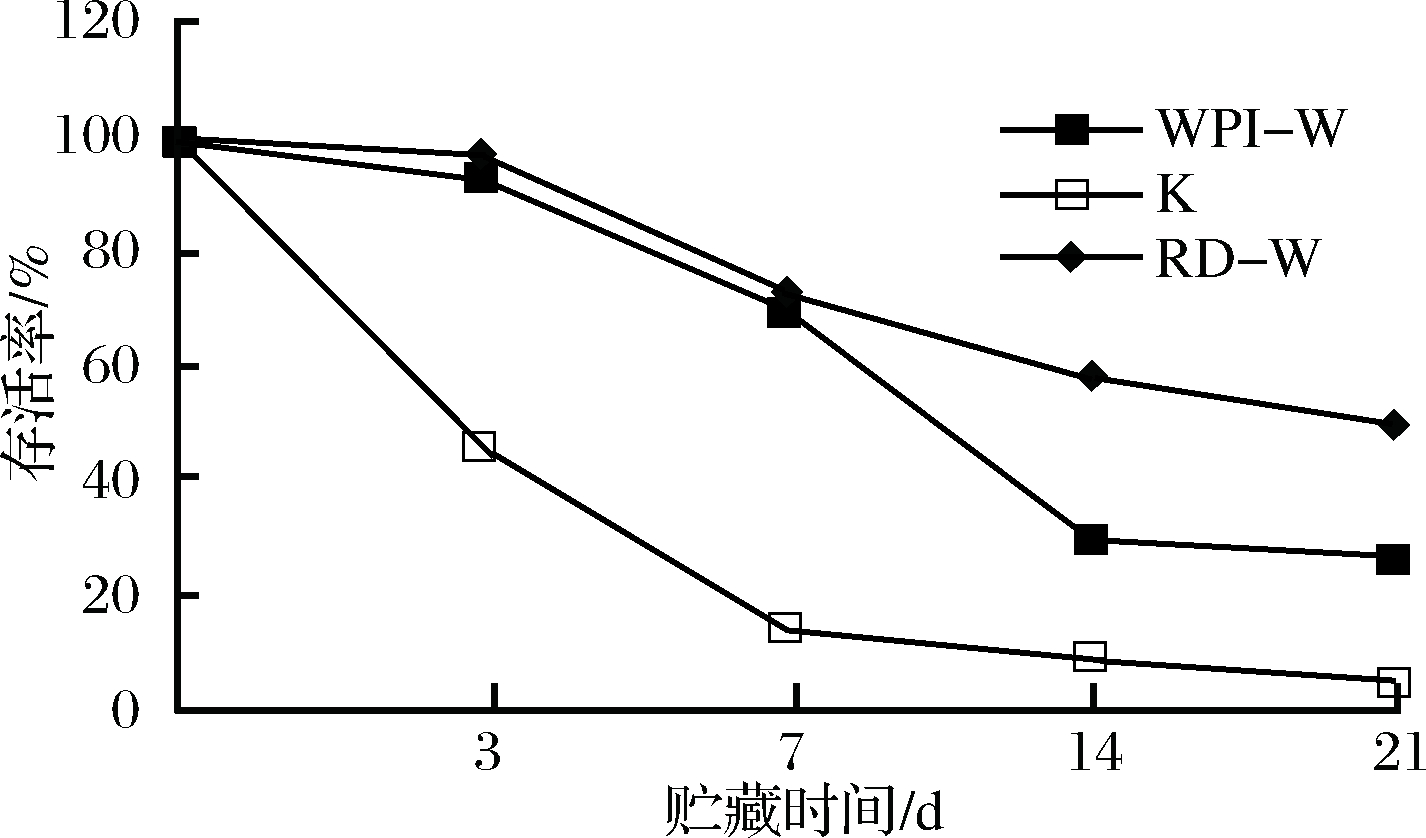
WPI-W-100 g/L分离乳清蛋白作保护剂,1%海藻酸钠进行微囊化; K-空白对照组; RD-W-100 g/L抗性糊精作保护剂,1%海藻酸钠进行微囊化
图5 微胶囊化对植物乳杆菌CCFM8661在发酵苹果汁贮藏期存活率的影响
Fig.5 Effect of microencapsulation on survival rate of ofLctobacillus plantarum CCFM8661 in fermented apple juice during storage
以分离乳清蛋白做保护剂对菌体进行的微胶囊包埋,贮藏21 d植物乳杆菌CCFM8661存活率达(27±1.8)%,高于未包埋的实验组。以抗性糊精作保护剂对菌体微胶囊包埋后,贮藏21 d植物乳杆菌CCFM8661的存活率得到更显著的提高,达到(50±1.4)%。海藻酸钠形成的微胶囊减缓了H+的侵入,微胶囊内保护剂不仅对菌体细胞有保护作用,且起到了缓冲作用,更好地延缓了植物乳杆菌CCFM8661活性的损失。基于上述分析,增加保护剂浓度或增加微胶囊粒径提高微胶囊内保护剂对H+的缓冲能力是否会进一步提高植物乳杆菌CCFM8661在贮藏期的存活率,需要进一步验证。
根据图5和图6可知,适量增加抗性糊精的浓度会提高植物乳杆菌CCFM8661在发酵苹果汁中的贮藏存活率。在图5中,10%抗性糊精制备的微胶囊在发酵苹果汁中贮藏21 d后,植物乳杆菌CCFM8661存活率为(50±1.4)%。由图6可知,提高抗性糊精质量浓度至200 g/L,制备的微胶囊在贮藏21 d时植物乳杆菌CCFM8661的存活率达(78±3.6)%,优于100 g/L的保护效果。但是,继续增加抗性糊精的质量浓度至300 g/L时,保护效果会下降,可能是因为渗透压的升高影响了菌体的活性,但是300 g/L的抗性糊精组依然优于100 g/L的实验组。综上,适当提高微胶囊内保护剂的浓度可提高其对菌体在发酵苹果汁贮藏期的活性保持,但浓度应适宜,浓度太高会影响保护效果。
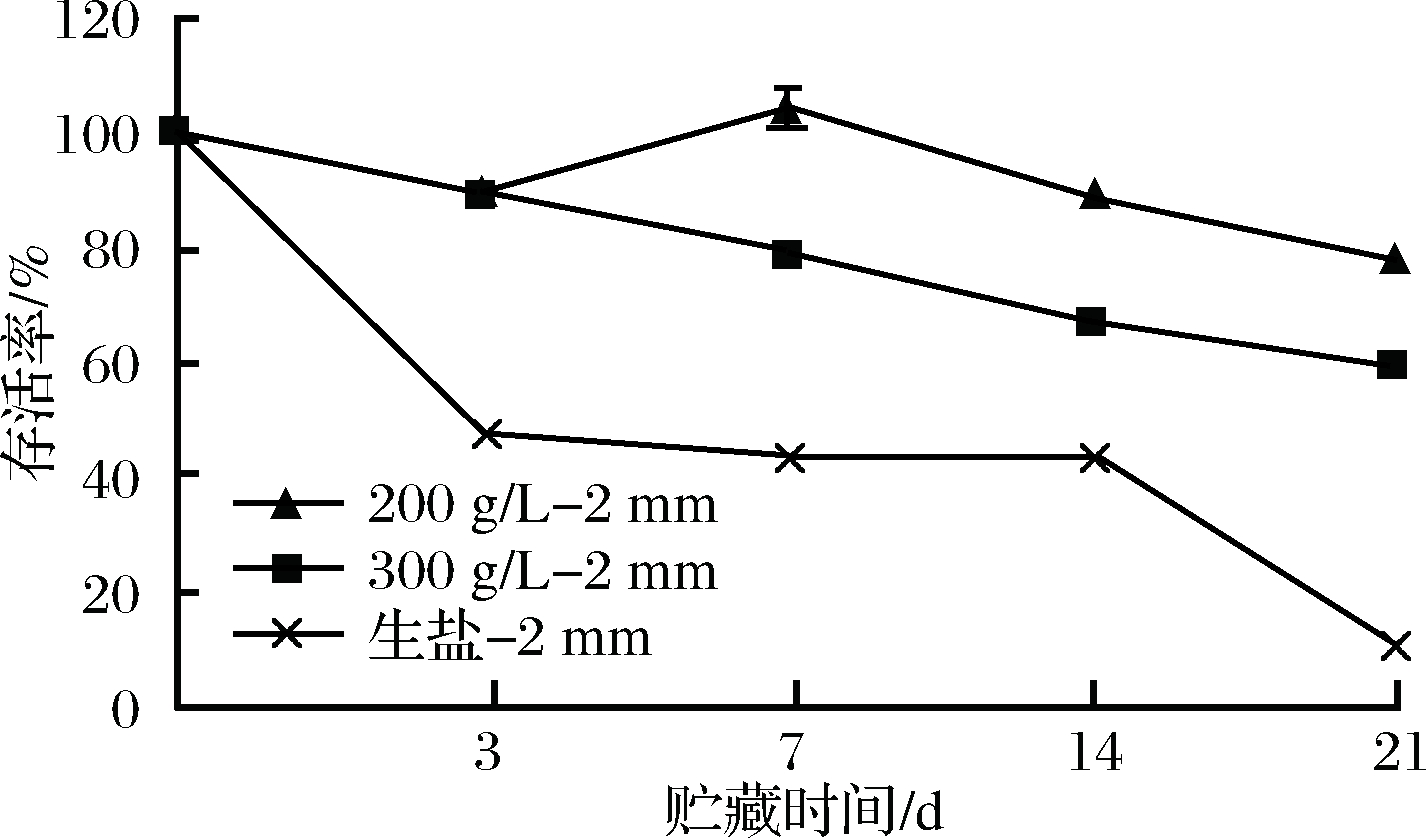
图6 不同浓度保护剂制备的微胶囊对植物乳杆菌CCFM8661在发酵苹果汁贮藏期存活率的影响
Fig.6 Effect of microcapsules prepared with different concentrations of protectant on survival rate of ofLctobacillus plantarum CCFM8661 in fermented apple juice during storage
由图7知,以200 g/L抗性糊精做保护剂,制备直径4 mm的微胶囊,其提高了植物乳杆菌CCFM8661在发酵苹果汁中的贮藏存活率,贮藏21 d后存活率达(81±3.1)%;且在整个贮藏期内,4 mm粒径的实验组菌体存活率普遍高于2 mm实验组。说明适当增加粒径对植物乳杆菌CCFM8661在整个货架期内的活性保持有积极作用。亦验证了2.6中的推测,随着粒径增大,微胶囊内保护剂的量增加,提高了其对菌体的保护作用。

图7 微胶囊粒径对植物乳杆菌CCFM8661在发酵苹果汁贮藏期存活率的影响
Fig.7 Effect of microcapsule size on survival rate of ofLctobacillus plantarum CCFM8661 in fermented apple juice during storage
根据表1,苹果汁经植物乳杆菌CCFM8661发酵后风味得到显著改善,具有辛辣气味的丙酮、窒息性气味的丁醛、令人不愉悦气味的三氯甲烷、苯酚等不好的风味物质在发酵后含量明显降低;而具有果香味、坚果香味、芳香味等香味的庚酮、苯甲醛、2-十一酮、嘧啶等,及对人体健康有益的乙酸、丁酸、癸烯酸等经发酵后显著提高。且发酵后添加抗性糊精作为保护剂,并未对发酵苹果汁的风味物质产生显著影响。
表1 苹果汁的风味物质
Table 1 The falavor of apple juice
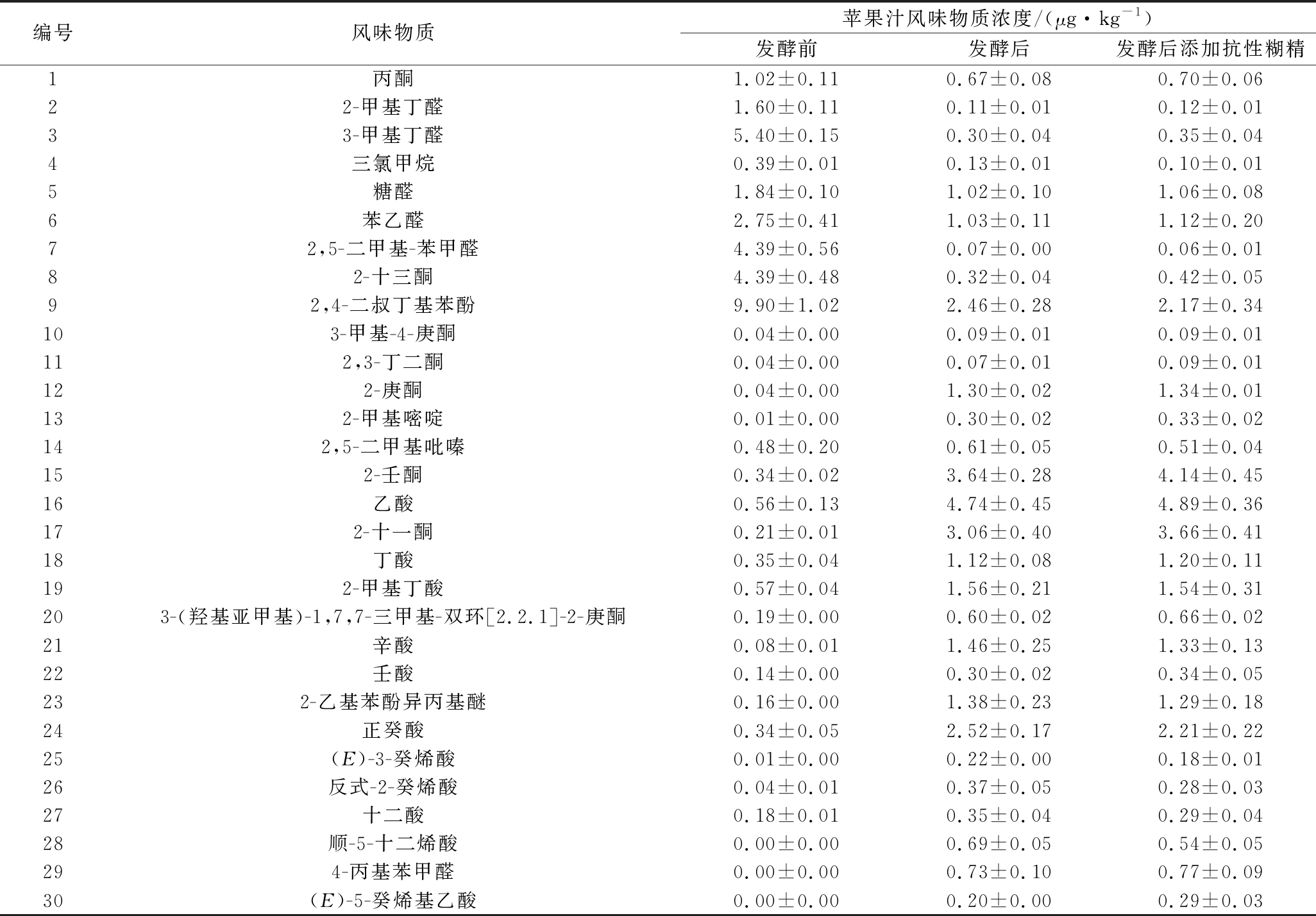
编号风味物质苹果汁风味物质浓度/(μg·kg-1)发酵前发酵后发酵后添加抗性糊精1丙酮1.02±0.110.67±0.080.70±0.0622-甲基丁醛1.60±0.110.11±0.010.12±0.0133-甲基丁醛5.40±0.150.30±0.040.35±0.044三氯甲烷0.39±0.010.13±0.010.10±0.015糖醛1.84±0.101.02±0.101.06±0.086苯乙醛2.75±0.411.03±0.111.12±0.2072,5-二甲基-苯甲醛4.39±0.560.07±0.000.06±0.0182-十三酮4.39±0.480.32±0.040.42±0.0592,4-二叔丁基苯酚9.90±1.022.46±0.282.17±0.34103-甲基-4-庚酮0.04±0.000.09±0.010.09±0.01112,3-丁二酮0.04±0.000.07±0.010.09±0.01122-庚酮0.04±0.001.30±0.021.34±0.01132-甲基嘧啶0.01±0.000.30±0.020.33±0.02142,5-二甲基吡嗪0.48±0.200.61±0.050.51±0.04152-壬酮0.34±0.023.64±0.284.14±0.4516乙酸0.56±0.134.74±0.454.89±0.36172-十一酮0.21±0.013.06±0.403.66±0.4118丁酸0.35±0.041.12±0.081.20±0.11192-甲基丁酸0.57±0.041.56±0.211.54±0.31203-(羟基亚甲基)-1,7,7-三甲基-双环[2.2.1]-2-庚酮0.19±0.000.60±0.020.66±0.0221辛酸0.08±0.011.46±0.251.33±0.1322壬酸0.14±0.000.30±0.020.34±0.05232-乙基苯酚异丙基醚0.16±0.001.38±0.231.29±0.1824正癸酸0.34±0.052.52±0.172.21±0.2225(E)-3-癸烯酸0.01±0.000.22±0.000.18±0.0126反式-2-癸烯酸0.04±0.010.37±0.050.28±0.0327十二酸0.18±0.010.35±0.040.29±0.0428顺-5-十二烯酸0.00±0.000.69±0.050.54±0.05294-丙基苯甲醛0.00±0.000.73±0.100.77±0.0930(E)-5-癸烯基乙酸0.00±0.000.20±0.000.29±0.03
(1)苹果汁中缺乏适宜乳酸菌增殖的氮源和微量元素,且pH值太低,植物乳杆菌CCFM8661无法在苹果汁中快速生长。
(2)苹果汁中添加5 g/L K2HPO4和7 g/L柠檬酸钠,可调整苹果汁pH值至5.5,基于此添加5 g/L酵母粉和适量微量元素锰,可显著促进植物乳杆菌CCFM8661在苹果汁中的增殖。发酵12 h后,苹果汁中植物乳杆菌CCFM8661的活菌数达(3.4±0.2)×109 CFU/mL。
(3)发酵苹果汁中添加分离乳清蛋白或抗性糊精均会提高植物乳杆菌CCFM8661在4 ℃贮藏期的活性保持,且抗性糊精效果优于分离乳清蛋白,且抗性糊精的添加不会对发酵苹果汁风味产生影响。
(4)以分离乳清蛋白作为保护剂,以海藻酸钠为壁材,包埋菌体与保护剂的混合液制备微胶囊,可显著提高植物乳杆菌CCFM8661在发酵果汁中储藏期间的存活率。
(5)微胶囊内保护剂的浓度和微胶囊粒径大小均会影响其对植物乳杆菌CCFM8661在发酵苹果汁贮藏期的存活率,适当增加保护剂浓度和粒径大小会进一步提高微胶囊的保护效果。
[1] 高寅, 李汴生,林伟锋,等. 干酪乳杆菌对柑橘汁发酵的工艺研究[J]. 现代食品科技, 2011, 27(8): 946-948;934.
[2] 张玉慧. 乳酸菌发酵蓝莓果汁的工艺研究[D]. 沈阳:沈阳农业大学, 2016.
[3] TIAN F, ZHAI Q, ZHAO J, et al.Lactobacillus plantarum CCFM8661 alleviates lead toxicity in mice[J]. Biological Trace Element Research, 2012, 150(1-3): 264-271.
[4] YIN R, ZHAI Q, YU L, et al. The binding characters study of lead removal byLactobacillus plantarum CCFM8661[J]. European Food Research and Technology, 2016, 242(10): 1 621-1 629.
[5] ZHAI Q, WANG H, TIAN F, et al. DietaryLactobacillus plantarum supplementation decreases tissue lead accumulation and alleviates lead toxicity in Nile tilapia (Oreochromis niloticus)[J]. Aquaculture Research, 2017, 48(9): 5 094-5 103.
[6] TIAN F, ZHAI Q, SUN Y, et al. A preliminary study of microbiological properties and applications ofLactobacillus plantarum CCFM8661[J]. Journal of Food Safety and Quality, 2014, 5(4): 1 010-1 015.
[7] CARPENTER C, BROADBENT J R. External concentration of organic acid anions and pH: Key independent variables for studying how organic acids inhibit growth of bacteria in mildly acidic foods[J]. Journal of Food Science, 2009, 74(1): R12-R15.
[8] SAARELA M, ALAKOMI H, M TTÖ J, et al. Improving the storage stability ofBifidobacterium breve in low pH fruit juice[J]. International Journal of Food Microbiology, 2011, 149(1): 106-110.
TTÖ J, et al. Improving the storage stability ofBifidobacterium breve in low pH fruit juice[J]. International Journal of Food Microbiology, 2011, 149(1): 106-110.
[9] SHAH N, DING W, FALLOURD M, et al. Improving the stability of probiotic bacteria in model fruit juices using vitamins and antioxidants[J]. Journal of Food Science, 2010, 75(5): M278-M282.
[10] NUALKAEKUL S, SALMERON I, CHARALAMPOPOULOS D. Investigation of the factors influencing the survival ofBifidobacterium longum in model acidic solutions and fruit juices[J]. Food Chemistry, 2011, 129(3): 1 037-1 044.
[11] PIMENTEL T C, MADRONA G S, GARCIA S, et al. Probiotic viability, physicochemical characteristics and acceptability during refrigerated storage of clarified apple juice supplemented withLactobacillus paracasei ssp.paracasei and oligofructose in different package type[J]. LWT-Food Science and Technology, 2015, 63(1): 415-422.
[12] 崔树茂. 乳酸菌的生长抑制和冻干存活的影响因素及规律[D]. 无锡:江南大学, 2017.
[13] 王璐. 盐胁迫下乳酸菌的高密度培养及冻干保护的研究[D]. 哈尔滨:哈尔滨工业大学, 2010.
[14] KRISCHKE W, SCHRÖDER M, TRÖSCH W. Continuous production ofL-lactic acid from whey permeate by immobilizedLactobacillus casei subsp.casei[J]. Applied Microbiology and Biotechnology, 1991, 34(5): 573-578.