紫甘蓝(Brassica oleracea var.capitata rubra)属于芸薹类蔬菜,又名紫包菜,红甘蓝。紫甘蓝种植面积广,价格低廉,已经成为餐桌上常见的蔬菜。紫甘蓝含有丰富的VC、VE、多酚、花色苷、硫代葡萄糖苷等生物活性物质,具有很高的抗氧化活性。
氧化是生物代谢中能够产生能量的必不可少的生物过程。然而,生物体的氧化过程与许多疾病,包括阿兹海默症,癌症、心脏病、动脉硬化等相关[1]。新鲜水果与蔬菜,含有丰富的生物活性物质,可以作为天然的抗氧化剂,有利于防止或延缓心血管疾病、癌症、高血压、高血脂等慢性疾病[2]。由于活性物质,比如酚类物质,在消化过程中可能会发生各种生理化学反应,相比较传统的利用有机溶剂提取来检测生物活性物质的方法,模拟体外消化能更好反映它们在消化过程中的存在形式和抗氧化能力,贴近真实的生理消化情况[3]。近年来,国内外已有很多研究基于模拟体外胃肠消化来评价食物中的活性物质。PODS![]() DEK等[4]研究了紫甘蓝在模拟胃肠消化过程中其花色苷的稳定性,结果表明,胃消化促进紫甘蓝释放基质中的花色苷,肠消化会损失花色苷含量,并降低其抗氧化活性。RYCHLIK等[5]对西兰花的体外模拟消化研究表明,硫苷类物质在消化过程中降解,酚类物质和抗氧化活性在消化过程中有所升高。消化后的西兰花提取物对结肠细胞的活性氧清除率达到76.59%,其DNA氧化损伤率降低了57.33%。
DEK等[4]研究了紫甘蓝在模拟胃肠消化过程中其花色苷的稳定性,结果表明,胃消化促进紫甘蓝释放基质中的花色苷,肠消化会损失花色苷含量,并降低其抗氧化活性。RYCHLIK等[5]对西兰花的体外模拟消化研究表明,硫苷类物质在消化过程中降解,酚类物质和抗氧化活性在消化过程中有所升高。消化后的西兰花提取物对结肠细胞的活性氧清除率达到76.59%,其DNA氧化损伤率降低了57.33%。
真空油炸作为一种新型的食品加工方式,已经被广泛应用于果蔬脆片的生产[6],淀粉制品[7]、肉制品[8-9]的加工。国内外目前已有很多文献研究了新鲜紫甘蓝的生物活性和抗氧化性[4],但对加工紫甘蓝的研究还比较少[10],并且,未有真空油炸紫甘蓝方面的报道。本研究对真空油炸紫甘蓝和常压油炸紫甘蓝分别进行体外模拟胃肠消化处理,评价多酚和花色苷在消化过程中的释放规律,并通过ABTS、ORAC两种方法评价抗氧化活性的变化趋势。本文旨在为紫甘蓝的开发利用提供新思路,丰富果蔬营养评价体系。
新鲜紫甘蓝,购于浙江杭州三墩沃尔玛超市;食用棕榈油,上海益海嘉里公司。
胰酶(pancreatin)、胃蛋白酶(pepsin)、胆汁提取物、没食子酸、VE、荧光素钠、ABTS试剂、DPPH试剂,美国Sigma公司;正己烷,Na2CO3,HCl,NaHCO3等,均为国产分析纯。
js-05型真空油炸机,上海劲森轻工机械有限公司;多功能小型油炸锅,力恩电器专营店;1510全波长酶标仪,美国Thermo Fisher公司;荧光酶标仪,美国Thermo Fisher公司。
1.3.1 油炸前预处理
将新鲜紫甘蓝拨片清洗后切成(3×3) cm的小块备用。沥干水分后,将块状紫甘蓝放入-20 ℃冰箱冷冻12 h。
1.3.2 油炸条件
为了比较常压油炸和真空油炸,引入了等效热驱动力(ETDF)的概念[11]。热驱动力指的是在一定的工作压力条件下,水的沸点和此时油温的差值。将真空油炸的真空度设置为0.091 MPa,选取△T=40、50、60 ℃三个值为热驱动力,真空油炸温度分别设为85、95、105 ℃,常压油炸温度分别设为140、150、160 ℃。真空油炸时间设为700 s,常压油炸时间为240 s (油炸终点由泡沫消失的时间决定)。将油炸后的紫甘蓝用正己烷进行脱油[6],冻干后于-80 ℃保存。
1.3.3 体外模拟胃肠消化
体外模拟消化过程分为胃消化和肠消化,参照从彦丽[3],BOUAYED[12]的方法,并有所改进。其中,取100 g胃蛋白酶于25 mL容量瓶中,用0.1 mol/L的HCl配制4 mg/mL的胃消化液;取20 mg胰酶和120 mg胆盐于10 mL容量瓶中,用0.1 mol/L的NaHCO3溶液配制肠消化液(2 mg/mL的胰液,12 mg/mL的胆汁)。
称取0.5 g脱油后的紫甘蓝冻干粉末溶于15 mL 9 mg/L的NaCl溶液中,用1 mol/L的HCl调pH=2~2.5后,加入2 mL胃消化液,于37 ℃振荡水浴锅中消化3 h,在0、0.5、1、2、3 h分别取0.5 mL上清液,并立即放在碎冰中冷却,经离心后于-80 ℃贮藏待测。
胃消化2 h后,样品中的多酚等物质的含量变化趋于平稳,因此以胃消化3 h的样品作为肠消化的初始样品。消化后的样品用1 mol/L的NaHCO3溶液调pH=7~7.5后, 加入1 mL肠消化液,于37 ℃振荡水浴锅中消化4 h,在0、0.5、1、2、3、4 h分别取0.5 mL上清液,并立即放入碎冰中冷却,经离心后于-80 ℃贮藏待测。
1.3.4 总酚含量的测定
总酚含量的测定采用福林酚法[13]。
1.3.5 花色苷含量的测定
总花色苷含量的测定采用pH示差法[13]。
1.3.6 抗氧化活性的测定
1.3.6.1 ABTS自由基清除能力[13]
将等量7 mmol/L的ABTS溶液与2.45 mmol/L的过硫酸钾溶液混合,摇匀后避光放置12~16 h,得到ABTS使用液。取20 μL稀释10倍后的样品溶液,向其中加入170 μL ABTS工作液,37 ℃下振荡反应10 min后于734 nm处检测吸光值。
1.3.6.2 ORAC氧自由基吸收能力[14]
先移取10 μL磷酸钾缓冲溶液,向其中加入10 μL稀释15倍的样品溶液,再加入10 μL荧光素使用液,于37 ℃下振荡反应5 min后,立刻加入170 μL AAPH溶液启动反应。于37 ℃下以激发波长485 nm,发射波长538 nm进行连续测定3 h,每2 min测定1次荧光强度。
1.3.7 数据的处理与统计分析
实验设3次重复,各指标重复测定3次。测定结果以平均值(means)±标准偏差(SD)表示。试验数据采用Excel和SPSS 20.0软件进行统计分析,实验数据采用ANOVA进行邓肯式(Duncan’s)差异分析,在0.05水平上进行显著性检验。
如图1、图2所示,新鲜紫甘蓝和油炸紫甘蓝在体外模拟胃肠消化之后,总酚的含量都有所上升。在经胃消化1 h,肠消化2 h后,释放量趋于平稳。经过体外模拟胃消化过程3 h后,新鲜紫甘蓝释放的总酚含量增加了25.93%,在经过4 h模拟肠消化之后,其释放量继续增加了19.42%。以△T=60 ℃为例,真空油炸紫甘蓝与常压油炸对照组释放的总酚含量在模拟胃消化后分别增加了33.61%和23.67%,在模拟肠消化后分别增加了18.83%和13.52%。真空油炸组在胃肠消化中的多酚释放量明显高于常压油炸组以及新鲜紫甘蓝,说明真空油炸能促进紫甘蓝在胃肠消化过程中的释放。
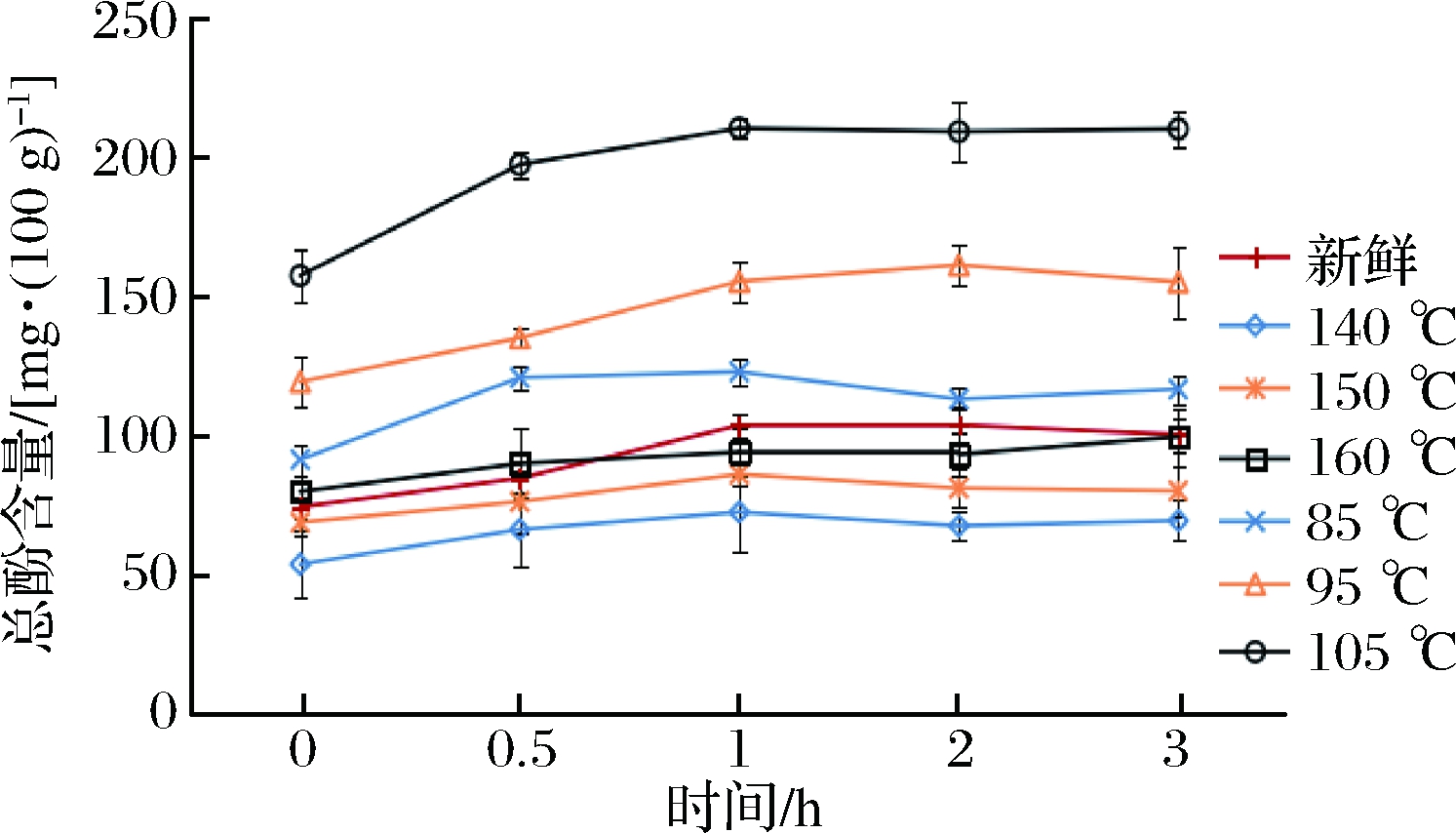
图1 不同油炸条件对紫甘蓝模拟胃消化过程总酚的释放规律的影响
Fig.1 Effect of different fried conditions on the release of total phenol in red cabbage peptic digestion process
注:0 h,从上至下依次为105 ℃、95 ℃、85 ℃、160 ℃、新鲜、150 ℃和140 ℃。
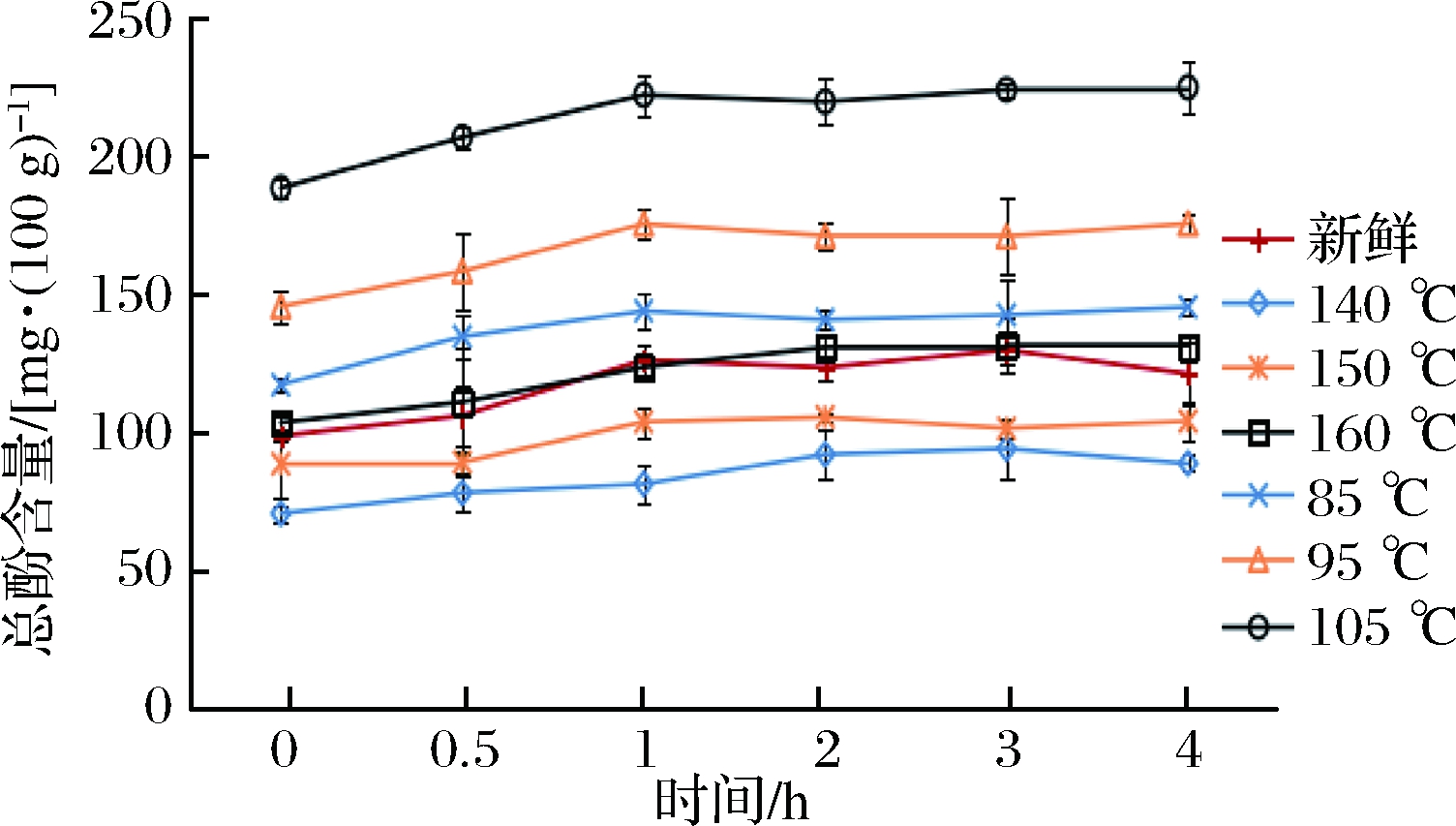
图2 不同油炸条件对紫甘蓝模拟肠消化过程总酚的释放规律的影响
Fig.2 Effect of different fried conditions on the release of total phenol in red cabbage intestinal digestion process
注:0 h,从上至下依次为105 ℃、95 ℃、85 ℃、160 ℃、新鲜、150 ℃、140 ℃。
紫甘蓝含有丰富的花色苷,但是其不稳定,极易受到温度、pH等因素的影响而损失。从胃消化0 h可以看出,2种油炸方式都对花色苷造成一定程度的破坏。曹帅颖等[15]研究表明,紫甘蓝的花色苷在加热或者贮藏过程中会发生降解或氧化反应,生成新化合物,保持其抗氧化活性。但在同一个热驱动力的条件下,与常压油炸相比,真空油炸能更好保留花色苷。在胃消化过程中,新鲜和油炸紫甘蓝的花色苷含量都显著增加。肠消化结束后,随着热驱动力的增加,新鲜紫甘蓝的花色苷含量比胃消化0 h增加了18.60%,真空油炸分别比初始增加了26.73%,25.48%和9.63%;常压油炸分别增加了23.06%,21.62%和-6.37%(图3、图4)。
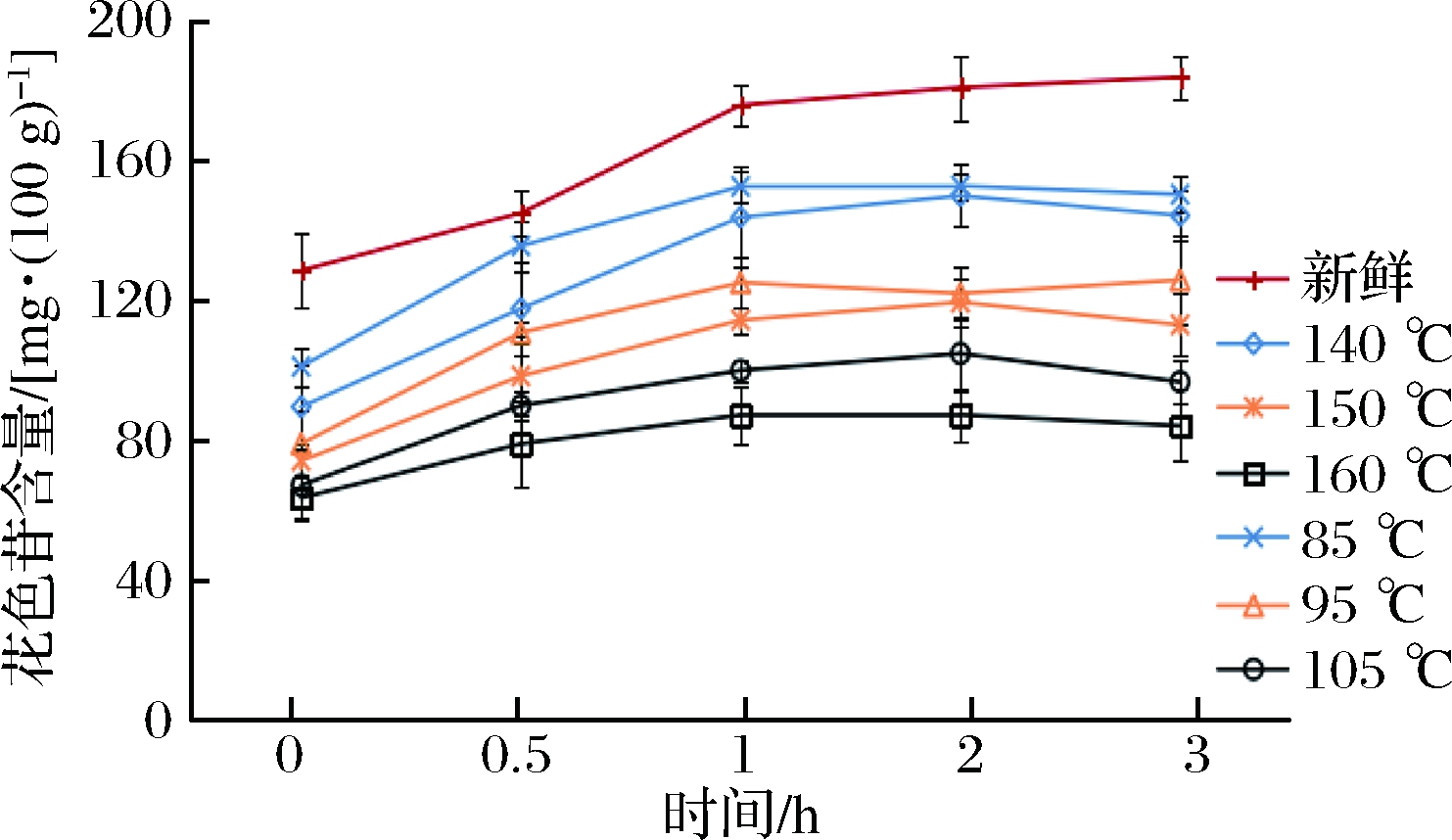
图3 不同油炸条件对紫甘蓝模拟胃消化过程花色苷的释放规律的影响
Fig.3 Effect of different fried conditions on the release of anthocyanin in purple cabbage peptic digestion process
注:0 h,从上至下依次为新鲜、85 ℃、140 ℃、95 ℃、150 ℃、105 ℃、160 ℃。
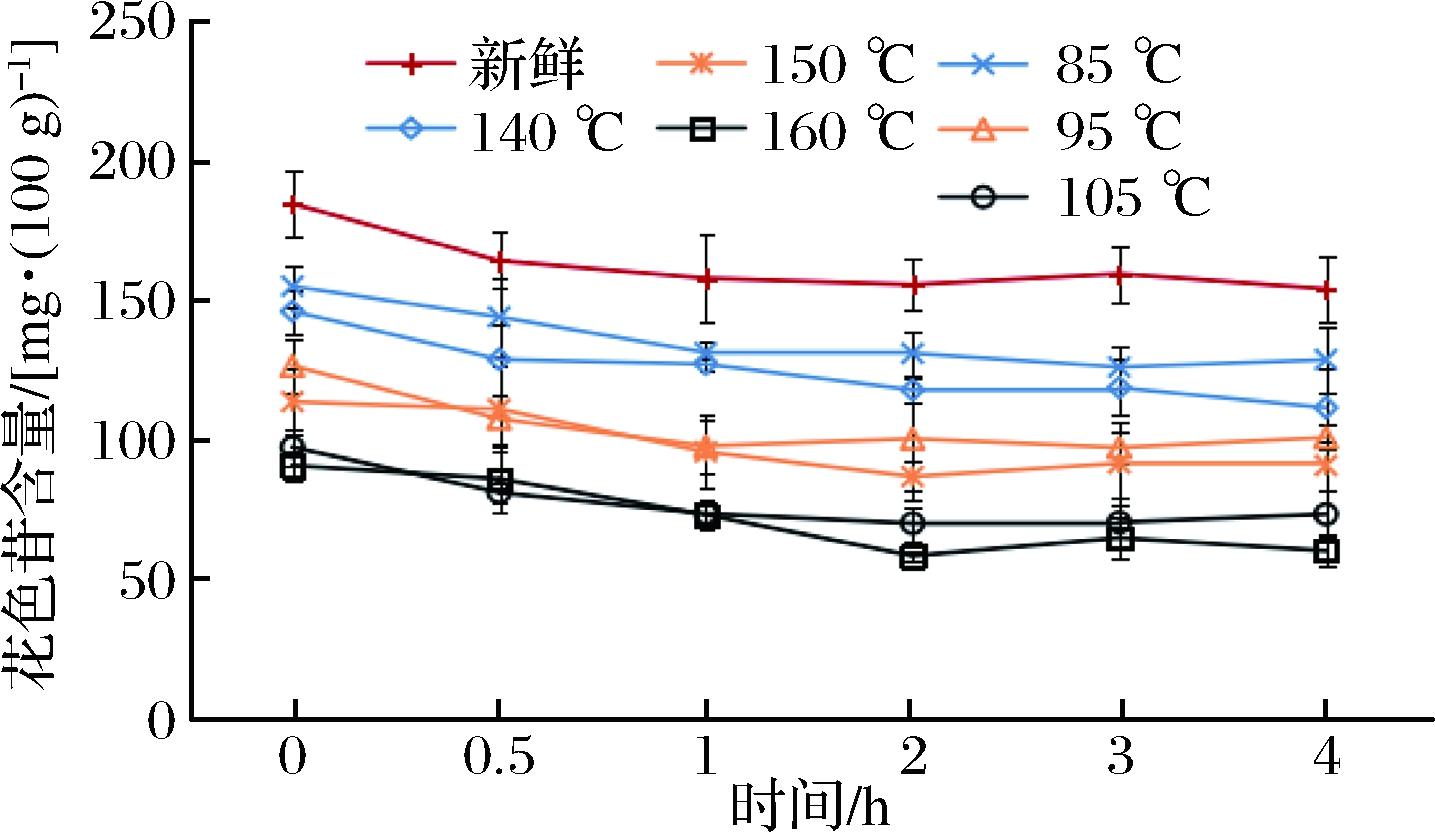
图4 不同油炸条件对紫甘蓝模拟肠消化过程花色苷的释放规律的影响
Fig.4 Effect of different fried conditions on the release of anthocyanin in purple cabbage intestinal digestion process
注:0 h,从上至下依次为新鲜、85 ℃、140 ℃、95 ℃、150 ℃、105 ℃、160 ℃。
如图5、图6所示,在胃消化1.5 h时,不同油炸条件处理的紫甘蓝ABTS值逐渐增加最后趋于稳定。
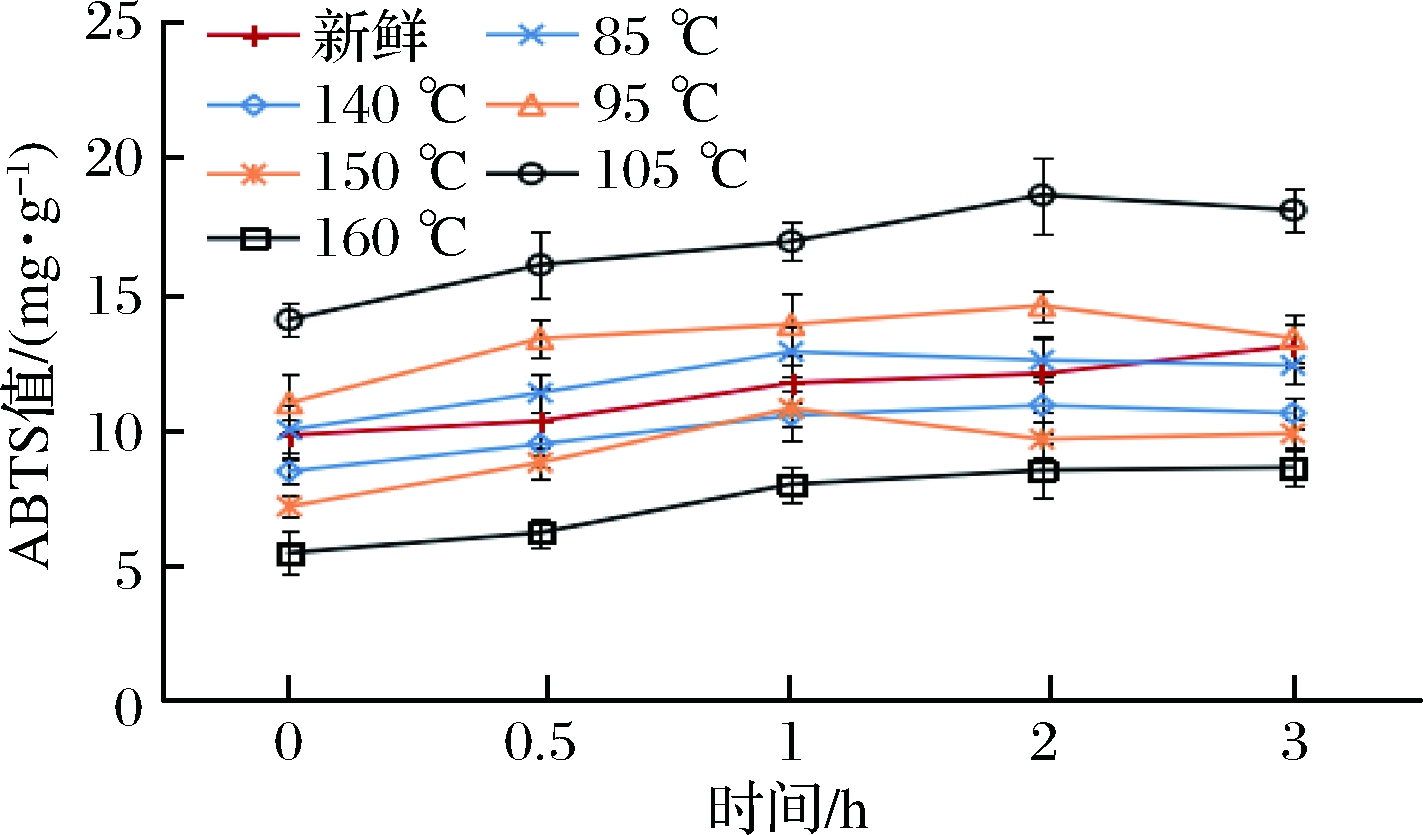
图5 不同油炸条件对紫甘蓝模拟胃消化过程ABTS的释放规律的影响
Fig.5 Effect of different fried conditions on the release of ABTS in purple cabbage peptic digestion process
注:0 h,从上至下依次为105 ℃、95 ℃、85 ℃、新鲜、140 ℃、150 ℃、160 ℃。
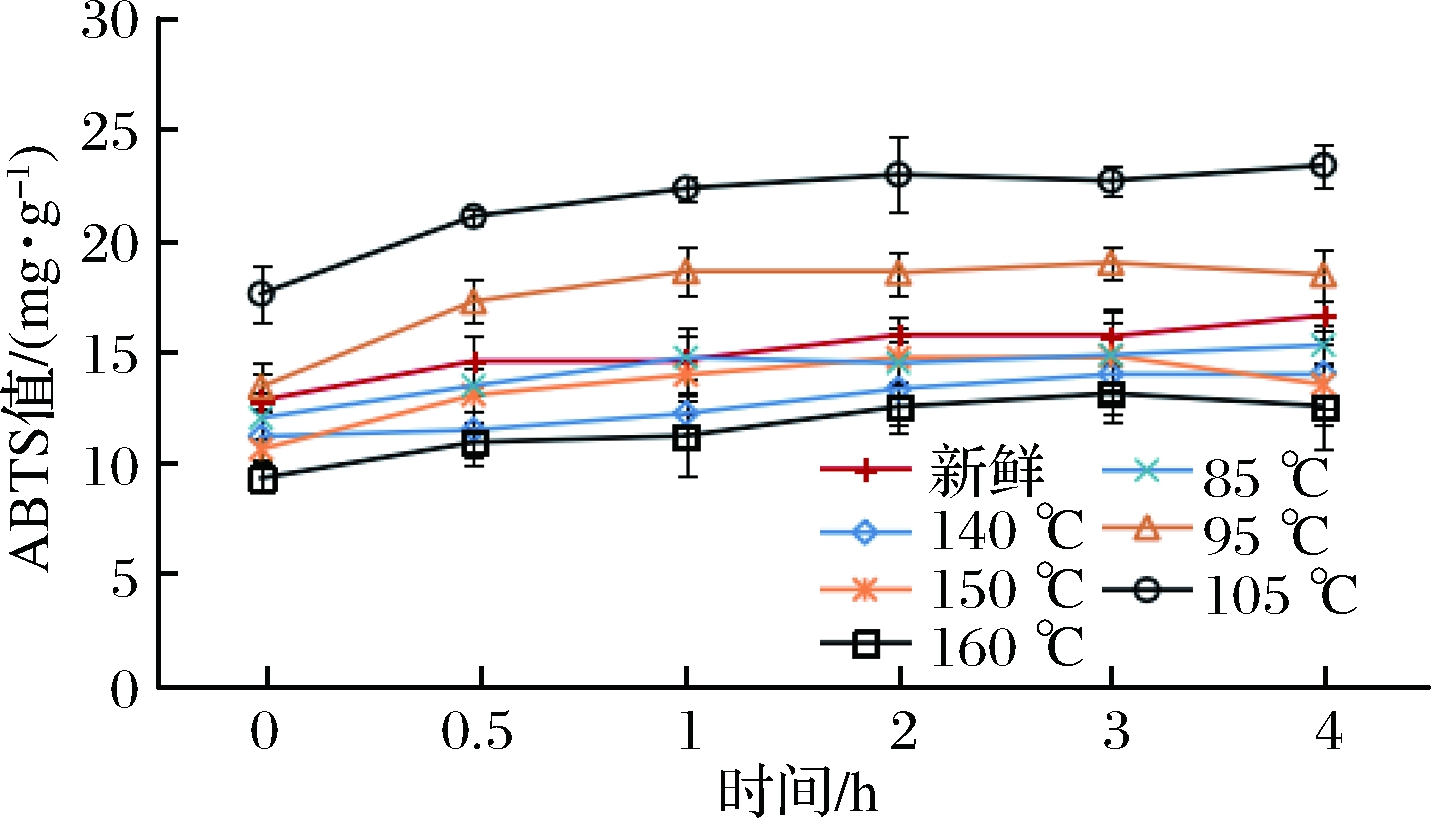
图6 不同油炸条件对紫甘蓝模拟肠消化过程ABTS的释放规律的影响
Fig.6 Effect of different fried conditions on the release of ABTS in purple cabbage peptic digestion process
注:0 h,从上至下依次为105 ℃、95 ℃、新鲜、85 ℃、140 ℃、150 ℃、160 ℃。
新鲜紫甘蓝在胃模拟消化之后,其ABTS值与未消化相比增长33%。经过真空油炸85、95、105 ℃处理的紫甘蓝,ABTS值分别增加了23.77%、24.43%和28.81%,常压油炸140、150、160 ℃处理的紫甘蓝,ABTS值分别增加了24.15%、20.46%和27.65%。肠模拟消化2 h,紫甘蓝的ABTS值变化趋于稳定。真空油炸实验组,其ABTS值分别增长了27.22%、32.84% 和37.59%;常压油炸对照组分别增长了25.34%、 27.44%和34.87%;新鲜紫甘蓝在肠消化之后,ABTS值增长了29.75%。
体外模拟胃消化过程中油炸紫甘蓝的ORAC值变化情况如图7所示。
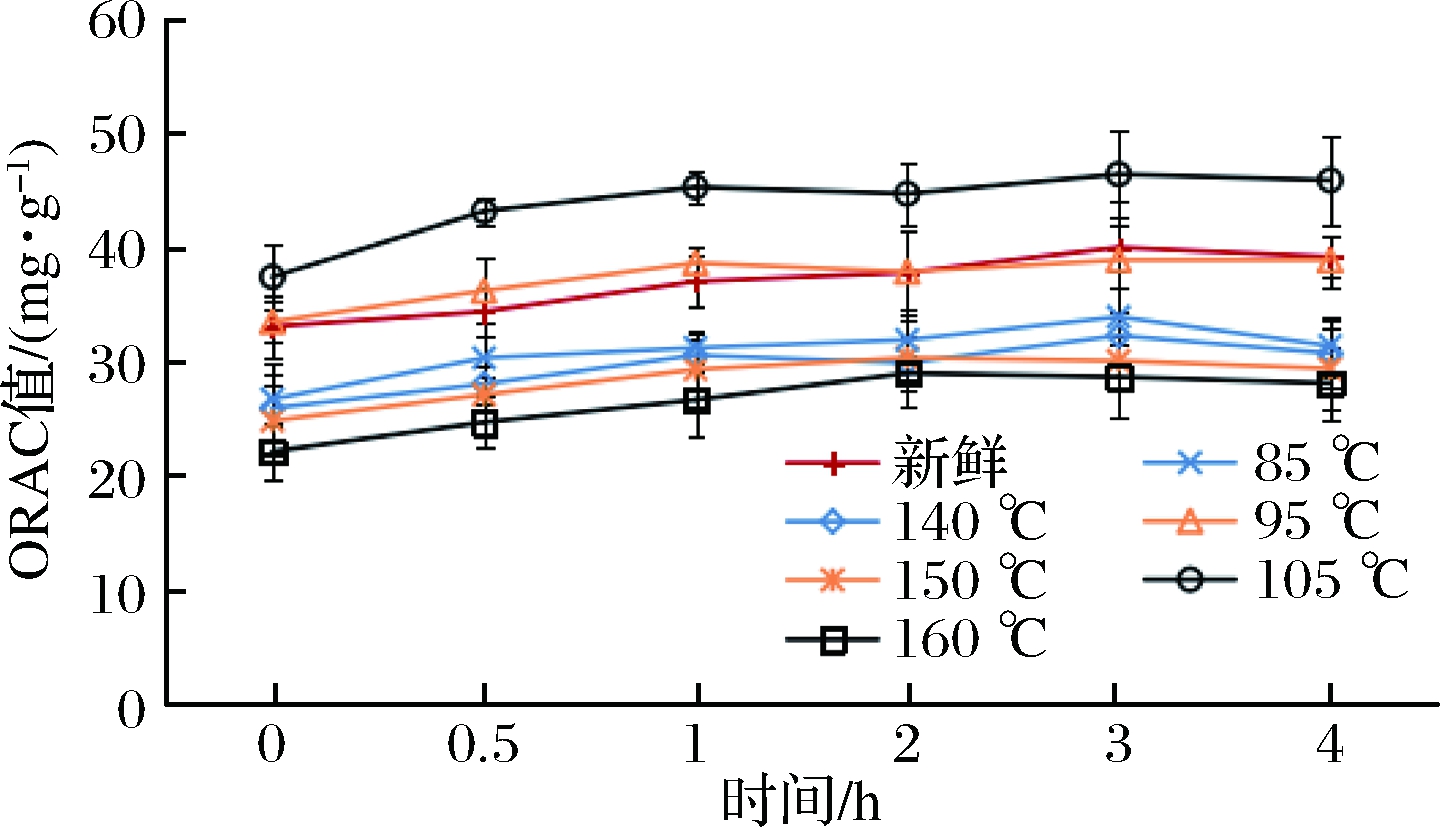
图7 不同油炸条件对紫甘蓝模拟胃消化过程
ORAC的释放规律的影响
Fig.7 Effect of different fried conditions on the release of ORAC in purple cabbage peptic digestion process
注:0 h,从上至下依次为105 ℃、新鲜、95 ℃、85 ℃、150 ℃、140 ℃、160 ℃。
新鲜和油炸紫甘蓝在胃模拟消化过程中较为稳定,整体变化趋势趋于平稳。真空油炸紫甘蓝(85、95、105 ℃)在经过胃模拟消化之后,ORAC值分别增加了9.94%、13.71%和14.49%;常压油炸紫甘蓝(140、150、160 ℃)在经过胃模拟消化之后,分别增加了8.15%、11.07%和11.21%;新鲜紫甘蓝的ORAC值增加了12.28%。油炸紫甘蓝在模拟肠消化过程中ORAC值的变化情况如图8所示。可以看出,高温油炸对紫甘蓝的抗氧化活性有明显的增强作用。在同一个热驱动力的条件下,相比较常压油炸,真空油炸紫甘蓝的ORAC值增加幅度更大。同一种油炸方式,随着油炸温度的升高,其消化后的ORAC值也逐渐升高。
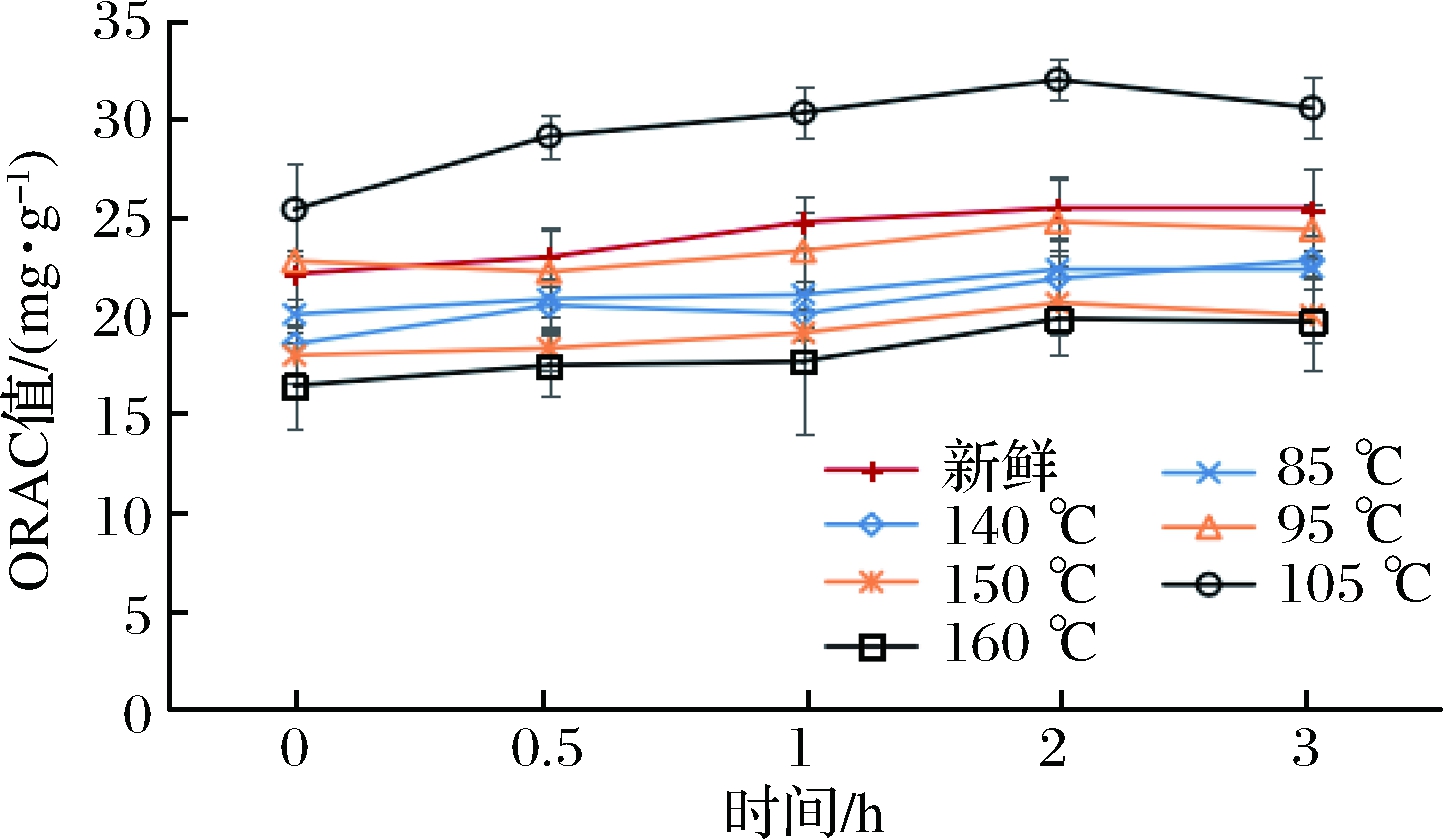
图8 不同油炸条件对紫甘蓝模拟肠消化过程ORAC的释放规律的影响
Fig.8 Effect of different fried conditions on the on the release of ORAC in purple cabbage peptic digestion process
注:0 h,从上至下依次为105 ℃、95 ℃、新鲜、85 ℃、140 ℃、150 ℃、160 ℃。
消化能明显增加紫甘蓝中的总酚含量,可能是因为在植物体内酚类物质经常与多糖、蛋白质等物质结合,在酶、pH等的作用下,促进酚类物质的释放。从彦丽等[3]研究结果表明,胃蛋白酶、胃酸、胰蛋白酶、胆汁等物质均可以促进宽皮柑、金橙、脐橙的多酚释放量。BOUAYED等[16]在对苹果进行体外模拟消化过程中,发现多酚含量在经过胃消化后显著升高,在模拟肠消化过程中进一步升高,但升高幅度相对较小,这与本文研究结果一致。这说明胃肠消化过程都能促进多酚物质的释放。而真空油炸紫甘蓝在消化过程中,其多酚的释放量更高,可能是因为真空油炸的低压油炸环境,改变了叶片的微观结构,从而使得叶片中的多酚类聚合物在消化过程中更容易溶出。在模拟胃消化过程中,紫甘蓝花色苷的含量有了明显的升高,这是因为模拟胃消化的胃蛋白酶,在酸性pH环境,促进了花色苷的释放;而在模拟肠消化的过程中,相比较肠消化0 h时,其含量明显降低,这可能是因为花色苷在肠消化的中性pH环境中结构不稳定,较容易降解为查尔酮或者其他小分子的酚类化合物[17]。研究表明,相比较酰化的花色苷,未酰化后的花色苷更不稳定[18]。这可能是紫甘蓝花色苷在胃肠消化过程中不稳定的原因。郑悦[19]研究发现,胃肠消化会降低黑果的花色苷含量,但其抗氧化能力依然保持较高水平,说明残留的花色苷活性并未受到影响。
ABTS自由基清除能力主要是基于电子转移实现,同时氢原子转移是边缘反应途径。多酚类化合物的ABTS自由基清除能力主要受到结构中存在的官能团以及游离羟基的数量和位置的影响[20]。胃肠消化过程显著增强了紫甘蓝的ABTS自由基清除能力,有可能是消化酶及酸碱环境改变了酚类物质的结构并促进其释放进而影响了抗氧化活性的表达。果蔬中的抗氧化成分除了酚类物质,还有维生素、多糖等,抗氧化活性除了与这些物质的含量有关,还与其之间的相互作用,包括协同和拮抗作用有密切的关系。有研究表明,炒和蒸可以显著增加紫甘蓝的还原能力,而微波和烫漂处理会降低其花色苷含量和抗氧化性[21]。马玉荣[22]研究发现,热处理后豆浆的抗氧化性增强,可能是由于在热处理过程中生成了具有抗氧化性的美拉德反应产物。CHANDRIKA等[23]发现胃消化之后,小麦的ABTS自由基清除能力显著提高;王谢祎等[24]研究南酸枣在人工胃肠液模拟消化之后,其ABTS自由基清除能力逐渐减弱,但幅度较小,并且与不加酶的对照组相比得出,消化酶和消化酸碱环境都会造成南酸枣ABTS自由基清除能力下降。盛雪飞研究了6种黄酮单体的抗氧化协同作用,研究发现,槲皮素和芦丁具有很强的抗氧化活性,与其他单体组合时,具有协同增效的作用[25]。在从彦丽等[3]在对柑橘的体外模拟消化过程的研究中发现,胃肠模拟消化可以显著增强柑橘的抗氧化能力(以ORAC值表示)。而在对蓝靛果的体外模拟消化过程中发现,氧自由基吸收能力在胃消化过程中先升高后下降,在肠消化过程中显著下降,与花色苷在消化过程中的变化趋势呈强相关性[26]。韩璐[27]研究表明,经过微波膨化、煮制、焙烤、乳酸菌发酵处理后的发芽糙米在经过胃肠消化后,ORAC值明显升高,说明胃蛋白酶、胃酸、胰酶、胆汁均可以促进抗氧化活性物质的释放。
本文以常压油炸紫甘蓝(140、150、160 ℃)为对照,通过体外模拟胃肠消化法评价了真空油炸紫甘蓝(85、95、105 ℃)在模拟胃肠消化过程中多酚、花色苷的释放规律和抗氧化能力的变化规律。结果表明,胃肠液消化可以促进真空油炸紫甘蓝中的酚类物质的释放和抗氧化性的增加;真空油炸紫甘蓝中的花色苷含量在胃消化液中显著增加,而在肠消化液中有所降低。在同一个热驱动力的条件下,真空油炸紫甘蓝的抗氧化成分含量和抗氧化性均高于常压油炸紫甘蓝;且随着油炸温度的升高,真空油炸紫甘蓝所释放的抗氧化成分含量和抗氧化性都呈现升高的趋势。
[1] CHEN G, KAN J. Characterization of a novel polysaccharide isolated fromRosa roxburghii Tratt fruit and assessment of its antioxidantin vitro andin vivo[J]. International Journal of Biological Macromolecules, 2017, 107 (Pt A):166-174.
[2] WANG Xinrui, ZHANG Changlong, PENG Yajie, et al. Chemical constituents, antioxidant and gastrointestinal transit accelerating activities of dried fruit ofCrataegus dahurica[J]. Food Chemistry, 2017, 246: 41-47.
[3] 从彦丽, 彭梦雪,刘冬,等. 柑橘在体外模拟胃肠消化过程中总多酚、总黄酮及总抗氧化活性的变化规律[J]. 食品科学. 2016, 37(17): 96-103.
[4] PODS![]() DEK A, REDZYNIA M, KLEWICKA E, et al. Matrix effects on the stability and antioxidant activity of red cabbage anthocyanins under simulated gastrointestinal digestion[J]. Biomed Research International, 2015, 2014 (2): 365 738.
DEK A, REDZYNIA M, KLEWICKA E, et al. Matrix effects on the stability and antioxidant activity of red cabbage anthocyanins under simulated gastrointestinal digestion[J]. Biomed Research International, 2015, 2014 (2): 365 738.
[5] RYCHLIK J, OLEJNIK A, OLKOWICZ M, et al. Antioxidant capacity of broccoli sprouts subjected to gastrointestinal digestion[J]. Journal of the Science of Food & Agriculture, 2015, 95 (9): 1 892-1 902.
[6] XU Jianteng, SU Xiaoyu, LIM Soyoung, et al. Characterisation and stability of anthocyanins in purple-fleshed sweet potato P40[J]. Food Chemistry, 2015, 186: 90-96.
[7] CONTARDO I, PARADA J, LEIVA A, et al. The effect of vacuum frying on starch gelatinization and itsin vitro digestibility in starch-gluten matrices[J]. Food Chemistry, 2016, 197 (Pt A): 353-358.
[8] ANDRÉS-BELLO A, GARC A-SEGOVIA P, MART
A-SEGOVIA P, MART NEZ-MONZ
NEZ-MONZ J. Vacuum frying process of gilthead sea bream (Sparus aurata) fillets[J]. Innovative Food Science and Emerging Technologies, 2010, 11(4): 630-636.
J. Vacuum frying process of gilthead sea bream (Sparus aurata) fillets[J]. Innovative Food Science and Emerging Technologies, 2010, 11(4): 630-636.
[9] 朱由珍, 吉宏武,刘书成,等. 真空油炸脆虾包装条件的选择及货架期预测[J]. 广东海洋大学学报, 2018, 38(4): 78-85.
[10] XU Feng, Zheng Yonghua, Yang Zhenfeng, et al. Domestic cooking methods affect the nutritional quality of red cabbage[J]. Food Chemistry, 2014, 161 (6): 162-167.
[11] SOBUKOLA O P, DUEIK V, BOUCHON P. Understanding the effect of vacuum level in structure development and oil absorption in vacuum-fried wheat starch and gluten-based snacks[J]. Food & Bioprocess Technology, 2013, 6 (8): 2 010-2 017.
[12] BOUAYEDJ, DEUBER H, HOFFMANNL, et al. Bioaccessible and dialysable polyphenols in selected apple varieties followingin vitro digestion vs. their native patterns[J]. Food Chemistry, 2012, 131 (4): 1 466-1 472.
[13] GRACE M H, ESPOSITO D, DUNLAP K L, et al. Comparative analysis of phenolic content and profile, antioxidant capacity, and anti-inflammatory bioactivity in wild Alaskan and commercialVaccinium berries[J]. Journal of Agricultural & Food Chemistry, 2014, 62 (18): 4 007-4 017.
[14] OU Boxin, HUANG Dejian, HAMPSCH-WOODILL M, et al. Analysis of antioxidant activities of common vegetables employing oxygen radical absorbance capacity (ORAC) and ferric reducing antioxidant power (FRAP) assays: A comparative study[J]. J Agric Food Chem, 2002, 50 (11): 3 122-3 128.
[15] 曹帅颖, 李洋,何晨阳,等. 热处理及贮藏温度对紫甘蓝花色苷稳定性和抗氧化能力的影响[J]. 食品研究与开发, 2018,39(2): 21-27.
[16] BOUAYED J, HOFFMANN L, BOHN T. Total phenolics, flavonoids, anthocyanins and antioxidant activity following simulated gastro-intestinal digestion and dialysis of apple varieties: Bioaccessibility and potential uptake[J]. Food Chemistry, 2011, 128(1): 14-21.
[17] BAO J, CAI Y, SUN M, et al. Anthocyanins, flavonols, and free radical scavenging activity of Chinese bayberry (Myrica rubra) extracts and their color properties and stability[J]. Journal of Agricultural & Food Chemistry, 2005, 53 (6): 2 327.
[18] WICZKOWSKI W, SZAWARA-NOWAK D, TOPOLSKA J. Changes in the content and composition of anthocyanins in red cabbage and its antioxidant capacity during fermentation, storage and stewing[J]. Food Chemistry, 2015, 167: 115-123.
[19] 郑悦. 黑果腺肋花楸花色苷分离、体外抗氧化及体外消化模拟研究[D]. 哈尔滨:东北林业大学, 2017.
[20] 左丽丽. 狗枣猕猴桃多酚的抗氧化与抗肿瘤效应研究[D]. 哈尔滨:哈尔滨工业大学, 2013: 151.
[21] 吴峰华, 周樑波,王卓然,等. 常用烹饪方式对紫甘蓝花色苷组分及其抗氧化活性的比较研究[J]. 营养学报, 2016,38(6): 613-615.
[22] 马玉荣.加热及模拟胃肠道消化处理对豆浆活性成分和抗氧化能力的影响[D]. 广州:华南理工大学, 2014.
[23] LYANA-PATHIRANA C M, SHAHIDI F. Antioxidant activity of commercial soft and hard wheat (Triticum aestivum L.) as affected by gastric pH conditions[J]. Journal of Agricultural & Food Chemistry, 2005, 53, (7): 2 433-2 440.
[24] 王谢祎, 翟宇鑫,李倩,等. 南酸枣在模拟消化过程中抗氧化活性及多酚含量分析[J]. 食品科学, 2016, 37(11): 7-11.
[25] 盛雪飞. 柑橘黄酮抗氧化及协同作用研究[D]. 杭州:浙江大学, 2010: 78.
[26] 王月华, 李斌,孟宪军,等. 模拟体外消化对蓝靛果提取物花色苷组成及抗氧化能力的影响[J]. 食品科学, 2016, 37(19): 100-105.
[27] 韩璐. 发芽糙米加工过程中活性物质变化及抗氧化活性的研究[D]. 锦州:渤海大学, 2018: 86.