青椒果实由于其自身的高营养价值而深受广大消费者的青睐。由于青椒果实原产于南美,是一种季节性较强的呼吸跃变型冷敏果蔬,采摘之后在常温下不易贮藏,极易失水萎蔫、腐败变质,使其外观品质和贮藏性大大降低,因此青椒的贮藏保鲜就显得尤为重要。目前人们大多数采用低温贮藏的方式来延长其贮藏期限,但在低温贮藏时,青椒果实由于其冷敏性的特点极易受到冷害而导致其可食用价值和商品价值大大降低,并造成严重的经济损失。其中冷害是指高于0 ℃的低温对产自于热带、亚热带的果实造成的生理代谢失调和组织伤害[1-2]。青椒果实的适宜贮藏温度为(7~9) ℃[3-6],当青椒的贮藏温度低于这个温度范围时就会出现冷害现象。由于冷害现象的发生,使得低温运输及贮藏受到了一定的限制。因此,需要找到适当的贮前处理方式来解决这一问题。有关青椒果实的贮前处理方式常见的有化学保鲜剂处理、涂膜处理、天然提取物处理以及热处理等方式[7]。其中热激处理技术结合低温贮藏的方式对保持果蔬品质新鲜,延长贮藏期很有效,有着很好的应用前景[8-17]。在常见的热处理方式中,短时间的热水浸泡处理被认为是最有效的热处理方式[18]。但目前关于同一有效热水处理温度下不同处理时间对青椒果实低温贮藏期间的活性氧代谢及抗氧化系统的影响之间的研究还未有人涉及。本次试验研究同一热水处理温度下不同的热水处理时间对青椒果实的活性氧代谢和抗氧化物质的变化情况,以期为青椒果实贮藏保鲜的进一步研究提供参考。
青椒:选用“洛椒”青椒作为试验材料,于2018 年6月 4日采于上海市南汇新城镇果园,装于泡沫箱中当天运回实验室。
盐酸羟胺、Na2HPO4、乙二胺四乙酸、对氨基苯磺酸、α-萘胺、DTT、三氯乙酸、二硫代硝基苯甲酸、还原性谷胱甘肽、氧化型谷胱甘肽、硫代巴比妥酸(分析纯):国药集团化学试剂有限公司。
BPS-100CA型恒温恒湿培养箱,上海一恒科学仪器有限公司;H-2050R-1型高速冷冻离心机,长沙湘仪离心机有限公司; THZ-82A型恒温振荡箱,江苏省金坛市环宇科学仪器厂;BJ2100D型数字孔式电子天平,台湾精达电子仪器有限公司;DDS-307型电导率仪,上海笛柏实验设备有限公司;HSWX-600BS型电热恒温水温箱,上海圣科仪器设备有限公司。
1.3.1 青椒预处理
挑选大小一致、形状规整、果皮坚硬有光泽、无明显机械损伤、无病虫害的新鲜青椒果实装于泡沫箱中当天运回实验室。果实平均长度为14~17 cm,平均质量为60~90 g。将青椒果实清洗干净后拭干备用。根据前期试验结果,选取有效热水处理温度为44 ℃,来研究该温度下处理青椒果实2、7、12、17和22 min,另外不经过热水处理的设为对照组,进而研究不同的热水处理时间对青椒果实的低温贮藏期间细胞内活性氧代谢及抗氧化物质的影响。将各组青椒果实处理后放于干净的实验台上晾干再装入厚度为0.03 mm的聚乙烯保鲜袋,最后放于(4±0.5) ℃相对湿度为(80±5)%的冷库中贮藏,整个贮藏周期为21 d,每隔2 d取出青椒样品观察各组的冷害指数并测定其他各项品质及生理生化指标,重复3次。
1.3.2 品质指标与测定方法
(1)冷害指数的测定
冷害指数是评价果蔬冷害程度很直观的一个指标。参照侯建设等[19]的方法来对青椒果实的冷害指数进行评定。通过观察青椒果实果面所呈现出的冷害面积将冷害症状分为4级。其中,0级:无冷害症状;1级:轻微冷害,冷害斑不超过果面的10%;2级:中度冷害,冷害斑占果面积的10%~40%;4级:严重冷害,冷害斑超过果面的40%。
冷害指数![]()
(1)
(2)失重率的测定
在贮藏前用电子天平将每个新鲜青椒果实称重并记为G0,将青椒从冷库中取出后置于干净的实验台上并用纸拭干,再用电子天平称重并记为G。每组青椒称重之后再将其放入新的厚度为0.03 mm的聚乙烯保鲜袋(打若干个1 cm的孔)中于冷库中贮藏。用公式(2)计算出青椒的失重率。
失重率![]()
(2)
(3)电解质外渗率的测定
参考陈健华等[20-21]的测定方法,稍作修改,用DDS-307电导率仪测定。选取较为平整的青椒果面,用打孔器取10个圆片放入有编号的烧杯中,并添加20 mL去离子水后将烧杯放于转速为150 r/min,环境温度为25 ℃的恒温振荡箱(THZ-82A,江苏省金坛市环宇科学仪器厂)内振荡10 min,振荡后取出烧杯并用去离子水反复冲洗3次,用滤纸将青椒圆片表面的水分拭干,把圆片再次放入烧杯中,重新加入20 mL去离子水,测定此时的电导率值,并记为Ro。测定结束后把烧杯放于真空干燥器(规格:240 mm,上海帅登仪器有限公司)中60 min。之后取出烧杯再次放入恒温振荡培养箱中振荡1 h,振荡结束后取出测定此时的电导率并记为R。用保鲜膜覆于烧杯上并把烧杯于沸水中煮沸10 min,煮沸结束后静待恢复至室温,测定此时的电导率R′。记录试验结果,并用公式(3)来算出电导率。
![]()
(3)
(4)丙二醛含量的测定
MDA含量测定分光光度计分别测定450、532和600 nm的吸光值,并利用公式(4)计算测定青椒果实的MDA含量。
c/(μmol·L-1)=6.45×(A532-A600)-0.56×A450
(4)
(5)超氧阴离子![]() 产生速率测试
产生速率测试
![]() 能与羟胺反应生成
能与羟胺反应生成![]() 能与对氨基苯磺酸和α-萘胺反应生成粉红色的偶氮染料,该染料在波长530 nm下具有显著光吸收。因此,利用羟胺氧化的方法可以测定青椒果实中
能与对氨基苯磺酸和α-萘胺反应生成粉红色的偶氮染料,该染料在波长530 nm下具有显著光吸收。因此,利用羟胺氧化的方法可以测定青椒果实中![]() 的产生速率。参照曹建康等[22]的方法稍作修改。
的产生速率。参照曹建康等[22]的方法稍作修改。
(6)过氧化氢酶(CAT)活性的测定
CAT在催化H2O2分解成为水和分子氧的过程中,起到电子传递的作用,因此,可根据反应过程中H2O2的消耗量来测定该酶的活性。H2O2在波长240 nm 处具有吸收峰,利用分光光度计可以检测H2O2含量的变化。其中CAT活性测定以每克果肉1 min 内OD240值变化0.01为1个酶活单位。
(7)谷胱甘肽还原酶(GR)活性的测试
在还原型辅酶(NADPH)提供氢的条件下,GR能将氧化性谷胱甘肽(GSSG)还原成还原型谷胱甘肽(GSH),同时NADPH形成NADP+。NADPH在波长340 nm处具有吸收峰,因此可以通过测定OD340的减小来计算GR的活性。反应系统中每分钟OD340变化0.1为1个酶活性单位。
(8)还原型谷胱甘肽(GSH)的测定
谷胱甘肽是一种天然三肽,能和二硫代硝基苯甲酸产生一种黄色物质,该物质在波长412 nm处具有最大光吸收,因此利用分光光度计法可测定青椒果实中GSH的含量。
1.3.3 数据分析
数据采用Excel 2010软件处理,SPSS 19.0 软件绘图进行差异性分析。本文所有试验为3次重复,试验结果为平均值±标准差。
冷害指数是评价果蔬细胞冷害情况的一个很直观、很重要的指标,可以直接反映出果蔬遭受低温冷害的程度[23]。在青椒果实的整个低温贮藏期间,由于青椒果实所处的环境温度低于其冷害发生的临界温度[24],所以随着贮藏时间的延长,各组青椒果实的冷害症状就逐渐显现,但不同处理组的青椒果实的冷害发生时间以及冷害程度又有所差别。由图1可以看出,各组冷害发生时间先后顺序为CK=22 min=17 min =7 min>2 min>12 min。
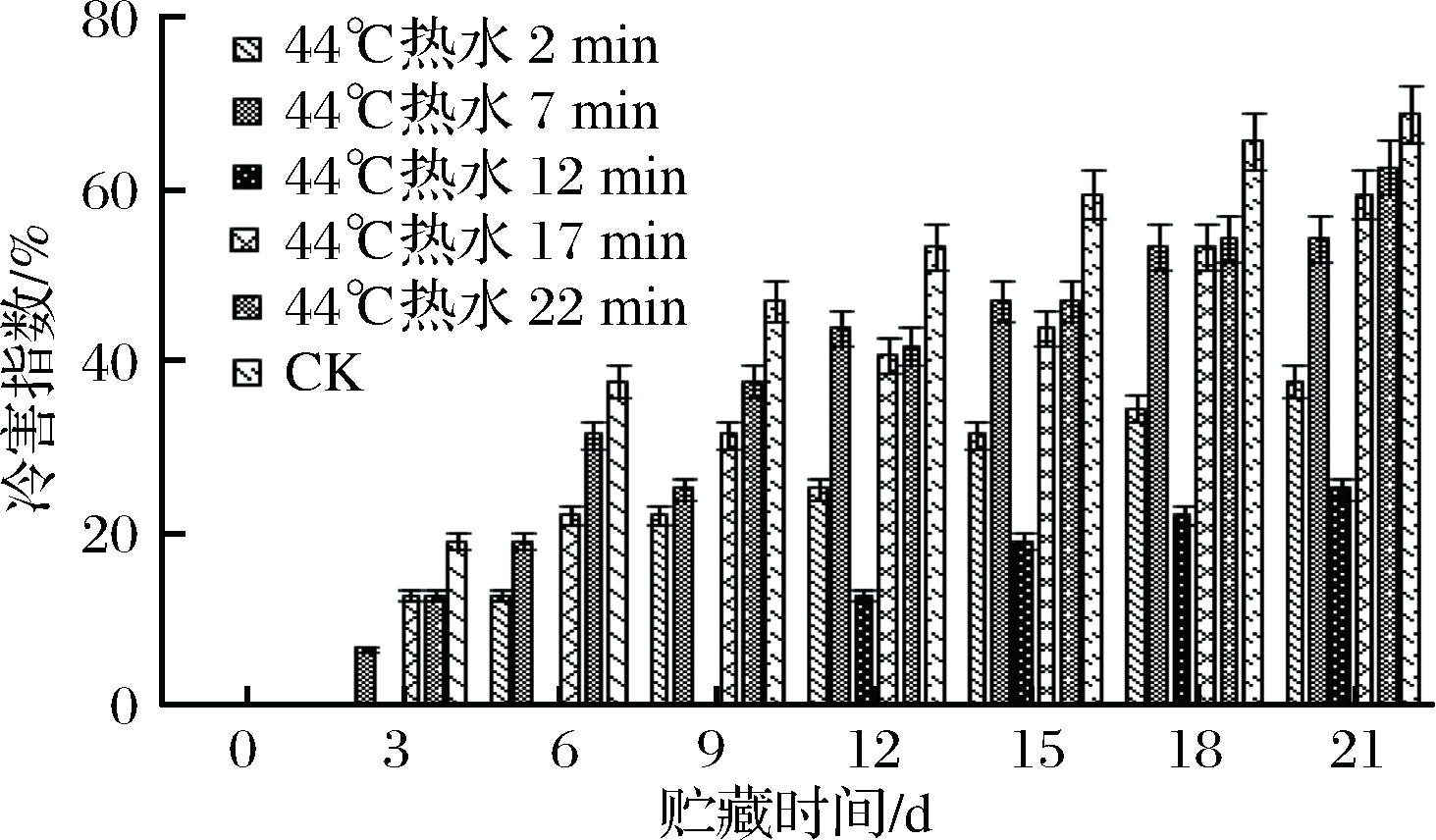
图1 不同热处理时间对青椒果实冷害指数的影响
Fig.1 Effects of different heat treatment time on cold damage index of green pepper fruits
随着贮藏时间的延长,各组青椒果实的冷害症状之间的差别就愈加明显。贮藏到12 d时,44 ℃热水处理12 min组青椒果实刚开始出现冷害症状,其值为12.5%,而2、7、17、22 min以及CK组的冷害指数分别为25%、43.8%、40.6%、41.7%和53.1%。在整个低温贮藏期间,12 min处理组青椒果实的冷害指数一直都维持在较低水平,远远小于其他处理组,到贮藏结束时,12 min处理组青椒果实的冷害指数仅为对照组的36%。而其他各处理组青椒果实的冷害指数在贮藏后期都有大幅度的增加,其中 2、7、12、17、22 min和CK组青椒果实的冷害指数分别达到了37.5%、54.2%、59.4%、62.5%和68.9%,均显著高于12 min组的冷害指数25%(P<0.05)。可能是因为在贮藏初期的青椒果实冷害症状不是很明显,随着低温贮藏时间的延长,各组青椒果实的冷害症状才随之加剧,而12 min组青椒果实较低的冷害指数则说明该条件可以有效减轻青椒的冷害症状。
新鲜的青椒果实果肉较厚且含水量较高,具有很好的外观品质以及很高的营养价值。但采摘后的青椒果实为了延长贮藏期常将其贮于低温环境中。处于低温环境下的青椒果实由于受到低温逆境的伤害难免会出现失水皱缩、果皮变软等现象。如图2所示,随着低温贮藏时间的延长,由于不同热水处理时间下的青椒果实都有一定程度的失水现象,所以青椒果实的失重率呈现出一直上升的趋势,但不同处理组下青椒果实的失重率的上升情况差异也较明显。
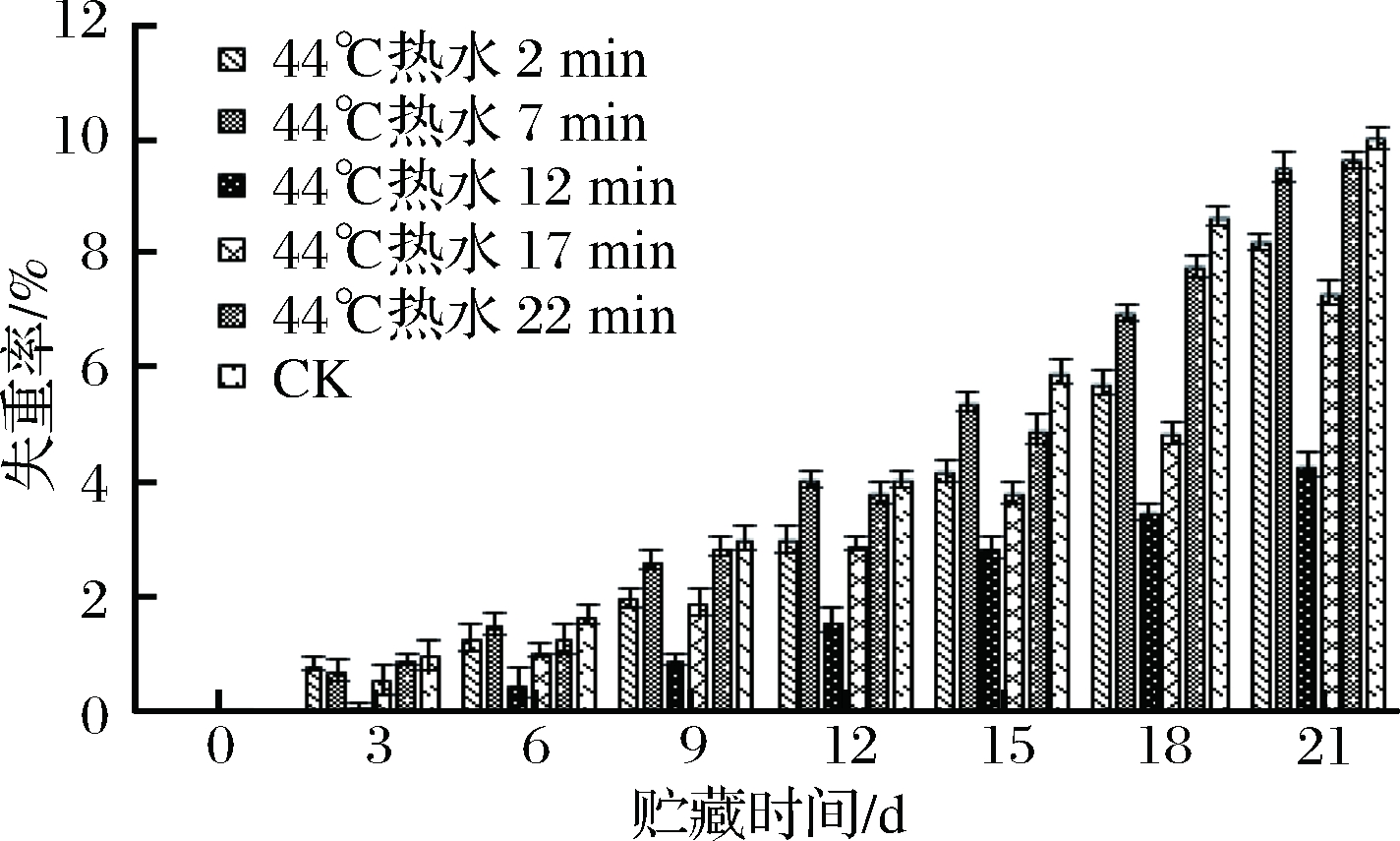
图2 不同热处理时间对青椒果实失重率的影响
Fig.2 Effects of different heat treatment time on weight loss rate of green pepper fruits
在整个低温贮藏期间,各个热处理组青椒果实的失重率都始终低于对照组,但22 min处理和对照组青椒果实的失重率接近,二者之间无显著性差异。第9天时,12 min组青椒果实的失重率仅为0.95%,而22 min组和CK组已经分别达到了2.91%和3.07%,远远高于12 min处理组。对于2、7和17 min处理组青椒果实的失重率来说,其数值也高于12 min处理组。该结果说明热水处理时间较长或较短都不能很好达到抑制失重率增加的效果,12 min处理可以增强青椒果实在低温贮藏期间的抗逆性,进而抑制其失重率的大幅度增加,使青椒果实的失重率维持在较低的水平,有利于青椒果实的进一步贮藏。
采后的青椒果实在低温贮藏时因为遭受了低温逆境的伤害,其细胞内会发生过氧化反应,进而造成青椒果实细胞膜的膜脂状态发生改变,减弱了膜脂分离的流动性,改变了原生质内部的隔离状态,使得青椒果实细胞内的细胞膜透性增加,细胞结构的完整性受到破坏,从而导致果实软化腐烂[25-26]。LYONS[27]研究得出果蔬细胞在处于低温逆境中时,最先受到影响的就是生物细胞膜当中的组成成分的状态。因此,电解质外渗率这一指标其值越高,说明果蔬细胞的细胞膜受损害的程度就越严重[28]。由图3可知,各处理组青椒果实的电解质外渗率均随着贮藏时间的延长而增加,这说明各组青椒果实细胞均受到了不同程度的伤害,膜脂状态也发生了一定程度的改变,进而体现在电解质外渗率数值的变化。不同处理组青椒果实的电解质外渗率增加的幅度不同,说明各处理组下的青椒果实对逆境的抗性不同。对于12 min处理组的青椒果实来说,其电解质外渗率一直维持在一个较低的水平,说明该处理组下的青椒果实在低温逆境下有了很好的抗性,进而能够保护细胞的膜脂状态,减少细胞内营养物质的渗漏,维持了较低的电解质外渗率值。在贮藏前期,其他各组青椒果实的电解质外渗率都有一个明显的上升过程,而12 min青椒果实的电解质外渗率值仅增加了3%。12 min处理组青椒果实在21 d时其电解质外渗率的数值仅为54%,是对照组青椒果实电解质外渗率的78%。而22 min处理组青椒果实的电解质外渗率在贮藏结束时甚至达到了70%,稍高于对照组青椒果实的电解质外渗率。出现该结果的原因可能是长时间的热水处理使青椒果实细胞在应对低温逆境时的抗性减小。在整个低温贮藏期间,12 min处理组的青椒果实的细胞膜完整性维持的最好,该处理组下的青椒果实的抗性高于其他各组(图3)。

图3 不同热处理时间对青椒果实电解质外渗率的影响
Fig.3 Effect of different heat treatment time on electrolyte extravasation rate of green pepper fruit
膜脂过氧化现象就是指细胞膜上的结构骨架磷脂分子被氧化,生成过氧化产物丙二醛,丙二醛的累积会破坏细胞膜的完整性[29]。由图4可知,在贮藏前期,各处理组青椒果实的丙二醛含量均出现了一个轻微的下降过程,从第6天开始一直到低温贮藏结束,各组青椒果实的丙二醛含量均持续增加,且不同处理组下的青椒果实丙二醛含量也呈现出来不同的增加幅度。各个处理组当中,增加幅度最明显的为对照组,其数值由贮藏初期的0.000 32 μmol/g增加到0.002 μmol/g。增加幅度最小的是12 min处理组,在贮藏结束时,其数值为0.001 μmol/g,明显小于其他各处理组(P<0.05)。且在贮藏后期,各组青椒果实的丙二醛含量增加的幅度比前期要高,这可能是由于长期的处于低温逆境中青椒果实内的膜脂过氧化反应加剧,使得丙二醛大量积累。青椒果实细胞内的丙二醛含量的变化跟电解质外渗率这一指标之间有着一定的联系。因为这两种指标的变化都跟青椒果实细胞的细胞膜膜脂状态的改变有关。当青椒果实处于低温环境中时,其细胞膜的完整性受到破坏,加之细胞内过氧化反应的进行,过氧化产物的积累使得青椒果实的抗逆性减弱。由结果可知,12 min热水处理组使青椒果实的丙二醛含量维持在一个较低的水平,表明该处理条件下的青椒果实细胞内的过氧化程度较低,细胞所受的逆境伤害最小。
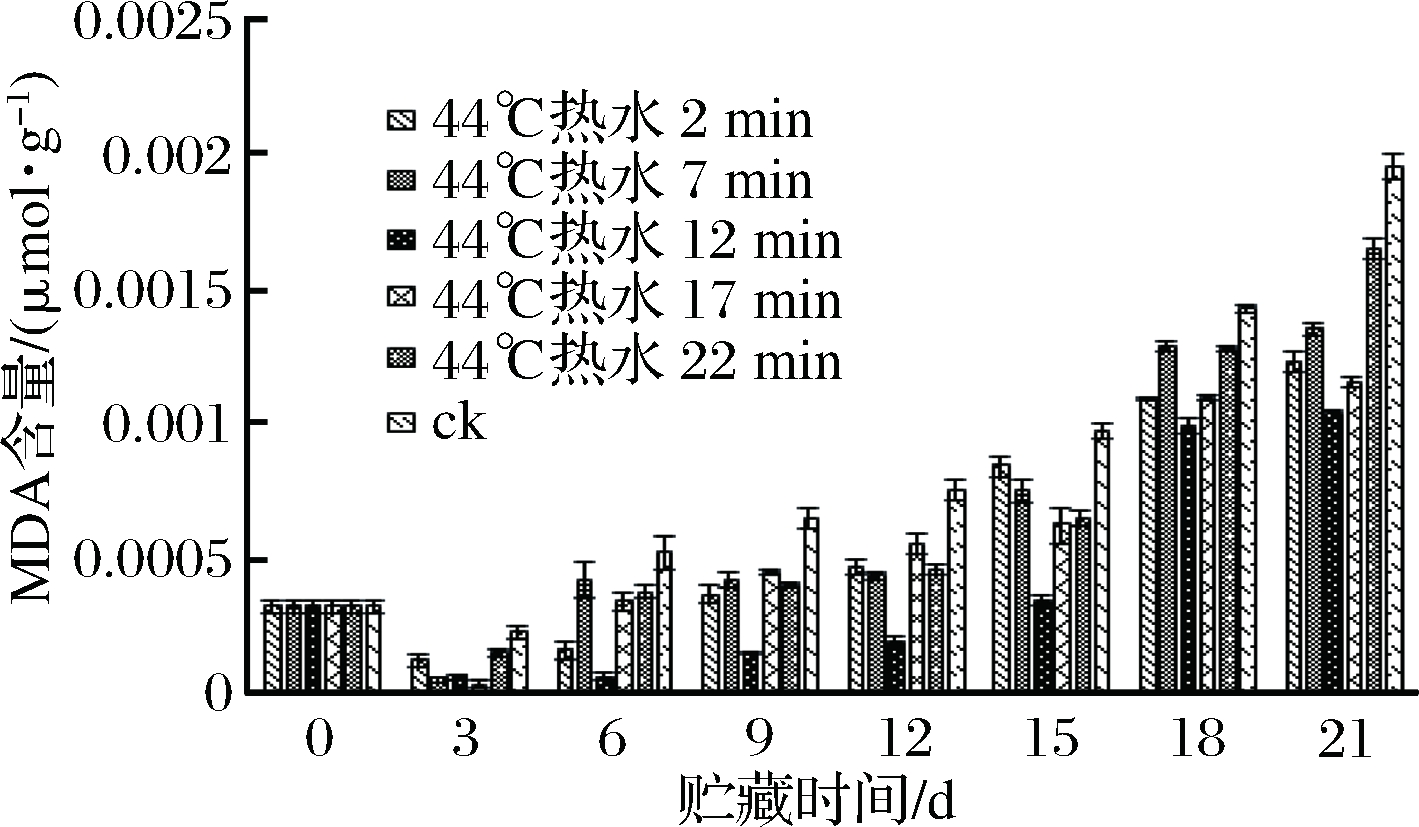
图4 不同热处理时间对青椒果实MDA含量的影响
Fig.4 Effect of different heat treatment time on MDA content of green pepper fruit
![]() 是细胞内活性氧代谢的主要产物,积累过多则会引起细胞的膜脂过氧化反应,使细胞受到一定程度的伤害,严重时则会导致果蔬细胞的死亡[30]。不同热水处理时间下的青椒果实的
是细胞内活性氧代谢的主要产物,积累过多则会引起细胞的膜脂过氧化反应,使细胞受到一定程度的伤害,严重时则会导致果蔬细胞的死亡[30]。不同热水处理时间下的青椒果实的![]() 产生速率的变化如图5所示。结果表明,随着低温贮藏时间的延长,
产生速率的变化如图5所示。结果表明,随着低温贮藏时间的延长,![]() 的产生速率呈上升趋势,不同处理组下的青椒果实的
的产生速率呈上升趋势,不同处理组下的青椒果实的![]() 产生速率有着明显不同。在整个低温贮藏期间,22 min和CK组青椒果实的
产生速率有着明显不同。在整个低温贮藏期间,22 min和CK组青椒果实的![]() 产生速率的变化趋势较为接近,都高于其他处理组。而2、7和17 min处理组青椒果实的
产生速率的变化趋势较为接近,都高于其他处理组。而2、7和17 min处理组青椒果实的![]() 产生速率虽低于22 min和CK组,但这3组却仍然高于12 min组青椒果实的
产生速率虽低于22 min和CK组,但这3组却仍然高于12 min组青椒果实的![]() 产生速率。
产生速率。
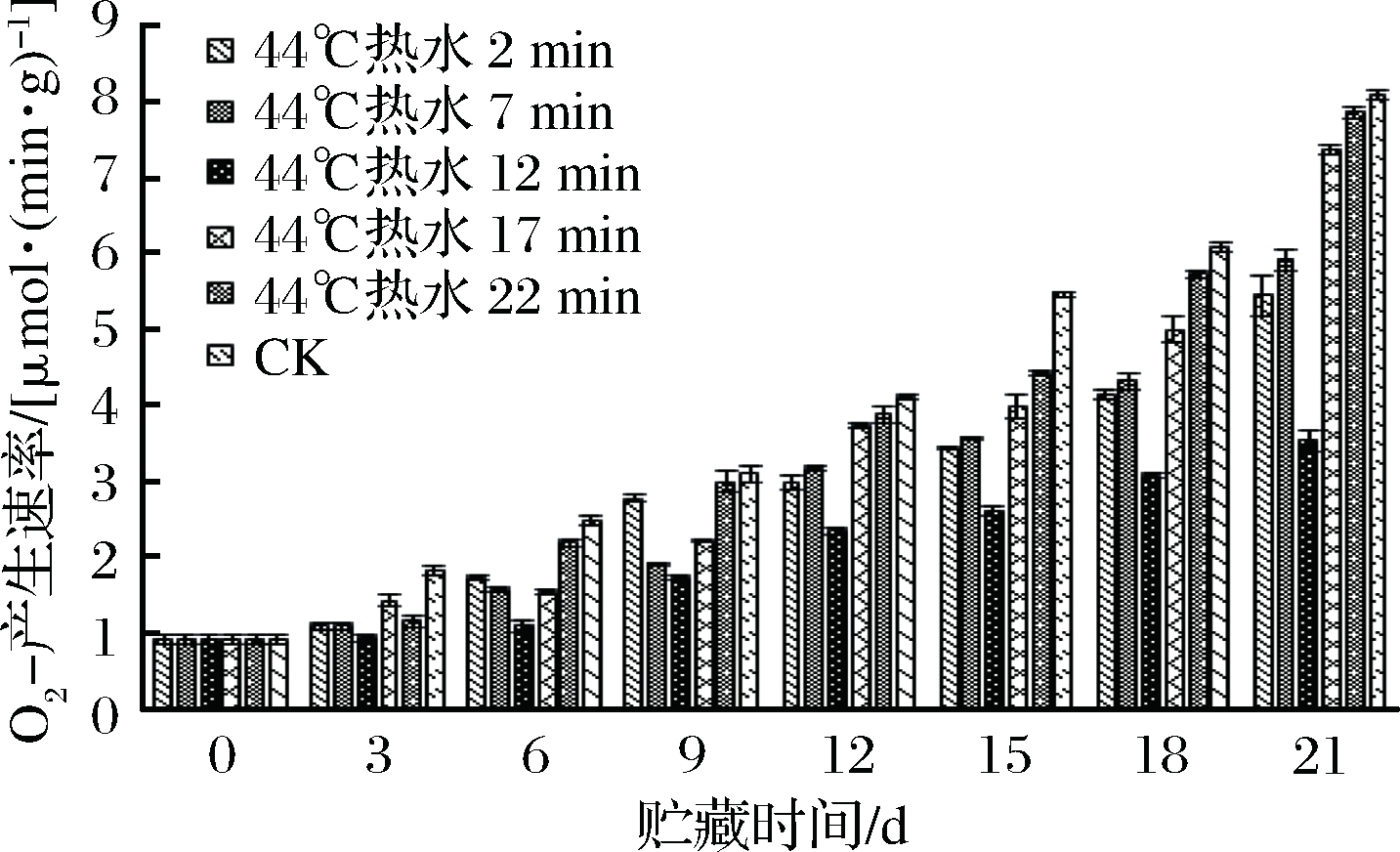
图5 不同热处理时间对青椒果实![]() 产生速率的影响
产生速率的影响
Fig.5 Effect of different heat treatment time on![]() production rate of green pepper fruit
production rate of green pepper fruit
在贮藏结束时,12 min处理组青椒果实的![]() 产生速率为3.53 μmol/(min·g),仅为2、7、17、22 min 和CK组的65%、59%、47%、45%和43%。由图5可知,在贮藏前期,各组的数值较小,尤其是12 min处理组的青椒果实在第6天时
产生速率为3.53 μmol/(min·g),仅为2、7、17、22 min 和CK组的65%、59%、47%、45%和43%。由图5可知,在贮藏前期,各组的数值较小,尤其是12 min处理组的青椒果实在第6天时![]() 的产生速率仅为1.097 μmol/(min·g), 该结果可能是由于在贮藏初期青椒果实细胞内的CAT、GR等酶活性较高,能够及时地发挥作用把
的产生速率仅为1.097 μmol/(min·g), 该结果可能是由于在贮藏初期青椒果实细胞内的CAT、GR等酶活性较高,能够及时地发挥作用把![]() 清除,使细胞免受自由基的伤害。随着贮藏时间的延长,17 min、22 min 和CK组青椒果实的
清除,使细胞免受自由基的伤害。随着贮藏时间的延长,17 min、22 min 和CK组青椒果实的![]() 急剧增加,使青椒果实细胞受到低温逆境的伤害。该结果表明12 min热水处理能够使青椒果实细胞内的活性氧物质的含量维持在较低的水平,有利于青椒果实低温贮藏的进行。
急剧增加,使青椒果实细胞受到低温逆境的伤害。该结果表明12 min热水处理能够使青椒果实细胞内的活性氧物质的含量维持在较低的水平,有利于青椒果实低温贮藏的进行。
CAT分解H2O2生成H2O和O2分子,能够有效地清除自由基。不同热水处理时间青椒果实的CAT酶活性的变化如图6所示。
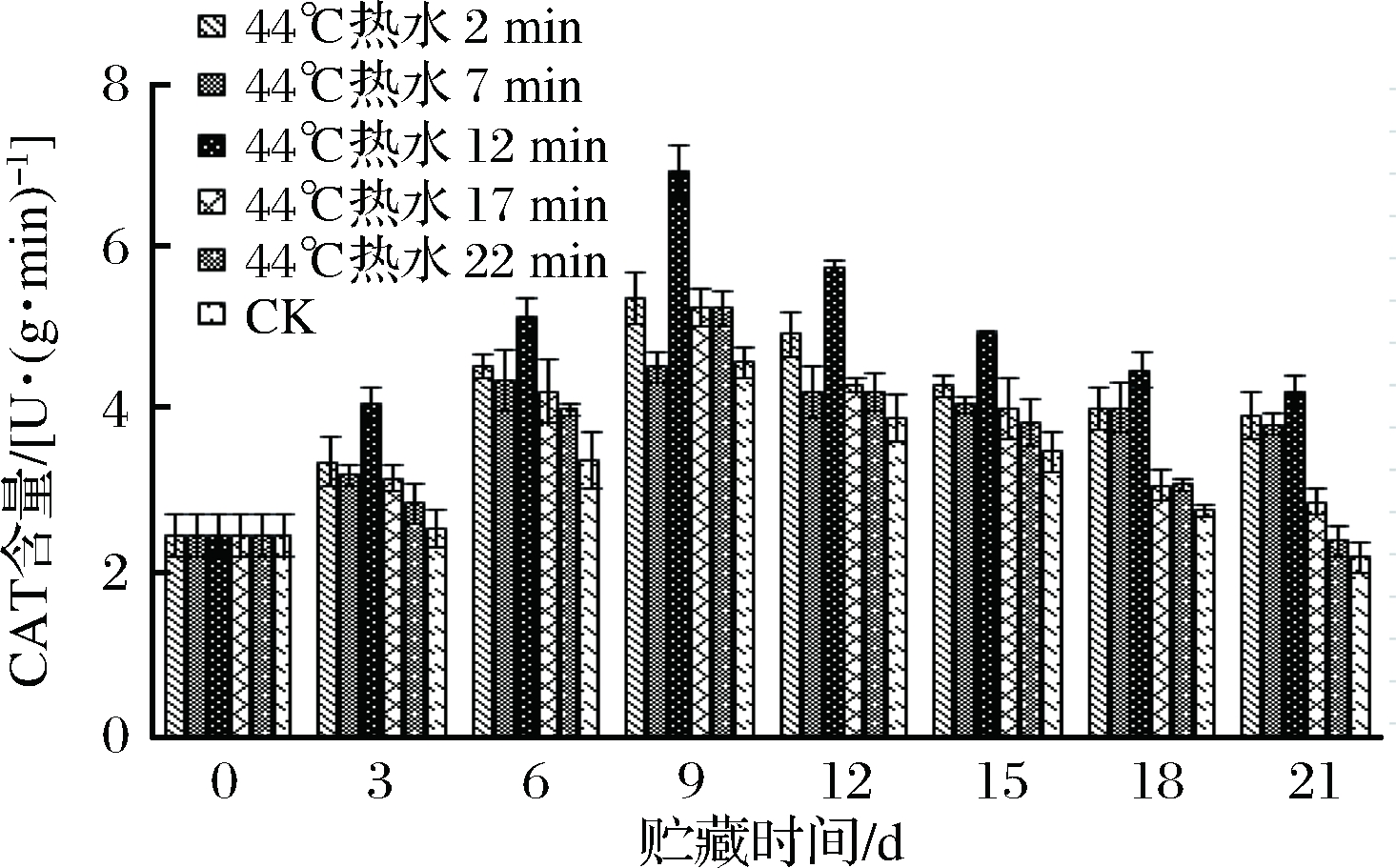
图6 不同热处理时间对青椒果实CAT活性的影响
Fig.6 Effects of different heat treatment time on CAT activity of green pepper fruits
结果表明,CAT酶活性呈现出先增大后减小的趋势。由各组青椒果实在整个低温贮藏期间CAT的活性变化可知,各组CAT活性均在第9天达到峰值,随后则下降。各处理组青椒果实CAT活性的峰值分别为5.37、4.52、6.91、 5.25、5.24和4.58 U/(g·min)。由图6可以看出,12 min处理组青椒果实的CAT活性一直高于其他各组,即使到了贮藏后期,12 min处理组青椒果实的CAT活性虽然有所降低,但降低的幅度却维持在较低的水平,贮藏到第21天时,12 min处理组青椒果实的CAT活性仍然高达4.21 U/(g·min),为对照组的1.91倍。CAT酶活性的变化趋势反映了青椒果实细胞内的活性氧清除水平。12 min组青椒果实的CAT活性一直高于其他处理组,说明该处理条件下的青椒果实的活性氧代谢维持在较低的水平,细胞受活性氧物质的伤害程度最小。因此,12 min处理下的青椒果实清除活性氧的能力处在一个较高的水平,提高了青椒果实在低温期间对逆境的抗性,增加了细胞的自我保护能力。
GR能够催化GSSG还原成GSH,从而维持GSH的含量,是果蔬细胞内抗氧化酶系统中的一个重要酶,它能够维持抗坏血酸-谷胱甘肽循环的有效进行,清除细胞内的活性氧自由基如![]() 等。各处理组青椒果实的GR活性变化如图7所示。
等。各处理组青椒果实的GR活性变化如图7所示。
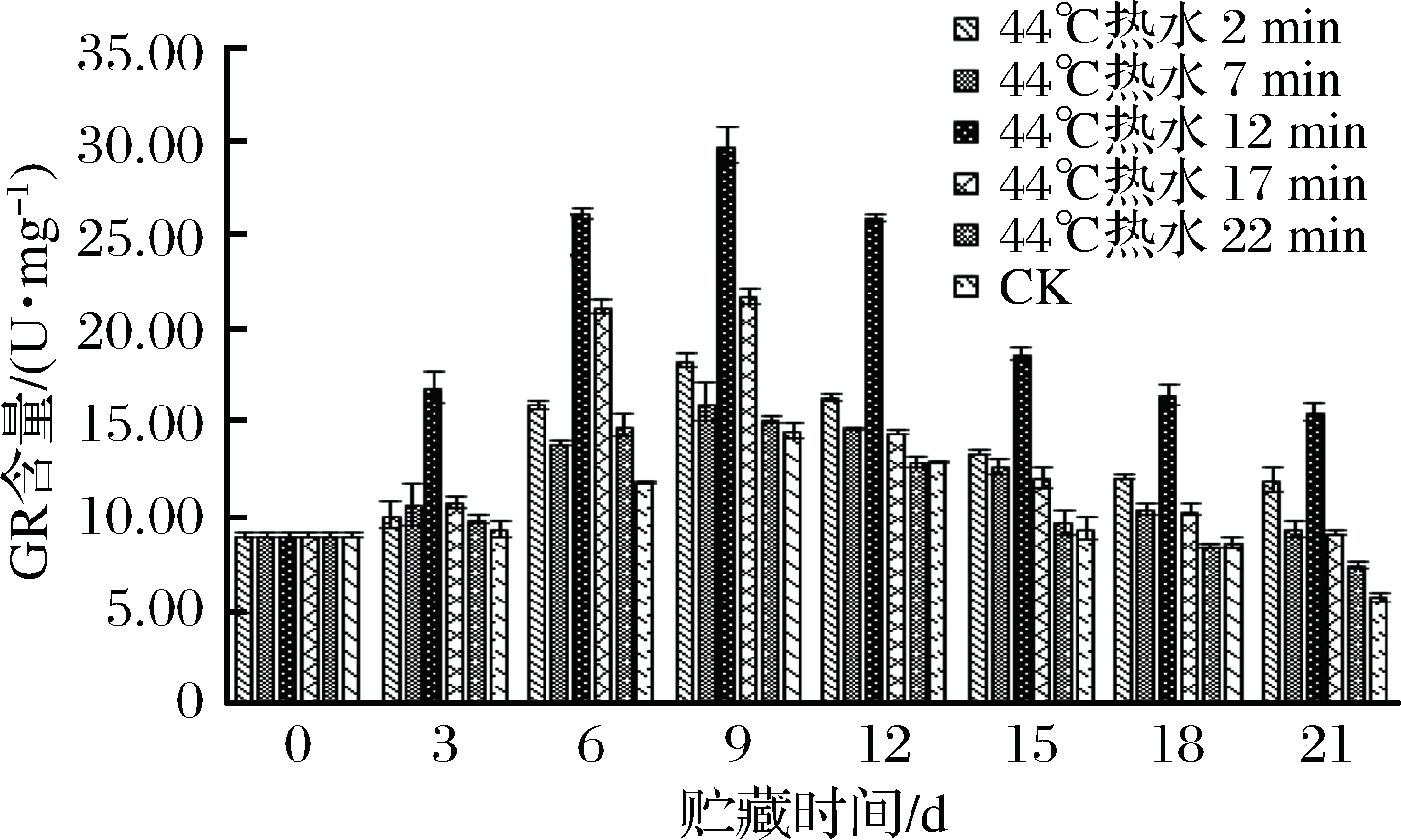
图7 不同热处理时间对青椒果实GR活性的影响
Fig.7 Effects of different heat treatment time on GR activity of green pepper fruits
12 min处理组青椒果实的GR活性一直高于其他各组。在第9天时各组青椒果实的GR均达到峰值,其中12 min处理组青椒果实的GR活性高达29.85 U/mg,其他各组青椒果实的GR活性除了17 min组的为21.75 U/mg外,其他各组均低于20 U/mg。各组青椒果实的GR活性不仅是峰值大小的差别,即使在贮藏结束时,12 min处理组青椒的GR活性仍然较高,维持在15.64 U/mg,是对照组的2.72倍。青椒果实在低温贮藏期间由于受到低温逆境的影响,其细胞内会发生一系列的活性氧代谢,此时青椒果实细胞中的GR就会保持一种较高的活性来应对,由上述结果可知,12 min处理组的青椒果实的GR的活性较高,对青椒细胞内产生的活性氧起到了很好的清除作用,降低了青椒果实低温贮藏期间的逆境伤害,是一种很好的热处理条件。
在果蔬细胞内存在着一些很重要的抗氧化物质,它们的存在能够调节细胞内的活性氧代谢,其中GSH就是细胞内最重要的抗氧化物质,它是植物组织中一种含量丰富的三肽,广泛存在于植物细胞的内质网、叶绿体及线粒体当中。因为GSH能够快速地还原![]() 就使得细胞内的自由基得到了有效的清除[31],GSH的含量常被用来评价细胞的抗氧化能力。由图8各组GSH含量的变化情况可知,各组青椒果实在低温贮藏时其GSH含量都呈现出先增加后减小的大致趋势,且各组GSH的数值均在第9天达到了峰值,12 min处理组的GSH为1.52 μmol/g,显著高于其他各组(P<0.05)。在贮藏前期,12 min处理组青椒果实的GSH含量一直高于其他各组,即使到了贮藏后期各组青椒果实的GSH含量都随贮藏时间的延长而下降时,12 min处理组青椒果实的GSH含量也保持在最高的水平,到贮藏结束时,其值为0.77 μmol/g,其他各组的数值均小于0.5 μmol/g。该结果表明12 min 处理组的青椒果实内一直维持较高的GSH含量来清除细胞内的活性氧自由基,进而保护了青椒果实细胞的完整性。
就使得细胞内的自由基得到了有效的清除[31],GSH的含量常被用来评价细胞的抗氧化能力。由图8各组GSH含量的变化情况可知,各组青椒果实在低温贮藏时其GSH含量都呈现出先增加后减小的大致趋势,且各组GSH的数值均在第9天达到了峰值,12 min处理组的GSH为1.52 μmol/g,显著高于其他各组(P<0.05)。在贮藏前期,12 min处理组青椒果实的GSH含量一直高于其他各组,即使到了贮藏后期各组青椒果实的GSH含量都随贮藏时间的延长而下降时,12 min处理组青椒果实的GSH含量也保持在最高的水平,到贮藏结束时,其值为0.77 μmol/g,其他各组的数值均小于0.5 μmol/g。该结果表明12 min 处理组的青椒果实内一直维持较高的GSH含量来清除细胞内的活性氧自由基,进而保护了青椒果实细胞的完整性。
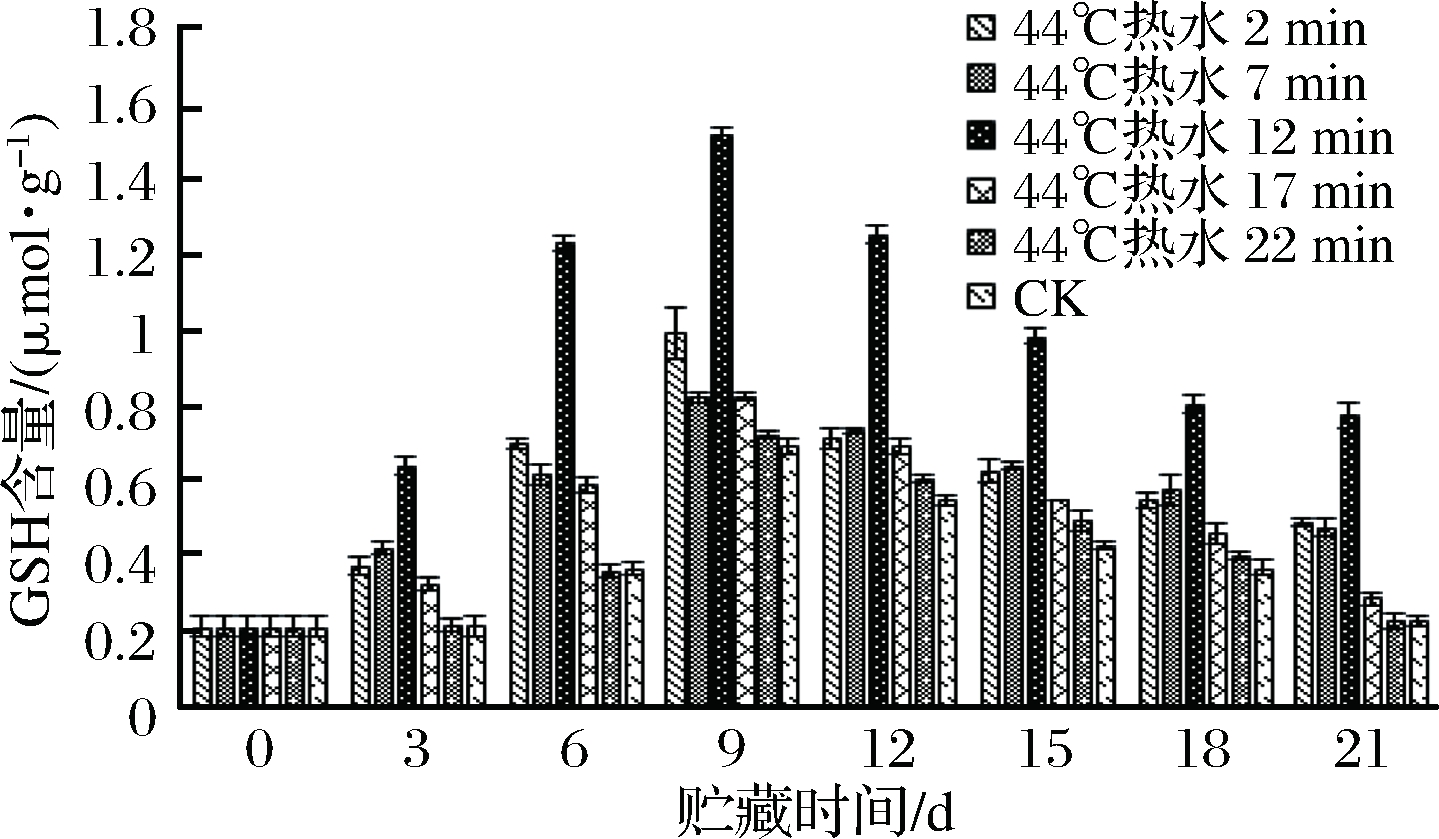
图8 不同热处理时间对青椒果实GSH含量的影响
Fig.8 Effects of different heat treatment time on GSH content of green pepper fruits
果蔬体内存在一个完善的清除活性氧的防卫系统,当果蔬处于低温逆境环境下时其活性氧的产生和清除之间的平衡被打破,进而会造成活性氧积累以及膜透性增大等现象[32]。试验表明,在各处理组中,44 ℃ 热水处理12 min可显著降低青椒果实在4 ℃贮藏期间的丙二醛含量以及电解质外渗率,其中丙二醛作为膜脂过氧化反应的主要产物,其含量较低则说明该处理方式下的青椒果实受到的逆境伤害较小,膜脂过氧化程度较低,进而使该组青椒果实的细胞膜完整性较好,体现在其电解质外渗率值较低。另外,44 ℃ 热水处理12 min下的青椒果实内部的CAT活性、GR活性以及GSH含量一直维持在较高水平,使该组青椒果实具有了较高的抗氧化能力和活性氧清除能力,能够降低细胞内的![]() 产生速率,对活性氧的清除起到了很好的作用,减轻青椒果实的低温伤害,进而提高了其抗冷性和耐贮性。同时,该处理组下青椒果实的冷害指数一直低于其他处理组,且能够推迟冷害发生时间。以往的研究也表明热处理可减轻蜜橘[33]、黄瓜[34]和哈密瓜[35]等冷害的发生,说明有效的热水处理可以抑制采后果蔬冷害的发生。本研究发现44 ℃热水处理12 min可提高青椒果实低温贮藏期间活性氧清除能力,减轻冷害症状的发生,是一种很好的贮前热处理条件。
产生速率,对活性氧的清除起到了很好的作用,减轻青椒果实的低温伤害,进而提高了其抗冷性和耐贮性。同时,该处理组下青椒果实的冷害指数一直低于其他处理组,且能够推迟冷害发生时间。以往的研究也表明热处理可减轻蜜橘[33]、黄瓜[34]和哈密瓜[35]等冷害的发生,说明有效的热水处理可以抑制采后果蔬冷害的发生。本研究发现44 ℃热水处理12 min可提高青椒果实低温贮藏期间活性氧清除能力,减轻冷害症状的发生,是一种很好的贮前热处理条件。
[1] 栾福磊, 张奎. 采后果蔬低温贮藏冷害、发生机理及控制研究进展[J]. 家电科技, 2018(1): 38-42.
[2] 王云香, 王清,高丽朴,等. 低温预贮对青圆椒采后生理特性的影响研究[J]. 食品工业, 2018, 39(9): 16-20.
[3] 邹学校. 中国辣椒[M]. 北京:中国农业出版社, 2002: 385.
[4] 王毅, 杨宏福,李树德. 园艺植物冷害和抗冷性的研究[J]. 园艺学报, 1994, 21(3): 239-244.
[5] KETSA S, CHIDTRAGOOL S, LURIE S. Prestorge heat treatment and post storage quality of mango fruit [J]. Hort Science, 2000, 35(2): 247-249.
[6] 刘珣. 辣椒采后生理及贮藏保鲜技术研究[D]. 石河子:石河子大学, 2008.
[7] 侯玉婷, 施威,孔令云,等. 采后水果保鲜技术研究进展[J]. 食品工业, 2015, 36(8): 226-231.
[8] 郭时印, 谭兴和,李清明,等. 热处理技术在果蔬贮藏中的应用[J]. 河南科技大学学报:农学版, 2004,24(2): 54-58.
[9] RODONI L M, HASPERUÉ J H, ORIZCM, et al Combined use of mild heat treatment and refrigeration to extend the postharvest life of organic pepper sticks, as affected by fruit maturity stage[J]. Postharvest Biology and Technology, 2016, 117: 168-176.
[10] GONZ LEZ-AGUILAR G A, GAYOSSO L, CRUZ R, et al. Polyamines induced by hot water treatments reduce chilling injury and decay in pepper fruit[J]. Postharvest Biology and Technology, 2000, 18(1): 19-26.
LEZ-AGUILAR G A, GAYOSSO L, CRUZ R, et al. Polyamines induced by hot water treatments reduce chilling injury and decay in pepper fruit[J]. Postharvest Biology and Technology, 2000, 18(1): 19-26.
[11] 钱鑫萍, 杨雪飞,潘利华,等. 热激和储藏温度对果蔬中抗坏血酸含量与相关酶活性的影响[J]. 安徽农业科学, 2011, 39(22): 13 513-13 515.
[12] 孙海燕, 张辰露. 热处理对青椒贮藏品质的影响[J]. 广东农业科学, 2010, 37(7): 116-117.
[13] 范林林, 毛宇豪,夏春丽,等. 热激处理对青椒的保鲜效果研究[J]. 安徽农业科学, 2016, 44(19): 76-79.
[14] 王雷, 张华,张蕾蕾,等. 甜樱桃采后热空气处理抑制青霉病的工艺优化[J]. 农业工程学报, 2017, 33(6): 295-300.
[15] 张建桃, 陈鸿,文晟,等. 柑橘黄龙病热空气快速处理温度场分布特性试验研究[J]. 农业工程学报, 2017, 33(8): 267-277.
[16] 马雪梅, 吴朝峰, 徐晓菇. 热空气处理对草莓采后贮藏品质的影响[J]. 北方园艺,2015(23):138-141.
[17] 马勇, 李君兰,禹兴海,等. 热空气处理对鲜枣采后生理和贮藏品质的影响[J]. 林业科技通讯, 2017(7): 55-61.
[18] AGHDAM M S, BODBODAK S. Postharvest heat treatment for mitigation of chilling injury in fruits and vegetables[J]. Food and Bioprocess Technology, 2014, 7(1): 37-53.
[19] 侯建设, 李中华,江杰. 冷害温度下薄膜包装对青椒贮藏效果的研究[J]. 食品科技, 2002(9): 66-67;70.
[20] 陈健华, 张敏,车贞花,等. 不同贮藏温度及时间对黄瓜果实冷害发生的影响[J]. 食品工业科技, 2012, 33(9): 394-397.
[21] 卢佳华. 低温贮藏黄瓜组织生理生化特性、传热特性及组织细胞结构变化研究[D]. 上海:上海海洋大学, 2013.
[22] 曹建康, 姜微波,赵玉梅. 果蔬采后生理生化实验指导[M]. 北京:中国轻工业出版社, 2011, 115.
[23] LIU Hai, SONG Lili, YOU Yanli, et al. Cold storage duration affects litchi fruit quality, membrane permeability, enzyme activities and energy charge during shelf time at ambient temperature [J]. Postharvest Biology and Technology, 2011, 60(1): 24-30.
[24] 童金华. 不同贮藏温度对青椒贮藏品质影响研究[C]. 第九届全国食品冷藏链大会暨第六届全国冷冻冷藏专业创新发展年会. 北京:国内贸易工程设计研究院, 2014: 4.
[25] 王艳颖, 胡文忠,刘程惠,等. 低温贮藏引起果蔬冷害的研究进展[J]. 食品科技, 2010, 35(1): 72-75;80.
[26] 任军, 黄志霖,曾立雄,等. 低温胁迫下植物生理反应机理研究进展[J]. 世界林业研究, 2013, 26(6): 15-20.
[27] LYONS J M. Chilling injury in plants [J]. Ann Rev Plant Physiology, 1973,24(1): 445-528.
[28] 张誉丹, 牛晓峰,王愈. 电解不同浓度氯化钠生成的酸性功能水对青椒保鲜效果的影响[J]. 食品科技, 2016, 41(9): 80-85.
[29] 杨婷. 膜脂过氧化对植物细胞的伤害[J]. 科技与创新, 2018(8): 61-62.
[30] 王云飞, 毕阳,任亚琳,等. 硅酸钠处理对厚皮甜瓜果实采后病害的控制及活性氧代谢的作用[J]. 中国农业科学, 2012, 45(11): 2 242-2 248.
[31] 张腾国, 聂亭亭,孙万仓,等. 逆境胁迫对油菜谷胱甘肽还原酶基因表达及其酶活性的影响[J]. 应用生态学报, 2018, 29(1): 213-222.
[32] 王静, 孙广宇,姬俏俏,等. 活性氧在果蔬采后衰老过程中的作用及其控制[J]. 包装与食品机械, 2015, 33(5): 51-54;58.
[33] 陈楚英, 陈明,周梦娇,等. 热水处理对冷藏新余蜜橘活性氧代谢的调节[J]. 食品与发酵工业, 2014, 40(1): 238-243.
[34] 沈丽雯, 刘娟,董红敏,等. 热激处理减轻黄瓜冷害与细胞壁代谢的关系[J]. 食品工业科技, 2015, 36(23): 329-332;338.
[35] 王静, 茅林春,李学文,等. 热处理降低哈密瓜果实活性氧代谢减轻冷害[J]. 农业工程学报,2016, 32(2): 280-286.