虾青素(astaxanthin)属于酮式类胡萝卜素,是一种强抗氧化剂,具有清除自由基,修复自由基和紫外线导致的细胞膜和核酸损伤,增强免疫力,抗肿瘤等功效,被广泛应用在医药、食品、保健品、化妆品、饲料添加等领域[1-4]。目前,发酵法生产虾青素所使用的菌种主要是红法夫酵母和雨生红球藻,但因存在产量不高、培养周期长、培养条件苛刻、提取难度大等方面的问题,一定程度上制约了其生产和应用[5-7];因此,虾青素产量高、生产工艺简单、易于培养和大规模生产的产虾青素生物资源一直是人们研究和寻求的目标。
本课题组分离获得1株产虾青素乳杆菌CHU-R,前期试验表明该菌种同时具备雨生红球藻高虾青素含量和红发夫酵母易培养的特点[8-10],且在虾青素提取方面表现出优良性能,通过分批培养,其虾青素含量约为20.0 mg/g干菌体[11-13]。本研究拟采用补料分批发酵进一步提高其生物量及虾青素产量,通过研究补料方式对其各指标的影响确定最佳补料工艺。
1.1.1 菌种
乳杆菌CHU-R[14](由华南农业大学天然农药与化学生物学重点实验室馈赠),华南农业大学食品学院生物工程实验室保存。
1.1.2 培养基
斜面培养基(g/L):去皮切块马铃薯200.0,蔗糖20.0,琼脂粉20.0,pH 6.0;种子制备培养基(g/L):糖蜜15.0(以总糖含量计),(NH4)2SO4 2.0,Na2HPO4·12H2O 1.0,pH 6.0;发酵培养基(g/L):糖蜜20.0(分批发酵为70.0,以总糖含量计),(NH4)2SO4 2.0,Na2HPO4·12H2O 1.0,pH 5.0;补料液浓度(g/L): 糖蜜200.0(以总糖含量计),(NH4)2SO4 20.0,Na2HPO4·12H2O 10.0,pH 4.0~4.5;补料量约占总装料体积20%,以上培养基的湿热灭菌条件为121 ℃,20 min。
LDZX-30KBS立式压力蒸汽灭菌锅,上海申安医疗器械厂;SW-CJ-1FD超净工台,苏州安泰空气技术有限公司;BIOTECH-7BGZ 5 L发酵罐,上海保兴生物设备工程有限公司;DHG-9140A电热鼓风干燥箱,上海一恒科学仪器有限公司;TGL-16GR台式冷冻高速离心机,上海安亭科学仪器厂;Aglinet 1100高效液相仪,Agilent公司。
1.3.1 种子制备
将斜面菌种接种于盛有25 mL种子培养基的250 mL锥形瓶中,置于28 ℃、180 r/min摇床内培养24 h,获得一级种子。然后,取2.5 mL一级种子液置于盛有50 mL新鲜种子培养基的500 mL锥形瓶中,于相同条件培养16 h,获得二级种子。
1.3.2 5 L发酵罐实验
分批发酵:以5% 接种量将二级种子液接入装料系数为0.8的5 L发酵罐中,发酵温度28 ℃,控制溶氧50%左右,压强0.08 MPa,发酵pH 5.0(使用15% NaOH和20% H3PO4控制),溶氧≥50%,培养周期72 h,每8 h取样测定菌体干重及虾青素产量。
以过程pH为补糖依据的补料分批发酵:采用流加方式,当碳源基本耗尽,即pH较基础值上升0.5时开始补料,调节流加速率使每次加入发酵液的糖含量分别为5.0、10.0、15.0、20.0 g/L,直至发酵液中总补糖量达50.0 g/L。其余操作条件与分批发酵相同。
以总糖消耗为补糖依据的补料分批发酵:采用流加方式,当发酵液中残糖含量达到设定值(3.0~6.0、6.0~9.0和9.0~12.0 g/L)开始补料,直至发酵液中总补糖量达50.0 g/L。其余操作条件同分批发酵。
以过程DO为补糖依据的补料分批发酵:采用流加方式,当DO升高到80%为补料依据进行补料,直至发酵液中总补糖量达50.0 g/L,控制DO值分别维持在20%~40%和40%~60%,其余操作条件同分批发酵。
1.3.3 总糖测定
参照GB/T 5009.7—2016直接滴定法[15]。
1.3.4 菌体干重测定
取10 mL发酵液,4 000 r/min离心10 min,除去上层液体,将菌体转移到称量瓶中,无菌水洗涤2次,置于105 ℃烘箱中干燥至恒重,获得菌体净重。根据取样液体积,计算干重浓度(g/L)。细胞得率计算如公式(1):
细胞得率![]()
(1)
1.3.5 虾青素产量测定
虾青素标准曲线绘制:准确称取0.001 g虾青素标准品(Sigma,美国),用少量丙酮溶解,并用甲醇定容至10.0 mL,此时标准溶液质量浓度为100.0 μg/mL。从中取一定量的标准溶液分别稀释至2.5、5.0、10.0、 15.0、20.0 μg/mL。使用高效液相色谱法进行检测,以质量浓度(μg/mL)为横坐标,峰面积为纵坐标制作标准曲线。
虾青素测定:吸取一定量细胞悬浮液,4 000 r/min离心10 min,除去上层液体,无菌水洗涤2次,95%乙醇洗涤2次,无水乙醇洗涤1次,加入一定量二甲基亚砜,将菌体重悬、搅拌均匀后于65.0 ℃水浴1 h,加入适量丙酮,摇匀后于4 000 r/min离心10 min,取上清液采用高效液相色谱仪进行检测并根据标准曲线定量分析。
色谱条件:色谱柱:ZORBAX Eclipse XDB-C18、(4.6×250) mm、5.0 μL;检测波长:480 nm;流动相:甲醇;流速:1.0 mL/min;柱温30.0 ℃;进样量:20.0 μL。
虾青素细胞产率的计算如公式(2):
虾青素细胞产率![]()
(2)
1.3.6 数据处理与计算
数据统计结果采用“平均值±标准差”形式表示,应用SPSS 19.0软件对数据进行方差分析和显著性检验(显著性水平为P<0.05)。
为了研究补料工艺对乳杆菌CHU-R生长代谢的影响,首先在5 L发酵罐中对其进行分批发酵培养,其发酵过程曲线如图1所示。
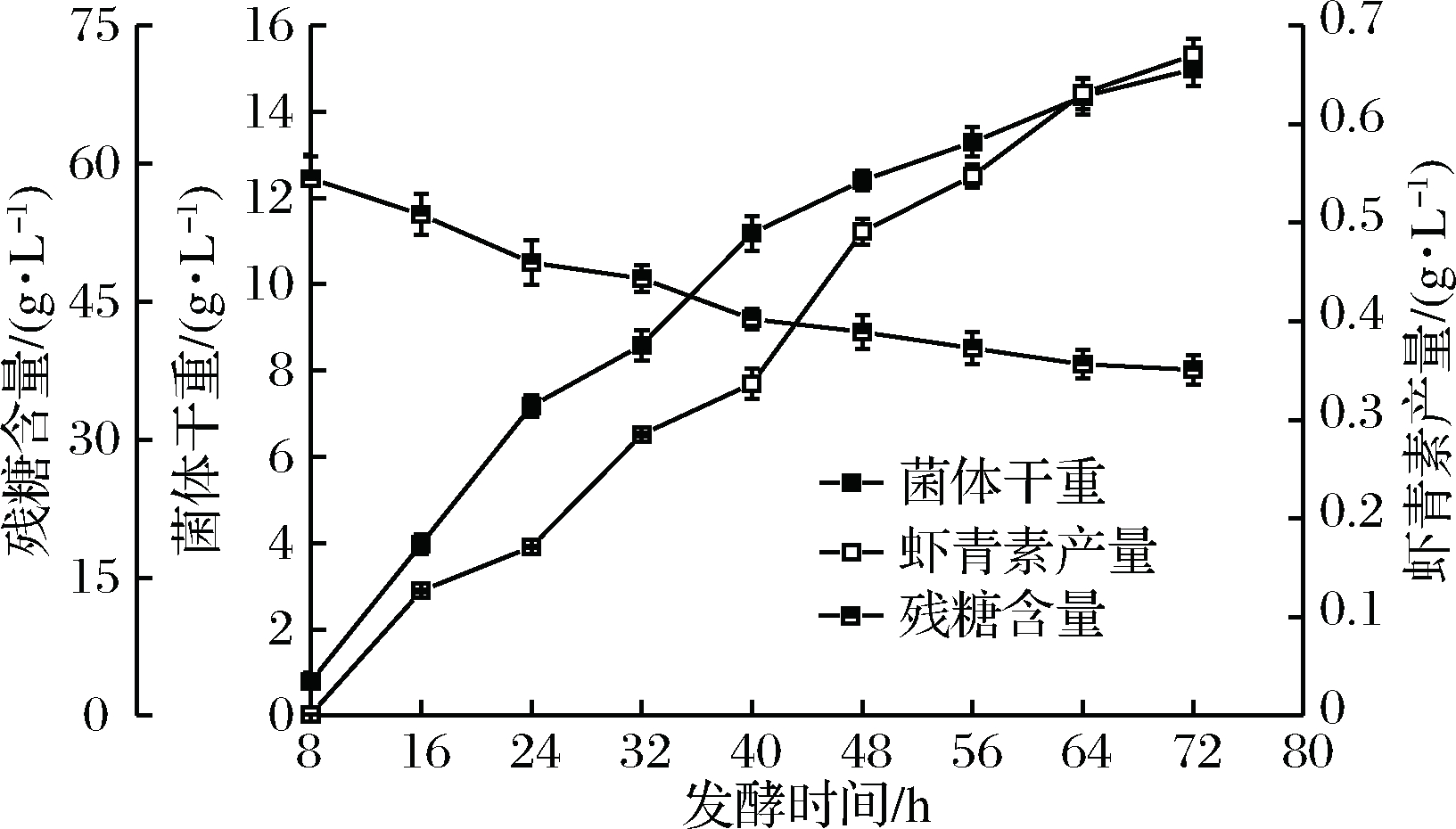
图1 乳杆菌CHU-R分批发酵曲线
Fig.1 Batch fermentation ofLactobacillus CHU-R
分批发酵结果表明,虾青素积累和菌体生长前期相偶联,后期不偶联[16];乳杆菌CHU-R生长的同时,虾青素迅速开始积累;当乳杆菌CHU-R进入对数生长期,虾青素同时进入快速积累期。40 h后,乳杆菌CHU-R对碳源的总消耗速率减慢,菌体生长速率相应放缓,但虾青素积累速率却并未减缓,表明菌体的生长和虾青素积累在不同时期仍有所侧重;前期主要进行菌体生长,而后期主要进行虾青素积累。当菌体生长及虾青素积累速度均渐趋平缓时,培养液中的残糖含量仍相对较高,推断原因可能是高浓度底物对菌体生长产生了抑制效应或者是产物的反馈抑制影响了乳杆菌CHU-R的生长和虾青素的积累[17-18],从而导致了发酵周期延长,碳源的利用率极低,因此有必要进行补料分批发酵。
以过程pH为依据的补料方式中,当pH略有上升时表明培养基的营养基本消耗完毕,此时若补加物料进去,有利于乳杆菌的生长,减缓菌体衰老和抑制自溶,促进产物虾青素的积累[19-20]。
发酵至17 h,pH较基础值上升0.5时开始补料,通过流加补料液控制pH值维持在5.0,补料液流加时长为24 h,发酵结束时乳杆菌CHU-R共加入物料70.0 g/L糖蜜(以总糖含量计)、7.0 g/L(NH4)2SO4和3.5 g/L Na2HPO4·12H2O。由图2可知,4种补糖浓度的菌体干重和虾青素产量变化趋势具有相似性,32 h达到稳定期,菌体干重维持在25.0~30.0 g/L。当补糖质量浓度为20.0 g/L时,生物量达到最大值(32.43 g/L), 不同时间下的虾青素产量在40 h前有较显著差异(最高值为1.39 g/L),表明以过程pH为补糖依据的补料模式中,每次补糖后,流加浓度的差异对乳杆菌CHU-R生长及虾青素积累虽有一定影响,但幅度不大;综合考虑成本因素,以流加浓度20.0 g/L 较为合适。在16 h前培养液中的初糖被迅速消耗,因为在17 h进行补料,发酵液中全程保持一定浓度的可利用碳源,菌体可维持一定的生长活力,残糖的含量维持在3.0~8.0 g/L。与分批发酵相比,以过程pH为补糖依据的补料模式能显著提高乳杆菌CHU-R菌体量、虾青素积累量及对残糖的利用率。

图2 以过程pH为补糖依据对乳杆菌CHU-R发酵过程的影响
Fig.2 Effect of process pH as supplementary sugar on fermentation process ofLactobacillus CHU-R
以总糖消耗为补料依据,是补料分批发酵中较为简单有效的一种底物补加策略。在此补料方式中,当发酵至12~16 h残糖浓度达到补糖设定值时开始补料,通过流加补料液控制残糖浓度维持在设定值,补料液流加时长为25~30 h,发酵结束时乳杆菌CHU-R共加入物料70.0 g/L糖蜜(以总糖含量计)、7.0 g/L(NH4)2SO4和3.5 g/L Na2HPO4·12H2O。如图3所示,3种补糖方式的菌体干重变化趋势具有相似性,差异较小;稳定期时菌体干重维持在25.0~30.0 g/L,最大值为32.96 g/L;然而,不同补糖方式的虾青素产量具有明显差异,而且,以6.0~9.0 g/L为设定值开始补糖的方式所得效果最佳。

图3 以总糖消耗为补料依据对乳杆菌CHU-R发酵过程的影响
Fig.3 Effect of total sugar consumption on the fermentation process ofLactobacillus CHU-R
这些结果表明补糖时机非常重要,补糖太早,发酵液中维持较高糖浓度,很可能不利于虾青素积累。与分批发酵相比,该发酵方式,维持了合适的碳源浓度,显著提高了乳杆菌CHU-R菌体量、虾青素积累量及对碳源的利用率,实验结果与卢富山等[21]利用葡萄糖反馈流加维持较低的糖浓度从而提高植物乳杆菌数结果相似。
由于该乳杆菌产虾青素是一个强好氧过程,因此培养液的溶氧浓度是影响菌体生长和虾青素合成的重要因素。当培养液的溶氧降低到一定水平时,溶氧的供应就无法满足其生长需求[22],导致虾青素产量降低。
在该补料工艺中,发酵至15~16 h开始补料,通过流加补料液控制溶氧浓度维持在设定值,补料液流加时长为35 h,发酵结束时乳杆菌CHU-R共加入物料70.0 g/糖蜜(以总糖含量计)、7.0 g/L (NH4)2SO4和3.5 g/L Na2HPO4·12H2O。由图4可知,在以过程DO为补料依据进行补料时,控制溶氧40%~60%的菌体干重和虾青素产量均高于溶氧20%~40%,且前者的残糖含量低于后者。其中,控制40%~60%溶氧的补料方式下,稳定期时,菌体干重保持在33.0~36.0 g/L(最高值39.73 g/L),虾青素产量维持在1.20~1.50 g/L。实验表明,较高的溶氧量使乳杆菌CHU-R充分利用发酵液中的残糖,使残糖含量维持在较低水平,提高了残糖的利用率,从而促进了乳杆菌CHU-R的生长和提高虾青素产量。
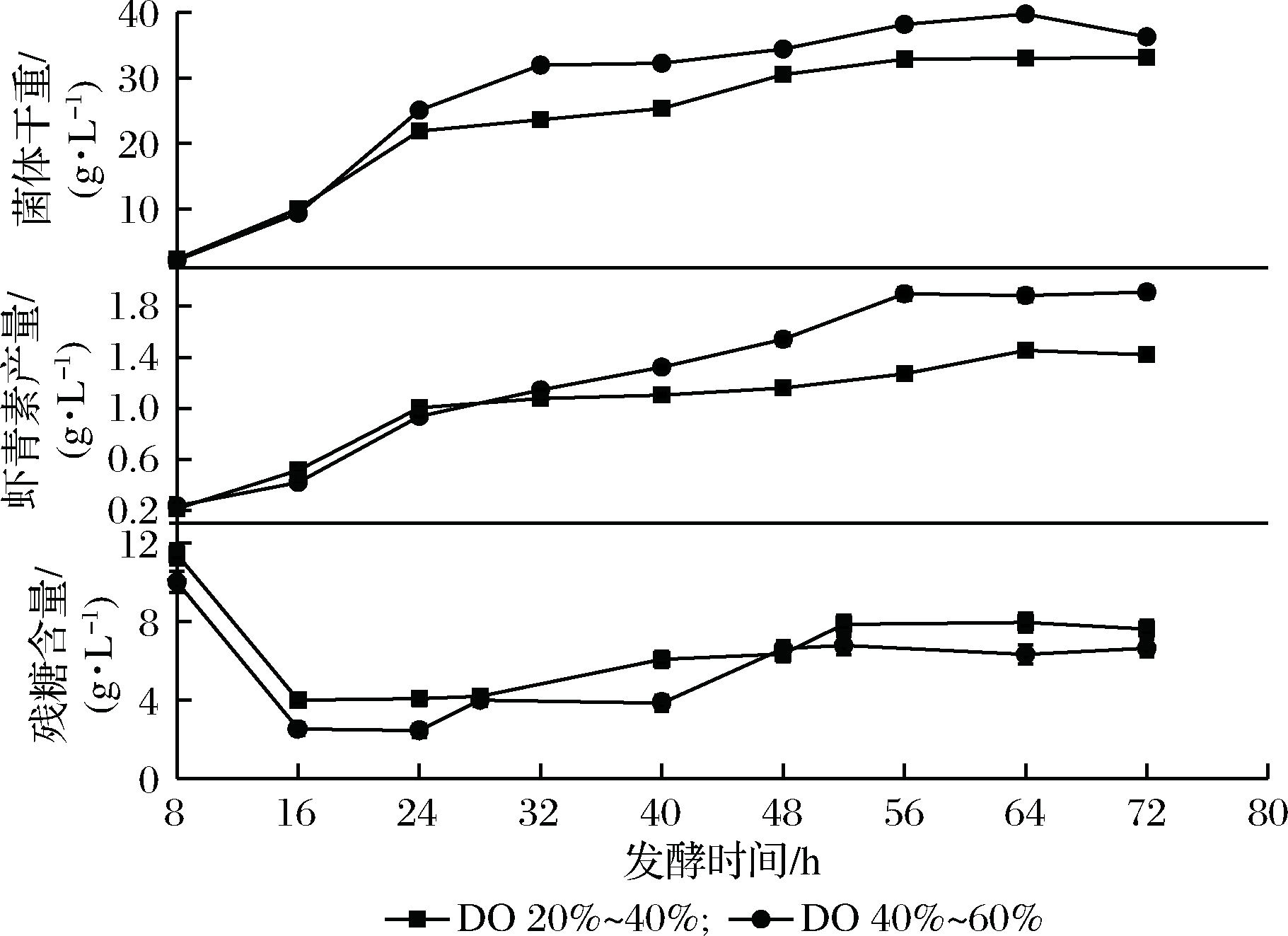
图4 以过程DO为补料依据对乳杆菌CHU-R发酵过程的影响
Fig.4 Effect of process DO as feeding basis on fermentation process ofLactobacillus CHU-R
根据上述不同补料分批发酵结果选择具有代表性时刻对3种补料方式的残糖含量进行分析比较,结果如图5所示,发现3种补料工艺的残糖浓度差异显著(P<0.05)。
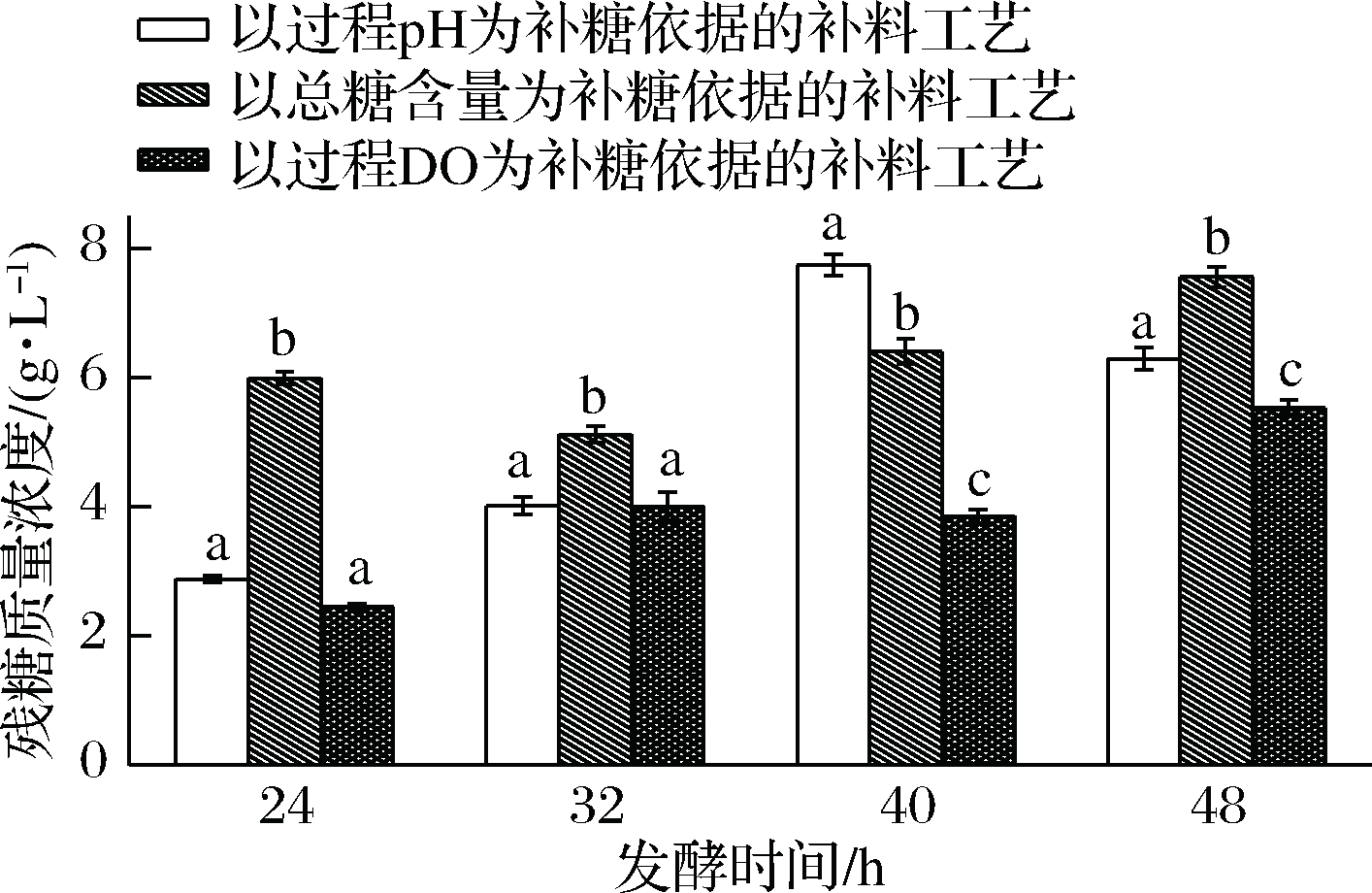
图5 不同补料方式发酵液中残糖质量浓度变化趋势
Fig.5 Trend of residual sugar concentration in fermentation broth with different feeding modes
注:图中不同字母表示差异显著(P<0.05)。
以过程pH为补糖依据的补料工艺是一种基于响应pH值变化的补料策略[23],因乳杆菌CHU-R是偶联的,虾青素积累可能更多利用发酵液中的有机酸等代谢产物,导致乳杆菌CHU-R未完全利用完发酵液中的碳源的情况下,触发了补料机制致使补料前期乳杆菌CHU-R对发酵液的碳源利用率较低,最终因产物反馈抑制或者渗透压升高等其他原因使乳杆菌CHU-R生长受到影响。
然而在以总糖消耗为依据的补料方式中,虽然全程严格控制碳源浓度,使得碳源浓度完全满足乳杆菌CHU-R的生长需求,但陈敏纯等[14]前期研究表明乳杆菌CHU-R生长和虾青素积累过程是好氧过程,乳杆菌CHU-R的快速生长会导致氧需求量不断增加,在此补料策略过程中,发酵液中的溶氧含量随着发酵时间越来越低,最终因发酵设备的供氧能力限制而不能满足乳杆菌CHU-R对氧气的需求,从而抑制了乳杆菌CHU-R的生长,因此发酵结果与以过程pH为补糖依据的补料工艺相似,无法达到最佳效果。
补料工艺的关键是确保基质消耗速率和补料流加速率的平衡,使发酵过程中基质浓度维持在合适范围,降低渗透压和菌种生存环境变动以减小对菌体活力的损伤[24]。在以过程DO为补糖依据的补料方式中,在保证供氧的情况下以溶氧浓度变化来判断补料时机,虽全程碳源浓度相对较低,但基本可以满足乳杆菌CHU-R生长需求,结合图5显著性差异分析,发酵液中残糖浓度对乳杆菌CHU-R发酵过程有较大影响,而且,在发酵过程中保持菌体处于半饥饿状态,可以刺激乳杆菌CHU-R的生长和产物的积累,因而其可以充分利用发酵液中的碳源,使发酵液的残糖浓度低于其他两种补料工艺,既保证了原料的利用率,同时进一步提高了乳杆菌CHU-R菌体量和虾青素积累量,与桑美纳等[25]通过补料方式将碳源浓度和溶解氧浓度同时控制在适中水平从而提高头孢菌素C浓度效果方法一致。
乳杆菌CHU-R分批发酵及以过程pH为补糖依据、以总糖消耗为补料依据、以过程DO为补料依据的补料方式下,最佳的菌体生长和虾青素合成情况如表1所示。
结果表明,相比分批发酵,3种补料工艺均能显著提高乳杆菌CHU-R的菌体干重、虾青素产量和细胞得率,其中,以过程DO为补糖依据的补料工艺能提高乳杆菌CHU-R生物量至2.6倍,虾青素产量至2.8倍,但其对提高虾青素细胞产率效果不显著,原因可能是虽然通过提高每升发酵液中的乳杆菌CHU-R菌体量而提高了虾青素总产量,但对于单菌的虾青素积累量却没有显著提高。关于如何进一步提高单菌的虾青素积累量,仅靠补料工艺难以达到理想的效果;因其涉及到虾青素合成代谢途径和代谢控制,若想显著提高单菌的虾青素积累量,需对乳杆菌CHU-R产虾青素的机制进行全面研究。
表1 乳杆菌CHU-R不同补料分批发酵工艺结果
Table 1Lactobacillus CHU-R different fed-batch fermentation process results
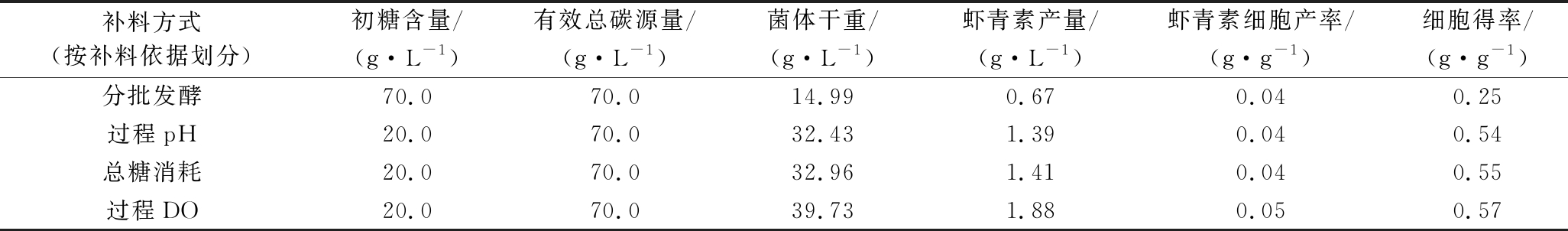
补料方式(按补料依据划分)初糖含量/(g·L-1)有效总碳源量/(g·L-1)菌体干重/(g·L-1)虾青素产量/(g·L-1)虾青素细胞产率/(g·g-1)细胞得率/(g·g-1)分批发酵70.070.014.990.670.040.25过程pH20.070.032.431.390.040.54总糖消耗20.070.032.961.410.040.55过程DO20.070.039.731.880.050.57
在本研究中,乳杆菌CHU-R作为虾青素的生产菌株,在5 L反应器中进行分批发酵和补料分批发酵,其中补料分批发酵的方式有3种,其补料依据分别是过程pH、总糖消耗和过程DO。经过大量试验发现,相对分批发酵对照组,本研究中采用的3种补料方式均可显著提高植物乳杆菌CHU-R的生物量及其虾青素积累量,其中以过程DO为补糖依据的补料分批发酵可达到最高,该发酵过程中的乳杆菌CHU-R生物量和虾青素产量(最大值)分别是39.73 g/L和1.88 g/L,是分批发酵对照组的2.6和2.8倍,同时,该发酵全程保持着较高的溶氧量和较低却足够的糖浓度,有利于乳杆菌CHU-R生长和虾青素积累。
[1] SCHMIDT I, SCHEWE H, GASSEL S, et al. Biotechnological production of astaxanthin withPhaffia rhodozyma/Xanthophyllomyces dendrorhous[J]. Applied Microbiology and Biotechnology, 2011, 89(3): 555-571.
[2] 吴伟,喻昕.一种新的提高法夫酵母中虾青素稳定性的方法[J]. 中国食品添加剂, 2013(4):141-144.
[3] 孙协军,赵爽,李秀霞,等. 虾青素的研究进展[J]. 食品与发酵科技,2015,51(5):62-66.
[4] 邹晓莹,钟先锋,上官国莲,等.法夫酵母虾青素提取工艺及功能研究进展[J]. 食品工业,2018,39(5):271-274.
[5] 董玉华,赵元凤. 虾青素生物学来源和功能的研究进展[J]. 水产科学,2005,24(10):50-52.
[6] AMAKASU K, ONO A, HIRANO D, et al. Distribution and density of Antarctic krill (Euphausia superba) and ice krill (E.crystallorophias) off adélie land in austral summer 2008 estimated by acoustical methods[J]. Polar Science, 2011, 5(2): 187-194.
[7] 蔡俊,游智能.发酵法生产虾青素的研究进展[J]. 食品科学,2015,36(23):358-366.
[8] 周玲燕.基于菊芋原料的红发夫酵母补料分批培养合成虾青素及其在化妆品中应用的研究[D]. 广州:华南理工大学,2016.
[9] 姜思,佟少明.雨生红球藻虾青素合成研究进展[J]. 生物工程学报,2019,35(6):1-10.
[10] 邢涛,张慧,祁琳琳,等.从雨生球藻中提取虾青素的工艺研究[J]. 中国食品添加剂,2018,11(6):169-174.
[11] 谭颖嫦,廖美德,秦鹏,等.CHU-R菌株产虾青素的发酵工艺研究[J]. 现代食品科技,2012,28(3):289-291;296.
[12] 蹇华丽,宋光均,陈敏纯,等.乳杆菌CHU-R虾青素提纯工艺研究[J]. 食品工业,2014,35(5):98-101.
[13] 蹇华丽,宋光均,陈敏纯,等.CHU-R菌株虾青素稳定性及抗氧化活性研究[J]. 中国食品添加剂,2014,6(2):114-119.
[14] 陈敏纯,廖美德.产虾青素菌株CHU-R的鉴定及其培养条件优化[J]. 西北农林科技大学学报(自然科学版),2012,40(6):153-160.
[15] GB/T 5009.7—2016,食品中还原糖的测定[S]. 北京:中国标准出版社,2016.
[16] 王有旭.补料分批发酵生产柠檬酸的研究[D]. 石家庄:河北科技大学,2013.
[17] 吴军林,柏建玲,莫树平,等.乳酸菌R8高密度培养的发酵工艺研究[J]. 现代食品科技,2018,34(2):164-170;251.
[18] HOSSAIN M, BROOKS J D, MADDOX I S. The effect of the sugar source on citric acid production by Aspergillus [J]. Applied Microbiology and Biotechnology, 1984, 19(6): 393-397.
[19] 王旎,管斌,孔青,等.利用控pH流加培养法提高雨生红球藻的生物量及虾青素产量[J]. 食品与发酵工业,2016,42(2):120-124.
[20] PARK J C, CHOI S P, HONG M E, et al. Enhanced astaxanthin production from microalgaHaematococcus pluvialis by two-stage perfusion culture with stepwise light irradiation[J]. Bioprocess and Biosystems Engineering, 2014, 37(10): 2 039-2 047.
[21] 卢富山,尹清强,赵卫卫,等.分批补料式高密度培养植物乳杆菌的研究[J]. 江西农业学报.2018,30(6):84-87.
[22] 李秋琴,王世杰,陆淳,等.乳酸菌高密度培养及其在产品中保持高密度的研究[J]. 中国乳品工业,2011,39(5):21-25.
[23] 蒋兴龙,洪清林,蔡慧农,等.补料工艺对两株法夫酵母菌株产虾青素的影响[J]. 微生物学通报,2013,40(11):1 996-2 004.
[24] 田原,张勇,宋安东,等.pH值反馈控制赖氨酸补料发酵中的碳氮源补加方法[J]. 过程工程学报,2011,11(3):492-496.
[25] 桑美纳,袁国强,李红飞,等.不同补料控制方式发酵生产头孢菌素C的性能比较[J]. 微生物学通报,2011,38(9):1 321-1 330.