益生菌是摄入足量后对宿主的健康有益的活的微生物[1],乳酸菌属和双歧杆菌属是最常使用的益生菌属[2],是国际公认的食品级安全微生物[3]。乳酸菌可通过改善肠道菌群的平衡,促进良好的消化,提高免疫力,降低胆固醇,减轻乳糖不耐受等,发挥其益生功能[4]。干酪乳杆菌属于乳酸菌属,广泛存在于传统发酵乳制品和人的口腔、肠道内含物、粪便等中。作为一种益生菌,干酪乳杆菌因其营养价值和保健作用越来越受到关注,相关研究逐年增多。分离自人体粪便的L.casei Shirota在提高肠道健康、调节人体免疫力、预防肿瘤、预防肺炎、抗敏性等方面已有大量研究,我国自行分离、鉴定并拥有相关专利的L.casei Zhang和L.casei BL23 的益生功能也在不断的探索和验证中[5]。同时,干酪乳杆菌作为一种工业微生物菌株,广泛应用于发酵食品中[6],L.casei Shirota发酵的Yakult乳饮料已经被全世界广泛接受。
FAO/WHO认定益生菌的标准,须满足3个基本特点:耐受胃肠黏膜的环境,黏附宿主的肠壁细胞,分泌物或者分解产物为抗菌物质[7]。而耐药性问题是乳酸菌应用安全方面的首要问题[8-9]。因此,为了更好地开发及利用南昌大学食品科学与技术国家重点实验室保藏的3株干酪乳杆菌,本研究通过对这几株干酪乳杆菌的耐高盐、耐酸、耐胆盐、自凝聚性、疏水性、黏附性、抑菌性及抗生素耐药性进行测定,为菌株在后期的健康食品和功能食品中的应用提供理论支持。
人源干酪乳杆菌NCU011056、NCU011057、NCU011 061,单核增生李斯特菌CMCC 54007、金黄色葡萄球菌CMCC 26003、大肠埃希氏菌CMCC 44496、沙门氏菌CMCC 50041,由南昌大学食品科学与技术国家重点实验室保藏提供。
MRS培养基(g/L):蛋白胨10、牛肉膏10、葡萄糖30、无水乙酸钠5、酵母膏5、柠檬酸三胺2、K2HPO4 2、MgSO4 0.2、吐温-80 1,pH 6.5,121 ℃灭菌20 min。
LB培养基(g/L):胰蛋白胨10、酵母粉5、NaCl 10,pH 7.0~7.2,121 ℃灭菌20 min。
DMEM完全培养液:DMEM培养液、10%(体积分数)胎牛血清、1%青-链霉素、1%非必需氨基酸。
DMEM培养液、1×PBS缓冲液(phosphate buffered saline,PBS)、优级胎牛血清:赛澳美细胞技术(北京)有限公司;牛胆盐、青-链霉素、胰蛋白酶-EDTA消化液:北京索莱宝科技有限公司;二甲苯:天津大茂化学试剂厂;抗生素:温州市康泰生物科技有限公司。
DWS-DG250厌氧工作站,华粤行仪器有限公司;CO2培养箱,长沙长锦科技有限公司; DNP-9272型生化培养箱,上海精宏实验设备有限公司;TU-1901双光束紫外可见分光光度计,北京普析通用仪器有限责任公司;Thermo-ST16高速冷冻离心机,赛默飞世尔(中国)科技有限公司;37XC倒置生物显微镜,上海光学仪器进出口有限公司。
1.3.1 菌株耐酸耐胆盐性能测定
在普通MRS液体培养基中加入NaCl,使其质量浓度分别为50、100 g/L;用稀HCl调整普通MRS液体培养基使其pH分别为3.0、2.0;在普通MRS液体培养基中加入牛胆盐,使其质量浓度分别为3、5 g/L;同时以普通MRS作为对照;将3株干酪乳杆菌株活化后,接种于上述不同MRS液体培养基中,37 ℃ 孵育,于0和4 h取样,稀释至合适梯度后涂布,培养48 h后平板活菌菌落计数,按公式(1)计算存活率[10]:
存活率![]()
(1)
1.3.2 菌株自凝聚性能测定
将过夜培养的菌株离心收集菌体,生理盐水洗涤2次,用生理盐水调整菌株菌液浓度至108 CFU/mL。在37 ℃孵育24 h。在第0、3、6和24 h时,取菌悬液上层,于600 nm下测定吸光度(At),每次测定3个平行。按照公式(2)计算细菌的自凝聚率[11]:
自凝聚率![]()
(2)
式中:A0表示0 h时刻菌体初始吸光值;At代表t时刻菌悬液上层的吸光值。
1.3.3 菌株表面疏水性能测定
将过夜培养的菌株离心收集菌体,生理盐水洗涤2次,用生理盐水调整菌株菌液浓度至108CFU/mL。取2 mL调好浓度的菌悬液与2 mL二甲苯混合,漩涡振荡10 min,静置30 min。取水相在600 nm下测定A值,每次测定3个平行。按照公式(3)计算细菌的疏水性[12]:
表面疏水性![]()
(3)
式中:A0和A分别表示与二甲苯混匀前后水相在600 nm下测量所得的吸光值。
1.3.4 菌株对结肠癌Caco-2细胞系黏附性能测定
将细胞培养瓶中的CaCo-2细胞用胰酶-EDTA消化液进行消化,之后用DMEM完全培养液调整细胞浓度为105 cells/mL,装于6孔组织培养板中,每孔2 mL,于5% CO2、95%空气培养箱中37 ℃孵育至细胞长至单层。弃去组织培养板中各孔的DMEM营养液,用无菌PBS缓冲液洗板2遍,其中1个孔用0.4 mL胰酶-EDTA消化液进行消化后,加入0.6 mL PBS,用巴氏吸管吹打,将细胞完全消化下来并使之混合均匀,血球计数板计算细胞浓度。其他5孔加入1 mL DMEM不完全培养液和1 mL菌悬液(108 CFU/mL),混合均匀,于培养箱中,37 ℃孵育2 h。孵育后弃去组织培养板中各孔的混合液,用无菌PBS缓冲液洗涤5次,以除去未黏附的菌体。加入0.4 mL胰酶-EDTA消化液进行消化后加入0.6 mL无菌PBS缓冲液,进行梯度稀释,涂布于MRS固体平板上计算黏附的细菌数[12],如公式(4):
黏附指数![]()
(4)
1.3.5 菌株抑菌性能测定
采用牛津杯法[13]测定3株菌株的无细胞上清液对常见病原菌的抑制能力来评价菌株的抑菌性能。选取由南昌大学食品科学与技术国家重点实验室保藏提供的单核增生李斯特菌CMCC 54007、金黄色葡萄球菌CMCC 26003、大肠埃希氏菌CMCC 44496和沙门氏菌CMCC 50041作为指示菌均匀涂布于LB固体培养基中,将牛津杯放置于培养皿中;将培养24 h的3株干酪乳杆菌菌悬液离心取上清,每个牛津杯中加入200 μL上清液,37 ℃放置12 h,测定抑菌圈直径。
1.3.6 菌株抗生素耐药性评价测定
采用K-B(药敏纸片琼脂扩散法)进行药敏试验来评价菌株的抗生素耐药性。取无菌生理盐水稀释后浓度为1.0×109CFU/mL的菌悬液0.1 mL,均匀涂布于固体培养基表面,放置30 min以上。待干燥后,将纸片平贴在涂好细菌的琼脂表面。所用的药敏纸片分别为:青霉素G(10 μg)、阿莫西林(10 μg)、头孢曲松(30 μg)、诺氟沙星(10 μg)、环丙沙星(5 μg)、 万古霉素(30 μg)、替考拉宁(30 μg)、庆大霉素(10 μg)、卡那霉素(30 μg)、四环素(30 μg)、红霉素(15 μg)、利福平(5 μg)。贴好药物纸片的平板放置30 min以上,然后倒置平板37 ℃培养48 h,用游标卡尺测量各药敏纸片的抑菌圈大小[11]。
1.3.7 数据处理
所有试验重复3次,试验结果以平均值±标准差表示,采用Origin 9.0将所得的实验数据绘制成图;使用SPSS 20.0软件进行数据统计分析(P<0.05)。
菌株的耐高盐能力对菌株在胃肠道中的生存以及其在工业生产中应用等有重要意义,高盐环境容易造成菌体细胞脱水、质壁分离,从而导致菌体代谢被抑制,甚至导致菌体死亡[14]。图1显示,在50 g/L质量浓度盐环境中孵育4 h后,3株菌的活菌数基本保持不变,在 100 g/L高质量浓度盐环境中孵育4 h后,存活率均约为95%。
菌株能在pH 3.0条件下存活是衡量其耐酸性的标准之一[15],为进一步模拟胃酸的情况,本实验同时测定了pH 2.0条件下菌株的耐受情况。在pH 3.0下孵育4 h后,3株干酪乳杆菌的存活率都高达97%以上,且NCU011056活菌数有正增长,在pH 2.0条件下孵育4 h后,3株菌的存活率都在84%以上。
菌株经过胃的消化后到达小肠,人体小肠中胆盐质量浓度一般为0.3~3 g/L[16],为进一步测定菌株对胆盐耐受性,本研究同时对菌株在3和5 g/L胆盐下3株菌的存活情况进行了实验。3株干酪乳杆菌在3 g/L胆盐下孵育4 h后存活率均在70%以上,且NCU011056的存活率高达86.10%,随着胆盐浓度的增加,耐受性下降,在5 g/L胆汁盐下,NCU011055的存活率降至50.12%,而NCU011056存活率仍然保持在80%。
本研究中3株干酪乳杆菌都是从婴儿粪便中筛选的,经过了胃和肠道的消化到大肠,这可能是其对高盐、酸和胆盐具有高耐受性的原因。

图1 三株干酪乳杆菌在不同环境中处理4 h后的存活情况
Fig.1 Survival of the three strains ofLactobacillus casei treated with various conditions for 4 h
研究表明,菌株的自凝聚有助于肠道定植,并对生物膜的形成有重要影响,自凝聚性能较强的菌株能够在肠道细胞表面形成一层天然的屏障防止食源性致病菌定殖于肠道表面[17]。3株干酪乳杆菌菌株的自聚性能的实验结果如表1所示。3株菌株悬液的自凝聚率都随孵育时间的延长而增大,24 h后都在70%以上,其中干酪乳杆菌NCU011056自聚率相对最高,为83.81%。MONTORO等[18]提出,细菌的自凝聚能力可分为:低(16%~35%),中等(35%~50%)和高(50%以上)。由此可见,这3株干酪乳杆菌的自凝聚能力均处于较高水平。
表1 三株干酪乳杆菌菌株自凝聚情况
Table 1 Co-aggregation of the three strains ofLactobacillus casei
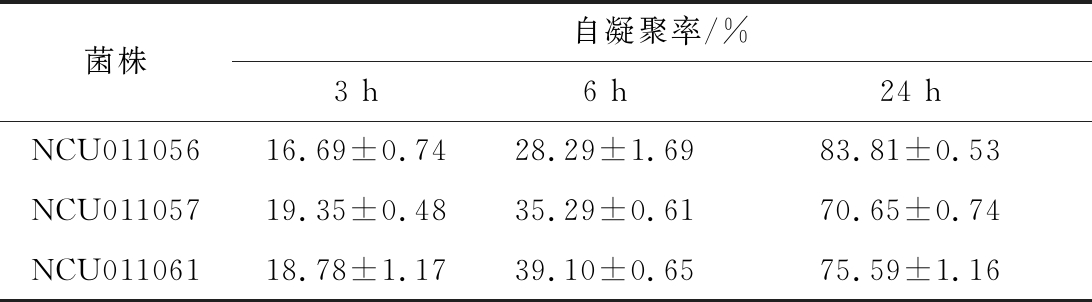
菌株自凝聚率/%3 h6 h24 hNCU01105616.69±0.7428.29±1.6983.81±0.53NCU01105719.35±0.4835.29±0.6170.65±0.74NCU01106118.78±1.1739.10±0.6575.59±1.16
疏水性是细菌与肠道表皮细胞相互吸附的重要指标之一,细菌表面疏水性作为乳酸菌的表面特性,被用于间接评估益生菌的黏附能力[19],DEL等[20]提出40%疏水性是益生菌菌株的基本要求的最小值,3株菌株的表面疏水性能测试结果如表2所示。干酪乳杆菌NCU011057对二甲苯的疏水率为86.21%,其他2株干酪乳杆菌的疏水率都在95%以上,远高于RIAZ等[21]从母乳中筛选的7株乳酸菌的疏水率(33%~69%),这表明了这3株干酪乳杆菌对二甲苯都表现出了高度的疏水性。
表2 三株干酪乳杆菌菌株表面疏水性及 对Caco-2细胞系黏附情况
Table 2 Surface hydrophobicity of three strains ofLactobacillus casei and adhesion to Caco-2 cell line

菌株表面疏水率/%对Caco-2细胞的黏附率/%NCU01105696.93±0.89a60.08±3.65aNCU01105786.21±0.79b14.52±2.81bNCU01106195.12±0.44a32.57±2.23c
注:同列不同字母表示差异显著。下同。
高黏附的菌株能够在动物肠道中停留相对较长的时间,有利于菌群在肠道内长久定植,竞争致病菌黏附位点,巩固肠黏液屏障,维持肠道健康[22]。Caco-2细胞系是分离自人结肠癌细胞的细胞株,以表皮吸附的方式生长,在适当的培养条件下,可以表现出成熟肠道所具有的特征,采用Caco-2单层细胞更能模拟体内肠道黏附[23]。3株干酪乳杆菌对Caco-2细胞系黏附情况如表2所示。3株干酪乳杆菌的黏附能力具有明显差异,NCU011056较其他菌株表现出较强的黏附能力,黏附指数为60.08%,且远高于DAS等[24]研究的3株干酪乳杆菌的黏附指数(32%~45%),NCU011057的黏附能力相对最弱,为14.52%,但也高于赵圣明等[25]研究的6株乳酸菌的黏附率(其中最高为13.57%)。
乳酸菌抑制致病菌的生长,有助于胃肠道菌群的微生态环境健康[26]。3株干酪乳杆菌发酵液对指示菌的抑菌作用如表3所示。3株干酪乳杆菌对革兰氏阳性和革兰氏阴性指示菌均表现出了抑菌活性,对单核增生李斯特菌和沙门氏菌的抑菌能力相对较强;其中,与其他2株干酪乳杆菌相比,NCU011056对4株指示菌的抑菌直径均相对较大,显示了较强的抑菌能力。
表3 三株干酪乳杆菌的抑菌情况
Table 3 Antibacterial activity of the three strains ofLactobacillus casei
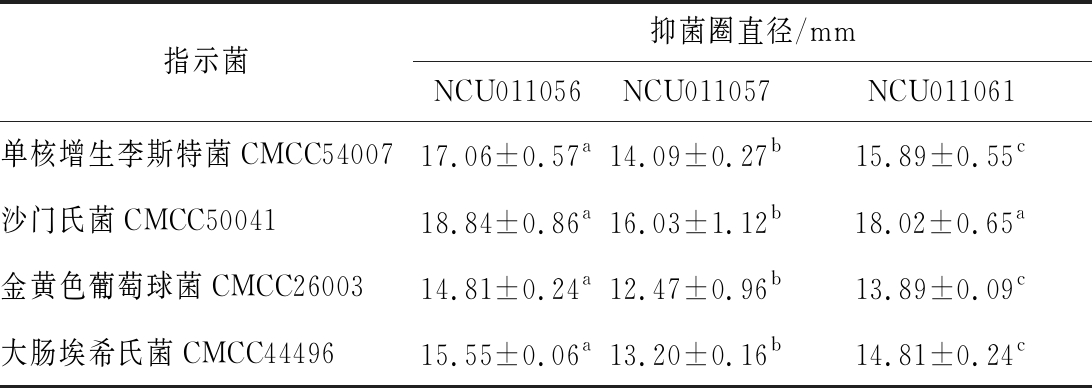
指示菌抑菌圈直径/mmNCU011056NCU011057NCU011061单核增生李斯特菌CMCC5400717.06±0.57a14.09±0.27b15.89±0.55c沙门氏菌CMCC5004118.84±0.86a16.03±1.12b18.02±0.65a金黄色葡萄球菌CMCC2600314.81±0.24a12.47±0.96b13.89±0.09c大肠埃希氏菌CMCC4449615.55±0.06a13.20±0.16b14.81±0.24c
通过对菌株进行药敏性测定,可避免耐药性对菌株应用安全方面的影响。3株干酪乳杆菌通过引用CHARTERIS等[27]提供的抑菌圈直径评判标准,测定的药敏性能结果如表4所示。表4显示了3株测试菌株具有类似的抗生素敏感性,这可能与该3株干酪乳杆菌来源于同一个6个月母乳喂养的婴儿的粪便有关。这3株干酪乳杆菌对青霉素、阿莫西林、头孢曲松、四环素、氯霉素、红霉素、利福平抗生素均敏感,对环丙沙星均中度敏感,对万古霉素、替考拉宁、庆大霉素、卡那霉素等抗生素均具有抗性,这种抗性与很多报道[24,28]相似:很多乳酸菌对万古霉素、替考拉宁先天具有抗性,且这种耐药性一般不会转移传递给致病菌[28]。
表4 三株干酪乳杆菌对不同抗生素敏感性情况
Table 4 Sensitivity of the three strains ofLactobacillus casei to antibiotics
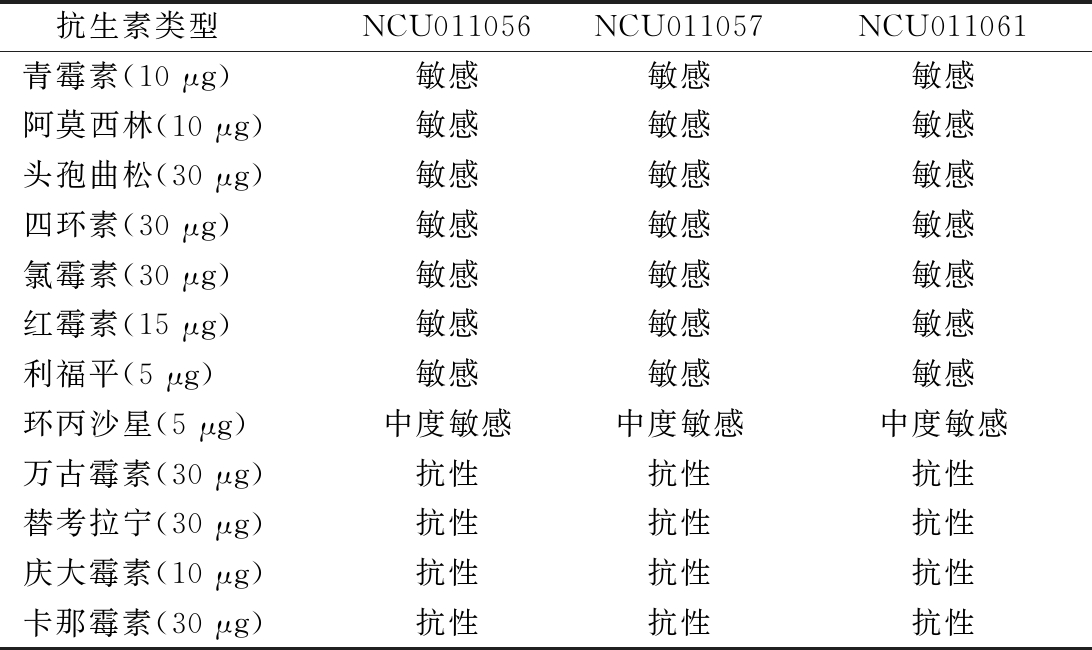
抗生素类型NCU011056NCU011057NCU011061青霉素(10 μg)敏感敏感敏感阿莫西林(10 μg)敏感敏感敏感头孢曲松(30 μg)敏感敏感敏感四环素(30 μg)敏感敏感敏感氯霉素(30 μg)敏感敏感敏感红霉素(15 μg)敏感敏感敏感利福平(5 μg)敏感敏感敏感环丙沙星(5 μg)中度敏感中度敏感中度敏感万古霉素(30 μg)抗性抗性抗性替考拉宁(30 μg)抗性抗性抗性庆大霉素(10 μg)抗性抗性抗性卡那霉素(30 μg)抗性抗性抗性
益生菌不断被应用于健康食品和功能食品中[29],对提高食品安全性、丰富营养成分、赋予产品功能特性和改善产品风味等起到重要作用[30]。本研究对南昌大学食品科学与技术国家重点实验室保藏的3株干酪乳杆菌耐受性、黏附性、抑菌性及抗生素耐药性进行了探究,结果表明,3株干酪乳杆菌对高盐、酸和胆盐环境具有高耐受性,自凝聚率24 h后都在70%以上,对二甲苯的疏水率都在86%以上,对Caco-2细胞系的黏附率为14.52%~60.28%(其中NCU011056的黏附率为60.28%),对4种常见的革兰氏阳性和革兰氏阴性致病菌都有抑制能力,对青霉素、阿莫西林、头孢曲松、四环素、氯霉素、红霉素、利福平均敏感,对环丙沙星均中度敏感。综上所述,3株人源干酪乳杆菌,尤其是NCU011056,是十分有潜力的优良益生菌株。后期可将这3株干酪乳杆菌进行动物实验来评价其具体益生性能,并可考虑应用于发酵奶制品、果蔬等食品,或制成益生菌菌剂应用于保健品等行业中。
[1] FAO/WHO. Probiotics in food: Health and Nutritional Properties and Guidelines for Evaluation[M]. Rome: World Health Organization and Food and Agriculture Organization of the United Nations, 2006.
[2] DACRUZ A G, DEAF-FARIA J, DENDER A G F. Packaging system and probiotic dairy foods[J]. Food Research International, 2007, 40(8):951-956.
[3] DASILVASABOS S, VITOLO M, GONZ LEZ J M D, et al. Overview ofLactobacillus plantarum as a promising bacteriocin producer among lactic acid bacteria[J]. Food Research International, 2014, 64:527-536.
LEZ J M D, et al. Overview ofLactobacillus plantarum as a promising bacteriocin producer among lactic acid bacteria[J]. Food Research International, 2014, 64:527-536.
[4] PARVEZ S, MALIK K A, AHKANG S, et al. Probiotics and their fermented food products are beneficial for health[J]. Journal of Applied Microbiology, 2006, 100(6):1 171-1 185.
[5] 鲍志宁. 干酪乳杆菌GBHM-21鉴定、中试制备及发酵技术研究[D]. 广州:华南理工大学, 2015.
[6] 杨子燕, 赵世伟,马万平,等. 干酪乳杆菌的筛选及其在活性乳酸菌饮料中的应用[J]. 食品工业科技, 2018, 39(3): 106-111.
[7] 周晏阳, 孔雪英,吴梅,等. 1株牦牛源产细菌素植物乳杆菌的益生特性分析[J]. 食品科学, 2018, 39(14): 132-137.
[8] 杨吉霞, 陈芝兰,贺稚非,等. 牦牛奶酪中乳酸菌对抗生素的药敏性[J]. 食品科学, 2014, 35(17): 176-180.
[9] SANDERS M E, AKKERMANS L M A, HALLER D, et al. Safety assessment of probiotics for human use[J]. Gut Microbes, 2010, 1(3):164-185.
[10] GUO Zhuang, WANG Jicheng, YAN Liya, et al.In vitro comparison of probiotic properties ofLactobacillus casei Zhang, a potential new probiotic, with selected probiotic strains [J]. LWT-Food Science and Technology, 2009, 42(10): 1 640-1 646.
[11] ANGMO K, KUMARI A, BHALLA T C, et al. Probiotic characterization of lactic acid bacteria isolated from fermented foods and beverage of Ladakh[J]. LWT-Food Science and Technology, 2016, 66:428-435.
[12] HAN Q, KONG B, CHEN Q, et al.In vitro comparison of probiotic properties of lactic acid bacteria isolated from Harbin dry sausages and selected probiotics[J]. Journal of Functional Foods, 2017, 32:391-400.
[13] 刘冬梅, 李理,杨晓泉,等. 用牛津杯法测定益生菌的抑菌活力[J]. 食品研究与开发, 2006, 27(3): 110-111.
[14] 辛羚, 郭本恒,吴正钧. 3株乳杆菌在模拟消化环境中存活性能的研究[J]. 中国乳品工业, 2005, 33(5): 15-17.
[15] 陈孝勇, 李键,赵欣,等. 传统发酵牦牛酸乳中益生性乳酸菌的体外筛选[J]. 食品与发酵工业, 2016, 42(4): 85-90.
[16] 胡斌. 植物乳杆菌胆盐耐受评价及内在影响因素分析[D]. 无锡:江南大学, 2015.
[17] SHEKH S L, DAVE J M, VYAS B R M. Characterization ofLactobacillus plantarum strains for functionality, safety and γ-amino butyric acid production[J]. LWT-Food Science and Technology, 2016, 74: 234-241.
[18] MONTORO B P, BENOMAR N, LAVILLA L L, et al. Fermented Alore a table olives as a source of potential probioticLactobacillus pentosus strains[J]. Frontiers in Microbiology, 2016, 7:1 583.
a table olives as a source of potential probioticLactobacillus pentosus strains[J]. Frontiers in Microbiology, 2016, 7:1 583.
[19] ABUSHELAIBI A, ALMAHADIN S, ELTARABILY K, et al. Characterization of potential probiotic Lactic acid bacteria isolated from camel milk[J]. LWT-Food Science and Technology, 2017, 79:316-325.
[20] DEL-RE B, SGORBATI, MIGLIOLI M, et al. Adhesion, autoaggregation and hydrophobicity of 13 strains ofBifidobacterium longum[J]. Letters in Applied Microbiology, 2000, 31(6): 438-442.
[21] RAJOKA M S R, MEHWISH H M, SIDDIQ M, et al. Identification, characterization, and probiotic potential of,Lactobacillus rhamnosus, isolated from human milk[J]. LWT-Food Science and Technology, 2017, 84: 271-280.
[22] 李晶. 乳酸菌黏附特性及评价方法[J]. 农产品加工, 2018, 466(20): 74-75;79.
[23] LAPARRA J M, SANZ Y. Comparison ofin vitro models to study bacterial adhesion to the intestinal epithelium[J]. Letters in Applied Microbiology, 2009, 49(6):695-701.
[24] DAS P, KHOWALA S, BISWAS S.In vitro probiotic characterization ofLactobacillus casei isolated from marine samples[J]. LWT-Food Science and Technology, 2016, 73: 383-390.
[25] 赵圣明, 赵岩岩,马汉军,等.发酵酸菜来源乳酸菌的益生特性及其在发酵乳中的应用研究[J]. 食品科学,40(6)187-194.
[26] 张英春, 韩雪,单毓娟,等. 益生菌抑制致病菌作用的机制研究进展[J]. 微生物学通报, 2012, 39(9):1 306-1 313.
[27] CHARTERIS W P, KELLY P M, MORELLI L, et al. Antibiotic susceptibility of potentially probioticLactobacillus species[J]. Journal of Food Protection, 1998, 61(12):1 636-1 643.
[28] 杨吉霞, 陈芝兰,贺稚非,等. 牦牛奶酪中乳酸菌对抗生素的药敏性[J]. 食品科学, 2014, 35(17): 176-180.
[29] JANKOVIC I, SYBESNA W, PHOTHIRATH P, et al. Application of probiotics in food products—challenges and new approaches[J]. Current Opinion in Biotechnology, 2010, 21(2):175-181.
[30] 马晓娟. 乳酸菌发酵胡萝卜原浆技术及其产品性能研究[D]. 南昌:南昌大学, 2013.