胶原蛋白是脊椎动物结缔组织的主要结构蛋白,占动物总蛋白的约30%左右[1],它具有独特的三螺旋结构,能够形成高拉伸强度的不溶性纤维。目前,已经鉴定出至少29种胶原蛋白类型,它们的氨基酸序列、结构和功能各不相同[2]。胶原蛋白与组织的形成和成熟、细胞间的信息传递、细胞的增生和分化运动、关节润滑及伤口愈合有着密切的关系[3]。因其具有良好的生物相容性、低过敏性及生物活性,在食品、化妆品和生物医药行业有着广泛的应用。
中华鳖是一种高水分、高蛋白、低脂肪的水产品,其鳖肉蛋白质的氨基酸组成比例相对较平衡,符合FAO/WHO的推荐标准,属于一种优质的蛋白质来源;且鳖肉含有丰富的不饱和脂肪酸、矿物质和微量元素。中华鳖作为一种经济价值较高的鳖,营养丰富,味道鲜美,素有“美食五味肉”的美称[4],具有强身健体,提高免疫的功效。
随着市场规模的逐渐扩大和养殖技术的不断提高,鳖类养殖在中国已形成一股热潮。然而目前对中华鳖的研究主要集中在全鳖喂养养殖、营养元素分析及胶原蛋白提取工艺的优化,对裙边的丰富蛋白质研究较少,且缺乏不同提取方式的胶原蛋白之间的性质比较。本研究采用酸溶解和胃蛋白酶辅助溶解2种提取方式,分别从中华鳖裙边中提取出酸溶性胶原蛋白(acid-soluble collagen,ASC)和胃蛋白酶可溶性胶原蛋白(pepsin-soluble collagen,PSC),利用扫描电子显微镜(scanning electron microscope,SEM)、圆二色光谱(circular dichroism spectrum,CD)对胶原蛋白的微观结构进行分析,采用十二烷基硫酸钠-聚丙烯酰胺-凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)、肽指纹质谱(matrix-assisted laser desorption ionization-time of flight,MALDI-TOF)和氨基酸分析仪对ASC和PSC的蛋白质和氨基酸进行比较分析,利用差示量热扫描(differential calorimetry scanning,DSC)对胶原蛋白的热稳定性进行分析。旨在进一步深入研究和开发中华鳖的裙边资源,为中华鳖加工行业研究提供理论依据。
中华鳖:购于中国江苏省无锡市苏南水产市场,选用2~3年生长期的中华鳖,体重为650~700 g;胃蛋白酶(30 000 U/g),购于上海源叶有限公司;乙酸、NaCl、异丙醇均为分析纯,购于国药化学试剂有限公司.
Agilent 1100氨基酸分析仪,美国安捷伦公司;SU8220冷场发射扫描电子显微镜,日本日立公司;DYCZ-24D 型电泳槽、DYY-6B 型电泳仪,北京市六一仪器厂;UltrafleXtreme基质辅助激光解析电离串联飞行时间质谱仪,美国布鲁克·道尔顿公司;Chirascan V100圆二色光谱仪,英国应用光物理公司;LGJ-18C冷冻干燥机,北京四环科学仪器厂有限公司;3K3D冷冻离心机,Sigma公司;X-DSC7000差示扫描量热仪,日本精工电子纳米科技有限公司。
1.3.1 裙边基本营养成分的测定
水分含量:参照GB5009.3—2016直接干燥法,进行食品中水分的测定;灰分含量:参照GB5009.4—2016高温灼烧法,进行食品中灰分的测定;脂肪含量:参照GB5009.6—2016索氏抽提法,进行食品中脂肪的测定;蛋白质含量:参照GB5009.5—2016凯氏定氮法,进行食品中蛋白质的测定。
1.3.2 裙边的预处理
将中华鳖去头、放血后致死,然后将其裙边进行分割,装入密封保鲜袋中,均等分割,切成0.5 cm×0.5 cm 的小块,以1∶30(g∶mL)的比例置于25 g/L的NaCl溶液(下同)中,于4 ℃下连续磁力搅拌24 h,以去除水溶性和盐溶性杂蛋白(非胶原蛋白成分),然后用蒸馏水反复洗涤,充分沥干后备用。置于与NaCl溶液同量的100 g/L的异丙醇溶液中,于4 ℃下浸泡24 h,以去除脂肪。然后用蒸馏水反复洗涤,充分沥干后备用[5]。
1.3.3 胶原蛋白的提取
参考文献[6]的方法,并在此基础上加以改动。
(1)酸溶性胶原蛋白(acid-soluble collagen,ASC)的提取:所有操作在4 ℃下进行。将预处理过的裙边样品浸泡在0.5 mol/L的乙酸中,样品与溶液的比例为1∶30(g∶mL),连续搅拌6 h,然后以5 000 r/min离心20 min。离心结束后,将上清液合并,缓慢加入NaCl固体至最终浓度为0.9 mol/L,盐析24 h。盐析结束后,以10 000 r/min离心20 min,收集所得白色沉淀物,即粗提酸溶性胶原。随后再将得到的胶原蛋白溶于0.5 mol / L的乙酸中,重复盐析和溶解3次。使用截留分子质量为8 000 Da的透析袋将沉淀物透析3 d,然后进行冷冻干燥,得到ASC。
(2)胃蛋白酶可溶性胶原蛋白(pepsin-soluble collagen,PSC)的提取:所有操作在4℃下进行。将预处理过的裙边样品浸泡在0.5 mol/L的乙酸中,样品与溶液的比例为1∶30(g∶mL),连续搅拌6 h,然后以5 000 r/min离心20 min,收集沉淀物。向得到的沉淀物中加入其质量30倍的0.5 mol/L的乙酸,并按照溶液体积的1%加入胃蛋白酶,持续搅拌提取6 h。将提取得到的黏性溶液以10 000 r/min离心20 min,收集所得白色沉淀物,即粗提酶溶性胶原。随后再将得到的胶原蛋白溶于0.5 mol/L的乙酸中,重复盐析和溶解3次。使用截留分子质量为8 000 Da的透析袋将沉淀物透析3 d,然后进行冷冻干燥,得到PSC。
得率的计算如式(1):
胶原蛋白得率![]()
(1)
1.3.4 扫描电子显微镜(SEM)
参考文献[7]的方法,将冷冻干燥后的ASC和PSC固定在载物台上,经离子溅射喷金处理4 min 后,在加速电压为5.0 kV 条件下,用扫描电子显微镜观察胶原的微观结构,观察不同放大倍数下胶原薄片的截面特征,对比两者表面微观结构的异同。
1.3.5 圆二色光谱(CD)
将冻干样品溶于0.05 mol/L的乙酸中,配制成0.3 mg/mL的胶原蛋白溶液,取少量溶液加入2 mm比色皿中,放入圆二色光谱仪中,于25 ℃,190~250 nm的波长下扫描3次,记录各光谱曲线[8]。
1.3.6 SDS-PAGE凝胶电泳
参照文献[9]的方法,对纯化的胶原蛋白样品进行SDS-PAGE垂直电泳。将分别含有6 mg/mLASC和PSC的溶液溶解于上样缓冲液中。煮沸3 min后冷却,在4 000 r/min下离心10 min。SDS-PAGE凝胶由 6%的分离胶和5%的浓缩胶组成。在80 V下电泳20 min,然后在120 V下电泳90 min。电泳结束用考马斯亮蓝R-250溶液对凝胶染色30 min,然后用脱色液脱色。
1.3.7 肽指纹图谱(MALDI-TOF)
将1.3.6得到的凝胶切除对应分子质量为α2的亚基带,切成约1 mm的切片。将30%的乙腈与100 mmol/mL (NH4)2CO3混合得到混合溶液,将切片溶于300 μL的混合溶液中进行脱色。除去上清液,加入50 μL乙腈和5 μL浓度为5 ng/ mL的胰蛋白酶,于4 ℃下培养30 min 后除去残留液体,加入20 μL浓度为25 mmol/L (NH4)2CO3,将样品置于37 ℃水浴下过夜孵育。将得到的酶解液转移到新的EP管中离心,得到5 μL上清液[8]。使用配备有Mascot序列匹配软件的UltrafleX-treme MALDI-TOF质谱仪(BrukerDaltonics,USA)进行两阶段质谱分析。实验结果用NCBI数据库的Mascot软件进行序列匹配。分数> 61表示同一性或广泛同源性,结果可信。
1.3.8 氨基酸分析
根据HEU等[10]的方法,采用OPAFMOC柱前衍生化法进行分析。
(1)样品前处理:将100 mg冻干样品溶于8 mL浓度为6 mol /L HCl溶液中,用氮气抽空混合物,真空密封,在110 ℃水解22 h。将样品从试管中转移到25 mL的容量瓶中,加入4.8 mL 10 mol/L NaOH中和酸水解。用少量清水冲洗烧瓶内壁,用水稀释至25 mL。将2片滤纸折叠过滤,取滤液1 mL, 10 000 r/min离心10 min。取400 μL上清液置于氨基酸自动分析仪分析水解产物中的氨基酸。
(2)色谱条件:C18 柱(4.0 mm×125 mm),设定柱温为 40 ℃,控制缓冲液的流速为1.0 mL/min。流动相:A:20 mmol/L醋酸钠;B:20 mmol/L醋酸钠、乙腈、甲醇混合液(V(醋酸钢)∶V(乙腈)∶V(甲醇)=1∶2 ∶2)。脯氨酸以262 nm检测,其他氨基酸在紫外波长338 nm条件下检测;氨基酸含量以外标法定量。
1.3.9 胶原蛋白的热变性温度(Td)测定
将冻干后的纯化样品用0.5 mol/L的乙酸溶解,样品和溶剂的比例1∶40(g∶mL)。采用差示扫描量热仪测定热变性温度,测定时精确称量8~10 mg样品溶液放入铝坩埚后密封,扫描温度范围为20~50 ℃, 升温速率为5 ℃/min,以一个空的铝坩埚作为空白对照。
1.3.10 数据统计与分析
采用SPSS 18和Origin 8.5对数据进行处理和绘图。每次试验设置3个平行实验,数据以平均值±标准偏差表示。
由表1可知,中华鳖裙边中的蛋白质含量为28.75%, 根据文献[11]中有关胶原蛋白的计算方式:
用提取的上清液中羟脯氨酸含量乘以对应的胶原蛋白换算系数得到胶原蛋白的含量。得到本研究中裙边中胶原蛋白占粗蛋白的72%。其次,由表1可知,中华鳖裙边中的脂肪含量较低,仅为0.05%。因此,中华鳖裙边是一种较好的胶原蛋白提取来源。
表1 裙边中基本成分
Table 1 Basic composition in thecalipash
成分水分蛋白脂肪灰分含量/[g·(100 g)-1]70.14±3.2128.75±2.040.05±0.020.54±0.07
经计算,ASC的得率为26.79%(干重),PSC的得率分别为37.50%(干重),明显高于ASC。据报道,黑骨鱼皮,虹色金线鱼皮,罗非鱼皮胶原蛋白得率分别为2.3%[12],24.9%[13],27.2%[14],这进一步表明胶原得率较高的中华鳖裙边可以作为良好的胶原蛋白来源。
采用SEM对2种胶原蛋白进行微观结构的分析,冷冻干燥的条件(温度、真空、升降温速率)相同,冻干前的胶原蛋白浓度相同。裙边胶原蛋白的扫描电镜图像如图1所示,ASC和PSC分别在1 mm,500 μm 和100 μm放大下观察。由图1可知,2种提取方式得到的裙边胶原蛋白均呈现均匀的多层聚集结构。

A1~A3和B1~B3分别为ASC和PSC在1 mm,500 μm,100 μm处的扫描电镜图
图1 裙边酸溶性胶原ASC和酶溶性胶原PSC扫描电镜图
Fig.1 SEM images of the ASC and the PSC from the calipash
放大结果显示,ASC结构呈现断层较多、排列规则性较小,层与层之间比较紧实的状态(图1-A1,图1-A2,图1-A3);PSC表面和横截面呈现断层较少、排列有序,层与层之间比较疏松的状态(图1-B1,图1-B2, 图1-B3)。结果表明,ASC与PSC之间的微观结构存在差异。
在分子生物学领域中,蛋白质溶液的圆二色谱可以反映蛋白质的立体结构信息[15],蛋白质是氨基酸以肽键联接而成的具有特定空间结构的生物大分子,其圆二色性表现为生色基团和折叠结构的总和[16]。由图2可以看出,在25 ℃下ASC和PSC的特征圆二色光谱分别在224 nm和222 nm处出现正峰,其中224 nm和222 nm处出现的正吸收峰是左旋聚脯氨酸构型的圆二色谱典型特征[17],无α螺旋双负峰吸收,主要表现为β折叠及无规卷曲的叠加吸收。ASC与PSC分别在199 nm和198 nm处出现负峰,这些光谱数据表明胶原存在三重螺旋结构,胶原蛋白结构完整,正吸收峰与负吸收峰的比值(Rpn)是胶原三螺旋结构特征性的参数,其比值越大,胶原蛋白的三重螺旋结构完整性更好[18]。图2结果显示,PSC的正/负吸收峰比值较ASC大,则说明PSC比ASC的三重螺旋结构更完整。

图2 裙边酸溶性胶原ASC和酶溶性胶原PSC在 25 ℃时的圆二色光谱
Fig.2 CD spectra of ASC and PSC from the calipash at 25 ℃
图3为裙边ASC和PSC的SDS-PAGE电泳结果,从凝胶电泳图谱上可以清晰的看到有染色较深的3条带,从上到下依次为β链,α1链,α2链,表明所提取的裙边胶原蛋白纯化度高。
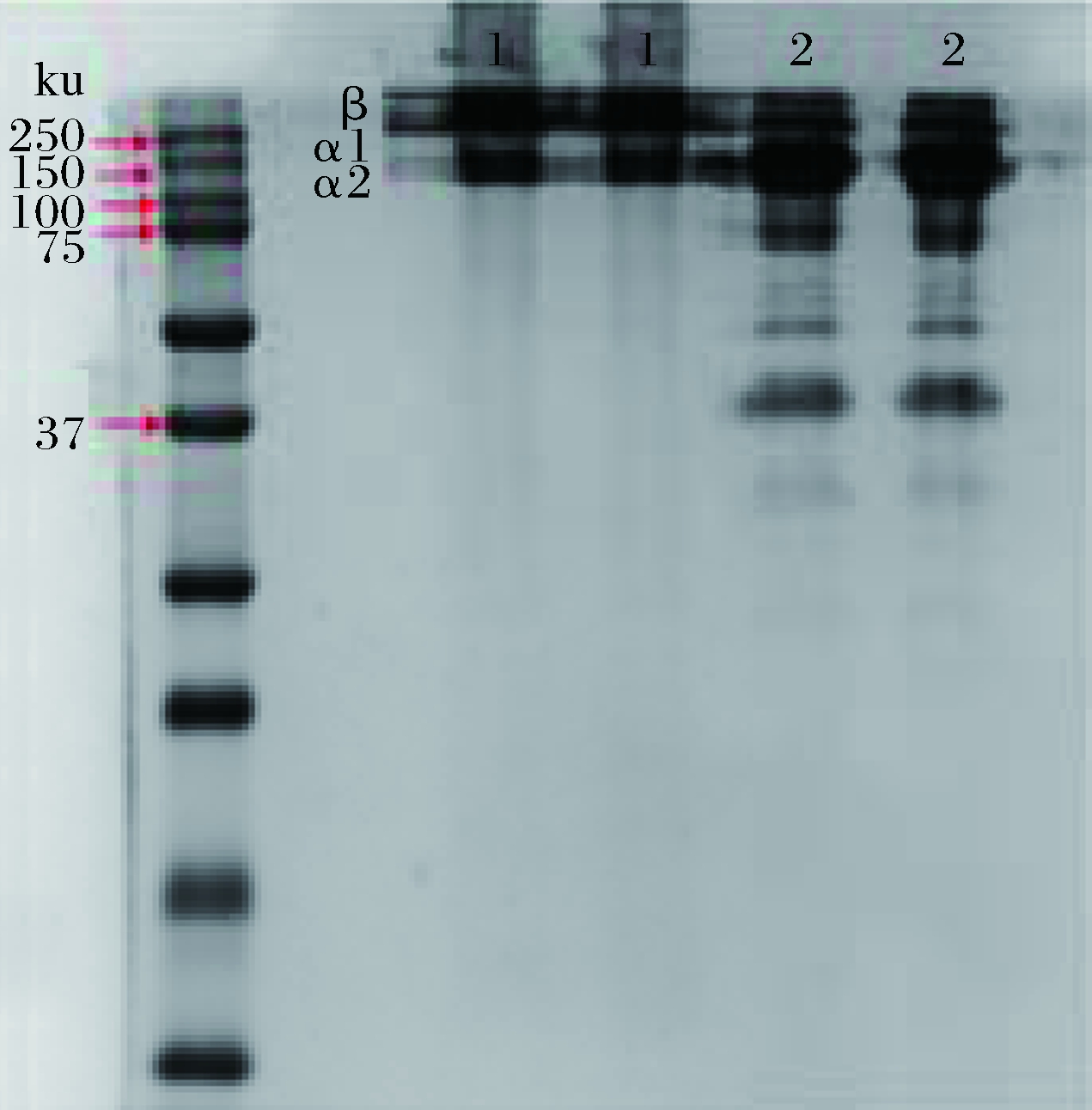
1-酸溶性胶原ASC; 2-酶溶性胶原PSC
图3 裙边酸溶性胶原ASC和酶溶性胶原PSC的SDS-PAGE电泳图
Fig.3 Protein pattern of ASC and PSC from the calipash
α1和α2的分子质量分别为142 kDa和129 kDa,与典型I型胶原结构一致。ASC的α2链条带以下未发现其他电泳条带,说明胶原蛋白纯度较高,基本结构得到很好的保存,没有生成多肽及小分子水解胶原蛋白;PSC的α2链条带以下有少许电泳条带,说明有小分子肽的存在。
通过MALDI-TOF/TOF质谱法分析α2条带,结果如表2所示,ASC和PSC的α2亚基分数为120和113,ASC评分略高于PSC,但两者分数均高于61,这与中华鳖胶原I型亚基α2相匹配,进一步证明所提取的裙边胶原为I型胶原蛋白。
表2 裙边酸溶性胶原ASC和酶溶性胶原PSC肽指纹图谱
Table 2 Peptide mass fingerprint of ASC and PSC from the calipash

蛋白质蛋白质描述序列号分子质量/Da得分ASCSubmit α2Collagen alpha 2(I)[Pelodiscussinensis]gi|558122772129 251120PSCSubmit α2Collagen alpha 2(I)[Pelodiscussinensis]gi|558122772129 251113
注:分数> 61表示同一性或广泛同源性,结果可信。
由表3、表4可知中华鳖裙边胶原蛋白的氨基酸组成。
其中呈味氨基酸含量>亚氨基酸含量>必需氨基酸含量>非必需氨基酸含量,与文献报道过的鱼皮[12,19-21]胶原蛋白相比,其呈味氨基酸含量偏低,而必需氨基酸含量偏高,说明裙边胶原蛋白的营养价值更高;非必需氨基酸含量分析表明,裙边胶原蛋白中精氨酸含量明显高于其他鱼皮胶原蛋白。裙边ASC和PSC中,呈味氨基酸和必需氨基酸含量相当,亚氨基酸和非必需氨基酸含量有略微差异,ASC与PSC亚氨基酸含量分别为20.46%和21.53%,非必需氨基酸含量分别为12.74%和11.62%,说明不同的提取方式对胶原蛋白的氨基酸含量有一定的影响。
表3 裙边酸溶性胶原ASC和酶溶性胶原PSC氨基酸组成
Table 3 ASC and PSC from the calipash amino composition
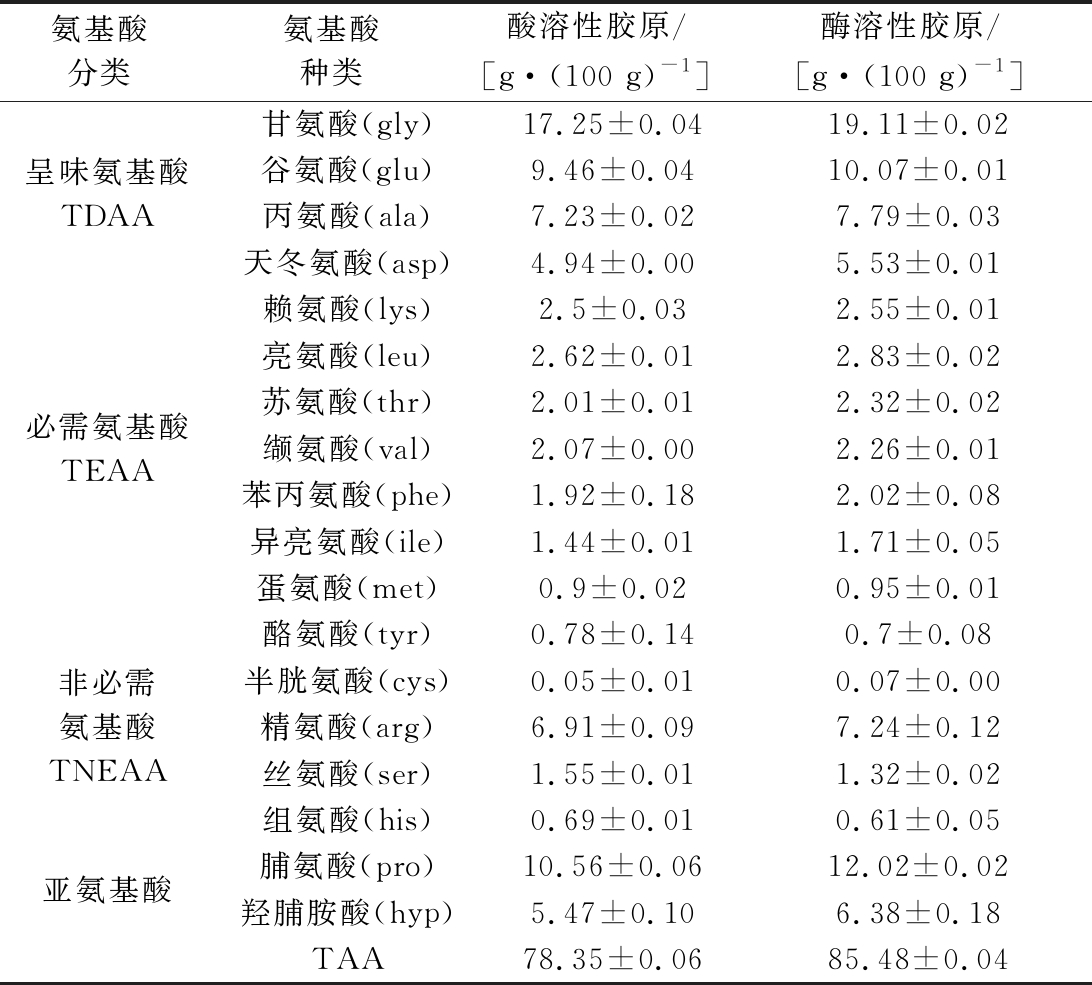
氨基酸分类氨基酸种类酸溶性胶原/[g·(100 g)-1]酶溶性胶原/[g·(100 g)-1]呈味氨基酸TDAA甘氨酸(gly)17.25±0.0419.11±0.02谷氨酸(glu)9.46±0.0410.07±0.01丙氨酸(ala)7.23±0.027.79±0.03天冬氨酸(asp)4.94±0.005.53±0.01必需氨基酸TEAA赖氨酸(lys)2.5±0.032.55±0.01亮氨酸(leu)2.62±0.012.83±0.02苏氨酸(thr)2.01±0.012.32±0.02缬氨酸(val)2.07±0.002.26±0.01苯丙氨酸(phe)1.92±0.182.02±0.08异亮氨酸(ile)1.44±0.011.71±0.05蛋氨酸(met)0.9±0.020.95±0.01非必需氨基酸TNEAA酪氨酸(tyr)0.78±0.140.7±0.08半胱氨酸(cys)0.05±0.010.07±0.00精氨酸(arg)6.91±0.097.24±0.12丝氨酸(ser)1.55±0.011.32±0.02组氨酸(his)0.69±0.010.61±0.05亚氨基酸脯氨酸(pro)10.56±0.0612.02±0.02羟脯胺酸(hyp)5.47±0.106.38±0.18TAA78.35±0.0685.48±0.04
注:TAA-氨基酸总量,TEAA-必需氨基酸总量,TNEAA-非必需氨基酸总量,TDAA-呈味氨基酸总量,亚氨基酸:脯氨酸+羟脯氨酸。
表4 裙边酸溶性胶原ASC和酶溶性胶原PSC氨基酸分类
Table 4 Amino acid classification of the calipash ASC and PSC

氨基酸占比/胶原类型酸溶性胶原/%酶溶性胶原/%TDAA/TAA49.6249.72TEAA/TAA17.1817.13TNEAA/TAA12.7411.62亚氨基酸/TAA20.4621.53
注:TAA氨基酸总量,TEAA必需氨基酸总量,TNEAA非必需氨基酸总量,TDAA呈味氨基酸总量,亚氨基酸:脯氨酸+羟脯氨酸。
裙边胶原蛋白的热稳定性利用DSC进行测定,通常当达到蛋白质热变性温度时,在热分析图谱上会出现一个吸热峰,这个峰值对应的温度即为该样品的热变性温度[22]。由图4可知,ASC和PSC的热变性温度分别为38.39 ℃和38.11 ℃。
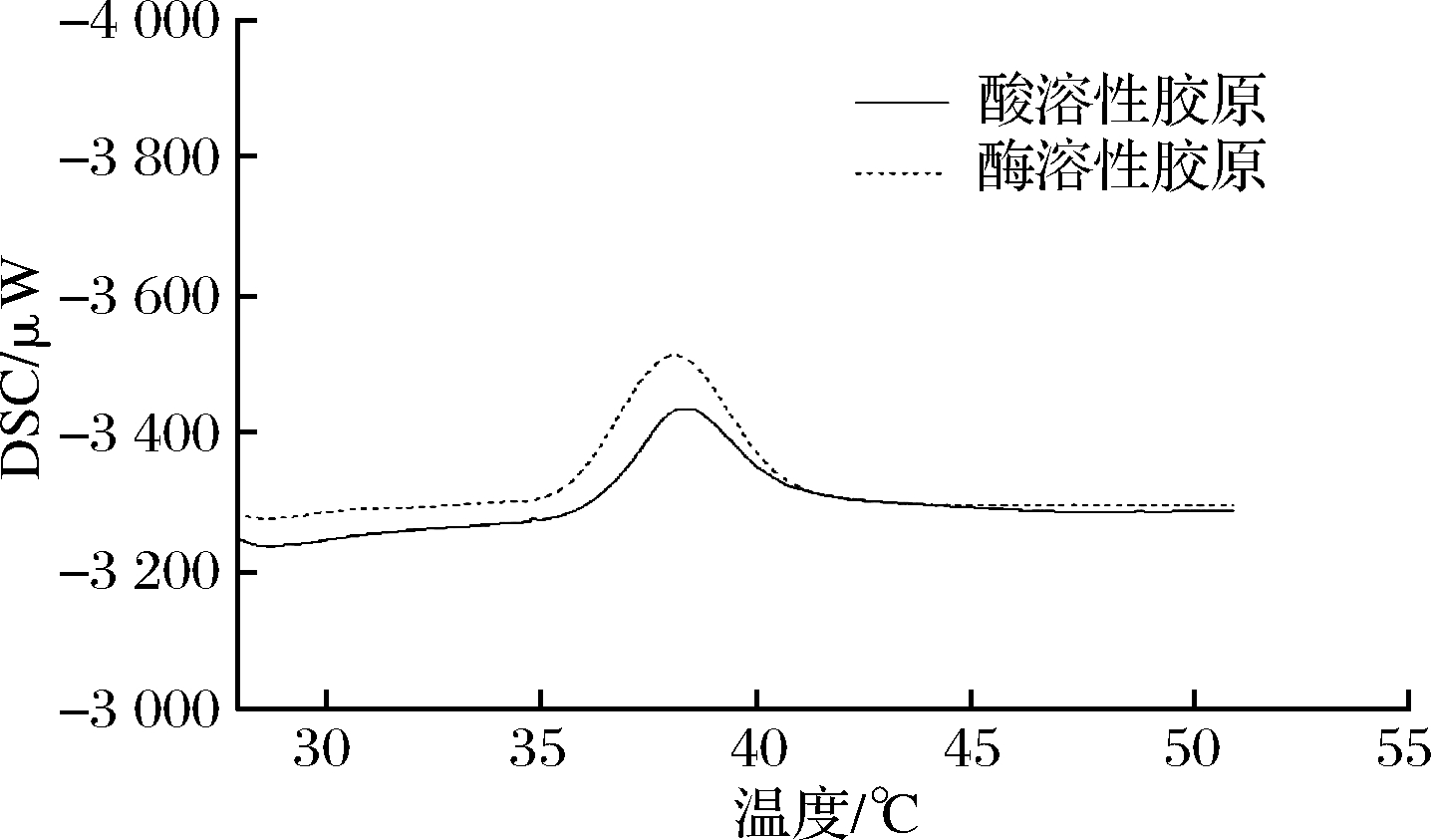
图4 裙边酸溶性胶原ASC和酶溶性胶原PSC热变性曲线
Fig.4 Thermal denaturation curve of ASC and PSC from calipash
根据文献报道,猪皮胶原蛋白的热变性温度为37 ℃[23],鱼皮胶原蛋白的热变性温度为16.1~35.9 ℃[20,24],表明通过2种提取方式获得的裙边胶原蛋白的热稳定性均优于常见的猪皮胶原蛋白和鱼皮胶原蛋白。研究表明,亚氨基酸含量与胶原蛋白热稳定性之间存在密切关联,脯氨酸和羟脯氨酸分子中的吡咯环对胶原三螺旋分子构型起结构固定作用,羟脯氨酸中的羟基通过氢键键合的方式进一步强化胶原三螺旋分子的稳定性;因此,亚氨基酸含量越高,则胶原分子的热变性温度越高[25-26]。裙边胶原ASC、PSC的亚氨基酸含量分别为20.46%、21.53%,高于文献中报道的鲟鱼皮、草鱼皮和鳕鱼皮胶原的亚氨酸含量(表4)。另一方面,通过分析氨基酸组成,如表5所示,裙边胶原中精氨酸含量明显高于其他鱼皮胶原,在胶原蛋白分子肽链间,当肽链所带的正负电荷大致相当时,肽链间能通过电荷吸引的形式结合,而当正负电荷总量不等时,肽链间则会出现同种电荷的排斥而导致肽链的分离,碱性氨基酸精氨酸可以降低电荷的排斥从而保持胶原蛋白分子三螺旋结构的稳定性,邓明霞等[20]报道胶原蛋白热变性温度与精氨酸含量呈现显著性正相关(P<0.01),这与本研究结果一致。
表5 不同胶原的亚氨基酸含量、精氨酸含量与 热变性温度的对比图
Table 5 Comparison of the sub-amino acid content, arginine content and heat denaturation temperature of different collagens
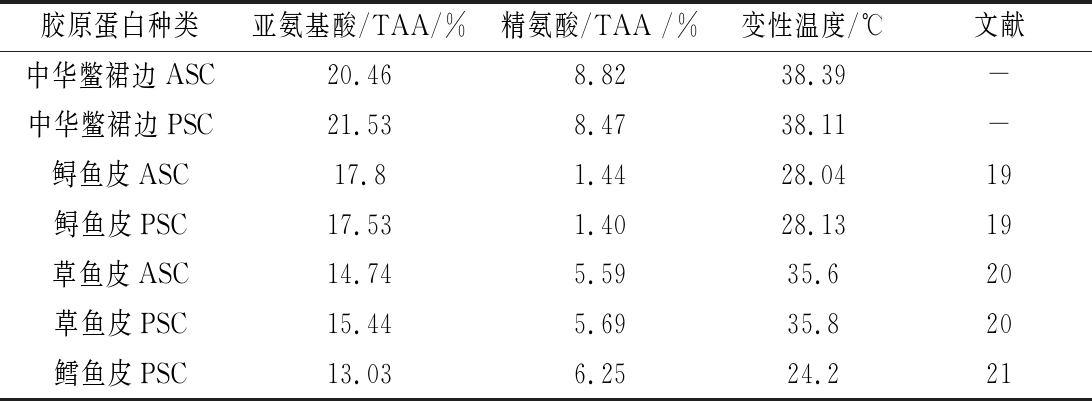
胶原蛋白种类亚氨基酸/TAA/%精氨酸/TAA /%变性温度/℃文献中华鳖裙边ASC20.468.8238.39-中华鳖裙边PSC21.538.4738.11-鲟鱼皮ASC17.81.4428.0419鲟鱼皮PSC17.531.4028.1319草鱼皮ASC 14.745.5935.620草鱼皮PSC15.445.6935.820鳕鱼皮PSC 13.036.2524.221
注:TAA氨基酸总量。
综上所述,裙边胶原蛋白热稳定性较高,维系胶原蛋白结构稳定的分子间作用力较大,天然结构保存较为完整,可作为其他胶原的良好替代品。
本文主要采用2种不同的提取方式,从中华鳖裙边中提取出酸溶性胶原蛋白(ASC)和胃蛋白酶可溶性胶原蛋白(PSC),对两种胶原蛋白进行鉴定和理化性质的分析。不同提取方式下,ASC和PSC的得率分别为26.79%和37.50%,说明胃蛋白酶辅助提取可以获得更高的裙边胶原蛋白产量。通过扫描电子显微镜(SEM)结果可知,ASC和PSC在微观结构上存在差异,体现在ASC比PSC具有较多、较分散的断层,层与层之间结构更加紧密。圆二色光谱(CD)的结果表明,PSC与ASC相比存在更为完整的三级螺旋结构,提取方式会对裙边胶原蛋白的三螺旋结构产生明显影响。十二烷基硫酸钠-聚丙烯酰胺-凝胶电泳(SDS-PAGE)结果显示ASC和PSC具有β链,α1链,α2链3种条带,提取的胶原蛋白纯化程度较高。肽指纹质谱(MALDI-TOF)分析显示裙边胶原蛋白为I型胶原蛋白。由氨基酸组成分析可知,ASC与PSC相比,具有相似的氨基酸组成,具有较高的亚氨基酸含量和精氨酸含量。在热稳定性方面,通过差示量热扫描(DSC)测定ASC和PSC的热稳定性温度分别为38.39和38.11 ℃,高于常见的猪皮胶原蛋白和鱼皮胶原蛋白,推测裙边胶原蛋白热稳定性较高与其亚氨基酸和精氨酸含量成正相关。
综上所述,2种提取方式得到的中华鳖裙边胶原蛋白在微观结构、氨基酸组成、热变性温度等方面略有差异,但所得到的ASC和PSC的纯度均比较高,且具有较多的必需氨基酸和较好的热稳定性,因此,可以作为其他胶原蛋白的良好替代品。
[1] SINTHUSAMRAN S,BENJAKUL S, KISHIMURA H. Comparative study on molecular characteristics of acid soluble collagens from skin and swim bladder of seabass (Latescalcarifer)[J]. Food Chemistry, 2013, 138(4):2 435-2 441.
[2] DU M,MCCORMICK R J. Applied Muscle Biology And Meat Science[M]. CRC Press, 2009.
[3] 韩霜, 马良,王雪蒙, 等. 兔皮胶原蛋白的加工特性[J]. 食品科学, 2017, 38(5):21-25.
[4] 张丹. 中华鳖营养、风味及功能特性研究进展[J]. 食品工业科技, 2013, 34(24):392-395.
[5] 陆剑锋, 万全,殷章敏, 等. 中华鳖裙边胶原蛋白的提取及其特征[J]. 水产学报, 2010, 34(6):801-808.
[6] LIU H Y, LI D,GUO S D. Studies on collagen from the skin of channel catfish (Ictaluru spunctaus)[J]. Food Chemistry, 2007, 101(2):621-625.
[7] 汪海波, 梁艳萍,汪海婴, 等. 草鱼鱼鳞胶原蛋白的提取及其部分生物学性能[J]. 水产学报, 2012, 36(4):553-561.
[8] WANG J, PEI X, LIU H, et al. Extraction and characterization of acid-soluble and pepsin-soluble collagen from skin of loach (Misgurnus anguillicaudatus)[J]. International Journal of Biological Macromolecules, 2017, 106.
[9] LAEMMLI U K. Cleavage of structural proteins during the assembly of the head of bacteriophage T4[J]. Nature, 1970,227(5259), 680-685.
[10] HEU M S, KIM J S, SHAHIDI F. Components and nutritional quality of shrimp processing by-products[J]. Food Chemistry, 2003, 82(2):235-242.
[11] WANG L, LIANG Q, CHEN T, et al. Characterization of collagen from the skin of Amur sturgeon(Acipenser schrenckii)[J]. Food Hydrocolloids, 2014, 38:104-109.
[12] PORTIER R J, MOODY M W, OGAWA M. Biochemical properties of black drum and sheepshead seabream skin collagen[J]. J.agric.foodChem, 2003, 51(27):8 088-8 092.
[13] NALINANON S, BENJAKUL S, KISHIMURA H, et al. Type I collagen from the skin of ornate threadfin bream (Nemipteru shexodon): Characteristics and effect of pepsin hydrolysis[J]. Food Chemistry, 2010, 125(2):500-507.
[14] CHEN J, LI L, YI R, et al. Extraction and characterization of acid-soluble collagen from scales and skin of tilapia (Oreochromis niloticus)[J]. LWT-Food Science and Technology, 2016, 66:453-459.
[15] STEPLEWSKI A, MAJSTEREK I, MCADAMS E, et al. Thermostability gradient in the collagen triple helix reveals its multi-domain structure[J]. Journal of Molecular Biology, 2004, 338(5):989-998.
[16] 史刘辉. 鳕鱼皮胶原及其低聚肽的制备及特性研究[D]. 无锡:江南大学, 2012.
[17] USHA R, RAMASAMI T. Structure and conformation of intramolecularly cross-linked collagen[J]. Colloids & Surfaces B Biointerfaces, 2005, 41(1):21-24.
[18] 邹明晖, 周建良,陈义初, 等. 枝化状聚乙二醇对牛跟腱I型胶原结构与构象稳定性的影响[J]. 中华实验外科杂志, 2011, 28(6):973-975.
[19] 杨玲, 赵燕,鲁亮, 等. 鲟鱼鱼皮胶原蛋白的提取及其理化性能分析[J]. 食品科学, 2013, 34(23):41-46.
[20] 邓明霞, 汪海波,杨玲, 等. 氨基酸组成及溶剂环境对淡水鱼胶原蛋白热稳定性能的影响[J]. 现代食品科技, 2015(12):111-120.
[21] 林琳. 鱼皮胶原蛋白的制备及胶原蛋白多肽活性的研究[D]. 青岛:中国海洋大学, 2006.
[22] 李永明, 徐子伟. 差示扫描量热法(DSC)评定豆粕产品质量初探[J]. 中国粮油学报, 2003, 18(5):82-84.
[23] WANG L, YANG B, WANG R, et al. Extraction of pepsin-soluble collagen from grass carp (Ctenopharyngodon idella) skin using an artificial neural network[J]. Food Chemistry, 2008, 111(3):683-686.
[24] JONGJAREONRAK A,BENJAKUL S, VISESSANGUAN W, et al. Isolation and characterisation of acid and pepsin-solubilised collagens from the skin of Brownstripe red snapper (Lutjanus vitta)[J]. Food Chemistry, 2006, 93(3):475-484.
[25] NAGAI T, YAMASHITA E, TANIGUCHI K, et al. Isolation and characterization of collagen from the outer skin waste material of cuttlefish (Sepia lycidas)[J]. Food Chemistry, 2001, 72(4):425-429.
[26] 王雪蒙,于玮,马良, 等. 兔皮胶原蛋白的提取及其结构鉴定[J]. 食品与发酵工业, 2016, 42(4):209-213.